Table of Contents

पदार्थ : धातु और अधातु
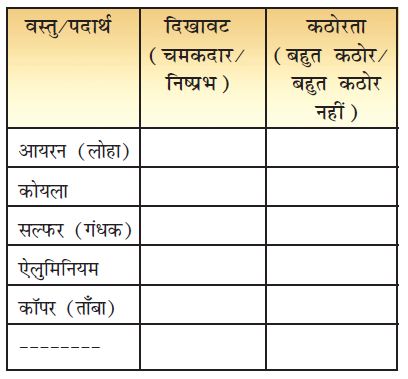
आप लोहा, एेलुमिनियम, ताँबा, आदि जैसे कुछ पदार्थों से परिचित हैं। कुछ पदार्थ सारणी 4.1 में दिए गए हैं।
सारणी 4.1 : पदार्थों की दिखावट और कठोरता
क्या आप उन पदार्थों के नाम बता सकते हैं जो धातु हैं? सारणी 4.1 में शेष पदार्थ अधातु हैं। धातुओं का अधातुओं से अन्तर उनके भौतिक और रासायनिक गुणों के आधार पर किया जा सकता है। स्मरण करिए कि चमक और कठोरता भौतिक गुण हैं।
4.1 धातुओं और अधातुओं के भौतिक गुण
क्या आपने लोहार को लोहे के टुकड़े अथवा लोहे से निर्मित वस्तु, जैसे– फावड़ा, बेलचा, कुल्हाड़ी, आदि को पीटते हुए देखा है? क्या इन वस्तुओं को पीटने पर आप इनके आकार में कोई परिवर्तन पाते हैं? क्या कोयले के टुकड़े को पीटने पर भी वैसे ही परिवर्तन की अपेक्षा करते हैं?
आइए जानें।
क्रियाकलाप 4.1
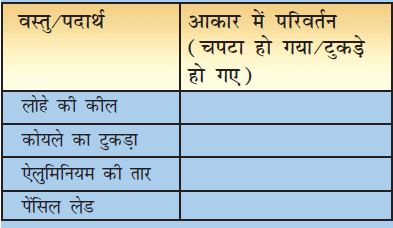
एक लोहे की कील, एक कोयले का टुकड़ा, एक मोटे एेलुमिनियम तार का टुकड़ा और एक पेंसिल लेड लीजिए। लोहे की कील लेकर उसे हथौड़े द्वारा पीटिए (चित्र 4.1)।

चित्र 4.1 : हथौड़े से लोहे की कील को पीटना।
(परन्तु ध्यान रहे कि इस प्रक्रम में आप स्वयं को चोट न पहुँचा लें।) जोर से पीटने का प्रयास करिए। एेलुमिनियम के तार पर भी जोर से चोट करिए। इसी प्रकार का प्रक्रम कोयले के टुकड़े और पेंसिल लेड के साथ भी करिए। अपने प्रेक्षणों को सारणी 4.2 में रिकॉर्ड करिए।
सारणी 4.2 : पदार्थों की आघातवर्धनीयता
आपने देखा कि लोहे की कील और एेलुमिनियम के तार को पीटने पर उनका आकार परिवर्तित हो गया। यदि उन्हें अधिक शक्ति से पीटा जाए तो उन्हें शीट में परिवर्तित किया जा सकता है। आप सम्भवतः मिठाइयों को सजाने के लिए उपयोग में लाए जाने वाले चाँदी के वर्क से भी परिचित होंगे। आप एेलुमिनियम पन्नीपर्णिका द्वारा खाद्य सामग्री को लपेटने के उपयोग से भी अवश्य परिचित होंगे। धातुओं का गुण जिसके कारण उन्हें पीटकर शीट में परिवर्तित किया जा सकता है, आघातवर्धनीयता कहलाता है। यह धातुओं का अभिलाक्षणिक गुण है। जैसा आपने देखा होगा, कोयले और पेंसिल लेड जैसे पदार्थ यह गुण प्रदर्शित नहीं करते। क्या हम इन्हें धातु कह सकते हैं?
क्या आप बिना प्लास्टिक या लकड़ी के हत्थे वाले गर्म धातु के पात्र को, स्वयं को बिना आघात पहुँचाए, पकड़ सकते हैं? शायद नहीं! क्यों? कुछ अन्य अनुभवों की सूची बनाने का प्रयास करिए जिसमें एक लकड़ी या प्लास्टिक का हत्था आपको घायल होने से बचाता है जब आप गर्म वस्तुओं को पकड़ते हैं। इन अनुभवों के आधार पर आप लकड़ी और प्लास्टिक द्वारा ऊष्मा के चालन के विषय में क्या कह सकते हैं? आपने एक विद्युतकर्मी को पेंचकस से काम करते देखा होगा। उसका हत्था किस प्रकार का होता है? क्यों? आइए जानें।
क्रियाकलाप 4.2
याद करिए, किसी वस्तु में विद्युत का प्रवाह होता है या नहीं– यह परीक्षण करने हेतु विद्युत परिपथ कैसे बनाया जाता है (चित्र 4.2)। आपने कक्षा VI

चित्र 4.2 : विद्युत परिपथ।
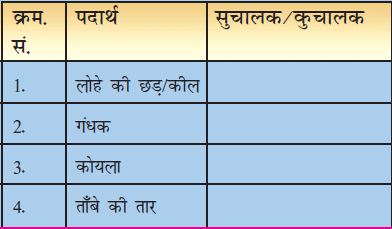
में विभिन्न वस्तुओं के साथ यह क्रियाकलाप किया होगा। अब इसी क्रियाकलाप को सारणी 4.3 में दिए गए पदार्थों के साथ दोहराइए। प्रेक्षण लीजिए और इन पदार्थों को सुचालकों और कुचालकों में वर्गीकृत करिए।
सारणी 4.3 : पदार्थों की वैद्युत चालकता
आपने पाया कि लोहे की छड़, कील और ताँबे का तार सुचालक हैं जबकि गंधक और कोयला कुचालक हैं।

ओह! अपने अनुभव स्मरण करने और फिर इस क्रियाकलाप का अर्थ यह दिखाना था कि धातु ऊष्मा और विद्युत के सुचालक होते हैं। यह हमने कक्षा VI में सीखा था।
आप एेलुमिनियम और ताँबे की तारों का उपयोग कहाँ देखते हैं? क्या आपने कोयले की तारें देखी हैं? निश्चित रूप से नहीं!
धातुओं का वह गुण जिससे उन्हें खींचकर तारों में परिवर्तित किया जा सकता है, तन्यता कहलाता है।
क्या आपने कभी लोहे की शीट/प्लेट, धातु का सिक्का, और एक कोयले का टुकड़ा फर्श पर गिराकर, उनसे उत्पन्न ध्वनि के अन्तर पर ध्यान दिया है? यदि नहीं, तो अब आप प्रयास कर सकते हैं।
क्या आप उत्पन्न ध्वनियों में कोई अन्तर पाते हैं?
क्या आपने मंदिरों में लकड़ी की घंटियाँ देखी हैं? क्या आप इसका कारण बता सकते हैं?
धातुओं से बनी वस्तुओं को जब कठोर सतह से टकराया जाता है तो एक निनाद ध्वनि (ringing sound) उत्पन्न होती है। माना आपके पास दो समान दिखने वाले डिब्बे हैं, एक लकड़ी से निर्मित और दूसरा धातु से। क्या आप दोनों डिब्बों पर चोट करके बता सकते हैं कि कौन सा डिब्बा धातु का बना हुआ है?
क्योंकि धातु गायन ध्वनियाँ उत्पन्न करते हैं, अतः वे ध्वानिक कहलाते हैं। धातुओं के अलावा अन्य पदार्थ ध्वानिक नहीं होते।
उक्त क्रियाकलाप करने के पश्चात् हम कह सकते हैं कि कुछ पदार्थ कठोर, चमकीले, आघातवर्ध, तन्य, ध्वानिक और ऊष्मा तथा विद्युत के सुचालक होते हैं। पदार्थ जिनमें सामान्यतया ये गुण होते हैं, धातु कहलाते हैं। धातुओं के उदाहरण हैं- आयरन, कॉपर, एेलुमिनियम, कैल्सियम, मैग्नीशियम, इत्यादि। इसके विपरीत कोयले और सल्फ़र जैसे पदार्थ नरम हैं तथा दिखने में मलिन हैं, ये हथौड़े की हलकी चोट से टूटकर चूरा हो जाते हैं, ध्वानिक नहीं हैं और ऊष्मा तथा विद्युत के कुचालक हैं। ये पदार्थ अधातु कहलाते हैं। अधातुओं के उदाहरण हैं - सल्फ़र, कार्बन, अॉक्सीजन, फॉस्फोरस, इत्यादि।
सोडियम और पोटैशियम धातु नरम होते हैं और उन्हें चाकू से काटा जा सकता है। मर्करी (पारा) केवल एेसा धातु है जो कमरे के तापमान पर द्रव अवस्था में पाया जाता है। ये अपवाद हैं।
4.2 धातुओं और अधातुओं के रासायनिक गुण
A. अॉक्सीजन से अभिक्रिया
आप आयरन में जंग लगने की परिघटना से परिचित हैं। जंग बनने की अभिक्रिया का स्मरण करिए। आपने कक्षा VII में मैग्नीशियम रिबन के वायु में दहन का क्रियाकलाप किया है। आपने सीखा था कि दोनों प्रक्रमों में अॉक्साइड बनते हैं। आयरन और मैग्नीशियम की अॉक्सीजन के साथ निम्नलिखित अभिक्रियाओं को पूरा करिए।
आयरन (Fe) + अॉक्सीजन (O2) + जल (H2O) → ?
मैग्नीशियम (Mg) + अॉक्सीजन (O2) → ?
क्रियाकलाप 4.3
आइए, आयरन, अॉक्सीजन और जल की अभिक्रिया के परिणामस्वरूप बने जंग की प्रकृति की जाँच करें। लगभग एक चम्मच जंग को इकट्ठा करिए और उसे बहुत थोड़े जल में घोलिए। आप पाएँगे कि वह जल में निलम्बन के रूप में रहता है। लटकन को अच्छी तरह हिलाइए। विलयन का परीक्षण क्रमशः लाल और नीले लिटमस पत्रों से करिए (चित्र 4.3)। आप क्या देखते हैं? विलयन अम्लीय है या क्षारीय?
चित्र 4.3 : जंग की प्रकृति का परीक्षण।

क्या कॉपर में भी जंग लगता है? मैंने कॉपर के बर्तनों की सतह पर हरा पदार्थ जमा हुआ देखा है।
जब कॉपर के बर्तन को लम्बे समय तक नम वायु में खुला रखा जाता है तो उस पर एक हलकी हरी परत जम जाती है। यह हरा पदार्थ कॉपर हाइड्रॉक्साइड [Cu(OH)2] और कॉपर कार्बोनेट [CuCO3] का मिश्रण होता है। अभिक्रिया निम्नलिखित है-
2Cu+H2O+CO2+O2→Cu(OH)2 + CuCO3

नम वायु
आपने प्रेक्षण किया होगा कि लाल लिटमस नीला हो जाता है। इसलिए मैग्नीशियम के अॉक्साइड की प्रकृति क्षारीय होती है। सामान्यतः धात्विक अॉक्साइड क्षारीय प्रकृति के होते हैं।
आइये, अब अधातुओं की अॉक्सीजन के साथ अभिक्रिया का प्रेक्षण करें।
क्रियाकलाप 4.4
(शिक्षक द्वारा कक्षा में प्रदर्शित की जाएँ)
चूर्णित सल्फ़र की कुछ मात्रा एक उद्दहन चम्मच में लीजिए और उसे गर्म करिए।
यदि उद्दहन चम्मच उपलब्ध न हो तो आप किसी भी बोतल का धातु का ढक्कन ले सकते हैं। इसके चारों ओर एक धातु का तार लपेट दीजिए जैसा कि चित्र 4.4(a) में दिखाया गया है। जैसे ही सल्फ़र जलना प्रारम्भ हो तो चम्मच को एक गैस जार/काँच के गिलास में ले जाइए [चित्र 4.4(a)] गिलास को एक ढक्कन से ढक दीजिए जिससे बनने वाली गैस बाहर न जा सके। कुछ समय पश्चात् चम्मच को हटा दीजिए।
गिलास में थोड़ा जल डालिए और तुरन्त ढक्कन से वापस ढक दीजिए। अब गिलास को भली भांति हिलाइए। विलयन का परीक्षण क्रमशः लाल और नीले लिटमस पत्रों से करिए [चित्र 4.4(b)]।
चित्र 4.4(a) : सल्फ़र चूर्ण का दहन।

चित्र 4.4(b) : लिटमस पत्रों द्वारा विलयन का परीक्षण।
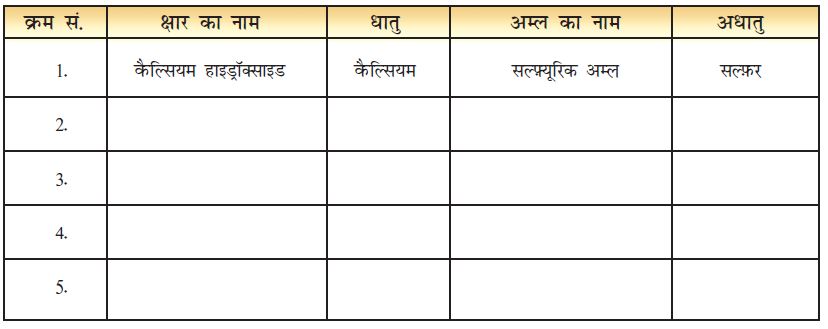
सारणी 4.4 : अम्लों और क्षारों में धातु और अधातु
सल्फर और अॉक्सीजन की अभिक्रिया में बनने वाले उत्पाद का नाम सल्फ़र डाइअॉक्साइड गैस है। जब सल्फ़र डाइअॉक्साइड को जल में विलेय करते हैं तो सल्फ्यूरस अम्ल प्राप्त होता है। अभिक्रिया निम्न प्रकार से दी जा सकती हैः
सल्फ़र डाइअॉक्साइड (SO2) + जल (H2O) → सल्फ्यूरस अम्ल (H2SO3)
सल्फ्यूरस अम्ल नीले लिटमस पत्र को लाल कर देता है। सामान्यतः अधातुओं के अॉक्साइड अम्लीय प्रकृति के होते हैं।
प्रयोगशाला में काम आने वाले कुछ अम्लों और क्षारों के नाम याद करिए जो आपने कक्षा VII में पढ़े थे। उनके नाम सारणी 4.4 में लिखिए। उनमें उपस्थित धातु अथवा अधातु की पहचान करिए जो अॉक्सीजन के साथ अॉक्साइड बनाता है।
B. जल के साथ अभिक्रिया
आइए देखें, धातु और अधातु किस प्रकार जल से अभिक्रिया करते हैं।
सोडियम धातु बहुत अभिक्रियाशील होता है। यह अॉक्सीजन और जल के साथ अत्यन्त तीव्र अभिक्रिया करता है। अभिक्रिया में बहुत अधिक ऊष्मा उत्पन्न होती है। इसलिए यह मिट्टी के तेल में संचित रखा जाता है।
क्रियाकलाप 4.5
शिक्षक द्वारा कक्षा में प्रदर्शित की जाए (प्रदर्शन के समय विशिष्ट सावधानी रखी जाए कि सोडियम धातु के टुकड़े का आकार लगभग गेहूँ के दाने के बराबर हो। इसे चिमटी द्वारा पकड़ना चाहिए)।
एक 250 mL का बीकर/काँच का गिलास लीजिए। इसे आधा जल से भर लीजिए। अब सावधानीपूर्वक एक छोटा सोडियम धातु का टुकड़ा काटिए। फिल्टर पत्र का उपयोग कर इसे सुखा लीजिए और फिर रुई के छोटे टुकड़े में लपेट लीजिए। रुई में लिपटे सोडियम के टुकड़े को बीकर में डाल दीजिए। सावधानीपूर्वक प्रेक्षण लीजिए। प्रेक्षण लेते समय बीकर से दूर रहें। जब अभिक्रिया बंद हो जाए, बीकर को छूइए। आप क्या अनुभव करते हैं? क्या बीकर गर्म हो गया? विलयन का लाल और नीले लिटमस पत्रों से परीक्षण करिए। विलयन अम्लीय है या क्षारीय?

चित्र 4.5 : सोडियम की जल से अभिक्रिया।
आपने देखा कि सोडियम जल के साथ तीव्र अभिक्रिया करता है। कुछ अन्य धातु एेसा नहीं करते। उदाहरण के लिए, आयरन जल से धीमी अभिक्रिया करता है।
सामान्यतः अधातु जल से अभिक्रिया नहीं करते, यद्यपि वे वायु में बहुत सक्रिय हो सकते हैं। इस प्रकार के अधातुओं को जल में रखा जाता है। उदाहरण के लिए, फ़ॉस्फ़ोरस एक बहुत सक्रिय अधातु है। वायु में खुला रखने पर यह आग पकड़ लेता है। फ़ॉस्फ़ोरस से वायुमण्डलीय अॉक्सीजन का सम्पर्क न हो, इसलिए उसे जल में रखा जाता है।
C. अम्लों से अभिक्रिया
आइए देखें, धातु और अधातु अम्लों के साथ किस प्रकार व्यवहार करते हैं।
क्रियाकलाप 4.6
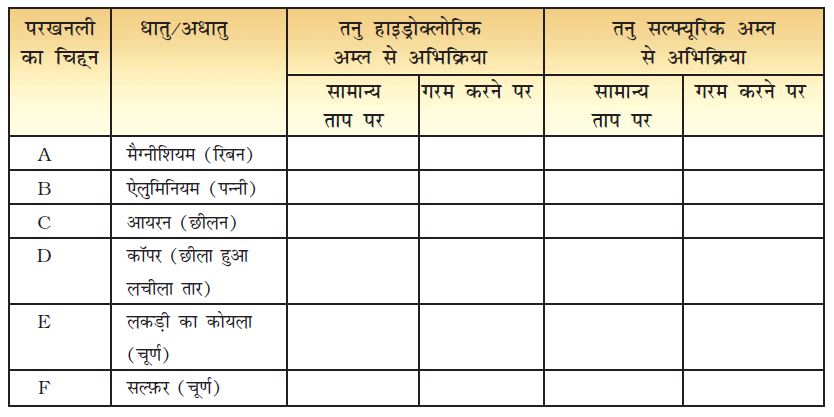
सावधानी : परखनली के मुँह को अपने चेहरे से दूर रखिए। परखनली पकड़ने के लिए परखनली होल्डर का प्रयोग करिए।
सारणी 4.5 में सूचीबद्ध धातुओं और अधातुओं के नमूने पृथक् परखनलियों में लीजिए और उन्हें A, B, C, D, E और F से चिह्नित कर दीजिए। ड्रॉपर की सहायता से प्रत्येक परखनली में एक-एक करके 5 mL तनु हाइड्रोक्लोरिक अम्ल डालिए। अभिक्रिया का सावधानीपूर्वक प्रेक्षण करिए। यदि ठंडे विलयन में कोई अभिक्रिया नहीं होती तो परखनली को हलका गर्म करिए। प्रत्येक परखनली के मुँह के पास एक जलती हुई माचिस की तीली लाइए। यही क्रियाकलाप तनु हाइड्रोक्लोरिक अम्ल के स्थान पर तनु सल्फ्यूरिक अम्ल लेकर दोहराइए। अपने प्रेक्षणों को सारणी 4.5 में लिखिए।
क्या धातु और अधातु, अम्लों से भिन्न प्रकार से अभिक्रिया करते हैं? परखनलियों के मुँह के पास जलती हुई माचिस की तीली लाने पर, कुछ में ‘पॉप’ ध्वनि क्यों उत्पन्न हुई थी?
आपने पाया होगा कि अधातु सामान्यतः अम्लों से अभिक्रिया नहीं करते, परन्तु धातु अम्लों से अभिक्रिया करते हैं और हाइड्रोजन गैस उत्पन्न करते हैं, जो ‘पॉप’ ध्वनि के साथ जलती है। आपने देखा कि कॉपर तनु हाइड्रोक्लोरिक अम्ल से गर्म करने पर भी अभिक्रिया नहीं करता। परन्तु यह सल्फ्यूरिक अम्ल से अभिक्रिया कर लेता है।
सारणी 4.5 : धातुओं और अधातुओं की अम्लों से अभिक्रिया
D. क्षारों से अभिक्रियाएँ
क्रियाकलाप 4.7
शिक्षक द्वारा प्रदर्शित की जाए
(सोडियम हाइड्रॉक्साइड विलयन बनाते समय सावधानी बरतिए कि सोडियम हाइड्रॉक्साइड की टिकियाओं को प्लास्टिक स्पैचुला से पकड़ें)
एक परखनली में सोडियम हाइड्रॉक्साइड का ताज़ा विलयन उसकी 3-4 टिकियाँ 5 mL जल में घोलकर बनाइए। इसमें एक एेलुमिनियम की पन्नी का टुकड़ा डालिए। एक जलती हुई माचिस की तीली परखनली के मुँह के निकट लाइए। ध्यान से प्रेक्षण लीजिए।
चित्र 4.6 (a) तथा (b) : विस्थापन अभिक्रियाएँ।
‘पॉप’ ध्वनि क्या दर्शाती है? पहले की तरह ‘पॉप’ ध्वनि हाइड्रोजन गैस की उपस्थिति दर्शाती है। धातु सोडियम हाइड्रॉक्साइड से अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करते हैं। अधातुओं की क्षारों से अभिक्रियाएँ जटिल हैं।
E. विस्थापन अभिक्रियाएँ
कॉपर सल्फेट और आयरन के मध्य अभिक्रिया वाले क्रियाकलाप को याद करिए जो आपने कक्षा VII में किया था। आइए, उस प्रकार की कुछ और अभिक्रियाओं को देखें।
क्रियाकलाप 4.8
100 मिली के पाँच बीकर लीजिए और उन्हें A, B, C, D और E चिह्नित कर दीजिए। प्रत्येक बीकर में लगभग 50 mL जल लीजिए। प्रत्येक बीकर में चित्र 4.6 (a) में दर्शाये पदार्थों में से प्रत्येक का एक चम्मच डालकर घोल लीजिए।
बीकरों को बिना छेड़े कुछ समय तक रखा रहने दीजिए।
अपने प्रेक्षणों को नोटबुक में रिकॉर्ड करिए।
बीकर B : कॉपर सल्फेट (CuSO4) + लोहे की कील (Fe)
बीकर C : जिंक सल्फेट (ZnSO4) + ताँबे की छीलन (Cu),
बीकर D : आयरन सल्फेट (FeSO4) + ताँबे की छीलन (Cu)
बीकर E : जिंक सल्फेट (ZnSO4) + लोहे की कील (Fe)
आप विभिन्न बीकरों में क्या परिवर्तन देखते हैं? आपने पढ़ा है कि एक धातु दूसरे धातु को उसके यौगिक के जलीय विलयन से विस्थापित करता है। बीकर A में जिंक, कॉपर सल्फेट विलयन से कॉपर को विस्थापित करता है और इसीलिए कॉपर सल्फेट का नीला रंग अदृश्य हो जाता है और बीकर के पेंदे पर कॉपर का लाल चूर्ण जमा हो जाता है। अभिक्रिया को निम्न प्रकार से प्रदर्शित किया जा सकता हैः
कॉपर सल्फेट (CuSO4) + जिंक (Zn) →
(नीला)
जिंक सल्फेट (ZnSO4) + कॉपर (Cu) (रंगहीन) (लाल)
आप इसी प्रकार बीकर B में होने वाली अभिक्रिया को लिख सकते हैं।

मैंने बीकर A और B में होने वाली अभिक्रियाओं को समझ लिया है। परन्तु मैं अभी भी भ्रमित हूँ कि बीकर C, D और E में कोई परिवर्तन क्यों
नहीं हुआ?
बीकर C में जिंक का कॉपर द्वारा और बीकर E में आयरन द्वारा विस्थापन हो सकता था। इसी प्रकार बीकर D में आयरन का विस्थापन कॉपर द्वारा हो सकता था।
क्योंकि हम बीकर C में कोई परिवर्तन नहीं देखते, हम इस निष्कर्ष पर पहुँच सकते हैं कि कॉपर, जिंक सल्फेट से जिंक को प्रतिस्थापित करने में सक्षम नहीं है। परन्तु क्यों? जब बीकर A में जिंक, कॉपर को प्रतिस्थापित कर सकता है, तो बीकर C में कॉपर, जिंक को प्रतिस्थापित क्यों नहीं कर सकता? याद रखिए विज्ञान मनमाना नहीं होता। यह तथ्यों पर आधारित निश्चित नियमों का पालन करता है। और यहाँ नियम यह है कि जिंक, कॉपर और आयरन से अधिक अभिक्रियाशील है। एक अधिक अभिक्रियाशील धातु, कम अभिक्रियाशील धातु को विस्थापित कर सकता है परन्तु कम अभिक्रियाशील धातु, अधिक अभिक्रियाशील धातु को प्रतिस्थापित नहीं कर सकता। अब आप समझ सकते हैं कि बीकर D और E में विस्थापन अभिक्रियाएँ क्यों सम्पन्न नहीं हुईं। क्या आप जिंक, आयरन और कॉपर के मध्य अधिक अभिक्रियाशील से कम अभिक्रियाशीलधातु के क्रम का अनुमान लगा सकते हैं?
4.3 धातुओं और अधातुओं के उपयोग
आपको अनुमान लगाने में सक्षम होना चाहिए कि क्यों धातुओं का उपयोग मशीनें, मोटर गाड़ियाँ, वायुयान, रेलगाड़ियाँ, उपग्रह, औद्योगिक साजो-सामान, खाना बनाने के पात्र, जल बॉयलर, आदि के निर्माण में किया जाता है। आप कुछ अधातुओं के उपयोगों से भी परिचित होंगे। यहाँ कुछ रोचक उपयोग दिये जा रहे हैं। हमें विश्वास है कि आप उनका सही अनुमान लगा पाएँगेः
- अधातु जो हमारे जीवन के लिए आवश्यक है और जिसे सभी सजीव श्वसन के समय अन्दर लेते हैं।
- अधातु जिनका उपयोग उर्वरकों में पौधों की वृद्धि हेतु किया जाता है।
- अधातु जिसका उपयोग जल शुद्धिकरण प्रक्रम में किया जाता है।
- अधातु जिसका बैंगनी रंग का विलयन एंटीबायोटिक के रूप में घावों पर लगाया जाता है।
- पटाखों में प्रयुक्त होने वाले अधातु।
आप अपने अनुभव से धातुओं और अधातुओं के कुछ और उपयोग जोड़ सकते हैं।
पदार्थ : धातु और अधातु
आपने कक्षा VII में सीखा है कि रासायनिक अभिक्रियाओं में नये पदार्थ बनते हैं। ये पदार्थ, उन पदार्थों से भिन्न होते हैं जिनमें अभिक्रिया होती है। अब यदि कोई पदार्थ रासायनिक अभिक्रियाओं द्वारा, ठंडा करके, गर्म कर अथवा वैद्युत अपघटन द्वारा और अधिक विघटित नहीं किया जा सकता, तो वह ‘तत्व’ कहलाता है। सल्फर एक तत्व है। इसी प्रकार आयरन और कार्बन भी एक तत्व हैं। तत्व के एक नमूने में एक ही प्रकार के परमाणु होते हैं। परमाणु तत्व की सबसे छोटी इकाई होता है। तत्व के भौतिक परिवर्तनों में तत्व के परमाणु अप्रभावित रहते हैं। उदाहरण के लिए, द्रव सल्फर का परमाणु पूर्ण रूप से ठोस अथवा वाष्प सल्फर के परमाणु के समान होता है।
यद्यपि ब्रह्माण्ड में पदार्थों की असंख्य किस्में हैं, इन्हें बनाने वाले तत्वों की संख्या सीमित है। प्राकृतिक रूप से पाए जाने वाले तत्वों की संख्या 94 से अधिक नहीं है। धातुओं और अधातुओं के रूप में तत्वों का एक महत्वपूर्ण वर्गीकरण है। अधिकांश तत्व धातु हैं। शेष तत्व या तो अधातु हैं या उपधातु है। उपधातु, धातु और अधातु दोनों के गुण रखते हैं।

डॉक्टर ने मेरे शरीर में आयरन की कमी बताई है। मेरे शरीर में आयरन कहाँ है?

मैंने सुना है कि पौधों में मैग्नीशियम पाया जाता है। यह उनमें किस रूप में पाया जाता है?
परमाणु
चालक
विस्थापन-अभिक्रिया
तन्यता
तत्व
कठोरता
आघातवर्धनीयता
धातु
उपधातु
अधातु
ध्वानिक
आपने क्या सीखा
धातुओं में चमक होती है जबकि अधातुओं में चमक नहीं होती।
सामान्यतः धातु आघातवर्धनीय और तन्य होते हैं, अधातु नहीं होते।
सामान्यतः धातु ऊष्मा और विद्युत के सुचालक होते हैं परन्तु अधातु नहीं होते।
दहन करने पर धातु अॉक्सीजन से अभिक्रिया कर धातु अॉक्साइड बनाते हैं जो क्षारीय प्रकृति के होते हैं। अधातु, अॉक्सीजन से अभिक्रिया कर अधातु अॉक्साइड बनाते हैं जिनकी प्रकृति अम्लीय होती है।
कुछ धातु, जल से अभिक्रिया कर धातु हाइड्रॉक्साइड और हाइड्रोजन गैस उत्पन्न करते हैं। अधातु जल से अभिक्रिया नहीं करते।
धातु अम्लों से अभिक्रिया करते हैं और धातु लवण तथा हाइड्रोजन गैस बनाते हैं। सामान्यतः अधातु अम्लों से अभिक्रिया नहीं करते।
कुछ धातु क्षारों से अभिक्रिया कर हाइड्रोजन गैस देते हैं।
अधिक अभिक्रियाशील धातु, कम अभिक्रियाशील धातुओं को उनके धातु यौगिकों के जलीय विलयन में विस्थापित कर देते हैं।
धातुओं और अधातुओं का दैनिक जीवन में व्यापक उपयोग होता है।
अभ्यास
1. निम्नलिखित में से किसको पीटकर पतली चादरों में परिवर्तित किया जा सकता है?
(क) जिंक (ख) फ़ॉस्फ़ोरस (ग) सल्फ़र (घ) अॉक्सीजन
2. निम्नलिखित में से कौन सा कथन सही है?
(क) सभी धातुएँ तन्य होती हैं।
(ख) सभी अधातुएँ तन्य होती हैं।
(ग) सामान्यतः धातुएँ तन्य होती हैं।
(घ) कुछ अधातुएँ तन्य होती हैं।
3. रिक्त स्थानों की पूर्ति कीजिए–
(क) फ़ॉस्फ़ोरस बहुत  अधातु है।
अधातु है।
(ख) धातुएँ ऊष्मा और  की
की  होती हैं।
होती हैं।
(ग) आयरन, कॉपर की अपेक्षा  अभिक्रियाशील है।
अभिक्रियाशील है।
(घ) धातुएँ, अम्लों से अभिक्रिया कर  गैस बनाती हैं।
गैस बनाती हैं।
4. यदि कथन सही है तो "T" और यदि गलत है तो कोष्ठक में "F" लिखिए–
(क) सामान्यतः अधातु अम्लों से अभिक्रिया करते हैं। ( )
(ख) सोडियम बहुत अभिक्रियाशील धातु है। ( )
(ग) कॉपर, जिंक सल्फेट के विलयन से जिंक विस्थापित करता है। ( )
(घ) कोयले को खींच कर तारें प्राप्त की जा सकती हैं। ( )
5. नीचे दी गई सारणी में गुणों की सूची दी गई है। इन गुणों के आधार पर धातुओं और अधातुओं में अन्तर कीजिए–
गुण धातु अधातु
1. दिखावट
2. कठोरता
3. आघातवर्धनीयता
4. तन्यता
5. ऊष्मा चालन
6. विद्युत चालन
6. निम्नलिखित के लिए कारण दीजिए–
(क) एेलुमिनियम की पन्नी का उपयोग खाद्य सामग्री को लपेटने में किया जाता है।
(ख) निमज्जन छड़ें (इमरशन रॉड) धात्विक पदार्थों से निर्मित होती हैं।
(ग) कॉपर, जिंक को उसके लवण के विलयन से विस्थापित नहीं कर सकता।
(घ) सोडियम और पोटैशियम को मिट्टी के तेल में रखा जाता है।
7. क्या आप नींबू के अचार को एेलुमिनियम पात्रों में रख सकते हैं? स्पष्ट करिए।
8. नीचे दी गई सारणी के कॉलम I में कुछ पदार्थ दिये गये हैं। कॉलम II में उनके कुछ उपयोग दिये गये हैं। कॉलम I के पदार्थों का कॉलम II से सही मिलान करिए–
कॉलम I कॉलम II
1. गोल्ड 1. थर्मामीटर2. आयरन 2. बिजली के तार
3. एेलुमिनियम 3. खाद्य सामग्री लपेटना
4. कार्बन 4. आभूषण
5. कॉपर 5. मशीनें
6. मर्करी 6. ईंधन
9. क्या होता है जब–
(क) तनु सल्फ्यूरिक अम्ल कॉपर प्लेट पर डाला जाता है?
(ख) लोहे की कील, कॉपर सल्फेट के विलयन में रखी जाती है?
सम्बन्धित अभिक्रियाओं के शब्द समीकरण लिखिए।
10. सलोनी ने लकड़ी के कोयले का एक जलता हुआ टुकड़ा लिया और उससे उत्सर्जित होने वाली गैस को एक परखनली में इकट्ठा किया–
(क) वह गैस की प्रकृति कैसे ज्ञात करेगी?
(ख) इस प्रक्रम में होने वाली सभी अभिक्रियाओं के शब्द समीकरण लिखिए।
11. एक दिन रीता अपनी माँ के साथ आभूषण विक्रेता की दुकान पर गई। उसकी माँ ने सुनार को पॉलिश करने हेतु सोने के पुराने आभूषण दिए। अगले दिन जब वे आभूषण वापस लाईं तो उन्होंने पाया कि उनका भार कुछ कम हो गया है। क्या आप भार में कमी का कारण बता सकते हैं?
विस्तारित अधिगम - क्रियाकलाप एवं परियोजनाएँ
1. किन्हीं चार धातुओं और चार अधातुओं के लिए सूचक पत्रक (इंडेक्स कार्ड) तैयार करिए। पत्रक में धातु/अधातु का नाम, उसके भौतिक गुण, रासायनिक गुण और उपयोगों जैसी सूचना होनी चाहिए।
2. एक लोहार के कार्य स्थल पर जाइए और देखिए कि किस प्रकार धातुओं को ढाला जाता है।
3. आयरन, कॉपर, एेलुमिनियम और जिंक की वैद्युत चालकताओं की तुलना करने हेतु कोई प्रयोग सुझाइए। प्रयोग करिए और परिणामों पर एक संक्षिप्त रिपोर्ट तैयार करिए।
4. भारत में आयरन, एेलुमिनियम और जिंक के भण्डार स्थलों की जानकारी प्राप्त करिए। इसे भारत के रेखाचित्र में चिह्नित करिए। ये भण्डार किस रूप में पाये जाते हैं? कक्षा में चर्चा करिए।
5. अपने माता-पिता/पड़ोसियों/स्वर्णकारों से चर्चा करिए कि आभूषण निर्माण में गोल्ड को वरीयता क्यों दी जाती है।
6. निम्नलिखित वेबसाइटों को देखिए और धातुओं एवं अधातुओं पर क्विज़ का आनन्द लीजिए
- chemistry.about.com/library/weekly/b1050303a.htm
- chemistry.about.com/od/testsquizzes/Chemistry_Tests_ Quizzes.htm
- www.gcsescience.com/q/qusemet.html
- www.corrosionsource.com/handbook/periodic/metals.htm