Table of Contents
अध्याय 3
परमाणु एवं अणु
(Atoms and Molecules)
प्राचीन भारतीय एवं ग्रीक दार्शनिक द्रव्य के अज्ञात एवं अदृश्य रूपों से सदैव चकित होते रहे। पदार्थ की विभाज्यता के मत के बारे में भारत में बहुत पहले, लगभग 500 ईसा पूर्व विचार व्यक्त किया गया था।
भारतीय दार्शनिक महर्षि कनाड (Maharshi Kanad) ने प्रतिपादित किया था कि यदि हम द्रव्य (पदार्थ) को विभाजित करते जाएँ तो हमें छोटे-छोटे कण प्राप्त होते जाएँगे तथा अंत में एक सीमा आएगी जब प्राप्त कण को पुनः विभाजित नहीं किया जा सकेगा अर्थात् वह सूक्ष्मतम कण अविभाज्य रहेगा। इस अविभाज्य सूक्ष्मतम कण को उन्होंने परमाणु कहा। एक अन्य भारतीय दार्शनिक पकुधा कात्यायाम (Pakudha Katyayama) ने इस मत को विस्तृत रूप से समझाया तथा कहा कि ये कण सामान्यतः संयुक्त रूप में पाए जाते हैं, जो हमें द्रव्यों के भिन्न-भिन्न रूपों को प्रदान करते हैं।
लगभग इसी समय ग्रीक दार्शनिक डेमोक्रिटस (Democritus) एवं लियुसीपस (Leucippus) ने सुझाव दिया था कि यदि हम द्रव्य को विभाजित करते जाएँ, तो एक एेसी स्थिति आएगी जब प्राप्त कण को पुनः विभाजित नहीं किया जा सकेगा। उन्होंने इन अविभाज्य कणों को परमाणु (अर्थात् अविभाज्य) कहा था। ये सभी सुझाव दार्शनिक विचारों पर आधारित थे। इन विचारों की वैधता सिद्ध करने के लिए 18वीं शताब्दी तक कोई अधिक प्रयोगात्मक कार्य नहीं हुए थे।
18वीं शताब्दी के अंत तक वैज्ञानिकों ने तत्वों एवं यौगिकों के बीच भेद को समझा तथा स्वाभाविक रूप से यह पता करने के इच्छुक हुए कि तत्व कैसे तथा क्यों संयोग करते हैं? जब तत्व परस्पर संयोग करते हैं, तब क्या होता है?
वैज्ञानिक आंतवाँ एल. लवाइजिए (Antonie L. Lavoisier) ने रासायनिक संयोजन के दो महत्वपूर्ण नियमों को स्थापित किया जिसने रसायन विज्ञान को महत्वपूर्ण आधार प्रदान किया।
3.1 रासायनिक संयोजन के नियम
लवाइजिए एवं जोजफ एल. प्राउस्ट (Joseph L. Proust) ने बहुत अधिक प्रायोगिक कार्यों के पश्चात् रासायनिक संयोजन के निम्नलिखित दो नियम प्रतिपादित किए।
3.1.1 द्रव्यमान संरक्षण का नियम
जब रासायनिक परिवर्तन (रासायनिक अभिक्रिया) संपन्न होता है, तब क्या द्रव्यमान में कोई परिवर्तन होता है?
क्रियाकलाप______________3.1
• निम्न X एवं Y रसायनों का एक युगल लीजिए।
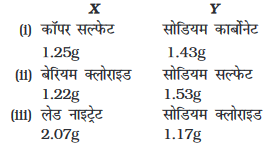
• X एवं Y युगलों की सूची में से किसी एक युगल के रसायनों के अलग-अलग विलयन 10 mL जल में तैयार कीजिए।
• उपरोक्त तैयार युगल विलयनों में से Y के विलयन को एक शंक्वाकार फ्लास्क में लीजिए एवं X के विलयन को एक छोटी परख नली में लीजिए।
• छोटी परख नली को विलय युक्त फ्लास्क में इस प्रकार लटकाइए ताकि दोनों विलयन परस्पर मिश्रित न हों। तत्पश्चात् फ्लास्क के मुख पर एक कार्क चित्र 3.1 की भाँति लगाइए।
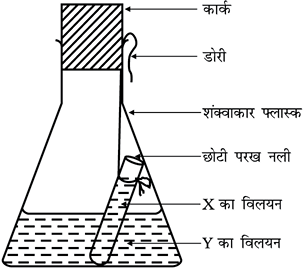
चित्र 3.1: Y के विलयन युक्त शंक्वाकार फ्लास्क में डूबी हुई X के विलयन युक्त छोटी परख नली।
• अंर्तवस्तु युक्त फ्लास्क को सावधानीपूर्वक तौल लीजिए।
• अब फ्लास्क को झुकाकर इस प्रकार घुमाएँ जिससे X एवं Y के विलयन परस्पर मिश्रित हो जाएँ।
• अब इस फ्लास्क को पुनः तौल लीजिए।
• शंक्वाकार फ्लास्क में क्या अभिक्रिया हुई?
• क्या आप सोचते हैं कि कोई रासायनिक अभिक्रिया हुई?
• फ्लास्क के मुख पर कार्क क्यों लगाते हैं?
• क्या फ्लास्क के द्रव्यमान एवं अंतर्वस्तुओं में कोई परिवर्तन हुआ?
द्रव्यमान संरक्षण के नियम के अनुसार किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है न ही विनाश।
3.1.2 स्थिर अनुपात का नियम
लवाइजिए एवं अन्य वैज्ञानिकों ने इस बात पर प्रकाश डाला कि कोई भी यौगिक दो या दो से अधिक तत्वों से निर्मित होता है। इस प्रकार प्राप्त यौगिकों में, इन तत्वों का अनुपात स्थिर होता है चाहे इसे किसी स्थान से प्राप्त किया गया हो अथवा किसी ने भी इसे बनाया हो।
यौगिक जल में हाइड्रोजन एवं अॉक्सीजन के द्रव्यमानों का अनुपात सदैव 1:8 होता है चाहे जल का स्रोत कोई भी हो। इसी प्रकार यदि 9 g जल का अपघटन करें तो सदैव 1 g हाइड्रोजन तथा 8g अॉक्सीजन ही प्राप्त होगी। इसी प्रकार अमोनिया (NH3) में, नाइट्रोजन एवं हाइड्रोजन द्रव्यमानों के अनुसार सदैव 14:3 के अनुपात में विद्यमान रहते हैं, चाहे अमोनिया किसी भी प्रकार से निर्मित हुई हो अथवा किसी भी स्रोत से ली गई हो।
उपरोक्त उदाहरणों से स्थिर अनुपात के नियम की व्याख्या होती है जिसे निश्चित अनुपात का नियम भी कहते हैं। प्राउस्ट ने इस नियम को इस प्रकार से व्यक्त किया था "किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमानों के अनुपात में विद्यमान होते हैं"।

जॉन डाल्टन
जॉन डाल्टन का जन्म सन् 1766 में इंग्लैंड के एक गरीब जुलाहा परिवार में हुआ था। बारह वर्ष की आयु में उन्होंने एक शिक्षक के रूप में अपनी जीविका शुरू की। सात साल बाद वह एक स्कूल के प्रिंसिपल बन गए। सन् 1793 में जॉन डाल्टन एक कॉलेज में गणित, भौतिकी एवं रसायन शास्त्र पढ़ाने के लिए मैनचेस्टर चले गए। वहाँ पर उन्होंने अपने जीवन का अधिकांश समय शिक्षण एवं शोधकार्य में व्यतीत किया। सन् 1808 में इन्होंने अपने परमाणु सिद्धांत को प्रस्तुत किया, जो द्रव्यों के अध्ययन के लिए एक महत्वपूर्ण सिद्धांत साबित हुआ।
वैज्ञानिकों की अगली समस्या इन नियमों की उचित व्याख्या करने की थी। अंग्रेज रसायनज्ञ, जॉन डाल्टन ने द्रव्यों की प्रकृति के बारे में एक आधारभूत सिद्धांत प्रस्तुत किया। डाल्टन ने द्रव्यों की विभाज्यता का विचार प्रदान किया जिसे उस समय तक दार्शनिकता माना जाता था। ग्रीक दार्शनिकों के द्वारा द्रव्यों के सूक्ष्मतम अविभाज्य कण, जिसे परमाणु नाम दिया था, उसे डाल्टन ने भी परमाणु नाम दिया। डाल्टन का यह सिद्धांत रासायनिक संयोजन के नियमों पर आधारित था। डाल्टन के परमाणु सिद्धांत ने द्रव्यमान के संरक्षण के नियम एवं निश्चित अनुपात के नियम की युक्तिसंगत व्याख्या की।
डाल्टन के परमाणु सिद्धांत के अनुसार सभी द्रव्य चाहे तत्व, यौगिक या मिश्रण हो, सूक्ष्म कणों से बने होते हैं जिन्हें परमाणु कहते हैं। डाल्टन के सिद्धांत की विवेचना निम्न प्रकार से कर सकते हैं ः
(i) सभी द्रव्य परमाणुओं से निर्मित होते हैं, जो कि रासायनिक अभिक्रिया में भाग लेते हैं।
(ii) परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं न ही उनका विनाश होता है।
(iii) दिए गए तत्व के सभी परमाणुओं का द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
(iv) भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
(v) भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं।
(vi) किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।
आप अगले अध्याय में यह अध्ययन करेंगे कि परमाणु में और भी छोटे-छोटे कण विद्यमान होते हैं।
प्रश्न
1. एक अभिक्रिया में 5.3 g सोडियम कार्बोनेट एवं 6.0 g एसीटिक अम्ल अभिकृत होते हैं। 2.2 g कार्बन डाइअॉक्साइड,8.2 g सोडियम एसीटेट एवं 0.9 g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + एसीटिक अम्ल → सोडियम एसीटेट + कार्बन डाइअॉक्साइड + जल
2. हाइड्रोजन एवं अॉक्सीजन द्रव्यमान के अनुसार 1:8 के अनुपात में संयोग करके जल निर्मित करते हैं। 3 g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए कितने अॉक्सीजन गैस के द्रव्यमान की आवश्यकता होगी?
3. डाल्टन के परमाणु सिद्धांत का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
4. डाल्टन के परमाणु सिद्धांत का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है?
3.2 परमाणु क्या होता है?
क्या आपने कभी किसी इमारत की दीवार बनते देखी है? इन दीवारों से एक कमरा एवं कई कमरों के समूह से एक इमारत निर्मित होती है। उस विशाल इमारत की रचनात्मक इकाई क्या है? किसी बाँबी (Ant-Hill) की रचनात्मक इकाई क्या होती है? यह रेत का छोटा-सा कण होता है। इसी प्रकार, सभी द्रव्यों की रचनात्मक इकाई परमाणु होती है।
परमाणु कितने बड़े होते हैं?
परमाणु बहुत छोटे होते हैं। ये किसी भी वस्तु, जिसकी हम कल्पना या तुलना कर सकते हैं, से भी छोटे होते हैं। लाखों परमाणुओं को जब एक के ऊपर एक चट्टे के रूप में रखें, तो बड़ी कठिनाई से कागज की एक शीट जितनी मोटी परत बन पाएगी।
परमाणु त्रिज्या को नेनोमीटर (nm) में मापा जाता है।
10–9 m = 1nm
1m = 109 nm
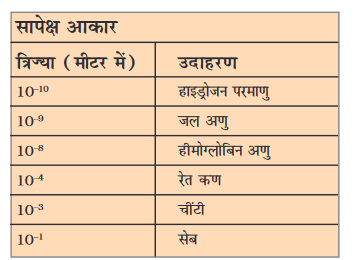
जब परमाणु का आकार इतना सूक्ष्म है कि हम इसे नगण्य मान सकते हैं, तो हम इसके बारे में क्यों सोचें? हम इसके बारे मेें इसलिए सोचते हैं क्योंकि हमारा पूरा विश्व ही परमाणुओं से बना है। चाहे हम उन्हें देख नहीं सकें, फिर भी वे यहाँ विद्यमान हैं तथा हमारे प्रत्येक क्रियाकलापों पर उनका प्रभाव पड़ता रहता है। अब हम आधुनिक तकनीकों की सहायता से तत्वों की सतहों के आवर्धित प्रतिबिंबों को दिखा सकते हैं, जिनमें उपस्थित परमाणु स्पष्ट दिखाई देते हैं।

चित्र 3-2ः सिलिकॉन सतह का प्रति ̄बब
3.2.1 विभिन्न तत्वों के परमाणुओं के आधुनिक प्रतीक क्या हैं?
डाल्टन एेसे प्रथम वैज्ञानिक थे, जिन्होंने तत्वों के प्रतीकों का प्रयोग अत्यंत विशिष्ट अर्थ में किया। जब उन्होंने किसी तत्व के प्रतीक का प्रयोग किया, तो यह प्रतीक उस तत्व की एक निश्चित मात्रा की ओर इंगित करता था अर्थात् यह प्रतीक तत्व के एक परमाणु को प्रदर्शित करता था। बर्जिलियस ने तत्वों के एेसे प्रतीकों का सुझाव दिया, जो उन तत्वोें के नामों के एक या दो अक्षरों से प्रदर्शित होता था।
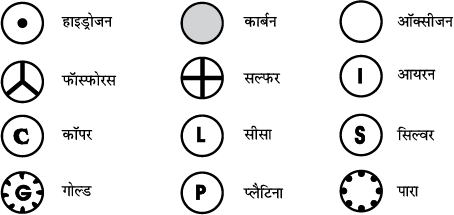
चित्र 3.3: डाल्टन द्वारा सुझाए गए कुछ तत्वों के प्रतीक
प्रारंभ में तत्वों के नामों की व्युत्पत्ति उन स्थानों के नामों से की गई, जहाँ वे सर्वप्रथम पाए गए थे। उदाहरणस्वरूप, कॉपर (Copper) का नाम साइप्रस (Cyprus) से व्युत्पन्न हुआ। कुछ तत्वों के नामों को विशिष्ट रंगों से लिया गया। उदाहरणस्वरूप, स्वर्ण (gold) का नाम अंग्रेजी के उस शब्द से लिया गया, जिसका अर्थ होता है पीला।
इंटरनेशनल यूनियन अॉफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) एक अर्न्तराष्ट्रीय वैज्ञानिक संस्था है जो तत्वों के नामों, प्रतीकों और मात्रकों को स्वीकृति प्रदान करती है। अधिकतर तत्वों के प्रतीक उन तत्वों के अंग्रेजी नामों के एक या दो अक्षरों से बने होते हैं। किसी प्रतीक के पहले अक्षर को सदैव बड़े अक्षर (capital letter) में तथा दूसरे अक्षर को छोटे अक्षर (small letter) में लिखा जाता है।
उदाहरणार्थ
(i) हाइड्रोजन, H
(ii) एेलुमिनियम, Al न कि AL
(iii) कोबाल्ट, Co न कि CO
कुछ तत्वों के प्रतीक उनके अंग्रेजी नामों के प्रथम अक्षर तथा बाद में आने वाले किसी एक अक्षर को संयुक्त करके बनाते हैं। उदाहरण ः (i) क्लोरीन, Cl, (ii) जिंक, Zn इत्यादि।
अन्य तत्वों के प्रतीकों को लैटिन, जर्मन या ग्रीक भाषाओं में उनके नामों से बनाया गया है। उदाहरणार्थः लौह (Iron) का प्रतीक Fe है, जो उसके लैटिन नाम फेरम से व्युत्पन्न किया गया है। इसी प्रकार सोडियम का प्रतीक Na तथा पोटैशियम का प्रतीक K क्रमशः नैट्रियम एवं केलियम से व्युत्पन्न हैं। इस प्रकार प्रत्येक तत्व का एक नाम एवं एक अद्वितीय रासायनिक प्रतीक होता है।
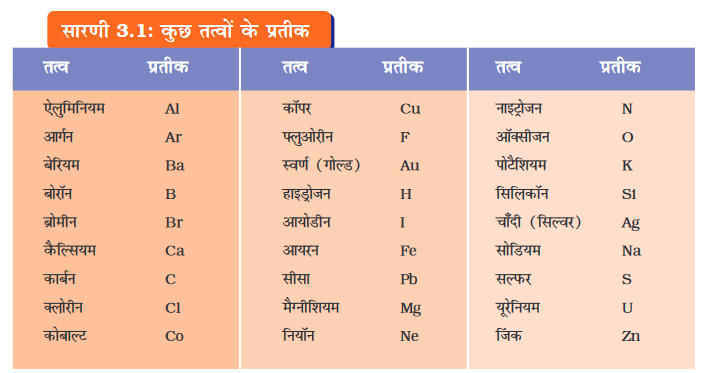
(जब कभी आप तत्वों का अध्ययन करें, तो आपके संदर्भ के लिए उपरोक्त सारणी दी गई है। इस पूरी सारणी को एक बार में याद करने की आवश्यकता नहीं है। समय-समय पर एवं बार-बार उपयोग करते रहने से आप स्वतः ही इन प्रतीकों को निर्मित करना सीख जाएँगे।)
3.2.2 परमाणु द्रव्यमान
डाल्टन के परमाणु सिद्धांत की सबसे विशिष्ट संकल्पना परमाणु द्रव्यमान की थी। उनके अनुसार प्रत्येक तत्व का एक अभिलाक्षणिक परमाणु द्रव्यमान होता है। डाल्टन का सिद्धांत स्थिर अनुपात के नियम को इतनी भली-भाँति समझाने में समर्थ था कि वैज्ञानिक इससे प्रेरित होकर परमाणु द्रव्यमान को मापने की ओर अग्रसर हुए। चूँकि एक परमाणु के द्रव्यमान को ज्ञात करना अपेक्षाकृत कठिन कार्य था इसलिए रासायनिक संयोजन के नियमों के उपयोग एवं उत्पन्न यौगिकों के द्वारा सापेक्ष परमाणु द्रव्यमानों को ज्ञात किया गया।
हम यहाँ पर एक यौगिक, कार्बन मोनोक्साइड (CO) का उदाहरण लेते हैं, जो कार्बन एवं अॉक्सीजन द्वारा निर्मित होता है। प्रायोगिक तौर पर यह निरीक्षित किया गया कि 3 g कार्बन तथा 4 g अॉक्सीजन के संयोजन से कार्बन मोनोक्साइड निर्मित हुई है। दूसरे शब्दों में कहा जा सकता है कि कार्बन अपने 4/3 गुणा अधिक द्रव्यमान वाले अॉक्सीजन के साथ संयुक्त होती है। मान लीजिए, हम परमाणु द्रव्यमान की इकाई को एक कार्बन परमाणु द्रव्यमान के बराबर मानते हैं तो कार्बन परमाणु को 1.0 u तथा अॉक्सीजन परमाणु द्रव्यमान को 1.33 u निर्दिष्ट करेंगे। (प्रारंभ में परमाणु द्रव्यमान को amu द्वारा संक्षेप में लिखते थे, लेकिन आजकल IUPAC के नवीनतम अनुमोदन द्वारा इसको 'u' -यूनीफाइड द्रव्यमान द्वारा प्रदर्शित करते हैं।) लेकिन द्रव्यमानों की इकाई को यथासंभव पूर्णांक या लगभग पूर्णांक में व्यक्त करना अधिक सुविधाजनक होता है। आगे चलकर वैज्ञानिकों ने परमाणु द्रव्यमानों की भिन्न-भिन्न इकाइयों के बारे में विचार व्यक्त किए। वैज्ञानिक जब विभिन्न परमाणु द्रव्यमानों की इकाइयों के बारे में शोधरत थे तो उन्होंने प्रारंभ में प्रकृतिजन्य अॉक्सीजन परमाणु के द्रव्यमान के 1/16 भाग को इकाई के रूप में लिया। दो कारणों से इसे सुसंगत समझा गयाः
• अॉक्सीजन अनेक तत्वों के साथ अभिक्रिया करके यौगिक बनाता है।
• इस परमाणु द्रव्यमान इकाई द्वारा अधिकांश तत्वों के परमाणु द्रव्यमान पूर्णांक में प्राप्त होते हैं।
तथापि, 1961 में परमाणु द्रव्यमानों को ज्ञात करने के लिए परमाणु द्रव्यमान इकाई कार्बन–12 समस्थानिक (आइसोटोप) को मानक संदर्भ के रूप में सार्वभौमिक रूप से स्वीकार किया गया था। कार्बन-12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12 वें भाग को मानक परमाणु द्रव्यमान इकाई के रूप में लेते हैं। कार्बन-12 समस्थानिक के एक परमाणु द्रव्यमान के सापेक्ष सभी तत्वों के परमाणु द्रव्यमान प्राप्त किए गए।
कल्पना कीजिए कि एक फल विक्रेता बिना मानक भार के फल बेच रहा है। वह एक तरबूज लेकर कहता है कि "इसका द्रव्यमान 12 इकाई है" (12 तरबूजीय इकाई अथवा 12 फल द्रव्यमान इकाई )। वह तरबूज के 12 बराबर टुकड़े करता है तथा पाता है कि उसके द्वारा बेचे जा रहे प्रत्येक फल का द्रव्यमान तरबूज के एक टुकड़े के द्रव्यमान के सापेक्ष है। जैसा कि चित्र 3.4 में दिखाया गया है, अब वह फलों को सापेक्ष फल द्रव्यमान इकाई (fmu) में बेचता है।

चित्र 3-4: (a) तरबूज (इ)12 टुकड़े (b) तरबूज का 1/12 वाँ भाग (क) तरबूज के टुकड़ों का उप
योग करके वह फल विक्रेता फलों को कैसे तौल सकता है
3.2.3 परमाणु किस प्रकार अस्तित्व में रहते हैं?
अधिकांश तत्वों के परमाणु स्वतंत्र रूप से अस्तित्व में नहीं रह पाते। परमाणु अणु एवं आयन बनाते हैं। ये अणु अथवा आयन अत्यधिक संख्या में पुंजित होकर वह द्रव्य बनाते हैं, जिसे हम देख सकते हैं, अनुभव कर सकते हैं अथवा छू सकते हैं।
प्रश्न
1. परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
2. एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है?
3.3. अणु क्या है?
साधारणतया अणु एेसे दो या दो से अधिक परमाणुओं का समूह होता है जो आपस में रासायनिक बंध द्वारा जुड़े होते हंैं अथवा वे परस्पर आकर्षण बल के द्वारा कसकर जुड़े होते हैं। अणु को किसी तत्व अथवा यौगिक के उस सूक्ष्मतम कण के रूप में परिभाषित कर सकते हैं जो स्वतंत्र रूप से अस्तित्व में रह सकता है तथा जो उस यौगिक के सभी गुणधर्म को प्रदर्शित करता है। एक ही तत्व के परमाणु अथवा भिन्न-भिन्न तत्वों के परमाणु परस्पर संयोग करके अणु निर्मित करते हैं।
3.3.1 तत्वों के अणु
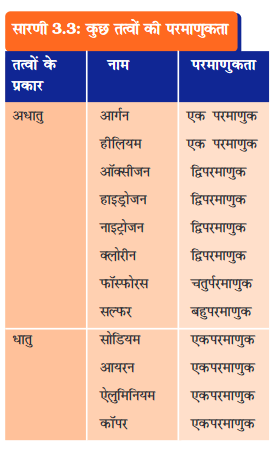
किसी तत्व के अणु एक ही प्रकार के परमाणुओं द्वारा संरचित होते हैं। आर्गन (Ar), हीलियम (He) इत्यादि जैसे अनेक तत्वों के अणु उसी तत्व के केवल एक परमाणु द्वारा निर्मित होते हैं। लेकिन अधिकांश अधातुओं में एेसा नहीं होता है। उदाहरणार्थ, अॉक्सीजन अणु दो अॉक्सीजन परमाणुओं से बनता है, इसलिए इसे द्वि-परमाणुक अणु, O2 कहते हैं। यदि सामान्यतः 2 के स्थान पर 3 अॉक्सीजन परमाणु परस्पर संयोग करते हैं तो हमें ओजोन, O3 प्राप्त होता है। किसी अणु की संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते हैं।
धातु अणुओं एवं कुछ अन्य तत्वों के अणुओं जैसे कि कार्बन के अणुओं की सरल संरचना नहीं होती है किंतु उनके अणुओं में असीमित परमाणु परस्पर बँधे होते हैं।
आइए, कुछ तत्वों की परमाणुकता का अवलोकन करें।
3.3.2 यौगिकों के अणु
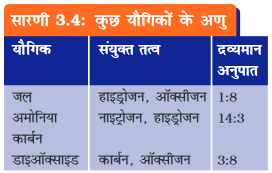
भिन्न-भिन्न तत्वों के परमाणु एक निश्चित अनुपात में परस्पर जुड़कर यौगिकों के अणु निर्मित करते हैं।
क्रियाकलाप______________3.2
• अणुओं में विद्यमान परमाणुओं के द्रव्यमान अनुपातों के लिए सारणी 3.4 एवं तत्वों के परमाणु द्रव्यमानों के लिए सारणी 3.2 देखिए। सारणी
3.4 में दिए गए यौगिकों के अणुओं में प्रयुक्त तत्वों के परमाणुओं की संख्या के अनुपातों को ज्ञात कीजिए।
• जल अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात निम्न प्रकार से प्राप्त किया जा सकता है ः
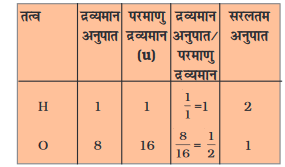
• इस प्रकार, जल अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात H:O = 2:1
3.3.3 आयन क्या होता है?
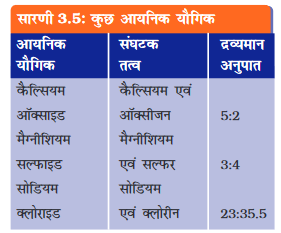
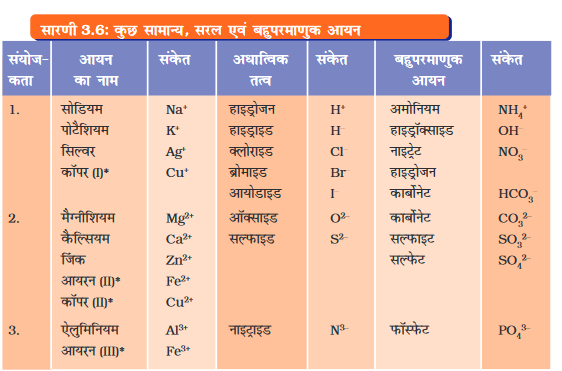
धातु एवं अधातु युक्त यौगिक आवेशित कणों से बने होते हैं। इन आवेशित कणों को आयन कहते हैं। आयन एक आवेशित परमाणु अथवा परमाणुओं का एक एेसा समूह होता है जिस पर नेट आवेश विद्यमान होता है। यह ऋण आवेश अथवा धन आवेश होता है। ऋण आवेशित आयन को ऋणायन (anion) तथा धन आवेशित आयन को धनायन (cation) कहते हैं। उदाहरण के लिए सोडियम क्लोराइड (NaCl) को लीजिए। इसमें धनात्मक सोडियम आयन (Na+) तथा ऋणात्मक क्लोराइड आयन (Cl–) संघटक कण के रूप में विद्यमान होते हैं। परमाणुओं के समूह जिन पर नेट आवेश विद्यमान हो उसे बहुपरमाणुक आयन कहते हैं (सारणी 3.6)। हम आयनों के निर्माण के बारे में अध्याय-4 में और अधिक जानकारी प्राप्त करेंगे।
3.4 रासायनिक सूत्र लिखना
किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है। भिन्न-भिन्न यौगिकों के रासायनिक सूत्र सरलतापूर्वक लिखे जा सकते हैं। इस अभ्यास के लिए हमें तत्वों के प्रतीकों एवं उनकी संयोजन क्षमताएँ ज्ञात होनी चाहिए।
किसी तत्व की संयोजन शक्ति (अथवा क्षमता) उस तत्व की संयोजकता कहलाती है। किसी एक तत्व के परमाणु दूसरे तत्व के परमाणुओं के साथ किस प्रकार से संयुक्त होकर एक रासायनिक यौगिक का निर्माण करते हैं? इसको ज्ञात करने के लिए संयोजकता का उपयोग करते हैं। किसी तत्व के परमाणु की संयोजकता को उसके हाथ अथवा भुजा के रूप में विचार किया जा सकता है।
*कुछ तत्व एक से अधिक संयोजकता दर्शाते हैं। संयोजकता को कोष्ठकों में रोमन संख्यांक द्वारा प्रदर्शित करते हैं।
मानव की दो भुजाएँ तथा अॉक्टोपस की आठ भुजाएँ होती हैं। अॉक्टोपस की एक भुजा मानव की केवल एक भुजा पकड़ सकती है। यदि एक अॉक्टोपस को कुछ मानवों को इस प्रकार से पकड़ना है कि उसकी आठ भुजाएँ मानवों की दोनों भुजाओं के साथ प्रयुक्त हो जाएँ तो आपके विचार में अॉक्टोपस कुल कितने मानवों को पकड़ सकता है? अब अॉक्टोपस को O तथा मानव को H से निरूपित कीजिए। क्या आप इस संयोजन के लिए सूत्र लिख सकते हैं? क्या आप OH4 को सूत्र के रूप में प्राप्त करेंगे? पादांक 4 अॉक्टोपस द्वारा पकड़े गए मानवों की संख्या को प्रदर्शित करता है।
सारणी 3.6 में कुछ सरल एवं बहुपरमाणुक आयनों की संयोजकताएँ दी गई हैं। संयोजकता के बारे में हम और अधिक जानकारी अगले अध्याय में प्राप्त करेंगे।
• आयन की संयोजकता अथवा आवेश संतुलित होना चाहिए।
• जब एक यौगिक किसी धातु एवं अधातु के संयोग से निर्मित होता है तो धातु के नाम अथवा उसके प्रतीक को रासायनिक सूत्र में पहले लिखते हैं। उदाहरणार्थः कैल्सियम अॉक्साइड (CaO), सोडियम क्लोराइड (NaCl), आयरन सल्फाइड (FeS), कॉपर अॉक्साइड (CuO) ... इत्यादि, जहाँ पर अॉक्सीजन, क्लोरीन, सल्फर अधातुएँ हैं तथा उन्हें दायीं तरफ लिखते हैं, जबकि कैल्सियम, सोडियम, आयरन एवं कॉपर धातुएँ हैं तथा उन्हें बायीं तरफ लिखते हैं।
• बहुपरमाणुक आयनों द्वारा निर्मित यौगिकों में आयनों की संख्या दर्शाने के लिए आयन को कोष्ठक में लिखकर आयनों की संख्या कोष्ठक के बाहर लिखते हैं उदाहरण Mg (OH)2 है। यदि बहुपरमाणुक आयन की संख्या 1 हो तो कोष्ठक की आवश्यकता नहीं होती। उदाहरण के लिए NaOH ।
3.4.1 सरल यौगिकों के सूत्र
दो भिन्न-भिन्न तत्वों से निर्मित सरलतम यौगिकों को द्विअंगी यौगिक कहते हैं। सारणी 3.6 में कुछ आयनों की संयोजकताएँ दी गई हैं। आप इनका उपयोग यौगिकों के सूत्रों को लिखने के लिए कर सकते हैं।
आण्विक यौगिकों के रासायनिक सूत्र लिखते समय हम पहले संघटक तत्वों के प्रतीक लिखकर उनकी संयोजकताएँ लिखते हैं जैसा कि निम्न उदाहरणों में दर्शाया गया है। तत्पश्चात् संयोजित परमाणुओं की संयोजकताओं को क्रॉस करके (cross over) अणु सूत्र लिखते हैं।
उदाहरण
1. हाइड्रोजन क्लोराइड का सूत्र
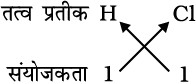
अतः हाइड्रोजन क्लोराइड का रासायनिक सूत्र HCl है।
2. हाइड्रोजन सल्फाइड के सूत्र
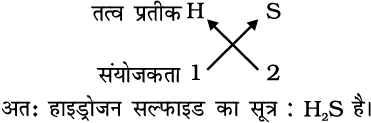
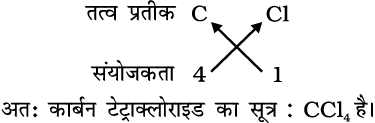
3. कार्बन टेट्राक्लोराइड का सूत्र
मैग्नीशियम क्लोराइड का सूत्र ज्ञात करने के लिए पहले हम धनायन का संकेत (Mg2+) लिखते हैं इसके पश्चात् ऋणायन क्लोराइड (Cl–) लिखते हैं। तत्पश्चात् इनके आवेशों को आड़ा-तिरछा (criss-cross) करके हम सूत्र प्राप्त करते हैं।
4. मैग्नीशियम क्लोराइड का सूत्र
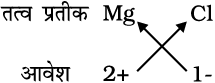
अतः सूत्र : MgCl2
इस प्रकार हम देखते हैं कि मैग्नीशियम क्लोराइड के अणु में दो क्लोराइड आयन (Cl–) प्रत्येक मैग्नीशियम आयन (Mg2+) के लिए होता है। इस प्रकार के आयनिक यौगिकों में धनात्मक तथा ऋणात्मक आवेशों का संतुलन होना चाहिए तथा संपूर्ण संरचना उदासीन होनी चाहिए। ध्यान देने योग्य बात यह है कि इस प्रकार के सूत्रों में आयनों के आवेशों को नहीं दर्शाया जाता है।
5. एेलुमिनियम अॉक्साइड का सूत्रः
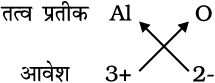
अतः सूत्र ः Al2O3
6. कैल्सियम अॉक्साइड का सूत्रः
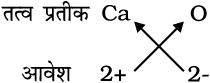
यहाँ पर दोनों तत्वों की संयोजकताएँ समान हैं। अतः इसका सूत्र Ca2O2 प्राप्त होगा, किंतु हम इस सूत्र को CaO के रूप में सरलीकृत करते हैं।
बहुपरमाणुक आयनों वाले यौगिक
सोडियम नाइट्रेट का सूत्र:
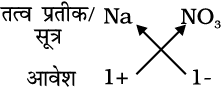
अतः सूत्र : NaNO3
कैल्सियम हाइड्रॉक्साइड का सूत्रः
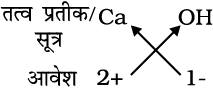
अतः सूत्र ः Ca(OH)2
ध्यान देने योग्य बात यह है कि कैल्सियम हाइड्रॉक्साइड का सूत्र Ca(OH)2 है न कि CaOH2। जब सूत्र में एक ही आयन के दो या दो से अधिक आयन होते हैं तो हम उनके लिए कोष्ठक का उपयोग करते हैं। यहाँ पर OH को कोष्ठक में रखकर पादांक 2 लगाते हैं जो यह निर्दिष्ट करता है कि एक कैल्सियम परमाणु के साथ दो हाइड्रोक्सील समूह जुड़े हैं। दूसरे शब्दों में, कैल्सियम हाइड्रॉक्साइड में अॉक्सीजन एवं हाइड्रोजन प्रत्येक के दो-दो परमाणु हैं।
सोडियम कार्बोनेट का सूत्रः
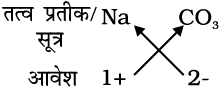
अतः सूत्र : Na2CO3
उपरोक्त उदाहरण में कोष्ठक के उपयोग की आवश्यकता नहीं है क्योंकि बहुपरमाणुक आयन कार्बोनेट का एक ही आयन विद्यमान है।
अमोनियम सल्फेट का सूत्र:
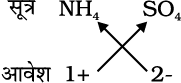
अतः सूत्र ः (NH4)2SO4
प्रश्न
1. निम्न के सूत्र लिखिएः
(i) सोडियम अॉक्साइड
(ii) एेलुमिनियम क्लोराइड
(iii) सोडियम सल्फाइड
(iv) मैग्नीशियम हाइड्रॉक्साइड
2. निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए ः
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
3. रासायनिक सूत्र का क्या तात्पर्य है?
4. निम्न में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) PO43– आयन?
3.5 आण्विक द्रव्यमान एवं मोल संकल्पना
3.5.1 आण्विक द्रव्यमान
अनुभाग 3-2-2 में हम परमाणु द्रव्यमान की अवधारणा की विवेचना कर चुके हैं। इस अवधारणा का विस्तार आण्विक द्रव्यमानों का परिकलन करने के लिए किया जा सकता है। किसी पदार्थ का आण्विक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमानों का योग होता है। इस प्रकार यह अणु का वह सापेक्ष द्रव्यमान है जिसे परमाणु द्रव्यमान इकाई (u) द्वारा व्यक्त किया जाता है।
उदाहरण 3-1 (a) जल (H2O) के सापेक्ष आण्विक द्रव्यमान का परिकलन कीजिए।
(b) नाइट्रिक अम्ल (HNO3) के आण्विक द्रव्यमान
= H का परमाणु द्रव्यमान + Ν का परमाणु द्रव्यमान + 3 × O का परमाणु द्रव्यमान
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
अॉक्सीजन का परमाणु द्रव्यमान = 16 u तथा
नाइट्रोजन का परमाणु द्रव्यमान = 14 u होता है।
अतः HNO3 का आण्विक द्रव्यमान
= 1 u + 14 u + 3 × 16 u = 63 u है।
3.5.2 सूत्र इकाई द्रव्यमान
कसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है। सूत्र द्रव्यमान का परिकलन उसी प्रकार से करते हैं जिस प्रकार से हमने आण्विक द्रव्यमान का परिकलन किया है। अंतर केवल इतना होता है कि यहाँ पर हम उस पदार्थ के लिए सूत्र इकाई का उपयोग करते हैं,जिसके संघटक आयन होते हैं। उदाहरणार्थः सोडियम क्लोराइड (इकाई सूत्र NaCl)। इसके इकाई सूत्र द्रव्यमान का परिकलन निम्न प्रकार से करते हैंः
1 × 23 u + 1 × 35.5 u = 58.5 u
उदाहरण 3.2 CaCl2 के सूत्र इकाई द्रव्यमान का परिकलन कीजिए
हल: कैल्सियम क्लोराइड का सूत्र इकाई द्रव्यमान CaCl2 है।
कैल्सियम (Ca) का परमाणु द्रव्यमान = 40 u
क्लोरीन (Cl) का परमाणु द्रव्यमान = 35.5 u
अतः CaCl2 का सूत्र इकाई द्रव्यमान
चित्र 3-5: मोल, आवोगाद्रो संख्या एवं द्रव्यमान के बीच संबंध
प्रश्न
1. निम्न यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिएः
H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH
2. निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिएः
ZnO, Na2O एवं K2CO3
दिया गया हैः
Zn का परमाणु द्रव्यमान = 65 u
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39 u,
C का परमाणु द्रव्यमान = 12 u एवं
O का परमाणु द्रव्यमान = 16 u है।
3.5.3 मोल संकल्पना
यहाँ हम हाइड्रोजन एवं ऑक्सीजन की किसी अभिक्रिया का उदाहरण लेते हैं, जिसमें जल निर्मित होता है।
2H2 + O2 → 2H2O
उपरोक्त अभिक्रिया यह निर्दिष्ट करती है कि
(i) हाइड्रोजन के दो अणु अॉक्सीजन के एक अणु के साथ अभिक्रिया करके जल के दो अणु निर्मित करते हैं, अथवा
(ii) हाइड्रोजन अणु के 4 u अॉक्सीजन अणु के 32 u के साथ संयोग करके 36 u जल अणु निर्मित करते हैं।
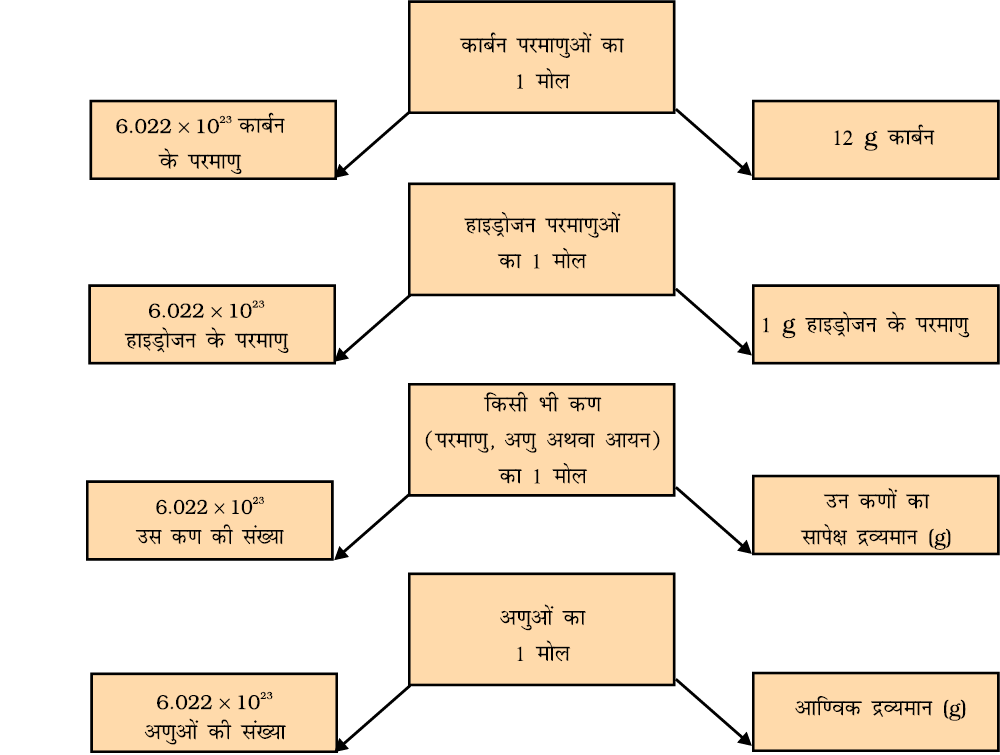
उपरोक्त समीकरण से यह निष्कर्ष निकाल सकते हैं कि हम किसी पदार्थ की मात्रा उसके द्रव्यमान से अथवा उसके परमाणुओं की संख्या से अभिलक्षित कर सकते हैं। परंतु एक रासायनिक अभिक्रिया समीकरण से अभिक्रिया में भाग लेने वाले परमाणुओं अथवा अणुओं की संख्याएँ सीधे प्राप्त हो जाती हैं। इसलिए पदार्थों की मात्राओं का ज्ञान, उनके द्रव्यमानों के आधार की अपेक्षा उनके अणुओं अथवा परमाणुओं की संख्या के आधार पर प्राप्त करना अधिक सुविधाजनक होता है। अतः एक नई इकाई ‘मोल’ (Mole) प्रस्तावित की गई। किसी स्पीशीज (परमाणु, अणु, आयन अथवा कण) के एक मोल में मात्राओं की वह संख्या है जो ग्राम में उसके परमाणु अथवा आण्विक द्रव्यमान के बराबर होती है।
किसी पदार्थ के एक मोल में कणों (परमाणु, अणु अथवा आयन) की संख्या निश्चित होती है जिसका मान 6.022 × 1023 होता है। यह मान प्रायोगिक विधि से प्राप्त किया गया है। इसको आवोगाद्रो स्थिरांक अथवा आवोगाद्रो संख्या कहते हैं जिसको N0 से निरूपित करते हैं। यह नाम इतालवी वैज्ञानिक एेमीडीओ आवोगाद्रो (Amedeo Avogadro) के सम्मान में रखा गया है।
1 मोल (किसी पदार्थ का) = 6.022 × 1023 संख्या में,
जैसे 1 दर्जन = 12
यद्यपि मोल एक संख्या से संबंधित है, परंतु दर्जन या ग्रुस की तुलना में इसका एक और लाभ है। वह यह है कि किसी विशिष्ट पदार्थ के एक मोल में द्रव्यमान निश्चित होता है।
किसी पदार्थ के एक मोल का द्रव्यमान उसके सापेक्ष परमाणु एवं अणु द्रव्यमान (ग्राम में) के बराबर होता है। किसी तत्व का परमाणु द्रव्यमान, उस तत्व के द्रव्यमान को परमाणु द्रव्यमान इकाई (u) में प्रदान करता है। किसी तत्व के परमाणुओं के एक मोल का द्रव्यमान जिसको मोलर द्रव्यमान कहते हैं, हमें उसी संख्यात्मक मान को लेना पड़ेगा परंतु इकाई को u से g में परिवर्तित करना होगा। परमाणुओं के मोलर द्रव्यमान को ग्राम परमाणु द्रव्यमान भी कहते हैं। उदाहरणार्थ- हाइड्रोजन परमाणु का दव्यमान =1u होता है। अतः हाइड्रोजन का ग्राम परमाणु द्रव्यमान = 1 g होगा।
1u हाइड्रोजन में केवल 1 हाइड्रोजन परमाणु होता है तथा 1 g हाइड्रोजन में उसके 1 मोल परमाणु होते हैं। अर्थात् उसमें 6.022 × 1023 हाइड्रोजन के परमाणु होंगे।
इसी प्रकार, 16 u अॉक्सीजन में केवल 1 अॉक्सीजन परमाणु होता है। अतः 16 g अॉक्सीजन में उसके
1 मोल परमाणु होंगे। अर्थात् उसमें 6.022 × 1023 अॉक्सीजन के परमाणु होंगे।
किसी अणु के ग्राम अणु द्रव्यमान अथवा मोलर द्रव्यमान को प्राप्त करने के लिए हम उसके संख्यात्मक मान जो उसके अणु द्रव्यमान के बराबर होता है, को उपरोक्त की तरह रखते हैं। परंतु हमें इकाई को u से g में परिवर्तित करना होगा।
उदाहरणार्थः जैसा कि हम पहले ही जल (H2O) के अणु द्रव्यमान का परिकलन कर चुके हैं जिसका मान 18 u होता है। यहाँ से हमें यह प्राप्त होता है कि
18 u जल में जल का केवल एक अणु होता है।
18 g जल में जल के 1 मोल अणु होते हैं। अर्थात् उसमें 6.022 × 1023 जल के अणु होते हैं।
रसायनज्ञों को अभिक्रियाओं को संपन्न कराने के लिए परमाणुओं एवं अणुओं की संख्याओं की आवश्यकता होती है, इसके लिए उन्हें द्रव्यमानों को ग्रामों में संख्याओं के साथ संबंधित करना पड़ता है। इसको निम्न प्रकार से करते हैं ः
1 मोल = 6.022 × 1023
= ग्राम सापेक्ष द्रव्यमान
सन् 1896 में विल्हेल्म ओस्टवाल्ड (Wilhelm Ostwald) ने मोल शब्द प्रस्तावित किया था जो एक लैटिन शब्द मोल्स (Moles) से व्युत्पन्न होता है जिसका अर्थ होता है ढेर (heap or pile)। किसी पदार्थ को परमाणुओं अथवा अणुओं के ढेर के रूप में विचार किया जा सकता है। सन् 1967 में मोल इकाई स्वीकार कर ली गई, जो परमाणुओं एवं अणुओं की बृहत् संख्या को निरूपित करने का सरलतम उपाय है।
उदाहरण 3-3
1-निम्नलिखित में मोलों की संख्या का परिकलन कीजिए
(i) 52 g हीलियम (द्रव्यमान से मोल प्राप्त कीजिए)
(ii)12.044 × 1023 हीलियम परमाणुओं की संख्या (कणों की संख्या से मोल प्राप्त कीजिए)
हलः मोलों की संख्या =n
दिया गया द्रव्यमान = m
मोलर द्रव्यमान = M
दिए गए कणों की संख्या = N
कणों की आवोगाद्रो संख्या = N0
(i) He का परमाणु
द्रव्यमान =4 u
He का मोलर
द्रव्यमान =4 u
अतः मोलों की संख्या

(ii) हम जानते हैं कि:
1 मोल = 6.022 × 1023
= मोलाें की सख्ंया

उदाहरण 3.4 निम्नलिखित द्रव्यमानों का परिकलन कीजिए:
(i) 0.5 मोल N2 गैस (अणु के मोल से द्रव्यमान)
(ii) 0.5 मोल N परमाणु (परमाणु के मोल से द्रव्यमान)
(iii) 3.011 × 10 23 N परमाणुओं की संख्या (संख्या से द्रव्यमान)
(iv) 6.022 × 10 23 N2 अणुओं की संख्या (संख्या से द्रव्यमान)
हलः
(i) द्रव्यमान = मोलर द्रव्यमान × मोलों की संख्या
m = M x n = 28 x 0.5 = 14g
(ii) द्रव्यमान = मोलर द्रव्यमान × मोलों की संख्या
⇒ m= M × n = 14 × 0.5 = 7g
(iii) मोलों की संख्या n

उदाहरण 3.5 निम्नलिखित प्रत्येक में कणों की संख्या का परिकलन कीजिए:
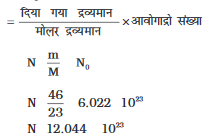
(i) 46 g सोडियम परमाणु (द्रव्यमान से संख्या)
(ii) 8 g ऑक्सीजन अणु (द्रव्यमान से अणुओं की संख्या)
(iii) 0.1 मोल कार्बन परमाणु (दिए गये मोल से संख्या)
हल: (i) परमाणुओं की सख्ंया
(ii)अणुओं की संख्या

ऑक्सीजन का परमाणु द्रव्यमान = 16 न
∴ ऑक्सीजन अणुओं का मोलर द्रव्यमान
= 16 × 2 = 32 g
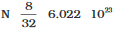
(iii) कणों (परमाणु) की संख्या = कण के मोलों की संख्या × आवोगाद्रो संख्या
N = n × N0 = 0.1 × 6.022 × 1023
= 6.022 × 1022
प्रश्न
1. यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 g है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा?
2. किस में अधिक परमाणु होंगे ः 100 g सोडियम अथवा 100 g लोहा (Fe)? (Na का परमाणु द्रव्यमान = 23 u, Feका परमाणु द्रव्यमान = 56 u)
आपने क्या सीखा
• किसी भी अभिक्रिया में, अभिकारकों और उत्पादों के द्रव्यमानों का योग अपरिवर्तनीय होता है। यह द्रव्यमान के संरक्षण का नियम कहलाता है।
• एक शुद्ध रासायनिक यौगिक में तत्व हमेशा द्रव्यमानों के निश्चित अनुपात में विद्यमान होते हैं, इसे निश्चित अनुपात का नियम कहते हैं।
• तत्व का सूक्ष्मतम कण परमाणु होता है, जो स्वतंत्र रूप से प्रायः नहीं रह सकता है तथा उसके सभी रासायनिक गुणधर्मों को प्रदर्शित करता है।
• अणु, किसी तत्व अथवा यौगिक का वह सूक्ष्मतम कण होता है जो सामान्य दशाओं में स्वतंत्र रह सकता है। यह पदार्थ के सभी गुणधर्मों को प्रदर्शित करता है।
• किसी यौगिक का रासायनिक सूत्र उसके सभी संघटक तत्वों तथा संयोग करने वाले सभी तत्वों के परमाणुओं की संख्या को दर्शाता है।
• परमाणुओं का वह पुंज जो आयन की तरह व्यवहार करता है, उसे बहुपरमाणुक आयन कहते हैं। उनके ऊपर एक निश्चित आवेश होता है।
• आण्विक यौगिकों के रासायनिक सूत्र प्रत्येक तत्व की संयोजकता द्वारा निर्धारित होते हैं।
• आयनिक यौगिकों में, प्रत्येक आयन के ऊपर आवेशों की संख्या द्वारा यौगिक के रासायनिक सूत्र ज्ञात करते हैं।
• वैज्ञानिक भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमानों की तुलना करने के लिए सापेक्ष परमाणु द्रव्यमान स्केल का उपयोग करते हैं। कार्बन-12 समस्थानिक (आइसोटोप) के परमाणु का सापेक्ष द्रव्यमान 12 निर्दिष्ट किया जाता है। अन्य सभी तत्वों के परमाणुओं का सापेक्ष द्रव्यमान कार्बन-12 परमाणु के द्रव्यमान के साथ तुलना करके प्राप्त करते हैं।
• 6.022 × 1023 आवोगाद्रो स्थिरांक है जो कि 12 g में विद्यमान कार्बन-12 के परमाणुओं की संख्या है।
• मोल पदार्थ की वह मात्रा है जिसमें कणों की संख्या (परमाणु, आयन, अणु या सूत्र इकाई इत्यादि) कार्बन-12 के ठीक 12 g में विद्यमान परमाणुओं के बराबर होती है।
• पदार्थ के एक मोल अणुओं का द्रव्यमान उसका मोलर द्रव्यमान कहलाता है।
अभ्यास
1. 0.24 g अॉक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096 g बोरॉन एवं 0.144 g अॉक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
2. 3.0 g कार्बन 8.00 g अॉक्सीजन में जलकर 11.00 g कार्बन डाइअॉक्साइड निर्मित करता है। जब 3.00 g कार्बन को 50.00 g अॉक्सीजन में जलाएँगे तो कितने ग्राम कार्बन डाइअॉक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित होगा?
3. बहुपरमाणुक आयन क्या होते हैं? उदारहरण दीजिए।
4. निम्नलिखित के रासायनिक सूत्र लिखिए ः
(a) मैग्नीशियम क्लोराइड
(b) कैल्सियम क्लोराइड
(c) कॉपर नाइट्रेट
(d) एेलुमिनियम क्लोराइड
(e) कैल्सियम कार्बोनेट
5. निम्नलिखित यौगिकों में विद्यमान तत्वों का नाम दीजिएः
(a) बुझा हुआ चूना
(b) हाइड्रोजन ब्रोमाइड
(c) बेकिंग पाउडर (खाने वाला सोडा)
(d) पोटैशियम सल्फेट
6. निम्नलिखित पदार्थों के मोलर द्रव्यमान का परिकलन कीजिएः
(a) एथाइन, C2H2
(b) सल्फर अणु, S8
(c) फॉस्फोरस अणु, P4 (फॉस्फोरस का परमाणु द्रव्यमान = 31)
(d) हाइड्रोक्लोरिक अम्ल, HCl
(e) नाइट्रिक अम्ल, HNO3
7. निम्न का द्रव्यमान क्या होगाः
(a) 1 मोल नाइट्रोजन परमाणु?
(b) 4 मोल एेलुमिनियम परमाणु (एेलुमिनियम का परमाणु द्रव्यमान = 27)?
(c) 10 मोल सोडियम सल्फाइट (Na2SO3)?
8. मोल में परिवर्तित कीजिएः
(a) 12 g अॉक्सीजन गैस
(b) 20 g जल
(c) 22 g कार्बन डाइअॉक्साइड
9. निम्न का द्रव्यमान क्या होगाः
(a) 0.2 मोल अॉक्सीजन परमाणु?
(b) 0.5 मोल जल अणु?
10. 16 g ठोस सल्फर में सल्फर (S8) के अणुओं की संख्या का परिकलन कीजिए।
11. 0.051 g एेलुमिनियम अॉक्साइड (Al2O3) में एेलुमिनियम आयन की संख्या का परिकलन कीजिए।
(संकेतः किसी आयन का द्रव्यमान उतना हीे होता है जितना कि उसी तत्व के परमाणु का द्रव्यमान होता है। एेलुमिनियम का परमाणु द्रव्यमान = 27 u है।)
समूह क्रियाकलाप
सूत्र लिखने के लिए एक खेल खेलिए
उदाहरण 1 : तत्वों के संकेतों एवं संयोजकताओं से युक्त अलग-अलग ताश के पत्ते बनाइए। प्रत्येक विद्यार्थी दो ताश के पत्तों को जिसमें से एक संकेत युक्त ताश के पत्ते को दाँए हाथ में तथा दूसरा संयोजकता युक्त ताश के पत्ते को बाँए हाथ में लीजिए। संकेतों को ध्यान में रखते हुए विद्यार्थी अपने ताश के पत्तों को अन्योन्य (criss-cross) (तिर्यक) करके यौगिक का सूत्र बनाएँगे।
उदाहरण 2 : सूत्र लिखने का एक सस्ता मॉडलः दवाओं के उस पैक को जिसमें से गोलियाँ निकाल ली गई हों, लीजिए। जैसा कि चित्र में दिखाया गया है, तत्व की संयोजकता के अनुसार उसे समूह में काट लीजिए। अब आप एक प्रकार के आयन को दूसरे प्रकार के आयनों में लगाकर सूत्र बना सकते हैं।
उदाहरणार्थ :

सोडियम सल्फेट के सूत्र के लिएः
2 सोडियम आयनों को एक सल्फेट आयन पर लगाइए। अतः सूत्र Na2SO4 होगा।
अपने आप कीजिए : सोडियम फॉस्फेट का सूत्र लिखिए।
