Table of Contents
अध्याय 4
परमाणु की संरचना
(Structure of the Atom)
अध्याय 3 में हम पढ़ चुके हैं कि पदार्थ, परमाणुओं और अणुओं से मिलकर बने हैं। विभिन्न प्रकार के पदार्थों का अस्तित्व उन परमाणुओं के कारण होता है, जिनसे वे बने हैं। अब प्रश्न उठता है कि ः (i) किसी एक तत्व का परमाणु दूसरे तत्व के परमाणुओं से भिन्न क्यों होता है? और (ii) क्या परमाणु वास्तव में अविभाज्य होते हैं, जैसा कि डाल्टन ने प्रतिपादित किया था या परमाणुओं के भीतर छोटे अन्य घटक भी विद्यमान होते हैं? इस अध्याय में हमें इस प्रश्न का उत्तर मिलेगा। हम अवपरमाणुक कणों और परमाणु के विभिन्न प्रकार के मॉडलों के बारे में पढ़ेंगे, जिनसे यह पता चलता है कि ये कण परमाणु के भीतर किस प्रकार व्यवस्थित होते हैं।
19वीं शताब्दी के अंत में वैज्ञानिकों के समक्ष सबसे बड़ी चुनौती थी, परमाणु की संरचना और उसके गुणों के बारे में पता लगाना। परमाणुओं की संरचना को अनेक प्रयोगों के आधार पर समझाया गया है।
परमाणुओं के अविभाज्य न होने के संकेतों में से एक संकेत स्थिर-विद्युत तथा विभिन्न पदार्थों द्वारा विद्युत चालन की परिस्थितियों के अध्ययन से मिला।
4.1 पदार्थों में आवेशित कण
पदार्थोंं में आवेशित कणों की प्रकृति को जानने के लिए, आइए हम निम्न क्रियाकलाप करें।
क्रियाकलाप 4.1
A. सूखे बालों पर कंघी कीजिए। क्या कंघी कागज़ के छोटे-छोटे टुकड़ाें को आकर्षित करती है?
B. काँच की एक छड़ को सिल्क के कपड़े पर रगड़िए और इस छड़ को हवा से भरे गुब्बारे के पास लाइए। क्या होता है, ध्यान से देखिए।
इन क्रियाकलापों से क्या हम यह निष्कर्ष निकाल सकते हैं कि दो वस्तुओं को आपस में रगड़ने से उनमें विद्युत आवेश आ जाता है? यह आवेश कहाँ से आता है? इसका उत्तर तब मिला जब यह पता चला कि परमाणु विभाज्य है और आवेशित कणों से बना है।
परमाणु में उपस्थित आवेशित कणों का पता लगाने में कई वैज्ञानिकों ने योगदान दिया।
19वीं शताब्दी तक यह जान लिया गया था कि परमाणु साधारण और अविभाज्य कण नहीं है, बल्कि इसमें कम से कम एक अवपरमाणुक कण इलेक्ट्रॉन विद्यमान होता है, जिसका पता जे. जे. टॉमसन ने लगाया था। इलेक्ट्रॉन के संबंध में जानकारी प्राप्त होने के पहले, ई. गोल्डस्टीन ने 1886 में एक नए विकिरण की खोज की, जिसे उन्होंने ‘केनाल रे’ का नाम दिया। ये किरणें धनावेशित विकिरण थीं, जिसके द्वारा अंततः दूसरे अवपरमाणुक कणों की खोज हुई। इन कणों का आवेश इलेक्ट्रॉन के आवेश के बराबर, किंतु विपरीत था। इनका द्रव्यमान इलेक्ट्रॉनों की अपेक्षा लगभग 2000 गुणा अधिक होता है। उनको प्रोटॉन नाम दिया गया। सामान्यतः इलेक्ट्रॅान को e– के द्वारा और प्रोटॉन को p+ के द्वारा दर्शाया जाता है। प्रोटॉन का द्रव्यमान 1 इकाई और इसका आवेश +1 लिया जाता है। इलेक्ट्रॅान का द्रव्यमान नगण्य और आवेश -1 माना जाता है।
एेसा माना गया कि परमाणु प्रोटॉन और इलेक्ट्रॉन से बने हैं, जो परस्पर आवेशों को संतुलित करते हैं। यह भी प्रतीत हुआ कि प्रोटॉन परमाणु के सबसे भीतरी भाग में होते हैं। इलेक्ट्रॅानों को आसानी से निकाला जा सकता है लेकिन प्रोटॅानों को नहीं। अब सबसे बड़ा प्रश्न यह था कि ये कण परमाणु की संरचना किस प्रकार करते हैं? हमें इस प्रश्न का उत्तर नीचे मिलेगा।
प्रश्न
1. केनाल किरणें क्या हैं?
2. यदि किसी परमाणु में एक इलेक्ट्रॅान और एक प्रोटॅान है, तो इसमें कोई आवेश होगा या नहीं?
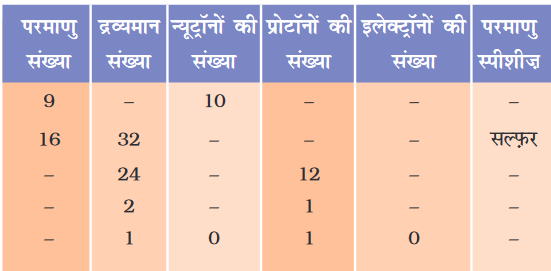
4.2 परमाणु की संरचना
हमने अध्याय 3 में डाल्टन के परमाणु सिद्धांत के बारे में पढ़ा है, जिसके अनुसार परमाणु अविभाज्य और अविनाशी था। लेकिन परमाणु के भीतर दो मूल कणों, इलेक्ट्रॉन और प्रोटॉन की खोज ने डाल्टन के परमाणु सिद्धांत की इस धारणा को गलत साबित कर दिया। अब यह जानना आवश्यक था कि इलेक्ट्रॅान और प्रोटॉन परमाणु के भीतर किस तरह व्यवस्थित हैं। इसको समझाने के लिए बहुत से वैज्ञानिकों ने भिन्न-भिन्न प्रकार के मॉडलों को प्रस्तुत किया।
जे. जे. टॉमसन पहले वैज्ञानिक थे जिन्होंने परमाणुओं की संरचना से संबंधित पहला मॉडल प्रस्तुत किया।
4.2.1 टॉमसन का परमाणु मॅाडल
टॉमसन ने परमाणुओं की संरचना से संबंधित एक मॉडल प्रस्तुत किया, जो क्रिसमस केक की तरह था। इनके अनुसार परमाणु एक धनावेशित गोला था, जिसमें इलेक्ट्रॉन क्रिसमस केक में लगे सूखे मेवों की तरह थे। तरबूज का उदाहरण भी ले सकते हैं, जिसके अनुसार परमाणु में धन आवेश तरबूज के खाने वाले लाल भाग की तरह बिखरा है, जबकि इलेक्ट्रॅान
धनावेशित गोले में तरबूज के बीज की भांति धँसे हैं (चित्र 4.1)।
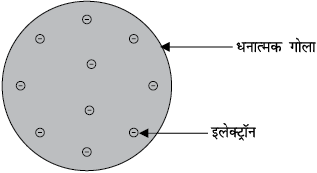
चित्र 4.1: टॉमसन का परमाणु मॉडल
ब्रिटिश भौतिकशास्त्री, जे. जे. टॉमसन (1856-1940), का जन्म 18 दिसंबर, 1856 में मैनचेस्टर के कीचम हिल क्षेत्र में हुआ था। इलेक्ट्रॉन की खोज के कारण 1906 में उनको भौतिकशास्त्र में नोबेल पुरस्कार मिला। 35 वर्ष तक वे कैम्ब्रिज में कैवेन्डिश प्रयोगशाला के निदेशक थे और उनके शोध के सात सहयोगियों को भी आगे चलकर नोबेल पुरस्कार मिला।

टॉमसन ने प्रस्तावित किया किः
(i) परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॅान उसमें धँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
यद्यपि टॉमसन के मॉडल से परमाणु के उदासीन होेने की व्याख्या हो गई किंतु दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझाया नहीं जा सका, जैसा कि हम आगे देखेंगे।
4.2.2 रदरफ़ोर्ड का परमाणु मॉडल
अरनेस्ट रदरफ़ोर्ड यह जानने के इच्छुक थे कि इलेक्ट्रॅान परमाणु के भीतर कैसे व्यवस्थित हैं। उन्होंने एक प्रयोग किया। इस प्रयोग में, तेज़ गति से चल रहे अल्फ़ा कणों को सोने की पन्नी पर टकराया गया।
• इन्होंने सोने की पन्नी इसलिए चुनी क्योंकि वे बहुत पतली परत चाहते थे। सोने की यह पन्नी 1000 परमाणुओं के बराबर मोटी थी।
• अल्फ़ा कण द्विआवेशित हिलीयम कण होते हैं अतः ये धनावेशित होते हैं। चूँकि इनका द्रव्यमान 4 u होता है इसलिए तीव्र गति से चल रहे इन अल्फ़ा कणों में पर्याप्त ऊर्जा होती है।
• यह अनुमान था कि अल्फ़ा कण सोने के परमाणुओं में विद्यमान अवपरमाणुक कणों के द्वारा विक्षेपित होंगे। चूँकि अल्फ़ा कण प्रोटॉन से बहुत अधिक भारी थे, इसलिए उन्होंने इनके अधिक विक्षेपण की आशा नहीं की थी।
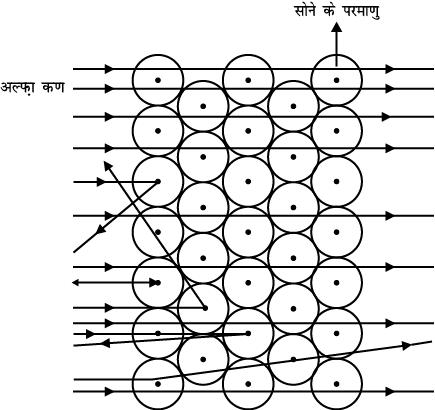
चित्र 4.2: सोने की परत द्वारा अल्फ़ा कणों का प्रकीर्णन
लेकिन अल्फ़ा कण-प्रकीर्णन प्रयोग ने आशा के बिल्कुल विपरीत परिणाम दिया (चित्र 4.2)। इससे निम्नलिखित परिणाम मिले -
(i) तेज़ गति से चल रहे अधिकतर अल्फ़ा कण सोने की पन्नी से सीधे निकल गए।
(ii) कुछ अल्फ़ा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए।
(iii) आश्चर्यजनक रूप से प्रत्येक 12000 कणों में से एक कण वापस आ गया।
रदरर्फ़ोड के अनुसार, ‘‘यह परिणाम उसी प्रकार अविश्वसनीय था, जैसे अगर आप एक 15 इंच के तोप के गोले को टिशू पेपर के टुकड़े पर मारते हैं और वह लौटकर आपको ही चोट पहुँचाता है।’’
ई. रदरफ़ोर्ड (1871-1937) का जन्म 30 अगस्त, 1871 में स्प्रिंग ग्रोव में हुआ था। उनको नाभिकीय भौतिकी का जनक माना जाता था। रेडियोधर्मिता पर अपने योगदान और सोने की पन्नी के द्वारा परमाणु के नाभिक की खोज के लिए वे बहुत प्रसिद्ध हुए। 1908 में उनको नोबेल पुरस्कार मिला।

इस प्रयोग के निष्कर्ष को समझने के लिए खुले मैदान में एक क्रियाकलाप करते हैं। मान लें कि एक बच्चा अपनी आँखों को बंद किए हुए एक दीवार के सामने खड़ा है। उसे दीवार पर कुछ दूरी से पत्थर फेंकने को कहें। प्रत्येक पत्थर के दीवार से टकराने के साथ ही वह एक आवाज़ सुनेगा। अगर वह इसे दस बार दोहराएगा तो वह दस बार आवाज़ सुनेगा। लेकिन जब आँख बंद किया हुआ बच्चा तार से घिरी हुई चारदिवारी पर पत्थर फेंकेगा तो अधिकतर पत्थर उस घेरे पर नहीं टकराएँगे और कोई आवाज़ सुनाई नहीं पड़ेगी। क्योंकि घेरे के बीच में बहुत सारे खाली स्थान हैं, जिनके बीच से पत्थर निकल जाता है।
इसी तर्क के अनुसार, अल्फ़ा कण-प्रकीर्णन प्रयोग के आधार पर रदरफ़ोर्ड ने निम्न परिणाम निकाले-
(i) परमाणु के भीतर का अधिकतर भाग खाली है क्योंकि अधिकतर अल्फ़ा कण बिना विक्षेपित हुए सोने की पन्नी से बाहर निकल जाते हैं।
(ii) बहुत कम कण अपने मार्ग से विक्षेपित होते हैं जिससे यह ज्ञात होता है कि परमाणु में
धनावेशित भाग बहुत कम है।
(iii) बहुत कम अल्फ़ा कण 180° पर विक्षेपित हुए थे, जिससे यह संकेत मिलता है कि सोने के परमाणु का पूर्ण धनावेशित भाग और द्रव्यमान, परमाणु के भीतर बहुत कम आयतन में सीमित है।
प्राप्त आँकड़ों के आधार पर उन्होंने यह निष्कर्ष निकाला कि नाभिक की त्रिज्या परमाणु की त्रिज्या से 105 गुणा छोटी है।
अपने प्रयोगों के आधार पर रदरफ़ोर्ड ने परमाणु का नाभिकीय-मॉडल प्रस्तुत किया, जिसके निम्नलिखित लक्षण थेः
(i) परमाणु का केंद्र धनावेशित होता है जिसे नाभिक कहा जाता है। एक परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
(ii) इलेक्ट्रॉन नाभिक के चारों ओर वर्तुलाकार मार्ग में चक्कर लगाते हैं।
(iii) नाभिक का आकार परमाणु के आकार की तुलना में काफ़ी कम होता है।
रदरफ़ोर्ड के परमाणु मॉडल की कमियाँ
वर्तुलाकार मार्ग में चक्रण करते हुए इलेक्ट्रॉन का स्थायी हो पाना संभावित नहीं है। कोई भी आवेशित कण गोलाकार कक्ष में त्वरित होगा। त्वरण के दौरान आवेशित कणों से ऊर्जा का विकिरण होगा। इस प्रकार स्थायी कक्ष में घूमता हुआ इलेक्ट्रॅान अपनी ऊर्जा विकिरित करेगा और नाभिक से टकरा जाएगा। अगर एेसा होता, तो परमाणु अस्थिर होता जबकि हम जानते हैं कि परमाणु स्थायी होते हैं।
4.2.3 बोर का परमाण्विक मॉडल
रदरफ़ोर्ड के मॉडल पर उठी आपत्तियों को दूर करने के लिए, नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत कीं-
(i) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॅान की विविक्त कक्षा कहते हैं।
(ii) जब इलेक्ट्रॅान इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता है।

नील्स बोर (1885-1962) का जन्म 7 अक्टूबर, 1885 में कोपेनहेगन में हुआ था। 1916 में कोपेनहेगन विश्वविद्यालय में उनको भौतिकशास्त्र का प्रोफ़ेसर नियुक्त किया गया। 1922 में उनको परमाणु की संरचना पर अपने योगदान के लिए नोबेल पुरस्कार मिला। प्रोफ़ेसर बोर के विविध लेखों पर आधारित तीन पुस्तकें प्रकाशित हुईं-
(i) दि थ्योरी अॉफ़ स्पेक्ट्रा एंड एटॉमिक कॉन्स्टीट्यूशन
(ii) एटॉमिक थ्योरी, और
(iii) दि डिस्क्रिप्शन अॉफ़ नेचर।
इन कक्षाओं (या कोशों) को ऊर्जा-स्तर कहते हैं। चित्र 4.3 में एक परमाणु के ऊर्जा स्तरों को दिखाया गया है।

चित्र 4.3: किसी परमाणु में कुछ ऊर्जा स्तर
ये कक्षाएँ (या कोश) K,L,M,N…….या संख्याओं, 1, 2, 3, 4........ के द्वारा दिखाई जाती हैं।
प्रश्न
1. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
2. रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन सा अवपरमाणुक कण विद्यमान है?
3. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
4. क्या अल्फ़ा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
4.2.4 न्यूट्रॉन
1932 में जे. चैडविक ने एक और अवपरमाणुक कण को खोज निकाला, जो अनावेशित और द्रव्यमान में प्रोटॉन के बराबर था। अंततः इसका नाम न्यूट्रॉन पड़ा। हाइड्रोजन को छोड़कर ये सभी परमाणुओं के नाभिक में होते हैं। समान्यतः, न्यूट्रॉन को ‘n' से दर्शाया जाता है। परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटॉन और न्यूटॅΡान के द्रव्यमान के योग के द्वारा प्रकट किया जाता है।
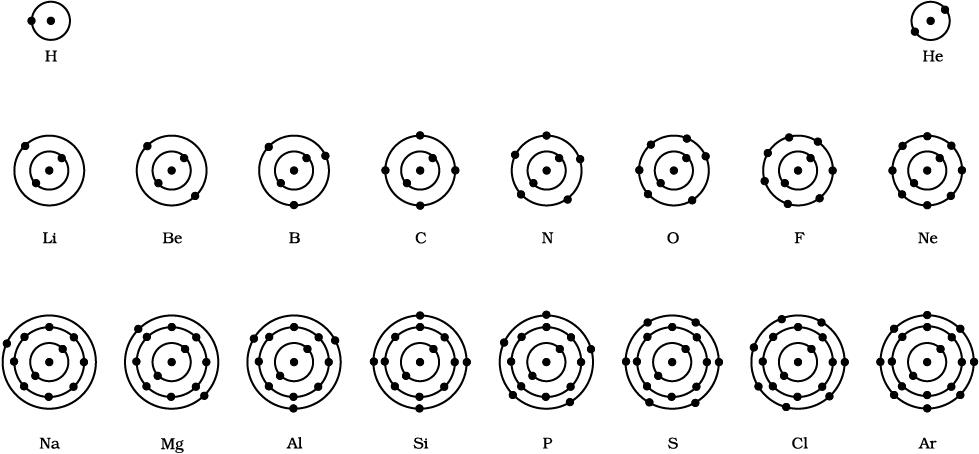
चित्र 4.4: पहले अठारह तत्वों की परमाण्विक संरचना का व्यवस्था चित्र
प्रश्न
1. परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
2. हीलियम परमाणु का परमाणु द्रव्यमान 4 u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
4.3 विभिन्न कक्षाओं में इलेक्ट्रॅान कैसे वितरित होते हैं?
परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने कुछ नियम प्रस्तुत किए जिसे बोर–बरी स्कीम के नाम से जाना जाता है।
(i) इन नियमों के अनुसार किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 2n2 से दर्शाया जाता है, जहाँ ‘n’ कक्षा की संख्या या ऊर्जा स्तर है। इसलिए इलेक्ट्रॉनों की
अधिकतम संख्या पहले कक्ष या K कोश में होगी = 2 × 12 = 2, दूसरे कक्ष या L कोश में होगी = 2 × 22 = 8, तीसरे कक्ष या M कोश में होगी = 2 × 32 = 18, चौथे कक्ष या N कोश में होगी = 2 × 42 = 32।
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते। इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
पहले 18 तत्वों की परमाणु संरचना के व्यवस्था चित्र को चित्र 4.4 में दिखाया गया है।
क्रियाकलाप 4.2
• स्थायी परमाण्विक मॉडल तैयार करें तथा पहले अठारह तत्वों के इलेक्ट्रॉनिक विन्यास को दिखाएँ।
• पहले अठारह तत्वों के परमाणुओं की संयोजन सारणी 4.1 में दी गई है।
श्न
1. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रान-वितरण लिखिए।
2. अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
4.4 संयोजकता
हम पढ़ चुके हैं कि परमाणुओं की विभिन्न कक्षाओं (या कोशों) में इलेक्ट्रॉन किस प्रकार व्यवस्थित होते हैं। किसी परमाणु की सबसे बाहरी कक्षा में उपस्थित इलेक्ट्रानों को संयोजकता-इलेक्ट्रॅान कहा जाता है।
बोर-बरी स्कीम से हम जानते हैं कि किसी परमाणु का बाह्यतम कक्ष अधिकतम 8 इलेक्ट्रॉन रख सकता है। यह देखा गया था कि जिन तत्वों के परमाणुओं के बाह्यतम कक्ष पूर्ण रूप से इलेक्ट्रॉनों (8) से भरे होते हैं वे रासायनिक रूप से सक्रिय नहीं होते हैं। दूसरे शब्दों में, एेसे तत्वों की संयोजन-शक्ति या संयोजकता शून्य होती है। इन अक्रिय तत्वों में से हीलियम-परमाणु के बाह्यतम कक्ष में दो (2) इलेक्ट्रॉन होते हैं और अन्य में आठ (8) होते है। सक्रिय तत्वों के परमाणुओं की संयोजन-शक्ति अर्थात् अपने समान या अन्य किसी तत्व के परमाणुओं से मिलकर अणु बनाने की प्रवृत्ति, अपने बाह्यतम कक्ष को पूर्ण रूप से भरने का प्रयास माना जाता है। आठ इलेक्ट्रॉन वाले सबसे बाहरी (बाह्यतम) कक्ष को अष्टक माना जाता है। परमाणु अपने अंतिम कक्ष में अष्टक प्राप्त करने के लिए क्रिया करते हैं। यह आपस में इलेक्ट्रॅानों की साझेदारी करने, उनको ग्रहण करने या उनका त्याग करने से होता है। परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वही उस तत्व की संयोजकता-शक्ति अर्थात् संयोजकता होती है, जिसकी चर्चा पिछले अध्याय में की गई है। उदाहरण के लिए, हाइड्रोजन, लीथियम या सोडियम प्रत्येक के परमाणुओं के बाह्यतम कक्ष में एक-एक इलेक्ट्रॅान होता है। अतः यह एक इलेक्ट्रॅान का त्याग कर सकते हैं। इसलिए उनकी संयोजकता एक (1) कही जाती है। क्या आप बता सकते हैं कि मैग्नीशियम और एल्युमिनियम की संयोजकता क्या है? यह क्रमशः 2 और 3 है क्योंकि मैग्नीशियम के बाह्यतम कक्ष में 2 तथा एलुमिनियम के 3 इलेक्ट्रॉन होते हैं।
यदि किसी परमाणु के बाह्यतम कक्ष में इलेक्ट्रॅानों की संख्या उसकी क्षमता के अनुसार लगभग पूरी है तो संयोजकता एक अन्य प्रकार से प्राप्त की जाती है। उदाहरण के लिए, फ़्लोरीन परमाणु के बाह्यतम कक्ष में सात (7) इलेक्ट्रॅान होते हैं और इसकी संयोजकता सात (7) हो सकती है किंतु बाह्यतम कक्ष में अष्टक बनाने के लिए फ़्लोरीन के लिए 7 इलेक्ट्रॉनों का त्याग करने की अपेक्षा एक (1) इलेक्ट्रॅान प्राप्त करना अधिक आसान है। अतः इसकी संयोजकता, अष्टक (8) में से सात (7) घटाकर प्राप्त की जाती है और इस तरह फ़्लोरीन की संयोजकता एक (1) है। अॉक्सीजन की संयोजकता का परिकलन भी इसी प्रकार किया जा सकता है। इस परिकलन से अॉक्सीजन की संयोजकता कितनी होगी?
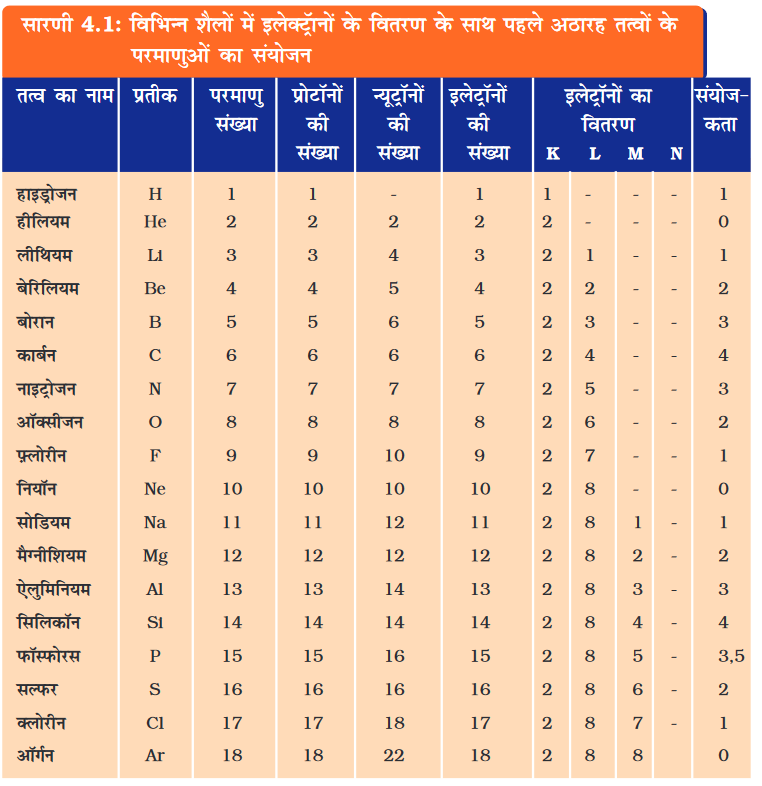
अतः प्रत्येक तत्व के परमाणु की एक निश्चित संयोजन-शक्ति होती है, जिसे संयोजकता कहते हैं। पहले 18 तत्वों की संयोजकता सारणी 4.1 के अंतिम स्तंभ में दी गई है।
श्न
1. क्लोरीन, सल्फ़र और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
4.5 परमाणु संख्या तथा द्रव्यमान संख्या
4.5.1 परमाणु संख्या
हम जानते हैं कि परमाणु के नाभिक में प्रोटॉन विद्यमान होते हैं। एक परमाणु में उपस्थित प्रोटॉनों की संख्या उसकी परमाणु संख्या को बताती है। इसे Z के द्वारा दर्शाया जाता है। किसी तत्व के सभी अणुओं की परमाणु संख्या (Z) समान होती है। वास्तव में तत्वों को उनके परमाणु में विद्यमान प्रोटॉनों की संख्या से परिभाषित किया जाता है। हाइड्रोजन के लिए Z = 1, क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है। इसी प्रकार, कार्बन के लिए Z = 6. इस प्रकार, एक परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु संख्या कहते हैं।
4.5.2 द्रव्यमान संख्या
एक परमाणु के अवपरमाणुक कणों के अध्ययन के बाद हम इस निष्कर्ष पर पहुँच सकते हैं कि व्यावहारिक रूप में परमाणु का द्रव्यमान उसमें विद्यमान प्रोटॉनों और न्यूट्रॅानों के द्रव्यमान के कारण होता है। ये परमाणु के नाभिक में विद्यमान होते हैं इसलिए इन्हें न्यूक्लियॉन भी कहते हैं। परमाणु का लगभग संपूर्ण द्रव्यमान उसके नाभिक में होता है। उदाहरण के लिए, कार्बन का द्रव्यमान 12u है क्योंकि इसमें 6 प्रोट्रॅान और 6 न्यूटॅΡान होते हैं, 6 u + 6 u = 12। इसी प्रकार, एेलुमिनियम का द्रव्यमान 27 u है (13 प्रोटॅान + 14 न्यूट्रॉन)। एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॅानों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है।
किसी परमाणु को दर्शाने के लिए परमाणुक संख्या, द्रव्यमान-संख्या और तत्व का प्रतीक इस प्रकार से लिखा जाता है।
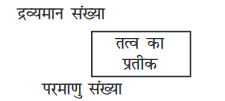
उदाहरण के लिए, नाइट्रोजन को इस प्रकार लिखा जाता है, 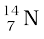 ।
।
श्न
1. यदि किसी परमाणु में इलेक्ट्रॅानों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब, (a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
2. सारणी 4.1 की सहायता से अॉक्सीजन और सल्फ़र-परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
4.6 समस्थानिक
प्रकृति में, कुछ तत्वों के परमाणुओं की पहचान की गई है, जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या अलग-अलग होती है। उदाहरण के लिए, हाइड्रोजन परमाणु को लें। इसके तीन परमाण्विक स्पीशीज़ होते हैंः प्रोटियम  H, ड्यूटीरियम (
H, ड्यूटीरियम (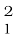 H या D), ट्राइटियम (
H या D), ट्राइटियम (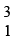 H या T), प्रत्येक की परमाणु संख्या समान है। लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है। इस तरह के अन्य उदाहरण हैंः (1) कार्बन,
H या T), प्रत्येक की परमाणु संख्या समान है। लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है। इस तरह के अन्य उदाहरण हैंः (1) कार्बन, 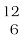 C और
C और 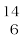 C; (2) क्लोरीन,
C; (2) क्लोरीन, 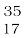 Cl और
Cl और 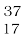 Cl।
Cl।
इन उदाहरणों के आधार पर समस्थानिकों को इस प्रकार परिभाषित किया जा सकता है, ‘‘एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है।’’ इस तरह हम कह सकते हैं कि हाइड्रोजन परमाणु के तीन समस्थानिक प्रोटियम, ड्यूटीरियम और ट्राइटियम होते हैं।
बहुत से तत्वों में समस्थानिक का मिश्रण भी होता है। किसी तत्व का प्रत्येक समस्थानिक शुद्ध पदार्थ होता है। समस्थानिकों के रासायनिक गुण समान लेकिन भौतिक गुण अलग-अलग होते हैं।
प्रकृति में क्लोरीन दो समस्थानिक रूपों में पाया जाता है, जिसका द्रव्यमान 35u और 37u, जो 3ः 1 के अनुपात में होते हैं। अब यह प्रश्न उठता है कि किस द्रव्यमान को क्लोरीन परमाणु का द्रव्यमान मानना चाहिए? आइए इसका पता लगाएँ।
क्लोरीन का औसत परमाणु द्रव्यमान होगा,
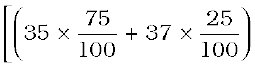

किसी प्राकृतिक तत्व के एक परमाणु का द्रव्यमान उस तत्व में विद्यमान सभी प्राकृतिक रूप से पाए जाने वाले परमाणुओं के औसत द्रव्यमान के बराबर होता है। अगर किसी एक तत्व का कोई समस्थानिक नहीं है तो परमाणु का द्रव्यमान उसमें उपस्थित प्रोटॅान और न्यूट्रॅानों के द्रव्यमान का योग होता है लेकिन अगर एक तत्व समस्थानिक रूप में उपस्थित होता है तो हमें प्रत्येक समस्थानिक रूप का प्रतिशत जानना होगा और औसत द्रव्यमान की गणना करनी होगी।
इसका मतलब यह नहीं है कि क्लोरीन के परमाणु का द्रव्यमान एक भिन्नात्मक संख्या 35.5u है। इसका तात्पर्य यह हुआ कि अगर आप क्लोरीन की कुछ मात्रा लेते हैं तो इसमें क्लोरीन के समस्थनिक होंगे और औसत द्रव्यमान 35.5 u होगा।
समस्थानिकों के अनुप्रयोग
कुछ समस्थानिकों के विशेष गुण होते हैं, जिनका उपयोग हम विभिन्न क्षेत्रों में करते हैं। उनमें से कुछ निम्नलिखित हैंः
(i) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी (atomic reactor) में ईंधन के रूप में होता है।
(ii) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
(iii) घेंघा रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
4.6.1 समभारिक
दो तत्वों- कैल्शियम, परमाणु संख्या 20 और आर्गन परमाणु संख्या 18 के बारे में विचार कीजिए। परमाणुओं में प्रोटॉनों की संख्या भिन्न-भिन्न है, दोनों तत्वों की द्रव्यमान संख्या 40 है। यानी, तत्वों के इस जोड़े के अणुओं में कुल न्यूक्लियॅानों की संख्या समान है। अलग-अलग परमाणु संख्या वाले तत्वों को जिनकी द्रव्यमान संख्या समान होती है, समभारिक कहा जाता है।
श्न
1. चिह्न H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
2. समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॅानिक विन्यास लिखिए।
आपने क्या सीखा
• इलेक्ट्रॉन और प्रोटॅान की खोज क्रमशः जे. जे. टॉमसन और ई. गोल्डस्टीन ने की।
• जे. जे. टॉमसन ने यह प्रस्तावित किया था कि इलेक्ट्रॅान धनात्मक गोले में धँसे होते हैं।
• रदरफ़ोर्ड के अल्फ़ा कणों के प्रकीर्णन प्रयोग ने परमाणु केंद्रक की खोज की।
• रदरफ़ोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर बहुत छोटा केंद्रक होता है और इलेक्ट्रॅान केंद्रक के चारों ओर घूमते हैं। परमाणु की स्थिरता की इस मॉडल से व्याख्या नहीं की जा सकी है।
• नील बोर द्वारा दिया गया परमाणु का मॉडल अधिक सफ्ηल था। उन्होंने प्रस्तावित किया कि इलेक्ट्रॅान केंद्रक के चारों ओर निश्चित ऊर्जा के साथ अलग-अलग कक्षाओं में वितरित हैं। अगर परमाणु की सबसे बाहरी कक्षाएँ भर जाती हैं, तो परमाणु स्थिर होगा और कम क्रियाशील होगा।
• जे. चैडविक ने परमाणु के अंदर न्यूट्रॅान की उपस्थिति को खोजा। इस प्रकार परमाणु के तीन अवपरमाणुक कण हैं- इलेक्ट्रॅान, प्रोटॉन और न्यूट्रॉन। इलेक्ट्रॅान ऋण आवेशित होते हैं, प्रोटॅान धनावेशित होते हैं और न्यूट्रॅान अनावेशित होते हैं। इलेक्ट्रॅान का द्रव्यमान हाइड्रोजन परमाणु के द्रव्यमान के 1/2000 गुणा होता है। प्रोटॉन और न्यूूट्रॉन में प्रत्येक का द्रव्यमान एक इकाई लिया जाता है।
• परमाणु के कक्षों को K, L, M, N…… नाम दिया गया है।
• संयोजकता परमाणु की संयोजन शक्ति है।
• एक तत्व की परमाणु संख्या केंद्रक में विद्यमान प्रोटॉनों की संख्या के बराबर होती है।
• परमाणु की द्रव्यमान संख्या केंद्रक में विद्यमान न्यूक्लियानों की संख्या के बराबर होती है।
• समस्थानिक एक ही तत्व के परमाणु हैं जिनकी द्रव्यमान संख्या भिन्न-भिन्न होती है।
• समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है।
• तत्वों को उनके प्रोटॉनों की संख्या के आधार पर परिभाषित किया जा सकता है।
अभ्यास
1. इलेक्ट्रॅान, प्रोटॉन और न्यूट्रॅान के गुणों की तुलना कीजिए।
2. जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
3. रदरफ़ोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
4. बोर के परमाणु मॉडल की व्याख्या कीजिए।
5. इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
6. पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
7. सिलिकॉन और अॉक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
8. उदाहरण के साथ व्याख्या कीजिए- परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक समस्थानिकों के कोई दो उपयोग लिखिए।
9. Na+ के पूरी तरह से भरे हुए K व L कोश होते हैं- व्याख्या कीजिए।
10. अगर ब्रोमीन परमाणु दो समस्थानिकाें [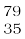 Br (49.7%) तथा
Br (49.7%) तथा 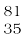 Br (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
Br (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
11. एक तत्व X का परमाणु द्रव्यमान 16.2 u है तो इसके किसी एक नमूनें में समस्थानिक 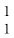 X और
X और 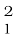 X का प्रतिशत क्या होगा?
X का प्रतिशत क्या होगा?
12. यदि तत्व का Z = 3 हो तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
13. दो परमाणु स्पीशीज़ के केंद्रकों का संघटन नीचे दिया गया है

X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज़ में क्या संबंध है?
14. निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें।
(a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॅान और प्रोटॅान मिलकर न्यूट्रॅान का निर्माण करते हैं इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॅान का द्रव्यमान प्रोटॅान से लगभग  गुणा होता है।
गुणा होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
प्रश्न संख्या 15, 16 और 17 में सही के सामने () का चिह्न और गलत के सामने (×) का चिह्न लगाइए।
15. रदरफ़ोर्ड का अल्फ़ा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था-
(a) परमाणु केंद्रक (b) इलेक्ट्रॅान
(c) प्रोटॅान (d) न्यूट्रॅान
16. एक तत्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण (b) भिन्न रासायनिक गुण
(c) न्यूट्रॅानों की अलग-अलग संख्या (d) भिन्न परमाणु संख्या
17. Cl– आयन में संयोजकता-इलेक्ट्रॉनों की संख्या है-
(a) 16 (b) 8 (c) 17 (d) 18
18. सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2,8 (b) 8,2,1 (c) 2,1,8 (d) 2,8,1
19. निम्नलिखित सारणी को पूरा कीजिए-