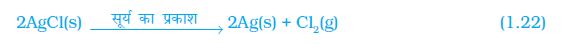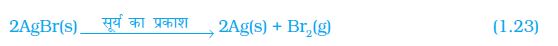Table of Contents
अध्याय 1
रासायनिक अभिक्रियाएँ एवं समीकरण
अपने दैनिक जीवन की निम्नलिखित परिस्थितियों पर ध्यान दीजिए और विचार कीजिए कि क्या होता है जब
गर्मियों में कमरे के ताप पर दूध को खुला छोड़ दिया जाता है।
लोहे का तवा/तसला/कील को आर्द्र वायुमंडल में खुला छोड़ दिया जाता है।
अंगूर का किण्वन हो जाता है।
भोजन पकाया जाता है।
हमारा शरीर भोजन को पचा लेता है।
हम साँस लेते हैं।
इन सभी परिस्थितियों में प्रारंभिक वस्तु की प्रकृति तथा पहचान कुछ न कुछ बदल जाती है। पदार्थ के भौतिक तथा रासायनिक परिवर्तनों के बारे में हम पिछली कक्षाओं में पढ़ चुके हैं। जब कोई रासायनिक परिवर्तन होता है तो हम कह सकते हैं कि एक रासायनिक अभिक्रिया हुई है।
आप शायद सोच रहे होंगे कि रासायनिक अभिक्रिया का वास्तविक अर्थ क्या है। हम कैसे जान सकते हैं कि कोई रासायनिक अभिक्रिया हुई है? इन प्रश्नोें के उत्तर पाने के लिए आइए हम कुछ क्रियाकलाप करते हैं।
क्रियाकलाप 1.1
सावधानीः इस क्रियाकलाप में शिक्षक के सहयोग की आवश्यकता है। सुरक्षा के लिए छात्र आँखों पर चश्मा पहन लें तो उचित होगा।
लगभग 3-4 cm लंबे मैग्नीशियम रिबन को रेगमाल से रगड़कर साफ़ कर लीजिए।
इसे चिमटे से पकड़कर स्पिरिट लैंप या बर्नर से इसका दहन करिए तथा इससे बनी राख को वॉच ग्लास में इकट्ठाकर लीजिए जैसा कि चित्र 1.1 में दिखाया गया है। मैग्नीशियम रिबन का दहन करते समय इसे अपनी आँखों से यथासंभव दूर रखिए।
आपने क्या प्रेक्षण किया?

चित्र 1.1
मैग्नीशियम रिबन का वायु में दहन कर मैग्नीशियम अॉक्साइड को वॉच ग्लास में इकट्ठा करना
आपने देखा होगा कि चमकदार श्वेत लौ के साथ मैग्नीशियम रिबन का दहन होता है और यह श्वेत चूर्ण में परिवर्तित हो जाता है। यह मैग्नीशियम अॉक्साइड का चूर्ण है। वायु में उपस्थित अॉक्सीजन तथा मैग्नीशियम के बीच होने वाली अभिक्रिया के कारण यह बनता है।
क्रियाकलाप 1.2
एक परखनली में लेड (सीसा) नाइट्रेट का घोल लीजिए।
इसमें पोटैशियम आयोडाइड का घोल मिला दीजिए।
आपने क्या प्रेक्षण किया?
क्रियाकलाप 1.3
एक शंक्वाकार फ़्लास्क या परखनली में कुछ दानेदार जिंक लीजिए।
इसमें तनु हाइड्रोक्लोरिक अम्ल या सल्फ़्यूरिक अम्ल मिला दीजिए (चित्र 1.2)
सावधानीः अम्ल का इस्तेमाल सावधानी से कीजिए।
क्या जस्ते के दानों के आसपास कुछ होता दिखाई दे रहा है?
शंक्वाकार फ्लास्क या परखनली को स्पर्श कीजिए। क्या इसके तापमान में कोई परिवर्तन हुआ है?
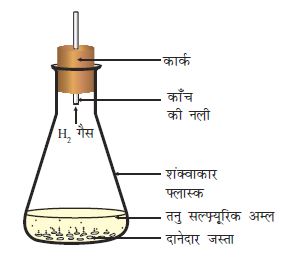
चित्र 1.2 दानेदार जस्ते पर तनु सल्फ़्यूरिक अम्ल की अभिक्रिया से हाइड्रोजन गैस का निर्माण
ऊपर दिए गए तीनों क्रियाकलापों के आधार पर हम कह सकते हैं कि निम्न किसी भी प्रेक्षण की सहायता से हम निर्धारित कर सकते हैं कि एक रासायनिक अभिक्रिया हुई है-
अवस्था में परिवर्तन
रंग में परिवर्तन
गैस का निकास/उत्सर्जन
तापमान में परिवर्तन
यदि हम अपने आसपास हो रहे परिवर्तनों को देखें, तो पाएँगे कि हमारे चारों ओर विविध प्रकार की रासायनिक अभिक्रियाएँ हो रही हैं। इस अध्याय में हम विभिन्न प्रकार की रासायनिक अभिक्रियाओं और उनके प्रतीकात्मक निरूपण का अध्ययन करेंगे।
1.1 रासायनिक समीकरण
क्रियाकलाप 1.1 का विवरणः जब अॉक्सीजन की उपस्थिति में मैग्नीशियम रिबन का दहन होता है तब यह मैग्नीशियम अॉक्साइड में परिवर्तित हो जाता है। वाक्य के रूप में किसी रासायनिक अभिक्रिया का विवरण बहुत लंबा हो जाता है। इसे संक्षिप्त रूप में भी लिखा जा सकता है। इसे शब्द-समीकरण के रूप में लिखना सबसे सरलतम विधि है।
ऊपर दी गई अभिक्रिया का शब्द-समीकरण इस प्रकार होगाः
मैग्नीशियम + अॉक्सीजन → मैग्नीशियम अॉक्साइड (1.1)
(अभिकारक) (उत्पाद)
अभिक्रिया (1.1) में मैग्नीशियम तथा अॉक्सीजन एेसे पदार्थ हैं जिनमें रासायनिक परिवर्तन होता है, इन्हें अभिकारक कहते हैं। इस अभिक्रिया से एक नए पदार्थ मैग्नीशियम अॉक्साइड का निर्माण होता है, इसे उत्पाद कहते हैं।
शब्द-समीकरण में अभिकारकों के उत्पाद में परिवर्तन को उनके मध्य एक तीर का निशान लगाकर दर्शाया जाता है। अभिकारकों के बीच योग (+) का चिह्न लगाकर उन्हें बाईं ओर (LHS) लिखा जाता है। इसी प्रकार उत्पादों के बीच भी योग (+) का चिह्न लगाकर उन्हें दाईं ओर (RHS) लिखा जाता है। तीर का सिरा उत्पाद की ओर होता है तथा यह अभिक्रिया होने की दिशा को दर्शाता है।
1.1.1 रासायनिक समीकरण लिखना
क्या रासायनिक समीकरण के निरूपण की इससे भी संक्षिप्त विधि है? शब्दों की जगह रासायनिक सूत्र का उपयोग करके रासायनिक समीकरणों को अधिक संक्षिप्त तथा उपयोगी बनाया जा सकता है। रासायनिक समीकरण किसी रासायनिक अभिक्रिया को दर्शाता है। यदि आप मैग्नीशियम, अॉक्सीजन तथा मैग्नीशियम अॉक्साइड के सूत्रों का स्मरण करें तो उपरोक्त शब्द-समीकरण इस प्रकार लिखा जा सकता हैः
Mg + O2 → MgO (1.2)
तीर के निशान के बाईं और दाईं ओर के तत्वों के परमाणुओं की संख्या की गिनती कर उनकी तुलना करें। क्या दोनों ओर तत्वों के परमाणुओं की संख्या समान है? यदि है, तो समीकरण संतुलित है। यदि नहीं, तो समीकरण असंतुलित है क्योंकि समीकरण के दोनों ओर का द्रव्यमान बराबर नहीं है। किसी अभिक्रिया का एेसा रासायनिक समीकरण ढाँचा रासायनिक समीकरण कहलाता है। इस प्रकार समीकरण (1.2) मैग्नीशियम के वायु में जलने का ढाँचा समीकरण है।
1.1.2 संतुलित रासायनिक समीकरण का महत्व
आपको द्रव्यमान के संरक्षण का नियम स्मरण होगा जिसका आपने नवीं कक्षा में अध्ययन किया थाः किसी भी रासायनिक अभिक्रिया में द्रव्यमान का न तो निर्माण होता है न ही विनाश। अर्थात किसी भी रासायनिक अभिक्रिया के उत्पाद तत्वों का कुल द्रव्यमान अभिकारक तत्वों के कुल द्रव्यमान के बराबर होता है।
दूसरे शब्दों में, रासायनिक अभिक्रिया के पहले एवं उसके पश्चात प्रत्येक तत्व के परमाणुओं की संख्या समान रहती है। इसलिए हमें कंकाली समीकरण को संतुलित करना आवश्यक है। क्या रासायनिक समीकरण (1.2) संतुलित है? आइए हम रासायनिक समीकरण को चरणबद्ध संतुलित करना सीखें।
क्रियाकलाप 1.3 के शब्द-समीकरण को इस प्रकार दर्शाया जा सकता हैः
जिंक + सल्फ़्यूरिक अम्ल → जिंक सल्फ़ेट + हाइड्रोजन
उपरोक्त शब्द-समीकरण को निम्नलिखित रासायनिक समीकरण से दर्शाया जा सकता हैः
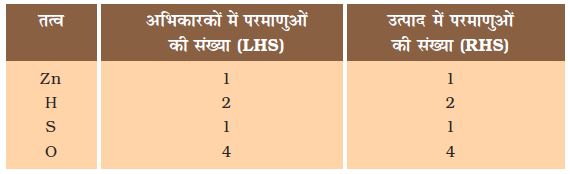
Zn + H2SO4 → ZnSO4 + H2 (1.3)
आइए, समीकरण (1.3) में तीर के निशान के दोनों ओर के तत्वों के परमाणुओं की संख्या की तुलना करें।
समीकरण (1.3) में, तीर के निशान के दोनों ओर के प्रत्येक तत्व के परमाणुओं की संख्या समान है इसलिए यह एक संतुलित रासायनिक समीकरण है।
अब हम निम्न रासायनिक समीकरण को संतुलित करने का प्रयास करते हैंः
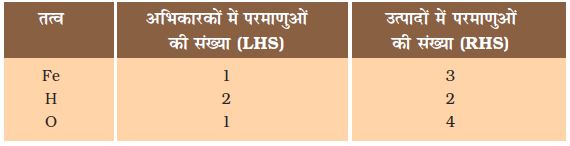
Fe + H2O → Fe3O4 + H2 (1.4)
चरण 1ः रासायनिक समीकरण को संतुलित करने के लिए सबसे पहले प्रत्येक सूत्र के चारों ओर एक बॉक्स बना लीजिए। समीकरण को संतुलित करते समय बॉक्स के अंदर कुछ भी परिवर्तन नहीं कीजिए।
Fe + H2O → Fe3O4 + H2 (1.5)
चरण 2ः असंतुलित समीकरण (1.5) में उपस्थित विभिन्न तत्वों के परमाणुओं की संख्या की सूची बना लीजिए।
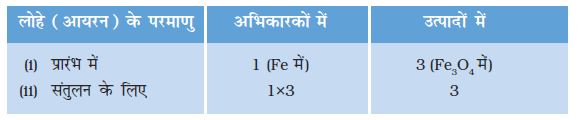
चरण 3ः सुविधा के लिए सबसे अधिक परमाणु वाले यौगिक को पहले संतुलित कीजिए चाहे वह अभिकारक हो या उत्पाद। उस यौगिक में सबसे अधिक परमाणु वाले तत्व को चुनिए। इस आधार पर हम Fe3O4 और उसके अॉक्सीजन तत्व को चुनते हैं। दाईं ओर अॉक्सीजन के चार परमाणु हैं जबकि बाईं ओर केवल एक।
अॉक्सीजन परमाणु को संतुलित करने के लिएः
यह याद रखना आवश्यक है कि परमाणुओं की संख्या को बराबर करने के लिए हम अभिक्रिया में शामिल तत्वों तथा यौगिकों के सूत्रों को नहीं बदल सकते हैं। जैसे कि अॉक्सीजन परमाणु को संतुलित करने के लिए हम ‘4’ गुणांक लगाकर 4 H2O लिख सकते हैं लेकिन H2O4 या (H2O)4 नहीं। आंशिक रूप से संतुलित समीकरण अब इस प्रकार होगाः
Fe + 4 H2O → Fe3O4 + H2
चरण 4ः Fe तथा H परमाणु अब भी संतुलित नहीं हैं। इनमें से किसी एक तत्व को चुनकर आगे बढ़ते हैं। अब हम आंशिक रूप से संतुलित समीकरण में हाइड्रोजन परमाणु को संतुलित करते हैंः
हाइड्रोजन परमाणु को बराबर करने के लिए दाईं ओर हाइड्रोजन अणु की संख्या को ‘4’ कर देते हैं।
समीकरण अब इस प्रकार होगाः
Fe + 4 H2O → Fe3O4 + 4 H2
चरण 5: ऊपर दिए समीकरण की जाँच कीजिए तथा तीसरा तत्व चुन लीजिए जो अब तक असंतुलित है। आप पाएँगे कि केवल लोहा ही एक तत्व है जिसे संतुलित करना शेष है।
Fe को संतुलित करने के लिए बाईं ओर हम Fe के 3 परमाणु लेते हैं।
3 Fe + 4 H2O → Fe3O4 + 4 H2 (1.8)
चरण 6ः अंत में, इस संतुलित समीकरण की जाँच के लिए हम समीकरण में दोनों ओर के तत्वों के परमाणुओं की संख्याओं का परिकलन करते हैं।
3 Fe + 4H2O → Fe3O4 + 4 H2
समीकरण (1.9) में दोनों ओर के तत्वों के परमाणुओं की संख्या बराबर है। अतः यह समीकरण अब संतुलित है। रासायनिक समीकरणों को संतुलित करने की इस विधि को हिट एंड ट्रायल विधि कहते हैं क्योंकि सबसे छोटी पूर्णांक संख्या के गुणांक का उपयोग करके समीकरण को संतुलित करने का प्रयत्न करते हैं।
चरण 7ः भौतिक अवस्थाओ के संकेत लिखनाः ऊपर लिखे संतुलित समीकरण
(1.9) की सावधानी से जाँच कीजिए। क्या इस समीकरण से हमें अभिकारकों तथा उत्पादों की भौतिक अवस्था के बारे में भी ज्ञान होता है? इस समीकरण में उनकी भौतिक अवस्थाओं की कोई जानकारी नहीं है।
रासायनिक समीकरण को अधिक सूचनापूर्ण बनाने के लिए अभिकारकों तथा उत्पादों के रासायनिक सूत्र के साथ उनकी भौतिक अवस्था को भी दर्शाया जाता है। अभिकारकों तथा उत्पादों के गैस, द्रव, जलीय तथा ठोस अवस्थाओं को क्रमशः (g), (l), (aq) तथा (s) से दर्शाया जाता है। अभिकारक या उत्पाद जब जल में घोल के रूप में उपस्थित होते हैं तब हम (aq) लिखते हैं।
अब संतुलित समीकरण (1.9) इस प्रकार होगाः
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g) (1.10)
ध्यान दीजिए समीकरण (1.10) में H2O के साथ (g) चिह्न का उपयोग किया गया है। यह दर्शाता है कि इस अभिक्रिया में जल का उपयोग भाप के रूप में किया गया है।
प्रायः हर रासायनिक समीकरण में भौतिक अवस्था को शामिल नहीं किया जाता है, जब तक कि यह आवश्यक न हो।
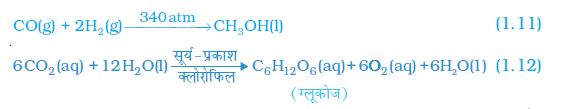
कभी-कभी अभिक्रिया की परिस्थितियाँ जैसे कि ताप, दाब, उत्प्रेरक आदि को भी तीर के निशान के ऊपर या नीचे दर्शाया जाता है। जैसे,
इसी प्रकार क्या आप पुस्तक में दिए गए समीकरण (1.2) को संतुलित कर सकते हैं?
प्रश्न
1. वायु में जलाने से पहले मैग्नीशियम रिबन को साफ़ क्यों किया जाता है?
2. निम्नलिखित रासायनिक अभिक्रियाओं के लिए संतुलित समीकरण लिखिएः
(i) हाइड्रोजन + क्लोरीन → हाइड्रोजन क्लोराइड
(ii) बेरियम क्लोराइड + एेलुमीनियम सल्फ़ेट → बेरियम सल्फ़ेट + एेलुमीनियम क्लोराइड
(ii) सोडियम + जल → सोडियम हाइड्रॉक्साइड + हाइड्रोजन
3. निम्नलिखित अभिक्रियाओं के लिए उनकी अवस्था के संकेतों के साथ संतुलित रासायनिक समीकरण लिखिएः
(i) जल में बेरियम क्लोराइड तथा सोडियम सल्फ़ेट के विलयन अभिक्रिया करके सोडियम क्लोराइड का विलयन तथा अघुलनशील बेरियम सल्फ़ेट का अवक्षेप बनाते हैं।
(i) सोडियम हाइड्रोक्साइड का विलयन (जल में) हाइड्रोक्लोरिक अम्ल के विलयन (जल में) से अभिक्रिया करके सोडियम क्लोराइड का विलयन तथा जल बनाते हैं।
1.2 रासायनिक अभिक्रियाओं के प्रकार
कक्षा 9 में हम अध्ययन कर चुके हैं कि रासायनिक क्रिया के समय किसी एक तत्व का परमाणु दूसरे तत्व के परमाणु में नहीं बदलता है। न तो कोई परमाणु मिश्रण से बाहर जाता है और न ही बाहर से मिश्रण में आता है। वास्तव में, किसी रासायनिक अभिक्रिया में परमाणुओं के आपसी आबंध के टूटने एवं जुड़ने से नए पदार्थों का निर्माण होता है। परमाणुओं के बीच विभिन्न प्रकार के आबंध के बारे में आप अध्याय 3 तथा 4 में अध्ययन करेंगे।
1.2.1 संयोजन अभिक्रिया
क्रियाकलाप 1.4
एक बीकर में थोड़ा कैल्सियम अॉक्साइड तथा बुझा हुआ चूना लीजिए।
इसमें धीरे-धीरे जल मिलाइए।
अब बीकर को स्पर्श कीजिए जैसा चित्र 1.3 में दिखाया गया है।
क्या इसके ताप में कोई परिवर्तन हुआ?
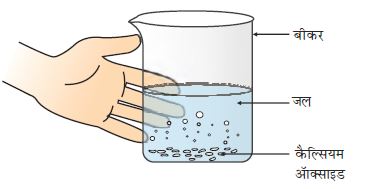
चित्र 1.3 जल के साथ कैल्सियम अॉक्साइड की अभिक्रिया से बुझे हुए चूने का निर्माण
कैल्सियम अॉक्साइड जल के साथ तीव्रता से अभिक्रिया करके बुझे हुए चूने (कैल्सियम हाइड्रोक्साइड) का निर्माण करके अधिक मात्रा में ऊष्मा उत्पन्न करता है।
CaO(s) + H2O(l) → Ca(OH)2(aq) + ऊष्मा (1.13)
(बिना बुझा हुआ चूना) (बुझा हुआ चूना)
इस अभिक्रिया में कैल्सियम अॉक्साइड तथा जल मिलकर एकल उत्पाद, कैल्सियम हाइड्रोक्साइड बनाते हैं। एेसी अभिक्रिया जिसमें दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं उसे संयोजन अभिक्रिया कहते हैं।
क्या आप जानते है
ऊपर की अभिक्रिया में निर्मित बुझे हुए चूने के विलयन का उपयोग दीवारों की सफ़ेदी करने के लिए किया जाता है। कैल्सियम हाइड्रॉक्साइड वायु में उपस्थित कार्बन डाइअॉक्साइड के साथ धीमी गति से अभिक्रिया करके दीवारों पर कैल्सियम कार्बोनेट की एक पतली परत बना देता है। सफ़ेदी करने के दो-तीन दिन बाद कैल्सियम कार्बोनेट का निर्माण होता है और इससे दीवारों पर चमक आ जाती है। रोचक बात यह है कि संगमरमर का रासायनिक सूत्र भी CaCO3 ही है।
Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l) (1.14)
(कैल्सियम हाइड्रोक्साइड) (कैल्सियम) (कार्बोनेट)
आइए, संयोजन अभिक्रिया के कुछ और उदाहरणों पर चर्चा करें।
(i) कोयले का दहन
C(s) + O2(g) → CO2(g) (1.15)
(ii) H2 (g) तथा O2 (g) से जल का निर्माण
2H2(g) + O2(g) → 2H2O(l) (1.16)
सरल शब्दों में हम कह सकते हैं कि जब दो या दो से अधिक पदार्थ (तत्व या यौगिक) संयोग करके एकल उत्पाद का निर्माण करते हैं, एेसी अभिक्रियाओं को संयोजन अभिक्रिया कहते हैं।
क्रियाकलाप 1.4 में हमने यह भी देखा कि अधिक मात्रा में ऊष्मा उत्पन्न हुई। इससे अभिक्रिया मिश्रण गर्म हो जाता है। जिन अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा भी उत्पन्न होती है उन्हें ऊष्माक्षेपी रासायनिक अभिक्रिया कहते हैं।
ऊष्माक्षेपी अभिक्रियाओं के कुछ अन्य उदाहरण हैंः
(i) प्राकृतिक गैस का दहनः
CH4(g) + 2O2 (g) → CO2 (g) + 2H2O (g) + ऊर्जा (1.17)
(ii) क्या आप जानते हैं कि श्वसन एक ऊष्माक्षेपी अभिक्रिया है?
हम सभी जानते हैं कि जीवित रहने के लिए हमें ऊर्जा की आवश्यकता होती है। यह ऊर्जा हमें भोजन से प्राप्त होती है। पाचन क्रिया के समय खाद्य पदार्थ छोटे-छोटे टुकड़ों में टूट जाते हैं। जैसे चावल, आलू तथा ब्रेड में कार्बोहाइड्रेट होता है। इन कार्बोहाइड्रेट के टूटने से ग्लूकोज़ प्राप्त होता है। यह ग्लूकोज़ हमारे शरीर की कोशिकाओं में उपस्थित अॉक्सीजन से मिलकर हमें ऊर्जा प्रदान करता है। इस अभिक्रिया का विशेष नाम श्वसन है जिसका अध्ययन आप अध्याय 6 में करेंगे।
C6H12O6(aq) + 6O2(aq) → 6CO2(aq) + 6H2O(l) + ऊर्जा (1.18)
ग्लूकोज़
(iii) शाक-सब्जियों (वनस्पति द्रव्य) का विघटित होकर कंपोस्ट बनना भी ऊष्माक्षेपी अभिक्रिया का ही उदाहरण है।
क्रियाकलाप 1.1 में दी गई अभिक्रिया के प्रकार को पहचानिए जिसमें एकल उत्पाद के निर्माण के साथ ऊष्मा उत्पन्न होती है।
चित्र 1.4 फ़ेरस सल्फ़ेट क्रिस्टल वाली परखनली को गर्म करने तथा गंध सूँघने की सही विधि
1.2.2 वियोजन (अपघटन) अभिक्रिया
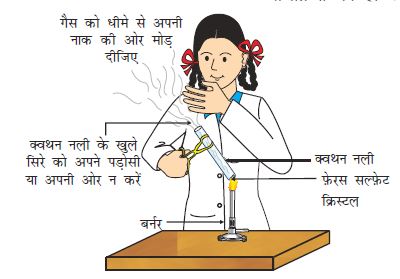
एक शुष्क क्वथन नली में 2 g फ़ेरस सल्फ़ेट के क्रिस्टल लीजिए।
फ़ेरस सल्फ़ेट के क्रिस्टल के रंग पर ध्यान दीजिए।
क्वथन नली को बर्नर या स्पिरिट लैंप की ज्वाला पर गर्म कीजिए, जैसा चित्र 1.4 में दिखाया गया है।
गर्म करने के पश्चात क्रिस्टल के रंग को देखिए।
क्या आपने ध्यान दिया कि फ़ेरस सल्फ़ेट क्रिस्टल के हरे रंग में परिवर्तन हुआ है? सल्फ़र के दहन से उत्पन्न उस अभिलाक्षणिक (विशिष्ट) गंध को भी आप सूँघ सकते हैं।
आप देख सकते हैं कि इस अभिक्रिया में एकल अभिकर्मक टूट कर छोटे-छोटे उत्पाद प्रदान करता है। यह एक वियोजन अभिक्रिया है। गर्म करने पर फ़ेरस सल्फ़ेट (FeSO4. 7H2O) का क्रिस्टल जल त्याग देता है और क्रिस्टल का रंग बदल जाता है। इसके उपरांत यह फ़ेरिक अॉक्साइड (Fe2O3), सल्फ़र डाइअॉक्साइड (SO2) तथा सल्फ़र ट्राइअॉक्साइड (SO3) में वियोजित हो जाता है। फ़ेरिक अॉक्साइड ठोस है जबकि SO2 तथा SO3 गैसें हैं।
ऊष्मा देने पर कैल्सियम कार्बोनेट का कैल्सियम अॉक्साइड तथा कार्बन डाइअॉक्साइड में वियोजित होना एक प्रमुख वियोजन अभिक्रिया है जिसका उपयोग विभिन्न उद्योगों में होता है। कैल्सियम अॉक्साइड को चूना या बिना बुझा हुआ चूना कहते हैं। इसके अनेक उपयोगों में से एक उपयोग सीमेंट के निर्माण में होता है। ऊष्मा के द्वारा की गई वियोजन अभिक्रिया को ऊष्मीय वियोजन कहते हैं।
ऊष्मीय वियोजन अभिक्रिया का एक अन्य उदाहरण क्रियाकलाप 1.6 में दिया गया है।
क्रियाकलाप 1.6
एक क्वथन नली में 2 g लेड नाइट्रेट का चूर्ण लीजिए।
चिमटे से क्वथन नली को पकड़कर ज्वाला के ऊपर रखकर इसे गर्म कीजिए जैसा चित्र 1.5 में दिखाया गया है।
आपने क्या देखा? यदि कोई परिवर्तन हुआ हैे तो उसे नोट कर लीजिए।
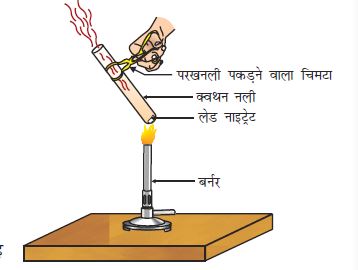
चित्र 1.5 लेड नाइट्रेट का तापन तथा नाइट्रोजन डाइअॉक्साइड का उत्सर्जन
आप देखेंगे कि भूरे रंग का धुआँ उत्सर्जित होता है। यह नाइट्रोजन डाइअॉक्साइड (NO2)का धुआँ है। यह अभिक्रिया इस प्रकार होती हैः
आइए क्रियाकलाप 1.7 तथा 1.8 में दी गयी कुछ अन्य अपघटन अभिक्रियाएँ करें।
क्रियाकलाप 1.7
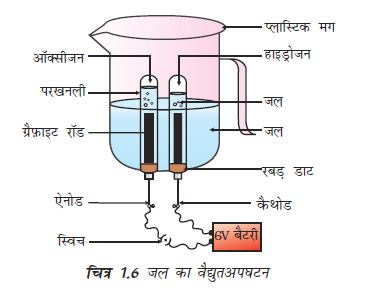
एक प्लास्टिक का मग लीजिए। इसकी तली में दो छिद्र करके उनमें रबड़ का डाट लगा दीजिए। इन छिद्रों में कार्बन इलेक्ट्रोड डाल दीजिए जैसा कि चित्र 1.6 में दिखाया गया है।
इन इलेक्ट्रोडों को 6 वोल्ट की बैटरी से जोड़ दीजिए।
मग में इतना जल डालिए कि इलेक्ट्रोड उसमें डूब जाए। जल में तनु सल्फ़्यूरिक अम्ल की कुछ बूँदें डाल दीजिए।
जल से भरी दो अंशांकित परखनलियों को दोनों कार्बन इलेक्ट्रोडों के ऊपर उलटा करके रख दीजिए।
अब विद्युत धारा प्रवाहित करके इस उपकरण को थोड़ी देर के लिए छोड़ दीजिए।
दोनों इलेक्ट्रोडों पर आप बुलबुले बनते हुए देखेंगे। ये बुलबुले अंशांकित नली से जल को विस्थापित कर देते हैं।
क्या दोनों परखनलियों में एकत्रित गैस का आयतन समान है?
जब दोनों परखनलियाँ गैस से भर जाएँ तब उन्हें सावधानीपूर्वक हटा लीजिए।
एक जलती हुई मोमबत्ती को दोनों परखनलियों के मुँह के ऊपर लाकर इन गैसों की जाँच कीजिए।
सावधानीः इस चरण को शिक्षक द्वारा सावधानीपूर्वक किया जाना चाहिए।
दोनों स्थितियों में क्या होता है?
दोनों परखनलियों में कौन सी गैस उपस्थित है?
क्रियाकलाप 1.8
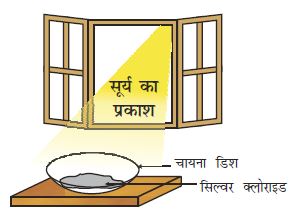
चायना डिश में 2 g सिल्वर क्लोराइड लीजिए।
इसका रंग क्या है?
इस चायना डिश को थोड़ी देर के लिए सूर्य के प्रकाश में रख दीजिए (चित्र 1.7)।
थोड़ी देर पश्चात सिल्वर क्लोराइड के रंग को देखिए।
चित्र 1.7
सूर्य के प्रकाश में सिल्वर क्लोराइड धूसर रंग का होकर सिल्वर धातु बनाता है
आप देखेंगे कि सूर्य के प्रकाश में श्वेत रंग का सिल्वर क्लोराइड धूसर रंग का हो जाता है। प्रकाश की उपस्थिति में सिल्वर क्लोराइड का सिल्वर तथा क्लोरीन में वियोजन के कारण से एेसा होता है।
सिल्वर ब्रोमाइड भी इसी प्रकार अभिक्रिया करता है।
ऊपर दी गई अभिक्रिया का उपयोग श्याम-श्वेत फ़ोटोग्राफी में किया जाता है।
किस प्रकार की ऊर्जा के कारण यह वियोजन अभिक्रिया होती है?
हमने देखा कि वियोजन अभिक्रिया में अभिकारकों को तोड़ने के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है। जिन अभिक्रियाओं में ऊर्जा अवशोषित होती है उन्हें ऊष्माशोषी अभिक्रिया कहते हैं।
निम्नलिखित क्रियाकलाप करें
एक परखनली में लगभग 2 g बेरियम हाइड्रॉक्साइड लीजिए। इसमें 1 g अमोनियम क्लोराइड डालकर काँच की छड़ से मिलाइए। अपनी हथेली से परखनली के निचले सिरे को छूइए। आप कैसा महसूस करते हैं? क्या यह अभिक्रिया ऊष्माक्षेपी अथवा ऊष्माशोषी है?
1.2.3 विस्थापन अभिक्रिया
लोहे की तीन कील लीजिए और उन्हें रेगमाल से रगड़कर साफ़ कीजिए।
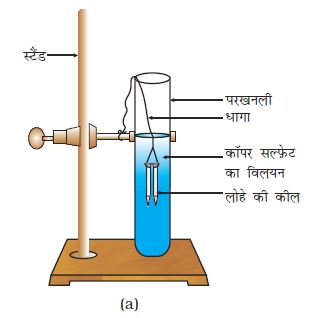
(A) तथा (B) से चिह्नित की हुई दो परखनलियाँ लीजिए। प्रत्येक परखनली में 10 mL कॉपर सल्फ़ेट का विलयन लीजिए।
दो कीलों को धागे से बाँधकर सावधानीपूर्वक परखनली (B) के कॉपर सल्फ़ेट के विलयन में लगभग 20 मिनट तक डुबो कर रखिए (चित्र 1.8 a)। तुलना करने के लिए एक कील को अलग रखिए।
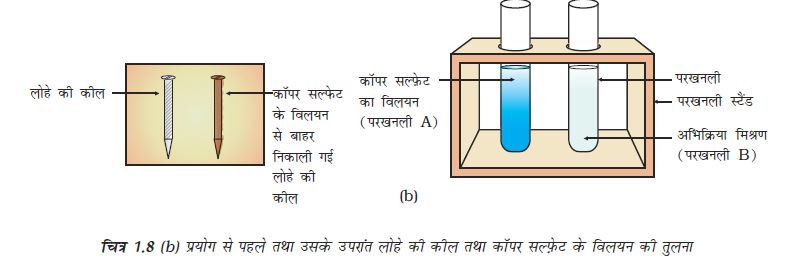
20 मिनट पश्चात दोनों कीलों को कॉपर सल्फ़ेट के विलयन से बाहर निकाल लीजिए।
परखनली (A) तथा (B) में कॉपर सल्फ़ेट के विलयन के नीले रंग की तीव्रता की तुलना कीजिए (चित्र 1.8 b)।
कॉपर सल्फ़ेट के विलयन में डूबी कीलों के रंग की तुलना बाहर रखी कील से कीजिए (चित्र 1.8 b)।
चित्र 1.8 (a)
कॉपर सल्फ़ेट के विलयन में डूबी हुई लोहे की कीलें
लोहे की कील का रंग भूरा क्यों हो गया तथा कॉपर सल्फ़ेट के विलयन का नीला रंग मलीन क्यों पड़ गया?
इस क्रियाकलाप में निम्नलिखित अभिक्रिया हुईः
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s) (1.24)
(कॉपर सल्फ़ेट) (आयरन सल्फ़ेट)
इस अभिक्रिया में लोहे (आयरन) ने दूसरे तत्व कॉपर को कॉपर सल्फ़ेट के विलयन सेे विस्थापित कर दिया या हटा दिया। इस अभिक्रिया को विस्थापन अभिक्रिया कहते हैं।
विस्थापन अभिक्रिया के कुछ अन्य उदाहरणः
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s) (1.25)
(कॉपर सल्फ़ेट) (जिंक सल्फ़ेट)
Pb(s) + CuCl2(aq) → PbCl2(aq) + Cu(s) (1.26)
(कॉपर क्लोराइड)(लेड क्लोराइड)
जिंक तथा लेड, कॉपर की अपेक्षा अधिक क्रियाशील तत्व हैं। वे कॉपर को उसके यौगिक से विस्थापित कर देते हैं।
चित्र 1.9
बेरियम सल्फ़ेट तथा सोडियम क्लोराइड का निर्माण
1.2.4 द्विविस्थापन अभिक्रिया
क्रियाकलाप 1.10
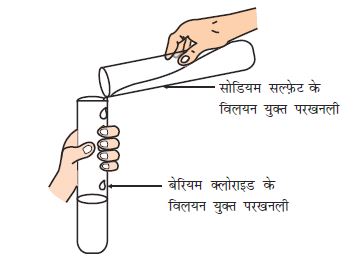
एक परखनली में 3 mL सोडियम सल्फ़ेट का विलयन लीजिए।
एक अन्य परखनली में 3 mL बेरियम क्लोराइड लीजिए।
दोनों विलयनों को मिला लीजिए (चित्र 1.9)।
आपने क्या देखा?
आप देखेंगे कि श्वेत रंग के एक पदार्थ का निर्माण होता है जो जल में अविलेय है। इस अविलेय पदार्थ को अवक्षेप कहते हैं। जिस अभिक्रिया में अवक्षेप का निर्माण होता है उसे अवक्षेपण अभिक्रिया कहते हैं।
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2NaCl(aq) (1.27)
(सोडियम (बेरियम (बेरियम (सोडियम
सल्फ़ेट) क्लोराइड) सल्फ़ेट) क्लोराइड)
एेसा क्यों होता है? Ba2+ तथा 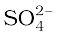 की अभिक्रिया से BaSO4 के अवक्षेप का निर्माण होता है। एक अन्य उत्पाद सोडियम कलोराइड का भी निर्माण होता है जो विलयन में ही रहता है। वे अभिक्रियाएँ जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।
की अभिक्रिया से BaSO4 के अवक्षेप का निर्माण होता है। एक अन्य उत्पाद सोडियम कलोराइड का भी निर्माण होता है जो विलयन में ही रहता है। वे अभिक्रियाएँ जिनमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।
क्रियाकलाप 1.2 पर ध्यान दें जिसमें आपने लेड (II) नाइट्रेट तथा पोटैशियम आयोडाइड के विलयनों को मिश्रित किया था।
(i) अवक्षेप किस रंग का था? क्या आप अवक्षेपित यौगिक का नाम बता सकते हैं?
(ii) इस अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
(iii) क्या यह भी द्विविस्थापन अभिक्रिया है?
1.2.5 उपचयन एवं अपचयन
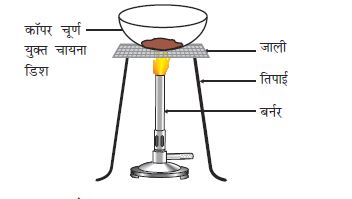
चित्र 1.10
कॅापर का कॉपर आक्साइड में उपचयन
क्रियाकलाप 1.11
चायना डिश में 1 g कॉपर चूर्ण लेकर उसे गर्म कीजिए (चित्र 1.10)।
आपने क्या देखा?
कॉपर चूर्ण की सतह पर कॉपर अॉक्साइड (II) की काली परत चढ़ जाती है। यह काला पदार्थ क्यों बना?
यह कॉपर अॉक्साइड कॉपर में अॉक्सीजन के योग से बना है।
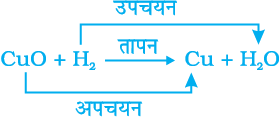
यदि इस गर्म पदार्थ (CuO) के ऊपर हाइड्रोजन गैस प्रवाहित की जाए तो सतह की काली परत भूरे रंग की हो जाती है क्योंकि इस स्थिति में विपरीत अभिक्रिया संपन्न होती है तथा कॉपर प्राप्त होता है।
अभिक्रिया के समय जब किसी पदार्थ में अॉक्सीजन की वृद्धि होती है तो कहते हैं कि उसका उपचयन हुआ है। तथा जब अभिक्रिया में किसी पदार्थ में अॉक्सीजन का ह्रास होता है तो कहते हैं कि उसका अपचयन हुआ है।
अभिक्रिया (1.29) में कॉपर (II) अॉक्साइड में अॉक्सीजन का ह्रास हो रहा है इसलिए यह अपचयित हुआ है। हाइड्रोजन में अॉक्सीजन की वृद्धि हो रही है इसलिए यह उपचयित हुआ है। अर्थात, किसी अभिक्रिया में एक अभिकारक उपचयित तथा दूसरा अभिकारक अपचयित होता है। इन अभिक्रियाओं को उपचयन-अपचयन अथवा रेडॉक्स अभिक्रियाएँ कहते हैं।
 (1.30)
(1.30)
रेडॉक्स अभिक्रिया के कुछ अन्य उदाहरण हैः
ZnO + C → Zn + CO (1.31)
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 (1.32)
अभिक्रिया (1.31) में र्काबन उपचयित होकर CO तथा ZnO अपचयित होकर Zn बनता है।
अभिक्रिया (1.32) में HCl, Cl2 में उपचयित तथा MnO2, MnCl2 में अपचयित हुआ है।
ऊपर के उदाहरणों के आधार पर हम कह सकते हैं कि यदि किसी अभिक्रिया में पदार्थ का उपचयन तब होता है जब उसमें अॉक्सीजन की वृद्धि या हाइड्रोजन का ह्रास होता है। पदार्थ का अपचयन तब होता है जब उसमें अॉक्सीजन का ह्रास या हाइड्रोजन की वृद्धि होती है।
क्रियाकलाप 1.1 पर ध्यान दीजिए जिसमें एक चमकदार ज्वाला के साथ मैग्नीशियम रिबन का वायु (अॉक्सीजन) में दहन होता है तथा यह श्वेत पदार्थ मैग्नीशियम अॉक्साइड में परिवर्तित हो जाता है। इस अभिक्रिया में मैग्नीशियम का उपचयन होता है या अपचयन?
1.3 क्या आपने दैनिक जीवन में उपचयन अभिक्रियाओं के प्रभावों को देखा है?
1.3.1 संक्षारण
आपने अवश्य देखा होगा कि लोहे की बनी नयी वस्तुएँ चमकीली होती हैं लेकिन कुछ समय पश्चात उन पर लालिमायुक्त भूरे रंग की परत चढ़ जाती है। प्रायः इस प्रक्रिया को लोहे पर जंग लगना कहते हैं। कुछ अन्य धातुओं में भी एेसा ही परिवर्तन होता है। क्या आपने चाँदी तथा ताँबे पर चढ़ने वाली परत के रंग पर ध्यान दिया है? जब कोई धातु अपने आसपास अम्ल, आर्द्रता आदि के संपर्क में आती है तब ये संक्षारित होती हैं और इस प्रक्रिया को संक्षारण कहते हैं। चाँदी के ऊपर काली पर्त व ताँबे के ऊपर हरी पर्त चढ़ना संक्षारण के अन्य उदाहरण हैं।
संक्षारण के कारण कार के ढाँचे, पुल, लोहे की रेलिंग, जहाज तथा धातु, विशेषकर लोहे से बनी वस्तुओं की बहुत क्षति होती है। लोहे का संक्षारण एक गंभीर समस्या है। क्षतिग्रस्त लोहे को बदलने में हर वर्ष अधिक पैसा खर्च होता है। अध्याय 3 में आपको संक्षारण के बारे में अधिक जानकारी प्राप्त होगी।
1.3.2 विकृतगंधिता
वसायुक्त अथवा तैलीय खाद्य सामग्री जब लंबे समय तक रखा रह जाता है तब उसका स्वाद या गंध कैसी होती है?
उपचयित होने पर तेल एवं वसा विकृतगंधी हो जाते हैं तथा उनके स्वाद तथा गंध बदल जाते हैं। प्रायः तैलीय तथा वसायुक्त खाद्य सामग्रियों में उपचयन रोकने वाले पदार्थ (प्रति अॉक्सीकारक) मिलाए जाते हैं। वायुरोधी बर्तनों में खाद्य सामग्री रखने से उपचयन की गति धीमी हो जाती है। क्या आप जानते हैं कि चिप्स बनाने वाले चिप्स की थैली में से अॉक्सीजन हटाकर उसमें नाइट्रोजन जैसे कम सक्रिय गैस से युक्त कर देते हैं ताकि चिप्स का उपचयन न हो सके।
प्रश्न
1. जब लोहे की कील को कॉपर सल्फ़ेट के विलयन में डुबोया जाता है तो विलयन का रंग क्यों बदल जाता है?
2. क्रियाकलाप 1.10 से भिन्न द्विविस्थापन अभिक्रिया का एक उदाहरण दीजिए।
3. निम्न अभिक्रियाओं में उपचयित तथा अपचयित पदार्थों की पहचान कीजिएः
(i) 4Na(s) + O2(g) → 2Na2O(s)
(ii) CuO(s) + H2(g) → Cu(s) + H2O(l)
आपने क्या सीखा
एक पूर्ण रासायनिक समीकरण अभिकारक, उत्पाद एवं प्रतीकात्मक रूप से उनकी भौतिक अवस्था को प्रदर्शित करता है।
रासायनिक समीकरण को संतुलित किया जाता है जिससे समीकरण में अभिकारक तथा उत्पाद, दोनों ही ओर, रासायनिक अभिक्रिया में भाग लेने वाले प्रत्येक परमाणु की संख्या समान हो। समीकरण का संतुलित होना आवश्यक है।
संयोजन अभिक्रिया में दो या दो से अधिक पदार्थ मिलकर एक नया पदार्थ बनाते हैं।
वियोजन अभिक्रिया संयोजन अभिक्रिया के विपरीत होती है। वियोजन अभिक्रिया में एकल पदार्थ वियोजित होकर दो या दो से अधिक पदार्थ देता है।
जिन अभिक्रियाओं में उत्पाद के साथ ऊष्मा का भी उत्सर्जन होता है उन्हें ऊष्माक्षेपी अभिक्रियाएँ कहते हैं।
जिन अभिक्रियाओं में ऊष्मा का अवशोषण होता है उन्हें ऊष्माशोषी अभिक्रियाएँ कहते हैं।
जब कोई एक तत्व दूसरे तत्व को उसके यौगिक से विस्थापित कर देता है, विस्थापन अभिक्रिया होती है।
द्विविस्थापन अभिक्रिया में दो अलग-अलग परमाणु या परमाणुओं के समूह (आयन) का आपस में आदान-प्रदान होता है।
अवक्षेपण अभिक्रिया से अविलेय लवण प्राप्त होेता है।
अभिक्रिया में पदार्थों से अॉक्सीजन या हाइड्रोजन का योग अथवा ह्रास भी होता है। अॉक्सीजन का योग या हाइड्रोजन का ह्रास अॉक्सीकरण या उपचयन कहलाता है। अॉक्सीजन का ह्रास या हाइड्रोजन का योग अपचयन कहलाता है।
अभ्यास
1. नीचे दी गयी अभिक्रिया के संबंध में कौन सा कथन असत्य है?
2PbO(s) + C(s) → 2Pb(s) + CO2(g)
(a) सीसा अपचयित हो रहा है।
(b) कार्बन डाइअॉक्साइड उपचयित हो रहा है।
(c) कार्बन उपचयित हो रहा है।
(d) लेड अॉक्साइड अपचयित हो रहा है।
(i) (a) एवं (b)
(ii) (a) एवं (c)
(iii) (a), (b) एवं (c)
(iv) सभी
2. Fe2O3 + 2Al → Al2O3 + 2Fe
ऊपर दी गयी अभिक्रिया किस प्रकार की हैः
(a) संयोजन अभिक्रिया
(b) द्विविस्थापन अभिक्रिया
(c) वियोजन अभिक्रिया
(d) विस्थापन अभिक्रिया
3. लौह-चूर्ण पर तनु हाइड्रोक्लोरिक अम्ल डालने से क्या होता है? सही उत्तर पर निशान लगाइए।
(a) हाइड्रोजन गैस एवं आयरन क्लोराइड बनता है।
(b) क्लोरीन गैस एवं आयरन हाइड्रॉक्साइड बनता है।
(c) कोई अभिक्रिया नहीं होती है।
(d) आयरन लवण एवं जल बनता है।
4. संतुलित रासायनिक समीकरण क्या है? रासायनिक समीकरण को संतुलित करना क्यों आवश्यक है?
5. निम्न कथनों को रासायनिक समीकरण के रूप में परिवर्तित कर उन्हें संतुलित कीजिए।
(a) नाइट्रोजन हाइड्रोजन गैस से संयोग करके अमोनिया बनाता है।
(b) हाइड्रोजन सल्फ़ाइड गैस का वायु में दहन होने पर जल एवं सल्फ़र डाइअॉक्साइड बनता है।
(c) एेलुमिनियम सल्फ़ेट के साथ अभिक्रिया कर बेरियम क्लोराइड, एेलुमिनियम क्लोराइड एवं बेरियम सल्फ़ेट का अवक्षेप देता है।
(d) पोटैशियम धातु जल के साथ अभिक्रिया करके पोटैशियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस देती है।
6. निम्न रासायनिक समीकरणों को संतुलित कीजिएः
(a) HNO3 + Ca(OH)2 → Ca(NO3)2 + H2O
(b) NaOH + H2SO4 → Na2SO4 + H2O
(c) NaCl + AgNO3 → AgCl + NaNO3
(d) BaCl2 + H2SO4 → BaSO4 + HCl
7. निम्न अभिक्रियाओं के लिए संतुलित रासायनिक समीकरण लिखिएः
(a) कैल्शियम हाइड्रोक्साइड + कार्बन डाइअॉक्साइड → कैल्शियम कार्बोनेट + जल
(b) जिंक + सिल्वर नाइट्रेट → जिंक नाइट्रेट + सिल्वर
(c) एेलुमिनियम + कॉपर क्लोराइड → एेलुमिनियम क्लोराइड + कॉपर
(d) बेरियम क्लोराइड + पोटैशियम सल्फ़ेट → बेरियम सल्फ़ेट + पोटैशियम क्लोराइड
8. निम्न अभिक्रियाओं के लिए सतुंलित रासायनिक समीकरण लिखिए एवं प्रत्येक अभिक्रिया
का प्रकार बताइए।
(a) पोटैशियम ब्रोमाइड (aq) + बेरियम आयोडाइड (aq) → पोटैशियम आयोडाइड (aq)
+ बेरियम ब्रोमाइड (s)
(b) जिंक कार्बोनेट(s) → जिंक अॉक्साइड (s) + कार्बन डाइअॉक्साइड (g)
(c) हाइड्रोजन(g) + क्लोरीन (g) → हाइड्रोजन क्लोराइड (g)
(d) मैग्नीशियम(s) + हाइड्रोक्लोरिक अम्ल(aq) → मैग्नीशियम क्लोराइड(aq) + हाइड्रोजन (g)
9. ऊष्माक्षेपी एवं ऊष्माशोषी अभिक्रिया का क्या अर्थ है? उदाहरण दीजिए।
10. श्वसन को ऊष्माक्षेपी अभिक्रया क्यों कहते हैं? वर्णन कीजिए।
11. वियोजन अभिक्रिया को संयोजन अभिक्रिया के विपरीत क्याें कहा जाता है? इन अभिक्रियाओं के लिए समीकरण लिखिए।
12. उन वियोजन अभिक्रियाओं के एक-एक समीकरण लिखिए जिनमें ऊष्मा, प्रकाश एवं विद्युत के रूप में ऊर्जा प्रदान की जाती है।
13. विस्थापन एवं द्विविस्थापन अभिक्रियाओं में क्या अंतर है? इन अभिक्रियाओं के समीकरण लिखिए।
14. सिल्वर के शोधन में, सिल्वर नाइट्रेट के विलयन से सिल्वर प्राप्त करने के लिए कॉपर धातु द्वारा विस्थापन किया जाता है। इस प्रक्रिया के लिए अभिक्रिया लिखिए।
15. अवक्षेपण अभिक्रिया से आप क्या समझते हैं? उदाहरण देकर समझाइए।
16. अॉक्सीजन के योग या ह्रास के आधार पर निम्न पदों की व्याख्या कीजिए। प्रत्येक के लिए दो उदाहरण दीजिए।
(a) उपचयन (b) अपचयन
17. एक भूरे रंग का चमकदार तत्व 'X' को वायु की उपस्थिति में गर्म करने पर वह काले रंग का हो जाता है। इस तत्व 'X' एवं उस काले रंग के यौगिक का नाम बताइए।
18. लोहे की वस्तुओं को हम पेंट क्यों करते हैं?
19. तेल एवं वसायुक्त खाद्य पदार्थों को नाइट्रोजन से प्रभावित क्यों किया जाता है?
20. निम्न पदों का वर्णन कीजिए तथा प्रत्येक का एक-एक उदाहरण दीजिएः
(a) संक्षारण (b) विकृतगंधिता
सामूहिक क्रियाकलाप
निम्नलिखित क्रियाकलाप कीजिएः
चार बीकर लेकर उन्हें A, B, C तथा D से चिह्नित कीजिए।
‘A’, ‘B’ तथा ‘C’ में 25 mL जल लीजिए तथा ‘D’ में कॉपर सल्फ़ेट का विलयन लीजिए।
प्रत्येक बीकर में रखे द्रव का तापमान मापकर उसे नोट कीजिए।
पोटैशियम सल्फ़ेट, अमोनियम नाइट्रेट, निर्जल कॉपर सल्फ़ेट एवं लोहे की छीलन को दो स्पैचुला के परिमाण के बराबर क्रमशः ‘A’, ‘B’, ‘C’ तथा ‘D’ बीकर में अलग-अलग डालकर उसे हिलाइए।
अंत में प्रत्येक मिश्रण का तापमान मापकर उसे नोट कीजिए।
पता लगाइए कि इनमें कौन सी अभिक्रियाएँ ऊष्माक्षेपी हैं तथा कौन सी ऊष्माशोषी हैं?