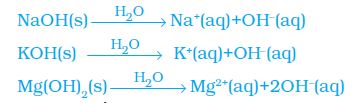Table of Contents
अध्याय 2
अम्ल, क्षारक एवं लवण
आपने पिछली कक्षाओं में अध्ययन किया होगा कि भोजन का खट्टा एवं कड़वा स्वाद भोजन में विद्यमान क्रमशः अम्ल एवं क्षारक के कारण होता है। यदि आपके परिवार का कोई सदस्य अत्यधिक भोजन करने के कारण अम्लता से पीड़ित है तो आप कौन सा उपचार सुझाएँगेे? नींबू पानी, सिरका या बेकिंग सोडा का विलयन?
उपचार बताते समय आप किस गुणधर्म का ध्यान रखेंगे? आप जानते हैं कि अम्ल एवं क्षारक एक दूसरे के प्रभाव को समाप्त करते हैं। आपने अवश्य ही इसी जानकारी का उपयोग किया होगा।
याद कीजिए कि कैसे हमने बिना स्वाद चखे ही खट्टे एवं कड़वे पदार्थों की जाँच की थी।
आप जानते हैं कि अम्लों का स्वाद खट्टा होता है तथा यह नीले लिटमस पत्र को लाल कर देते हैं। जबकि क्षारकों का स्वाद कड़वा होता है एवं यह लाल लिटमस पत्र को नीला कर देते हैं। लिटमस एक प्राकृतिक सूचक होता है। इसी प्रकार हल्दी (turmeric) भी एक एेसा ही सूचक है। क्या आपने कभी ध्यान दिया है कि श्वेत कपड़े पर लगे सब्जी के दाग पर जब क्षारकीय प्रकृति वाला साबुन रगड़ते हैं तब उस धब्बे का रंग भूरा-लाल हो जाता है? लेकिन कपड़े को अत्यधिक जल से धोने के पश्चात् वह फिर से पीले रंग का हो जाता है। अम्ल एवं क्षारक की जांँच के लिए आप संश्लेषित (synthetic) सूचक जैसे मेथिल अॉरेंज (methyl orange) एवं फीनॉल्फथेलिन (phenolphthalein) का भी उपयोग कर सकते हैं।
इस अध्याय में हम अम्ल एवं क्षारक की अभिक्रियाओं के बारे में अध्ययन करेंगे। हमें जानकारी प्राप्त होगी कि अम्ल एवं क्षारक कैसे एक दूसरे के प्रभाव को समाप्त कर देते हैं। साथ ही दैनिक जीवन में पायी जाने वाली तथा उपयोग में आने वाली बहुत सी रोचक वस्तुओं के बारे में भी हम अध्ययन करेंगे।
क्या आप जानते है
लिटमस विलयन बैंगनी रंग का रंजक होता है जो थैलोफ़ाइटा समूह के लिचेन (lichen) पौधे से निकाला जाता है। प्रायः इसे सूचक की तरह उपयोग किया जाता है। लिटमस विलयन जब न तो अम्लीय होता है न ही क्षारकीय, तब यह बैंगनी रंग का होता है। बहुत सारे प्राकृतिक पदार्थ; जैसे–लाल पत्ता गोभी, हल्दी, हायड्रेंजिया, पेटूनिया एवं जेरानियम जैसे कई फूलों की रंगीन पंखुड़ियाँ किसी विलयन में अम्ल एवं क्षारक की उपस्थिति को सूचित करते हैं। इन्हें अम्ल-क्षारक सूचक या कभी-कभी केवल सूचक कहते हैं।
प्रश्न
2.1 अम्ल एवं क्षारक के रासायनिक गुणधर्म समझना
2.1.1 प्रयोगशाला में अम्ल एवं क्षारक
क्रियाकलाप 2.1
विज्ञान की प्रयोगशाला से हाइड्रोक्लोरिक अम्ल (HCl), सल्फ़्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3), एेसीटिक अम्ल (CH3COOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्सियम हाइड्रॉक्साइड ([Ca(OH) 2])]पोटैशियम हाइड्रॉक्साइड(KOH) मैग्नीशियम हाइड्रॉक्साइड ([Mg(OH) 2]) एवं अमोनियम हाइड्रॉक्साइड(NH4OH) के विलयनों के नमूने एकत्र कीजिए।
ऊपर दिए गए प्रत्येक विलयन की एक बूँद वाच ग्लास में बारी-बारी से रखिए एवं सारणी 2.1 के अनुसार निम्नलिखित सूचकों से उसकी जाँच कीजिए।
लाल लिटमस, नीले लिटमस, फेनॉलप्थेलियन एवं मेथिल अॉरेंज विलयन के साथ लिए गए विलयन के रंग में क्या-क्या परिवर्तन होते हैं?
अपने प्रेक्षण को सारणी 2.1 में लिखिए।
रंग में परिवर्तन के द्वारा यह सूचक हमें बताते हैं कि कोई पदार्थ अम्ल है या क्षारक। कुछ एेसे पदार्थ होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में भिन्न हो जाती है। इन्हें गंधीय (Olfactory) सूचक कहते हैं। आइए इनमें से कुछ सूचकों की जाँच करें।
क्रियाकलाप 2.2
बारीक कटी हुई प्याज तथा स्वच्छ कपड़े के टुकड़े को एक प्लास्टिक के थैले में लीजिए। थैले को कस कर बाँध दीजिए तथा पूरी रात फ्रिज में रहने दीजिए। अब इस कपड़े के टुकड़े का उपयोग अम्ल एवं क्षारक की जांँच के लिए किया जा
सकता है।
इसमें से दो टुकड़े लीजिए एवं उनकी गंध की जाँच कीजिए।
इन्हें स्वच्छ सतह पर रखकर उनमें से एक टुकड़े पर तनु HCl विलयन की कुछ बूँदें एवं दूसरे पर तनु NaOH विलयन की कुछ बूँदें डालिए।
दोनों टुकड़ों को जल से धोकर उनकी गंध की पुनः जाँच कीजिए।
अपने प्रेक्षणों को लिखिए।
अब थोड़ा तनु वैनिला एवं लौंग का तेल लीजिए तथा इनकी गंधों की जाँच कीजिए।
एक परखनली में तनु HCl विलयन एवं दूसरी में तनु NaOH का विलयन लीजिए। दोनों में तनु वैनिला एसेंस की कुछ बूँदें डालकर उसे हिलाइए। उसकी गंध की पुनः जाँच कीजिए। यदि गंध में कोई बदलाव है तो उसे दर्ज़ कीजिए।
इसी प्रकार तनु HCl एवं तनु NaOH के साथ लौंग के तेल (clove oil) की गंध में आए परिवर्तन की जाँच कर अपने प्रेक्षण को दर्ज़ कीजिए।
आपके प्रेक्षण के आधार पर वैनिला, प्याज एवं लौंग के तेल में से किसे गंधीय (olfactory) सूचक की तरह उपयोग किया जा सकता है?
अम्ल एवं क्षारक के रासायनिक गुणधर्मों को समझने के लिए आइए कुछ और क्रियाकलाप करते हैं।
2.1.2 अम्ल एवं क्षारक धातु के साथ कैसे अभिक्रिया करते हैं?
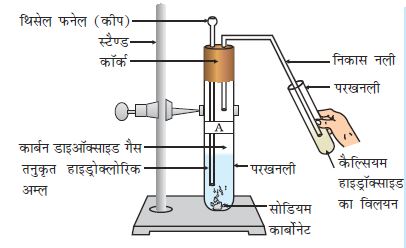
क्रियाकलाप 2.3
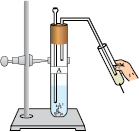
चित्र 2.1 के अनुसार उपकरण व्यवस्थित कीजिए।
एक परखनली में लगभग 5 mL तनु सल्फ़्यूरिक अम्ल लीजिए एवं इसमें दानेदार जिंक के टुकड़े डालिए।
दानेदार जिंक के टुकड़ों की सतह पर आप क्या देखते हैं?
उत्सर्जित गैस को साबुन के विलयन से प्रवाहित कीजिए।
साबुन के विलयन में बुलबुले क्यों बनते हैं?
जलती हुई मोमबत्ती को गैस वाले बुलबुले के पास ले जाइए।
आप क्या प्रेक्षण करते हैं?
कुछ अन्य अम्ल जैसे HCl, HNO3 एवं CH 3COOH के साथ यह क्रियाकलाप दोहराइए।
प्रत्येक स्थिति में आपका प्रेक्षण समान है या भिन्न?
चित्र 2.1 दानेदार जिंक के टुकड़ों के साथ तनु सल्फ़्यूरिक की अभिक्रिया एवं ज्वलन द्वारा हाइड्रोजन गैस की जाँच
ध्यान दीजिए कि ऊपर दी गई अभिक्रियाओं में धातु, अम्लों से हाइड्रोजन परमाणुओं का हाइड्रोजन गैस के रूप में विस्थापन करती है और एक यौगिक बनाता है जिसे लवण कहते हैं। अम्ल के साथ धातु की अभिक्रिया को इस प्रकार व्यक्त कर सकते हैंः
अम्ल + धातु → लवण + हाइड्रोजन गैस
आपने जिन अभिक्रियाओं का प्रेक्षण किया है, क्या आप उनका समीकरण लिख सकते हैं?
क्रियाकलाप 2.4
एक परखनली में जिंक के कुछ दानेदार टुकड़े रखिए।
उसमें 2 mL सोडियम हाइड्रॉक्साइड का घोल मिला कर उसे गर्म कीजिए।
तत्पश्चात, क्रियाकलाप 2.3 के अनुसार क्रियाओं को दोहराइए एवं अपने प्रेक्षण को लिखिए।
इस अभिक्रिया को निम्न प्रकार से लिख सकते हैंः
2NaOH(aq) + Zn(s) → Na2ZnO2(s) + H2(g)
(सोडियम जिंकेट)
आप देखेंगे कि अभिक्रिया में पुनः हाइड्रोजन बनता है। किंतु एेसी अभिक्रियाएँ सभी धातुओं के साथ संभव नहीं हैं।
2.1.3 धातु कार्बोनेट तथा धातु हाइड्रोजनकार्बोनेट अम्ल के साथ कैसे अभिक्रिया करते हैं?
चित्र 2.2
कैल्सियम हाइड्रॉक्साइड में से कार्बन डाइअॉक्साइड गैस को गुज़ारना
क्रियाकलाप 2.5
दो परखनलियाँ लीजिए। उन्हें ‘A’ एवं ‘B’ से नामांकित कीजिए।
परखनली ‘A’ में लगभग 0.5 g सोडियम कार्बोनेट (Na2CO3) लीजिए एवं परखनली ‘B’ में 0.5 g सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) लीजिए।
दोनों परखनलियों में लगभग 2 mL तनु HCl मिलाइए।
आपने क्या निरीक्षण किया?
चित्र 2.2 के अनुसार प्रत्येक स्थिति में उत्पादित गैस को चूने के पानी (कैल्सियम हाइड्रॉक्साइड का विलयन) से प्रवाहित कीजिए एवं अपने निरीक्षणों को अभिलिखित कीजिए।
उपरोक्त क्रियाकलाप में होने वाली अभिक्रियाओं को इस प्रकार लिखा जाता हैः
परखनली ‘A’ : 
परखनली ‘B’ : 
उत्पादित कार्बन डाइअॉक्साइड गैस को चूने के पानी से प्रवाहित करने पर,
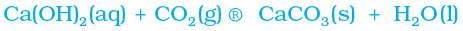
(चूने का पानी) (श्वेत अवक्षेप)
अत्यधिक मात्रा में कार्बन डाइअॉक्साइड प्रवाहित करने पर निम्न अभिक्रिया होती हैः

(जल में विलयशील)
चूना-पत्थर (limestone), खड़िया (chalk) एवं संगमरमर (marble) कैल्सियम कार्बोनेट के विविध रूप हैं। सभी धातु कार्बोनेट एवं हाइड्रोजनकार्बोनेट अम्ल के साथ अभिक्रिया करके संगत लवण, कार्बन डाइअॉक्साइड एवं जल बनाते हैं।
इस अभिक्रिया को इस प्रकार से व्यक्त कर सकते हैंः
धातु कार्बोनेट/धातु हाइड्रोजनकार्बोनेट + अम्ल → लवण + कार्बन डाइअॉक्साइड +जल
2.1.4 अम्ल एवं क्षारक परस्पर कैसे अभिक्रिया करते हैं?
क्रियाकलाप 2.6
परखनली में लगभग 2 mL NaOH का घोल लीजिए एवं उसमें दो बूँदें फीनॉल्फथैलिन विलयन डालिए।
विलयन का रंग क्या है?
इस विलयन में एक-एक बूँद तनु HCl विलयन मिलाइए।
क्या अभिक्रिया मिश्रण के रंग में कोई परिवर्तन आया?
अम्ल मिलाने के बाद फीनॉल्फथैलिन का रंग क्यों बदल गया?
अब उपरोक्त मिश्रण में NaOH की कुछ बूँदें मिलाइए।
क्या फीनॉल्फथैलिन पुनः गुलाबी रंग का हो गया?
आपके विचार से एेसा क्यों होता है?
उपरोक्त क्रियाकलाप में हमने प्रेक्षण किया कि अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है। अभिक्रिया को इस प्रकार लिख सकते हैंः
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
अम्ल एवं क्षारक की अभिक्रिया के परिणामस्वरूप लवण तथा जल प्राप्त होते हैं तथा इसे उदासीनीकरण अभिक्रिया कहते हैं। सामान्यतः उदासीनीकरण अभिक्रिया को इस प्रकार लिख सकते हैंः
क्षारक + अम्ल → लवण + जल
2.1.5 अम्लों के साथ धात्विक अॉक्साइडों की अभिक्रियाएँ
क्रियाकलाप 2.7
बीकर में कॉपर अॉक्साइड की अल्प मात्रा लीजिए एवं हिलाते हुए उसमें धीरे-धीरे तनु हाइड्रोक्लोरिक अम्ल मिलाइए।
विलयन के रंग पर ध्यान दीजिए। कॉपर अॉक्साइड का क्या हुआ?
आप देखेंगे कि विलयन का रंग नील-हरित हो जाएगा एवं कॉपर अॉक्साइड घुल जाता है। विलयन का नील-हरित रंग अभिक्रिया में कॉपर (II) क्लोराइड के बनने के कारण होता है। धातुु अॉक्साइड एवं अम्ल के बीच होने वाली सामान्य अभिक्रिया को इस प्रकार लिख सकते हैंः
धातु अॉक्साइड + अम्ल → लवण + जल
अब उपरोक्त अभिक्रिया के लिए समीकरण लिखकर उसे संतुलित कीजिए। क्षारक एवं अम्ल की अभिक्रिया के समान ही धात्विक अॉक्साइड अम्ल के साथ अभिक्रिया करके लवण एवं जल प्रदान करते हैं, अतः धात्विक अॉक्साइड को क्षारकीय अॉक्साइड भी कहते हैं।
2.1.6 क्षारक के साथ अधात्विक अॉक्साइड की अभिक्रियाएँ
क्रियाकलाप 2.5 में आपने कार्बन डाइअॉक्साइड एवं कैल्सियम हाइड्रॉक्साइड (चूने का पानी) के बीच हुई अभिक्रिया देखी। कैल्सियम हाइड्रॉक्साइड जो एक क्षारक है, कार्बन डाइअॉक्साइड के साथ अभिक्रिया करके लवण एवं जल का निर्माण करता है। चूँकि यह क्षारक एवं अम्ल के बीच होने वाली अभिक्रिया के समान है, अतः हम यह निष्कर्ष निकाल सकते हैं कि अधात्विक अॉक्साइड अम्लीय प्रकृति के होते हैं।
प्रश्न
1. पीतल एवं ताँबे के बर्तनों में दही एवं खट्टे पदार्थ क्यों नहीं रखने चाहिए?
2. धातु के साथ अम्ल की अभिक्रिया होने पर सामान्यतः कौन सी गैस निकलती है? एक उदाहरण के द्वारा समझाइए। इस गैस की उपस्थिति की जाँच आप कैसे करेंगे?
3. कोई धातु यौगिक ‘A’ तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करता है तो बुदबुदाहट उत्पन्न होती है। इससे उत्पन्न गैस जलती मोमबत्ती को बुझा देती है। यदि उत्पन्न यौगिकों में एक से कैल्सियम क्लोराइड हैं, तो इस अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
2.2 सभी अम्लों एवं क्षारकों में क्या समानताएँ हैं?
अनुभाग 2.1 में हमने देखा कि सभी अम्लों में समान रासायनिक गुणधर्म होते हैं। गुणधर्मों में समानता क्यों होती है? हमने क्रियाकलाप 2.3 में देखा कि धातु के साथ अभिक्रिया करने पर सभी अम्ल हाइड्रोजन गैस उत्पन्न करते हैं। इससे पता चलता है कि सभी अम्लों में हाइड्रोजन होता है। आइए, एक क्रियाकलाप के माध्यम से हम जाँच करें कि क्या हाइड्रोजन युक्त सभी यौगिक अम्लीय होते हैं।
क्रियाकलाप 2.8
ग्लूकोज़, एेल्कोहॉल, हाइड्रोक्लोरिक अम्ल, सल्फ्यूरिक अम्ल आदि का विलयन लीजिए।
एक कॉर्क पर दो कीलें लगाकर कॉर्क को 100 mL के बीकर में रख दीजिए।
चित्र 2.3 के अनुसार कीलों को 6 वोल्ट की एक बैटरी के दोनों टर्मिनलों के साथ एक बल्ब तथा स्विच के माध्यम से जोड़ दीजिए।
अब बीकर में थोड़ा तनु HCl डालकर विद्युत धारा प्रवाहित कीजिए।
इसी क्रिया को तनु सल्फ्यूरिक अम्ल के साथ दोहराइए।
आपने क्या प्रेक्षण किया?
इन परीक्षणों को ग्लूकोज़ एवं एेल्कोहॉल के विलयनों के साथ अलग-अलग दोहराइए। अब आपने क्या प्रेक्षण किया?
बल्ब क्या प्रत्येक स्थिति में जलता है?
चित्र 2.3
जल में अम्ल का विलयन विद्युत चालन करता है
अम्ल की स्थिति में बल्ब जलने लगता है जैसा कि चित्र 2.3 में दिखाया गया है। परंतु आप यह देखेंगे कि ग्लूकोज़ एवं एेल्कोहॉल का विलयन विद्युत का चालन नहीं करते हैं। बल्ब के जलने से यह पता चलता है कि इस विलयन से विद्युत का प्रवाह हो रहा है। अम्लीय विलयन में विद्युत धारा का प्रवाह अम्ल में उपस्थित इन्हीं आयनों द्वारा होता है।
अम्लों में धनायन H+ तथा ऋणायन जैसे HCl में Cl–, HNo3 में No3–, CH3CooH में CH3Coo–, H2So4 में So42- होते हैं। चूँकि अम्ल में उपस्थित धनायन H+ है, इससे ज्ञात होता है कि अम्ल विलयन में हाइड्रोजन आयन H+ (aq) उत्पन्न करता है, तथा इसी कारण उनका गुणधर्म अम्लीय होता है।
सोडियम हाइड्रॉक्साइड, कैल्सियम हाइड्रॉक्साइड आदि जैसे क्षारकों का उपयोग करके इस क्रियाकलाप को दोहराइए। इस क्रियाकलाप के परिणामों से आप क्या निष्कर्ष निकाल सकते हैं?
2.2.1 जलीय विलयन में अम्ल या क्षारक का क्या होता है?
क्या अम्ल केवल जलीय विलयन में ही आयन उत्पन्न करते हैं? आइए इसकी जाँच करें।
क्रियाकलाप 2.9
एक स्वच्छ एवं शुष्क परखनली में लगभग 1 g ठोस NaCl लीजिए तथा चित्र 2.4 के अनुसार उपकरण व्यवस्थित कीजिए।
परखनली में कुछ मात्रा में सांद्र सल्फ्यूरिक अम्ल डालिए।
आपने क्या प्रेक्षण किया? क्या निकास नली से कोई गैस बाहर आ रही है?
इस प्रकार उत्सर्जित गैस की सूखे तथा नम नीले लिटमस पत्र द्वारा जाँच कीजिए।
किस स्थिति में लिटमस पत्र का रंग परिवर्तित होता है?
उपरोक्त क्रियाकलाप के आधार पर आप निम्न के अम्लीय गुण के बारे में क्या निष्कर्ष निकाल सकते हैंः
(i) शुष्क HCl गैस (ii) HCl विलयन?
अध्यापकों के लिए निर्देशः यदि जलवायु अत्यधिक आर्द्र हो तो गैस को शुष्क करने के लिए आपको कैल्सियम क्लोराइड वाली शुष्क नली से गैस प्रवाहित करना होगा।
इस प्रयोग से यह स्पष्ट होता है कि जल की उपस्थिति में HCl में हाइड्रोजन आयन उत्पन्न होते हैं। जल की अनुपस्थिति में HCl अणुओं से H+ आयन पृथक नहीं हो सकते हैं।
HCl + H2O → H3O+ + Cl–
हाइड्रोजन आयन स्वतंत्र रूप में नहीं रह सकते लेकिन ये जल के अणुओं के साथ मिलकर रह सकते हैं। इसलिए हाइड्रोजन आयन को सदैव H+(aq) या हाइड्रोनियम आयन (H3O+) से दर्शाना चाहिए।
H+ + H2O → H3O+
हमने देखा कि अम्ल जल में H3O+ अथवा H+(aq) आयन प्रदान करता है। आइए देखें कि किसी क्षारक को जल में घोलने पर क्या होता हैः
क्षारक जल में हाइड्रॉक्साइड (OH–) आयन उत्पन्न करते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं।
क्या आप जानते है
अब तक हम जान चुके हैं कि सभी अम्ल H+(aq) तथा सभी क्षारक OH– (aq) उत्पन्न करते हैं, अतः अब हम उदासीनीकरण अभिक्रिया को निम्नलिखित रूप में व्यक्त कर सकते हैं।
अम्ल + क्षारक → लवण + जल
H X + M OH → MX + HOH
H+(aq) + OH– (aq) → H2O(l)
आइए देखें कि अम्ल या क्षारक में जल मिलाने पर क्या होता है
क्रियाकलाप 2.10
एक बीकर में 10 mL जल लीजिए।
इसमें कुछ बूँदें सांद्र सल्फ्यूरिक अम्ल (H2SO4) की डालकर बीकर धीरे-धीरे घुमाइए।
बीकर के आधार को स्पर्श कीजिए।
क्या तापमान में कोई परिवर्तन आया?
यह प्रक्रिया क्या उष्माक्षेपी अथवा ऊष्माशोषी है?
उपर्युक्त क्रियाकलाप को सोडियम हाइड्रॉक्साइड के साथ दोहराइए एवं अपने प्रेक्षण को लिखिए।
जल में अम्ल या क्षारक के घुलने की प्रक्रिया अत्यंत ऊष्माक्षेपी होती है। जल में सांद्र नाइट्रिक अम्ल या सल्फ़्यूरिक अम्ल को मिलाते समय अत्यंत सावधानी रखनी चाहिए। अम्ल को सदैव धीरे-धीरे तथा जल को लगातार हिलाते हुए जल में मिलाना चाहिए। सांद्र अम्ल में जल मिलाने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फलित होकर बाहर आ सकता है तथा आप जल सकते हैं। साथ ही अत्यधिक स्थानीय ताप के कारण प्रयोग में उपयोग किया जा रहा काँच का पात्र भी टूट सकता है। सांद्र सल्फ़्यूरिक अम्ल के कैन (डिब्बा) तथा सोडियम हाइड्रॉक्साइड की बोतल पर चेतावनी के चिह्न (चित्र 2.5 में प्रदर्शित) पर ध्यान दीजिए।
जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता (H3O+/OH–) में प्रति इकाई आयतन में कमी हो जाती है। इस प्रक्रिया को तनुकरण कहते हैं एवं अम्ल या क्षारक तनुकृत होते हैं।
प्रश्न
1. HCl, HNO3 आदि जलीय विलयन में अम्लीय अभिलक्षण क्यों प्रदर्शित करते हैं, जबकि एेल्कोहॉल एवं ग्लूकोज़ जैसे यौगिकों के विलयनों में अम्लीयता के अभिलक्षण नहीं प्रदर्शित होते हैं?
2. अम्ल का जलीय विलयन क्यों विद्युत का चालन करता है?
3. शुष्क हाइड्रोक्लोरिक गैस शुष्क लिटमस पत्र के रंग को क्यों नहीं बदलती है?
4. अम्ल को तनुकृत करते समय यह क्यों अनुशंसित करते हैं कि अम्ल को जल में मिलाना चाहिए, न कि जल को अम्ल में?
5. अम्ल के विलयन को तनुकृत करते समय हाइड्रोनियम आयन (H3O+) की सांद्रता कैसे प्रभावित हो जाती है?
6. जब सोडियम हाइड्रॉक्साइड विलयन में आधिक्य क्षारक मिलाते हैं तो हाइड्रॉक्साइड आयन (OH– ) की सांद्रता कैसे प्रभावित होती है?
2.3 अम्ल एवं क्षारक के विलयन कितने प्रबल होते हैं?
हम जानते हैं कि अम्ल-क्षारक के सूचकों का उपयोग करके अम्ल एवं क्षारक में अंतर प्रदर्शित किया जा सकता है। पिछले अध्याय में हमने H+ अथवा OH– आयनों के विलयनों की सांद्रता कम होना तथा तनुकरण के बारे में पढ़ा था। क्या हम किसी विलयन में उपस्थित आयनों की संख्या जान सकते हैं? क्या हम ज्ञात कर सकते हैं कि विलयन में अम्ल अथवा क्षारक कितना प्रबल है?
इसको जानने के लिए हम सार्वत्रिक सूचक जो अनेक सूचकों का मिश्रण होता है, का उपयोग करके ज्ञात कर सकते हैं। सार्वत्रिक सूचक किसी विलयन में हाइड्रोजन आयन की विभिन्न सांद्रता को विभिन्न रंगों में प्रदर्शित करते हैं।
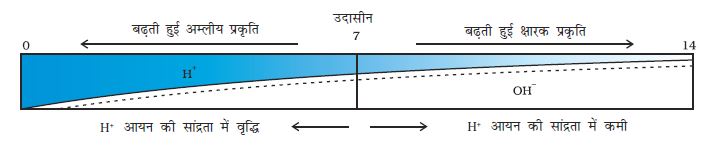
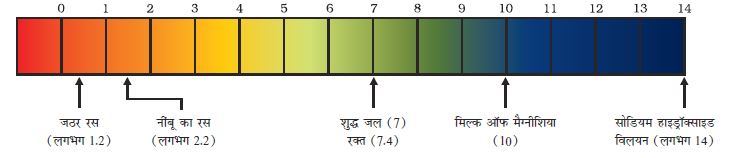
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया जिसे pH स्केल कहते हैं। इस pH में p सूचक है, ‘पुसांस’ (Potenz) जो एक जर्मन शब्द है, का अर्थ होता है ‘शक्ति’। इस pH स्केल से सामान्यतः शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। साधारण भाषा pH को एक एेसी संख्या के रूप में देखना चाहिए जो किसी विलयन की अम्लता अथवा क्षारकीयता को दर्शाते हैं। हाइड्रोनियम आयन की सांद्रता जितनी अधिक होगी उसका pH उतना ही कम होगा।
किसी भी उदासीन विलयन के pH का मान 7 होगा। यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय विलयन होगा एवं यदि pH मान 7 से 14 तक बढ़ता है तो वह विलयन में OH– की सांद्रता में वृद्धि को दर्शाता है, अर्थात यहाँ क्षार की शक्ति बढ़ रही है (चित्र 2.6)। सामान्यतः pH सार्वत्रिक सूचक अंतर्भारित पेपर द्वारा ज्ञात किया जाता है।
चित्र 2.6 H+(aq) एवं OH–(aq) की सांद्रता परिवर्तन के साथ pH की विभिन्नता
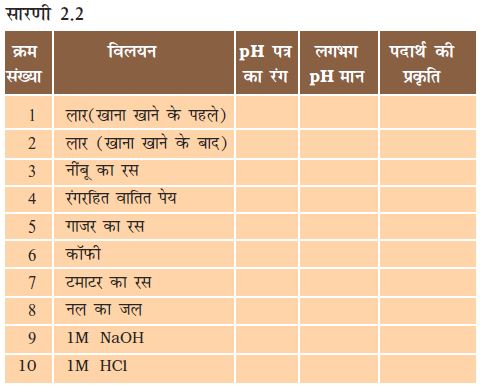
क्रियाकलाप 2.11
दी गई सारणी 2.2 में विलयन के pH मानों की जाँच कीजिए।
अपने प्रेक्षणों को लिखिए।
आपके प्रेक्षणों के आधार पर प्रत्येक पदार्थ की प्रकृति क्या है?
चित्र 2.7 कुछ सामान्य पदार्थों के pH को pH पत्र पर दिखाया गया है (रंग केवल रफ़ मार्गदर्शन के लिए दिए गए हैं)
अम्ल तथा क्षारक की शक्ति विलयन (जल) में क्रमशः H + आयन तथा OH– आयन की संख्या पर निर्भर करती है। यदि हम समान सांद्रता के हाइड्रोक्लोरिक अम्ल तथा एेसीटिक अम्ल, जैसे एक मोलर, विलयन लेते हैं तो वह विभिन्न मात्रा में हाइड्रोजन आयन उत्पन्न करेंगे। अधिक संख्या में H + आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं, जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलाएँगे। क्या आप अब यह बता सकते हैं कि दुर्बल एवं प्रबल क्षारक क्या होते हैं?
2.3.1 दैनिक जीवन में pH का महत्त्व
क्या पौधे एवं पशु pH के प्रति संवेदनशील होते हैं?
हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) में ही जीवित रह सकते हैं। वर्षा के जल की pH मान जब
5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है। अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। एेसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
दूसरे ग्रहों में अम्ल पदार्थ
आपके बागीचे की मिट्टी का pH क्या है?
अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है। किसी पौधे के स्वस्थ विकास के लिए आवश्यक pH को ज्ञात करने के लिए विभिन्न स्थानों से मिट्टी एकत्र कीजिए एवं क्रियाकलाप 2.12 के अनुसार उनके pH की जाँच कीजिए। इस बात पर भी ध्यान दीजिए कि जहाँ से मिट्टी ले रहे हैं वहाँ कौन से पौधे उपज रहे हैं?
क्रियाकलाप 2.12
एक परखनली में लगभग 2 g मिट्टी रखिए एवं उसमें 5 mL जल मिलाइए।
परखनली की सामग्री को हिलाइए।
सामग्रियों को छानिए एवं परखनली में निस्यंद एकत्र कीजिए।
सार्वत्रिक सूचक पत्र की सहायता से इस निस्यंद के pH की जाँच कीजिए।
अपने क्षेत्र में पौधों के उपयुक्त विकास के लिए आदर्श मिट्टी के pH के संबंध में आपने क्या निष्कर्ष निकाला?
हमारे पाचन तंत्र का pH
यह अत्यन्त रोचक है कि हमारा उदर हाइड्रोक्लोरिक अम्ल (Hydrochloric acid) उत्पन्न करता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है। इस दर्द से मुक्त होने के लिए एेन्टैसिड (antacid) जैसे क्षारकों का उपयोग किया जाता है। इस अध्याय के आरंभ में एेसा ही एक उपचार आपने अवश्य सुझाया होगा। यह एेन्टैसिड अम्ल की आधिक्य मात्रा को उदासीन करता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क अॉफ मैगनीशिया) जैसे दुर्बल क्षारक का उपयोेग किया जाता है।
pH परिवर्तन के कारण दंत-क्षय
मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय प्रारंभ हो जाता है। दाँतों का इनैमल (दत्तवल्क) कैल्सियम हाइड्रोक्सीएपेटाइट (कैल्सियम फॉस्फेट का क्रिस्टलीय रूप) से बना होता है जो कि शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता लेकिन मुँह की pH का मान 5.5 से कम होने पर यह संक्षारित हो जाता है। मुँह में उपस्थित बैक्टीरिया, भोजन के पश्चात मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। भोजन के बाद मुँह साफ़ करने से इससे बचाव किया जा सकता है। मुँह की सफ़ाई के लिए क्षारकीय दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है जिसके परिणामस्वरूप दंत क्षय को रोका जा सकता है।
पशुओं एवं पौधों द्वारा उत्पन्न रसायनों से आत्मरक्षा
क्या कभी आपको मधुमक्खी ने डंक मारा है? मधुमक्खी का डंक एक अम्ल छोड़ता है जिसके कारण दर्द एवं जलन का अनुभव होता है। डंक मारे गए अंग में बेकिंग सोडा जैसे दुर्बल क्षारक के उपयोग से आराम मिलता है। नेटल (nettle) के डंक वाले बाल मेथैनॉइक अम्ल छोड़ जाते हैं जिनके कारण जलन वाले दर्द का अनुभव होता है।
क्या आप जानते है
प्रकृति उदासीनीकरण के विकल्प देती है

नेटल एक शाकीय पादप है जो जंगलों में उपजता है। इसके पत्तों में डंकनुमा बाल होते हैं जो अगर गलती से छू जाएँ तो डंक जैसा दर्द होता है। इन बालों से मेथैनॉइक अम्ल का स्राव होने के कारण यह दर्द होता है। पारंपरिक तौर पर इसका इलाज डंक वाले स्थान पर डॉक पौधे की पत्ती रगड़कर किया जाता है। ये पौधे अधिकतर नेटल के पास ही पैदा होते हैं। क्या आप डॉक पौधे की प्रकृति का अनुमान लगा सकते हैं? आप अब जान गए होंगे कि अगली बार पहाड़ों पर चढ़ते हुए गलती से नेटल पौधे के छू जाने पर आपको क्या करना होगा? क्या आप एेसे ही पारंपरिक इलाज जानते हैं जो डंक लगने पर प्रभावी हों?
सारणी 2.3 कुछ प्राकृतिक अम्ल

प्रश्न
1. आपके पास दो विलयन ‘A’ एवं ‘B’ हैं। विलयन ‘A’ के pH का मान 6 है एवं विलयन ‘B’ के pH का मान 8 है। किस विलयन में हाइड्रोजन आयन की सांद्रता अधिक है? इनमें से कौन अम्लीय है तथा कौन क्षारकीय?
2. H+(aq) आयन की सांद्रता का विलयन की प्रकृति पर क्या प्रभाव पड़ता है?
3. क्या क्षारकीय विलयन में H+(aq) आयन होते हैं? अगर हाँ, तो यह क्षारकीय क्यों होते हैं?
4. कोई किसान खेत की मृदा की किस परिस्थिति में बिना बुझा हुआ चूना (कैल्सियम अॉक्साइड), बुझा हुआ चूना (कैल्सियम हाइड्रॉक्साइड) या चॉक (कैल्सियम कार्बोनेट) का उपयोग करेगा?
2.4 लवण के संबंध में अधिक जानकारी
पिछले भागों में हमने विभिन्न अभिक्रियाओं के द्वारा लवणों का निर्माण होते देखा है। आइए, इनके निर्माण, गुणधर्म एवं उपयोग के बारे में अधिक जानकारी प्राप्त करें।
2.4.1 लवण परिवार
क्रियाकलाप 2.14
नीचे दिए गए लवण के रासायनिक सूत्र लिखिए
पोटैशियम सल्फ़ेट, सोडियम सल्फ़ेट, कैल्सियम सल्फ़ेट, मैग्नीशियम सल्फ़ेट, कॉपर सल्फ़ेट, सोडियम क्लोराइड, सोडियम नाइट्रेट, सोडियम कार्बोनेट एवं अमोनियम क्लोराइड।
उन अम्ल एवं क्षारक की पहचान कीजिए जिससे उपरोक्त लवण प्राप्त किए जा सकते हैं।
समान धन या ऋण मूलक वाले लवणों को एक ही परिवार का कहा जाता है। जैसे, NaCl एवं Na2SO4, सोडियम लवण के परिवार का है। इसी प्रकार NaCl एवं KCl क्लोराइड लवण के परिवार के हैं। इस क्रियाकलाप में दिए गए लवणों में आप कितने परिवारों की पहचान कर सकते हैं?
2.4.2 लवणों का pH
क्रियाकलाप 2.14
निम्नलिखित लवणों के नमूने एकत्र कीजिए–
सोडियम क्लोराइड, पोटैशियम नाइट्रेट, एेलुमिनियम क्लोराइड, जिंक सल्फ़ेट, कॉपर सल्फ़ेट, सोडियम एेसीटेट, सोडियम कार्बोनेट एवं सोडियम हाइड्रोजनकार्बोनेट (कुछ अन्य लवण जो उपलब्ध हाें)
जल में इनकी विलेयता की जाँच कीजिए (केवल आसवित जल का उपयोग कीजिए)।
लिटमस पर इन विलयनों की क्रिया की जाँच कीजिए एवं pH पेेपर का उपयोग कर इनके pH के मान का पता लागाइए।
कौन से लवण अम्लीय, क्षारकीय या उदासीन हैं?
लवण बनाने के लिए उपयोग होने वाले अम्ल या क्षारक की पहचान कीजिए।
अपने प्रेक्षणों को सारणी 2.4 में लिखिए।
सारणी 2.4

प्रबल अम्ल एवं प्रबल क्षारक के लवण के pH का मान 7 होता है तथा ये उदासीन होते हैं। जबकि प्रबल अम्ल एवं दुर्बल क्षारक के लवण के pH का मान 7 से कम होता है तथा ये अम्लीय होते हैं। प्रबल क्षारक एवं दुर्बल अम्ल के लवण के pH का मान 7 से अधिक होता है तथा ये क्षारकीय होते हैं।
2.4.3 साधारण नमक से रसायन
आप जानते हैं कि हाइड्रोक्लोरिक अम्ल एवं सोडियम हाइड्रॉक्साइड के विलयन की अभिक्रिया से उत्पन्न लवण को सोडियम क्लोराइड कहते हैं। इसी लवण का हम अपने भोजन में उपयोग करते हैं। ऊपर के क्रियाकलाप में आपने देखा होगा कि यह एक उदासीन लवण है।
समुद्री जल में कई प्रकार के लवण घुले होते हैं। इन लवणों से सोडियम क्लोराइड को पृथक किया जाता है। विश्व के कई भागों में भी ठोस लवण का निक्षेप होता है। बड़े आकार के यह क्रिस्टल प्रायः अपद्रव्यों के कारण भूरे रंग के होते हैं। इसे खनिज नमक कहते हैं। यह खनिज नमक तब बने जब युगों के व्यतीत होने के साथ समुद्र का कोई हिस्सा सूख गया। खनिज नमक का खनन भी कोयले की तरह होता है।
आपने महात्मा गांधी के दांडी यात्रा के बारे में अवश्य सुना होगा। क्या आप जानते हैं कि हमारे स्वतंत्रता संग्राम में नमक एक महत्वपूर्ण प्रतीक था?

साधारण नमक–रसायनों का कच्चा पदार्थ
इस प्रकार प्राप्त साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों; जैसे–सोडियम हाइड्रॉक्साइड, बेकिंग सोडा, वाशिंग सोडा, विरंजक चूर्ण आदि के लिए एक महत्वपूर्ण कच्चा पदार्थ है। आइए देखते हैं कि कैसे एक पदार्थ का उपयोग विभिन्न पदार्थ बनाने के लिए करते हैं।
सोडियम हाइड्रॉक्साइड
सोडियम क्लोराइड के जलीय विलयन (लवण जल) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर-क्षार प्रक्रिया कहते हैं क्योंकि इससे निर्मित उत्पाद - क्लोरीन (क्लोर) एवं सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
क्लोरीन गैस एेनोड पर मुक्त होती है एवं हाइड्रोजन गैस कैथोड पर। कैथोड पर सोडियम हाइड्रॉक्साइड विलयन का निर्माण भी होता है। इस प्रक्रिया से उत्पन्न हुए तीनों उत्पाद उपयोगी हैं। चित्र 2.8 इन उत्पादों के विभिन्न उपयोगों को दर्शाता है।
विरंजक चूर्ण
आप जानते हैं कि जलीय सोडियम क्लोराइड (लवण जल) के विद्युत अपघटन से क्लोरीन का निर्माण होता है। इस क्लोरीन गैस का उपयोग विरंजक चूर्ण के उत्पादन के लिए किया जाता है। शुष्क बुझा हुआ चूना [Ca(OH)2] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है। विरंजक चूर्ण को CaOCl2 से दर्शाया जाता है यद्यपि वास्तविक संगठन काफ़ी जटिल होता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंचक चूर्ण का उपयोगः
(i) वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के लिए कागज़ की फैक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ़ कपड़ाें के विरंजन के लिए
(ii) कई रासायनिक उद्योगों में एक उपचायक के रूप में, एवं
(iii) पीने वाले जल को जीवाणुओं से मुक्त करने के लिए।
बेकिंग सोडा
बेकिंग सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े आदि बनाने के लिए किया जाता है। कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है। इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) है। इसको बनाने में सोडियम क्लोराइड का उपयोग एक मूल पदार्थ के रूप में किया जाता है।

(अमोनियम (सोडियम
क्लोराइड) हाइड्रोजनकार्बोनेट)
क्रियाकलाप 2.14 में क्या आपने सोडियम हाइड्रोजनकार्बोनेट के pH के मान की जाँच की थी? क्या आप सह संबंध स्थापित कर सकते हैं, कि क्यों इसका उपयोग एक अम्ल को उदासीन करने में किया जाता है? यह एक दुर्बल असंक्षारक क्षारीय लवण है। खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती हैः
सोडियम हाइड्रोजनकार्बोनेट का उपयोग हमारे घरों में अनेक प्रकार से किया जाता है।
बेकिंग सोडा का उपयोग
(i) बेकिंग पाउडर बनाने में, जो बेकिंग सोडा (सोडियम हाइड्रोजनकार्बोनेट) एवं टार्टरिक अम्ल जैसा एक मंद खाद्य अम्ल का मिश्रण है। जब बेकिंग पाउडर को गर्म किया जाता है या जल में मिलाया जाता है तो निम्न अभिक्रिया होती हैः
NaHCO3 + H+ → CO2 + H2O + अम्ल का सोडियम लवण
(किसी अम्ल से)
इस अभिक्रिया से उत्पन्न कार्बन डाइअॉक्साइड के द्वारा पावरोटी या केक में खमीर उठाया (फूल/उभर) जा सकता है तथा इससे ये मुुलायम एवं स्पंजी हो जाता है।
(ii) सोडियम हाइड्रोजनकार्बोनेट भी एेन्टैसिड का एक संघटक है। क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुँचाता है।
(iii) इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
धोने का सोडा
Na2CO3.10H2 O (धोने का सोडा) एक अन्य रसायन जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। आप ऊपर देख चुके हैं कि बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है। सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।

(सोडियम कार्बोनेट)
10H2O क्या दर्शाता है? क्या यह Na2CO3 को आर्द्र बनाता है? हम इसका जबाब अगले भाग में पढ़ेंगे।
सोडियम कार्बोनेट एवं सोडियम हाइड्रोजनकार्बोनेट, कई औद्योगिक प्रक्रियाओं के लिए भी उपयोगी रसायन है।
धोने के सोडे के उपयोग
(i) सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज़ उद्योगों में होता है।
(ii) इसका उपयोग बोरेक्स जैसे सोडियम यौगिक के उत्पादन में होता है।
(iii) सोडियम कार्बोनेट का उपयोग घरों में साफ़-सफ़ाई के लिए होता हैै।
(iv) जल की स्थायी कठोरता को हटाने के लिए इसका उपयोग होता है।
2.4.4 क्या लवण के क्रिस्टल वास्तव में शुष्क हैं?
क्रियाकलाप 2.15
कॉपर सल्फ़ेट के कुछ क्रिस्टल को शुष्क क्वथन नली में गर्म कीजिए।
गर्म करने के बाद कॉपर सल्फ़ेट का रंग क्या है?
क्वथन नली में क्या जल की बूँदें नज़र आती हैं? ये कहाँ से आईं?
गर्म करने के बाद प्राप्त कॉपर सल्फ़ेट के नमूने में जल की 2-3 बूँदें डालिए।
आप क्या प्रेक्षण करते हैं? क्या कॉपर सल्फ़ेट का नीला रंग वापस आ जाता है?
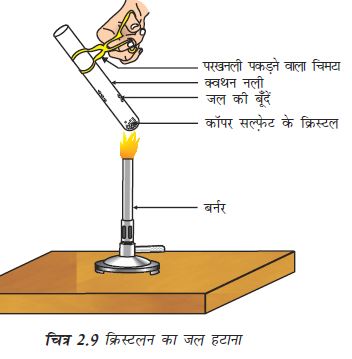
शुष्क दिखने वाले कॉपर सल्फ़ेट क्रिस्टलों में क्रिस्टलन का जल होता है। जब हम क्रिस्टल को गर्म करते हैं तो यह जल हट जाता है एवं लवण का रंग श्वेत हो
जाता है।
यदि आप क्रिस्टल को पुनः जल से भिगोते हैं तो क्रिस्टल का नीला रंग वापस आ जाता है।
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं। कॉपर सल्फ़ेट के एक सूत्र इकाई में जल के पाँच अणु उपस्थित होते हैं। जलीय कॉपर सल्फ़ेट का रासायनिक सूत्र CuSO4.5H2O है। क्या आप अब बता सकते हैं कि Na 2CO 3.10H 2O का अणु आर्द्र है या नहीं।
जिप्सम एक अन्य लवण है जिसमें क्रिस्टलन का जल होता है। इसमें क्रिस्टलन के जल के दो अणु होते हैं। इसका रासायनिक सूत्र CaSO4.2H2O है। अब हम इस लवण के उपयोगों पर ध्यान देते हैं।
प्लास्टर अॉफ पेरिस
जिप्सम को 373 K पर गर्म करने पर यह जल के अणुओं का त्याग कर कैल्सियम सल्फ़ेट अर्धहाइड्रेट/हेमिहाइड्रेट(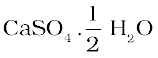 )बनाता है। इसे प्लास्टर अॉफ पेरिस कहते हैं। इस पदार्थ का उपयोग डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं। प्लास्टर अॉफ पेरिस एक सफ़ेद चूर्ण है जो जल मिलाने पर यह पुनः जिप्सम बनकर कठोर ठोस पदार्थ प्रदान करता है।
)बनाता है। इसे प्लास्टर अॉफ पेरिस कहते हैं। इस पदार्थ का उपयोग डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं। प्लास्टर अॉफ पेरिस एक सफ़ेद चूर्ण है जो जल मिलाने पर यह पुनः जिप्सम बनकर कठोर ठोस पदार्थ प्रदान करता है।
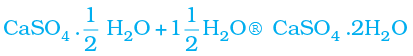
(प्लास्टर अॉफ पेरिस) (जिप्सम)
ध्यान दीजिए कि जल का केवल आधा अणु क्रिस्टलन के जल के रूप में जुड़ा होता है। जल का आधा अणु कैसे प्राप्त होता है? CaSO4 का दो इकाई सूत्र जल के एक अणु के साथ साझेदारी करते हैं। प्लास्टर अॉफ पेरिस का उपयोग खिलौना बनाने, सजावट का सामान एवं सतह को चिकना बनाने के लिए किया जाता है। पता करें कि कैल्सियम सल्फ़ेट अर्धहाइड्रेट को प्लास्टर अॉफ पेरिस क्यों कहा जाता है?
प्रश्न
1. CaOCl2 यौगिक का प्रचलित नाम क्या है?
2. उस पदार्थ का नाम बताइए जो क्लोरीन से क्रिया करके विरंजक चूर्ण बनाता है।
3. कठोर जल को मृदु करने के लिए किस सोडियम यौगिक का उपयोग किया जाता है?
4. सोडियम हाइड्रोजनकार्बोनेट के विलयन को गर्म करने पर क्या होगा? इस अभिक्रिया के लिए समीकरण लिखिए।
5. प्लास्टर अॉफ पेरिस की जल के साथ अभिक्रिया के लिए समीकरण लिखिए।
आपने क्या सीखा
अम्ल-क्षारक सूचक रंजक या रंजकों के मिश्रण होते हैं जिनका उपयोग अम्ल एवं क्षारक की उपस्थिति को सूचित करने के लिए किया जाता है।
विलयन में H+(aq) आयन के निर्माण के कारण ही पदार्थ की प्रकृति अम्लीय होती है। विलयन में OH– (aq)आयन के निर्माण से पदार्थ की प्रकृति क्षारकीय होती है।
जब कोई अम्ल किसी धातु के साथ अभिक्रिया करता है तो हाइड्रोजन गैस का उत्सर्जन होता है। साथ ही संगत लवण का निर्माण होता है।
जब क्षारक किसी धातु से अभिक्रिया करता है तो हाइड्रोजन गैस के उत्सर्जन के साथ एक लवण का निर्माण होता है जिसका ऋण आयन एक धातु एवं अॉक्सीजन के परमाणुओं से संयुक्त रूप से निर्मित होता है।
जब अम्ल किसी धातु कार्बोनेट या धातु हाइड्रोजनकार्बोनेट से अभिक्रिया करता है तो यह संगत लवण कार्बन डाइअॉक्साइड गैस एवं जल उत्पन्न करता है।
जल में अम्लीय एवं क्षारकीय विलयन विद्युत का चालन करते हैं क्योंकि ये क्रमशः हाइड्रोजन एवं हाइड्रॉक्साइड आयन का निर्माण करते हैं।
अम्ल या क्षारक की प्रबलता की जाँच pH (0-14) स्केल के उपयोग से की जा सकती है जो विलयन में हाइड्रोजन आयन की सांद्रता की माप होता है।
एक उदासीन विलयन के pH का मान 7 होता है जबकि अम्लीय विलयन के pH का मान 7 से कम एवं क्षारकीय विलयन के pH का मान 7 से अधिक होता है।
सभी जीवों में उपापचय की क्रिया pH की एक इष्टतम सीमा में होती है।
सांद्र अम्ल या क्षारक को जल के साथ मिश्रित करना एक अत्यन्त ऊष्माक्षेपी अभिक्रिया है।
अम्ल एवं क्षारक एक-दूसरे को उदासीन करके लवण एवं जल का निर्माण करते हैं।
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
हमारे दैनिक जीवन एवं उद्योगों में लवण के कई उपयोग हैं।
अभ्यास
1. कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH संभवतः क्या होगा?
(a) 1 (b) 4 (c) 5 (d) 10
2. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है जो चूने के पानी को दुधिया कर देती है। इस विलयन में क्या होगा?
(a) NaCl (b) HCl (c) LiCl (d) KCl
3. NaOH का 10 mL विलयन, HCl के 8 mL विलयन से पूर्णतः उदासीन हो जाता है। यदि हम NaOH के उसी विलयन का 20 mL लें तो इसे उदासीन करने के लिए HCl के उसी विलयन की कितनी मात्रा की आवश्यकता होगी?
(a) 4 mL
(b) 8 mL
(c) 12 mL
(d) 16 mL
4. अपच का उपचार करने के लिए निम्न में से किस औषधि का उपयोग होता है?
(a) एंटीबायोटिक (प्रतिजैविक)
(b) एेनालजेसिक (पीड़ाहरी)
(c) एेन्टैसिड
(d) एंटीसेप्टिक (प्रतिरोधी)
5. निम्न अभिक्रिया के लिए पहले शब्द-समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिएः
(a) तनु सल्फ़्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
(c) तनु सल्फ़्यूरिक अम्ल एेलुमिनियम चूर्ण के साथ अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लौह के रेतन के साथ अभिक्रिया करता है।
6. एेल्कोहॉल एवं ग्लूकोज़ जैसे यौगिकों में भी हाइड्रोजन होते हैं लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे साबित कीजिए।
7. आसवित जल विद्युत का चालक क्यों नहीं होता जबकि वर्षा जल होता है?
8. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है?
9. पाँच विलयनों A, B, C, D, व E की जब सार्वत्रिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4, 1, 11, 7 एवं 9 प्राप्त होते हैं। कौन सा विलयनः
(a) उदासीन है?
(b) प्रबल क्षारीय है?
(c) प्रबल अम्लीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
pH के मानों को हाइड्रोजन आयन की सांद्रता के आरोही क्रम में व्यवस्थित कीजिए।
10. परखनली ‘A’ एवं ‘B’ में समान लंबाई की मैग्नीशियम की पट्टी लीजिए। परखनली ‘A’ में हाइड्रोक्लोरिक अम्ल(HCl) तथा परखनली ‘B’ में एेसिटिक अम्ल (CH3COOH) डालिए। दोनों अम्लों की मात्रा तथा सांद्रता समान हैं। किस परखनली में अधिक तेज़ी से बुदबुदाहट होगी तथा क्यों?
11. ताज़े दूध के pH का मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
12. एक ग्वाला ताज़े दूध में थोड़ा बेकिंग सोडा मिलाता है।
(a) ताज़ा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है?
(b) इस दूध को दही बनने में अधिक समय क्यों लगता है?
13. प्लास्टर अॉफ पेरिस को आर्दΡ-रोधी बर्तन में क्यों रखा जाना चाहिए। इसकी व्याख्या कीजिए।
14. उदासीनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।
15. धोने का सोडा एवं बेकिंग सोडा के दो-दो प्रमुख उपयोग बताइए।
सामूहिक क्रियाकलाप
(I) आप अपना सूचक तैयार करें
खरल में चुकंदर की जड़ को पीसिए।
निष्कर्ष प्राप्त करने के लिए पर्याप्त जल मिलाइए।
पिछली कक्षाओं में पढ़ी गई विधियों द्वारा निष्कर्ष छान लीजिए।
पदार्थों की जाँच के लिए निस्यंद को एकत्र कर लिजिए। इस पदार्थ को शायद आप पहले भी चख चुके हैं।
परखनली स्टैंड में चार परखनलियों को व्यवस्थित कीजिए एवं उसे A, B, C एवं D से चिह्नित कीजिए। इन परखनलियों में क्रमशः नींबू रस का विलयन, सोडा-जल, सिरका एवं बेकिंग सोेडा का 2 mL डालिए।
प्रत्येक परखनली में चुकंदर जड़ के निचोड़ (निष्कर्ष) की 2-3 बूँदें मिलाइए एवं रंग में आए परिवर्तन पर ध्यान दीजिए। अपने प्रेक्षणों को सारणी में लिखिए।
लाल पत्ता गोभी की पत्तियों, कुछ फूल जैसे पेटुनिया (Petunia), हाइड्रेंजिया (Hydrangea) एवं जेरानियम(Geranium) की पंखुड़ी आदि जैसे कुछ प्राकृतिक पदार्थों के निचोड़ से भी आप अपना सूचक बना सकते हैं।
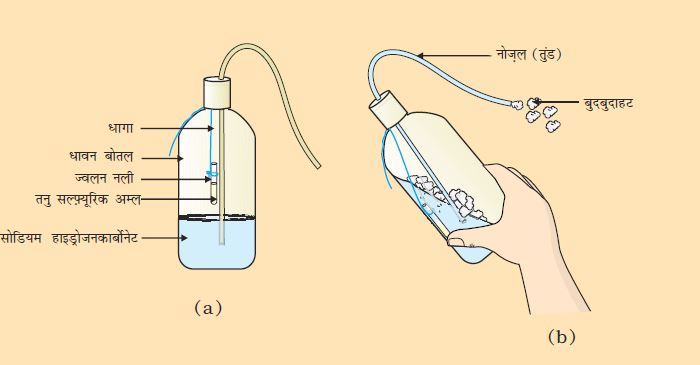
(II) सोडा-अम्ल अग्निशामक तैयार करना
कार्बन डाइअॉक्साइड उत्पन्न करने वाले अग्निशामक में धातु हाइड्रोजनकार्बोनेट के साथ अम्ल की अभिक्रिया का उपयोग होता है।
एक धावन बोतल में सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) विलयन का 20 mL विलयन लीजिए।
तनु सल्फ़्यूरिक अम्ल वाली ज्वलन नली को धावन बोतल में लटकाइए।
धावन बोतल का मुँह बंद कर दीजिए।
धावन बोतल को इस प्रकार से झुकाइए जिससे कि ज्वलन नली का अम्ल सोडियम हाइड्रोजनकार्बोनेट के विलयन से मिश्रित हो जाए।
आप देखेंगे कि नोज़ल (तुंड) से बुदबुदाहट बाहर आ रही है।
इसे एक जलती हुई मोमबत्ती की ओर लाइए। क्या होता है?
चित्र 2.10 (a) सोडियम हाइड्रोजनकार्बोनेट वाली धावन बोतल में लटकी हुई तनु सल्फ़्यूरिक अम्ल वाली ज्वलननली (b) नोज़ल से बाहर आता बुदबुदाहट