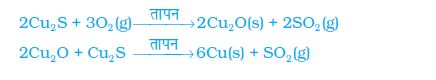Table of Contents
अध्याय 3
धातु एवं अधातु

नौवीं कक्षा में आपने कई तत्वों के बारे में पढ़ा होगा। आपने देखा कि किस प्रकार तत्वों को उनके गुणधर्मों के आधार पर धातु एवं अधातु में वर्गीकृत किया जाता है।
अपने दैनिक जीवन में धातु एवं अधातु के उपयोगों पर विचार कीजिए।
आपके विचार से कौन से गुणधर्म तत्वों को धातु एवं अधातु में वर्गीकृत
करते हैं?
किस प्रकार यह गुणधर्म इन तत्वों के उपयोग से संबंधित है? हम इनके कुछ गुणधर्मों का विस्तार से अध्ययन करेंगे।
3.1 भौतिक गुणधर्म
3.1.1 धातु
इन पदार्थों के भौतिक गुणधर्मों की तुलना करके समूहों में अलग करना सबसे आसान है। इनके अध्ययन के लिए हम निम्न क्रियाकलापाें की सहायता लेते हैं। अनुभाग 3.1 से 3.6 में दिए गए क्रियाकलापों के लिए निम्न धातुओं–आयरन, कॉपर, एेलुमिनियम, मैग्नीशियम, सोडियम, लेड, जिंक तथा आसानी से मिलने वाली कुछ अन्य धातुओं के नमूने इकट्ठे कीजिए।
क्रियाकलाप 3.1
आयरन, कॉपर, एेलुमिनियम और मैग्नीश्यिम के नमूने लीजिए। प्रत्येक नमूना कैसा दिखाई देता है उस पर ध्यान दीजिए।
रेगमाल से रगड़कर प्रत्येक नमूने की सतह को साफ़ करके उसके स्वरूप पर फिर ध्यान दीजिए।
अपने शुद्ध रूप में धातु की सतह चमकदार होती है। धातु के इस गुणधर्म को धात्विक चमक कहते हैं।
क्रियाकलाप 3.2
आयरन, कॉपर एेलुमिनियम तथा मैग्नीशियम का एक छोटा टुकड़ा लीजिए। इन धातुओं को तेज धार वाले चाकू से काटने का प्रयास कीजिए तथा अपने प्रेक्षणों को लिखिए।
चिमटे से सोडियम धातु का एक टुकड़ा पकड़िए।
सावधानीः सोडियम धातु का उपयोग करते समय हमेशा सावधान रहिए। फिल्टर पेपर के बीच दबाकर इसे सुखा लीजिए।
वाच-ग्लास पर रखकर इसे चाकू से काटने का प्रयास कीजिए।
आपने क्या देखा?
आप देखेंगे कि धातुएँ सामान्यतः कठोर होती हैं। प्रत्येक धातु की कठोरता अलग-अलग होती है।
क्रियाकलाप 3.3
आयरन, जिंक, लेड तथा कॉपर के टुकड़े लीजिए।
किसी एक धातु को लोहे के ब्लॉक (खंड) पर रखकर चार-पाँच बार हथौड़े से प्रहार कीजिए। आपने क्या देखा?
अन्य धातुओं के साथ भी यही क्रिया कीजिए।
इन धातुओं के आकार में हुए परिवर्तन को लिखिए।
आप देखेंगे कि कुछ धातुओं को पीटकर पतली चादर बनाया जा सकता है। इस गुणधर्म को आघातवर्ध्यता कहते हैं। क्या आप जानते हैं कि सोना तथा चाँदी सबसे अधिक आघातवर्ध्य धातुएँ हैं?
क्रियाकलाप 3.4
धातु के पतले तार के रूप में खींचने की क्षमता को तन्यता कहा जाता है। सोना सबसे अधिक तन्य धातु है। आपको यह जानकर आश्चर्य होगा कि एक ग्राम सोने से 2 km लंबा तार बनाया जा सकता है।
आघातवर्ध्यता तथा तन्यता के कारण धातुओं को हमारी आवश्यकता के अनुसार विभिन्न आकार दिए जा सकते हैं।
क्या आप कुछ धातुओं के नाम बता सकते हैं जिनका उपयोग खाना पकाने के बर्तन बनाने के लिए होता हैै? क्या आप जानते हैं इन धातुओं का उपयोग बर्तनों को बनाने के लिए क्यों किया जाता है? इसका उत्तर पाने के लिए आइए हम निम्न क्रियाकलाप करते हैं।
क्रियाकलाप 3.5
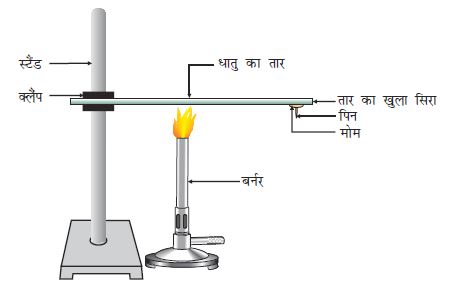
एेलुमिनियम या कॉपर का तार लीजिए। क्लैंप की मदद से इस तार को स्टैंड से बाँध दीजिए जैसा चित्र 3.1 में दिखाया गया है।
तार के खुले सिरे पर मोम का उपयोग कर एक पिन चिपका दीजिए।
स्पिरिट लैंप, मोमबत्ती या बर्नर से क्लैंप के निकट तार को गर्म कीजिए।
थोड़ी देर बाद आप क्या देखते हैं?
अपने प्रेक्षणों को लिखिए। क्या धातु का तार द्रवित होता है?
उपरोक्त क्रियाकलाप से पता चलता है कि धातु ऊष्मा के सुचालक हैं तथा इनका गलनांक बहुत अधिक होता है। सिल्वर तथा कॉपर ऊष्मा के सबसे अच्छे चालक हैं। इनकी तुलना में लेड तथा मर्करी ऊष्मा के कुचालक हैं।
चित्र 3.1 धातु उष्मा के सुचालक होते हैं
क्रियाकलाप 3.6
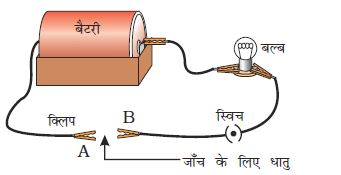
चित्र 3.2 की तरह एक विद्युत सर्किट (परिपथ) तैयार कीजिए।
जिस धातु की जाँच करनी है उसे परिपथ में टर्मिनल (A) तथा टर्मिनल (B) के बीच उसी प्रकार रखिए जैसा चित्र में दिखाया गया है।
क्या बल्ब जलता है? इससे क्या पता चलता है?
आपने अवश्य देखा होगा कि जिस तार से आपके घर तक बिजली पहुँचती है उस पर पॉलिवाइनिल क्लोराइड ( PVC) अथवा रबड़ जैसी सामग्री की परत चढ़ी होती है। विद्युत तार पर एेसे पदार्थों की परत क्यों होती है?
जब धातुएँ किसी कठोर सतह से टकराती हैं तो क्या होता है? क्या वह कोई आवाज़ उत्पन्न करती हैं? जो धातुएँ कठोर सतह से टकराने पर आवाज़ उत्पन्न करती हैं उन्हें ध्वानिक (सोनोरस) कहते हैं। क्या अब आप बता सकते हैं कि स्कूल की घंटी धातु की क्यों बनी होती है?
3.1.2 अधातु
पिछली कक्षा में आप अध्ययन कर चुके हैं कि धातुओं की तुलना में अधातुओं की संख्या कम है। कार्बन, सल्फ़र, आयोडीन, अॉक्सीजन, हाइड्रोजन आदि अधातुओं के कुछ उदाहरण हैं। ब्रोमीन एेसी अधातु है जो द्रव होती है। इसके अलावा सारी अधातुएँ या तो ठोस या फिर गैसें होती हैं। क्या धातुओं के समान अधातुओं के भी कुछ गुणधर्म होते हैं? आइए पता करते हैं।
क्रियाकलाप 3.7
कार्बन (कोल या ग्रेफाइट), सल्फ़र तथा आयोडीन के नमूने एकत्र कीजिए।
इन अधातुओं से 3.1 से 3.4 और 3.6 तक के क्रियाकलापों को दोहराइए तथा अपने प्रेक्षणों को लिखिए।
धातुओं एवं अधातुओं से संबंधित अपने प्रेक्षणों को सारणी 3.1 में संकलित कीजिए।
सारणी 3.1
सारणी 3.1 मे लिखे प्रेक्षणों के आधार पर अपनी कक्षा में धातुओं तथा अधातुओं के सामान्य गुणधर्मों की चर्चा कीजिए। आप निश्चित रूप से इस निष्कर्ष पर पहुँचे होंगे कि केवल भौतिक गुणधर्मों के आधार पर ही हम तत्वों का वर्गीकरण नहीं कर सकते क्योंकि इसमें कई अपवाद हैं। उदाहरण के लिएः
(i) मर्करी को छोड़कर सारी धातुएँ कमरे के ताप पर ठोस अवस्था में पाई जाती हैं। क्रियाकलाप 3.5 में आपने देखा कि धातुओं का गलनांक अधिक होता है लेकिन गैलियम और सीज़ियम का गलनांक बहुत कम है। यदि आप अपनी हथेली पर इन दोनों धातुओं को रखेंगे तो ये पिघलने लगेंगी।
(ii) आयोडीन अधातु होते हुए भी चमकीला होता है।
(iii) कार्बन एेसी अधातु है जो विभिन्न रूपों में विद्यमान रहती है। प्रत्येक रूप को अपररूप कहते हैं। हीरा कार्बन का एक अपररूप है। यह सबसे कठोर प्राकृतिक पदार्थ है एवं इसका गलनांक तथा क्वथनांक बहुत अधिक होता हैै। कार्बन का एक अन्य अपररूप ग्रेफ़ाइट, विद्युत का सुचालक है।
(iv) क्षारीय धातु (लीथियम, सोडियम, पोटैशियम) इतनी मुलायम होती हैं कि उनको चाकू से भी काटा जा सकता है। इनके घनत्व तथा गलनांक कम होते हैं।
तत्वों को उनके रासायनिक गुणधर्मों के आधार पर अधिक स्पष्टता से धातुओं एवं अधातुओं में वर्गीकृत किया जा सकता है।
क्रियाकलाप 3.8
मैग्नीशियम की एक पट्टी तथा थोड़ा सल्फ़र चूर्ण लीजिए।
मैग्नीशियम की पट्टी का दहन कीजिए। उसकी राख को इकट्ठा करके उसे पानी में घोल दीजिए।
लाल तथा नीले लिटमस पेपर से प्राप्त विलयन की जाँच कीजिए।
मैग्नीशियम के दहन से जो उत्पाद मिला है वह अम्लीय है या क्षारकीय?
अब सल्फ़र के चूर्ण का दहन कीजिए। दहन से उत्पन्न धुएँ को एकत्र करने के लिए उसके ऊपर एक परखनली रख दीजिए।
इस परखनली में जल डालकर उसे अच्छी तरह मिला दीजिए।
नीले तथा लाल लिटमस पेपर से इस विलयन की जाँच कीजिए।
सल्फ़र के दहन से उत्पन्न पदार्थ अम्लीय है या क्षारकीय।
क्या आप इन अभिक्रियाओं के समीकरण लिख सकते हैं?
अधिकांश अधातुएँ अॉक्साइड प्रदान करते हैं जो जल में घुलकर अम्ल बनाते हैं। वहीं अधिकतर धातुएँ क्षारकीय अॉक्साइड प्रदान करते हैं। अगले भाग में आपको धातुओं के अॉक्साइडों के बारे में अधिक जानकारी प्राप्त होगी।
प्रश्न
1. एेसी धातु का उदाहरण दीजिए जो
(i) कमरे के ताप पर द्रव होती है। (i) चाकू से आसानी से काटा जा सकता है।
(iii) ऊष्मा की सबसे अच्छी चालक होती है। (iv) ऊष्मा की कुचालक होती है।
2. आघातवर्ध्य तथा तन्य का अर्थ बताइए।
3.2 धातुओं के रासायनिक गुणधर्म
धातुओं के रासायनिक गुणधर्मों के बारे में हम भाग 3.2.1 से 3.2.4 में पढ़ेंगे। इसके लिए निम्न धातुओं के नमूने एकत्र कीजिएः एेलुमिनियम, कॉपर, आयरन, लेड, मैग्नीशियम, जिंक तथा सोडियम।
3.2.1 धातुओं का वायु में दहन करने से क्या होता है?
क्रियाकलाप 3.8 में आपने देखा कि वायु में चमकदार श्वेत ज्वाला के साथ मैग्नीशियम का दहन होता है। क्या सभी धातुएँ इसी प्रकार अभिक्रिया करती हैं? आइए निम्न क्रियाकलापों द्वारा इसकी जाँच करते हैं।
क्रियाकलाप 3.9
सावधानीः निम्न क्रियाकलाप में शिक्षक का सहयोग आवश्यक है। आँखों की सुरक्षा के लिए छात्र चश्मा लगा लें तो बेहतर होगा।
एकत्र की गई किसी धातु को चिमटे से पकड़कर ज्वाला पर उसका दहन कीजिए। अन्य धातुओं के साथ भी यही क्रिया दोहराइए।
इससे उत्पन्न पदार्थ को एकत्र कीजिए।
उत्पाद तथा धातु की सतह को ठंडा होने दीजिए।
किस धातु का दहन आसानी से होता है?
जब धातु का दहन हो रहा था तो ज्वाला का रंग क्या था?
दहन के पश्चात धातु की सतह कैसी प्रतीत होती है?
धातुओं को अॉक्सीजन के साथ अभिक्रियाशीलता के आधार पर घटते क्रम में व्यवस्थित कीजिए।
क्या इनके उत्पाद जल में घुलनशील हैं?
लगभग सभी धातुएँ अॉक्सीजन के साथ मिलकर संगत धातु के अॉक्साइड बनाती हैं।
धातु + अॉक्सीजन → धातु अॉक्साइड
उदाहरण के लिए, जब कॉपर को वायु की उपस्थिति में गर्म किया जाता है तो यह अॉक्सीजन के साथ मिलकर काले रंग का कॉपर (II) अॉक्साइड बनाता है।
2Cu + O2 → 2CuO
(कॉपर) [कॉपर(II) अॉक्साइड]
इसी प्रकार एेलुमिनियम एेलुमिनियम अॉक्साइड प्रदान करता है।
4Al + 3O2 → 2Al2O3
(एेलुमिनियम) (एेलुमिनियम अॉक्साइड)
अध्याय 2 में आपने देखा कि कॉपर अॉक्साइड हाइड्रोक्लोरिक अम्ल से कैसे अभिक्रिया करता है। हम जानते हैं कि धातु अॉक्साइड की प्रकृति क्षारकीय होती है। लेकिन एेलुमिनियम अॉक्साइड, जिंक अॉक्साइड जैसे कुछ धातु अॉक्साइड अम्लीय तथा क्षारकीय दोनों प्रकार के व्यवहार प्रदर्शित करते हैं। एेसे धातु अॉक्साइड जो अम्ल तथा क्षारक दोनों से अभिक्रिया करके लवण तथा जल प्रदान करते हैं, उभयधर्मी अॉक्साइड कहलाते हैं। अम्ल तथा क्षारक के साथ एेलुमिनियम अॉक्साइड निम्न प्रकार से अभिक्रिया करता है।
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
(सोडियम एेलुमिनेट)
अधिकांश धातु अॉक्साइड जल में अघुलनशील हैं लेकिन इनमें से कुछ जल में घुलकर क्षार प्रदान करते हैं। सोडियम अॉक्साइड एवं पोटैशियम अॉक्साइड निम्न प्रकार से जल में घुलकर क्षार प्रदान करते हैंः
Na2O(s) + H2O(l) → 2NaOH(aq)
K2O(s) + H2O(l) → 2KOH(aq)
क्रियाकलाप 3.9 में हमने देखा कि अॉक्सीजन के साथ सभी धातुएँ एक ही दर से अभिक्रिया नहीं करती हैं। विभिन्न धातुएँ अॉक्सीजन के साथ विभिन्न अभिक्रियाशीलता प्रदर्शित करती हैं। पोटैशियम तथा सोडियम जैसी कुछ धातुएँ इतनी तेज़ी से अभिक्रिया करती हैं कि खुले में रखने पर आग पकड़ लेती हैं। इसलिए, इन्हें सुरक्षित रखने तथा आकस्मिक आग को रोकने के लिए किरोसिन तेल में डुबो कर रखा जाता है। सामान्य ताप पर मैग्नीशियम, एेलुमिनियम, जिंक, लेड आदि जैसी धातुओं की सतह पर अॉक्साइड की पतली परत चढ़ जाती है। अॉक्साइड की यह परत धातुओं को पुनः अॉक्सीकरण से सुरक्षित रखती है। गर्म करने पर आयरन का दहन तो नहीं होता है लेकिन जब बर्नर की ज्वाला में लौह चूर्ण डालते हैं तब वह तेज़ी से जलने लगता है। कॉपर का दहन तो नहीं होता है लेकिन गर्म धातु पर कॉपर (II) अॉक्साइड की काले रंग की परत चढ़ जाती है। सिल्वर एवं गोल्ड अत्यंत अधिक ताप पर भी अॉक्सीजन के साथ अभिक्रिया नहीं करते हैं।
क्या आप जानते हैं?
क्रियाकलाप 3.9 करने के बाद आपने देखा होगा कि उन धातुओं के नमूनों में सोडियम सबसे अधिक अभिक्रियाशील है। मैग्नीशियम धीमी अभिक्रिया करता है और यह सोडियम की अपेक्षा कम अभिक्रियाशील है। लेकिन अॉक्सीजन में दहन करने से हमें ज़िंक, आयरन, कॉपर तथा लेड की अभिक्रियाशीलता का पता नहीं चलता है। कुछ और अभिक्रियाओं को देखकर हम इन धातुओं की अभिक्रियाशीलता का क्रम बनाने का प्रयास करते हैं।
3.2.2 धातुएँ जब जल के साथ अभिक्रिया करती हैं तो क्या होता है?
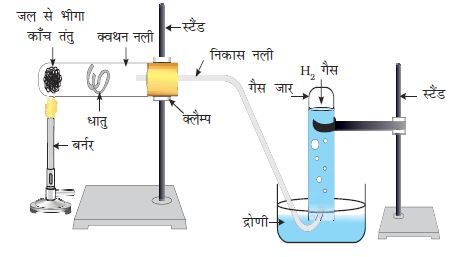
चित्र 3.3 धातु पर भाप की क्रिया
क्रियाकलाप 3.10
सावधानीः इस क्रियाकलाप में शिक्षक के सहयोग की आवश्यकता है।
क्रियाकलाप 3.9 की तरह समान धातुओं के नमूने एकत्र कीजिए।
ठंडे जल से आधे भरे बीकर में नमूने के छोटे टुकड़ों को अलग-अलग डालिए।
कौन सी धातु ठंडे जल से अभिक्रिया करती है? ठंडे पानी के साथ अभिक्रियाशीलता के आधार पर उन्हें आरोही क्रम में व्यवस्थित कीजिए।
क्या कोई धातु जल में आग उत्पन्न करती है?
थोड़ी देर बाद क्या कोई धातु जल में तैरने लगती है?
जो धातुएँ ठंडे जल के साथ अभिक्रिया नहीं करती हैं उन्हें एेसे बीकरों में डालिए जो गर्म जल से आधे भरे
हुए हों।
जो धातुएँ गर्म जल के साथ अभिक्रिया नहीं करती हैं उसके लिए चित्र 3.3 की तरह उपकरण व्यवस्थित कीजिए तथा भाप के साथ उसकी अभिक्रिया को प्रेक्षित कीजिए।
कौन सी धातुएँ भाप के साथ भी अभिक्रिया नहीं करती हैं?
जल के साथ अभिक्रियाशीलता के आधार पर धातुओं को अवरोही क्रम में व्यवस्थित कीजिए।
जल के साथ अभिक्रिया करके धातुएँ हाइड्रोजन गैस तथा धातु अॉक्साइड उत्पन्न करती हैं। जो धातु अॉक्साइड जल में घुलनशील हैं, जल में घुलकर धातु हाइड्रॉक्साइड प्रदान करते हैं। लेकिन सभी धातुएँ जल के साथ अभिक्रिया नहीं करती हैं।
धातु + जल → धातु अॉक्साइड + हाइड्रोजन
धातु अॉक्साइड + जल → धातु हाइड्रॉक्साइड
पोटैशियम एवं सोडियम जैसी धातुएँ ठंडे जल के साथ तेज़ी से अभिक्रिया करती हैं। सोडियम तथा पोटैशियम की अभिक्रिया तेज़ तथा ऊष्माक्षेपी होती है कि इससे उत्सर्जित हाइड्रोजन तत्काल प्रज्ज्वलित हो जाती है।
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g) + ऊष्मीय ऊर्जा
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g) + ऊष्मीय ऊर्जा
जल के साथ कैल्सियम की अभिक्रिया थोड़ी धीमी होती है। यहाँ उत्सर्जित ऊष्मा हाइड्रोजन के प्रज्ज्वलित होने के लिए पर्याप्त नहीं होती है।
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
क्योंकि उपरोक्त अभिक्रिया में उत्पन्न हाइड्रोजन गैस के बुलबुले कैल्सियम धातु की सतह पर चिपक जाते हैं। अतः कैल्सियम तैरना प्रारंभ कर देता है।
मैग्नीशियम शीतल जल के साथ अभिक्रिया नहीं करता है परंतु गर्म जल के साथ अभिक्रिया करके वह मैग्नीशियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस उत्पन्न करता है। चूँकि हाइड्रोजन गैस के बुलबुले मैग्नीशियम धातु की सतह से चिपक जाते हैं। अतः यह भी तैरना प्रारंभ कर देते हैं।
एेलुमिनियम, आयरन तथा जिंक जैसी धातुएँ न तो शीतल जल के साथ और न ही गर्म जल के साथ अभिक्रिया करती हैं। लेकिन भाप के साथ अभिक्रिया करके यह धातु अॉक्साइड तथा हाइड्रोजन प्रदान करती हैं।
2Al(s) + 3H2O(g) → Al2O3(s) + 3H2(g)
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
लेड, कॉपर, सिल्वर तथा गोल्ड जैसी धातुएँ जल के साथ बिलकुल अभिक्रिया नहीं करती हैं।
3.2.3 क्या होता है जब धातुएँ अम्लों के साथ अभिक्रिया करती हैं?
आप पहले ही अध्ययन कर चुके हैं कि धातुएँ अम्ल के साथ अभिक्रिया करके संगत लवण तथा हाइड्रोजन गैस प्रदान करती हैं।
धातु + तनु अम्ल → लवण + हाइड्रोजन
लेकिन क्या सभी धातुएँ इसी प्रकार अभिक्रिया करती हैं? आइए पता करते हैं।
क्रियाकलाप 3.11
सोडियम तथा पोटैशियम के अतिरिक्त बाकी सभी धातुओं के नमूने एकत्र कीजिए। यदि नमूने मलीन हैं तो रेगमाल से रगड़कर उन्हें साफ़ कर लीजिए।
सावधानीः सोडियम तथा पोटैशियम को नहीं लीजिए क्योंकि वे ठंडे जल के साथ भी तेज़ी से अभिक्रिया करते हैं।
नमूनों को अलग-अलग तनु हाइड्रोक्लोरिक अम्ल युक्त परखनलियों में डालिए।
थर्मामीटर को परखनलियों में इस प्रकार लटका दें कि उसका बल्ब अम्ल में डूब जाए।
बुलबुले बनने की दर का सावधानीपूर्वक प्रेक्षण कीजिए।
कौन सी धातुएँ तनु हाइड्रोक्लोरिक अम्ल के साथ तेज़ी से अभिक्रिया करती हैं?
आपने किस धातु के साथ सबसे अधिक ताप रिकार्ड किया?
तनु अम्ल के साथ अभिक्रियाशीलता के आधार पर धातुओं को अवरोही क्रम में व्यवस्थित कीजिए।
तनु हाइड्रोक्लोरिक अम्ल के साथ मैग्नीशियम, एेलुमिनियम, जिंक तथा आयरन की अभिक्रियाओं के लिए समीकरण लिखिए।
जब धातुएँ नाइट्रिक अम्ल के साथ अभिक्रिया करती हैं तब हाइड्रोजन गैस उत्सर्जित नहीं होती है। क्योंकि HNO3 एक प्रबल अॉक्सीकारक होता है जो उत्पन्न H2 को अॉक्सीकृत करके जल में परिवर्तित कर देता है एवं स्वयं नाइट्रोजन के किसी अॉक्साइड ( N2O, NO, NO2 ) में अपचयित हो जाता है। लेकिन मैग्नीशियम (Mg) एवं मैंगनीज (Mn), अति तनु HNO3 के साथ अभिक्रिया कर H2 गैस उत्सर्जित करते हैं।
क्रियाकलाप 3.11 में आपने देखा कि बुलबुले बनने की दर मैग्नीशियम के साथ सबसे अधिक थी। इस स्थिति में अभिक्रिया सबसे अधिक ऊष्माक्षेपी थी। अभिक्रियाशीलता इस क्रम में घटती हैः Mg > Al >Zn >Fe। कॉपर की स्थिति में न तो बुलबुले बनते हैं और न ही ताप में कोई परिवर्तन होता है। इससे पता चलता है कि कॉपर तनु HCl के साथ अभिक्रिया नहीं करता है।
क्या आप जानते है?
3.2.4 अन्य धातु लवणों के विलयन के साथ धातुएँ कैसे अभिक्रिया करती हैं?
क्रियाकलाप 3.12
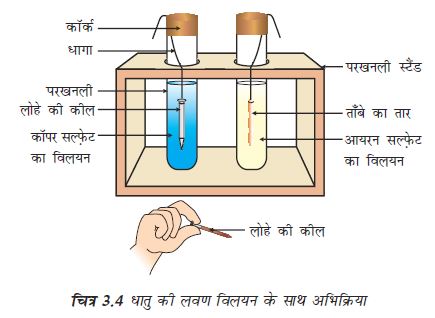
कॉपर का एक स्वच्छ तार एवं आयरन की एक कील लीजिए।
कॉपर के तार को परखनली में रखे आयरन सल्फ़ेट के विलयन तथा आयरन की कील को दूसरी परखनली में रखे कॉपर सल्फ़ेट के विलयन में डाल दीजिए (चित्र 3.4)
20 मिनट के बाद अपने प्रेक्षणों को रिकार्ड कीजिए।
आपको किस परखनली में कोई अभिक्रिया हुई है, इसका पता चलता है?
किस आधार पर आप कह सकते हैं कि वास्तव में कोई अभिक्रिया हुई है?
क्या आप अपने प्रेक्षणों को क्रियाकलाप 3.9, 3.10, तथा 3.11 से कोई संबंध स्थापित कर सकते हैं?
इस अभिक्रिया के लिए संतुलित रसायनिक समीकरण लिखिए।
यह किस प्रकार की अभिक्रिया है?
अभिक्रियाशील धातु अपने से कम अभि- क्रियाशील धातु को उसके यौगिक के विलयन या गलित अवस्था से विस्थापित कर देती है।
पिछले खंड में हमने देखा कि सभी धातुओं की अभिक्रियाशीलता समान नहीं होती है। हमने अॉक्सीजन, जल एवं अम्ल के साथ विभिन्न धातुओं की अभिक्रियशीलता की जाँच की। लेकिन सभी धातुएँ इन अभिकर्मकों के साथ अभिक्रिया नहीं करती हैं। इसलिए हम सभी धातुओं के नमूने को अभिक्रियाशीलता के अवरोही क्रम में नहीं रख सके। आपने अध्याय-1 में जो विस्थापन अभिक्रियाओं का अध्ययन किया वह धातुओं की अभिक्रियाशीलता का उत्तम प्रमाण प्रस्तुत करता है। इसे समझना बहुत ही आसान एवं सरल है। अगर धातु (A) धातु (B) को उसके विलयन से विस्थापित कर देती है तो यह धातु (B) की अपेक्षा अधिक अभिक्रियाशील है।
धातु (A) + (B) का लवण विलयन → (A) का लवण विलयन + धातु (B)
क्रियाकलाप 3.12 में आपके प्रेक्षणों के आधार पर कॉपर तथा आयरन में से कौन-सी धातु अधिक अभिक्रियाशील है?
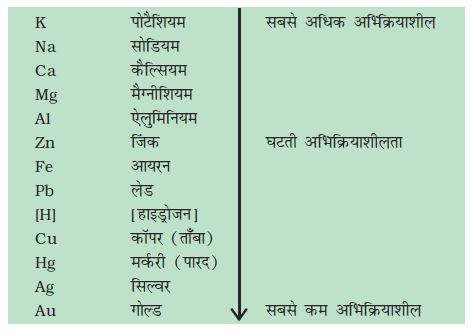
3.2.5 सक्रियता श्रेणी
सक्रियता श्रेणी वह सूची है जिसमें धातुओं की क्रियाशीलता को अवरोही क्रम में व्यवस्थित किया जाता है। विस्थापन के प्रयोगों के बाद (क्रियाकलाप 1.9 तथा 3.12) निम्न श्रेणी (सारणी 3.2) को विकसित किया गया है जिसे सक्रियता श्रेणी कहते हैं।
सारणी 3.2 सक्रियता श्रेणी : धातुओं की सापेक्ष अभिक्रियाशीलताएँ
प्रश्न
1. सोडियम को किरोसिन में डुबो कर क्यों रखा जाता हैं?
2. इन अभिक्रियाओं के लिए समीकरण लिखिएः
(i) भाप के साथ आयरन।
(ii) जल के साथ कैल्सियम तथा पोटैशियम।
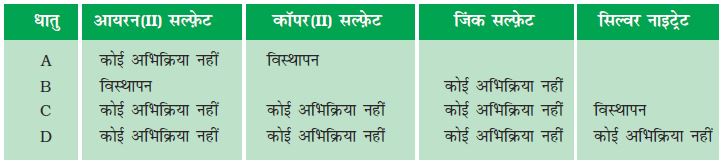
3. A, B, C एवं D चार धातुओं के नमूनों को लेकर एक-एक करके निम्न विलयन में डाला गया। इससे प्राप्त परिणाम को निम्न प्रकार से सारणीबद्ध किया गया हैः
इस सारणी का उपयोग कर धातु A, B, C एवं D के संबंध में निम्न प्रश्नों के उत्तर दीजिएः
(i) सबसे अधिक अभिक्रियाशील धातु कौन सी है?
(ii) धातु B को कॉपर(II) सल्फ़ेट के विलयन में डाला जाए तो क्या होगा?
(iii) धातु A, B, C एवं D को अभिक्रियाशीलता के घटते हुए क्रम में व्यवस्थित कीजिए।
4. अभिक्रियाशील धातु को तनु हाइड्रोक्लोरिक अम्ल में डाला जाता है तो कौन सी गैस निकलती है? आयरन के साथ तनु H2SO4 की रासायनिक अभिक्रिया लिखिए।
5. जिंक को आयरन(II) सल्फ़ेट के विलयन में डालने से क्या होता है? इसकी रासायनिक अभिक्रिया लिखिए।
3.3 धातुएँ एवं अधातुएँ कैसे अभिक्रिया करती हैं?
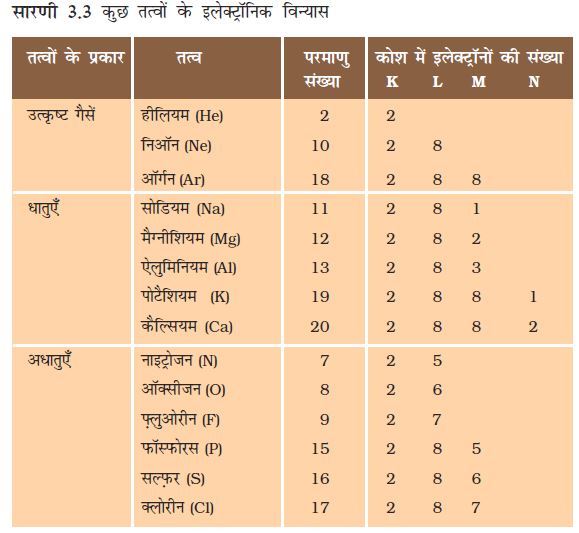
ऊपर के क्रियाकलापों में आपने कई अभिकर्मकों के साथ धातुओं की अभिक्रियाएँ देखीं। धातुएँ इस प्रकार की अभिक्रिया क्यों प्रदर्शित करती हैं? नवीं कक्षा में अध्ययन किए तत्वों के इलेक्ट्रॉनिक विन्यास को स्मरण कीजिए? हमने जाना कि संयोजकता कोश पूर्ण होने के कारण उत्कृष्ट गैसों की रासायनिक अभिक्रियाएँ बहुत कम होती हैं। इसलिए, हम तत्वों की अभिक्रियाशीलता को, संयोजकता कोश को पूर्ण करने की प्रवृत्ति के रूप में समझ सकते हैं।
उत्कृष्ट गैसों एवं कुछ धातुओं तथा अधातुओं के इलेक्ट्रॉनिक विन्यास पर ध्यान दीजिए।
सारणी 3.3 में हम देख सकते हैं कि सोडियम परमाणु के बाह्यतम कोश में केवल एक इलेक्ट्रॉन है। यदि यह अपने M कोश से एक इलेक्ट्रॉन को त्याग देता है तब L कोश इसका बाह्यतम कोश बन जाता है जिसमें स्थायी अष्टक उपस्थित है। इस परमाणु के नाभिक में 11 प्रोटॉन हैं लेकिन इलेक्ट्रॉनों की संख्या 10 होने के कारण इसमें धन आवेश की अधिकता होती है तथा यह सोडियम धनायन Na+ प्रदान करता है। दूसरी ओर, क्लोरीन के बाह्यतम कोश में 7 इलेक्ट्रॉन होते हैं तथा अष्टक पूर्ण होने के लिए इसे एक इलेक्ट्रॉन की आवश्यकता होती है। यदि सोडियम एवं क्लोरीन अभिक्रिया करें तो सोडियम द्वारा त्यागा गया एक इलेक्ट्रॉन क्लोरीन ग्रहण कर लेता है। एक इलेक्ट्रॉन ग्रहण करके क्लोरीन-परमाणु, इकाई ऋण आवेश प्राप्त करता है क्योंकि इसके नाभिक में 17 प्रोटॉन होते हैं तथा इसके K, L, एवं M कोशों में 18 इलेक्ट्रॉन होते हैं। इससे क्लोराइड ऋणायन Cl– प्राप्त होता है। इसलिए यह दोनों तत्वों के बीच निम्न प्रकार से आदान-प्रदान का संबंध स्थापित हो जाता है (चित्र 3.5)।
विपरीत आवेश होने के कारण सोडियम तथा क्लोराइड आयन परस्पर आकर्षित होते हैं तथा मजबूत स्थिरवैद्युत बल में बँधकर सोडियम क्लोराइड (Nacl) के रूप में उपस्थित रहते हैं। ध्यान देने योग्य बात है कि सोडियम क्लोराइड अणु के रूप में नहीं पाया जाता है बल्कि यह विपरीत आयनों का समुच्चय होता है।
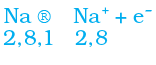

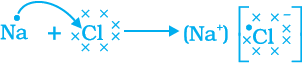
चित्र 3.5 सोडियम क्लोराइड का निर्माण
अब एक और आयनिक यौगिक, मैग्नीशियम क्लोराइड के निर्माण को चित्र 3.6 में दर्शाया गया है।
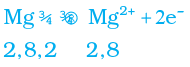
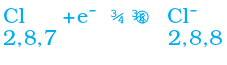
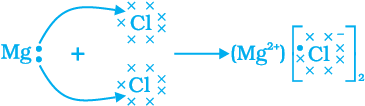
चित्र 3.6 मैग्नीशियम क्लोराइड का निर्माण
धातु से अधातु में इलेक्ट्रॉन के स्थानांतरण से बने यौगिकों को आयनिक यौगिक या वैद्युत संयोजक यौगिक कहा जाता है। क्या आप MgCl2 में उपस्थित धनायन एवं ऋणायन का नाम बता सकते हैं?
3.3.1 आयनिक यौगिकों के गुणधर्म
आयनिक यौगिकों के गुणधर्मों के बारे में जानने के लिए आइए निम्न क्रियाकलाप करते हैं।
क्रियाकलाप 3.13
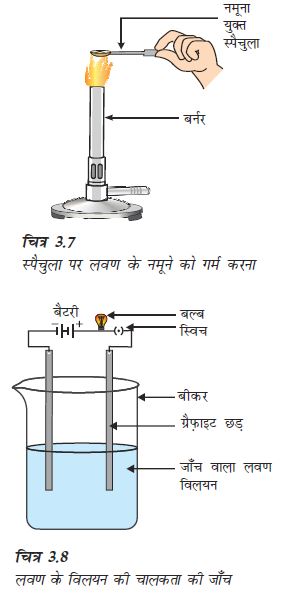
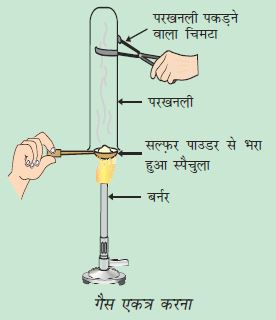
विज्ञान की प्रयोगशाला से सोडियम क्लोराइड, पोटैशियम आयोडाइड, बेरियम क्लोराइड या किसी अन्य लवण का नमूना लीजिए।
इन लवणों की भौतिक अवस्था क्या है?
धातु के स्पैचुला पर छोटी मात्रा में नमूने को लीजिए तथा इसे ज्वाला पर गर्म कीजिए (चित्र 3.7)। अन्य नमूनों के साथ भी यही क्रिया दोहराइए।
आप क्या देखते हैं? क्या ये नमूने ज्वाला को रंग प्रदान करते हैं? क्या यौगिक पिघलते हैं?
नमूने को जल, पेट्रोल एवं किरोसिन में घोलने का प्रयास कीजिए। क्या ये घुलनशील हैं?
चित्र 3.8 की तरह एक परिपथ बनाइए और किसी एक लवण के विलयन में इलैक्ट्रोड डाल दीजिए। आप क्या देखते हैं? इसी प्रकार अन्य लवण नमूनों की भी जाँच कीजिए।
इन यौगिकों की प्रकृति के संबंध में आप क्या निष्कर्ष निकालते हैं?
आयनिक यौगिकों के निम्न सामान्य गुणधर्मों पर आपने ध्यान दिया होगाः
(i) भौतिक प्रकृतिः धन एवं ऋण आयनों के बीच मजबूत आकर्षण बल के कारण आयनिक यौगिक ठोस एवं थोड़े कठोर होते हैं। ये यौगिक सामान्यतः भंगुर होते हैं तथा दाब डालने पर टुकड़ों में टूट जाते हैं।
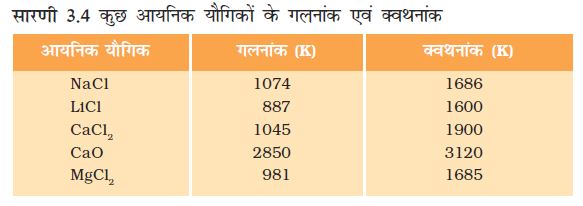
(ii) गलनांक एवं क्वथनांकः आयनिक यौगिकों का गलनांक एवं क्वथनांक बहुत अधिक होता है क्योंकि मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की पर्याप्त मात्रा की आवश्यकता होती है।
(iii) घुलनशीलताः वैद्युत संयोजक यौगिक सामान्यतः जल में घुलनशील तथा किरोसिन, पेट्रोल आदि जैसे विलायकों में अविलेय होते हैं।
(iv) विद्युत चालकताः किसी विलयन से विद्युत के चालन के लिए आवेशित कणों की गतिशीलता आवश्यक होती है। आयनिक यौगिकों के जलीय विलयन में आयन उपस्थित होते हैं। जब विलयन में विद्युत धारा प्रवाहित की जाती है तो यह आयन विपरीत इलैक्ट्रोड की ओर गमन करने लगते हैं। ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं करते हैं क्योंकि ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति संभव नहीं होती है। लेकिन आयनिक यौगिक गलित अवस्था में विद्युत का चालन करते हैं क्योंकि गलित अवस्था में विपरीत आवेश वाले आयनों के मध्य स्थिरवैद्युत आकर्षण बल ऊष्मा के कारण कमज़ोर पड़ जाता है। इसलिए आयन स्वतंत्र रूप से गमन करते हैं एवं विद्युत का चालन करते हैं।
प्रश्न
1. (i) सोडियम, अॉक्सीजन एवं मैग्नीशियम के लिए इलेक्ट्रॉन-बिंदु संरचना लिखिए।
(ii) इलेक्ट्रॉन के स्थानांतरण के द्वारा Na2O एवं MgO का निर्माण दर्शाइए।
(iii) इन यौगिकों में कौन से आयन उपस्थित हैं?
2. आयनिक यौगिकों का गलनांक उच्च क्यों होता है?
3.4 धातुओं की प्राप्ति
पृथ्वी की भूपर्पटी धातुओं का मुख्य स्रोत है। समुद्री जल में भी सोडियम क्लोराइड, मैग्नीशियम क्लोराइड आदि जैसे कुछ विलेय लवण उपस्थित रहते हैं। पृथ्वी की भूपर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्वों या यौगिकों को खनिज कहते हैं। कुछ स्थानों पर खनिजों में कोई विशेष धातु काफ़ी मात्रा में होती है जिसे निकालना लाभकारी होता है। इन खनिजों को अयस्क कहते हैं।
3.4.1 धातुओं का निष्कर्षण
धातुओं की सक्रियता श्रेणी के बारे में आप पढ़ चुके हैं। इसलिए आप आसानी से समझ सकते हैं कि अयस्क से धातु का निष्कर्षण कैसे होता है। कुछ धातुएँ भूपर्पटी में स्वतंत्र अवस्था में पाई जाती हैं। कुछ धातुएँ अपने यौगिकों के रूप में मिलती हैं। सक्रियता श्रेणी में नीचे आने वाली धातुएँ सबसे कम अभिक्रियाशील होती हैं। ये स्वतंत्र अवस्था में पाई जाती हैं। उदाहरण के लिए, गोल्ड (सोना), सिल्वर (चाँदी), प्लैटिनम एवं कॉपर (ताँबा) स्वतंत्र अवस्था में पाए जाते हैं। कॉपर एवं सिल्वर, अपने सल्फ़ाइड या अॉक्साइड के अयस्क के रूप में संयुक्त अवस्था में भी पाए जाते हैं। सक्रियता श्रेणी में सबसे ऊपर की धातुएँ (K, Na, Ca, Mg एवं Al) इतनी अधिक अभिक्रियाशील होती हैं कि ये कभी भी स्वतंत्र तत्व के रूप में नहीं पाई जातीं। सक्रियता श्रेणी के मध्य की धातुएँ (Zn, Fe, Pb,आदि) की अभिक्रियाशीलता मध्यम होती है। पृथ्वी की भू-पर्पटी में ये मुख्यतः अॉक्साइड, सल्फ़ाइड या कार्बोनेट के रूप में पाई जाती हैं। आप देखेंगे कि कई धातुओं के अयस्क अॉक्साइड होते हैं। अॉक्सीजन की अत्यधिक अभिक्रियाशीलता एवं पृथ्वी पर इसके प्रचुर मात्रा में पाए जाने के कारण एेसा होता है।
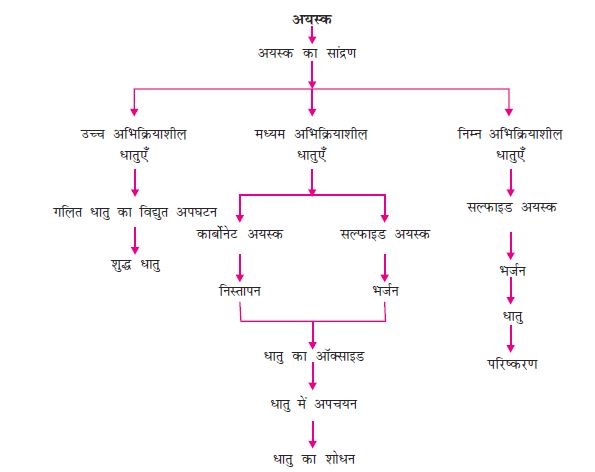
इस प्रकार, अभिक्रियाशीलता के आधार पर हम धातुओं को निम्न तीन वर्गों (चित्र 3.9) मेें विभाजित कर सकते हैंः (i) निम्न अभिक्रियाशील धातुएँ (ii) मध्यम अभिक्रियाशील धातुएँ (iii) उच्च अभिक्रियाशील धातुएँ। प्रत्येक वर्ग में आने वाली धातुओं को प्राप्त करने के लिए विभिन्न तकनीकों का उपयोग किया जाता है।
अयस्क से शुद्ध धातु का निष्कर्षण कई चरणों में होता है। इन चरणों का सारांश चित्र 3.10 में दिया गया है। निम्न भागों में प्रत्येक चरण की विस्तृत चर्चा की गई है।
चित्र 3.10 अयस्क से धातु निष्कर्षण में प्रयुक्त चरण
3.4.2 अयस्कों का समृद्धीकरण
पृथ्वी से खनित अयस्कों में मिट्टी, रेत आदि जैसी कई अशुद्धियाँ होती हैं जिन्हें गैंग (gangue) कहते हैं। धातुओं के निष्कर्षण से पहले अयस्क से अशुद्धियों को हटाना आवश्यक होता है। अयस्कों से गैंग को हटाने के लिए जिन प्रक्रियाओं का उपयोग होता है वे अयस्क एवं गैंग के भौतिक या रासायनिक गुणधर्मों पर आधारित होते हैं। इस पृथकन के लिए विभिन्न तकनीक अपनायी जाती है।
3.4.3 सक्रियता श्रेणी में नीचे आने वाली धातुओं का निष्कर्षण
सक्रियता श्रेणी में नीचे आने वाली धातुएँ काफ़ी अनभिक्रिय होती हैं। इन धातुओं के अॉक्साइड को केवल गर्म करने से ही धातु प्राप्त किया जा सकता है। उदाहरण के लिए, सिनाबार (HgS), मर्करी (पारद) का एक अयस्क है। वायु में गर्म करने पर यह सबसे पहले मर्क्यूरिक अॉक्साइड (HgO) में परिवर्तित होता है और अधिक गर्म करने पर मर्क्यूरिक अॉक्साइड मर्करी (पारद) में अपचयित हो जाता है।
इसी प्रकार, प्राकृतिक रूप से Cu2S के रूप में उपलब्ध ताँबे (कॉपर) को केवल वायु में गर्म करके इसको अयस्क से अलग किया जा सकता है।
3.4.4 सक्रियता श्रेणी के मध्य में स्थित धातुओं का निष्कर्षण
सक्रियता श्रेणी के मध्य में स्थित धातुएँ; जैसे–आयरन, जिंक, लेड, कॉपर की अभिक्रियाशीलता मध्यम होती है। प्रकृति में यह प्रायः सल्फ़ाइड या कार्बोनेट के रूप में पाई जाती हैं। सल्फ़ाइड या कार्बोनेट की तुलना में धातु को उसके अॉक्साइड से प्राप्त करना अधिक आसान है। इसलिए अपचयन से पहले धातु के सल्फ़ाइड एवं कार्बोनेट को धातु अॉक्साइड में परिवर्तित करना आवश्यक है। सल्फ़ाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह अॉक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को भर्जन कहते हैं। कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर गर्म करने से यह अॉक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को निस्तापन कहा जाता है। जिंक के अयस्कों के भर्जन एवं निस्तापन के समय निम्न रासायनिक अभिक्रिया होती हैः
भर्जन
इसके बाद कार्बन जैसे उपयुक्त अपचायक का उपयोग कर धातु अॉक्साइड से धातु प्राप्त किया जाता है। उदाहरण के लिए, जब जिंक अॉक्साइड को कार्बन के साथ गर्म किया जाता है तो यह जिंक धातु में अपचयित हो जाता हैै।
प्रथम अध्याय में दिए गए अॉक्सीकरण एवं अपचयन प्रक्रम से आप पहले से ही परिचित हैं। धातुओं को उनके यौगिकों से प्राप्त करना भी अपचयन प्रक्रम है।
कार्बन (कोयला) का उपयोग कर धातु के अॉक्साइड को धातु में अपचयन करने के अलावा विस्थापन अभिक्रिया का भी उपयोग किया जा सकता है। अत्यधिक अभिक्रियाशील धातुएँ; जैसे–सोडियम, कैल्सियम, एेलुमिनियम आदि को अपचायक के रूप में उपयोग किया जा सकता है क्योंकि ये निम्न अभिक्रियाशीलता वाले धातुओं को उनके यौगिकों से विस्थापित कर सकते हैं। उदाहरण के लिए, जब मैगनीज डाइअॉक्साइड को एेलुमिनियम चूर्ण के साथ गर्म किया जाता है तो निम्न अभिक्रिया होती हैः

चित्र 3.11
रेल पटरियों को संधित करने (जोड़ना) के लिए थर्मिट प्रक्रम
3MnO2(s) + 4Al(s) → 3Mn(l) + 2Al2O3(s) + ऊष्मा
क्या आप उन पदार्थों को पहचान सकते हैं जिनका अॉक्सीकरण या अपचयन हो रहा है?
यह विस्थापन अभिक्रियाएँ अत्यधिक ऊष्माक्षेपी होती हैं। इसमें उत्सर्जित ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती हैं। वास्तव में आयरन(III)अॉक्साइड (Fe2O3) के साथ एेलुमिनियम की अभिक्रिया का उपयोग रेल की पटरी एवं मशीनी पुर्जों की दरारों को जोड़ने के लिए किया जाता है। इस अभिक्रिया को थर्मिट अभिक्रिया कहते हैं।
Fe2O3(s) + 2Al(s) → 2Fe(l) + Al2O3(s) + ऊष्मा
3.4.5 सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण
अभिक्रियाशीलता श्रेणी में सबसे ऊपर स्थित धातुएँ अत्यंत अभिक्रियाशील होती हैं। इन्हें कार्बन के साथ गर्म कर इनके यौगिकों से प्राप्त नहीं किया जा सकता है। उदाहरण के लिए, कार्बन के द्वारा सोडियम, मैग्नीशियम, कैल्सियम, एेलुमिनियम आदि के अॉक्साइड का अपचयन कर उन्हें धातुओं में परिवर्तित नहीं किया जा सकता है। इन धातुओं की बंधुता कार्बन की अपेक्षा अॉक्सीजन के प्रति अधिक होती है। इन धातुओं को विद्युत अपघटनी अपचयन द्वारा प्राप्त किया जाता है। उदाहरण के लिए, सोडियम, मैग्नीशियम एवं कैल्सियम को उनके गलित क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है। कैथोड (ऋण आवेशित इलैक्ट्रोड) पर धातुएँ निक्षेपित हो जाती हैं तथा एेनोड (धन आवेशित इलैक्ट्रोड) पर क्लोरीन मुक्त होती है। अभिक्रियाएँ इस प्रकार हैंः
कैथोड पर Na+ + e– → Na
एेनोड पर 2Cl– → Cl2 + 2e–
इसी प्रकार, एेलुमिनियम अॉक्साइड के विद्युत अपघटनी अपचयन से एेलुमिनियम प्राप्त किया जाता है।
कैथोड
3.4.6 धातुओं का परिष्करण
ऊपर वर्णित विभिन्न अपचयन प्रक्रमों से प्राप्त धातुएँ पूर्ण रूप से शुद्ध नहीं होती हैं। इनमें अपद्रव्य होते हैं जिन्हें हटाकर ही शुद्ध धातु प्राप्त की जा सकती है। धातुओं से अपद्रव्य को हटाने के लिए सबसे अधिक प्रचलित विधि विद्युत अपघटनी परिष्करण है।
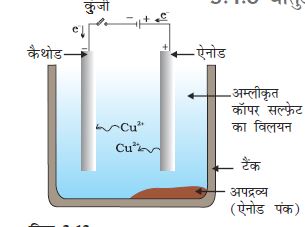
चित्र 3.12
ताँबे का विद्युत अपघटनी परिष्करण। अम्लीकृत कॉपर सल्फेट का विलयन विद्युत अपघट्य है। अशुद्ध ताँबाएेनोड है जबकि शुद्ध ताँबे की पट्टी कैथोड का कार्य करती है। विद्युत धारा प्रवाहित करने पर शुद्ध ताँबा कैथोड परनिक्षेपित हो जाता है।
विद्युत अपघटनी परिष्करणः कॉपर, जिंक, टिन, निकैल, सिल्वर, गोल्ड आदि जैसी अनेक धातुओं का परिष्करण विद्युत अपघटन द्वारा किया जाता है। इस प्रकम में, अशुद्ध धातु को एेनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है। धातु के लवण विलयन का उपयोग विद्युत अपघट्य के रूप में होता है। चित्र 3.12 के अनुसार उपकरण व्यवस्थित किया जाता है। विद्युत अपघट्य से जब धारा प्रवाहित की जाती है तब एेनोड पर स्थित अशुद्ध धातु विद्युत अपघट्य में घुल जाती है। इतनी ही मात्रा में शुद्ध धातु विद्युत अपघट्य से कैथोड पर निक्षेपित हो जाती है। विलेय अशुद्धियाँ विलयन में चली जाती हैं तथा अविलेय अशुद्धियाँ एेनोड तली पर निक्षेपित हो जाती हैं जिसे एेनोड पंक कहते हैं।
प्रश्न
1. निम्न पदों की परिभाषा दीजिएः
(i) खनिज (ii) अयस्क (iii) गैंग
2. दो धातुओं के नाम बताइए जो प्रकृति में मुक्त अवस्था में पाई जाती हैं।
3. धातु को उसके अॉक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रम का उपयोग किया जाता है?
3.5 संक्षारण
संक्षारण के संबंध में अध्याय 1 में आप निम्न बातों का अध्ययन कर चुके हैंः
खुली वायु में कुछ दिन छोड़ देने पर सिल्वर की वस्तुएँ काली हो जाती हैं। सिल्वर का वायु में उपस्थित सल्फ़र के साथ अभिक्रिया कर सिल्वर सल्फ़ाइड की परत बनने के कारण एेसा होता है।
कॉपर वायु में उपस्थित आर्द्र कार्बन डाइअॉक्साइड के साथ अभिक्रिया करता है जिससे इसकी सतह से भूरे रंग की चमक धीरे-धीरे खत्म हो जाती है तथा इस पर हरे रंग की परत चढ़ जाती है। यह हरा पदार्थ बेसिक कॉपर कार्बोनेट होता है।
लंबे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग के पत्रकी पदार्थ की परत चढ़ जाती है जिसे जंग कहते हैं।
आइए उन परिस्थितियों का पता करते हैं जिनमें लोहे पर जंग लग जाती है।
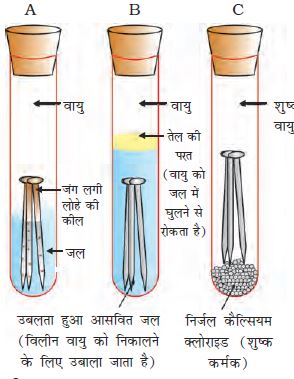
तीन परखनली लीजिए एवं प्रत्येक में स्वच्छ लोहे की कीलें डाल दीजिए।
इन परखनलियों को A, B, तथा C नाम दीजिए। परखनली A में थोड़ा जल डालकर उसे कॉर्क से बंद कर दीजिए।
चित्र 3.13
लोहे पर जंग लगने की स्थिति की जाँच करना। परखनली A में वायु एवं जल दोनों उपस्थित हैं। परखनली B में जल में विलीन वायु नहीं है। परखनली C में शुष्क वायु है।
क्रियाकलाप 3.14
परखनली B में उबलता हुआ आसवित जल डालकर उसमें 1 mL तेल मिलाइए एवं कॉर्क से बंद कर दीजिए। तेल जल पर तैरने लगेगा एवं वायु को जल में विलीन होने से रोक देगा।
परखनली C में थोड़ा निर्जल कैल्सियम क्लोराइड डालकर उसे कॉर्क से बंद कर दीजिए। निर्जल कैल्सियम क्लोराइड वायु की नमी को सोख लेगा। इन परखनलियों को कुछ दिन छोड़ने के बाद उनका प्रेक्षण कीजिए (चित्र 3.13)।
आप देखेंगे कि परखनली A मेें रखे लोहे की कीलों पर जंग लग गया है लेकिन परखनली B एवं C में रखी कीलों पर जंग नहीं लगा है। परखनली A की कील, वायु एवं जल दोनों के संपर्क में रहती है। परखनली A की कील केवल जल के संपर्क में रहती हैै एवं परखनली C की कील शुष्क वायु के संपर्क में रहती है। इससे लोहे की वस्तुओं में जंग लगने की अवस्थाओं के बारे में हम क्या कह सकते हैं?
3.5.1 संक्षारण से सुरक्षा
पेंट करके, तेल लगाकर, ग्रीज़ लगाकर, यशदलेपन (लोहे की वस्तुओं पर जस्ते की परत चढ़ाकर), क्रोमियम लेपन, एेनोडीकरण या मिश्रधातु बनाकर लोहे को जंग लगने से बचाया जा सकता है।
लोहे एवं इस्पात को जंग से सुरक्षित रखने के लिए उनपर जस्ते (जिंक) की पतली परत चढ़ाने की विधि को यशदलेपन कहते हैं। जस्ते की परत नष्ट हो जाने के बाद भी यशदलेपित वस्तु जंग से सुरक्षित रहती है। क्या आप इसका कारण बता सकते हैं?
धातु के गुणधर्मों को बेहतर बनाने की अच्छी विधि मिश्रात्वन है। इस विधि से हम इच्छानुसार धातुओं के अत्यन्त गुणधर्म प्राप्त कर सकते हैं। उदाहरण के लिए, लोहा सर्वाधिक उपयोग मे आनेे वाली धातु है। लेकिन कभी भी शुद्ध अवस्था में इसका उपयोग नहीं किया जाता। एेसा इसलिए क्योंकि शुद्ध लोहा अत्यन्त नर्म होता है एवं गर्म करने पर सुगमतापूर्वक खिंच जाता है। लेकिन यदि इसमें थोड़ा कार्बन (लगभग 0.05 प्रतिशत) मिला दिया जाता है तो यह कठोर तथा प्रबल हो जाता है। लोहे के साथ निकैल एवं क्रोमियम मिलाने पर हमें स्टेनलेस इस्पात प्राप्त होता है जो कठोर होता है तथा उसमें जंग नहीं लगता है। इस प्रकार यदि लोहे के साथ कोई अन्य पदार्थ मिश्रित किया जाता है तो इसके गुणधर्म बदल जाते हैं। वास्तव में, कोई अन्य पदार्थ मिला कर किसी भी धातु के गुणधर्म बदले जा सकते हैं। यह पदार्थ धातु या अधातु कुछ भी हो सकता है। दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रातु कहते हैं। इसे तैयार करने के लिए पहले मूल धातु को गलित अवस्था में लाया जाता है एवं तत्पश्चात दूसरे तत्वों को एक निश्चित अनुपात में इसमें विलीन किया जाता है। फिर इसे कमरे के ताप पर शीतलीकृत किया जाता है।
क्या आप जानते है
यदि कोई एक धातु पारद है तो इसके मिश्रातु को अमलगम कहते हैं। शुद्ध धातु की अपेक्षा उसके मिश्रातु की विद्युत चालकता तथा गलनांक कम होता है। उदाहरण के लिए, ताँबा एवं जस्ते (Cu एवं Zn) की मिश्रातु पीतल तथा ताम्र एवं टिन (Cu एवं Sn) की मिश्रातु काँसा विद्युत के कुचालक हैं, लेकिन ताम्र का उपयोग विद्युतीय परिपथ बनाने में किया जाता है। सीसा एवं टिन (Pb एवं Sn) की मिश्रातु सोल्डर है जिसका गलनांक बहुत कम होता है। इसका उपयोग विद्युत तारों की परस्पर वेल्डिंग के लिए किया जाता है।

प्राचीन भारतीय धातुकर्म का चमत्कार
प्रश्न
1. जिंक, मैग्नीशियम एवं कॉपर के धात्विक अॉक्साइडों को निम्न धातुओं के साथ गर्म किया गयाः
किस स्थिति में विस्थापन अभिक्रिया घटित होगी?
2. कौन सी धातु आसानी से संक्षारित नहीं होती है?
3. मिश्रातु क्या होते हैं?
आपने क्या सीखा
तत्वों को धातुओं एवं अधातुओं में वर्गीकृत किया जा सकता है।
धातुएँ तन्य, आघातवर्ध्य, चमकीली एवं ऊष्मा तथा विद्युत की सुचालक होती हैं। पारद के अलावा सभी धातुएँ कमरे के ताप पर ठोस होती हैं। कमरे के ताप पर पारद द्रव होता है।
धातुएँ विद्युत धनात्मक तत्व होते हैं क्योंकि यह अधातुओं को इलेक्ट्रॉन देकर स्वयं धन आयन में परिवर्तित हो जाते हैं।
अॉक्सीजन के साथ संयुक्त होकर धातुएँ क्षारकीय अॉक्साइड बनाती हैं। एेलुमिनियम अॉक्साइड एवं जिंक अॉक्साइड, क्षारकीय अॉक्साइड तथा अम्लीय अॉक्साइड, दानों के गुणधर्म प्रदर्शित करती हैं। इन अॉक्साइड को उभयधर्मी अॉक्साइड कहते हैं।
जल एवं तनु अम्लों के साथ विभिन्न धातुओं की अभिक्रियाशीलता भिन्न-भिन्न होती है।
अभिक्रियाशीलता के आधार पर अवरोही क्रम में व्यवस्थित सामान्य धातुओं की सूची को सक्रियता श्रेणी कहते हैं।
सक्रियता श्रेणी में हाइड्रोजन के ऊपर स्थित धातुएँ तनु अम्ल से हाइड्रोजन को विस्थापित कर सकती हैं।
अधिक अभिक्रियाशील धातुएँ अपने से कम अभिक्रियाशील धातुओं को उसके लवण विलयन से विस्थापित कर सकती हैं।
प्रकृति में धातुएँ स्वतंत्र अवस्था में या अपने यौगिकों के रूप में पाई जाती हैं।
अयस्क से धातु का निष्कर्षण तथा उसका परिष्करण कर उपयोगी बनाने के प्रक्रम को धातुकर्म कहते हैं।
दो या दो से अधिक धातुओं अथवा एक धातु या एक अधातु के समांगी मिश्रण को मिश्रातु कहते हैं।
लंबे समय तक आर्द्र वायु के संपर्क में रखने से लोहा जैसे कुछ धातुओं की सतह संक्षारित हो जाती है। इस परिघटना को संक्षारण कहते हैं।
अधातुओं के गुणधर्म धातुओं के विपरीत होते हैं। यह न तो आघातवर्ध्य तथा न ही तन्य होते हैं। ग्रैफ़ाइट के अलावा सभी अधातुएँ ऊष्मा एवं विद्युत की कुचालक होती हैं। ग्रैफ़ाइट विद्युत का चालक होता है।
अधातुएँ विद्युत ऋणात्मक तत्व होती हैं क्योंकि धातुओं के साथ अभिक्रिया में इलेक्ट्रॉन ग्रहण कर ऋण आवेशित आयन बनाती हैं।
अधातुएँ अॉक्साइड बनाती हैं जो अम्लीय या उदासीन होती हैं।
अधातुएँ तनु अम्लों में से हाइड्रोजन का विस्थापन नहीं करती हैं। यह हाइड्रोजन के साथ अभिक्रिया कर हाइड्राइड बनाती हैं।
अभ्यास
1. निम्न में कौन सा युगल विस्थापन अभिक्रिया प्रदर्शित करता हैः
(a) NaCl विलयन एवं कॉपर धातु
(b) MgCl2 विलयन एवं एेलुमिनियम धातु
(c) FeSO4 विलयन एवं सिल्वर धातु
(d) AgNO3 विलयन एवं कॉपर धातु
2. लोहे के फ्राइंग पैन (frying pan) को जंग से बचाने के लिए निम्न में से कौन सी विधि उपयुक्त हैः
(a) ग्रीज़ लगाकर
(b) पेंट लगाकर
(c) जिंक की परत चढ़ाकर
(d) ऊपर के सभी
3. कोई धातु अॉक्सीजन के साथ अभिक्रिया कर उच्च गलनांक वाला यौगिक निर्मित करती है। यह यौगिक जल में विलेय है। यह तत्व क्या हो सकता है?
(a) कैल्सियम
(b) कार्बन
(c) सिलिकन
(d) लोहा
4. खाद्य पदार्थ के डिब्बों पर जिंक की बजाय टिन का लेप होता है क्योंकि
(a) टिन की अपेक्षा जिंक मँहगा है।
(b) टिन की अपेक्षा जिंक का गलनांक अधिक है
(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है
(d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है
5. आपको एक हथौड़ा, बैटरी, बल्ब, तार एवं स्विच दिया गया हैः
(a) इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों के बीच आप विभेद कैसे कर सकते हैं?
(b) धातुओं एवं अधातुओं में विभेदन के लिए इन परीक्षणों की उपयोगिताओं का आकलन कीजिए।
6. उभयधर्मी अॉक्साइड क्या होते हैं? दो उभयधर्मी अॉक्साइडों का उदाहरण दीजिए।
7. दो धातुओं के नाम बताइए जो तनु अम्ल से हाइड्रोजन को विस्थापित कर देंगे तथा दो धातुएँ जो एेसा नहीं कर सकती हैं।
8. किसी धातु M के विद्युत अपघटनी परिष्करण में आप एेनोड, कैथोड एवं विद्युत अपघट्य किसे बनाएँगे?
9. प्रत्यूष ने सल्फ़र चूर्ण को स्पैचुला में लेकर उसे गर्म किया। चित्र के अनुसार एक परखनली को उलटा करके उसने उत्सर्जित गैस को एकत्र किया
(a) गैस की क्रिया क्या होगी
(i) सूखे लिटमस पत्र पर?
(ii) आर्द्र लिटमस पत्र पर?
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक अभिक्रिया लिखिए।
10. लोहे को जंग से बचाने के लिए दो तरीके बताइए।
11. अॉक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा अॉक्साइड बनाती हैं?
12. कारण बताइएः
(a) प्लैटिनम, सोना एवं चांँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम को तेल के अंदर संग्रहीत किया जाता है।
(c) एेलुमिनियम अत्यंत अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने के लिए किया जाता है।
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फ़ाइड अयस्क को अॉक्साइड में परिवर्तित किया जाता है।
13. आपने ताँबे के मलीन बर्तन को नींबू या इमली के रस से साफ़ करते अवश्य देखा होगा। यह खट्टे पदार्थ बर्तन को साफ़ करने में क्यों प्रभावी हैं?
14. रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद कीजिए।
15. एक व्यक्ति प्रत्येक घर में सुनार बनकर जाता है। उसने पुराने एवं मलीन सोने के आभूषणों में पहले जैसी चमक पैदा करने का ढोंग रचाया। कोई संदेह किए बिना ही एक महिला अपने सोने के कंगन उसे देती है जिसे वह एक विशेष विलयन में डाल देता है। कंगन नए की तरह चमकने लगते हैं लेकिन उनका वजन अत्यंत कम हो जाता है। वह महिला बहुत दुखी होती है तथा तर्क-वितर्क के पश्चात उस व्यक्ति को झुकना पड़ता है। एक जासूस की तरह क्या आप उस विलयन की प्रकृति के बारे में बता सकते हैं।
16. गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है परंतु इस्पात (लोहे की मिश्रातु) का नहीं। इसका कारण बताएइए।