Table of Contents
अध्याय 5
तत्वाें का आवर्त वर्गीकरण

नौवीं कक्षा में हमने सीखा कि हमारे आसपास के पदार्थ तत्व, मिश्रण एवं यौगिक के रूप में उपस्थित रहते हैं। हमने यह भी सीखा कि तत्व एक ही प्रकार के परमाणुओं से बने होते हैं। क्या आप जानते हैं कि आज तक कितने तत्वों का पता चल चुका है? आज तक हमें 118 तत्वों की जानकारी है। इन सभी तत्वों के गुण भिन्न-भिन्न हैं। इनमें से 94 तत्व प्राकृतिक रूप में पाये जाते हैं।
जैसे-जैसे विभिन्न तत्वों की खोज हो रही थी, वैज्ञानिक इन तत्वों के गुणधर्मों के बारे में अधिक से अधिक जानकारी एकत्र करने लगे। उन्हें तत्वों की इन जानकारियों को व्यवस्थित करना बड़ा ही कठिन लगा। उन्होंने इन गुणधर्मों में एक एेसा प्रतिरूप ढूँढ़ना आरंभ किया जिसके आधार पर इतने सारे तत्वों का आसानी से अध्ययन किया जा सके।
5.1 अव्यवस्थित को व्यवस्थित करना–तत्वों के वर्गीकरण के प्रारंभिक प्रयास
हमने पढ़ा कि कैसे विभिन्न वस्तुओं एवं प्राणियों को उनके गुणधमोे के आधार पर वर्गीकृत किया जा सकता है। अन्य स्थितियों में भी हमें गुणधर्मों के आधार पर व्यवस्थित होने के उदाहरण मिलते हैं। जैसे, दुकानों में साबुनों को एक साथ एक स्थान पर रखा जाता है, जबकि बिस्कुटों को एक साथ दूसरे स्थान पर रखा जाता है। यहाँ तक कि साबुनों में भी, नहाने के साबुन को कपड़ा धोने के साबुन से अलग रखा जाता है। इसी प्रकार वैज्ञानिकों ने भी तत्वों को उनके गुणधर्मों के आधार पर वर्गीकृत करने के कई प्रयास किए ताकि अव्यवस्थित को व्यवस्थित किया सके।
सबसे पहले, ज्ञात तत्वों को धातु एवं अधातु में वर्गीकृत किया गया। जैसे-जैसे तत्वों एवं उनके गुणधर्मों के बारे में हमारा ज्ञान बढ़ता गया, वैसे-वैसे उन्हें वर्गीकृत करने के प्रयास किए गए।
5.1.1 डॉबेराइनर के त्रिक
सन् 1817 में जर्मन रसायनज्ञ, वुल्फगांग डॉबेराइनर ने समान गुणधमोेρं वाले तत्वों को समूहों में व्यवस्थित करने का प्रयास किया। उन्होंने तीन-तीन तत्व वाले कुछ समूहों को चुना एवं उन समूहों को त्रिक कहा। डॉबेराइनर ने बताया कि त्रिक के तीनों तत्वों को उनके परमाणु द्रव्यमान के आरोही क्रम में रखने पर बीच वाले तत्व का परमाणु द्रव्यमान, अन्य दो तत्वों के परमाणु द्रव्यमान का लगभग औसत होता हैै।

चित्र 5.1
कल्पना कीजिए कि आपको तथा आपके दोस्तों को टुकड़ों में बँटा हुआ एक नक्शा मिलता है जो किसी खज़ाने का पता बताता है। क्या उस खज़ाने तक का रास्ते का पता करना आसान होगा या अव्यवस्थित? रसायन विज्ञान में भी एेसी ही अव्यवस्था थी, तत्व तो ज्ञात थे लेकिन उनके वर्गीकरण एवं अध्ययन की कोई विधि ज्ञात नहीं थी।
उदाहरण के लिए, लीथियम (Li), सोडियम (Na) एवं पोटैशियम (K) वाले त्रिक पर ध्यान दीजिए, जिनके परमाणु द्रव्यमान क्रमशः 6.9, 23.0 तथा 39.0 हैं। लीथियम एवं पोटैशियम के परमाणु द्रव्यमानों का औसत क्या है? सोडियम के परमाणु द्रव्यमान से इसकी तुलना कैसे की जा सकती है?
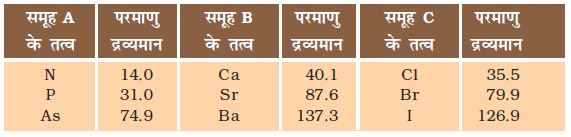
निम्न सारणी 5.1 में तीन तत्वों के कुछ समूह दिए गए हैं। इन तत्वों को परमाणु द्रव्यमान के आरोही क्रम में ऊपर से नीचे की ओर व्यवस्थित किया गया है। क्या आप बता सकते हैं कि इनमें से कौन-सा समूह डॉबेराइनर त्रिक बनाता है।
सारणी 5.1
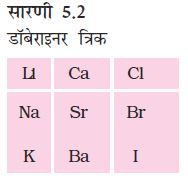
आप देखेंगे कि समूह B तथा समूह C डॉबेराइनर त्रिक बनाते हैं। डॉबेराइनर उस समय तक ज्ञात तत्वों में केवल तीन त्रिक ही ज्ञात कर सके थे (सारणी 5.2)। इसलिए त्रिक में वर्गीकृत करने की यह पद्धति सफल नहीं रही।
जे. डब्ल्यू डॉबेराइनर (1780-1849)

जोहान्न वुल्फगांग डॉबेराइनर ने जर्मनी के म्यून्शबर्ग में औषधि विज्ञान की पढ़ाई की और उसके बाद स्ट्रैसबर्ग मेंरसायन शास्त्र का अध्ययन किया। फिर वे जेना विश्वविद्यालय में रसायन एवं औषधि विज्ञान के प्रोफ़ेसर बन गए। उन्होंने ही सबसे पहले प्लैटिनम को उत्प्रेरक के रूप में पहचाना तथा समान त्रिक की खोज की जिससे तत्वों की आवर्त सारणी का विकास हुआ।
5.1.2 न्यूलैंड्स का अष्टक सिद्धांत
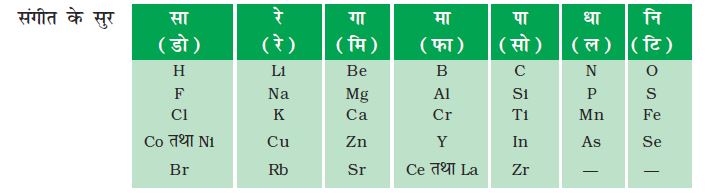
डॉबेराइनर के प्रयासों ने दूसरे रसायनज्ञों को तत्वों के गुणधमोेρं का उनके परमाणु द्रव्यमान के साथ संबंध स्थापित करने के लिए प्रोत्साहित किया। सन् 1866 में अंग्रेज़ वैज्ञानिक जॉन न्यूलैंड्स ने ज्ञात तत्वों को परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित किया। उन्होंने सबसे कम परमाणु द्रव्यमान वाले तत्व हाइड्रोजन से आरंभ किया तथा 56वें तत्व थोरियम पर इसे समाप्त किया। उन्होंने पाया कि प्रत्येक आठवें तत्व का गुणधर्म पहले तत्व के गुणधर्म के समान है। उन्होंने इसकी तुलना संगीत के अष्टक से की और इसलिए उन्होंने इसे अष्टक का सिद्धांत कहा। इसे ‘न्यूलैंड्स का अष्टक सिद्धांत’ के नाम से जाना जाता है। न्यूलैंड्स के अष्टक में लीथियम एवं सोडियम के गुणधर्म समान थे। सोडियम, लीथियम के बाद आठवाँ तत्व है। इसी तरह बेरिलियम एवं मैग्नीशियम में अधिक समानता है। न्यूलैंड्स के अष्टक के मूल रूप का एक भाग सारणी 5.3 में दिया गया है।
सारणी 5.3 न्यूलैंड्स का अष्टक
क्या आप संगीत के सुरों से परिचित हैं?
भारतीय संगीत प्रणाली में संगीत के सात सुर होते हैं– सा रे गा मा पा धा नि।
पाश्चात्य संगीत में, लोग इन सुरों का एेसे उपयोग करते हैं– डो रे मि फा सो ल टि। सुर के स्केल, पूर्णटोन और अर्द्धटोन आवृत्ति अंतराल से अलग किए गए होते हैं। इन सुरों का उपयोग कर कोई संगीतकार संगीत की रचना करता है। स्पष्ट है कि कुछ सुर बार-बार दुहराए जाते हैं। प्रत्येक आठवाँ सुर पहले सुर जैसा होता है तथा अगली पंक्ति का पहला सुर होता है।
एेसा देखा गया कि अष्टक का सिद्धांत केवल कैल्सियम तक ही लागू होता था, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्व का गुणधर्म पहले तत्व से नहीं मिलता।
न्यूलैंड्स ने कल्पना की कि प्रकृति में केवल 56 तत्व विद्यमान हैं तथा भविष्य में कोई अन्य तत्व नहीं मिलेगा। लेकिन, बाद में कई नए तत्व पाए गए जिनके गुणधर्म, अष्टक सिद्धांत से मेल नहीं खाते थे।
अपनी सारणी में इन तत्वों को समंजित करने के लिए न्यूलैंड्स ने दो तत्वों को एक साथ रख दिया और कुछ असमान तत्वों को एक स्थान में रख दिया। क्या आप सारणी 5.3 में एेसे उदाहरण ढूँढ़ सकते हैं? ध्यान दीजिए कि कोबाल्ट तथा निकैल एक साथ में हैं तथा इन्हें एक साथ उसी स्तंभ में रखा गया है जिसमें फ्लुओरीन, क्लोरीन एवं ब्रोमीन हैं यद्यपि इनके गुणधर्म उन दोनों तत्वों से भिन्न हैं। आयरन को कोबाल्ट एवं निकैल से दूर रखा गया है जबकि उनके गुणधमोेंρं में समानता होती है।
इस प्रकार, न्यूलैंड्स अष्टक सिद्धांत केवल हलके तत्वों के लिए ही ठीक से लागू हो पाया।
नोबल गैसों की खोज के पश्चात अष्टक का सिद्धांत अप्रासंगिक हो गया।
प्रश्न
1. क्या डॉबेराइनर के त्रिक, न्यूलैंड्स के अष्टक के स्तंभ में भी पाए जाते हैं? तुलना करके पता कीजिए।
2. डॉबेराइनर के वर्गीकरण की क्या सीमाएँ हैं?
3. न्यूलैंड्स के अष्टक सिद्धांत की क्या सीमाएँ हैं?
5.2 अव्यवस्थित से व्यवस्थित करना–मेन्डेलीफ की आवर्त सारणी
न्यूलैंड्स के अष्टक सिद्धांत के अस्वीकार होने के बाद भी कई वैज्ञानिकों ने एेसे प्रतिरूपों की खोज जारी रखी जिससे तत्वों के गुणधमोेρं का, उनके परमाणु द्रव्यमान के साथ संबंध स्थापित हो सके।
तत्वों के वर्गीकरण का मुख्य श्रेय रूसी रसायनज्ञ डमित्री इवानोविच मेन्डेलीफ को जाता है। तत्वों की आवर्त सारणी के प्रारंभिक विकास में उनका प्रमुख योगदान रहा। उन्होंने अपनी सारणी में तत्वों को उनके मूल गुणधर्म, परमाणु द्रव्यमान तथा रासायनिक गुणधमोेρं में समानता के आधार पर व्यवस्थित किया।
डमित्री इवानोविच मेन्डेलीफ (1834-1907)

मेन्डेलीफ का जन्म 8 फरवरी 1834 में रूस के पश्चिमी साइबेरिया के टोबोलस्क स्थान में हुआ था। अपनी प्रारंभिक शिक्षा के बाद मेन्डेलीफ अपनी माँ के प्रयासों के कारण ही विश्वविद्यालय में प्रवेश पा सके। अपनी खोज को उन्होंने माँ को समर्पित करते हुए लिखा, ‘‘उन्होंने मुझे उदाहरण देकर समझाया, प्यार से समझाया, अपने शेष संसाधनों एवं शक्ति व्यय करके मेरे साथ विभिन्न स्थानों पर गईं। वह जानती थीं कि विज्ञान की मदद से, बिना हिंसा के, लेकिन प्यार एवं दृढ़ता से अंधविश्वास, असत्य धारणाओं एवं गलतियों को दूर किया जा सकता है।’’ उनके द्वारा प्रस्तावित तत्वों की व्यवस्था को मेन्डेलीफ की आवर्त सारणी कहा जाता है। आवर्त सारणी रसायन में एकमेव सिद्धांत साबित हुआ। इससे नए तत्वों की खोज के लिए प्रेरणा मिली।
जब मेन्डेलीफ ने अपना कार्य आरंभ किया तब तक 63 तत्व ज्ञात थे। उन्होंने तत्वों के परमाणु द्रव्यमान एवं उनके भौतिक तथा रासायनिक गुणधमोे के बीच संबंधों का अध्ययन किया। रासायनिक गुणधमोे के अंतर्गत मेन्डेलीफ ने तत्वों के अॉक्सीजन एवं हाइड्रोजन के साथ बनने वाले यौगिकों पर अपना ध्यान केंद्रित किया। उन्होंने अॉक्सीजन एवं हाइड्रोजन का इसलिए चुनाव किया क्योंकि ये अत्यंत सक्रिय हैं तथा अधिकांश तत्वों के साथ यौगिक बनाते हैं। तत्व से बनने वाले हाइड्राइड एवं अॉक्साइड के सूत्र को तत्वों के वर्गीकरण के लिए मूलभूत गुणधर्म माना गया। फिर उन्होंने 63 कार्ड लिए एवं प्रत्येक कार्ड पर अलग-अलग तत्वों के गुणधमोेρं को लिखा। उन्होंने समान गुणधर्म वाले तत्वों को अलग कर दिया तथा इन पत्तों को पिन लगाकर दीवार पर लटका दिया। उन्होंने देखा कि अधिकांश तत्वों को आवर्त सारणी में स्थान मिल गया था तथा अपने परमाणु द्रव्यमान के आरोही क्रम में ये तत्व व्यवस्थित हो गए। यह भी देखा गया कि समान भौतिक एवं रासायनिक गुणधर्म वाले विभिन्न तत्व एक निश्चित अंतराल के बाद फिर आ जाते हैं। इसी आधार पर मेन्डेलीफ ने आवर्त सारणी बनाई, जिसका सिद्धांत है–तत्वों के गुणधर्म उनके परमाणु द्रव्यमान का आवर्त फलन होते हैं।
मेन्डेलीफ की आवर्त सारणी में ऊर्ध्व स्तंभ को ‘ग्रुप’ (समूह) तथा क्षैतिज पंक्तियों को ‘पीरियड’ (आवर्त) कहते हैं (सारणी 5.4)।
सारणी 5.4 मेन्डेलीफ की आवर्त सारणी
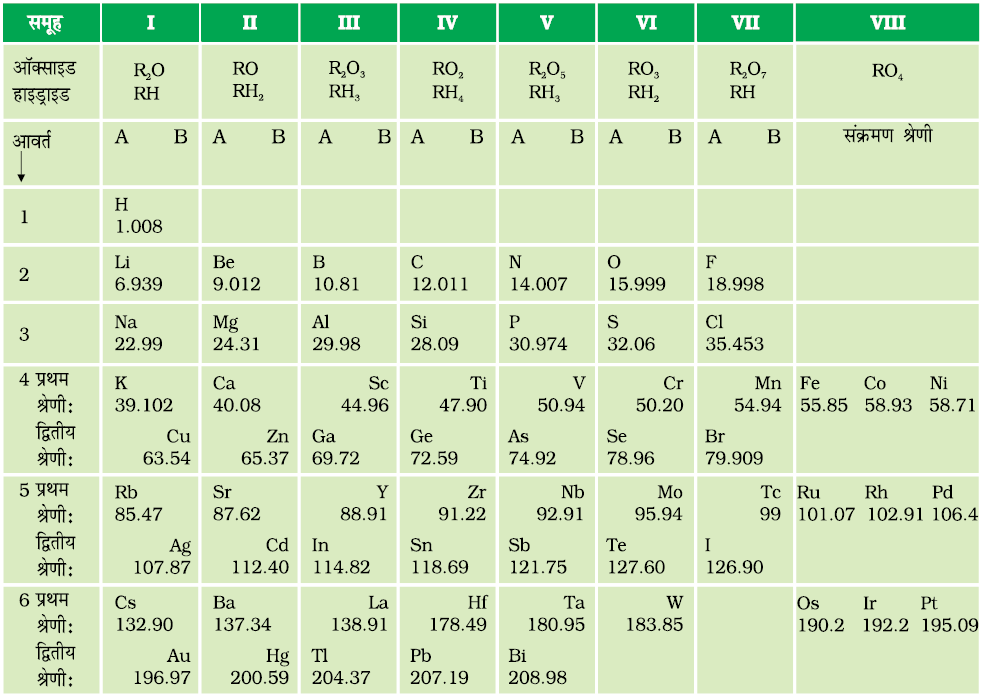
मेन्डेलीफ की आवर्त सारणी 1872 में जर्मन पत्रिका में प्रकाशित हुई थी। स्तंभ के शीर्ष पर अॉक्साइड तथा हाइड्राइड के सूत्र में अंग्रेज़ी का अक्षर 'R', समूह के किसी भी तत्व को दर्शाता है। सूत्र को लिखने के तरीके पर ध्यान दीजिए। उदाहरण के लिए, कार्बन के हाइड्राइड CH4 को RH4 तथा उसके अॉक्साइड CO2 को RO2 लिखा गया है।
5.2.1 मेन्डेलीफ की आवर्त सारणी की उपलब्धियाँ
आवर्त सारणी व्यवस्थित करते समय मेन्डेलीफ को सारणी में अधिक द्रव्यमान वाले तत्व को कभी-कभी कम द्रव्यमान वाले तत्व से पहले रखना पड़ा। क्रम इसलिए उलटना पड़ा ताकि समान गुणधर्म वाले तत्वों को एक साथ रखा जा सके। उदाहरण के लिए कोबाल्ट (परमाणु द्रव्यमान 58.9) सारणी में निकैल (परमाणु द्रव्यमान 58.7) से पहले है। सारणी 5.4 को देखकर क्या आप एेसी ही एक अन्य विसंगति ढूँढ़ सकते हैं।
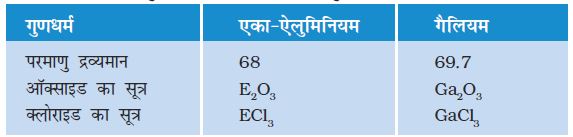
इसके अतिरिक्त, मेन्डेलीफ ने अपनी आवर्त सारणी में कुछ रिक्त स्थानों को छोड़ दिया। इन रिक्त स्थानों को दोष के रूप में देखने के बजाय मेन्डेलीफ ने दृढ़तापूर्वक कुछ एेसे तत्वों के अस्तित्व का अनुमान किया जो उस समय तक ज्ञात नहीं थे। इनका नामकरण उन्होंने उसी समूह में इससे पहले आने वाले तत्व के नाम में एका (संस्कृत शब्द) उपसर्ग लगाकर किया। जैसे बाद में ज्ञात होने वाले स्कैंडियम, गैलियम, जर्मेनियम के गुणधर्म क्रमशः एका-बोरॉन, एका-एेलुमिनियम तथा एका-सिलिकॉन के समान थे। मेन्डेलीफ द्वारा अनुमानित एका-एेलुमिनियम तथा बाद में ज्ञात गैलियम के गुणधर्म को सारणी 5.5 में सूचीबद्ध किया गया हैः
सारणी 5.5 एका-एेलुमिनियम तथा गैलियम के गुणधर्म
इससे मेन्डेलीफ की आवर्त सारणी की परिशुद्धता तथा उपयोगिता के ठोस प्रमाण मिल गए। इसके अलावा मेन्डेलीफ के अनुमान की असाधारण सफलता के कारण रसायनज्ञों ने उनकी आवर्त सारणी को न केवल स्वीकार किया अपितु उनको इस सिद्धांत की अवधारणा का सृजक भी माना। उत्कृष्ट गैसों; जैसे–हीलियम (He), निअॉन (Ne) एवं आर्गन (Ar) का पहले भी कई संदर्भ में उल्लेख किया गया। इन गैसों का पता देर से चला क्योंकि ये अक्रिय हैं तथा वायुमंडल में इनकी मात्रा बहुत कम है। मेन्डेलीफ की आवर्त सारणी की एक विशेषता यह भी थी कि जब इन गैसों का पता चला तब पिछली व्यवस्था को छेड़े बिना ही इन्हें नए समूह में रखा जा सका।
5.2.3 मेन्डेलीफ के वर्गीकरण की सीमाएँ
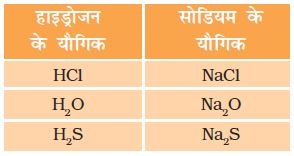
हाइड्रोजन का इलेक्ट्रॉनिक विन्यास क्षार धातुओं से मिलता है। क्षार धातुओं की भाँंति हाइड्रोजन भी हैलोजन, अॉक्सीजन एवं सल्फ़र के साथ एक जैसे सूत्र वाले यौगिक बनाती है जैसा उदाहरण में दिखाया गया हैः
दूसरी ओर, हैलोजन की भाँति हाइड्रोजन भी द्विपरमाणुक अणु के रूप में पाई जाती है और धातुओं एवं अधातुओं के साथ सहसंयोजक यौगिक बनाती है।
क्रियाकलाप 5.1
क्षार धातुओं एवं हैलोजन कुल की समानता को ध्यान में रखते हुए हाइड्रोजन को मेन्डेलीफ की आवर्त सारणी में उचित स्थान पर रखिए।
हाइड्रोजन को किस समूह एवं आवर्त में रखना चाहिए?
निश्चित रूप से आवर्त सारणी में हाइड्रोजन को नियत स्थान नहीं दिया जा सकता है। यह मेन्डेलीफ की आवर्त सारणी की पहली कमी थी। वह अपनी सारणी में हाइड्रोजन को सही स्थान नहीं दे पाए।
मेन्डेलीफ के तत्वों के आवर्त वर्गीकरण तैयार होने के पर्याप्त समय बाद समस्थानिकों का पता चला। हम जानते हैं कि किसी तत्व के समस्थानिकों के रासायनिक गुणधर्म समान होते हैं लेकिन उनके परमाणु द्रव्यमान भिन्न-भिन्न होते हैं।
क्रियाकलाप 5.2
क्लोरीन के समस्थानिक Cl-35 तथा Cl-37 पर विचार कीजिए।
उनके परमाणु द्रव्यमान भिन्न-भिन्न होने के कारण क्या आप उन्हें अलग-अलग रखेंगे?
या रासायनिक गुणधर्म समान होने के कारण आप दोनों को एक ही स्थान पर रखेंगे?
इस प्रकार सभी तत्वों के समस्थानिक मेन्डेलीफ के आवर्त नियम के लिए एक चुनौती थी। दूसरी समस्या यह थी कि एक तत्व से दूसरे तत्व की ओर आगे बढ़ने पर परमाणु द्रव्यमान नियमित रूप से नहीं बढ़ते। इसलिए यह अनुमान लगाना कठिन हो गया कि दो तत्वों के बीच कितने तत्व खोजे जा सकते हैं, विशेषकर जब हम भारी तत्वों पर विचार करते हैं तो कठिनाई आती है।
प्रश्न
1. मेन्डेलीफ की आवर्त सारणी का उपयोग कर निम्नलिखित तत्वों के अॉक्साइड के सूत्र का अनुमान कीजिएः K,C, Al, Si, Ba
2. गैलियम के अतिरिक्त, अब तक कौन-कौन से तत्वों का पता चला है जिसके लिए मेन्डेलीफ ने अपनी आवर्तसारणी में खाली स्थान छोड़ दिया था? दो उदाहरण दीजिए।
3. मेन्डेलीफ ने अपनी आवर्त सारणी तैयार करने के लिए कौन सा मापदंड अपनाया?
4. आपके अनुसार उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया?
5.3 अव्यवस्थित से व्यवस्थित करना–आधुनिक आवर्त सारणी
सन् 1913 में हेनरी मोज्ले ने बताया कि तत्व के परमाणु द्रव्यमान की तुलना में उसका परमाणु-संख्या (z) अधिक आधारभूत गुणधर्म है। तदनुसार, मेन्डेलीफ की आवर्त सारणी में परिवर्तन किया गया तथा परमाणु-संख्या को आधुनिक आवर्त सारणी के आधार के रूप में स्वीकार किया गया। इस आधुनिक आवर्त नियम को इस प्रकार वर्णित किया जा सकता हैः
‘तत्वों के गुणधर्म उनकी परमाणु-संख्या का आवर्त फलन होते हैं।’
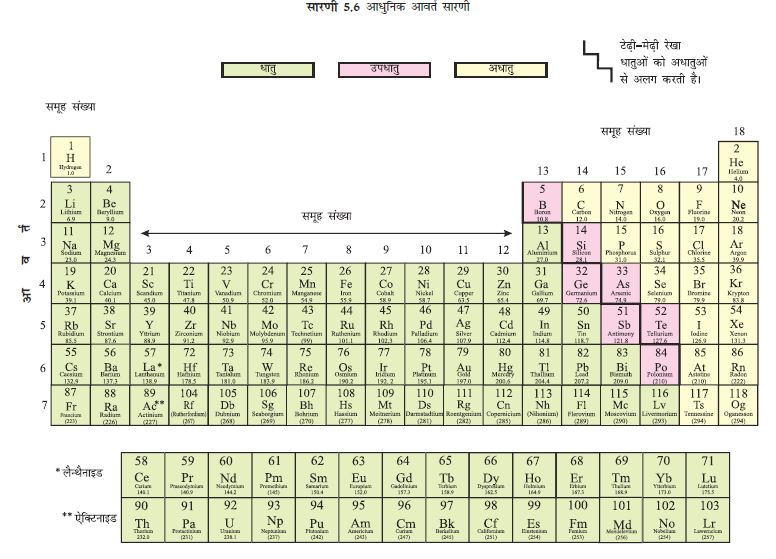
आप जानते हैं कि परमाणु संख्या से हमें परमाणु के नाभिक में स्थित प्रोटोनों की संख्या का पता चलता है तथा एक तत्व से दूसरे तक बढ़ने पर इस संख्या में एक की बढ़ोतरी होती है। तत्वोें को उनकी परमाणु-संख्या के आरोही क्रम में व्यवस्थित करने पर जो वर्गीकरण प्राप्त होता है उसे आधुनिक आवर्त सारणी कहा जाता है (सारणी 5.6)। तत्वों को परमाणु-संख्या के आरोही क्रम में व्यवस्थित करने पर तत्वों के गुणधर्मों का अधिक परिशुद्धता से अनुमान लगाया जा सकता है।
क्रियाकलाप 5.3
आधुनिक आवर्त सारणी में कोबाल्ट एवं निकैल के स्थान कैसे निर्धारित किए गए हैं?
आधुनिक आवर्त सारणी में विभिन्न तत्वों के समस्थानिकों का स्थान कैसे सुनिश्चित किया गया है।
क्या 1.5 परमाणु-संख्या वाले किसी तत्व को हाइड्रोजन एवं हीलियम के मध्य रखा जा सकता है?
आपके अनुसार आधुनिक आवर्त सारणी में हाइड्रोजन को कहाँ रखना चाहिए?
आप देख सकते हैं कि आधुनिक आवर्त सारणी में मेन्डेलीफ की आवर्त सारणी की तीनों कमियों को सुधारा गया है। आधुनिक आवर्त सारणी में तत्वों का स्थान किन बातों पर निर्भर करता है, यह जानने के बाद हम हाइड्रोजन की असंगत स्थिति की चर्चा करेंगे।
5.3.1 आधुनिक आवर्त सारणी में तत्वों की स्थिति
आधुनिक आवर्त सारणी में 18 ऊर्ध्व स्तंभ हैं जिन्हें ‘समूह’ कहा जाता है तथा 7 क्षैतिज पक्तियाँ हैं जिन्हें ‘आवर्त’ कहा जाता है। आइए, देखते हैं कि किसी ‘समूह’ अथवा ‘आवर्त’ में तत्वों की स्थिति किस बात पर निर्भर करती है।
क्रियाकलाप 5.4
आधुनिक आवर्त सारणी के समूह 1 में उपस्थित तत्वों के नाम बताइए।
समूह 1 के पहले तीन तत्वों के इलेक्ट्रॉनिक विन्यास लिखिए।
इन तत्वों के इलेक्ट्रॉनिक विन्यास में क्या समानता है?
इन तीनों तत्वों में कितने संयोजकता इलेक्ट्रॉन हैं?
आप देखेंगे कि इन सभी तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या समान है। इसी प्रकार आप देखेंगे कि एक ही समूह के सभी तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या समान है। जैसे फ्लुओरीन (F) तथा क्लोरीन (Cl) जो समूह-17 के तत्व हैं। फ्लुओरीन एवं क्लोरीन के बाहरी कोश में कितने इलेक्ट्रॅान हैं? इससे पता चलता है कि आधुनिक आवर्त सारणी में समूह, बाहरी कोश के सर्वसम इलेक्ट्रॉनिक विन्यास को दर्शाता है। यद्यपि समूह में ऊपर से नीचे की ओर जाने पर कोशों की संख्या बढ़ती जाती है।
हाइड्रोजन की स्थिति अनिश्चित रहती है क्योंकि इसे पहले आवर्त के समूह 1 या समूह 17 किसी में भी रखा जा सकता है। क्या आप बता सकते हैं क्यों?
क्रियाकलाप 5.5
यदि आप आवर्त सारणी के आधुनिक (सारणी 5.6) रूप को देखें तो आपको पता चलेगा कि Li, Be, B, C, N, O, Fतथा Ne दूसरे आवर्त के तत्व हैं। इनका इलेक्ट्रॉनिक विन्यास लिखिए।
क्या इन सभी तत्वों के भी संयोजकता इलेक्ट्रॉनों की संख्या समान है।
क्या इनके कोशों की संख्या समान है।
आप देखेंगे कि इन दूसरे आवर्त के तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या तो भिन्न-भिन्न है लेकिन इनमें कोशों की संख्या समान है। आप यह भी देखेंगे कि आवर्त में बाईं से दाईं ओर जाने पर यदि परमाणु-संख्या में इकाई की वृद्धि होती है तो संयोजकता इलेक्ट्रॉनों की संख्या में भी इकाई वृद्धि होती है।
आप कह सकते हैं कि अध्यासित कोशों की समान संख्या वाले विभिन्न तत्वों के परमाणु एक ही आवर्त में स्थित हैं। Na, Mg, Al, Si, P, S, Cl एवं Ar आधुनिक आवर्त सारणी के तीसरे आवर्त में स्थित हैं क्योंकि इनके परमाणुओं के इलेक्ट्रॉन K, L एवं M कोशों में स्थित हैं। इन तत्वों के इलेक्ट्रॉनिक विन्यास लिखकर इस कथन की पुष्टि कीजिए। प्रत्येक आवर्त दर्शाता है कि एक नया कोश इलेक्ट्रॉनों से भरा गया।
पहले, दूसरे, तीसरे एवं चौथे आवर्त में कितने तत्व हैं?
विभिन्न कक्षों में भरे जाने वाले इलेक्ट्रॉनों की संख्या के आधार पर हम इन आवर्तों में तत्वों की संख्या बता सकते हैं। आगे की कक्षा में आप इस बारे में विस्तार से अध्ययन करेंगे। आप जानते हैं कि किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या एक सूत्र 2n2 पर निर्भर करती है जहाँ n, नाभिक से नियत कोश की संख्या को दर्शाता है।
जैसे,
K कोश – 2 × (1)2 = 2, प्रथम आवर्त में दो तत्व हैं।
L कोश – 2 × (2)2 = 8, दूसरे आवर्त में आठ तत्व हैं।
तीसरे, चौथे, पाँचवें, छटवें एवं सातवें आवर्त में तत्वों की संख्या क्रमशः 8, 18, 18, 32, 32, होती है, इसका कारण आप उच्च कक्षा में पढ़ेंगे।
आवर्त सारणी में तत्वों की स्थिति से उनकी रासायनिक अभिक्रियाशीलता का पता चलता है। आप जानते हैं कि तत्व द्वारा निर्मित आबंध के प्रारूप तथा इसकी संख्या संयोजकता इलेक्ट्रॉनों द्वारा निर्धारित होती है। क्या अब आप बता सकते हैं कि मेन्डेलीफ ने अपनी सारणी में तत्वों की स्थिति निर्धारित करने के लिए यौगिकों के सूत्र को आधार बनाया था, वह शुद्ध था। इस आधार पर समान रासायनिक गुणधर्म वाले तत्वों को एक ही समूह में कैसे रखा जा सकता है?
5.3.2 आधुुनिक आवर्त सारणी की प्रवृत्ति
संयोजकताः आप जानते हैं कि किसी भी तत्व की संयोजकता उसके परमाणु के सबसे बाहरी कोश में उपस्थित संयोजकता इलेक्ट्रॉनों की संख्या से निर्धारित होती है।
क्रियाकलाप 5.6
किसी तत्व के इलेक्ट्रॉनिक विन्यास से आप उसकी संयोजकता का परिकलन कैसे करेंगे?
परमाणु-संख्या 12 वाले मैग्नीशियम तथा परमाणु-संख्या 16 वाले सल्फ़र की संयोजकता क्या है?
इसी प्रकार पहले 20 तत्वों की संयोजकताएँ ज्ञात कीजिए।
आवर्त में बाईं से दाईं ओर जाने पर संयोजकता किस प्रकार परिवर्तित होती है?
समूह में ऊपर से नीचे जाने पर संयोजकता किस प्रकार परिवर्तित होती है?
परमाणु साइज़
परमाणु साइज़ से परमाणु की त्रिज्या का पता चलता है। एक स्वतंत्र परमाणु के केंद्र से उसके सबसे बाहरी कोश की दूरी ही परमाणु के साइज़ को दर्शाती है। हाइड्रोजन परमाणु की त्रिज्या 37 pm (पीकोमीटर, 1 pm = 10–12 m) है।
आइए, हम समूह तथा आवर्त में परमाणु साइज़ की विभिन्नता का अध्ययन करें।
क्रियाकलाप 5.7
दूसरे आवर्त के तत्वों की परमाणु त्रिज्याएँ नीचे दी गई हैंः
दूसरे आवर्त के तत्व B Be O N Li C
परमाणु त्रिज्या (pm) 88 111 66 74 152 77
इन्हें परमाणु त्रिज्या के अवरोही क्रम में व्यवस्थित कीजिए।
क्या ये तत्व अब आवर्त सारणी के आवर्त की तरह ही व्यवस्थित हैं?
किस तत्व का परमाणु सबसे बड़ा है एवं किसका सबसे छोटा है?
आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या किस प्रकार बदलती है?
आप देखेंगे कि आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या घटती है। नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर खींचता है जिससे परमाणु का साइज़ घटता जाता है।
क्रियाकलाप 5.8
प्रथम समूह के तत्वों के परमाणु त्रिज्या में परिवर्तन का अध्ययन कीजिए तथा उन्हें आरोही क्रम में व्यवस्थित कीजिए।
प्रथम समूह के तत्व ः Na Li Rb Cs K
परमाणु त्रिज्या (pm): 186 152 244 262 231
किस तत्व का परमाणु सबसे छोटा तथा किसका सबसे बड़ा है?
समूह में ऊपर से नीचे जाने पर परमाणु साइज़ में कैसा परिवर्तन होगा?
आप देखेंगे कि समूह में ऊपर से नीचे जाने पर परमाणु का साइज़ बढ़ता है। एेसा इसलिए होता है क्योंकि नीचे जाने पर एक नया कोश जुड़ जाता है। इससे नाभिक तथा सबसे बाहरी कोश के बीच की दूरी बढ़ जाती है और इस कारण नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का साइज़ बढ़ जाता है।
धात्विक एवं अधात्विक गुणधर्म
क्रियाकलाप 5.8
तीसरे आवर्त के तत्वों की जाँच कर उन्हें धातु एवं अधातु में वर्गीकृत कीजिए।
सारणी के किस ओर धातुएँ स्थित हैं?
सारणी के किस ओर अधातुएँ स्थित हैं?
Na एवं Mg जैसी धातुएँ सारणी के बाईं ओर तथा सल्फ़र एवं क्लोरीन जैसी अधातुएँ दाईं ओर स्थित हैं। मध्य में, सिलिकन स्थित है जिसे अर्द्धधातु या उपधातु कहते हैं। यह अधातु एवं धातु दोनों के गुणधर्म प्रदर्शित करती है।
आधुनिक आवर्त सारणी में एक टेढ़ी-मेढ़ी रेखा धातुओं को अधातुओं से अलग करती है। इस रेखा पर आने वाले तत्व–बोरोन, सिलिकन, जर्मेनियम, आर्सेनिक, एेंटिमनी, टेल्यूरियम एवं पोलोनियम धातुओं एवं अधातुओं दोनों के गुणधर्म प्रदर्शित करते हैं। इसलिए इन्हें अर्द्धधातु या उपधातु भी कहते हैं।
तीसरे अध्याय में आपने देखा कि आबंध बनाते समय धातु में इलेक्ट्रॉन त्यागने की प्रवृत्ति होती है अर्थात यह विद्युत धनात्मक होते हैं।
क्रियाकलाप 5.10
समूह में इलेक्ट्रॉन त्यागने की प्रवृत्ति किस प्रकार बदलती है?
आवर्त में यह प्रवृत्ति कैसे बदलेगी?
आवर्त में जैसे-जैसे संयोजकता कोश के इलेक्ट्रॉनों पर किया जाने वाला प्रभावी नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति घट जाती है। समूह में नीचे की ओर, संयोजकता इलेक्ट्रॉन पर क्रिया करने वाला प्रभावी नाभिकीय आवेश घटता है क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते हैं। इसलिए यह इलेक्ट्रॉन सुगमतापूर्वक निकल जाते हैं। इसलिए धात्विक अभिलक्षण आवर्त में घटता है तथा समूह में नीचे जाने पर बढ़ता है।
दूसरी ओर, अधातुएँ विद्युत ऋणात्मक होती हैं। उनमें इलेक्ट्रॉन ग्रहण करके आबंध बनाने की प्रवृत्ति होती है। आइए, इन गुणधर्मों की विविधता के बारे में जानकारी प्राप्त करें।
क्रियाकलाप 5.11
आवर्त में बाईं से दाईं ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी।
समूह में ऊपर से नीचे जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी।
विद्युतऋणात्मकता की प्रवृत्ति के अनुसार अधातुएँ आवर्त सारणी के दाहिनी ओर ऊपर की ओर स्थित होती हैं।
इन प्रवृत्तियों से हमें इन तत्वों से बने अॉक्साइडों की प्रकृति का भी पता चलता है क्योंकि धातुओं के अॉक्साइड क्षारकीय तथा अधातुओं के अॉक्साइड सामान्यतः अम्लीय होते हैं।
प्रश्न
1. आधुनिक आवर्त सारणी द्वारा किस प्रकार से मेन्डेलीफ की आवर्त सारणी की विविध विसंगतियों को दूर किया गया?
2. मैग्नीशियम की तरह रासायनिक अभिक्रियाशीलता दिखाने वाले दो तत्वों के नाम लिखिए? आपके चयन का क्या आधार है?
3. के नाम बताइएः
(a) तीन तत्वों जिनके सबसे बाहरी कोश में एक इलेक्ट्रॉन उपस्थित हो।
(b) दो तत्वों जिनके सबसे बाहरी कोश में दो इलेक्ट्रॉन उपस्थित हों।
(c) तीन तत्वों जिनका बाहरी कोश पूर्ण हो।
4. (a) लीथियम, सोडियम, पोटैशियम, ये सभी धातुएँ जल से अभिक्रिया कर हाइड्रोजन गैस मुक्त
करती हैं। क्या इन तत्वों के परमाणुओं में कोई समानता है?
(b) हीलियम एक अक्रियाशील गैस है जबकि निअॉन की अभिक्रियाशीलता अत्यंत कम है। इनके परमाणुओं में कोई समानता है?
5. आधुनिक आवर्त सारणी में पहले दस तत्वों में कौन सी धातुएँ हैं?
6. आवर्त सारणी में इनके स्थान के आधार पर इनमें से किस तत्व में सबसे अधिक धात्विक अभिलक्षण की विशेषता है?
Ga Ge As Se Be
आपने क्या सीखा
तत्वों को उनके गुणधर्मों में समानता के आधार पर वर्गीकृत किया गया है।
डॉबेराइन ने तत्वों को त्रिक में वर्गीकृत किया जबकि न्यूलैंड्स ने अष्टक का सिद्धांत दिया।
मेन्डेलीफ ने तत्वों को उनके परमाणुु द्रव्यमान के आरोही क्रम तथा रासायनिक गुणधर्मों के आधार पर वर्गीकृत किया।
मेन्डेलीफ ने आवर्त सारणी में खाली स्थानों के आधार पर नए तत्वों की भविष्यवाणी की।
तत्वों को परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित करने से होने वाली विसंगतियाँ, परमाणु संख्या के आरोही क्रम में व्यवस्थित करने से दूर हो गईं। तत्व के इस आधारभूत गुणधर्म अर्थात संख्या की खोज मोज्ले ने की।
आधुनिक आवर्त सारणी में तत्वों को 18 ऊर्ध्व स्तंभों, जिन्हें समूह कहते हैं तथा 7 क्षैतिज पंक्तियों जिन्हें आवर्त कहते हैं, में व्यवस्थित किया।
इस प्रकार व्यवस्थित तत्व, परमाणु साइज़, संयोजकता या संयोजन क्षमता तथा धात्विक एवं अधात्विक अभिलक्षण जैसे गुणधर्मों में आवर्तिता प्रदर्शित करते हैं।
अभ्यास
1. आवर्त सारणी में बाईं से दाईं ओर जाने पर, प्रवृत्तियों के बारे में कौन सा कथन असत्य है?
(a) तत्वों की धात्विक प्रकृति घटती है।
(b) संयोजकता इलेक्ट्रॉनों की संख्या बढ़ जाती है।
(c) परमाणु आसानी से इलेक्ट्रॉन का त्याग करते हैं।
(d) इनके अॉक्साइड अधिक अम्लीय हो जाते हैं।
2. तत्व X, XCl2 सूत्र का वाला एक क्लोराइड बनाता है जो एक ठोस है तथा जिसका गलनांक अधिक है। आवर्त सारणी में यह तत्व संभवतः किस समूह के अंतर्गत होगा?
(a) Na (b) Mg (c) Al (d) Si
3. किस तत्व में
(a) दो कोश हैं तथा दोनों इलेक्ट्रॉनों से पूरित हैं?
(b) इलेक्ट्रॉनिक विन्यास 2, 8, 2 है?
(c) कुल तीन कोश हैं तथा संयोजकता कोश में चार इलेक्ट्रॉन हैं?
(d) कुल दो कोश हैं तथा संयोजकता कोश में तीन इलेक्ट्रॉन हैं?
(e) दूसरे कोश में पहले कोश से दोगुने इलेक्ट्रॉन हैैं?
4. (a) आवर्त सारणी में बोरान के स्तंभ के सभी तत्वों के कौन से गुणधर्म समान हैं?
(b) आवर्त सारणी में फ्लुओरीन के स्तंभ के सभी तत्वों के कौन से गुणधर्म समान हैं?
5. एक परमाणु का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है।
(a) इस तत्व की परमाणु-संख्या क्या है?
(b) निम्न में किस तत्व के साथ इसकी रासायनिक समानता होगी? (परमाणु-संख्या कोष्ठक में दी गई है)
N(7) F(9) P(15) Ar(18)
6. आवर्त सारणी में तीन तत्व A, B तथा C की स्थिति निम्न प्रकार हैः
समूह 16 समूह 17
– –
– A
– –
B C
अब बताइए किः
(a) A धातु है या अधातु।
(b) A की अपेक्षा C अधिक अभिक्रियाशील है या कम?
(c) C का साइज़ B से बड़ा होगा या छोटा?
(d) तत्व A, किस प्रकार के आयन, धनायन या ऋणायन बनाएगा?
7. नाइट्रोजन (परमाणु-संख्या 7) तथा फ़ॉस्फ़ोरस (परमाणु-संख्या 15) आवर्त सारणी के समूह 15 के तत्व हैं। इन दोनों तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए। इनमें से कौन सा तत्व अधिक ऋण विद्युत होगा और क्यों?
8. तत्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्व की स्थिति से क्या संबंध है?
9. आधुनिक आवर्त सारणी में कैल्सियम (परमाणु-संख्या 20) के चारों ओर 12, 19, 21 तथा 38 परमाणु-संख्या वाले तत्व स्थित हैं। इनमें से किन तत्वों के भौतिक एवं रासायनिक गुणधर्म कैल्सियम के समान हैं?
10. आधुनिक आवर्त सारणी एवं मेन्डेलीफ की आवर्त सारणी में तत्वों की व्यवस्था की तुलना कीजिए।
सामूहिक क्रियाकलाप
1. हमने तत्वों के वर्गीकरण के लिए किए गए कुछ प्रमुख प्रयासों पर चर्चा की। (इंटरनेट या पुस्तकालय से) इस वर्गीकरण के लिए अन्य प्रयासों का पता लगाइए।
2. हमने आवर्त सारणी के विस्तृत रूप का अध्ययन किया है। आधुनिक आवर्त नियम का प्रयोग कर तत्वों को अन्य प्रकार से भी व्यवस्थित किया गया है, इनका पता लगाइए।