Table of Contents

अध्याय 9
जैव अणु
9.1 रासायनिक संघटन का विश्लेषण कैसे करें?
9.2 प्राथमिक एवं द्वितीयक उपापचयज
9.3 वृहत् जैव अणु
9.4 प्रोटीन
9.5 पॉलीसैकेराइड
9.6 न्यूक्लीक अम्ल
9.7 प्रोटीन की संरचना
9.8 एक बहुलक में एककों को जोड़ने वाले बंधों की प्रकृति
9.9 शरीर अवयवों की गतिक अवस्था- उपापचय की संकल्पना
9.10 जीव का उपापचयी आधार
9.11 जीव अवस्था
9.12 एंजाइम
इस जीवमंडल में विविध प्रकार के जीव मिलते हैं! मस्तिष्क में यह प्रश्न उठता है कि क्या सभी जीव रासायनिक संघटन की दृष्टि से एक ही प्रकार के तत्वों एवं यौगिकों से मिलकर बने होते हैं? आप रसायन विज्ञान में सीख चुके होगें कि तत्वों का विश्लेषण कैसे करते हैं! यदि पादप व प्राणी ऊतकों एवं सूक्ष्मजीवी लेई में तत्वों का परीक्षण करें तो हमें कार्बन, हाइड्रोजन, अॉक्सीजन व अन्य तत्वों की एक सूची प्राप्त होती है! जिनकी मात्रा जीव ऊतकों की प्रति इकाई मात्रा में भिन्न-भिन्न होती है! यदि उपरोक्त परीक्षण निर्जीव पदार्थ जैसे भू-पर्पटी के एक टुकड़ े का करें, तब भी हमें तत्वों की उपरोक्त सूची प्राप्त होती है! लेकिन उपरोक्त दोनों सूचियों में क्या अंतर है? सुनिश्चित तौर पर उनमें कोई अंतर नहीं मिलता है! सभी तत्व जो भू-पर्पटी के नमूने में मिलते हैं, वे सभी जीव ऊतकों के नमूने में भी मिलते हैं! फिर भी सूक्ष्म परीक्षण से पता चलता है कि कार्बन व हाइड्रोजन की मात्रा अन्य तत्वों की अपेक्षा किसी भी जीव में भू-पर्पटी से सामान्यतया ज्यादा होती है! (तालिका 9.1)
9.1 रासायनिक संघटन का विश्लेषण कैसे करें ?
इसी तरह से हम पूछ सकते हैं कि जीवों में कार्बनिक यौगिक किस रूप में मिलते हैं? उपरोक्त उत्तर पाने के लिए कोई व्यक्ति क्या करेगा? इसका उत्तर पाने के लिए हमें रासायनिक विश्लेषण करना होगा! हम किसी भी जीव ऊतक (जैसे-सब्जी या यकृत का टुकड़ ा आदि) को लेकर खरल व मूसल की सहायता से ट्राइक्लोरोएसिटिक अम्ल के साथ पीसते हैं, जिसके बाद एक गा\ढ़ा कर्दम (slurry) प्राप्त होता है, पुनः इसे महीन कपड़ े में रखकर कसकर निचोड़ने (छानने) के बाद हमें दो अंश प्राप्त होते हैं! एक अंश जो अम्ल में घुला होता है उसे निस्यंद कहते हैं व दूसरा अंश अम्ल में अविलेय है जिसे धारित कहते हैं! वैज्ञानिकों ने अम्ल घुलनशील भाग में हजारों कार्बनिक यौगिकों को प्राप्त किया! तुम्हें उच्च कक्षाओं में बताया जाएगा कि जीव ऊतकों के नमूनों का विश्लेषण व इनमें मिलने वाले, विशेषकर कार्बनिक यौगिकों की पहचान केसे की जाती है? किसी निचोड़ में मिलने वाले विशेष यौगिक को उसमें मिलने वाले अन्य यौगिकों से अलग करने के लिए विभिन्न पृथक्करण विधि अपनाते हैं, जब तक कि वह अलग नहीं हो जाता! दूसरे शब्दों में एक वियुक्त एक शुद्ध यौगिक होता है! विश्लेषणात्मक तकनीक का प्रयोग कर किसी भी यौगिक के आण्विकसूत्र व संभावित संरचना के बारे में जानकारी प्राप्त कर सकते हैं! जीव ऊतकों में मिलने वाले सभी कार्बनिक यौगिकों को ‘जैव अणु’ कहते हैं! लेकिन जीवों में भी अकार्बनिक तत्व व यौगिक मिलते हैं! हम यह कैसे जान पाते हैं? एक थोड़ ा भिन्न किंतु भंजक प्रयोग करना पड़ ेगा! जीव ऊतकों (पर्ण व यकृत) की थोड़ ी मात्रा को तोलकर (यह नम भार कहलाता है) शुष्क कर लें, जिससे संपूर्ण जल वाष्पित हो जाता है! बचे हुए पदार्थ से शुष्क भार प्राप्त होता है! यदि ऊतकों को पूर्ण रूप से जलाया जाए तो सभी कार्बनिक यौगिक अॉक्सीकृत होकर गैसीय रूप (CO2 व जल वाष्प) में अलग हो जाते हैं! बचे हुए पदार्थ को ‘भस्म’ कहते हैं! इस भस्म में अकार्बनिक तत्व (जैसे कैल्सियम, मैग्नीसियम आदि) मिलते हैं! अकार्बनिक यौगिक जैसे सल्फेट, फॉस्फेट आदि अम्ल घुलनशील अंश में मिलते हैं! इस कारण से तत्वीय विश्लेषण से किसी जीव ऊतक के तत्वीय संगठन की हाइड्रोजन, अॉक्सीजन, क्लोरीन, कार्बन आदि के रूप में जानकारी मिलती (सारणी 9.1) है! यौगिकों के परीक्षण से जीव ऊतकों में उपस्थित कार्बनिक व अकार्बनिक (तालिका 9.2) यौगिकों के बारे में जानकारी मिलती है! रसायन विज्ञान के दृष्टिकोण से क्रियात्मक समूह जैसे एेल्डीहाइड, कीटोन एरोमेटिक (Aromatic) यौगिकों आदि की पहचान की जा सकती है किंतु जीव विज्ञान की दृष्टि से इन्हें अमीनो अम्ल, न्यूक्लियोटाइड क्षार, वसा अम्ल इत्यादि में वर्गीकृत करते हैं!
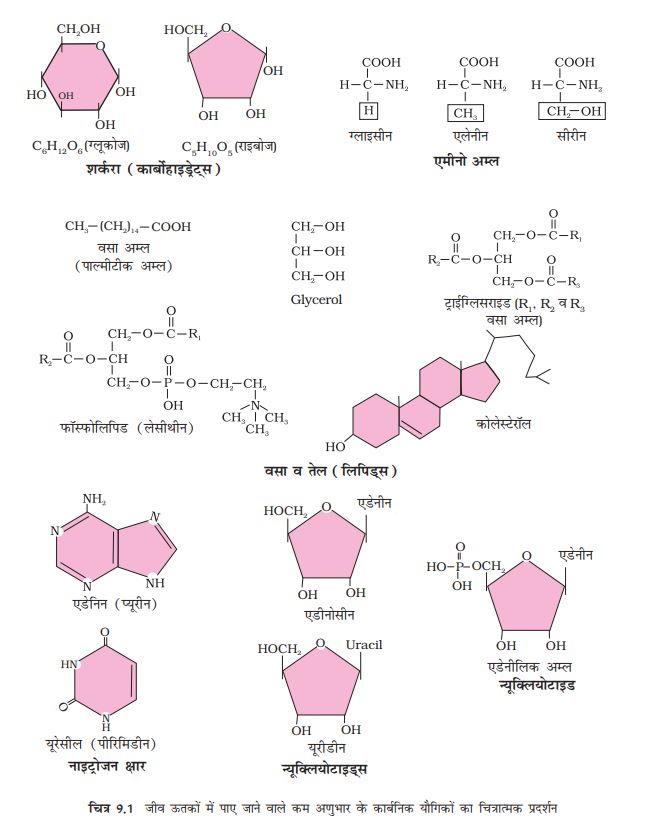
अमीनो अम्ल कार्बनिक यौगिक होते हैं जिनमें इसके एक ही कार्बन (α-कार्बन) पर एक अमीनो समूह व एक अम्लीय समूह प्रतिस्थापित होते हैं! इस कारण इन्हें (α) एल्फा अमीनो अम्ल कहते हैं! ये प्रतिस्थापित मेथेन हैं! चार प्रतिस्थाई समूह चार संयोजकता स्थल से जुड़ े रहते हैं! ये समूह हाइड्रोजन, कार्बोक्सिल समूह, अमीनो समूह तथा भिन्न परिवर्तनशील समूह जिसे R समूह, से व्यक्त करते हैं, पाए जाते हैं! R समूह की प्रकृति के आधार पर अमीनो अम्ल अनेक प्रकार के होते हैं फिर भी प्रोटीन में उपलब्धता के आधार पर ये 21 प्रकार के होते हैं! प्रोटीन के अमीनो अम्लों में R समूह, हाइड्रोजन (अमीनो अम्ल-ग्लाइसीन), मेथिल समूह (एेलेनीन), हाइड्रोक्सीमेथिल (सीरिन) आदि हो सकते हैं! 21 में से 3 को चित्र 9.1 में दर्शाया गया है!
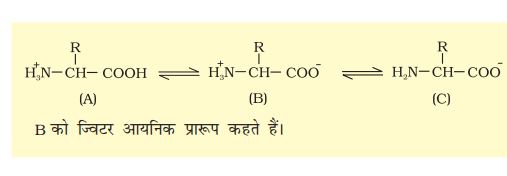
अमीनो अम्लों के भौतिक व रासायनिक गुण मुख्यतया अमीनो, कार्बोक्सिल व R क्रियात्मक समूह पर निर्भर है! अमीनो व कार्बोक्सिल समूहों की संख्या के आधार पर अम्लीय (उदाहरण ग्लुटामिक अम्ल), क्षारीय (उदाहरण लाइसिन) और उदासीन (उदाहरण वेलीन) अमीनो अम्ल होते हैं! इसी तरह से एरोमेटिक अमीनो अम्ल (टायरोसीन, फेनिलएेलेनीन, ट्रिप्टोफान) होते हैं! अमीनो अम्लों का एक विशेष गुण यह है कि अमीनो (-NH2) व कार्बोक्सिल (-COOH) समूह आयनिकरण प्रकृति के होते हैं, अतः विभिन्न pH वाले विलयनों में अमीनो अम्लों की संरचना परिवर्तित होती रहती हैं!
साधारणतया लिपिड पानी में अघुलनशील होते हैं! ये साधारण वसा अम्ल हो सकते हैं! वसा अम्ल में एक कार्बोक्सिल समूह होता है, जो एक R समूह से जुड़ ा होता है! R समूह मेथिल (-CH3), अथवा एेथिल -C2H5 या उच्च संख्या वाले -CH2 समूह (1 कार्बन से 19 कार्बन)! उदाहणार्थ - पाल्मिटिक अम्ल में कार्बोक्सिल कार्बन के सहित 16 कार्बन मिलते हैं! एेरेकिडोनिक अम्ल में कार्बोक्सिल कार्बन सहित 20 कार्बन परमाणु होते हैं! वसा अम्ल संतृप्त (बिना द्विक आबंध) या असंतृप्त (एक या एक से अधिक c=c द्विआबंध) प्रकार के हो सकते हैं! दूसरा साधारण लिपिड ग्लिसरॉल है जो ट्राइहाइड्रिक्ससी प्रोपेन होता है! बहुत सारे लिपिड्स में ग्लिसरॉल व वसा अम्ल दोनों मिलते हैं! यहाँ पर वसा अम्ल ग्लिसरॉल से एस्टरीकृत होता है तब वे मोनोग्लिसरॉइड, डाइग्लिसरॉइड तथा ट्राई ग्लिसरॉइड हो सकते हैं! गलन बिंदु के आधार पर वसा या तेल (oils) कहलाते हैं! तेलों का गलनांक अपेक्षाकृत कम होता है (जैसे जिंजेली तेल)! अतः सर्दियों में तेल के रूप में होते हैं! क्या आप बाजार में उपलब्ध वसा की पहचान कर सकते हैं? कुछ लिपिड्स में फॉस्फोरस व एक फॉस्फोरिलीकृत कार्बनिक यौगिक मिलते हैं! ये फॉस्फोलिपिड्स हैं, जो कोशिका झिल्ली में मिलते हैं जैसे लेसिथिन! कुछ ऊतक विशेष तैार तंत्रिका ऊतक में अधिक जटिल संरचना के लिपिड पाए जाते हैं!
जीवों में बहुत सारे कार्बनिक यौगिक विषमचक्रीय वलय युक्त भी होते हैं! इनमें से कुछ नाइट्रोजन क्षार-एेडेनीन, ग्वानीन, साइटोसीन, यूरेसिल व थायमीन हैं! ये शर्करा से जुड़ कर न्यूक्लिोसाइड बनाते हैं! यदि इनसे फॉस्फेट समूह भी शर्करा से इस्टरीकृत रूप में हो तो इन्हें न्यूक्लियोटाइड कहते हैं! एेडेनोसिन, ग्वानोसिन, थायमिडिन, यूरिडिन व साइटिडिन न्यूक्लियोसाइड हैं! एेडेनिलिक अम्ल, थायमेडिलिक अम्ल, ग्वानिलिक अम्ल, यूरिडिलिक अम्ल व सिटिडिलिक अम्ल न्यूक्लियोटाइड्स हैं! न्यूक्लीक अम्ल जैसे डीएनए (DNA) व आरएनए आनुवंशिक पदार्थ के रूप में कार्य करते हैं!
9.2 प्राथमिक व द्वितियक उपापचयज
रसायन विज्ञान की एक महत्वपूर्ण शाखा में जीवों के हजारों बड़ े-छोटे यौगिकों का विलगन (पृथक्करण) किया जाता है! उनकी संरचना निर्धारित की जाती है और संभव हो तो उन्हें संश्लेषित किया जाता है! यदि कोई जैव अणुओं की एक तालिका बनाए तो उनमें हजारों कार्बनिक यौगिक जैसे अमीनो अम्ल, शर्करा इत्यादि पाए जाएंगे! कुछ कारणों से जिन्हें खंड 9.10 में दिया गया है, को हम उपापचयज कहते हैं! उपरोक्त सभी श्रेणी के इन यौगिकों की उपस्थिति को जिन्हें (चित्र 9.1) में दर्शाया गया है! कोई व्यक्ति प्राणि ऊतकों में ज्ञात कर सकता है! इन्हें प्राथमिक उपापचयज कहते हैं! जब कोई पादप, कवक व सूक्ष्म जीवी कोशिकाओं का विश्लेषण करें तो उसे इन प्राथमिक उपापचयजों के अतिरिक्त हजारों यौगिक जैसे- एल्केलायड्, फ्लेवेनोयड्स, रबर, वाष्पशील तेल, प्रतिजैविक, रंगीन वर्णक, इत्र, गोंद, मसाले मिलते हैं! इन्हें द्वितीयक उपापचयज कहते हैं (तालिका 9.3)! प्राथमिक उपापचयज ज्ञात कार्य करते हैं व सामान्य कार्यिकी प्रक्रिया में इनकी भूमिका भी ज्ञात है, किंतु हम इस समय सभी द्वितीयक उपापचयजों की (जिन प्राणियों में ये पाए जाते हैं, में उनकी) भूमिका या कार्य नहीं जानते! जबकि इनमें से बहुत (जैसे- रबर, औषधि, मसाले, इत्र व वर्णक) मनुष्य के कल्याण में उपयोगी हैं! कुछ द्वितीयक उपापचयजों का पारिस्थितिक महत्व है! आप बाद के अध्यायों व वर्षों में इनके बारे में विस्तृत रूप से अध्ययन करेंगे!
9.3 वृहत् जैव अणु
अम्ल घुलनशील भाग में पाए जाने वाले सभी यौगिकों की एक सामान्य विशेषता है कि इनका अणुभार 18 से लगभग 800 डाल्टॉन के आस-पास होता है!
अम्ल अविलेय अंश में केवल चार प्रकार के कार्बनिक यौगिक जैसे प्रोटीन, न्यूक्लीक अम्ल, पॉलीसैकेराइड्स व लिपिड्स मिलते हैं! लिपिड्स के अतिरिक्त इस श्रेणी के यौगिकों का अणु भार दस हजार डाल्टॉन या इसके ऊपर होता है! इस कारण से जैव अणु अर्थात् जीवों में मिलने वाले रासायनिक यौगिक दो प्रकार के होते हैं! एक वे हैं जिनका अणुभार एक हजार डाल्टॉन से कम होता है; उन्हें सामान्यतया सूक्ष्मअणु या जैव अणु कहते हैं; जबकि जो अम्ल अविलेय अंश में पाए जाते हैं; उन्हें वृहत् अणु या वृहत् जैव अणु कहते हैं!
लिपिड्स के अतिरिक्त अविलेय अंशों में पाए जाने वाले अणु बहुलक पदार्थ होते हैं! लिपिड्स जिनके अणुभार 800 से अधिक नहीं होते, वे अम्ल अविलेय अंश या वृहत् आण्विक अंश की श्रेणी में क्यों आते हैं? वास्तव में लिपिड्स कम अणुभार के यौगिक होते हैं, वे एेसे ही नहीं मिलते, बल्कि कोशिका झिल्ली और दूसरी झिल्लियों में पाए जाते हैं! जब हम ऊतकों को पीसते हैं तब कोशकीय संरचना विघटित हो जाती है! कोशिकाझिल्ली व अन्य दूसरी झिल्लियाँ टुकड़ ों में विख्ांडित हो जाती हैं, तथा पुटिका बनाती हैं जो जल में घुलनशील नहीं हैं! इस कारण से इन झिल्लियों के पुटिका के रूप में टुकड़ े अम्ल अविलेय भाग के साथ पृथक् हो जाते हैं, जो वृहत् आण्विक अंश का भाग होते हैं! सही अर्थ में लिपिड्स वृहत् अणु नहीं है! अम्ल विलेय अंश वास्तव में कोशिका द्रव्य संगठन का भाग है! कोशिका द्रव्य व अंगकों के वृहत् अणु अम्ल अविलेय अंश होते हैं! ये दोनों आपस में मिलकर जीव ऊतकों या जीवों का संगठन बनाते हैं!
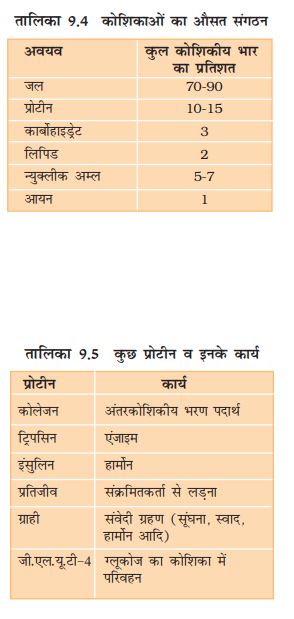
संक्षेप में, यदि जीव ऊतकों में पाए जाने वाले रासायनिक संगठन को बाहुल्यता की दृष्टि से श्रेणीबद्ध किया जाए तो हम पाते हैं कि जीवों में पानी सबसे सर्वाधिक बाहुल्यता से मिलने वाला रसायन है! (तालिका 9.4)
9.4 प्रोटीन
प्रोटीन पॉलीपेप्टाइड होते हैं! ये अमीनो अम्ल की रेखीय शृंखलाएं होती हैं, जो पेप्टाइड बंधों से जुड़ ी होती हैं; जैसा कि चित्र 9.2 में दर्शाया गया है!
प्रत्येक प्रोटीन अमीनो अम्ल का बहुलक है! अमीनो अम्ल 20 प्रकार के होने से (जैसे-एलेनीन, सिस्टीन, प्रोलीन, ट्रीप्टोफान, लाइसीन आदि) होते हैं! प्रोटीन समबहुलक नहीं, बल्कि विषम बहुलक होते हैं! एक समबहुलक एक एकलक की कई बार आवर्ती के कारण बनता है! अमीनो अम्ल के बारे में यह जानकारी अति महत्वपूर्ण है जैसा कि बाद में पोषण अध्याय में आप प\ढ़ेंगे कि कुछ अमीनो अम्ल स्वास्थ्य के लिए अति आवश्यक होते हैं, जिनकी आपूर्ति खाद्य पदार्थों के द्वारा होती है! इस तरह आहार की प्रोटीन इन आवश्यक अमीनो अम्ल की स्रोत होती हैं! इस प्रकार से अमीनो अम्ल अनिवार्य या अनानिवार्य हो सकते हैं! अनानिवार्य वे होते हैं जो हमारे शरीर में बनते हैं! जबकि हम अनिवार्य अमीनो अम्लों की आपूर्ति अपने खाद्य पदार्थ से करते हैं! प्रोटीन जीवों में बहुत सारे कार्य करते हैं, इनमें कुछ पोषकों के कोशिका झिल्ली से होकर अभिगमन, करने तथा कुछ संक्रामक जीवों से बचाने में सहायक होती हैं और कुछ एंजाइम के रूप में होती हैं (तालिका 9.5)!
9.5 पॉलीसैकेराइड्स
अम्ल अविलेय भाग में दूसरे श्रेणी के वृहत् अणुओं की तरह पॉलीसैकेराइड्स (कार्बोहाइट्रेडस) भी पाए जाते हैं! ये पॉलीसैकेराइड्स शर्करा की लंबी शृंखला होती है! यह शृंखला सूत्र की तरह (कपास के रेशे) विभिन्न प्रकार एकल सैकेराइड्स से मिलकर बने होते हैं! उदाहरणार्थ, सेलुलोज एक बहुलक पॉलीसैकेराइड होता है जो एक प्रकार के मोनोसैकेराइड जैसे ग्लूकोज का बना होता है! सेलुलोज एक सम बहुलक है! इसका एक परिवर्तित रूप स्टार्च (मंड) सेलुलोज से भिन्न होता है, लेकिन यह पादप ऊतकों में ऊर्जा भंडार के रूप में मिलता है! प्राणियों में एक अन्य परिवर्तित रूप होता है जिसे ग्लाइकोजन कहते हैं! इनूलिन फ्रुक्टोज का बहुलक है! एक पॉलीसैकेराइड शृंखला (जैसे ग्लाइकोजन) का दाहिना सिरा अपचायक व बाया सिरा अनअपचायक कहलाता है! यह शाखायुक्त होती है, जो व्यंगचित्र जैसी दिखाई देती है (चित्र 9.2)!
मंड में द्वितीयक कुंडलीदार संरचना मिलती है! वास्तव में मंड में आयोडीन अणु इसके कुंडलीय भाग से जुड़ े होते हैं! आयोडीन अणु मंड से जुड़ कर नीला रंग देता है! सेलुलोज में उपरोक्त जटिल कुंडलियाँ नहीं मिलने के कारण आयोडीन इसमें प्रवेश नहीं कर पाता है!
पादप कोशिका भित्ति सेलुलोज की बनी होती है! कागज पौधों की लुगदी से बना होता है जो सेलुलोज होता है! रूई के धागे सेलुलोज के बने होते हैं! प्रकृति में बहुत सारे जटिल पॉलीसैकेराइड्स मिलते हैं! ये अमीनो शर्करा व रासायनिक रूप से परिवर्तित शर्करा (जैसे - ग्लूकोसमीन, एनएसीटाइल ग्लूकोसएमीन आदि) से मिलकर बने होते हैं! जैसे आर्थोपोडा के बाह्यकंकाल जटिल सैकेराइड्स काइटीन से बने होते हैं! ये जटिल पॉलीसैकेराइड्स अधिकतर समबहुलक होते हैं!
9.6 न्यूक्लीक अम्ल
दूसरे प्रकार का एक वृहत् अणु जो किसी भी जीव ऊतक के अम्ल अविलेय अंश में मिलता है, उसे न्यूक्लीक अम्ल कहते हैं! यह पॉलीयूक्लीयोटाइडस होते हैं! यह पॉलीसैकेराइड्स व पॉली पेप्टाइड्स के साथ समाविष्ट होकर किसी भी जीव ऊतक या कोशिका का वास्तविक वृहत्आण्विक अंश बनाता है! न्यूक्लीक अम्ल न्यूक्लीयोटाइड से मिलकर बने होते हैं! एक न्यूक्लीयोटाइड तीन भिन्न रासायनिक घटकों से मिलकर बना होता है! पहला विषम चक्रीय यौगिक, दूसरा मोनोसैकेराइड व तीसरा फॉस्फोरिक अम्ल या फॉस्फेट होता है!
यदि चित्र 9.1 को ध्यान दें तो पाएंगे कि न्यूक्लीक अम्ल में विषमचक्रीय यौगिक नाइट्रोजन क्षार जैसे- एेडेनीन, ग्वानीन, यूरेसील, साइटोसीन व थाईमीन होते हैं! एेडेनीन व ग्वानीन प्रतिस्थापित प्यूरीन है तथा अन्य तीन प्रतिस्थापित पीरीमिडीन हैं! विषमचक्रीय वलय को क्रमशः प्यूरीन व पीरीमिडिन कहते हैं! पॉलीन्यूक्लीयोटाइड में मिलने वाली शर्करा या तो राइबोज (मोनोसैकेराइड पेंटोज) या डीअॉक्सीराइबोज होती है! जिस न्यूक्लीक अम्ल में डीअॉक्सीराइबोज मिलता है, उसे डीअॅाक्सीराइबोन्यूक्लीक अम्ल (डीएनए) व जिसमें राइबोज मिलता है, उसे राइबोन्यूक्लीक अम्ल (आरएनए) कहते हैं!
9.7 प्रोटीन की संरचना
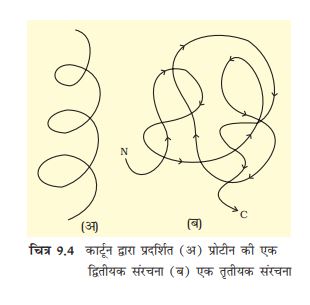
जैसा की पहले बताया गया है कि प्रोटीन विषमबहुलक होते हैं जो अमीनो अम्ल की लड़ ियों से बने होते हैं! अणुओं की संरचना का अर्थ विभिन्न संदर्भों में भिन्न-भिन्न होता है! अकार्बनिक रसायन में संरचना का संबंध आण्विकसूत्र से होता है (जैसे NaCl, MgCl2 आदि)! कार्बनिक रसायनविज्ञनी जब अणुओं की संरचना (जैसे-बेंजीन, नैफ्थलीन आदि) को व्यक्त करते हैं तो वे हमेशा उसके द्विआयामी दृश्य को व्यक्त करते हैं! भौतिक वैज्ञानी आण्विक संरचना के त्रिआयामी दृश्य को; जबकि जीव विज्ञानी प्रोटीन की संरचना चार तरह से व्यक्त करते हैं! प्रोटीन में अमीनो अम्ल के क्रम व इसके स्थान के बारे में जैसे कि पहला, दूसरा व इसी प्रकार अन्य कौन सा अमीनो अम्ल होगा, की जानकारी को प्रोटीन की प्राथमिक संरचना कहते हैं (चित्र 9.3 अ)! कल्पना करें किप्रोटीनएक रेखा है तो इसके बाएं सिरे पर प्रथम व दाएं सिरे पर अंतिम अमीनो अम्ल मिलता है! प्रथम अमीनो अम्ल को नाइट्रोजनसिरा अमीनो अम्ल कहते हैं, जबकि अंतिम अमीनो अम्ल को कार्बनसिरा (C-सिरा) अमीनो अम्ल कहते हैं! प्रोटीन लड़ ी हमेशा फैली हुई दृ\ढ़ छड़ ी जैसी रचना नहीं होती है! यह लड़ ी कुंडली की तरह मुड़ ी होती है (घूमती हुई सी\ढ़ी की तरह)! वास्तव में प्रोटीन लड़ ी कुछ का अंश कुंडली के रूप में व्यवस्थित होता है! प्रोटीन में केवल दक्षिणावर्ती कुंडलियाँ मिलती हैं! अन्य जगहों पर प्रोटीन की लड़ ी दूसरे रूप में मुड़ ी हुई होती है, इन्हें द्वितीयक संरचना (चित्र 9.4 ब) कहते हैं! इसके अतिरिक्त प्रोटीन की लंबी कड़ ी अपने ऊपर ही ऊन के एक खोखले गोले के समान मुड़ ी हुई होती है जिसे प्रोटीन की तृतीयक संरचना कहते हैं (चित्र 9.4 स)! यह प्रोटीन के त्रिआयामी रूप को प्रदर्शित करता है! तृतीयक संरचना प्रोटीन के जैविक क्रियाकलापों के लिए नितांत आवश्यक है!
कुछ प्रोटीन एक से अधिक पॉलीपेप्टाइड्स या उपइकाइयों के समूह होते हैं, जिस ढंग से प्रत्येक पॉलीपेप्टाइड्स या उपइकाई एक दूसरे के सापेक्ष व्यवस्थित होती हैं (उदाहरण, गोले की सीधी लड़ ी, गोले एक दूसरे के ऊपर व्यवस्थित होकर घनाभ या पट्टिका की संरचना आदि)! वे प्रोटीन के स्थापत्य को प्रदर्शित करती हैं, जिसे प्रोटीन की चतुष्क संरचना (चित्र 9.4 द) कहते हैं! वयस्क मनुष्य का हीमोग्लोबीन चार उपखंडों का बना होता है! इनमें दो एक दूसरे के समान होते हैं! दो उपखंड अल्फा (α) व दो उपखंड बीटा (β) प्रकार के होते हैं, जो आपस में मिलकर मनुष्य के हीमोग्लोबीन (Hb) बनाते हैं!
9.8 एक बहुलक में एककाें को जोड़ ने वाले बंधों की प्रकृति
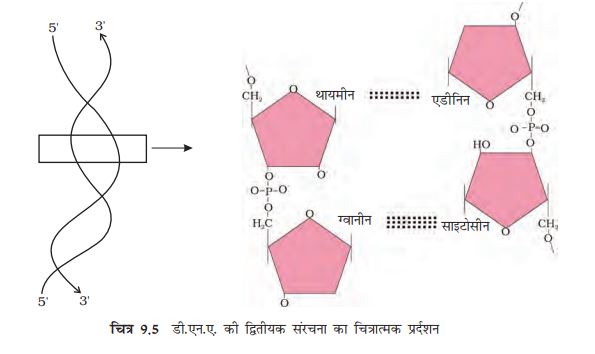
किसी भी पॉलीपेप्टाइड या प्रोटीन में एमीनो अम्ल पेप्टाइड बंध द्वारा जुड़ े होते हैं, जो एक एमीनो अम्ल के कार्बाक्सिल (-COOH) समूह व अगले अमीनो अम्ल के एमीनो (-NH2) समूह के बीच अभिक्रिया के उपरांत जल अणु के निकलने के बाद बनता है (इस प्रक्रिया को निर्जलीकरण कहते हैं)! एक पॉलीसैकेराइड में मोनोसेकेराइड संभवतः ग्लाइकोसाइडिक बंध द्वारा जुड़ े रहते हैं! यह बंध भी निर्जलीकरण द्वारा बनता है! यह बंध पास के दो मोनो सैकेराइड के दो कार्बन परमाणु के बीच बनता है! न्यूक्लीक अम्ल में एक न्यूक्लीओटाइड के एक शर्करा का 3’- कार्बन अनुवर्ती न्यूक्लीओटाइड के शर्करा के 5’- कार्बन से फॉस्फेट समूह द्वारा जुड़ ा होता है! शर्करा के फॅास्फेट व हाइड्राक्सिल समूह के बीच का बंध एक एस्टर बंध होता है! एस्टर बंध दोनों तरफ मिलता है, अतः इसे फॉस्फोडाएटस्टर बंध कहते हैं (चित्र 9.5)!
न्यूक्लीक अम्लों में विभिन्न प्रकार की द्वितीयक संरचना मिलती है! उदाहरणार्थ बाटसन क्रिक का प्रसिद्ध नमूना डीएनए की द्वितीयक संरचना को प्रदर्शित करता है! इस नमूने से स्पष्ट है कि डीएनए एक दोहरी कुंडली के रूप में मिलता है! पॉलीयूक्लीओटाइड्स की दोनों लड़ ियाँ प्रति समानांतर है जो एक दूसरे की विपरीत दिशाओं में होती हैं! इनका मुख्य भाग शर्करा-फॉस्फेट-शर्करा शृंखला से बना होता है! नाइट्रोजन क्षार एक दूसरे की तरफ मुख किए हुए मुख्य भाग पर लगभग लंबवत प्रक्षेपित होते हैं! एक लड़ ी के क्षार ए एवं जी अनिवार्यता दूसरे लड़ ी के क्षार क्रमशः टी एवं सी से क्षार युग्म बनाते हैं! ए एवं टी के बीच दो हाइड्रोजन बंध जबकि जी व सी के बीच तीन हाइड्रोजन बंध होते हैं! प्रत्येक शृंखला एक घुमावदार सी\ढ़ी जैसी प्रतीत होती है! सी\ढ़ी का प्रत्येक पद क्षारों युग्मों का बना होता है! सी\ढ़ी का प्रत्येक पद दूसरे पद से 360 के कोण पर घूमा होता है! कुंडलित शृंखला के एक पूर्ण घुमाव में दस पद या दस क्षार युग्म पाए जाते हैं! इस तरह आप डीएनए का रेखाचित्र बनाने का प्रयास कर सकते हैं! एक पूर्ण घुमाव की लंबाई 34A° (एंग्स्ट्राम) होता है जबकि दो क्षार युग्मों के बीच खड़ ी दूरी 3.4A° एंग्स्ट्राम होती है! उपरोक्त वर्णित विशेषतायुक्त डीएनए को बीडीएनए कहते हैं! उच्च कक्षाओं में तुम्हें बताया जाएगा कि एक दर्जन से भी अधिक प्रकार के डीएनए होते हैं, जिनका नामकरण संरचनात्मक विशेषता के आधार पर अंग्रेजी की वर्णमाला के आधार पर किया गया है!
9.9 शरीर अवयवों की गतिक अवस्था-उपापचय की संकल्पना
हम लोगाें ने अब तक जो अध्ययन किया है उसके अनुसार जीव, चाहे वह साधारण जीवाणु कोशिका हो, प्रोटोजोआ, पौधा या प्राणी हो, ये सभी हजारों कार्बनिक यौगिकों से मिलकर बने होते हैं! ये यौगिक या जैव अणु एक निश्चित सांद्रता में मिलते हैं (इन्हें मोल्स प्रति कोशिका या मोल्स प्रति लीटर आदि के रूप में व्यक्त करते हैं)! अध्ययनों से एक जो प्रमुख जानकारी प्राप्त हुई है उसके अनुसार जैव अणुओं में हेर-फेर होता रहता है! इससे तात्पर्य यह है कि ये लगातार दूसरे नए जैव अणुओं में परिवर्तित होते रहते हैं और दूसरे जैव अणुओं से मिलकर बनते रहते है! जीवधारियों में यह निर्माण व विखंडन रासायनिक अभिक्रिया द्वारा लगातार होता रहता है! सभी इन रासायनिक अभिक्रियाओं को उपापचय कहते हैं! सभी उपापचयी अभिक्रियाओं द्वारा जैवअणुओं का रूपांतरण होता रहता है! कुछ उपापचयी रूपांतरण के उदाहरण निम्न हैं-एमीनो अम्ल से कार्बनडाइअॉक्साइड के निकलने के बाद एमीनो अम्ल का एमीन में बदलना, न्यक्लीयोटाइड क्षार से एमीनो समूह का अलग होना, डाईसैकेराइड में ग्लाइकोसाइडिक बंध का जल अपघटन! इस प्रकार दस से हजारों उदाहरणों की सूची बना सकते हैं! अधिकांशतः इस प्रकार की रासायनिक अभिक्रियाएं अकेले नहीं होती, बल्कि सदैव अन्य दूसरी अभिक्रियाओं से जुड़ ी होती हैं! उपापचयजों का एक दूसरे में परिवर्तन आपस में जुड़ ी हुई अभिक्रियाओं की शृंखलाओं से होता है, जिन्हें उपापचयी पथ कहते हैं! ये उपापचयी पथ शहर की कार/मोटर यातायात व्यवस्था जैसी होती है! ये पथ या तो रेखीय या वृत्ताकार होते हैैं! ये पथ एक दूसरे से आड़ े-तिरछे यातायात के संगम जैसे दिखाई पड़ ते हैं! उपापचयज यातायात के कार/मोटर सदृश एक निश्चित वेग व दिशा में उपापचयी पथ से होकर गमन करते हैं! यह उपापचयज बहाव शरीर के घटकों की गतिक अवस्था कहलाता है! सबसे महत्वपूर्ण यह है कि आपस में जुड़ ा हुआ यह उपापचयी यातायात अत्यंत निर्वाध गति से बिना दुर्घटना के स्वस्थ अवस्था बनाए रखने के लिए होता रहता है! इन उपापचयी अभिक्रियाओं की दूसरी विशेषता यह है कि इनकी प्रत्येक रासायनिक क्रिया उत्प्रेेरित अभिक्रियाएं हैं! जीव तंत्र में कोई भी उपापचयी रूपांतरण बिना उत्प्रेरक के स्ांपन्न नहीं होता है! कार्बनडाइअॉक्साइड का पानी में घुलना जो एक भौतिक प्रक्रिया है, लेकिन जीव तंत्र में यह एक उत्प्रेरित अभिक्रिया होती है! उत्प्रेेरक जो किसी उपापचयी रूपांतरण की गति को ब\ढ़ाते हैं, वे भी प्रोटीन होते हैं! ये प्रोटीन जिनमें उत्प्रेरण की क्षमता होती है उन्हें एंजाइम कहते हैं!
9.10 जीव का उपापचयी आधार
उपापचयी पथ द्वारा साधारण पदार्थों से जटिल पदार्थ (जैसे एसीटीक अम्ल से कोलेस्ट्राल का बनना)व जटिल पदार्थों से सरल पदार्थों (जैसे कंकाली पेशियों में ग्लूकोज से लैक्टिक अम्ल) का निर्माण होता रहता है! पहली प्रकार की प्रक्रिया को जैव संश्लेषण पथ या उपचयी पथ कहते हैं! दूसरी प्रक्रिया में अपचय या विखंडन होता है, इसलिए इसे अपचयी पथ कहते हैं! उपचयी पथों में ऊर्जा खर्च होती है! एमिनो अम्लों से प्रोटीन के निर्माण में ऊर्जा की आवश्यकता होती है! दूसरी तरफ अपचयी पथ द्वारा ऊर्जा मुक्त होती है, जैसे कंकाली पेशियों में जब ग्लूकोज लैक्टिक अम्ल में टूटता है तो ऊर्जा मुक्त होती है! यह उपापचयी पथ जिसके द्वारा ग्लूकोज से लैक्टिक अम्ल का निर्माण होता है, 10 उपापचयी चरणों में पूर्ण होता है तथा इसे ग्लाइकोलिसिस कहते हैं! जीवों में विखंडन द्वारा निकलने वाली यह ऊर्जा रासायनिक बंध के रूप में संचित कर ली जाती है! यह बंध ऊर्जा जब और जहाँ आवश्यक होती है; जैसे जैव संश्लेषण, परासरण व यांत्रिक कार्य किए जाने पर, इसका उपयोग किया जाता है! ऊर्जा की मुद्रा का सर्वाधिक महत्वपूर्ण स्वरूप जीव तंत्र में एक रसायन में बंध ऊर्जा के रूप में मिलता है जिसे एडीनोसीन ट्राई फास्फेट (एटीपी) कहते हैं!
जीव अपनी ऊर्जा कैसे प्राप्त करते हैं? उनमें किस तरह की योजना विकसित हुई है? वे इस ऊर्जा को कैसे व किस रूप में संचित करते हैं? इस ऊर्जा को वे कार्य में कैसे बदलते हैं? तुम इन सब चीजों के बारे में बाद में उच्च कक्षाओं में एक नई शाखा में अध्ययन करोगे, जिसे ‘जैव ऊर्जा विज्ञान’ (Bioenergetics) कहते हैं!
9.11 जीव अवस्था
इस अवस्था में आप समझ चुके होंगे कि जीवों में उनके अनुसार एक निश्चित सांद्रता में हजारों रासायनिक यौगिक मिलते हैं, जिसे उपापचयज या जैव अणु कहते हैं, उदाहरणार्थ सामान्य स्वस्थ व्यक्ति में रक्त शर्करा की मात्रा 4.2-6.1 मिलीमोल जबकि हार्मोन की नैनोग्राम प्रति मिलीलीटर होती है! सबसे महत्वपूर्ण तथ्य यह है कि जैविक तंत्र में सभी जीव एक स्थिर अवस्था में मिलते हैं जिनमें सभी जैव अणुओं की एक निश्चित मात्रा होती है! ये जैव अणु एक उपापचयी प्रवाह में होते हैं! कोई भी रासायनिक या भौतिक प्रक्रिया स्वतः साम्यावस्था को प्राप्त करती है! स्थिर अवस्था एक असाम्यावस्था होती है! भौतिक सिद्धांत के अनुसार कोई भी तंत्र साम्यावस्था में कार्य नहीं कर सकता है! जैसा कि जीव हमेशा कार्य करते हैं, उनमें कभी भी साम्यावस्था की स्थिति नहीं हो सकती है! अतः जीव अवस्था एक असाम्य स्थाई अवस्था होती है, जिससे कार्य संपन्न होता है! जीव प्रक्रिया एक लगातार प्रयास है जिसमें साम्यावस्था से बचा जा सके!
इसके लिए सदा ऊर्जा की आवश्यकता होती है! उपापचय वह प्रक्रिया है जिससे ऊर्जा प्राप्त होती है! अतः जीव अवस्था व उपापचय एक दूसरे के पर्यायवाची होते हैं! बिना उपापचय के जीव अवस्था प्राप्त नहीं हो सकती है!
9.12 एंजाइम
लगभग सभी एंजाइम प्रोटीन होते हैं! कुछ न्यूक्लीक अम्ल एंजाइम की तरह व्यवहार करते हैं, इन्हें राइबोजाइम्स कहते हैं! किसी भी एंजाइम को रेखीय चित्र द्वारा चित्रित कर सकते हैं! एक एंजाइम में भी प्रोटीन की तरह प्राथमिक संरचना मिलती है जो एमीनो अम्ल की शृंखला से बना होता है! प्रोटीन की तरह एंजाइम में भी द्वितीयक व तृतीयक संरचना मिलती है! जब आप तृतीयक संरचना (चित्र 9.4ब) को देखेंगे तो ध्यान देंगे कि प्रोटीन शृंखला का प्रमुख भाग अपने ऊपर स्वयं कुंडलित होता है और शृंखला स्वयं आड़ ी-तिरछी स्थित होती है! इससे बहुत सी दरार या थैलियाँ बन जाती हैं! इस प्रकार की थैली को सक्रिय स्थल कहते हैं! एंजाइम का सक्रिय स्थल वे दरार या थैली हैं, जिनमें क्रियाधार आकर व्यवस्थित होते हैं! इस प्रकार एंजाइम सक्रिय स्थल द्वारा अभिक्रियाओं को तेज गति से उत्प्रेरित करता है! एंजाइम उत्प्रेरक अकार्बनिक उत्प्रेरक से कई प्रकार से भिन्न होते हैं; लेकिन इनमें एक बहुत बड़ े अंतर को जानना आवश्यक है! अकार्बनिक उत्प्रेरक उच्च तापक्रम व दाब पर कुशलता से काम करते हैं! एंजाइम अणु उच्च तापक्रम (400 से. से ऊपर) पर क्षतिग्रस्त हो जाते हैं! साधारणतया अति उच्च तापक्रम (जैसे गर्म स्रोतों या गंधक के झरनों में) पाए जाने वाले जीवों से प्राप्त एंजाइम स्थाई होते हैं और उनकी उत्प्रेरक शक्ति उच्च तापक्रम (800 से 900 से. तक) पर भी बनी रहती है! उपरोक्त एंजाइम जो उष्मा स्नेही जीवों से पृथक् किए गए हैं, उष्मास्थाई होते हैं! यह उनकी विशेषता है!
9.12.1 रासायनिक अभिक्रियाएं
एंजाइम्स क्या होते हैं? इससे पहले यह समझ लेना आवश्यक है कि रासायनिक अभिक्रिया क्या होती है! रासायनिक यौगिकों में दो तरह के परिर्वतन होते हैं! पहला भौतिक परिवर्तन जिसमें बिना बंध के टूटे हुए यौगिक के आकार में परिवर्तन होता है! अन्य भौतिक प्रक्रिया में द्रव्य की अवस्था में परिवर्तन होता है, जैसे बर्फ का पिघलकर पानी में परिवर्तित होना या पानी का वाष्प में बदलना! ये भौतिक प्रक्रियाएं हैं! रूपांतरण के समय बंधों का टूटना व नये बंधों का निर्माण होना ही रासायनिक अभिक्रिया होती है! उदाहरण -बेरियम हाइड्राक्साइड गंधक के अम्ल से क्रिया कर बेरियम सल्फेट व पानी बनाता है!
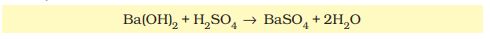
यह एक अकाबर्निक रासायनिक अभिक्रिया है! ठीक इसी प्रकार (टार्च का जल अपघटन द्वारा ग्लूकोज में बदलना एक कार्बनिक रसायनिक अभिक्रिया है! भौतिक या रासायनिक अभिक्रिया की दर का सीधा संबंध इकाई समय में बनने वाले उत्पाद से होता है! इसे इस प्रकार प्रदर्शित कर सकते हैंः
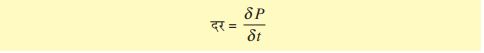
यदि दिशा निर्धारित हो तो इस दर को वेग भी कहते हैं! भौतिक व रासायनिक प्रक्रियाओं की दर अन्य कारकों के साथ-साथ तापक्रम द्वारा प्रभावित होती है! एक सर्वमान्य नियम के अनुसार प्रत्येक 100 सेंटिग्रेड तापक्रम के ब\ढ़ने या घटने पर अभिक्रिया की दर क्रमशः द्विगुणित या आधी हो जाती है! उत्प्रेरित अभिक्रियाएं, अनुत्प्रेरित अभिक्रियाओं की अपेक्षा उच्च दर से संपन्न होती हैं! जब किसी एंजाइम द्वारा उत्प्रेरित अभिक्रिया की दर बिना उत्प्रेरण के संपन्न होने वाली अभिक्रिया से बहुत अधिक होती है! उदाहरणार्थः
यह अभिक्रिया बहुत मंद गति से होती है जिसमें एक घंटे में कार्बोनिक अम्ल के 200 अणुओं का निर्माण होता है, लेकिन उपरोक्त अभिक्रिया कोशिका द्रव्य में उपस्थित एंजाइम कार्बोनिक एनहाइड्रेज की उपस्थिति में तीव्रगति से संपन्न होती है, जिसके कार्बोनिक अम्ल के 600000 अणु प्रति सेकेंड बनते हैं! एंजाइम ने इस क्रिया की दर को 10 लाख गुना ब\ढ़ा दिया! एंजाइम की यह शक्ति वास्तव में अविश्वसनीय लगती है!
हजारों प्रकार के एंजाइम होते हैं जो विशेष प्रकार की रासायनिक व उपापचयी अभिक्रियाओं को उत्प्रेरित करते हैं! बहुचरणीय रासायनिक अभिक्रियाओं में जहाँ प्रत्येक चरण एक ही जटिल एंजाइम या विभिन्न प्रकार के एंजाइम से उत्प्रेरित होती है, तो इन्हें उपापचयी पथ कहते हैं! जैसे उदाहरण-
ग्लूकोज से पाइरूविक अम्ल का निर्माण एक रासायनिक पथ द्वारा होता है, जिसमें दस विभिन्न प्रकार के एंजाइम उपापचयी अभिक्रिया को उत्प्रेरित करते हैं! आप अध्याय 14 में उपरोक्त अभिक्रियाओं के बारे में अध्ययन करेंगे! इस अवस्था में आपको जान लेना चाहिए कि एक ही उपापचयी पथ एक या दो अतिरिक्त अभिक्रियाओं के द्वारा विभिन्न प्रकार के उपापचयी उत्पाद बनाते हैं! हमारी कंकाली पेशियों में अनॉक्सी स्थिति में लैक्टिक अम्ल का निर्माण होता है जबकि सामान्य अॉक्सी स्थिति में पाइरूविक अम्ल का निर्माण होता है! खमीर में किण्वन के दौरान उपरोक्त पथ द्वारा इथेनाल (एल्कोहल) का निर्माण होता है! विभिन्न दिशाओं में विभिन्न प्रकार के उत्पाद का निर्माण संभव है!
9.12.2 एंजाइम द्वारा उच्च दर से रासायनिक रूपांतरण कैसे होता है?
इसे समझने के लिए एंजाइम के बारे में थोड़ ा विस्तृत अध्ययन करना पड़ ेगा! सक्रिय स्थल के बारे में हम पहले ही प\ढ़ चुके हैं! रासायनिक या उपापचयी रूपांतरण एक अभिक्रिया होती है! जो रसायन (Chemical) उत्पाद में रूपांतरित होता है, उसे क्रियाधार (Substrate) कहते हैं! एंजाइम जो एक सक्रिय स्थल सहित एक त्रिविम संरचना की प्रोटीन है, जो एक क्रियाधार को उत्पाद में बदलता है! सांकेतिक रूप में इसे निम्न ढंग से चित्रित कर सकते हैं!
क्रियाधार S → उत्पाद P
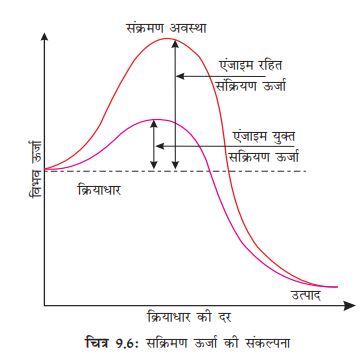
क्रियाधार (S) एंजाइम के सक्रिय स्थल जो दरार या पुटिका के रूप में होता है, से जुड़ जाता है! क्रियाधार सक्रिय स्थल की ओर जाते हैं! इस प्रकार आवश्यक एंजाइम-क्रियाधार सम्मिश्र (ES) का अविकल्पीय निर्माण होता है! ई (E) एंजाइम को प्रदर्शित करता है! इस समूह का निर्माण एक अल्पकालिक घटना है! क्रियाधार एंजाइम के सक्रिय स्थल से जुड़ ने की अवस्था में क्रियाधार की नई संरचना का निर्माण होता है जिसे संक्रमण अवस्था-संरचना कहते हैं! इसके बाद शीघ्र ही प्रत्याशित बंध के टूटने या बनने के उपरांत सक्रिय स्थल से उत्पाद अवमुक्त होता है! दूसरे शब्दों में क्रियाधार की संरचना उत्पाद की संरचना में रूपांतरित हो जाती है! रूपांतरण का यह पथ तथा कथित संक्रमण अवस्था के द्वारा होता है! स्थाई क्रियाधार व उत्पाद के बीच में बहुत सारी ‘रूपांतरित संरचनात्मक अवस्था’ हो सकती है! इस कथन का आशय है कि बनने वाली सभी मध्यवर्ती संरचनात्मक अवस्था अस्थाई होती है! स्थाइत्व का संबंध अणु की ऊर्जा अवस्था या संरचना से जुड़ ा होता है! यदि इसे चित्रात्मक लेखाचित्र के रूप में प्रदर्शित किया जाए तो यह चित्र 9.6 के अनुरूप होगा!
y- अक्ष अंतर्निहित ऊर्जा अंश को व्यक्त करता है! x- अक्ष संरचनात्मक रूपांतरण की या वह अवस्था जिसका निर्माण मध्यवर्ती संरचना द्वारा होता है, की प्रगति को व्यक्त करता है! दो चीजें ध्यान देने योग्य है! क्रियाधार (S) व उत्पाद (p) के बीच ऊर्जा स्तर में अंतर! यदि उत्पाद क्रियाधार से नीचे स्तर का है तो अभिक्रिया बाह्य उष्मीय होती है! इस अवस्था में उत्पाद निर्माण हेतु ऊर्जा आपूर्ति (गर्म करने से) की आवश्यकता नहीं होती है! फिर भी चाहे यह बाह्यउष्मीय या स्वतः प्रवर्तित अभिक्रिया या अंतःउष्मीय या ऊर्जा आवश्यक अभिक्रिया हो क्रियाधार को उच्च ऊर्जा अवस्था या संक्रमण अवस्था से गुजरना होता है! क्रियाधार व संक्रमण अवस्था के बीच औसत ऊर्जा के अंतर को ‘सक्रियण ऊर्जा’ (Activation energy) कहते हैं!
एंजाइम ऊर्जा अवरोध को घटाकर क्रियाधार से उत्पाद के आसान रूपांतरण में सहयोग करता है!
9.12.3 एंजाइम क्रिया की प्रकृति
प्रत्येक एंजाइम (E) के अणु में क्रियाधार-बंधन-स्थल (Substrate binding site) मिलता है जो क्रियाधार (s) से बंध कर सक्रिय एंजाइम-क्रियाधार सम्मिश्र (ES) का निर्माण करता है! यह सम्मिश्र अल्पावधि का होता है, जो उत्पाद (P) एंव अपरिवर्तित एंजाइम में विघटित हो जाता है इसके पूर्व मध्यावस्था के रूप में एंजाइम उत्पाद (EP) जटिल का निर्माण होता है!
एंजाइम-क्रियाधार जटिल (ES) का निर्माण उत्प्रेरण के लिए आवश्यक होता है!
एंजाइम क्रिया के उत्प्रेरक चक्र को निम्न चरणों में व्यक्त किया जा सकता है-
1. सर्वप्रथम क्रियाधार सक्रिय स्थल में व्यवस्थित होकर एंजाइम के सक्रिय स्थल से बँध जाता है!
2. बँधने वाला क्रियाधार एंजाइम के आकार में इस प्रकार से बदलाव लाता है कि क्रियाधार एंजाइम से मजबूती से बँध जाता है!
3. एंजाइम का सक्रिय स्थल अब क्रियाधार के काफी समीप होता है जिसके परिणामस्वरूप क्रियाधार के रासायनिक बंध टूट जाते हैं और नए एंजाइम उत्पाद जटिल का निर्माण होता है!
4. एंजाइम नवनिर्मित उत्पाद को अवमुक्त करता है व एंजाइम स्वतंत्र होकर क्रियाधार के दूसरे अणु से बँधने के लिए तैयार हो जाता है! इस प्रकार पुनः उत्प्रेरक चक्र प्रारंभ हो जाता है!
9.12.4 एंजाइम क्रियाविधि को प्रभावित करने वाले कारक
जो कारक प्रोटीन की तृतीयक संरचना को परिवर्तित करते हैं, वे एंजाइम की सक्रियता को भी प्रभावित करते हैं; जैसे- तापक्रम, पी.एच. (pH)! क्रियाधार की सांद्रता में परिवर्तन या किसी विशिष्ट रसायन का एंजाइम से बंधन, उसकी प्रक्रिया को नियंत्रित करते हैं!
तापक्रम व पी एच (pH)
एंजाइम सामान्यतः तापक्रम व पी एच के लघु परिसर में कार्य करते हैं (चित्र 9.7)! प्रत्येक एंजाइम की अधिकतम क्रियाशीलता एक विशेष तापक्रम व पी एच पर ही होती है, जिसे क्रमशः ईष्टतम तापक्रम व पी एच कहते हैं! इस ईष्टतम मान के ऊपर या नीचे होने से क्रियाशीलता घट जाती है! निम्न तापक्रम एंजाइम को अस्थाई रूप से निष्क्रिय अवस्था में सुरक्षित रखता है, जबकि उच्च तापक्रम एंजाइम की क्रियाशीलता को समाप्त कर देता है; क्योंकि उच्च तापक्रम एंजाइम के प्रोटीन को विकृत कर देता है!
क्रियाधार की सांद्रता
क्रियाधार की सांद्रता (s) के ब\ढ़ने के साथ-साथ पहले तो एंजाइम क्रिया की गति (v) ब\ढ़ती है! अभिक्रिया अंततोगत्वा सर्वोच्च गति (Vmax) प्राप्त करने के बाद क्रियाधार की सांद्रता ब\ढ़ने पर भी अग्रसर नहीं होती है! एेसा इसलिए होता है कि एंजाइम के अणुओं की संख्या क्रियाधार के अणुओं से कहीं कम होती हैं और इन अणुओं से एंजाइम के संतृप्त होने के बाद एंजाइम का कोई भी अणु क्रियाधार के अतिरिक्त अणुओं से बंधन करने के लिए मुक्त नहीं बचता है, (चित्र 9.7)!
किसी भी एंजाइम की क्रियाशीलता विशिष्ट रसायनों की उपस्थिति में संवेदनशील होती है जो एंजाइम से बँधते हैं! जब रसायन का एंजाइम से बँधने के उपरांत इसकी क्रियाशीलता बंद हो जाती है तो इस प्रक्रिया को संदमन (Inhibition) व उस रसायन को संदमक (Inhihitor) कहते हैं!
जब संदमक अपनी आणुविक संरचना में क्रियाधार से काफी समानता रखता है और एंजाइम की क्रियाशीलता को संदमित करता हो तो इसे प्रतिस्पर्धात्मक संदमन (Competitive Inhibitor)कहते हैं! संदमक की क्रियाधार से निकटतम संरचनात्मक समानता के फलस्वरूप यह क्रियाधार से एंजाइम के क्रियाधार-बंधक स्थल से बंधते हुए प्रतिस्पर्धा करता है! परिणामस्वरूप क्रियाधार, क्रियाधार बंधक स्थल से बंध नहीं पाता, जिसके फलस्वरूप एंजाइम क्रिया मंद पड़ जाती है! उदाहरण के लिए, सक्सीनिक डिहाइड्रोजिनेज का मेलोनेट द्वारा संदमन जो संरचना में क्रियाधार सक्सीनेट से निकट की समानता रखता है! एेसे प्रतिस्पर्धी संदमकों का अक्सर उपयोग जीवाणु जन्म रोगजनकों (Bacterial Pathogens) के नियंत्रण हेतु किया जाता है!
9.12.5 एंजाइम का नामकरण व वर्गीकरण
हजारों एंजाइमों की खोज, विलगन व अध्ययन किया जा चुका है! एंजाइम द्वारा विभिन्न अभिक्रिया के उत्प्रेरण के आधार पर, इन्हें विभिन्न समूहों में वर्गीकृत किया गया है! एंजाइम को 6 वर्गों व प्रत्येक वर्ग को 4-13 उपवर्गों में विभाजित किया गया है! जिनका नामकरण चार अंकीय संख्या पर आधारित है!
अॅाक्सीडोरिडक्टेजेज/डीहाइड्रोजीनेजेज
एंजाइम जो दो क्रियाधारकों S व के S1 बीच अॅाक्सीअपचयन को उत्प्रेरित करते हैं जैसे
S(उपचयित) +S1 (अॉक्सीकृत) =S (अॉक्सीकृत) +S1 (उपचयित)
ट्रांसफरेजेज : एंजाइम क्रियाधारकों के एक जोड़ े S व S1 के बीच एक समूह (हाइड्रोजन के अतिरिक्त) के स्थानातंरण को उत्प्रेरित करते हैं! जैसे-
S- G+ S1 → S + S1 G
हाइड्रोलेजेज : एंजाइम इस्टर, ईथर, पेप्टाइड, ग्लाइकोसाइडिक, कार्बन-कार्बन, कार्बन-हैलाइड या फॉस्फोरस-नाइट्रोजन बंधों का जल-अपघटन करते हैं!
लायेजेज : जल अपघटन के अतिरिक्त विधि द्वारा एंजाइम क्रियाधारकों से समूहों के अलग होने को उत्प्रेरित करते हैं, जिसके फलस्वरूप द्विबंधों का निर्माण होता है!
आइसोमरेजेज : वे सभी एंजाइम जो प्रकाशीय, ज्यामितिय व स्थितीय समावयवों के अंतर-रूपांतरण को उत्प्रेरित करते हैं!
लाइगेजेज : एंजाइम दो यौगिकों के आपस में जुड़ ने को उत्प्रेरित करते हैं, जैसे एंजाइम जो कार्बन-अॉक्सीजन, कार्बन-सल्फर, कार्बन-नाइट्रोजन व फॉस्फोरस-अॉक्सीजन बंधों के निर्माण के लिए उत्प्रेरित करते हैं!
9.12.6 सहकारक (Co-factors)
एंजाइम एक या अनेक बहुपेप्टाइड शृंखलाओं से मिलकर बना होता है! फिर भी कुछ स्थितियों में इतर प्रोटीन अवयव, जिसे सह-कारक कहते हैं, एंजाइम से बंधकर उसे उत्प्रेरक सक्रिय बनाते हैं! इन उदाहरणों में एंजाइम के केवल प्रोटीन भाग को एपोएंजाइम कहते हैं! सह-कारक तीन प्रकार के होते है ः प्रोस्थेटिक-समूह, सह-एंजाइम व धातु-आयन!
प्रोस्थेटिक-समूह कार्बनिक यौगिक होते हैं और यह अन्य सह-कारकों से इस रूप में भिन्न होते हैं कि ये एपोएंजाइम्स से दृ\ढ़ता से बंधे होते हैं! उदाहरणस्वरूप एंजाइम परअॅाक्सीडेज व केटलेज जो हाइड्रोजन पराक्साइड को अॅाक्सीजन व पानी में विखंडित करते हैं, हीम प्रोस्थेटिक समूह होता है जो एंजाइम के सक्रिय स्थल से जुड़ ा होता है!
सह एंजाइम भी कार्बनिक यौगिक होते हैं और इनका संबंध एपोएंजाइम से अस्थाई होता है जो सामान्यतया उत्प्रेरण के दौरान बनता है! सह-एंजाइम विभिन्न एंजाइम उत्प्रेरित अभिक्रियाओं में सह-कारक के रूप में कार्य करते हैं! अनेक सह-एंजाइम का मुख्य रासायनिक अवयव विटामिन्स होते हैं जैसे- सहएंजाइम नीकोटीनेमाइड एडेनीन डाईन्यूक्लीयोटाइड (NAD) नीकोटीनेमाइड एडेनीन डाईन्यूक्लीयोटाइड फॉस्फेट (NADP) विटामिन नियासीन से जुड़ े होते हैं!
धातु आयन; कई एंजाइम की क्रियाशीलता हेतु धातु-आयन की आवश्यकता होती है जो सक्रिय स्थल पर पार्श्व- शृंखला से समन्वयन बंध बनाते हैं व उसी समय एक या एक से अधिक समन्वयन बंध द्वारा क्रियाधारकों से जुड़ े होते हैं! जैसे-प्रोटीयोलिटीक एंजाइम कार्बाक्सीपेप्टीडेज से εंजंक एक सह-कारक के रूप में जुड़ा होता है!
एंजाइम से यदि सह-कारक को अलग कर दिया जाय तो इनकी उत्प्रेरक क्रियाशीलता समाप्त हो जाती है, इससे स्पष्ट है कि एंजाइम की उत्प्रेरक क्रियाशीलता हेतु ये निर्णायक भूमिका अदा करते हैं!
सारांश
जीवों में आश्चर्यजनक विभिन्नता मिलती है! इनकी रासायनिक संघटन व उपापचयी अभिक्रियाओं में
असाधारण समानताएं मिलती हैं! जीव ऊतकों व निर्जीव द्रव्यों में पाए जाने वाले तत्वों के संघटन का यदि गुणात्मक परीक्षण किया जाए तो वे काफी समान होते हैं! फिर भी सूक्ष्म परीक्षण के बाद यह स्पष्ट है कि यदि जीव तंत्र व निर्जीव द्रव्यों की तुलना की जाए तो जीव तंत्र में कार्बन, हाइड्रोजन व अॉक्सीजन की अपेक्षाकृत अधिक बहुलता होती है! जीव में सर्वाधिक प्रचुर रसायन जल मिलता है! कम अणुभार (1000 डाल्टन से कम) वाले हजारों जैव अणु होते हैं! जीवों में एमीनो अम्ल, एकलसैकेराइडस, द्विक्शैकेराइडस शर्कराएं, वसा, अम्ल, ग्लिसरॉल, न्यूक्लियोटाइड, न्यूक्लियोसाइडस व नाइट्रोजन क्षार जैसे कुछ कार्बनिक यौगिक मिलते हैं! इनमें 20 प्रकार के एमीनो अम्ल व 5 प्रकार के न्यूक्लीयोटाइडस मिलते हैं! वसा व तेल ग्लिसराइडस होते हैं, जिनमें वसा अम्ल, ग्लिसराल से इस्टरीकृत होता है! फॉस्फोलिपिडस में फॉस्फोरीकृत नाइट्रोजनीय यौगिक मिलते हैं!
जीव तंत्रों में केवल तीन प्रकार के वृहत्अणु जैसे- प्रोटीन, न्यूक्लीक अम्ल व बहुसैकेराइडस मिलते हैं! लिपिड्स का झिल्ली संबंधित होने के कारण वृहत् आण्विक अंश में रहते हैं! जैव वृहत् अणु बहुलक होते है! वे विभिन्न घटकों से बने होते हैं! न्यूक्लीक अम्ल (डी.एन.ए. व आर.एन.ए.) न्यूक्लिओटाइडस से मिलकर बने होते हैं! जैव वृहत् अणुओं में संरचनाओं का पदानुक्रम जैसे- प्राथमिक, द्वितीयक, तृतीयक व चतुष्कीय संरचनाएं मिलती है! न्यूक्लीक अम्ल आनुवंशिक द्रव्य की कोशिकाभित्तियों के रूप में कार्य करता है! बहुसैकेराइडस पौधों, कवकों व संधिपादों के बाह्य कंकाल के घटक हैं! ये ऊर्जा के संचित रूप (जैसे-स्टार्च व ग्लाइकोजेन) में भी मिलते हैं! प्रोटीन विभिन्न कोशिकीय कार्यो में सहायता करते हैं! उनमें से कुछ एंजाइम्स, प्रतिरक्षी, ग्राही, हार्मोन्स, व दूसरे संरचनात्मक प्रोटीन होते हैं! प्राणी जगत में सर्वाधिक प्रचुरता में मिलने वाला प्रोटीन कोलेजेन व संपूर्ण जैवमंडल मे सर्वाधिक प्रचुरता में मिलने वाला प्रोटीन रूबीस्को (RUBISCO) है!
एंजाइम्स प्रोटीन होते हैं जो कोशिकाओं में जैव रासायनिक क्रियाओं की उत्प्रेरक शक्ति होते हैं! प्रोटीनमय एंजाइम्स क्रियाशीलता हेतु ईष्टतम तापक्रम व पी.एच. (ph) की आवश्यकता होती हैं! एंजाइम्स अभिक्रिया की दर को काफी तीव्र कर देते हैं! न्यूक्लीक अम्ल आनुवंशिक सूचनाओं के वाहक होते हैं, जो इसे पैतृक पी\ढ़ी से संतति में आगे ब\ढ़ाते हैं!
अभ्यास
1. वृहत् अणु क्या है? उदाहरण दीजिए?
2. ग्लाइकोसिडिक, पेप्टाइड, तथा फॉस्फो-डाइस्टर बंधों का वर्णन कीजिए?
3. प्रोटीन की तृतीयक संरचना से क्या तात्पर्य है?
4. 10 एेसे रुचिकर सूक्ष्म जैव अणुओं का पता लगाइए जो कम अणुभार वाले होते हैं व इनकी संरचना बनाइए? एेसे उद्योगों का पता लगाइए जो इन यौगिकों का निर्माण विलगन द्वारा करते हैं? इनको खरीदने वाले कौन है? मालूम कीजिए?
5. प्रोटीन में प्राथमिक संरचना होती है, यदि अपको जानने हेतु एेसी विधि दी गई है, जिसमें प्रोटीन के दोनों किनारों पर अमीनो अम्ल है तो क्या आप इस सूचना को प्रोटीन की शुद्धता अथवा समागंता (homogeneity) से जोड़ सकते हैं?
6. चिकित्सार्थ अभिकर्ता (therapeutic agents) के रूप में प्रयोग में आने वाले प्रोटीन का पता लगाइए व सूचीबद्ध कीजिए! प्रोटीन की अन्य उपयोगिताओं को बताइए (जैसे सौंद्रर्य-प्रसाधन आदि)!
7. ट्राइग्लिसराइड के संगठन का वर्णन कीजिए!
8. क्या आप प्रोटीन की अवधारणा के आधार पर वर्णन कर सकते हैं कि दूध का दही अथवा योगर्ट में परिवर्तन किस प्रकार होता है?
9. क्या आप व्यापारिक दृष्टि से उपलब्ध परमाणु मॉडल (बल व स्टिक नमूना) का प्रयोग करते हुए जैवअणुओं के उन प्रारूपों को बना सकते हैं?
10. अमीनो अम्लों को दुर्बल क्षार से अनुमापन (Titrate) कर, अमीनो अम्ल में वियोजी क्रियात्मक समूहों का पता लगाने का प्रयास कीजिए?
11. एेलेनीन अमीनो अम्ल की संरचना बताइए?
12. गोंद किससे बने होते हैं? क्या फेविकोल इससे भिन्न है?
13. प्रोटीन, वसा व तेल अमीनो अम्लों का विश्लेषणात्मक परीक्षण बताइए एवं किसी भी फल के रस, लार, पसीना तथा मूत्र में इनका परीक्षण करें?
14. पता लगाइए कि जैव मंडल में सभी पादपों द्वारा कितने सेल्यूलोज का निर्माण होता है! इसकी तुलना मनुष्यों द्वारा उत्पादित कागज से करें! मानव द्वारा प्रतिवर्ष पादप पदार्थो की कितनी खपत की जाती है? इसमें वनस्पतियों की कितनी हानि होती है?
15. एंजाइम के महत्वपूर्ण गुणों का वर्णन कीजिए?