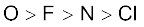Table of Contents
एकक 3
तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
Classification of Elements and Periodicity in Properties
" आवर्त सारणी प्रमाणित तौर पर रसायन शास्त्र का अत्यंत महत्त्वपूर्ण विचार है। प्रतिदिन विद्यार्थी को इससे सहायता मिलती है, खोजकर्त्ताओं को नई दिशा मिलती है और व्यवस्थित रूप में संपूर्ण रसायन शास्त्र का संक्षिप्त वर्णन मिलता है। यह इस बात का एक अद्भुत उदाहरण है कि रासायनिक तत्व अव्यवस्थित समूह में बिखरी हुई इकाई नहीं होते, अपितु वे व्यवस्थित समूहों में समानता प्रदर्शित करते हैं। जो लोग यह जानना चाहते हैं कि दुनिया छोटे-छोटे अंशों से कैसे बनी, उनके लिए आवर्त सारणी बहुत उपयोगी है। "
ग्लेन टी सीबर्ग
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप –
• जीवन के विभिन्न क्षेत्रों में रसायन विज्ञान के महत्त्व को समझ सकेंगे;
• तत्त्वों के गुणधर्मों के आधार पर उनके वर्गीकरण की संकल्पना द्वारा आवर्त सारणी के विकास से अवगत हो सकेंगे;
• आवर्त-नियम को समझ सकेंगे;
• आवर्ती वर्गीकरण के लिए परमाणु-संख्या तथा इलेक्ट्रॉनिक विन्यास के आधार की सार्थकता को समझ सकेंगे;
• 100 से अधिक परमाणु-क्रमांकवाले तत्त्वों के लिए IUPAC नाम लिख सकेंगे;
• तत्त्वों को s, p, d एवं f ब्लॉक में वर्गीकृत कर सकेंगे और उनके मुख्य अभिलक्षणों को बता सकेंगे;
• तत्त्वों के भौतिक एवं रासायनिक गुणधर्मों में आवर्ती लक्षणों को पहचान सकेंगे;
• तत्त्वों की अभिक्रियाशीलता की तुलना कर सकेंगे और उन्हें उनकी प्रकृति में उपस्थिति से संबद्ध कर सकेंगे;
• आयनन एंथैल्पी एवं धात्विक लक्षणों के बीच संबंध बता सकेंगे;
• परमाणु से संबंधित कुछ महत्त्वपूर्ण गुणधर्मों, जैसे – आयनिक, परमाणु त्रिज्या आयनन एंथैल्पी, इलेक्ट्रॉन, लब्धि एंथैल्पी, विद्युत् ऋणात्मकता और संयोजकता से संबंधित विचारों को व्यक्त करने के लिए सही वैज्ञानिक शब्दावली का उपयोग कर सकेंगे।
इस एकक में हम वर्तमान आवर्त सारणी का एेतिहासिक विकास एवं आधुनिक आवर्त-नियम का अध्ययन करेंगे। तत्त्वों का वर्गीकरण परमाणु के इलेक्ट्रॉनिक विन्यास का परिणाम है। अंत में हम तत्त्वों के भौतिक तथा रासायनिक गुणों की आवर्ती प्रवृत्ति पर विचार करेंगे।
3.1 तत्त्वों का वर्गीकरण क्यों आवश्यक है?
अब तक हम यह जान चुके हैं कि तत्त्व सभी प्रकार के पदार्थों की मूल इकाई होते हैं। सन् 1800 में केवल 31 तत्त्व ज्ञात थे। सन् 1865 तक 63 तत्त्वों की जानकारी हो गई थी। आजकल हमें 114 तत्त्वों के बारे में पता है। इनमें से हाल में खोजे गए तत्त्व मानव-निर्मित हैं। वैसे, अभी भी नए तत्त्वों की कृत्रिम रचना के प्रयास जारी हैं। इतने सारे तत्त्वों और उनके असंख्य यौगिकों के रसायन का अध्ययन अलग-अलग कर पाना बहुत कठिन है। इस कठिनाई को दूर करने के लिए वैज्ञानिकों ने तत्त्वों का वर्गीकरण करके इस अध्ययन को संगठित किया और आसान बनाया। इतना ही नहीं, इस संक्षिप्त तरीके से सभी तत्त्वों से संबंधित रासायनिक तथ्यों का अध्ययन तर्कसंगत रूप से तो कर ही सकेंगे, भविष्य में खोजे जाने वाले अन्य तत्त्वों के अध्ययन में भी मदद मिलेगी।
3.2 आवर्त सारणी की उत्पत्ति
सारणी 3.1 डॉबेराइनर के त्रिक
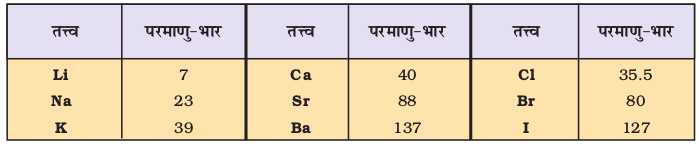
तत्त्वों का वर्गीकरण समूहों में और आवर्तिता नियम एवं आवर्त सारणी का विकास वैज्ञानिकों द्वारा अनेक अवलोकनों तथा प्रयोगों का परिणाम है। सर्वप्रथम जर्मन रसायनज्ञ जॉन डॉबेराइनर ने सन् 1800 के प्रारंभिक दशकों में इस बात की ओर संकेत किया कि तत्त्वों के गुणधर्मों में निश्चित प्रवृत्ति होती है। सन् 1829 में उन्होंने समान भौतिक एवं रासायनिक गुणों वाले तीन तत्त्वों के समूहों (त्रिकों) की तरफ ध्यान आकर्षित कराया। उन्होंने यह भी पाया कि प्रत्येक त्रिक में बीच वाले तत्त्व का परमाणु-भार शेष दोनों तत्त्वों के परमाणु भार के औसत मान के लगभग बराबर था (सारणी 3.1 को देखें)। साथ ही, मध्य वाले तत्त्व के गुणधर्म शेष दोनों तत्त्वों के गुणधर्मों के मध्य पाए गए।
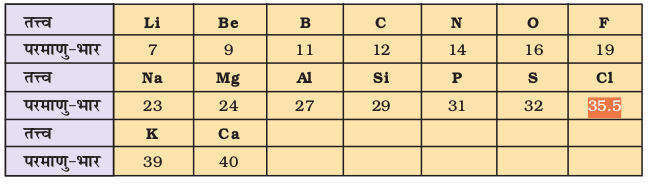
डॉबेराइनर का ‘त्रिक का नियम’ कुछ ही तत्त्वों के लिए सही पाया गया। इसलिए इसे महज एक संयोग समझकर इसका विचार छोड़ दिया गया। इसके पश्चात् फ्रांसिसी भूगर्भशास्त्री ए.ई.बी. डी चैनकोरटोइस (A.E.B. de Chancourtois) ने सन् 1862 में तत्त्वों का वर्गीकरण करने का प्रयास किया। उन्होंने तत्त्वों को उनके बढ़ते हुए परमाणु-भार के क्रम में व्यवस्थित किया और तत्त्वों की वृत्ताकार सारणी बनाई, जिसमें तत्त्वों के गुणधर्मों में आवर्ती पुनरावृत्ति को दर्शाया गया। यह भी अधिक ध्यान आकृष्ट नहीं कर सका। अंग्रेज़ रसायनज्ञ जॉन एलेक्जेंडर न्यूलैंड ने सन् 1865 में अष्टक नियम (Law of octaves) को विकसित किया। उन्होंने तत्त्वों को उनके बढ़ते हुए परमाणु-भार के क्रम में व्यवस्थित किया तथा पाया कि किसी भी तत्त्व से प्रारंभ करने पर आठवें तत्त्व के गुण प्रथम तत्त्व के समान थे (सारणी 3.2 देखें)। यह संबंध उसी प्रकार का था, जैसा आठवें सांगीतिक स्वर (eight musical note) का संबंध प्रथम सांगीतिक स्वर के साथ होता है। न्यूलैंड का अष्टक नियम सिर्फ Ca तक के तत्त्वों तक सही प्रतीत हुआ, हालाँकि उस समय इस धारणा को व्यापक मान्यता नहीं मिली, परंतु बाद में रॉयल सोसायटी (लंदन) द्वारा सन् 1887 में न्यूलैंड को डेवी पदक द्वारा पुरस्कृत कर उनकेकाम को मान्यता दी गई।
रूसी रसायनज्ञ दमित्री मेंडलीव (1834-1907) तथा जर्मन रसायनज्ञ लोथर मेयर (1830-1895) के सतत् प्रयासों के फलस्वरूप आवर्त-सारणी के विकास में सफलता प्राप्त हुई। स्वतंत्र रूप से कार्य करते हुए दोनों रसायनज्ञों ने सन् 1869 में प्रस्तावित किया कि जब तत्त्वों को उनके बढ़ते हुए परमाणु-
सारणी 3.2 न्यूलैंड के अष्टक
भारों के क्रम में व्यवस्थित किया जाता है, तब नियमित अंतराल के पश्चात् उनके भौतिक तथा रासायनिक गुणों में समानता पाई जाती है। लोथर मेयर ने भौतिक गुणों (जैसे– परमाण्वीय आयतन, गलनांक एवं क्वथनांक और परमाणु-भार के मध्य वक्र आलेखित (curve plotting) किया, जो एक निश्चित समुच्चय वाले तत्त्वों में समानता दर्शाता था। सन् 1868 तक लोथर मेयर ने तत्त्वों की एक सारणी का विकास कर लिया, जो आधुनिक आवर्त-सारणी से काफी मिलती-जुलती थी, लेकिन उसके काम का विवरण दमित्री मेंडलीव के काम के विवरण से पहले प्रकाशित नहीं हो पाया। आधुनिक आवर्त सारणी के विकास में योगदान का श्रेय दमित्री मेंडेलीव को दिया गया है।
हालाँकि आवर्ती संबंधों के अध्ययन का आरंभ डॉबेराइनर ने किया था, किंतु मेंडलीव ने आवर्त नियम को पहली बार प्रकाशित किया। यह नियम इस प्रकार है –
"तत्त्वों के गुणधर्म उनके परमाणु भारों के आवर्ती फलन होते हैं।"
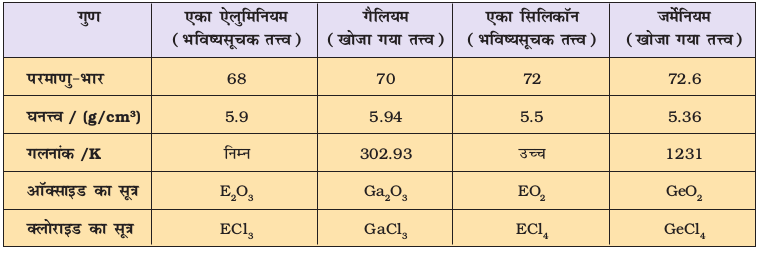
मेंडलीव ने तत्त्वों को क्षैतिज पंक्तियों एवं ऊर्ध्वाधार स्तंभों में उनके बढ़ते हुए परमाणु-भार के अनुसार सारणी में इस तरह क्रम में रखा कि समान गुणधर्मों वाले तत्त्व एक ही ऊर्ध्वाधर-स्तंभ या समूहों में स्थान पाएँ। मेंडलीव द्वारा तत्त्वों का वर्गीकरण निश्चित तौर पर लोथर मेयर के वर्गीकरण से अधिक विस्तृत था। मेंडलीव ने आवर्तिता के महत्त्व को पूर्ण रूप से समझा और तत्त्वों के वर्गीकरण के लिए अधिक विस्तृत भौतिक एवं रासायनिक गुणधर्मों को आधार माना। विशेष रूप से मेंडलीव ने तत्त्वों द्वारा प्राप्त यौगिकों के मूलानुपाती सूत्रों (empirical formula) तथा उनके गुणधर्मों की समानता को आधार माना। वह यह जानते थे कि यदि परमाणु-भार के क्रम का पूर्णतः पालन किया जाता, तो कुछ तत्त्व उनके द्वारा दिए गए क्रम में आवर्त-सारणी में नहीं रखे जा सकते थे। उन्होंने समान रासायनिक गुण दर्शाने वाले तत्त्वों को आवर्त-सारणी में उचित स्थान देने के लिए उनके परमाणु-भारों के क्रम की उपेक्षा की। उदाहरण के तौर पर– आयोडीन, जिसका परमाणु भार समूह VI के तत्त्व ‘टैलूरियम’ से कम था, को समूह VII में फ्लुओरीन, क्लोरीन, ब्रोमीन आदि के साथ गुणधर्मों में समानता के आधार पर रखा गया (चित्र 3.1)। उन्होंने समान गुणधर्मों वाले तत्त्वों को एक समूह में रखने की प्राथमिकता को आधार मानते हुए यह प्रस्तावित किया कि कुछ तत्त्व (जो खोजे नहीं गए थे) के लिए सारणी में कुछ रिक्त स्थान छोड़ दिए गए। उदाहरण के लिए– जब मेंडलीव की आवर्त-सारणी प्रकाशित हुई, तब गैलियम (Gallium) तथा जर्मेनियम (Germanium) तत्त्वों की खोज नहीं हुई थी। उन्होंने एेलुमिनियम और सिलिकॉन के नीचे एक-एक रिक्त स्थान छोड़ा और इन तत्त्वों का नाम क्रमशः एका-एेलुमीनियम (Eka-Aluminium) तथा एका-सिलिकॉन (Eka-Silicon) रखा। मेंडेलीव ने न केवल गैलियम और जर्मे सारणी 3.3 मेंडलीव द्वारा एका-एेलुमीनियम (गैलियम) तथा एका-सिलिकान (जर्मेनियम) तत्त्वों की प्रागुक्ति गुण एका एेलुमिनियम गैलियम एका सिलिकॉन जर्मेनियम(भविष्यसूचक तत्त्व) (खोजा गया तत्त्व) (भविष्यसूचक तसमूहों तथा श्रेणियों में तत्त्वों की आवर्तिता नियम तत्त्वों के होने की प्रागुक्ति की, बल्कि इन तत्त्वों के कुछ भौतिक गुणधर्मों का ब्यौरा भी दिया। बाद में खोजे गए इन तत्त्वों के प्रागुक्त गुणधर्मों तथा प्रायोगिक गुणधर्मों को सारणी 3.3 में सूचीबद्ध किया गया है। मेंडलीव की मात्रात्मक प्रागुक्तियों और कालांतर में उनकी सफलता के कारण उन्हें और उनकी आवर्त सारणी को काफी प्रसिद्धि मिली। मेंडलीव की सन् 1905 में प्रकाशित आवर्त सारणी को चित्र 3.1 में दर्शाया गया है।
3.3 आधुनिक आवर्त-नियम तथा आवर्त सारणी का वर्तमान स्वरूप
यहाँ यह बात ध्यान देने योग्य है कि जब मेंडलीव ने आवर्त सारणी का विकास किया, तब रसायनज्ञों को परमाणु की आंतरिक संरचना का ज्ञान नहीं था। बीसवीं शताब्दी के आरंभ में अवपरमाणुक कणों का विकास हुआ। सन् 1913 में अंग्रेज़ भौतिकी वैज्ञानिक हेनरी मोज़ले ने तत्त्वों के अभिलाक्षणिक X- किरण स्पेक्ट्रमों में नियमितता पाई और देखा कि 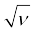 (जहाँ
(जहाँ 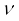 X-किरण की आवृत्ति है) और परमाणु-क्रमांक (Z) के मध्य वक्र आलेखित करने पर एक सरल रेखा प्राप्त होती है, परंतु परमाणु द्रव्यमान तथा
X-किरण की आवृत्ति है) और परमाणु-क्रमांक (Z) के मध्य वक्र आलेखित करने पर एक सरल रेखा प्राप्त होती है, परंतु परमाणु द्रव्यमान तथा 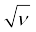 के आलेख में सरल रेखा प्राप्त नहीं होती।
के आलेख में सरल रेखा प्राप्त नहीं होती।
सारणी 3-3 मेंडलीव द्वारा एका-ऐलुमीनियम (गैलियम) तथा एका-सिलिकान (जर्मेनियम) तत्त्वों की प्रागुक्ति
समूहों तथा श्रेणियों में तत्त्वों की आवर्तिता
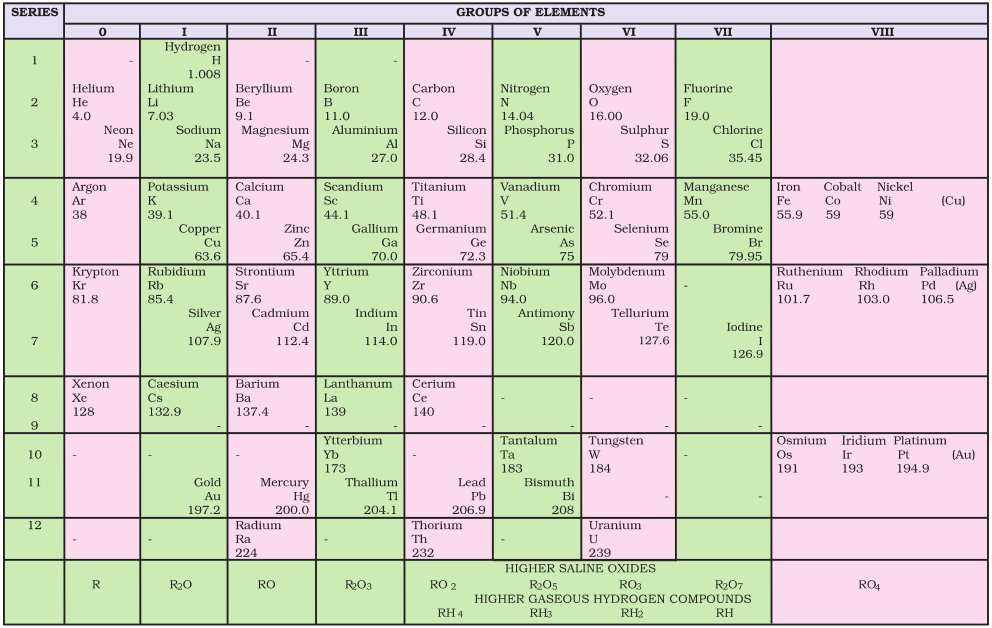
चित्र 3-1 :मेंडलीव द्वारा प्रकाशित आवर्त सारणी
अत: मोजले ने दर्शाया कि परमाणु-द्रव्यमान की तुलना में किसी तत्त्व का परमाणु-क्रमांक उस तत्त्व के गुणों को दर्शाने में अधिक सक्षम है। इसी के अनुसार मेंडलीव के आवर्त नियम का संशोधन किया गया। इसे आधुनिक आवर्त नियम कहते हैं। यह इस प्रकार है –
‘तत्त्वों के भौतिक तथा रासायनिक गुणधर्म उनके परमाणु-क्रमांकों के आवर्ती फलन होते हैं।’ (The physical and chemical properties of the elements are periodic functions of their atomic numbers.)
आवर्त नियम के द्वारा प्राकृतिक रूप से पाए जाने वाले 94 तत्त्वों में उल्लेखनीय समानताएँ मिलीं। एेक्टीनियम और प्रोटोक्टीनियम की भाँति नेप्ट्यूनियम और प्लूटोनियम भी यूरेनियम के अयस्क पिच ब्लैंड में पाए गए। इससे अकार्बनिक रसायन शास्त्र में प्रोत्साहन मिला और कृत्रिम अल्पायु वाले तत्त्वों की खोज हुई।
आप पहले पढ़ चुके हैं कि किसी तत्त्व का परमाणु क्रमांक उस तत्त्व के नाभिकीय आवेश (प्रोटॉनों की संख्या) या उदासीन परमाणु में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होता है। इसके पश्चात् क्वांटम संख्याओं की सार्थकता और इलेक्ट्रॉनिक विन्यासों की आवर्तिता को समझना सरल हो जाता है। अब यह स्वीकार कर लिया गया है कि आवर्त नियम तत्त्वों तथा उनके यौगिकों के भौतिक तथा रासायनिक गुणों का फलन है, जो तत्त्वों के इलेक्ट्रॉनिक विन्यास पर आधारित है।
समय-समय पर आवर्त-सारणी के विभिन्न रूप प्रस्तुत किए गए हैं। कुछ रूप तत्त्वों की रासायनिक अभिक्रियाओं तथा संयोजकता पर बल देते हैं, जबकि कुछ अन्य इलेक्ट्रॉनिक विन्यास पर। इसका आधुनिक स्वरूप (जिसे आवर्त सारणी का दीर्घ स्वरूप कहते हैं) बहुत सरल तथा अत्यंत उपयोगी है और इसे चित्र 3.2 में दर्शाया गया है। क्षैतिज पंक्तियों (जिन्हें मेंडलीव ने ‘श्रेणी’ कहा है) को आवर्त (periods) कहा जाता है और ऊर्ध्वाधर स्तंभों को वर्ग (group) कहते हैं। समान बाह्य इलेक्ट्रॉन विन्यास वाले तत्त्वों को ऊर्ध्वाधर स्तंभों में रखा जाता है, जिन्हें ‘वर्ग’ या ‘परिवार’ कहा जाता है। IUPAC के अनुमोदन के अनुसार, वर्गों को पुरानी पद्धति IA...VIIA, VIII, IB...VII B, के स्थान पर उन्हें 1 से 18 तक की संख्याओं में अंकित करके निरूपित किया गया है।
आवर्त-सारणी में कुल सात आवर्त हैं। आवर्त-संख्या आवर्त में तत्त्व की अधिकतम मुख्य क्वांटम संख्या (n) को दर्शाती है। प्रथम आवर्त में 2 तत्त्व उपस्थित हैं। इसके बाद के आवर्तों में क्रमशः 8, 8, 18, 18 और 32 तत्त्व हैं। सातवाँ आवर्त अपूर्ण आवर्त है। सैद्धांतिक रूप से छठवें आवर्त की तरह इसमें तत्त्वों की अधिकतम संख्या क्वांटम संख्याओं के आधार पर 32 ही होगी। इस रूप में आवर्त-सारणी के छठवें एवं सातवें आवर्त के क्रमशः लेन्थेनाइड और एेक्टिनाइड के 14-14 तत्त्व नीचे अलग से दर्शाए जाते रहे हैं।*
3.4 100 से अधिक परमाणु-क्रमांक वाले तत्त्वों का
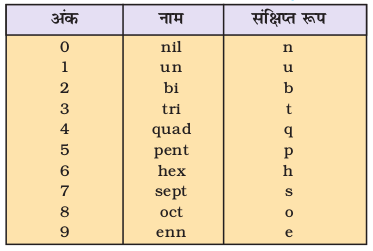
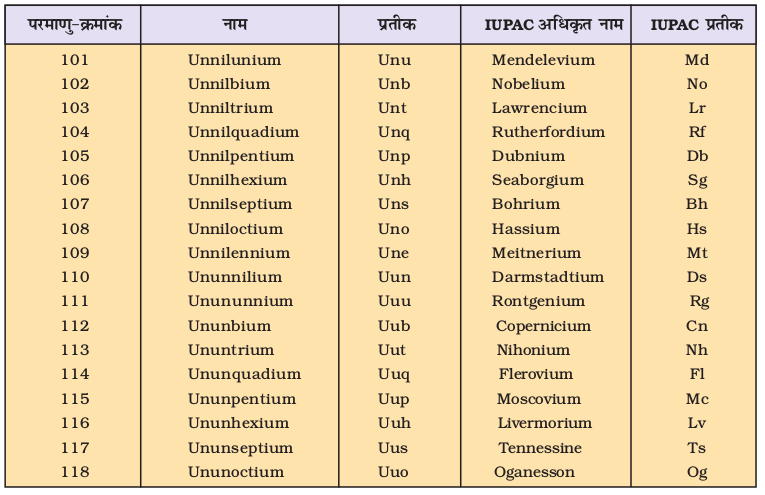
पूर्व में परंपरागत रूप से नए तत्त्वों का नामकरण उन तत्त्वों के शोधकर्ताओं के नाम पर कर दिया जाता था तथा प्रस्तावित नाम का समर्थन आई.यू.पी.ए.सी. (International Union of Pure and Applied Chemistry) द्वारा कर दिया जाता था। परंतु हाल ही में इस मुद्दे पर विवाद हो गया। उच्च परमाणु-क्रमांक वाले नए तत्त्व इतने अस्थिर होते हैं कि उनकी केवल सूक्ष्म मात्रा (और कभी-कभी तो केवल कुछ परमाणु मात्र ही) प्राप्त होती हैं। इन तत्त्वों के संश्लेषण और विशेष गुणों के अध्ययन के लिए महँगे तथा आधुनिक उपकरणों और प्रयोगशाला की आवश्यकता होती है। विश्व की कुछ ही प्रयोगशालाओं में स्पर्धा की भावना से एेसा काम होता है। कभी-कभी वैज्ञानिक बिना विश्वसनीय आँकड़े इकट्ठे किए, नए तत्त्वों की खोज का दावा करने के लिए लालायित हो जाते हैं। उदाहरण के तौर पर– अमेरिकी और रूसी, दोनों ही देशों के वैज्ञानिकों ने 104 परमाणु-क्रमांक वाले तत्त्व की खोज का दावा किया। अमेरिकी वैज्ञानिक ने इसे ‘रदरफोर्डियम’ (Rutherfordium) तथा रूसी वैज्ञानिकों ने इसे ‘कुरशाटोवियम’ (Kurchatovium) नाम दिया। इस तरह की कठिनाई को दूर करने के लिए IUPAC ने सुझाव दिया कि जब तक तत्त्व की खोज सिद्ध न हो जाए और नाम का समर्थन न हो जाए, तब तक शून्य एवं 1 से 9 तक संख्याओं के लिए संख्यात्मक मूल (numerical root) का प्रयोग करते हुए इनके नामों को परमाणु के आधार पर सीधे दिया जाए। इसे सारणी 3.4 में दिया गया है।
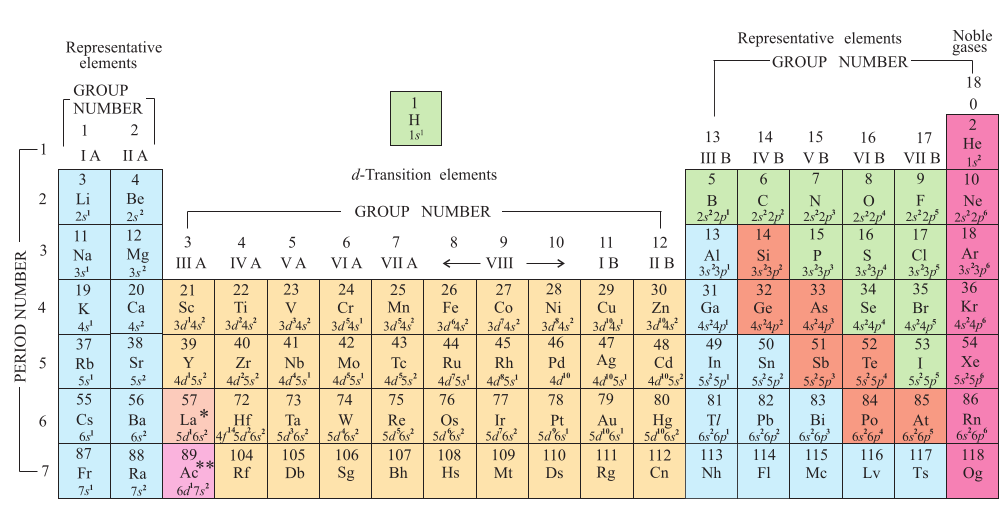

चित्र 3-2 तत्त्वों के परमाणु-क्रमांक तथा तलस्थ अवस्था इलेक्टंॉनिक विन्यास के साथ आवर्त सारणी का दीर्घ रूप। सन् 1984 के IUPAC के अनुमोदन के अनुसार वर्गों को 1 से 18 तक दर्शाया गया है। इस प्रकार का संकेतन वर्गों I A–VIIA, VIII, I B–VII B एवं O से प्रदर्शित करने की पुरानी पद्धति को प्रतिस्थापित करता है।
सारणी 3.4 तत्त्वों के IUPAC नामकरण हेतु संकेतन
उदाहरण 3.1
120 परमाणु क्रमांक वाले तत्त्व का IUPAC नाम तथा प्रतीक (symbol) क्या होगा?
हल
सारणी 3.4 के अनुसार 1, 2 तथा 0 अंकों के लिए मूल (root) क्रमशः un, bi तथा nil होंगे। अतः 120 परमाणु-क्रमांक वाले तत्त्व का नाम Unbinilum तथा प्रतीक Ubn होगा।
सारणी 3.5 परमाणु-क्रमांक 100 से अधिक वाले तत्त्वों का नामकरण
3.5 तत्त्वों के इलेक्ट्रॉनिक विन्यास तथा आवर्त-सारणी
पिछले एकक में हमने यह जाना कि किसी परमाणु में इलेक्ट्रॉन की पहचान चार क्वांटम संख्याओं से की जा सकती है। मुख्य क्वांटम संख्या (n) परमाणु के मुख्य ऊर्जा स्तर, जिसे ‘कोश’ (shell) कहते हैं, को व्यक्त करती है। हमने यह भी जाना कि किस तरह परमाणु में इलेक्ट्रॉन भिन्न-भिन्न उप-कोशों में भरे जाते हैं, जिन्हें हम s, p, d, f कहते हैं। परमाणु में इलेक्ट्रॉनों के वितरण को ही उसका ‘इलेक्ट्रॉनिक विन्यास’ कहते हैं। किसी तत्त्व की आवर्त सारणी में स्थिति उसके भरे जानेवाले अंतिम कक्षक की क्वांटम-संख्याओं को दर्शाती है। इस भाग में हम दीर्घाकार आवर्त सारणी तथा तत्त्वों के इलेक्ट्रॉनिक विन्यास के मध्य सीधे संबंध के बारे में जानकारी प्राप्त करेंगे।
(क) आवर्त में इलेक्ट्रॉनिक विन्यास
आवर्त मुख्य ऊर्जा या बाह्य कोश के लिए n का मान बताता है। आवर्त सारणी में प्रत्येक उत्तरोत्तर आवर्त (successive period) की पूर्ति अगले उच्च मुख्य ऊर्जा स्तर n=1, n=2 आदि से संबंधित होती है। यह देखा जा सकता है कि प्रत्येक आवर्त में तत्त्वों की संख्या, भरे जानेवाले ऊर्जा-स्तर में उपलब्ध परमाणु-कक्षकों की संख्या से दुगुनी होती है। इस प्रकार प्रथम आवर्त (n=1) का प्रारंभ सबसे निचले स्तर (1s) के भरने से शुरू होता है। उसमें दो तत्त्व होते हैं। हाइड्रोजन का विन्यास (1s1) तथा हीलियम (1s2) है। इस प्रकार, प्रथम कोश (K कोश) पूर्ण हो जाता है। दूसरा आवर्त 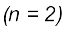 लीथियम से आरंभ होता है (Li=1s2,2s1), जिसमें तीसरा इलेक्ट्रॉन 2s कक्षक में प्रवेश करता है। अगले तत्त्व बेरिलियम में चार इलेक्ट्रॉन उपस्थित होते हैं। इसका इलेक्ट्रॉनिक विन्यास (1s2,2s2) है। इसके बाद बोरॉन तत्त्व से शुरू करते हुए जब हम निअॉन तत्त्व तक पहुँचते हैं, तो
लीथियम से आरंभ होता है (Li=1s2,2s1), जिसमें तीसरा इलेक्ट्रॉन 2s कक्षक में प्रवेश करता है। अगले तत्त्व बेरिलियम में चार इलेक्ट्रॉन उपस्थित होते हैं। इसका इलेक्ट्रॉनिक विन्यास (1s2,2s2) है। इसके बाद बोरॉन तत्त्व से शुरू करते हुए जब हम निअॉन तत्त्व तक पहुँचते हैं, तो 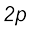 कक्षक पूर्ण रूप से इलेक्ट्रॉनों से भर जाता है। इस प्रकार L कोश निअॉन
कक्षक पूर्ण रूप से इलेक्ट्रॉनों से भर जाता है। इस प्रकार L कोश निअॉन 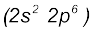 तत्त्व के साथ पूर्ण हो जाता है। अतः दूसरे आवर्त में तत्त्वों की संख्या आठ होती है। आवर्त सारणी का तीसरा आवर्त
तत्त्व के साथ पूर्ण हो जाता है। अतः दूसरे आवर्त में तत्त्वों की संख्या आठ होती है। आवर्त सारणी का तीसरा आवर्त 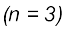 सोडियम तत्त्व के साथ प्रारंभ होता है, जिसमें इलेक्ट्रॉन 3s कक्षक में जाता है। उत्तरोत्तर 3s एवं 3p कक्षकों में इलेक्ट्रॉनों के भरने के पश्चात् तीसरे आवर्त में तत्त्वों की संख्या सोडियम से अॉर्गन तक कुल मिलाकर आठ हो जाती है।
सोडियम तत्त्व के साथ प्रारंभ होता है, जिसमें इलेक्ट्रॉन 3s कक्षक में जाता है। उत्तरोत्तर 3s एवं 3p कक्षकों में इलेक्ट्रॉनों के भरने के पश्चात् तीसरे आवर्त में तत्त्वों की संख्या सोडियम से अॉर्गन तक कुल मिलाकर आठ हो जाती है।
चौथे आवर्त (n = 4) का प्रारंभ पोटैशियम से, 4s कक्षक के भरने के साथ होता है। यहाँ यह बात महत्त्वपूर्ण है कि 4p कक्षक के भरने से पूर्व ही 3d कक्षक का भरना शुरू हो जाता है, जो ऊर्जात्मक (energetically) रूप से अनुकूल है।
इस प्रकार, हमें तत्त्वों की 3d संक्रमण-श्रेणी (3d transtitian series) प्राप्त हो जाती है। यह स्केन्डियम (Scandium : Z = 21) से प्रारंभ होती है, जिसका इलेक्ट्रॉनिक विन्यास 3d1 4s2 होता है। 3d कक्षक जि्ांक 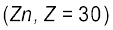 पर पूर्ण रूप से भर जाता है, जिसका इलेक्ट्रॉनिक विन्यास
पर पूर्ण रूप से भर जाता है, जिसका इलेक्ट्रॉनिक विन्यास 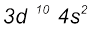 है। चौथा आवर्त 4p कक्षकों के भरने के साथ क्रिप्ट्रॉन (Krypton) पर समाप्त होता है। कुल मिलाकर चौथे आवर्त में 18 तत्त्व होते हैं। पाँचवाँ आवर्त
है। चौथा आवर्त 4p कक्षकों के भरने के साथ क्रिप्ट्रॉन (Krypton) पर समाप्त होता है। कुल मिलाकर चौथे आवर्त में 18 तत्त्व होते हैं। पाँचवाँ आवर्त  रूबिडियम से शुरू होता है, चौथे आवर्त के समान है। उस में 4d इट्रियम (ytrrium, Z=39) से 4d संक्रमण श्रेणी (4d transition series) शुरू होती है। यह आवर्त 5p कक्षकों के भरने पर जीनॉन (Xenon) पर समाप्त होता है। छठवें आवर्त में 32 तत्त्व होते हैं। उत्तरोत्तर इलेक्ट्रॉन 6s, 4f, 5d तथा 6p कक्षकों में भरे जाते हैं। 4f कक्षकों का भरना सीरियम (cerium, Z=58) से शुरू होकर ल्यूटीशियम (Lutetium, Z=71) पर समाप्त होता है। इसे 4f आंतरिक संक्रमण श्रेणी या लेन्थैनॉयड श्रेणी (Lenthanoid Series) कहते हैं।
रूबिडियम से शुरू होता है, चौथे आवर्त के समान है। उस में 4d इट्रियम (ytrrium, Z=39) से 4d संक्रमण श्रेणी (4d transition series) शुरू होती है। यह आवर्त 5p कक्षकों के भरने पर जीनॉन (Xenon) पर समाप्त होता है। छठवें आवर्त में 32 तत्त्व होते हैं। उत्तरोत्तर इलेक्ट्रॉन 6s, 4f, 5d तथा 6p कक्षकों में भरे जाते हैं। 4f कक्षकों का भरना सीरियम (cerium, Z=58) से शुरू होकर ल्यूटीशियम (Lutetium, Z=71) पर समाप्त होता है। इसे 4f आंतरिक संक्रमण श्रेणी या लेन्थैनॉयड श्रेणी (Lenthanoid Series) कहते हैं।
एेक्टिनियम (Actinium, Z = 89) के पश्चात् 5f कक्षक भरने के फलस्वरूप 5f आंतरिक संक्रमण-श्रेणी (5f inner transition series) प्राप्त होती है। इसे ‘एेक्टिनॉयड श्रेणी’ (Actinoid Series) कहते हैं। 4f तथा 5f आंतरिक संक्रमण-श्रेणियों को आवर्त सारणी के मुख्य भाग से बाहर रखा गया है, ताकि इसकी संरचना को अक्षुण्ण रखा जा सके और साथ ही समान गुणधर्मों वाले तत्त्वों को एक ही स्तंभ में रखकर वर्गीकरण के सिद्धांत का भी पालन किया जा सके।
उदाहरण 3.2
आवर्त सारणी के पाँचवें आवर्त में 18 तत्त्वों के होने की व्याख्या आप किस प्रकार करेंगे?
हल
जब n=5 होता है, तो l=0,1,2,3 होता है। उपलब्ध कक्षकों 4d, 5s और 5P की ऊर्जाओं के बढ़ने का क्रम इस प्रकार है– 5s<4d<5d में कुल मिलाकर 9 कक्षक उपलब्ध हैं। इनमें अधिकतम 18 इलेक्ट्रॉन भरे जा सकते हैं। इसीलिए आवर्त 5 में 18 तत्त्व होते हैं।
(ख) वर्गवार इलेक्ट्रॉनिक विन्यास
एक ही वर्ग या ऊर्ध्वाधर स्तंभ में उपस्थित तत्त्वों के संयोजकता कोश इलेक्ट्रॉनिक विन्यास समान होते हैं। इनके बाह्य कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या एवं गुणधर्म भी समान होते हैं। उदाहरण के लिए वर्ग 1 के तत्त्वों (क्षार धातुओं) का संयोजकता कोश इलेक्ट्रॉनिक विन्यास ns1 होता है, जैसा नीचे दिखाया गया है। इस प्रकार यह स्पष्ट हो जाता है कि किसी तत्त्व के गुणधर्म उसके परमाणु-क्रमांक पर निर्भर करते हैं, न कि उसके सापेक्षिक परमाणु-द्रव्यमान पर।
3.6 इलेक्ट्रॉनिक विन्यास और तत्त्वों के प्रकार (s,p,d,f ब्लॉक)
आवर्त वर्गीकरण का सैद्धांतिक मूलाधार ‘अॉफबाऊ का सिद्धांत’ (Aufbau Principle) तथा परमाणुओं का इलेक्ट्रॉनिक विन्यास है। आवर्त सारणी के ऊर्ध्वाधर स्तंभों (vertical columns) में स्थित तत्त्व एक वर्ग (Group) अथवा परिवार (family) की रचना करते हैं, और समान रासायनिक गुणधर्म दर्शाते हैं। यह समानता इसलिए होती है, क्योंकि इन तत्त्वों के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या और वितरण एक ही प्रकार का होता है। इन तत्त्वों का विभाजन चार विभिन्न ब्लॉकों s,p,d और f में किया जा सकता है, जो इस बात पर निर्भर करता है कि किस प्रकार के कक्षक इलेक्ट्रॉनों द्वारा भरे जा रहे हैं। इसे चित्र 3.3 में दर्शाया गया है।
इस प्रकार के वर्गीकरण में दो अपवाद देखने को मिलते हैं। पहला अपवाद हीलियम का है। उसे 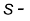 ब्लॉक के तत्त्वों में संबद्ध होना चाहिए, परंतु इसका स्थान आवर्त सारणी में वर्ग 18 के तत्त्वों के साथ
ब्लॉक के तत्त्वों में संबद्ध होना चाहिए, परंतु इसका स्थान आवर्त सारणी में वर्ग 18 के तत्त्वों के साथ 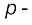 ब्लॉक में है। इसका औचित्य इस आधार पर है कि हीलियम का संयोजी कोश (valance shell) पूरा भरा हुआ है (He=1s2), जिसके फलस्वरूप यह उत्कृष्ट गैसों के अभिलक्षणों को प्रदर्शित करती है। दूसरा अपवाद हाइड्रोजन का है। इसमें केवल एक s- इलेक्ट्रॉन है (H=1s1)। इस प्रकार इसका स्थान वर्ग 1 में क्षारीय धातुओं के साथ होना चाहिए। दूसरी ओर, यह एक इलेक्ट्रॉन ग्रहण करके उत्कृष्ट गैस (हीलियम) का इलेक्ट्रॉनिक विन्यास प्राप्त कर सकती है। इस प्रकार इसका व्यवहार वर्ग 17 (हैलोजेन परिवार) की भाँति हो सकता है। चूँकि यह एक विशेष स्थिति है, अतः हाइड्रोजन को आवर्त सारणी में सबसे ऊपर अलग से स्थान देना अधिक तर्कसंगत माना गया है (चित्र 3.2 और 3.3 को देखें)।
ब्लॉक में है। इसका औचित्य इस आधार पर है कि हीलियम का संयोजी कोश (valance shell) पूरा भरा हुआ है (He=1s2), जिसके फलस्वरूप यह उत्कृष्ट गैसों के अभिलक्षणों को प्रदर्शित करती है। दूसरा अपवाद हाइड्रोजन का है। इसमें केवल एक s- इलेक्ट्रॉन है (H=1s1)। इस प्रकार इसका स्थान वर्ग 1 में क्षारीय धातुओं के साथ होना चाहिए। दूसरी ओर, यह एक इलेक्ट्रॉन ग्रहण करके उत्कृष्ट गैस (हीलियम) का इलेक्ट्रॉनिक विन्यास प्राप्त कर सकती है। इस प्रकार इसका व्यवहार वर्ग 17 (हैलोजेन परिवार) की भाँति हो सकता है। चूँकि यह एक विशेष स्थिति है, अतः हाइड्रोजन को आवर्त सारणी में सबसे ऊपर अलग से स्थान देना अधिक तर्कसंगत माना गया है (चित्र 3.2 और 3.3 को देखें)।
अब आवर्त सारणी में दिखाए गए चार प्रकार के तत्त्वों के मुख्य लक्षणों की चर्चा हम करेंगे। इन तत्त्वों के बारे में अधिक जानकारी का विवरण बाद में दिया जाएगा। उनके लक्षणों की चर्चा करने के लिए जिस शब्दावली का उपयोग किया गया है, उसका वर्गीकरण भाग 3.7 में किया गया है।
3.6.1 s– ब्लॉक के तत्त्व
वर्ग 1 के तत्त्वों (क्षारीय धातुओं) तथा वर्ग 2 के तत्त्वों (क्षारीय मृदा धातुओं) के बाह्यतम कोश के सामान्य इलेक्ट्रॉनिक विन्यास क्रमशः ns1 तथा ns2 हैं। इन दोनों वर्गों के तत्त्व आवर्त सारणी के s– ब्लॉक से संबद्ध हैं। ये सभी क्रियाशील धातुएँ हैं। इनके आयनन एंथैल्पी के मान कम होते हैं। ये तत्त्व सरलतापूर्वक बाह्यतम इलेक्ट्रॉन त्यागने के पश्चात् 1+ आयन (क्षारीय धातुओं में) या 2+ आयन (मृदा क्षारीय धातुओं में) बना लेते हैं। वर्ग में नीचे की ओर जाने पर इन धातुओं के धात्विक लक्षण तथा अभिक्रियाशीलता में वृद्धि होती है। अधिक अभिक्रियाशील होने के कारण वे प्रकृति में शुद्ध रूप में नहीं पाई जाती हैं। लीथियम और बेरीलियम को छोड़कर s– ब्लॉक के तत्त्वों के यौगिक मुख्य रूप से आयनिक होते हैं।
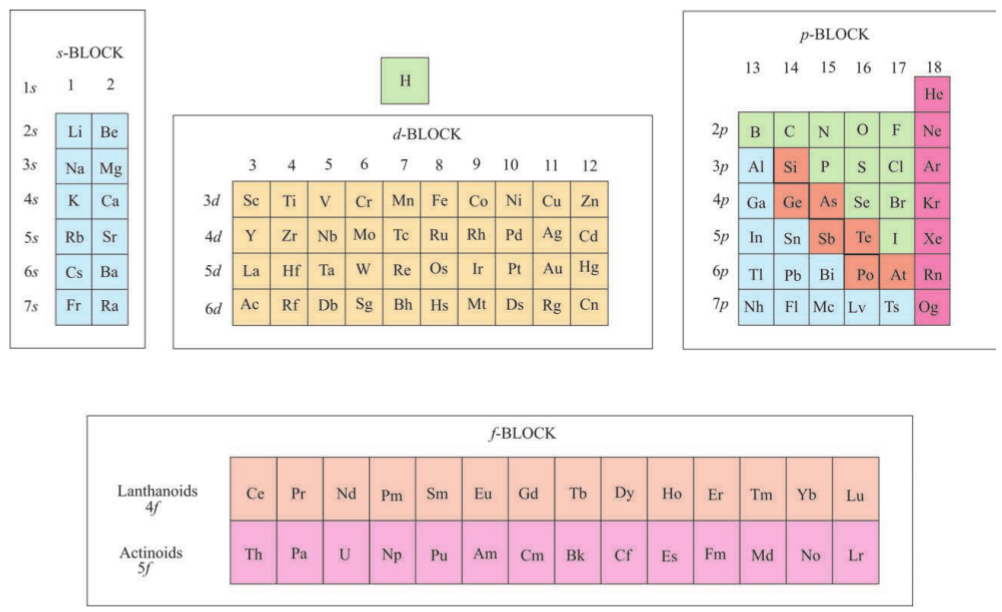
चित्र 3-3 विभिन्न कक्षकों के भरने के आधार पर आवर्त सारणी में तत्त्वों के प्रकार। तत्वों को मोटे तौर पर धातु
3.6.2 p-ब्लॉक के तत्त्व
आवर्त सारणी के p- ब्लॉक में वर्ग 13 से लेकर वर्ग 18 तक के तत्त्व सम्मिलित हैं। p- ब्लॉक के तत्त्वों और s- ब्लॉक के तत्त्वों को संयुक्त रूप से निरूपक तत्त्व (Representative elements) या मुख्य वर्ग के तत्त्व (Main Group Elements) कहा जाता है। प्रत्येक आवर्त में इनका बाह्यतम इलेक्ट्रॉनिक विन्यास ns2, np1 से ns2, np6 तक परिवर्तित होता है। प्रत्येक आवर्त ns2, np6, उत्कृष्ट गैस के इलेक्ट्रॉनिक विन्यास के साथ समाप्त होता है। उत्कृष्ट गैसों में संयोजी कोश में सभी कक्षक इलेक्ट्रॉनों से पूरे भरे होते हैं। इलेक्ट्रॉनों को हटाकर या जोड़कर इस स्थायी व्यवस्था को बदलना बहुत कठिन होता है। इसीलिए उत्कृष्ट गैसों की रासायनिक अभिक्रियाशीलता बहुत कम होती है। उत्कृष्ट गैसों के परिवार से पहले अधातुओं के रासायनिक रूप से दो महत्त्वपूर्ण वर्ग हैं। ये वर्ग हैं 17वें वर्ग के हैलोजेन (Halogens) तथा 16वें वर्ग के तत्त्व ‘चाल्कोजेन’ (Chalcogen)। इन दो वर्गों के तत्त्वों की उच्च ऋणात्मक इलेक्ट्रॉन लब्धि एंथैल्पी (negative electron gain enthalpy) होती है। ये तत्त्व आसानी से क्रमशः एक या दो इलेक्ट्रॉन ग्रहण कर स्थायी उत्कृष्ट गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं। आवर्त में बाईं से दाईं ओर बढ़ने पर तत्त्वों के अधात्विक लक्षणों में वृद्धि होती है तथा किसी वर्ग में ऊपर से नीचे की तरफ जाने पर धात्विक लक्षणों में वृद्धि होती है।
3.6.3 d- ब्लॉक के तत्त्व (संक्रमण तत्त्व)
आवर्त सारणी के मध्य में स्थित वर्ग 3 से वर्ग 12 वाले तत्त्व 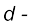 ब्लॉक के तत्त्व कहलाते हैं। इस ब्लॉक के तत्त्वों की पहचान इनके आंतरिक
ब्लॉक के तत्त्व कहलाते हैं। इस ब्लॉक के तत्त्वों की पहचान इनके आंतरिक 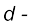 आर्बिटल में इलेक्ट्रॉनों के भरे जाने के आधार पर की जाती है। यही कारण है कि ये तत्त्व d–ब्लॉक के तत्त्व कहलाते हैं। इन तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास
आर्बिटल में इलेक्ट्रॉनों के भरे जाने के आधार पर की जाती है। यही कारण है कि ये तत्त्व d–ब्लॉक के तत्त्व कहलाते हैं। इन तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास 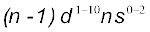 है। ये सभी तत्त्व धातुएँ हैं। इन तत्त्वों के आयन प्रायः रंगीन होते हैं तथा परिवर्ती संयोजकता एवं अनुचुंबकीयता प्रदर्शित करते हैं, और उत्प्रेरक के रूप में प्रयुक्त होते हैं। Zn, Cd तथा
है। ये सभी तत्त्व धातुएँ हैं। इन तत्त्वों के आयन प्रायः रंगीन होते हैं तथा परिवर्ती संयोजकता एवं अनुचुंबकीयता प्रदर्शित करते हैं, और उत्प्रेरक के रूप में प्रयुक्त होते हैं। Zn, Cd तथा 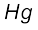 के सामान्य इलेक्ट्रॉनिक विन्यास
के सामान्य इलेक्ट्रॉनिक विन्यास 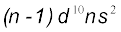 होते हुए भी ये धातुएँ संक्रमण तत्त्वों के बहुत-से लक्षणों को प्रदर्शित नहीं करती हैं। d-ब्लॉक के तत्त्व रासायनिक तौर पर अतिक्रियाशील s-ब्लॉक के तत्त्वों तथा कम क्रियाशील 13वें तथा 14वें वर्गों के तत्त्वों के बीच एक प्रकार से सेतु का कार्य करते हैं। इसी कारण d-ब्लॉक के तत्त्वों को ‘संक्रमण तत्त्व’ भी कहते हैं।
होते हुए भी ये धातुएँ संक्रमण तत्त्वों के बहुत-से लक्षणों को प्रदर्शित नहीं करती हैं। d-ब्लॉक के तत्त्व रासायनिक तौर पर अतिक्रियाशील s-ब्लॉक के तत्त्वों तथा कम क्रियाशील 13वें तथा 14वें वर्गों के तत्त्वों के बीच एक प्रकार से सेतु का कार्य करते हैं। इसी कारण d-ब्लॉक के तत्त्वों को ‘संक्रमण तत्त्व’ भी कहते हैं।
3.6.4 f- ब्लॉक के तत्त्व (आंतरिक संक्रमण तत्त्व)
मुख्य आवर्त सारणी में नीचे जिन तत्त्वों को दो क्षैतिज पंक्तियों में रखा गया है, उन्हें लैन्थेनॉयड (58Ce – 72Lu) तथा एेक्टीनॉयड (90Th – 103Lr) कहते हैं। इन श्रेणियों के तत्त्वों की पहचान इनके सामान्य इलेक्ट्रॉनिक विन्यास [(n–2)f1–14(n–1)d0–1ns2] द्वारा की जाती है। इन तत्त्वों में अंतिम इलेक्ट्रॉन f उप-कोश में भरता है। इसी आधार पर इन श्रेणियों के तत्त्वों को f-ब्लॉक के तत्त्व (आंतरिक संक्रमण तत्त्व) कहते हैं। ये सभी तत्त्व धातुएँ हैं। प्रत्येक श्रेणी में तत्त्वों के गुण लगभग समान हैं। प्रारंभिक एेक्टीनॉयड श्रेणी के तत्त्वों की अनेक संभावित अॉक्सीकरण अवस्थाओं के फलस्वरूप इन तत्त्वों का रसायन इनके संगत लैन्थैनॉयड श्रेणी के तत्त्वों की तुलना में अत्यधिक जटिल होता है। एेक्टीनॉयड श्रेणी के तत्त्व रेडियोधर्मी (Radioactive) होते हैं। बहुत से एेक्टीनॉयड तत्त्वों को नाभिकीय अभिक्रियाओं द्वारा नैनोग्राम (Nenogram) या उससे भी कम भाग में प्राप्त किया गया है। इन तत्त्वों के रसायन का अध्ययन पूर्ण रूप से नहीं हो पाया है। यूरेनियम के बाद वाले तत्त्व ‘परायूरेनियम तत्त्व’ कहलाते हैं।
उदाहरण 3.3
परमाणु क्रमांक 117 एवं 120 वाले तत्त्वों की खोज अब तक नहीं हो पाई है। बताएँ कि इन तत्त्वों का स्थान आवर्त सारणी के किस परिवार/वर्ग में होना चाहिए तथा प्रत्येक का इलेक्ट्रॉनिक विन्यास क्या होगा?
हल
चित्र 3.2 में दी गई सारणी से स्पष्ट है कि परमाणु क्रमांक 117 वाले तत्त्व का स्थान आवर्त सारणी में हैलोजेन परिवार (वर्ग 17) में At के नीचे होगा तथा इसका इलेक्ट्रॉनिक विन्यास [Rn] 5f146d107s27p5 होगा। परमाणु क्रमांक 120 वाले तत्त्व का स्थान वर्ग 2 (क्षारीय मृदा धातुएँ) में Ra के नीचे होगा तथा इसका इलेक्ट्रॉनिक विन्यास [Uuo] 8s2 होगा।
3.6.5 धातु, अधातु और उप-धातु
तत्वों केें s-,p-,d तथा f-ब्लॉकों में वर्गीकरण के अलावा इनके गुणों के आधार पर मौटे तौर पर इन्हें धातुओं तथा अधातुओं में विभाजित किया जा सकता है (चित्र 3.3)। ज्ञात तत्त्वों में 78 प्रतिशत से अधिक संख्या धातुओं की है, जो आवर्त सारणी की बाईं ओर स्थित हैं। धातुएँ कमरे के ताप पर सामान्यतया ठोस होती हैं। [मर्करी इसका अपवाद है, गैलियम और सीजियम के गलनांक भी बहुत कम, क्रमशः 303K और 302K हैं।] धातुओं के गलनांक एवं क्वथनांक उच्च होते हैं। ये ताप तथा विद्युत् के सुचालक होते हैं। ये आघातवर्ध्य (हथौड़े से पीटने पर पतली चादर में ढाले जा सकने वाले) तथा तन्य (जिसके तार खींचे जा सकते हैं) होते हैं। दूसरी अधातुएँ आवर्त सारणी के दाईं ओर स्थित हैं। दीर्घ आवर्त सारणी में किसी वर्ग में तत्त्वों के धात्विक गुणों में ऊपर से नीचे की ओर जाने पर वृद्धि होती है और आवर्त में बाईं ओर से दाईं ओर जाने पर धात्वि क गुण कम होते जाते हैं। अधातुएँ कक्षताप पर ठोस एवं गैस होती हैं। इनके गलनांक तथा क्वथनांक कम होते हैं (बोरोन और कार्बन अपवाद हैं)। ये ताप तथा विद्युत् के अल्प चालक हैं। बहुत से अधात्विक ठोस भंगुर (Brittle) होते हैं। ये ही अघात और तन्य नहीं होते हैं। तत्त्वों के धात्विक से अधात्विक गुणों में परिवर्तन असंलग्न (abrupt) नहीं होता है, बल्कि यह परिवर्तन टेढ़ी-मेढ़ी रेखा (Zig-Zag line) के रूप में देखने को मिलता है। (चित्र 3.3) आवर्त सारणी से विकर्ण (टेढ़ी-मेढ़ी) रेखा के सीमावर्ती स्थित जर्मेनियम, सिलिकॉन, आर्सेनिक, एेन्टेमनी तथा टेलुरियम तत्त्व, धातुओं एवं अधातुओं– ‘दोनों के अभिलक्षण दर्शाते हैं। इस प्रकार के तत्त्वों को उप-धातु’ (Metalloid) कहते हैं।
उदाहरण 3.4
चित्र 3.4 (क) द्वितीय आवर्त में परमाणु क्रमांक के साथ तत्त्वों की परमाणु त्रिज्या में परिवर्तन
परमाणु क्रमांक और आवर्त सारणी में स्थिति को ध्यान में रखते हुए निम्नलिखित तत्त्वों को उनके बढ़ते हुए
धात्विक लक्षण के क्रम में व्यवस्थित कीजिए–
Si, Be, Mg, Na एवं P
हल
आवर्त सारणी के वर्ग में ऊपर से नीचे की ओर जाने पर तत्त्वों के धात्विक गुणों में वृद्धि होती है तथा आवर्त में बाईं से दाईं ओर बढ़ने पर धात्विक गुणों में कमी होती है। इस आधार पर दिए गए तत्त्वों के बढ़ते हुए धात्विक लक्षण का क्रम इस प्रकार होगा–
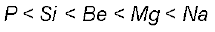
* समइलेक्ट्रॉनी स्पीशीज़– दो या दो से अधिक स्पीशीज़ जिनमें अणुओं और वैलेन्सी इलेक्ट्रॉनों की संख्या समान हो तथा समान संरंचना हो चाहे तत्वों की कोई भी प्रकृति हो।
3.7 तत्त्वों के गुण-धर्मों में आवर्तिता
आवर्त सारणी में यदि हम ऊपर से नीचे की तरफ जाएँ या बाईं से दाईं ओर जाएँ, तो तत्त्वों के भौतिक तथा रासायनि क गुणों में एक प्रारूप दिखाई देता है। उदाहरणार्थ– किसी आवर्त में रासायनिक क्रियाशीलता प्रथम वर्ग के धातुओं में बहुत ज़्यादा है, मध्य तक पहुँचकर यह कम हो जाती है और वर्ग 17 के अधातुओं पर पहुँचने पर बढ़कर बहुत ज्यादा हो जाती है। इसी तरह निरूपक तत्त्वों के समूह में (जैसे– क्षारीय धातुओं में) आवर्त सारणी में ऊपर से नीचे जाने पर क्रियाशीलता बढ़ती है, जबकि अधातुओं के समूह में (जैसे– हैलोजन परिवार) ऊपर से नीचे जाने पर क्रियाशीलता घटती है। तत्त्वों के गुणधर्मों में एेसा क्यों हो रहा है और इस आवर्तिता को हम कैसे समझाएं? इन सभी प्रश्नों के उत्तर देने के लिए हमें परमाणु की संरचना के सिद्धांत एवं परमाणु के गुणधर्मों की ओर ध्यान देना होगा। इस भाग में हम भौतिक एवं रासायनिक गुणधर्मों की आवर्तिता की विवेचना करेंगे और उन्हें इलेक्ट्रॉन की संख्या तथा ऊर्जा-स्तर को लेकर समझाएँगे।
3.7.1 भौतिक गुणधर्मों की प्रवृत्ति
तत्त्वों के कई भौतिक गुण (जैसे– गलनांक, क्वथनांक, संलयन एवं वाष्पीकरण) ऊष्मा, परमाणवीकरण-ऊर्जा आदि सभी आवर्ती परिवर्तन दर्शाते हैं। इस अनुभाग में हम परमाणु एवं आयनिक त्रिज्याएँ, आयनन एंथैल्पी (Ionization Enthalpy), इलेक्ट्रॉन लब्धि एंथैल्पी (Electron Gain Enthalpy) और इलेक्ट्रॉन ऋणात्मकता (Electronegativity) में आवर्त प्रवृत्ति का अध्ययन करेंगे।
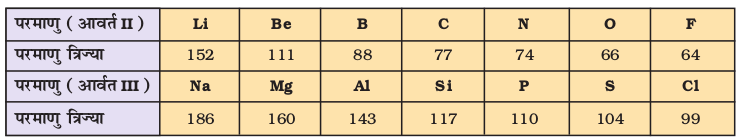
(क) परमाणु त्रिज्या
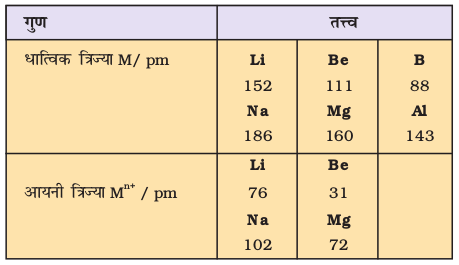
परमाणु के आकार का सही-सही निर्धारण बहुत ही जटिल है, जबकि एक गेंद की त्रिज्या आसानी से नापी जा सकती है। क्या आपको इसका कारण मालूम है? पहली बात तो यह है कि परमाणु की त्रिज्या बहुत छोटी (मात्र 1.2×10–10m) होती है। परमाणु के चारों ओर इलेक्ट्रॉन अभ्र (electron cloud) की कोई स्पष्ट सीमा निर्धारित नहीं है। अतः परमाणु का आकार सही तरह से निर्धारित नहीं किया जा सकता। दूसरे शब्दों में– परमाणु त्रिज्या सही नहीं नापी जा सकती। प्रायोगिक विधि के आधार पर परमाणु के आकार का निर्धारण संभव नहीं है। संयुक्त अवस्था में परमाणुओं के बीच की दूरी की जानकारी के आधार पर परमाणु-आकार का आकलन किया जा सकता है। एकल आबंध (Single Bond) द्वारा जुड़े हुए सहसंयोजक अणुओं (covalent molecules) में उपस्थित दो अधात्विक परमाणुओं के नाभिक के बीच की दूरी ज्ञात कर ली जाती है तथा इस (दूरी) के आधार पर सहसंयोजक त्रिज्या (covalent Radius) का आकलन किया जाता है। उदाहरण के तौर पर– क्लोरीन अणु के लिए बंध दूरी (bond length) का मान 198 pm निर्धारित किया गया है। इस मान का आधा, (99 pm), क्लोरीन की परमाणु त्रिज्या होगी। धातुओं की धात्विक त्रिज्या (Metalic Radius) का मान धात्विक क्रिस्टल में स्थित धातु कोरों की अंतरा नाभिकीय दूरी (Internuclear distance) का आधा होता है। कॉपर धातु में दो संलग्न कॉपर परमाणुओं के बीच की दूरी 256 pm है। अतः कॉपर के लिए धात्विक त्रिज्या का मान 256 pm का आधा, अर्थात् 128 pm होगा। इस पुस्तक में सहसंयोजी त्रिज्या तथा धात्विक त्रिज्या के लिए केवल परमाण्वीय त्रिज्या (Atomic Radius) का प्रयोग किया गया है। चाहे वह तत्त्व हो या धातु या अधातु, परमाण्वीय त्रिज्या को x-किरणों तथा अन्य स्पैक्ट्रोस्कोपिक विधि से नापा जा सकता है। कुछ तत्त्वों के लिए परमाणु त्रिज्या का मान सारणी 3.6 (क) में दिया गया है।
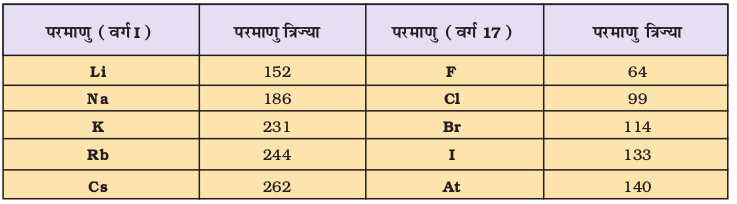
दो प्रकार की प्रवृत्तियाँ स्पष्ट रूप से देखने को मिलती हैं, जिनकी व्याख्या हम नाभिकीय आवेश तथा ऊर्जास्तर से कर सकते हैं। आवर्त में दाईं ओर बढ़ने पर परमाणु-आकार घटता है, जैसा द्वितीय आवर्त के तत्त्वों के परमाणु-आकार से स्पष्ट है (सारणी 3.6 क का अवलोकन करें)। इस प्रवृत्ति का कारण यह है कि आवर्त में दाईं ओर बढ़ने पर बाह्य इलेक्ट्रॉन एक ही संयोजी कोश में स्थित हैं, परंतु उनके नाभिकीय आवेश में हुई वृद्धि के फलस्वरूप बाह्य इलेक्ट्रॉनों का आकर्षण नाभिक की ओर बढ़ता जाता है, जिसके कारण परमाणु त्रिज्या घट जाती है। आवर्त सारणी के वर्गों में परमाणु-क्रमांक के साथ-साथ परमाणु त्रिज्याओं में भी नियमित रूप से वृद्धि होती है, जैसा क्षारीय धातुओं तथा हैलोजेन तत्त्वों के लिए सारणी 3.6 (ख) में दर्शाया गया है। वर्ग में जब हम नीचे की ओर बढ़ते हैं, तो मुख्य क्वांटम संख्या (n) का मान बढ़ता है तथा संयोजी इलेक्ट्रॉन (valence electron) नाभिक से दूर होता जाता है, इसलिए कि आंतरिक ऊर्जा-स्तर इलेक्ट्रॉनों से भरे होते हैं, जो कवच के रूप में बाह्य इलेक्ट्रॉनों पर नाभिक का आकर्षण कम कर देते हैं। फलस्वरूप परमाणु का आकार बढ़ता जाता है, जो परमाणु त्रिज्या के रूप में परिलक्षित होता है।
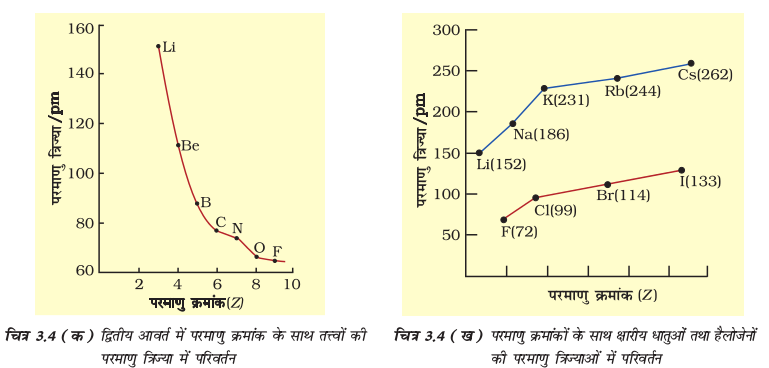
ध्यान देने की आवश्यकता है कि यहाँ उत्कृष्ट गैसों की परमाणु त्रिज्या पर विचार नहीं किया गया है। एकल परमाणु होने के कारण उनकी अबंधित त्रिज्या बहुत अधिक है। इसलिए उत्कृष्ट गैसों की तुलना दूसरे तत्त्वों की सहसंयोजक त्रिज्या से न करके वान्डरवाल्स त्रिज्या से करनी चाहिए।
(ख) आयनी त्रिज्या
यदि परमाणु से एक इलेक्ट्रॉन निकाल दिया जाए तो धनायन बनता है, जबकि एक इलेक्ट्रॉन मिल जाए, तो परमाणु ऋणायन बन जाता है। आयनी त्रिज्या का आकलन आयनिक क्रिस्टल में स्थित धनायनों एवं ऋणायनों के बीच की दूरी के निर्धारण के आधार पर किया जा सकता है। साधारणतया तत्त्वों की आयनी त्रिज्या भी परमाणु त्रिज्या की प्रवृत्ति ही दर्शाती है।
धनायन आकार में अपने जनक परमाणु (parent atom) से छोटा होता है, क्योंकि इसमें इलेक्ट्रॉनों की संख्या कम होती है, जबकि नाभकीय आवेश, जनक परमाणु जैसा ही रहता है। ऋणायन का आकार जनक परमाणु से अधिक होता है, क्योंकि एक या अधिक अतिरिक्त इलेक्ट्रॉन होने से इलेक्ट्रॉनों में प्रतिकर्षण बढ़ता है और प्रभावी नाभिकीय आवेश में कमी आती है। उदाहरण के तौर पर– फ्लुओराइड आयन की आयनी त्रिज्या 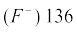 pm है, जबकि फ्लुओरीन की परमाणु त्रिज्या केवल 64 pm है। दूसरी ओर, सोडियम तत्त्व की परमाणु त्रिज्या 186 pm और Na+ आयन की त्रिज्या का मान
pm है, जबकि फ्लुओरीन की परमाणु त्रिज्या केवल 64 pm है। दूसरी ओर, सोडियम तत्त्व की परमाणु त्रिज्या 186 pm और Na+ आयन की त्रिज्या का मान 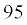 pm है।
pm है।
जब परमाणुओं तथा आयनों में इलेक्ट्रॉनों की संख्या समान होती है, तो ये समइलेक्ट्रॉनी स्पीशीज़ (Isoelectronic species)* कहलाते हैं। समइलेक्ट्रॉनी स्पीशीज़ के उदाहरण हैं O2–,F–,Na+,Mg2+,O2–। प्रत्येक स्पीशीज़ में इलेक्ट्रॉनों की संख्या 10 है। प्रत्येक स्पीशीज़ की त्रिज्याएं भिन्न-भिन्न होंगी, क्योंकि प्रत्येक का नाभिकीय आवेश भिन्न है। अधिक धनावेशित धनायन की आयनी त्रिज्या का मान कम होगा, क्योंकि इनके नाभिक तथा इलेक्ट्रॉनों के बीच आकर्षण अधिक होगा। अधिक ऋणावेशित ऋणायन की आयनी त्रिज्या का मान अधिक होगा, क्योंकि इलेक्ट्रॉनों के बीच संपूर्ण प्रतिकर्षण का प्रभाव नाभिकीय आवेश से अधिक हो जाएगा तथा आयन का आकार बढ़ जाएगा।
उदाहरण 3.5
निम्नलिखित स्पीशीज़ में किसकी त्रिज्या अधिकतम तथा किसकी त्रिज्या न्यूनतम होगी?
Mg, Mg2+,Al, Al3+
हल
आवर्त में बाईं से दाईं ओर बढ़ने पर परमाणु त्रिज्या का का मान घटता है। धनायन का आकार उसके जनक परमाणु की तुलना में छोटा होता है। समइलेक्ट्रॉनिक स्पीशीज़ में अधिक नाभिकीय आवेश वाली स्पीशीज़ की त्रिज्या छोटी होती है।
अतः अधिकतम आकार वाली स्पीशीज़ Mg तथा न्यूनतम आकार वाली स्पीशीज़ Al3+ होगी।
(ग) आयनन एन्थैल्पी
तत्त्वों द्वारा इलेक्ट्रॉन त्यागने की मात्रात्मक प्रकृति ‘आयनन एन्थैल्पी’ कही जाती है। तलस्थ अवस्था (Ground State) में विलगित गैसीय परमाणु (Isolated Gaseous Atom) से बाह्यतम इलेक्ट्रॉन को बाहर निकालने में जो ऊर्जा लगती है, उसे ‘तत्त्व की आयनन एन्थैल्पी’ कहते हैं। दूसरे शब्दों में– तत्त्व (X) की प्रथम आयनन एन्थैल्पी का मान रासायनिक प्रक्रम 3.1 में एन्थैल्पी परिवर्तन 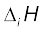 के बराबर होगा।
के बराबर होगा।
X(g) → X+(g) + e– (3.1)
आयनन एन्थैल्पी को सामान्यतया किलो जूल प्रतिमोल (kJ mol–1) इकाई में व्यक्त किया जाता है। सर्वाधिक शिथिलता से बंधे दूसरे इलेक्ट्रॉन को पृथक् करने के लिए दी गई ऊर्जा को ‘द्वितीय आयनन एन्थैल्पी’ कहते हैं। इस एन्थैल्पी का मान रासायनिक प्रक्रम (3.2) के संपन्न होने में प्रयुक्त ऊर्जा के बराबर होता है।
X+(g) → X2+(g) + e– (3.2)
परमाणु से इलेक्ट्रॉन को पृथक् करने में हमेशा ऊर्जा की आवश्यकता होती है। अत : आयनन एन्थैल्पी हमेशा धनात्मक होती है। तत्त्व के द्वितीय आयनन एन्थैल्पी का मान उसके प्रथम आयनन एन्थैल्पी से अधिक होता है, क्योंकि उदासीन परमाणु की तुलना में धनावेशित आयन से इलेक्ट्रॉन को पृथक् करना अधिक कठिन होता है। इसी प्रकार तृतीय आयनन एन्थैल्पी का मान द्वितीय आयनन एन्थैल्पी के मान से अधिक होगा। ‘आयनन एन्थैल्पी’ पद को यदि विनिर्दिष्ट (Specified) नहीं किया गया है, तो इसे प्रथम आयनन एन्थैल्पी समझना चाहिए।
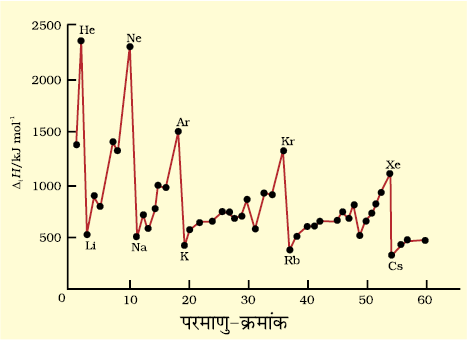
चित्र . 3.5 1 से 60 परमाणु-क्रमांकों वाले तत्त्वों के प्रकम आयनन ऐंथैल्पी के मात्रें में परिवर्तन
परमाणु क्रमांक 60 तक वाले तत्त्वों की प्रथम आयनन एन्थैल्पी का वक्र चित्र 3.5 में दर्शाया गया है। ग्राफ में आवर्तिता असाधारण है। इस चित्र से यह स्पष्ट है कि वक्र (curve) के उच्चिष्ठ (maxima) पर उत्कृष्ट गैसें हैं, जो पूर्ण इलेक्ट्रॉन कोश (closed electron shell) रखती हैं तथा इनके इलेक्ट्रॉनिक विन्यास बहुत ही स्थायी हैं। दूसरी ओर वक्र के निम्निष्ठ (Minima) पर क्षारीय धातुएं स्थित हैं तथा इन धातुओं की आयनन एन्थैल्पी का मान कम होता है। यही कारण है कि क्षारीय धातुएं अति क्रियाशील होती हैं। इसके अतिरिक्त हम देखेंगे कि आवर्त में बाईं से दाईं तरफ बढ़ने पर तत्त्वों के प्रथम आयनन एन्थैल्पी के मानों में सामान्यतया वृद्धि होती है तथा जब हम वर्ग में नीचे की ओर बढ़ते हैं, तब उनके मानों में कमी आती है। इस प्रकार की प्रवृत्ति द्वितीय आवर्त के तत्त्वों तथा प्रथम वर्ग के क्षारीय धातुओं में क्रमशः चित्र 3.6 (क) और 3.6 (ख) में स्पष्ट रूप से दिखती है। इसका कारण दो तथ्यों पर आधारित है– (i) नाभिक तथा इलेक्ट्रॉनों के मध्य आकर्षण और (ii) इलेक्ट्रॉनों के मध्य प्रतिकर्षण।
तत्त्वों में क्रोडीय इलेक्ट्रॉनों (core elctrons) की स्थिति नाभिक तथा संयोजी इलेक्ट्रॉन के बीच आ जाने के फलस्वरूप संयोजी इलेक्ट्रॉन नाभिक से परिरक्षित (shielded) या आवरित (Screened) हो जाता है। इस प्रभाव को ‘परिरक्षण-प्रभाव’ (shielding Effect) या ‘आवरण-प्रभाव’ (Screening Effect) कहते हैं। आवरण-प्रभाव के कारण परमाणु के संयोजी इलेक्ट्रॉनों द्वारा अनुभव किया गया प्रभावी नाभिकीय आवेश (Effective Nuclear charge) नाभिक में उपस्थित वास्तविक नाभकीय आवेश (Actual Nuclear charge) से कम हो जाता है। उदाहरणार्थ– लीथियम का बाह्यतम 2s इलेक्ट्रॉन (संयोजी इलेक्ट्रॉन) उसके आंतरिक 1s क्रोड इलेक्ट्रॉनों द्वारा आवरण-प्रभाव का अनुभव करता है। फलस्वरूप लीथियम का संयोजी इलेक्ट्रॉन वास्तविक +3 धनावेश से कम प्रभाव का धनावेश अनुभव करेगा। आवरण-प्रभाव उस परिस्थिति में अत्यधिक प्रभावी होता है, जब आंतरिक कोश के कक्षक पूर्ण रूप से भरे होते हैं। इस प्रकार की स्थिति हम क्षारीय धातुओं में पाते हैं, जिसमें एकाकी ns1 इलेक्ट्रॉन (n = बाह्यतम कोश) से पहले कोश में उत्कृष्ट गैस का इलेक्ट्रॉन-विन्यास होता है।
जब हम द्वितीय आवर्त में लीथियम से फ्लुओरीन की ओर बढ़ते हैं, तब क्रमशः इलेक्ट्रॉन एक ही मुख्य क्वांटम ऊर्जा-स्तर के कक्षकों में भरते हैं तथा नाभिक पर आंतरिक क्रोड इलेक्ट्रॉनों (Inner Core Electrons) द्वारा डाले गए आवरण-प्रभाव में इतनी वृद्धि नहीं होती कि नाभिक तथा इलेक्ट्रॉन के बीच बढ़ते हुए आकर्षण को पूरित (compensate) कर सके। एेसी परिस्थिति में बढ़ते हुए नाभिकीय आवेश द्वारा बाह्यतम इलेक्ट्रॉन पर डाला गया आकर्षण-प्रभाव आवरण-प्रभाव की तुलना में अधिक हो जाता है। फलस्वरूप बाह्यतम इलेक्ट्रॉन अधिक दृढ़ता से बंध जाते हैं तथा आवर्त में आगे बढ़ने पर तत्त्वों के आयनन एन्थैल्पी के मानों में वृद्धि होती जाती है। वर्ग में नीचे की ओर बढ़ने पर बाह्यतम इलेक्ट्रॉन नाभिक से अधिक दूरी पर रहते हैं तथा आंतरिक इलेक्ट्रॉन के कारण नाभिक पर आवरण- प्रभाव अधिक होता है। एेसी दशा में वर्ग में नीचे की ओर बढ़ने पर नाभिकीय आवेश की तुलना में आवरण-प्रभाव अधिक महत्त्वपूर्ण हो जाता है। इस कारण बाह्यतम इलेक्ट्रॉन को निकालने के लिए कम ऊर्जा की आवश्यकता होती है तथा वर्ग में नीचे की ओर बढ़ने पर तत्त्वों के आयनन एन्थैल्पी का मान घटता जाता है।
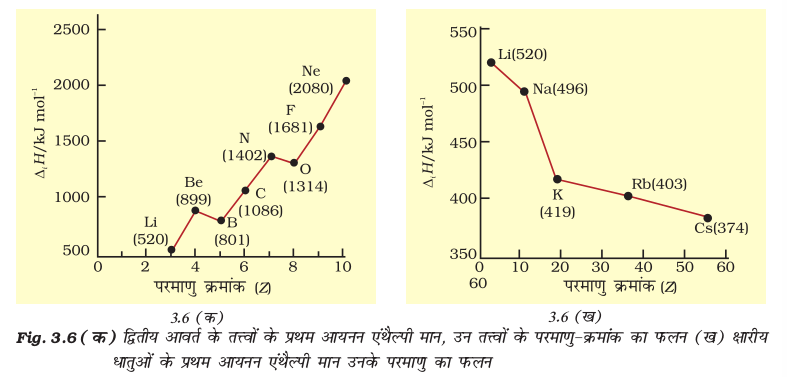
चित्र 3.6 (क) से स्पष्ट है कि बोरॉन (Z = 5) के प्रथम आयनन एन्थैल्पी का मान बेरिलियम (Z = 4) के प्रथम आयनन एन्थैल्पी के मान से कम है, जबकि बोरॉन का नाभिकीय आवेश अधिक है। जब हम एक ही मुख्य क्वांटम ऊर्जा-स्तर पर विचार करते हैं, तो s–इलेक्ट्रॉन p–इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित रहता है। बेरिलियम में बाह्यतम इलेक्ट्रॉन, जो अलग किया जाएगा, वह s–इलेक्ट्रॉन होगा, जबकि बोरॉन में बाह्यतम इलेक्ट्रॉन (जो अलग किया जाएगा, वह) 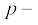 इलेक्ट्रॉन होगा। उल्लेखनीय है कि नाभिक की ओर 2s–इलेक्ट्रॉन का भेदन (penetration) 2p– इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का 2p– इलेक्ट्रॉन बेरिलियम के 2s–इलेक्ट्रॉन की तुलना में आंतरिक क्रोड़ इलेक्ट्रॉनों द्वारा अधिक परिरक्षित (Shielded) होता है। अतः बेरिलियम के 2s– इलेक्ट्रॉन की तुलना में बोरॉन का 2p– इलेक्ट्रॉन अधिक आसानी से पृथक् हो जाता है। अतः बेरिलियम की तुलना में बोरॉन के प्रथम आयनन एन्थैल्पी का मान कम होगा। दूसरी अनियमितता हमें अॉक्सीजन तथा नाइट्रोजन के प्रथम आयनन एन्थैल्पी के मानों में देखने को मिलती है। अॉक्सीजन के लिए प्रथम आयनन एन्थैल्पी का मान नाइट्रोजन के प्रथम आयनन एन्थैल्पी के मान से कम है। इसका कारण यह है कि नाइट्रोजन में तीनों बाह्यतम 2p–इलेक्ट्रॉन विभिन्न p–कक्षकों में वितरित है (हुंड का नियम), जबकि अॉक्सीजन के चारों 2p–इलेक्ट्रॉनों में से दो 2p–इलेक्ट्रॉन एक ही 2p–आर्बिटल में हैं। फलतः इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों 2p–इलेक्ट्रॉनों में से एक इलेक्ट्रॉन को पृथक् करने की बजाय अॉक्सीजन के चारों 2p–इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को अलग करना आसान हो जाता है।
इलेक्ट्रॉन होगा। उल्लेखनीय है कि नाभिक की ओर 2s–इलेक्ट्रॉन का भेदन (penetration) 2p– इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का 2p– इलेक्ट्रॉन बेरिलियम के 2s–इलेक्ट्रॉन की तुलना में आंतरिक क्रोड़ इलेक्ट्रॉनों द्वारा अधिक परिरक्षित (Shielded) होता है। अतः बेरिलियम के 2s– इलेक्ट्रॉन की तुलना में बोरॉन का 2p– इलेक्ट्रॉन अधिक आसानी से पृथक् हो जाता है। अतः बेरिलियम की तुलना में बोरॉन के प्रथम आयनन एन्थैल्पी का मान कम होगा। दूसरी अनियमितता हमें अॉक्सीजन तथा नाइट्रोजन के प्रथम आयनन एन्थैल्पी के मानों में देखने को मिलती है। अॉक्सीजन के लिए प्रथम आयनन एन्थैल्पी का मान नाइट्रोजन के प्रथम आयनन एन्थैल्पी के मान से कम है। इसका कारण यह है कि नाइट्रोजन में तीनों बाह्यतम 2p–इलेक्ट्रॉन विभिन्न p–कक्षकों में वितरित है (हुंड का नियम), जबकि अॉक्सीजन के चारों 2p–इलेक्ट्रॉनों में से दो 2p–इलेक्ट्रॉन एक ही 2p–आर्बिटल में हैं। फलतः इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों 2p–इलेक्ट्रॉनों में से एक इलेक्ट्रॉन को पृथक् करने की बजाय अॉक्सीजन के चारों 2p–इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को अलग करना आसान हो जाता है।
उदाहरण 3.6
तीसरे आवर्त के तत्त्वों Na, Mg और Si की प्रथम आयनन एन्थैल्पी 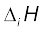 का मान क्रमशः 496, 737 और 786 k J mol–1 है। पूर्वानुमान कीजिए कि एेलुमीनियम का प्रथम
का मान क्रमशः 496, 737 और 786 k J mol–1 है। पूर्वानुमान कीजिए कि एेलुमीनियम का प्रथम 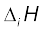 मान 575 या 760 kJ mol–1 में से किसके अधिक पास होगा, इसका उचित कारण बताइए।
मान 575 या 760 kJ mol–1 में से किसके अधिक पास होगा, इसका उचित कारण बताइए।
हल
यह 575 k J mol–1 के अधिक पास होगा। एेलुमीनियम का मान मैग्नीशियम के मान से कम होना चाहिए, क्योंकि नाभिक से 3p – इलेक्ट्रॉन 3s – इलेक्ट्रॉनों के द्वारा परिरक्षित होते हैं।
(घ) इलेक्ट्रॉन लब्धि एन्थैल्पी
जब कोई उदासीन गैसीय परमाणु (X) इलेक्ट्रॉन ग्रहण कर ऋणायन (anion) में परिवर्तित होता है, तो इस प्रक्रम में हुए एन्थैल्पी परिवर्तन को उस तत्त्व की ‘इलेक्ट्रॉन लब्धि एन्थैल्पी’ 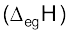 कहते हैं। यह एन्थैल्पी इस तथ्य की माप कही जा सकती है कि किस सरलता से परमाणु इलेक्ट्रॉन को ग्रहण करके ऋणायन बना लेता है। यह समीकरण 3.3 में दर्शाया गया है–
कहते हैं। यह एन्थैल्पी इस तथ्य की माप कही जा सकती है कि किस सरलता से परमाणु इलेक्ट्रॉन को ग्रहण करके ऋणायन बना लेता है। यह समीकरण 3.3 में दर्शाया गया है–
X(g) + e– → X–(g) .........(3.3)
परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने का प्रक्रम ऊष्माक्षेपी (exothermic) अथवा ऊष्माशोषी (endothermic) होगा, यह तत्त्व के स्वभाव पर निर्भर करता है। बहुत-से तत्त्व जब इलेक्ट्रॉन ग्रहण करते हैं,
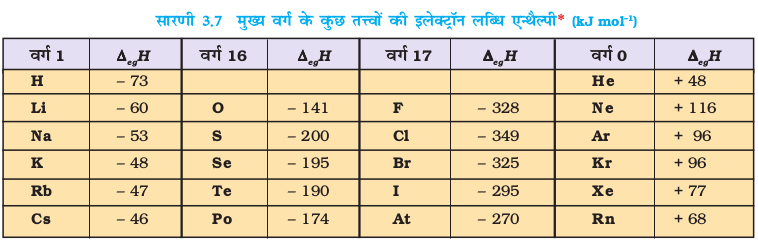
तब ऊर्जा निर्मुक्त होती है। एेसी अवस्था में इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होगी। उदाहरणार्थ– 17वें वर्ग के तत्त्वों (हैलोजन) की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अत्यधिक ऋणात्मक होता है। इसका कारत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं। इसी तरह उत्कृष्ट गैसों की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अत्यधिक धनात्मक होता है, क्योंकि इलेक्ट्रॉन को वर्तमान क्वांटम स्तर से अगले क्वांटम स्तर में प्रवेश करना पड़ता है जो बहुत ही अस्थायी इलेक्ट्रॉनिक विन्यास होगा। उल्लेखनीय है कि उत्कृष्ट गैसों के पहले जो तत्त्व आवर्त सारणी में दाईं तरफ ऊपर की ओर स्थित हैं, उनके लिए इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अत्यधिक ऋणात्मक होता है।
आयनन एन्थैल्पी की तुलना में इलेक्ट्रॉन लब्धि एन्थैल्पी के परिवर्तन का क्रम कम नियमित है। सामान्य नियम के अनुसार आवर्त सारणी के आवर्त में जब हम दाईं तरफ बढ़ते हैं, तब बढ़ते हुए परमाणु क्रमांक के साथ इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती है। आवर्त सारणी में बाईं से दाईं ओर जाने पर प्रभावी नाभिकीय आवेश में वृद्धि होती है। फलस्वरूप छोटे परमाणु में इलेक्ट्रॉन का जोड़ना सरल होता है, क्योंकि प्रविष्ट हुआ इलेक्ट्रॉन धनावेशित नाभिक के सन्निकट होगा। वर्ग में नीचे की ओर बढ़ने पर इलेक्ट्रॉन लब्धि एन्थैल्पी का मान कम ऋणात्मक होता जाता है, क्योंकि परमाणु आकार बढ़ता है तथा प्रविष्ट हुआ इलेक्ट्रॉन नाभिक से दूर होगा। इसी प्रकार की प्रवृत्ति सामान्यतया आवर्त सारणी में देखने को मिलती है। (सारणी 3.7) यहाँ पर इस तथ्य का उल्लेख करना महत्त्वपूर्ण है कि अॉक्सीजन तथा फ्लुओरीन के लिए इलेक्ट्रॉन लब्धि एन्थैल्पी का मान क्रमशः उन्हीं के वर्गों में आगे वाले तत्त्वों से कम ऋणात्मक है। इसका स्पष्टीकरण इस प्रकार है–जब अॉक्सीजन तथा फ्लुओरीन परमाणुओं में इलेक्ट्रॉन प्रवेश करते हैं, तब ग्रहण किया गया इलेक्ट्रॉन निम्न क्वांटम संख्या वाले ऊर्जा स्तर (n = 2) में प्रवेश करता है। इस प्रकार इसी क्वांटम ऊर्जा स्तर में उपस्थित इलेक्ट्रॉनों द्वारा अधिक प्रतिकर्षण होता है। क्वांटम स्तर n = 3 (S या Cl) में प्रवेश कराया गया इलेक्ट्रॉन, दिक्स्थान (space) में अधिक स्थान घेरता है। इस प्रकार इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण बहुत कम हो जाता है।
उदाहरण 3.7
P,S,Cl तथा F में से किसकी अधिकतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी तथा किसकी न्यूनतम इलेक्ट्रॉन लब्धि एन्थैल्पी होगी? व्याख्या कीजिए।
हल
आवर्त में बाईं से दाईं ओर बढ़ने पर इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक तथा वर्ग में नीचे की ओर बढ़ने पर कम ऋणात्मक होती है। 3p –कक्षक (जो बड़ा है) उसमें इलेक्ट्रॉन प्रवेश कराने की तुलना में जब
2p –कक्षक में इलेक्ट्रॉन प्रवेश कराया जाता है, तब इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अधिक होता है। अतः सर्वाधिक ऋणात्मक इलेक्ट्रॉन लंब्धि एन्थैल्पी क्लोरीन की होगी तथा सबसे कम इलेक्ट्रॉन लब्धि एन्थैल्पी फॉस्फोरस की होगी।
(च) विद्युत् ऋणात्मकता
परमाणु के रासायनिक यौगिक में सहसंयोजक आबंध के इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की योग्यता का गुणात्मक माप विद्युत् ऋणात्मकता है। आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को मापा जा सकता है, किंतु विद्युत् ऋणात्मकता मापने योग्य नहीं है। फिर भी तत्त्वों की विद्युत् ऋणात्मकता के लिए कई संख्या-सूचक पैमाने (जैसे– पॉालि्ांग पैमाना, मुलिकन ज़फे पैमाना, अलर्ड राचो पैमाना आदि) का विकास हुआ है। पॉलि्ांग पैमाना सबसे ज्यादा उपयोग में आता है। अमेरिकी वैज्ञानिक लीनियस पॉलि्ांग ने सन् 1922 में फ्लुओरीन की विद्युत् ऋणात्मकता को 4.0 आँका। इस तत्त्व की इलेक्ट्रॉनों को अपनी ओर आकर्षित करने की क्षमता सबसे अधिक है। कुछ तत्त्वों की विद्युत् ऋणात्मकता के मान सारणी 3.8 (अ) में दिएगए हैं।
इलेक्ट्रॉन ऋणात्मकता किसी दिए गए तत्त्व के लिए स्थिर नहीं हैः इसका मान इस बात पर निर्भर करता है कि यह तत्त्व किस दूसरे तत्त्व से जुड़ा है। हालाँकि यह मापने योग्य राशि नहीं है, फिर भी दो परमाणु आपस में किस प्रकार के बल से जुड़े हैं, इसकी प्रागुक्ति करने का आधार देती है, जिसके बारे में आप आगे जानेंगे।
साधारणतया विद्युत्-ऋणात्मकता आवर्त सारणी में आवर्त में बाईं से दाईं तरफ (Li से F) जाने पर बढ़ती है तथा वर्ग में नीचे (F से At) जाने पर कम होती है। यह प्रवृत्ति कैसे समझाई जाए? क्या विद्युत्-ऋणात्मकता को परमाणु त्रिज्या से संबंधित माना जा सकता है, जो आवर्त में बाई से दाईं ओर जाने पर घटती है तथा वर्ग में नीचे जाने पर बढ़ती है। आवर्त में परमाणु त्रिज्या के कम होने से संयोजी इलेक्ट्रॉनों और नाभिक में आर्कषण बढ़ता है तथा विद्युत्-ऋणात्मकता बढ़ती है। इसी आधार पर जब हम वर्ग में नीचे जाते हैं, तो जैसे-जैसे परमाणु त्रिज्या बढ़ती है, वैसे-वैसे विद्युत्-ऋणात्मकता कम होती जाती है। यह प्रवृत्ति आयनन एन्थैल्पी के समान है।
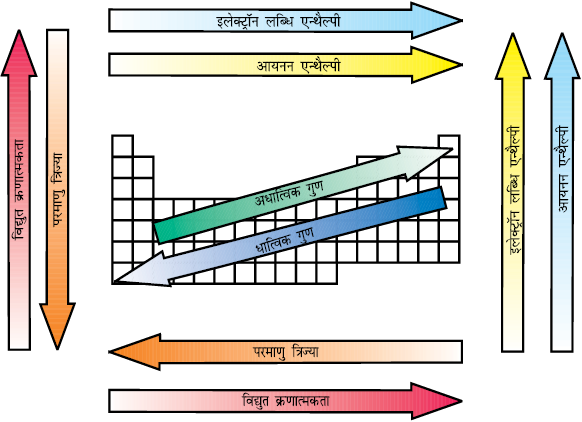
चित्र 3.7 आवर्त सारणी में तत्त्वों की आवर्त प्रवृत्ति
सारणी 3.8 (क) विद्युत्-ऋणात्मकता का मान (पॉलि्ांग पैमाना)
सारणी 3.8 (ख) विद्युत्-ऋणात्मकता का मान (पॉलि्ांग पैमाना)
अब आप विद्युत् ऋणात्मकता एवं परमाणु त्रिज्या का संबंध जान गए होंगे। क्या अब आप विद्युत् ऋणात्मकता और अधातुओं के बीच संबंध की कल्पना कर सकते हैं?
अधातु तत्त्वों में इलेक्ट्रॉन लब्धि की प्रबल प्रवृत्ति होती है। इसीलिए विद्युत्-ऋणात्मकता का सीधा संबंध अधातु तत्त्वों के गुणधर्मों से है। इस प्रकार आवर्त में तत्त्वों की विद्युत् ऋणात्मकता बढ़ने के साथ ही अधातु गुणधर्मों में वृद्धि होती है (या धातु गुणधर्मों में कमी होती है)। इसी प्रकार वर्गों में नीचे जाने पर तत्त्वों की विद्युत्-ऋणात्मकता कम होने से अधातु गुणधर्मों में कमी आती है (या धातु गुणधर्मों में वृद्धि होती है)।
इन सभी आवर्त प्रवृत्तियों को संक्षेप में चित्र 3.7 में दर्शाया है।
3.7.2 रासायनिक गुणधर्मों में आवर्त प्रवृत्ति
तत्त्वों के रासायनिक गुणधर्मों में बहुत सारी प्रवृत्तियाँ (जैसे– विकर्ण संबंध (diagonal relationship), अक्रिय युग्म प्रभाव (Inert pair effect), लैंथेनॉयड संकुचन प्रभाव (effect of lanthanoid contraction) इत्यादि पर चर्चा हम आगामी एककों में करेंगे। इस भाग में तत्त्वों की संयोजकता में आवर्तिता एवं दूसरे आवर्त में (Li से F तक) असामान्य गुणधर्मों का अध्ययन हम करेंगे।
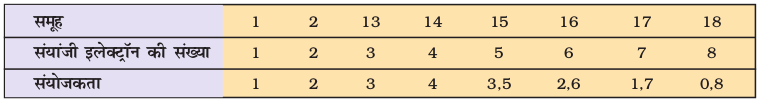
(क) संयोजकता में आवर्तिता या अॉक्सीकरण अवस्थाएँ
संयोजकता तत्त्वों का महत्त्वपूर्ण गुणधर्म है। इसे तत्त्च के इलेक्ट्रॉनिक विन्यास के आधार पर समझा जा सकता है। निरूपक तत्त्वों (Representative Elements) की संयोजकता सामान्यतया (हालाँकि आवश्यक नहीं है) उस तत्त्व के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होती है या आठ की संख्या में से बाह्यतम इलेक्ट्रॉनों की संख्या घटाने पर जो संख्या प्राप्त होती है, वही उस तत्त्व की संयोजकता कहलाती है। संयोजकता के स्थान पर अब अॉक्सीकरण अवस्था पद का प्रयोग होता है। एेसे दो यौगिकों पर विचार करते हैं, जिनमें अॉक्सीजन है OF2 और Na2O। इन यौगिकों में तीन तत्त्व शामिल हैं, जिनकी विद्युत्-ऋणात्मकता का क्रम F>O>Na है। फ्लुओरीन का बाह्य इलेक्ट्रॉनिक विन्यास 2s22p5 है। इसका प्रत्येक परमाणु  अणु में अॉक्सीजन के एक इलेक्ट्रॉन के साथ संयोजन करता है, फ्लुओरीन की अॉक्सीकरण अवस्था -1 है, क्योंकि इस अणु में दो फ्लुओरीन परमाणु है अॉक्सीजन का बाह्य इलेक्ट्रॉनिक विन्यास 2s2 2p4 है। यह फ्लुओरीन परमाणु साथ दो इलेक्ट्रॉनों का संयोजन करता है। इसीलिए इसकी अॉक्सीकरण अवस्था +2 है।
अणु में अॉक्सीजन के एक इलेक्ट्रॉन के साथ संयोजन करता है, फ्लुओरीन की अॉक्सीकरण अवस्था -1 है, क्योंकि इस अणु में दो फ्लुओरीन परमाणु है अॉक्सीजन का बाह्य इलेक्ट्रॉनिक विन्यास 2s2 2p4 है। यह फ्लुओरीन परमाणु साथ दो इलेक्ट्रॉनों का संयोजन करता है। इसीलिए इसकी अॉक्सीकरण अवस्था +2 है। 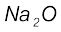 अणु में अॉक्सीजन परमाणु अधिक विद्युत् ऋणात्मक होने के कारण इलेक्ट्रॉन ग्रहण करता है तथा प्रत्येक सोडियम परमाणु एक इलेक्ट्रॉन देता है। अतः अॉक्सीजन अॉक्सीकरण अवस्था -2 को दर्शाता है। दूसरी ओर सोडियम (जिसका बाह्य इलेक्ट्रॉन विन्यास 3s1 है) एक इलेक्ट्रॉन अॉक्सीजन को देता है और इस प्रकार इसकी अॉक्सीकरण अवस्था +1 है। इलेक्ट्रॉन ऋणात्मकता का ध्यान रखते हुए एक विशेष यौगिक में तत्त्व के किसी परमाणु द्वारा अन्य परमाणु के आवेश की संख्या ग्रहण करने को उसकी ‘अॉक्सीकरण अवस्था’ कहते हैं।
अणु में अॉक्सीजन परमाणु अधिक विद्युत् ऋणात्मक होने के कारण इलेक्ट्रॉन ग्रहण करता है तथा प्रत्येक सोडियम परमाणु एक इलेक्ट्रॉन देता है। अतः अॉक्सीजन अॉक्सीकरण अवस्था -2 को दर्शाता है। दूसरी ओर सोडियम (जिसका बाह्य इलेक्ट्रॉन विन्यास 3s1 है) एक इलेक्ट्रॉन अॉक्सीजन को देता है और इस प्रकार इसकी अॉक्सीकरण अवस्था +1 है। इलेक्ट्रॉन ऋणात्मकता का ध्यान रखते हुए एक विशेष यौगिक में तत्त्व के किसी परमाणु द्वारा अन्य परमाणु के आवेश की संख्या ग्रहण करने को उसकी ‘अॉक्सीकरण अवस्था’ कहते हैं।
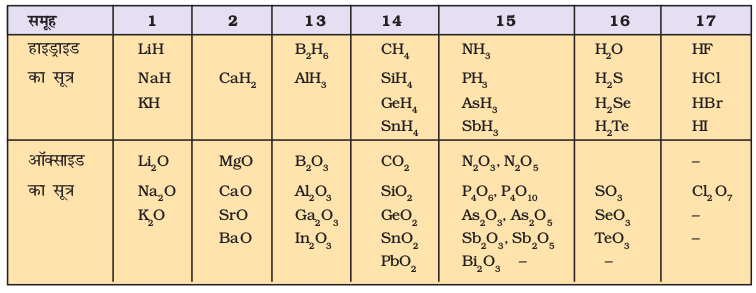
हाइड्राइड तथा अॉक्साइड में तत्त्वों की संयोजकता की आवर्त प्रवृत्ति (Periodic Trend) को सारणी 3.9 में दर्शाया गया है। तत्त्वों के रासायनिक व्यवहार में इस तरह की आवर्त प्रकृतियों को इस पुस्तक में अन्यत्र भी चर्चा की गई है। बहुत से तत्त्व एेसे भी हैं, जो परिवर्ती संयोजकता (Variable Valency) प्रदर्शित करते हैं। परिवर्ती संयोजकता संक्रमण तत्त्वों एवं एेक्टीनॉयड तत्त्वों का एक विशेष अभिलक्षण है। इसका अध्ययन हम बाद में करेंगे।
उदाहरण 3.8
आवर्त सारणी का उपयोग करते हुए, निम्नलिखित युग्मों वाले तत्त्वों के संयोग से बने यौगिकों के अणु-सूत्र की प्रागुक्ति (prediction) कीजिए– (क) सिलिकॉन एवं ब्रोमीन और (ख) एेलुमिनियम तथा सल्फर
हल
(क) सिलिकॉन आवर्त सारणी के 14वें वर्ग का तत्त्व है, जिसकी संयोजकता 4 है। ब्रोमीन, जो 17वें वर्ग (हैलोजन परिवार) का सदस्य है, की संयोजकता 1 है। अतः यौगिक का अणुसूत्र  होगा।
होगा।
(ख) आवर्त सारणी में 13वें वर्ग का तत्त्व एेलुमिनियम है, जिसकी संयोजकता 3 है। सल्फर 16वें वर्ग का तत्त्व है, जिसकी संयोजकता 2 है। अतः एेलुमिनियम तथा सल्फर से बने यौगिक का अणु सूत्र 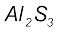 होगा।
होगा।
(ख) द्वितीय आवर्त के तत्त्वों के गुणधर्मों में असंगतता
प्रत्येक वर्ग के प्रथम तत्त्व वर्ग 1 (लीथियम), वर्ग 2 (बेरिलियम) और वर्ग 13-17 (बोरॉन से फ्लुओरीन) अपने वर्ग के अन्य सदस्यों से अनेक पहलुओं में भिन्न हैं। उदाहरणार्थ– लीथियम अन्य क्षारीय धातुओं से तथा बेरिलियम अन्य क्षारीय मृदा धातुओं से भिन्न यौगिक बनाते हैं, जिनमें निश्चित तौर पर सहसंयोजक बंध होते हैं, जबकि अन्य सदस्य प्रधानतया आयनिक यौगिक बनाते हैं। वास्तव में लीथियम तथा बेरिलियम क्रमशः अगले वर्गों के द्वितीय तत्त्व (जैसे– मैगनीशियम और एेलुमिनियम) से अधिक मिलते है। आवर्त गुणधर्मों में इस तरह की तुल्यता को ‘विकर्ण संबंध’ (Diagonal Relationship) कहते हैं।
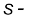 और
और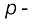 ब्लॉक के तत्त्वों के समूह में अन्य सदस्यों की तुलना में प्रथम तत्त्व के भिन्न रासायनिक व्यवहार के क्या कारण हो सकते हैं? इनका असामान्य व्यवहार इन कारणों से होता है– तत्त्वों का छोटा आकार, अधिक आवेश/त्रिज्या अनुपात तथा अधिक विद्युत्-ऋणात्मकता वर्गों के प्रथम सदस्य में सिर्फ चार संयोजक कक्षक (2s और 2p) बंध बनाने के लिए प्राप्य होते हैं, जबकि वर्गों के द्वितीय सदस्य हेतु 9 संयोजक कक्षक होते हैं (3s, 3p, 3d)। फलस्वरूप हर वर्ग के प्रथम सदस्य के लिए अधिकतम सहसंयोजकता चार है। उदाहरणार्थ– बोरान केवल [BF4]– बना सकता है, जबकि वर्ग के अन्य सदस्य अपने संयोजक कोश का विस्तार इलेक्ट्रॉनों के चार से अधिक जोड़ों को स्थान देने के लिए कर सकते हैं। उदाहरणार्थ– एेलुमिनियम [AlF6]3– बनाता है। इतना ही नहीं,
ब्लॉक के तत्त्वों के समूह में अन्य सदस्यों की तुलना में प्रथम तत्त्व के भिन्न रासायनिक व्यवहार के क्या कारण हो सकते हैं? इनका असामान्य व्यवहार इन कारणों से होता है– तत्त्वों का छोटा आकार, अधिक आवेश/त्रिज्या अनुपात तथा अधिक विद्युत्-ऋणात्मकता वर्गों के प्रथम सदस्य में सिर्फ चार संयोजक कक्षक (2s और 2p) बंध बनाने के लिए प्राप्य होते हैं, जबकि वर्गों के द्वितीय सदस्य हेतु 9 संयोजक कक्षक होते हैं (3s, 3p, 3d)। फलस्वरूप हर वर्ग के प्रथम सदस्य के लिए अधिकतम सहसंयोजकता चार है। उदाहरणार्थ– बोरान केवल [BF4]– बना सकता है, जबकि वर्ग के अन्य सदस्य अपने संयोजक कोश का विस्तार इलेक्ट्रॉनों के चार से अधिक जोड़ों को स्थान देने के लिए कर सकते हैं। उदाहरणार्थ– एेलुमिनियम [AlF6]3– बनाता है। इतना ही नहीं, 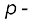 ब्लॉक के तत्त्वों में समूहों के प्रथम सदस्य स्वयं से एवम् द्वितीय आवर्त के अन्य सदस्यों से pπ– pπ बंध बनाने की प्रबल योग्यता रखते हैं (जैसे–C = C, C ≡ C, N = N, N ≡ Ν, C = N, C ≡ N), जबकि वर्गों के उत्तरवर्ती सदस्य एेसा नहीं कर पाते हैं।
ब्लॉक के तत्त्वों में समूहों के प्रथम सदस्य स्वयं से एवम् द्वितीय आवर्त के अन्य सदस्यों से pπ– pπ बंध बनाने की प्रबल योग्यता रखते हैं (जैसे–C = C, C ≡ C, N = N, N ≡ Ν, C = N, C ≡ N), जबकि वर्गों के उत्तरवर्ती सदस्य एेसा नहीं कर पाते हैं।
सारणी 3.9 यौगिकों के सूत्रों द्वारा दर्शाए गए तत्त्वों की संयोजकता में आवर्त-प्रवृत्ति
उदाहरण 3.9
क्या एेलुमिनियम के यौगिक Al [Cl(H2O)5]2+ में एेलुमिनियम की अॉक्सीकरण अवस्था (oxidation state) और सहसंयोजकता समान है?
हल
एेलुमिनियम की अॉक्सीकरण अवस्था +3 और सहसंयोजकता 6 है।
3.7.3 रासायनिक अभिक्रियाशीलता तथा आवर्तिता
हमने कुछ मौलिक गुणों (जैसे–परमाणु एवम् आयनन त्रिज्या, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी और संयोजकता) में आवर्त प्रवृत्ति का अध्ययन किया। अब तक हम यह जान गए हैं कि आवर्तिता इलेक्ट्रॉनिक विन्यास से संबंधित है। भौतिक एवं रासायनिक गुणधर्म तत्त्वों के इलेक्ट्रॉनिक विन्यास की अभिव्यक्ति है। तत्त्वों के इन मौलिक गुणों और रासायनिक गुणों में संबंध खोजने की कोशिश अब हम करेंगे।
हम जानते हैं कि आवर्त में बाईं से दाईं ओर जाने पर परमाणु एवं आयनिक त्रिज्या घटती है। फलस्वरूप आवर्त में आयनन एन्थैल्पी साधारणतया बढ़ती है (कुछ अपवादों को छोड़कर, जिसका विवरण भाग 3.7.1–क में दिया है) तथा इलेक्ट्रॉन लब्धि एन्थैल्पी और अधिक ऋणात्मक हो जाती है। आवर्त में सबसे बाईं ओर स्थित तत्त्व की आयनन एन्थैल्पी सबसे कम है और सबसे दाईं ओर के तत्त्व की इलेक्ट्रॉन लब्धि एन्थैल्पी सबसे अधिक ऋणात्मक है। (नोट– उत्कृष्ट गैसों में पूर्णतः भरे कोश होते हैं। उनकी इलेक्ट्रॉन लब्धि एंथैल्पी का मान धनात्मक होता है)। आवर्त सारणी में दोनों छोरों पर सबसे अधिक और मध्य में सबसे कम रासायनिक क्रियाशीलता होती है। इस प्रकार सबसे बाईं ओर अधिकतम रासायनिक क्रियाशीलता (क्षारीय धातुओं में) इलेक्ट्रॉन खोकर धनायन बनाकर प्रदर्शित होती है और सबसे दाईं ओर (हैलोजन परिवार) इलेक्ट्रॉन प्राप्त कर ऋणायन बनाकर प्रदर्शित होती है। इस गुण का संबंध तत्त्वों के अपचयन तथा उपचयन व्यवहार से करेंगे, जिसे आप बाद में पढ़ेंगे। तत्त्वों की धात्विक तथा अधात्विक विशेषता का इससे सीधा संबंध है। आवर्त में बाईं ओर से दाईं ओर जाने पर धात्विक गुण में कमी और अधात्विक गुण में बढ़ोतरी होती है। तत्त्वों की रासायनिक क्रियाशीलता उनकी अॉक्सीजन और हैलोजन से क्रिया कराकर प्रदर्शित की जा सकती है। यहाँ अॉक्सीजन से तत्त्वों की अभिक्रिया पर हम विचार करेंगे। आवर्त के दोनों किनारों के तत्त्व अॉक्सीजन से सरलतापूर्वक संयोग करके अॉक्साइड बनाते हैं। सबसे बाईं ओर के तत्त्वों के साधारण अॉक्साइड सबसे अधिक क्षारीय होते हैं (उदाहरणार्थ– Na2O) और जो सबसे दाईं ओर हैं, उनके अॉक्साइड सबसे अम्लीय (उदाहरणार्थ– Cl2O7) तथा मध्य के तत्त्वों के अॉक्साइड उभयधर्मी (उदाहरणार्थ– Al2O3, As2O3) या उदासीन (उदाहरणार्थ– CO, NO, N2O) होते हैं। उभयधर्मी (amphoteric) अॉक्साइड क्षारों के साथ अम्लीय और अम्लों के साथ क्षारीय व्यवहार करते हैं, जबकि उदासीन अॉक्साइड में अम्ल या क्षार का गुण नहीं होता है।
उदाहरण 3.10
जल से रासायनिक अभिक्रिया द्वारा दर्शाएं कि Na2O एक क्षारीय एवं Cl2O7 एक अम्लीय अॉक्साइड है।
हल
Na2O जल से अभिक्रिया करके प्रबल क्षार बनाता है, जबकि Cl2O7 प्रबल अम्ल बनाता है।
2Na + H2O  2NaOH
2NaOH
Cl2O7 + H2O  2HClO4
2HClO4
क्षारीय या अम्लीय गुण का परीक्षण आप लिटमस पत्र से कर सकते हैं।
निरूपक तत्त्वों की तुलना में संक्रमण धातुओं (3d श्रेणी) का आवर्त में परमाणु त्रिज्या का परिर्वतन बहुत कम है। परमाणु त्रिज्या में परिर्वतन आंतरिक संक्रमण धातुओं (4f श्रेणी) के लिए और भी कम है। आयनन एन्थैल्पी s- और
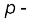 ब्लॉक के तत्त्वों के मध्य है। परिणामस्वरूप ये तत्त्व वर्ग 1 और 2 की धातुओं की तुलना में कम विद्युत्धनीय हैं।
ब्लॉक के तत्त्वों के मध्य है। परिणामस्वरूप ये तत्त्व वर्ग 1 और 2 की धातुओं की तुलना में कम विद्युत्धनीय हैं।
मुख्य वर्ग के तत्त्वों में उनके परमाणु-क्रमांक बढ़ने से सामान्यतया परमाणु तथा आयनी त्रिज्या बढ़ती है। फलतः धीरे-धारे आयनन एन्थैल्पी घटती है और इलेक्ट्रॉन लब्धि एन्थैल्पी में नियमित कमी (कुछ अपवाद तीसरे आवर्त के तत्त्वों में हैं, जिन्हें भाग 3.7.1–घ में दर्शाया गया है।) होती है। इस प्रकार वर्ग में नीचे जाने पर धात्विक गुण बढ़ता है और अधात्विक गुण घटता है। इस प्रवृत्ति को उनके उपचयन तथा अपचयन के गुण से जोड़ा जा सकता है, जिसे आप बाद में पढ़ेंगे। संक्रमण तत्त्वों की प्रवृत्ति इसके विपरीत है। इसे हम परमाणु आकार और आयनन एन्थैल्पी से समझ सकते हैं।
सारांश
इस एकक में आपने आवर्त नियम और आवर्त सारणी के विकास का अध्ययन किया है। मेंडलीव आवर्त सारणी परमाणु द्रव्यमान पर आधारित थी। आधुनिक आवर्त सारणी में तत्त्वों की व्यवस्था उनके बढ़ते हुए परमाणु क्रमांक के क्रम में सात क्षैतिज पंक्तियों (आवर्त) और 18 ऊर्ध्वाधर स्तंभों (वर्ग या परिवार) में की है। आवर्त में परमाणु क्रमांक क्रमशः बढ़ता है, जबकि वर्ग में वह एक पैटर्न से बढ़ता है। एक वर्ग के तत्त्वों में समान संयोजी कोश (Valence Shell) इलेक्ट्रॉनिक विन्यास होता है। इसीलिए ये समान रासायनिक गुणधर्मों को दर्शाते हैं। एक ही आवर्त के तत्त्वों में बाईं से दाईं ओर जाने पर इलेक्ट्रॉनों की संख्या में वृद्धि होती है। अतः इनकी संयोजकता (Valencies) भिन्न होती है। आवर्त सारणी में इलेक्ट्रॉनिक विन्यास के आधार पर चार प्रकार के तत्त्वों की पहचान की गई है। ये तत्त्व हैं– s- ब्लॉक तत्त्व, p- ब्लॉक तत्त्व, d- ब्लॉक तत्त्व तथा f- ब्लॉक तत्त्व। 1s कक्षक में एक इलेक्ट्रॉन होने के कारण आर्वत सारणी में हाइड्रोजन का स्थान अद्वितीय है। ज्ञात तत्त्वों में 78 प्रतिशत से अधिक संख्या धातुओं की है। अधातुओं की संख्या 20 प्रतिशत से कम है, जो आवर्त सारणी में दाईं ओर शीर्ष पर स्थित हैं। एेसे तत्त्व, जो धातुओं और अधातुओं के सीमावर्ती हैं, अर्ध-धातुएं (Semi metals) या उप-धातुएं (Metaloids) कहलाते हैं (जैसे– Si, Ge, As)। वर्ग में नीचे की ओर बढ़ने पर तत्त्वों के धात्विक गुणों में वृद्धि होती है। बाईं से दाईं ओर जाने पर आवर्त में धात्विक गुण में कमी आती है। तत्त्वों के भौतिक तथा रासायनिक गुण उनके परमाणु क्रमांक के साथ आवर्तित होते हैं।
तत्त्वों के परमाणु आकार, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी, विद्युत् ऋणात्मकता तथा संयोजकता में आवर्तिता की प्रवृत्ति पाई जाती है। परमाणु त्रिज्या आवर्त में बाईं ओर से दाईं ओर जाने पर घटती है और वर्ग में परमाणु-क्रमांक बढ़ने पर बढ़ती है। आयनन एन्थैल्पी प्रायः आवर्त में परमाणु-क्रमांक बढ़ने पर बढ़ती है तथा वर्ग में नीचे जाने पर घटती है। विद्युत् ऋणात्मकता की भी यही प्रवृत्ति होती है। इलेक्ट्रॉन लब्धि एन्थैल्पी साधारणतया आवर्त में दाईं ओर चलने पर और अधिक ऋणात्मक तथा वर्ग में नीचे जाने पर कम ऋणात्मक होती है। संयोजकता में भी आवर्तिता पाई जाती है। उदाहरण के तौर पर– निरूपक तत्त्वों में संयोजकता या तो बाह्यतम कक्षकों में इलेक्ट्रॉन की संख्या के बराबर अथवा आठ में से इन इलेक्ट्रॉनों की संख्या घटाकर ज्ञात की जाती है। रासायनिक क्रियाशीलता आवर्त के दोनों किनारों पर सबसे अधिक और मध्य में सबसे कम होती है। आवर्त में सबसे दाईं ओर रासायनिक अभिक्रियाशीलता इलेक्ट्रॉन को त्यागने की सुगमता (या कम आयनन एन्थैल्पी) के कारण होती है। अधिक क्रियाशील तत्त्व प्रकृति में स्वतंत्र अवस्था में नहीं मिलते। वे प्रायः यौगिकों के रूप में मिलते हैं। किसी आवर्त में बाईं ओर के तत्त्व क्षारीय अॉक्साइड बनाते हैं, जबकि दाईं ओर के तत्त्व अम्लीय अॉक्साइड बनाते हैं। जो तत्त्व मध्य में हैं, वे उभयधर्मी अॉक्साइड या उदासीन अॉक्साइड बनाते हैं।
अभ्यास
3.1 आवर्त सारणी मे व्यवस्था का भौतिक आधार क्या है?
3.2 मेंडलीव ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्त्वों के वर्गीकरण का आधार बनाया? क्या वे उसपर दृढ़ रह पाए?
3.3 मेंडलीव के आवर्त नियम और आधुनिक आवर्त नियम में मौलिक अंतर क्या है?
3.4 क्वांटम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्त्व होने चाहिए।
3.5 आवर्त और वर्ग के पदों में यह बताइए कि Z=14 कहाँ स्थित होगा?
3.6 उस तत्त्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और 17वें वर्ग में स्थित होता है।
3.7 कौन से तत्त्व का नाम निम्नलिखित द्वारा दिया गया है?
(i) लॉरेन्स बर्कले प्रयोगशाला द्वारा
(ii) सी बोर्ग समूह द्वारा
3.8 एक ही वर्ग में उपस्थित तत्त्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
3.9 ‘परमाणु त्रिज्या’ और ‘आयनी त्रिज्या’ से आप क्या समझते हैं?
3.10 किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
3.11 समइलेक्ट्रॉनिक स्पीशीज़ से आप क्या समझते हैं? एक एेसी स्पीशीज़ का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी–
(i) F–
(ii) Ar
(iii) Mg2+
(iv) Rb+
3.12 निम्नलिखित स्पीशीज़ पर विचार कीजिए–
N3–, O2–, F–, Na+, Mg2+ & Al3+
(क) इनमें क्या समानता है?
(ख) इन्हें आयनी त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
3.13 धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
3.14 आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा ‘आद्य अवस्था’ पदों की सार्थकता क्या है?
3.15 हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा –2.18 × 10–18J है। परमाणविक हाइड्रोजन की आयनन एन्थैल्पी J mol–1 के पदों में परिकलित कीजिए।
[संकेत – उत्तर प्राप्त करने के लिए मोल संकल्पना का उपयोग कीजिए।]
3.16 द्वितीय आवर्त के तत्त्वों में वास्तविक आयनन एन्थैल्पी का क्रम इस प्रकार है–Li< B<Be<C<O<N<F<Ne। व्याख्या कीजिए कि (i) Be की 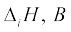 से अधिक क्यों है?
से अधिक क्यों है?
(i) O की 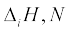 और F से कम क्यों है?
और F से कम क्यों है?
3.17 आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की प्रथम आयनन एन्थैल्पी से कम है, किंतु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है।
3.18 मुख्य समूह तत्त्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौन से कारक हैं?
3.19 वर्ग 13 के तत्त्वों की प्रथम आयनन एन्थैल्पी के मान (KJ mol–1) में इस प्रकार हैं–
B A1 Ga In T1
801 577 579 558 589
सामान्य से इस विचलन की प्रवृत्ति की व्याख्या आप किस प्रकार करेंगे?
3.20 तत्त्वों के निम्नलिखित युग्मों में किस तत्त्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
(i) O या F
(ii) F या Cl
3.21 आप क्या सोचते हैं कि O की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
3.22 इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता में क्या मूल अंतर है?
3.23 सभी नाइट्रोजन यौगिकों में N की विद्युत् ऋणात्मकता पाऊलिंग पैमाने पर 3.0 है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
3.24 उस सिद्धांत का वर्णन कीजिए, जो परमाणु की त्रिज्या से संबंधित होता है–
(i) जब वह इलेक्ट्रॉन प्राप्त करता है।
(ii) जब वह इलेक्ट्रॉन का त्याग करता है।
3.25 किसी तत्त्व के दो समस्थानिकों की प्रथम आयनन एन्थैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
3.26 धातुओं और अधातुओं में मुख्य अंतर क्या है?
3.27 आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए–
(क) उस तत्त्व का नाम बताइए, जिसके बाह्य उप-कोश में पाँच इलेक्ट्रॉन उपस्थित हों।
(ख) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
(ग) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
(घ) उस वर्ग का नाम बताइए, जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
3.28 प्रथम वर्ग के तत्त्वों के लिए अभिक्रियाशीलता का बढ़ता हुआ क्रम इस प्रकार है–
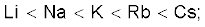 जबकि वर्ग 17 के तत्त्वों में क्रम
जबकि वर्ग 17 के तत्त्वों में क्रम
F>Cl>Br>I है। इसकी व्याख्या कीजिए।
3.29 s–, p–, d– और f– ब्लॉक के तत्त्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
3.30 तत्त्व, जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्न है, का स्थान आवर्त सारणी में बताइए–
(i) ns2 np4, जिसके लिए n=3 है।
(ii) (n–1) d2 ns2, जब n=4 है तथा
(iii) (n–2)f7 (n–1) d1 ns2, जब n=6 है।
3.31 कुछ तत्त्वों की प्रथम 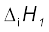 और द्वितीय
और द्वितीय 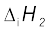 आयनन एंथैल्पी (kJ mol–1 में) और इलेक्ट्रॉन लब्धि एंथैल्पी (∆egH) (kJ mol–1 में) निम्नलिखित है–
आयनन एंथैल्पी (kJ mol–1 में) और इलेक्ट्रॉन लब्धि एंथैल्पी (∆egH) (kJ mol–1 में) निम्नलिखित है–

ऊपर दिए गए तत्त्वों में से कौन-सी
(क) सबसे कम अभिक्रियाशील धातु है?
(ख) सबसे अधिक अभिक्रियाशील धातु है?
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
(घ) सबसे कम अभिक्रियाशील अधातु है?
(ङ) एेसी धातु है, जो स्थायी द्विअंगी हैलाइड (binary halide), जिनका सूत्र
MX2 (X = हैलोजन) है, बनाता है।
(च) एेसी धातु, जो मुख्यतः MX (X = हैलोजन) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
3.32 तत्त्वों के निम्नलिखित युग्मों के संयोजन से बने स्थायी द्विअंगी यौगिकों के सूत्रों की प्रगुक्ति कीजिए–
(क) लीथियम और अॉक्सीजन
(ख) मैगनीशियम और नाइट्रोजन
(ग) एेलुमीनियम और आयोडीन
(घ) सिलिकॉन और अॉक्सीजन
(ङ) फॉस्फोरस और फ्लुओरीन
(च) 71वाँ तत्त्व और फ्लुओरीन
3.33 आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वांटम संख्या
(घ) दिगंशी क्वांटम संख्या
3.34 आधुनिक आवर्त सारणी के लिए निम्नलिखित के संदर्भ में कौन सा कथन सही नहीं है?
(क) p–ब्लॉक में 6 स्तंभ हैं, क्योंकि p–कोश के सभी कक्षक भरने के लिए अधिकतम 6
इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) d–ब्लॉक में 8 स्तंभ हैं, क्योंकि d–उप-कोश के कक्षक भरने के लिए अधिकतम 8 इलेक्ट्रॉनों
की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तंभों की संख्या उस उपकोश में भरे जा सकनेवाले इलेक्ट्रॉनों की संख्या
के बराबर होती है।
(घ) तत्त्व के इलेक्ट्रॉन विन्यास को भरते समय अंतिम भरे जानेवाले इलेक्ट्रॉन का उप-कोश उसके
द्विगंशी क्वांटम संख्या को प्रदर्शित करता है।
3.35 एेसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्त्व की रासायनिक प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौन सा कारक संयोजकता कोश को प्रभावित नहीं करता?
(क) संयोजक मुख्य क्वांटम संख्या (n)
(ख) नाभिकीय आवेश (Z)
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या
3.36 सम इलेक्ट्रॉनिक स्पीशीज़ F–, Ne और Na+ का आकार इनमें से किससे प्रभावित होता है?
(क) नाभिकीय आवेश (Z)
(ख) मुख्य क्वांटम संख्या (n)
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्य क्रिया
(घ) ऊपर दिए गए कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
3.37 आयनन एन्थैल्पी के संदर्भ में निम्नलिखित में से कौन सा कथन गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एन्थैल्पी बढ़ती है।
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है, तब आयनन एन्थैल्पी का मान अत्यधिक होता है।
(ग) आयनन एन्थैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करता है।
(घ) कम n मानवाले कक्षकों से अधिक n मानवाले कक्षकों कीे तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
3.38 B, Al, Mg, K तत्त्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें कौन सा है?
(क) 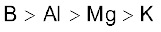
(ख) 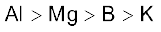
(ग) 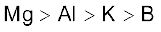
(घ) 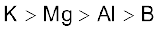
3.39 तत्त्वों B, C, N, F और Si के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौन सा है?
(क) 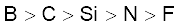
(ख) 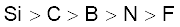
(ग) 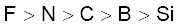
(घ) 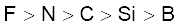
3.40 तत्त्वों F, Cl, O और N तथा अॉक्सीकरण गुणधर्मों के अधार पर उनकी रासायनिक अभिक्रियाशीलता का निम्नलिखित में से कौन सा तत्त्वों में है?
(क) 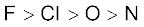
(ख) 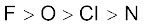
(ग) 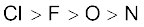
(घ)