Table of Contents
" वैज्ञानिक निरंतर नए यौगिकों की खोज कर रहे हैं, उनके तथ्यों को क्रम में व्यवस्थित कर रहे हैं, विद्यमान जानकारी के आधार पर उनकी व्याख्या की कोशिश कर रहे हैं, नए तथ्यों की व्याख्या करने के लिए प्रचलित धारणाओं को संशोधित कर रहे हैं या नए सिद्धांतों को विकसित कर रहे हैं। "
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप–
• रासायनिक आबंधन की कॉसेल लूइस अवधारणा को समझ सकेंगे;
• अष्टक नियम तथा इसकी सीमाओं की व्याख्या कर सकेंगे तथा साधारण अणुओं की लूइस संरचनाओं को लिख सकेंगे।
• विभिन्न प्रकार के आबंध बनने के कारण बता सकेंगे;
• वी. एस. ई. पी. आर सिद्धांत का विवरण दे सकेंगे तथा सरल अणुओं की ज्यामिति की प्रागुक्ति कर सकेंगे;
• सहसंयोजी आबंध के संयोजकता आबंध सिद्धांत की व्याख्या कर सकेंगे;
• सहसंयोजक आबंधों के दिशात्मक गुणों की प्रागुक्ति कर सकेंगे;
• विभिन्न प्रकार के उन संकरणों के बीच अंतर स्पष्ट कर सकेंगे, जिनमें s, p तथा d कक्षक सम्मिलित हों तथा अणुओं की आकृतियों को आरेखित कर सकेंगे;
• समनाभकीय द्विपरमाणुक अणुओं के आण्विक कक्षक सिद्धांत की व्याख्या कर सकेंगे;
• हाइड्रोजन आबंध की संकल्पना की व्याख्या कर सकेंगे।
द्रव्य एक या विभिन्न प्रकार के तत्त्वों से मिलकर बना होता है। सामान्य स्थितियों में उत्कृष्ट गैसों के अलावा कोई अन्य तत्त्व एक स्वतंत्र परमाणु के रूप में विद्यमान नहीं होता हैं। परमाणुओं के समूह विशिष्ट गुणों वाली स्पीशीज़ के रूप में विद्यमान होते हैं। परमाणुओं के एेसे समूह को ‘अणु’ कहते हैं। प्रत्यक्ष रूप में कोई बल अणुओं के घटक परमाणुओं को आपस में पकड़े रहता है। विभिन्न रासायनिक स्पीशीज़ में उनके अनेक घटकों (परमाणुओं, आयनों इत्यादि) को संलग्न रखनेवाले आकर्षण बल को ‘रासायनिक आबंध’ कहते हैं। चूँकि रासायनिक यौगिक विभिन्न तत्त्वों के परमाणुओं की भिन्न-भिन्न विधिओं से संयुक्त होने के परिणामस्वरूप बनते हैं, अतः इससे कई प्रश्न उत्पन्न होते हैं। परमाणु संयुक्त क्यों होते हैं? केवल कुछ संयोजन ही संभव क्यों हैं? क्यों कुछ परमाणु संयुक्त होते हैं, जबकि कुछ अन्य एेसा नहीं होते हैं? अणुओं की निश्चित आकृतियाँ क्यों होती हैं? इन सभी प्रश्नों के उत्तर देने के लिए समय-समय पर विभिन्न सिद्धांत सामने आए हैं। ये हैं कॉसेल-लूइस सिद्धांत, संयोजकता कक्ष इलेक्ट्रॉन युग्म प्रतिकर्षण (वी.एस.ई.पी.आर) सिद्धांत, संयोजकता आबंध सिद्धांत तथा आण्विक कक्षक सिद्धांत।
संयोजकता के विभिन्न सिद्धांताें का विकास तथा रासायनिक आबंधों की प्रकृति की व्याख्या का सीधा संबंध वास्तव में परमाणु-संरचना तत्त्वों के इलेक्ट्रॉनिक विन्यास तथा आवर्त सारणी को समझने से रहा है। प्रत्येक निकाय अधिक स्थायी होने का प्रयास करता है। यह आबंधन स्थायित्व पाने के लिए ऊर्जा को कम करने का प्राकृतिक तरीका है।
4.1 रासायनिक आबंधन की कॉसेल- लूइस अवधारणा
इलेक्ट्रॉनों द्वारा रासायनिक आबंधों के बनने की व्याख्या के लिए कई प्रयास किए गए, लेकिन सन् 1916 में कॉसेल और लुइस स्वतंत्र रूप से संतोषजनक व्याख्या देने में सफल हुए। उन्हाेंने सर्वप्रथम संयोजकता (Valence) की तर्क संगत व्याख्या की। यह व्याख्या उत्कृष्ट गैसों की अक्रियता पर आधारित थी।
लूइस परमाणुओं को एक धन आवेशित अष्टि (आंतरिक इलेक्ट्रॉन एवं नाभिकयुक्त) तथा बाह्य कक्षकों के रूप में निरूपित किया। बाह्य कक्षकों में अधिकतम आठ इलेक्ट्रॉन समाहित हो सकते हैं। उसने यह भी माना कि ये आठों इलेक्ट्रॉन घन के आठों कोनों पर उपस्थित होते हैं, जो केंद्रीय अष्टि को चारों तरफ से घेरे रहते हैं। इस प्रकार सोडियम के बाह्य कक्ष में उपस्थित एकल इलेक्ट्रॉन घन के एक कोने पर स्थित रहता है, जबकि उत्कृष्ट गैसों में घन के आठों कोनों पर एक-एक इलेक्ट्रॉन उपस्थित रहते हैं। इलेक्ट्रॉनों का यह अष्टक एक विशेष स्थायी विन्यास निरूपित करता है। लूइस ने यह अभिगृहीत दिया कि परमाणु परस्पर रासायनिक आबंध द्वारा संयुक्त होकर अपने स्थायी अष्टक को प्राप्त करते हैं। उदाहरण के लिए– सोडियम एवं क्लोरीन में सोडियम अपना एक इलेक्ट्रॉन क्लोरीन को सरलतापूर्वक देकर अपना स्थायी अष्टक प्राप्त करता है तथा क्लोरीन एक इलेक्ट्रॉन प्राप्त कर अपना स्थायी अष्टक निर्मित करता है, अर्थात् सोडियम आयन (Na+) एवं क्लोराइड आयन (Cl–) बनते हैं। अन्य उदाहरणों (जैसे- Cl2, H2, F2, इत्यादि) में परमाणुओं में आबंध परस्पर इलेक्ट्रॉनों की सहभाजन द्वारा निर्मित होते हैं। इस प्रक्रिया द्वारा इन अणुओं के परमाणु एक बाह्य स्थायी अष्टक अवस्था प्राप्त करते हैं।
लूइस प्रतीक : किसी अणु के बनने में परमाणुओं के केवल बाह्य कोश इलेक्ट्रॉन रासायनिक संयोजन में हिस्सा लेते हैं। ये इनके संयोजकता इलेकट्रॉन (Valence Electron) कहलाते हैं। आंतरिक कोश इलेक्ट्रॉन (Inner Shell Electron) अच्छी प्रकार से सुरक्षित होते हैं तथा सामान्यतः संयोजन प्रक्रिया में सम्मिलित नहीं होते हैं। एक अमेरिकी रसायनज्ञ जी.एन. लूइस ने परमाणु में संयोजकता इलेक्ट्रॉनों को निरूपित करने के लिए सरल संकेतनों को प्रस्तावित किया, जिन्हें लूइस प्रतीक (Lewis Symbol) कहा जाता है। उदाहरणार्थ– दूसरे आवर्त के तत्त्वों के ‘लूइस प्रतीक’ इस प्रकार हैं–
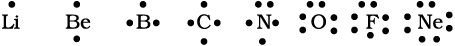
लूइस प्रतीकों का महत्त्व : प्रतीक के चारों ओर उपस्थित बिंदुओं की संख्या परमाणु के संयोजकता इलेक्ट्रॉनों की संख्या को दर्शाती है। यह संख्या तत्त्व की सामान्य अथवा समूह संयोजकता के परिकलन में सहायता देती है। तत्त्व की समूह संयोजकता या तो लूइस प्रतीक में उपस्थित बिंदुओं की संख्या के बराबर होती है या 8 में से बिंदुओं अथवा संयोजकता इलेक्ट्रॉनों की संख्या को घटाकर इसे परिकलित किया जा सकता है।
रासायनिक आबंधन के संबंध में कॉसेल ने निम्नलिखित तथ्यों की ओर ध्यान आकर्षित किया–
• आवर्त सारणी में उच्च विद्युत्-ऋणात्मकता वाले हैलोजेन तथा उच्च विद्युत्-धनात्मकता वाले क्षार धातु एक दूसरे से उत्कृष्ट गैसों द्वारा पृथक् रखे गए हैं।
• हैलोजेन परमाणुओं से ऋणायन तथा क्षार से धनायन का निर्माण संबंधित परमाणुओं द्वारा क्रमशः एक इलेक्ट्रॅान ग्रहण करने तथा एक इलेक्ट्रॅान मुक्त होने के फलस्वरूप होता है।
• इस प्रकार निर्मित ऋणायन तथा धनायन उत्कृष्ट गैस के स्थायी इलेक्ट्रॅानिक विन्यास को प्राप्त करते हैं। उत्कृष्ट गैसों में बाह्यतम कोश का आठ इलेक्ट्रॅानों वाला (अष्टक) विन्यास ns2np6, विशेष रूप से स्थायी होता है। हीलियम इसका अपवाद है, जिसके बाह्यतम कोश में केवल दो इलेक्ट्रॉन (डयूप्लेट) होते हैं।
• ऋणायन तथा धनायन स्थिर वैद्युत आकर्षण द्वारा स्थायित्व ग्रहण करते हैं।
उदाहरणार्थ– उपर्युक्त सिद्धांत के अनुसार, सोडियम तथा क्लोरीन से NaCl का बनना निम्नलिखित रूप में दर्शाया जा सकता है–
Na  Na+ + e–
Na+ + e–
[Ne] 3s1 [Ne]
Cl + e–  Cl–
Cl–
[Ne] 3s2 3p5 [Ne] 3s2 3p6 अथवा [Ar]
Na+ + Cl–  NaCl अथवा Na+Cl–
NaCl अथवा Na+Cl–
CaF2 का बनना इस प्रकार दर्शाया जा सकता है–
Ca  Ca2+ + 2e–
Ca2+ + 2e–
[Ar]4s2 [Ar]
F + e–  F–
F–
[He] 2s2 2p5 [He] 2s2 2p6 अथवा [Ne]
Ca2+ + 2F–  CaF2 अथवा Ca2+(F– )2
CaF2 अथवा Ca2+(F– )2
धनायन तथा ऋणायन के बीच आकर्षण के फलस्वरूप निर्मित आबंध को ‘वैद्युत् संयोजक आबंध’ (Electrovalent Bond) का नाम दिया गया। इस प्रकार वैद्युत संयोजकता (Electrovalency) आयन पर उपस्थित आवेश की इकाइयों की संख्या के बराबर होती है। अतः कैल्सियम की धनात्मक वैद्युत संयोजकता दो हैं, जबकि क्लोरीन की ऋणात्मक संयोजकता एक है।
इलेक्ट्रॉन स्थानांतरण द्वारा आयन का बनना तथा आयनिक क्रिस्टलीय यौगिकों के बनने के बारे में आधुनिक संकल्पनाएँ कॉसेल की अभिगृहीतों (Postulates) पर आधारित हैं। आयनिक यौगिकों के व्यवहार को समझने तथा उनको क्रमबद्ध करने में कॉसेल के विचारों से उल्लेखनीय सहायता मिली। साथ ही साथ उन्होंने इस तथ्य को भी स्वीकार किया है कि अनेक यौगिक उनकी अवधारणाओं के अनुरूप नहीं थे।
4.1.1 अष्टक् नियम (Octet Rule)
सन् 1916 में कॉसेल तथा लूइस ने परमाणुओं के बीच रासायनिक संयोजन के एक महत्त्वपूर्ण सिद्धांत को विकसित किया। इसे ‘रासायनिक आबंधन का इलेक्ट्रॉनिकी सिद्धांत’ कहा जाता है। इस सिद्धांत के अनुसार, परमाणुओं का संयोजन संयोजक इलेक्ट्रॅानों के एक परमाणु से दूसरे परमाणु पर स्थानांतरण के द्वारा अथवा संयोजक इलेक्ट्रॉनों के सहभाजन (Sharing) के द्वारा होता है। इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक प्राप्त करते हैं। इसे ‘अष्टक नियम’ कहते हैं।
4.1.2 सहसंयोजी आबंध
सन् 1919 में लैंगम्यूर ने लूइस अभिगृहीतिओं में संशोधन किया। उन्होंने स्थिर घनीय अष्टक की आवधारणा का परित्याग किया तथा ‘सहसंयोजक आबंध’ (Covalent Bond) का प्रयोग किया। लूइस-लैंगम्यूर के सिद्धांत को क्लोरीन अणु (Cl2) बनने के उदाहरण से समझा जा सकता है। क्लोरीन परमाणु का इलेक्ट्रॉनिक विन्यास [Ne]3s2 3p5 है, अर्थात् क्लोरीन परमाणु में अॉर्गन के विन्यास को प्राप्त करने के लिए एक इलेक्ट्रॉन की कमी है। Cl2 अणु के बनने को दो क्लोरीन परमाणुओं के बीच एक इलेक्ट्रॉन युग्म के सहभाजन के रूप में समझा जा सकता है। इस प्रक्रिया में दोनों क्लोरीन परमाणु सहभाजित इलेक्ट्रॉन युग्म में एक-एक इलेक्ट्रॉन का योगदान करते हैं तथा इनके बाह्य कोश करीबी उत्कृष्ट गैस, अर्थात् अॉर्गन का अष्टक विन्यास प्राप्त कर लेते हैं।

या Cl — Cl
दो क्लोरीन परमाणुओं के बीच सहसंयोजी आबंध यहाँ बिंदु इलेक्ट्रॉनों को निरूपित करते हैं। ये संरचनाएँ ‘लूइस बिंदु संरचनाएँँ’ कहलाती हैं।
अन्य अणुओं के लिए भी लूइस बिंदु संरचनाएँँ लिखी जा सकती हैं, जिनमें संयुक्त होने वाले परमाणु समान अथवा भिन्न हो सकते हैं। इसके लिए मुख्य नियम निम्नलिखित हैं–
• प्रत्येक आबंध का निर्माण परमाणुओं के मध्य एक इलेक्ट्रॉन युग्म के सहभाजन के फलस्वरूप होता है।
• संयुक्त होने वाला प्रत्येक परमाणु सहभाजित युग्म में एक-एक इलेक्ट्रॉन का योगदान देता है।
• इलेक्ट्रॉनों के सहभाजन के फलस्वरूप संयुक्त होने वाले परमाणु अपने बाह्य कोश में उत्कृष्ट गैस विन्यास प्राप्त कर लेते हैं।
इस प्रकार, जल तथा कार्बन टेट्राक्लोराइड के अणुओं में आबंधों के निर्माण को हम इस प्रकार निरूपित कर सकते हैं–
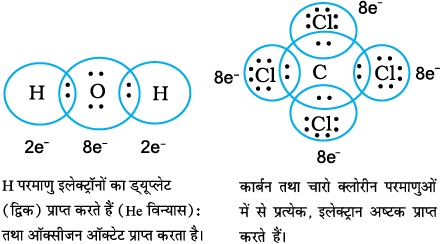
एक इलेक्ट्रॉन युग्म द्वारा संयुग्मित दो परमाणु एकल सहसंयोजी आबंध (Single Covalent Bond) द्वारा आबंधित कहलाते हैं। कई यौगिकों में परमाणुओं के बीच बहु- आबंध (Multiple Bonds) उपस्थित होते हैं। बहु-आबधों का निर्माण दो परमाणुओं के मध्य एक से अधिक इलेक्ट्रॉन युग्मों के सहभाजन के फलस्वरूप होता है। दो परमाणुओं के मध्य यदि दो इलेक्ट्रॉन युग्मों का सहभाजन होता है, तो उनके बीच का सहसंयोजी आबंध ‘द्वि-आबंध’ (Double Bond) कहलाता है। उदाहरणार्थ– कार्बन डाइ- अॉक्साइड अणु में कार्बन तथा अॉक्सीजन परमाणुओं के मध्य दो द्वि-आबंध उपस्थित होते हैं।
इसी प्रकार एथीन (Ethene) के अणु में दो कार्बन परमाणु एक द्वि-आबंध द्वारा बंधित होते हैं।


C2H4 अणु
जब संयोजी परमाणुओं के मध्य तीन इलेक्ट्रॉन युग्मों का सहभाजन होता है, जैसा N2 अणु के दो नाइट्रोजन परमाणुओं के मध्य या एथाइन में दो कार्बन परमाणुओं के मध्य है, तब उनके मध्य एक त्रि-आबंध बनता है।

N2 अणु

C2H2 अणु
4.1.3 सरल अणुओं का लूइस निरूपण (लूइस संरचाएँ)
लूइस बिंदु संरचनाओं द्वारा सहभाजित इलेक्ट्रॉन युग्मों तथा अष्टक नियम के अनुसार अणुओं एवं आयनों में आबंधन का चित्रण किया जाता है। यद्यपि यह चित्रण अणु में आबंधन तथा उसकी प्रकृति को पूर्ण रूप से स्पष्ट नहीं करता, परंतु इसके आधार पर अणु के विरचन (Formation) तथा उसके गुणों को पर्याप्त सीमा तक समझने में सहायता मिलती है। अतः अणुओं की लूइस बिंदु संरचनाएँँ अत्यंत उपयोगी होती हैं। इन्हें निम्नलिखित पदों के आधार पर लिखा जा सकता है।
• लूइस संरचना लिखने के लिए आवश्यक कुल इलेक्ट्रॉनों की संख्या संयुग्मित होने वाले परमाणुओं के संयोजकता- इलेक्ट्रॉनों के योग द्वारा प्राप्त की जाती है। उदाहरणार्थ– CH4 अणु में कुल आठ संयोजकता इलेक्ट्रॉन (4 कार्बन परमाणु से तथा 4 हाइड्रोजन के चार परमाणुओं से) उपलब्ध होते हैं।
• संयोजकता इलेक्ट्रॉनों की कुल संख्या में ऋणायनों के लिए प्रति ऋणावेश एक इलेक्ट्रॉन जोड़ दिया जाता है, जबकि धनायनों के लिए प्रति धनावेश एक इलेक्ट्रॉन घटा दिया जाता है। उदाहरणार्थ– 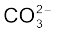 आयन के लिए कार्बन तथा अॉक्सीजन के संयोजकता-इलेक्ट्रॉनों के योग में दो इलेक्ट्रॉन जोड़ दिए जाते हैं
आयन के लिए कार्बन तथा अॉक्सीजन के संयोजकता-इलेक्ट्रॉनों के योग में दो इलेक्ट्रॉन जोड़ दिए जाते हैं 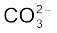 आयन पर उपस्थित दो ऋणावेश यह दर्शाते हैं कि इस आयन में उदासीन परमाणुओं द्वारा दिए गए संयोजी इलेक्ट्रॉनों से दो इलेक्ट्रॉन अधिक हैं।
आयन पर उपस्थित दो ऋणावेश यह दर्शाते हैं कि इस आयन में उदासीन परमाणुओं द्वारा दिए गए संयोजी इलेक्ट्रॉनों से दो इलेक्ट्रॉन अधिक हैं।  आयन पर उपस्थित +1 आवेश एक इलेक्ट्रॉन की हानि को दर्शाता है। अतः
आयन पर उपस्थित +1 आवेश एक इलेक्ट्रॉन की हानि को दर्शाता है। अतः  आयन के लिए उदासीन परमाणुओं द्वारा दिए गए संयोजी इलेक्ट्रॉनाें में से एक इलेक्ट्रॉन घटाया जाता है।
आयन के लिए उदासीन परमाणुओं द्वारा दिए गए संयोजी इलेक्ट्रॉनाें में से एक इलेक्ट्रॉन घटाया जाता है।
• संयुक्त होने वाले परमाणुओं के रासायनिक प्रतीकों तथा अणु की आधारभूत संरचना (Skeletal Structure), अर्थात कौन से परमाणु किन परमाणुओं के साथ आबंधित हैं– इस बात का ज्ञान होने पर परमाणुओं के बीच सभी इलेक्ट्रॉनों का वितरण आबंधित सहभाजी इलेक्ट्रॉन युग्माें के रूप में तथा संपूर्ण आबंधों की संख्या के अनुपात में सरल हो जाता है।
• सामान्यतः अणु में न्यूनतम विद्युत् ऋणात्मकता वाला परमाणु केंद्रीय परमाणु का स्थान पाता है। हाइड्रोजन तथा फ्लुओरीन के परमाणु साधारणतया अंतस्थ स्थान (Terminal Position) पाते हैं। जैसे NF3 तथा 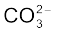 में क्रमशः नाइट्रोजन तथा कार्बन केंद्रीय परमाणु के रूप में लिखे जाएँगे।
में क्रमशः नाइट्रोजन तथा कार्बन केंद्रीय परमाणु के रूप में लिखे जाएँगे।
• एकल आबंधों के लिए सहभाजित इलेक्ट्रॉन युग्म लिखने के पश्चात् शेष इलेक्ट्रॉन युग्मों का उपयोग या तो बहु- आबंधन के लिए किया जाता है या वे एकाकी इलेक्ट्रॉन युग्मों के रूप में रहते हैं। आधारभूत आवश्यकता यह है कि प्रत्येक आबंधित परमाणु में इलेक्ट्रॉनों का अॉक्टेट (अष्टक) पूरा हो जाए। कुछ अणुओं तथा आयनों की लूइस बिंदु संरचनाओं को सारणी 4.1 में दिया गया है।
सारणी 4.1 कुछ अणुओं तथा आयनों की लुइस संरचनाएँँ
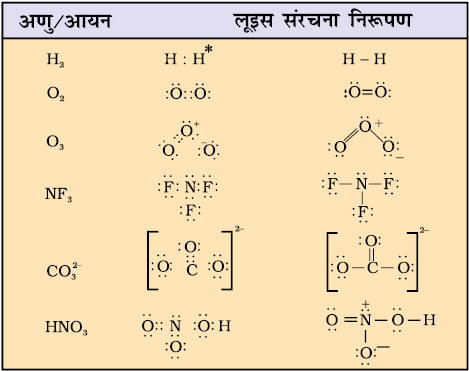
* प्रत्येक H परमाणु हीलियम का विन्यास (इलेक्ट्रॉनों का ड्यूप्लेट) प्राप्त करता है।
उदाहरण 4.1
CO के अणु की लूइस बिंदु संरचना लिखें।
हल
पद 1 ः कार्बन तथा अॉक्सीजन परमाणुओं के संयोजी इलेक्ट्रॉनों की कुल संख्या की गणना :
कार्बन तथा अॉक्सीजन परमाणुओं के बाह्य (संयोजकता) कोश के विन्यास क्रमशः 2s2 2p2 तथा 2s2 2p4 हैं।
अतः उपलब्ध संयोजकता इलेक्ट्रॉनों की संख्या
= 4 + 6 = 10
पद 2: CO की आधारभूत संरचना : CO
पद 3: C तथा O के बीच एक एकल आबंध बनाएँ (अर्थात् एक सहभाजित इलेक्ट्रॉन युग्म लिखें)
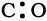
अॉक्सीजन के परमाणु पर अष्टक पूर्ण करें।
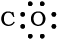
बचे हुए दो इलेक्ट्रॉन, C पर एकाकी इलेक्ट्रॉन युग्म के रूप में दर्शाएँ
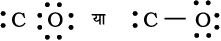
परंतु इस संरचना में कार्बन का अष्टक पूर्ण नहीं होता है। इसलिए C तथा O के नीच बहु-आबंध की आवश्यकता होती है। इन परमाणुओं के मध्य त्रि-आबंध लिखने पर दोनों परमाणुओं के लिए अष्टक नियम का पालन हो जाता है।

प्रश्न 4.2
नाइट्राइट आयन,  के लिए ‘लूइस संरचना’ लिखें।
के लिए ‘लूइस संरचना’ लिखें।
हल
पद 1 ः नाइट्रोजन तथा अॉक्सीजन परमाणुओं के संयोजकता इलेक्ट्रॉनों की संख्या–
N(2s2 2p3), O (2s2 2p4)
5 + (2 × 6) = 17
इकाई ऋणावेश के लिए एक इलेक्ट्रॉन जमा करने पर इलेक्ट्रॉनों की कुल संख्या
17 +1 = 18
पद 2: NO2– आयन की आधारमूत संरचना को हम इस प्रकार लिख सकते हैं–
O N O
पद 3: नाइट्रोजन तथा प्रत्येक अॉक्सीजन के बीच एक एक आबंध बनाने (अर्थात् एक सहभाजित इलेक्ट्रॉन युग्म लिखने) तथा अॉक्सीजन के परमाणुओं के अष्टक पूर्ण करने पर नाइट्रोजन पर उपस्थित दो इलेक्ट्रॉन एक एकाकी इलेक्ट्रॉन युग्म बनाते हैं।
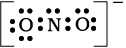
चूँकि इस प्रकार नाइट्रोजन परमाणु पर अष्टक पूर्ण नहीं होता है। इसलिए N तथा O के बीच बहु-आबंध की आवश्यकता होती है। नाइट्रोजन तथा अॉक्सीजन के किसी एक परमाणु के बीच एक द्वि-आबंध बनाने पर हमें निम्नलिखित लूइस बिंदु संरचना प्राप्त होती है–
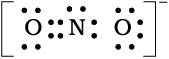
या
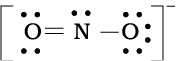 या
या 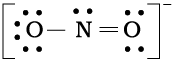
4.1.4 फॉर्मल आवेश
लूइस बिंदु संरचनाएँँ सामान्यतः अणुओं की वास्तविक आकृति नहीं दर्शाती हैं। बहु-परमाणुक आयनों में संपूर्ण आवेश किसी विशेष परमाणु पर उपस्थित न होकर पूरे आयन पर स्थित होता है। हालाँकि प्रत्येक परमाणु पर फॉर्मल आवेश दर्शाया जा सकता है। बहुपरमाणुक अणु या आयन के किसी परमाणु पर उपस्थित फॉर्मल आवेश दर्शाया जा सकता है। बहुपरमाणुक अणु या आयन के किसी परमाणु पर उपस्थित फॉर्मल आवेश को उसके विगलित (Isolated) स्थिति (अर्थात् मुक्त परमाणु अवस्था) में संयोजकता इलेक्ट्रॉनों की कुल संख्या तथा लूइस संरचना में परमाणु को प्रदत्त इलेक्ट्रॉनों की संख्या के अंतर के रूप में परिभाषित किया जा सकता है। इसे इस प्रकार अभिव्यक्त किया जाता है–
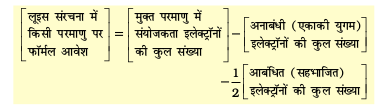
फॉर्मल आवेश का परिकलन इस अवधारणा पर आधारित है कि अणु अथवा आयन में संबंधित परमाणु पर प्रत्येक सहभाजित युग्म में से एक इलेक्ट्रॉन तथा एकाकी युग्म के दोनों इलेक्ट्रॅान उपस्थित रहते हैं।
आइए, ओज़ोन (O3) के अणु को लें। O3 की लूइस संरचना को इस प्रकार लिखा जा सकता है–
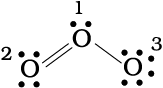
अॉक्सीजन के परमाणुओं को 1, 2 तथा 3 द्वारा चिह्नित किया गया है–
• 1 द्वारा चिह्नित केंद्रीय O परमाणु पर फॉर्मल आवेश 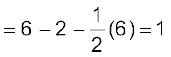
• 2 द्वारा चिह्नित अंतस्थ O परमाणु पर फॉर्मल आवेश 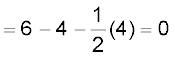
• 3 द्वारा चिह्नित अंतस्थ O परमाणु पर फॉर्मल आवेश 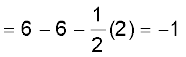
अतः O3 के अणु को फॉर्मल आवेश के साथ इस प्रकार दर्शाया जाता है–
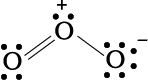
यहाँ पर ध्यान देने योग्य बात यह है कि फॉर्मल आवेश, अणु में वास्तविक आवेश पृथकन प्रकट नहीं करते हैं। लूइस- संरचना में परमाणुओं पर आवेश को दर्शाने से अणु में संयोजकता इलेक्ट्रॉनों को लेखा-जोखा रखने में सहायता मिलती है। फॉर्मल आवेश की सहायता से किसी स्पीशीज़ की कई संभव लूइस संरचनाओं में से निम्नतम ऊर्जा की संरचना का चयन करने में सहायता मिलती है। साधारणतः न्यूनतम ऊर्जा वाली संरचना वह होती है, जिसके परमाणुओं पर न्यूनतम फॉर्मल आवेश हो। फॉर्मल आवेश का सिद्धांत आबंधन की शुद्ध सहसंयोजी प्रकृति पर आधारित है, जिसमें आबंधित परमाणुओं के मध्य इलेक्ट्रॉनों का सहभाजन समान रूप से होता है।
4.1.5 अष्टक नियम की सीमाएँ
यद्यपि अष्टक नियम अत्यंत उपयोगी है, परंतु यह सदैव लागू नहीं किया जा सकता है। यह मुख्य रूप से आवर्त सारणी के द्वितीय आवर्त के तत्त्वों पर लागू होता है तथा अधिकांश कार्बनिक यौगिकों की संरचनाओं को समझने में उपयोगी होता है। अष्टक नियम के तीन प्रमुख अपवाद हैं–
केंद्रीय परमाणु का अपूर्ण अष्टक
कुछ यौगिकों में केंद्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या आठ से कम होती है। यह मुख्यतः उन तत्त्वों के यौगिकाें में होता है, जिनमें संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है। उदाहरण के लिए– LiCl, BeH2 तथा BCl3 लेते हैं।

यहाँ पर Li, Be तथा B के संयोजकता इलेक्ट्रॉनों की संख्या क्रमशः 1, 2 तथा 3 है। इस प्रकार के अन्य यौगिक AlCl3 तथा BF3 हैं।
विषम इलेक्ट्रॉन (Odd-Electron) अणु
उन अणुओं जिनमें इलेक्ट्रॉनों की कुल संख्या विषम (Odd) होती है (जैसे–नाइट्रिक अॉक्साइड, NO तथा नाइट्रोजन डाइ- अॉक्साइड, NO2), में सभी परमाणु अष्टक नियम का पालन नहीं कर पाते।

प्रसारित (Expanded) अष्टक
आवर्त सारणी के तीसरे तथा इसके आगे के आवर्तों के तत्त्वों में आबंधन के लिए 3s तथा 3p कक्षकों के अतिरिक्त 3d कक्षक भी उपलब्ध होते हैं। इन तत्त्वों के अनेक यौगिकों में केंद्रीय परमाणु के चारों ओर आठ से अधिक इलेक्ट्रॉन होते हैं। इसे प्रसारित अष्टक (Expanded Octet) कहते हैं। स्पष्ट है कि इन यौगिकों पर अष्टक नियम लागू नहीं होता है। एेसे यौगिकों के कुछ उदाहरण हैं– PF5, SF6, H2SO4 तथा कई उपसहसंयोजी यौगिक।
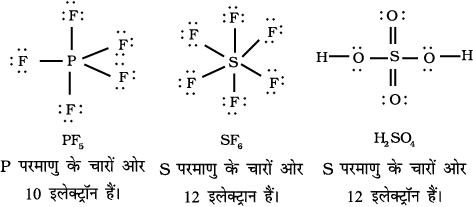
रोचक तथ्य यह है कि सल्फर परमाणु एेसे अनेक यौगिक भी बनाता है, जिनमें अष्टक नियम का पालन होता है। उदाहरणार्थ– सल्फर डाइक्लोराइड में S परमाणु के चारों ओर इलेक्ट्रॉनों का अष्टक उपस्थित होता है।

अष्टक नियम की कुछ अन्य कमियाँ
• यह स्पष्ट है कि अष्टक नियम उत्कृष्ट गैसों की रासायनिक अक्रियता पर आधारित है, परंतु कुछ उत्कृष्ट गैसें (जैसे– ज़ीनॉन तथा क्रिप्टॉन) अॉक्सीजन तथा फ्लुओरीन से भी संयोजित होती हैं तथा कई यौगिक बनाती हैं। जैसे– XeF2, KrF2, XeOF2 इत्यादि।
• अष्टक सिद्धांतअणु की आकृति स्पष्ट नहीं करता है।
• यह अणु की ऊर्जा, अर्थात् उसके सापेक्ष स्थायित्व के बारे में कुछ भी संकेत नहीं देता है।
4.2 आयनिक या वैद्युत् संयोजी आबंध
आयनिक आबंध विरचन की कॉसेल तथा लूइस अवधारणा से यह निष्कर्ष निकलता है कि इस आबंध का विरचन मुख्य रूप से निम्नलिखित तथ्यों निर्भर करेगा–
• उदासीन परमाणु से संबंधित धनायनों एवं ऋणायनों के बनने की सरलता तथा
• धनायनों एवं ऋणायनों की ठोस में व्यवस्थित होने की विधि, अर्थात् क्रिस्टलीय यौगिक का जालक (Lattice) निर्मित होने की विधि।
धनायन का बनना आयनीकरण, अर्थात् उदासीन परमाणु में से एक या एक से अधिक इलेक्ट्रॉनों के निष्कासन द्वारा संपन्न होता है। इसी प्रकार उदासीन परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने से ऋणायन प्राप्त होता है।
M(g) → M+(g) + e– ; आयनन एंथैल्पी
X(g) + e– → X – (g) ; इलेक्ट्रॉन लब्धि एंथैल्पी
M+(g) + X –(g) → MX(s)
इलेक्ट्रॉन लब्धि एंथैल्पी, ∆egH, गैस प्रावस्था में परमाणु द्वारा एक इलेक्ट्रॉन ग्रहण करने के फलस्वरूप होने वाला एंथैल्पी परिवर्तन है (एकक 3)। इलेक्ट्रॉन लब्धि प्रकिया ऊष्माशोषी अथवा उष्माक्षेपी हो सकती है। दूसरी ओर आयनन सदैव ऊष्माशोषी ही होता है। इलेक्ट्रॉन-लब्धि के फलस्वरूप होने वाले ऊर्जा-परिवर्तन का ऋणात्मक मान इलेक्ट्रॉन बंधुता (Electron Affinity) होता है।
यह स्पष्ट है कि आयनिक आबंध निम्न आयनन एंथैल्पी तथा अपेक्षाकृत निम्न इलेक्ट्रॉन लब्धि एंथैल्पी वाले तत्त्वों के बीच अधिक सरलता से बनते हैं।
अधिकांश आयनिक यौगिकों के धनायन धात्विक तत्त्वों से तथा ऋणायन अधात्विक तत्त्वों से निर्मित होते हैं। दो अधात्विक तत्त्वों से बनने वाला अमोनियम आयन एक अपवाद है। यह अनेक यौगिकों में धनायन के रूप में होता है।
आयनिक यौगिकों के क्रिस्टल में धनायन तथा ऋणायन त्रिविमीय रूप में नियमित रूप से व्यवस्थित रहते हैं। ये आयन कूलामी अन्योन्य (Coulombic Interaction) बलों द्वारा परस्पर जुड़े रहते हैं। आयनों के आकार उनके नियचन (Packing) क्रम तथा अन्य कारणों के आधार पर ये यौगिक विभिन्न क्रिस्टलीय संरचनाओं में क्रिस्टलित होते हैं। उदाहरण के लिए–सोडियम क्लोराइड, NaCl (खनिज नमक) की क्रिस्टल संरचना नीचे दर्शाई गई है।
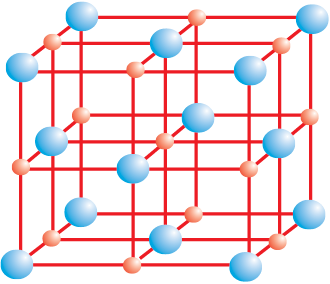
खनिज नमक संरचना
आयनिक ठोस के लिए इलेक्ट्रॉन लब्धि एन्थैल्पी तथा आयनन एन्थैल्पी का योग धनात्मक हो सकता है। एेसे में क्रिस्टल संरचना का स्थायित्व उसके जालक के बनने में उत्पन्न मुक्त ऊर्जा के कारण होता है। उदाहरण के लिए–
Na धातु से Na+ आयन के बनने की आयनन ऊर्जा 495.8 kJ mol–1 है, जबकि Cl(g) से Cl–(g) बनने की इलेक्ट्रॉन लब्धि एन्थैल्पी केवल –348.7 kJ mol–1 है। इन दोनों का मान 147.1 kJ होता है। यह परिमाण (Value) सोडियम क्लोराइड के विरचन जालक एन्थैल्पी के मान (–788 J) की अपेक्षा अधिक प्रतिपूरित होती है। इसी प्रकार संपूर्ण प्रक्रमों से प्राप्त होने वाली ऊर्जा शोषित ऊर्जा से कहीं अधिक होती है। अतः किसी आयनिक यौगिक के स्थायित्व का गुणात्मक मान उस यौगिक के विरचन जालक एन्थैल्पी के ऊपर निर्भर करती है, न कि गैसीय अवस्था में उस आयनिक स्पीशीज़ द्वारा अॉक्टेट प्राप्ति पर।
चूँकि आयनिक यौगिकों के विरचन में जालक एन्थैल्पी महत्त्वपूर्ण भूमिका निभाती है; अत: आइए, हम इस विषय में कुछ और जानकारी प्राप्त करें।
4.2.1 जालक एन्थैल्पी (जालक ऊर्जा)
किसी आयनिक ठोस के एक मोल यौगिक को गैसीय अवस्था में संघटक आयनों में पृथक करने के लिए आवश्यक ऊर्जा को उस यौगिक की ‘जालक एन्थैल्पी’ कहते है। उदाहरण के लिए– NaCl की जालक एन्थैल्पी 788 kJ mol–1 है। इसका अर्थ यह है कि एक मोल ठोस NaCl को एक मोल Na+(g) तथा एक मोल Cl–(g) में अनंत दूरी तक पृथक् करने के लिए 788 kJ ऊर्जा की आवश्यकता होती है।
इस प्रक्रिया में विपरीत आवेश वाले आयनों में आकर्षक बल तथा समान आवेश वाले आयनों में प्रतिकर्षण बल-दोनाें भाग लेते हैं। चूँकि ठोस क्रिस्टल त्रिविभीय होता है, अतः केवल आकर्षण तथा प्रतिकर्षण बलों की अन्योन्य क्रिया से ही जालक एन्थैल्पी का परिकलन करना संभव नहीं है। क्रिस्टल ज्यामिति से संबंधित कारकों को भी इसमें सम्मिलित करना आवश्यक है।
4.3 आबंध प्राचल
4.3.1 आबंध लंबाई
किसी अणु में आबंधित परमाणुओं के नाभिकों के बीच साम्यावस्था दूरी ‘आबंध लंबाई’ कहलाती है। आबंध लंबाई स्पेक्ट्रमी, एक्स-किरण विवर्तन तथा इलेक्ट्रॉन विवर्तन (Electron Diffraction) विधियों की सहायता से ज्ञात की जाती है। इन तकनीकों का अध्ययन आप उच्च कक्षाओं में करेंगे। आबंधित युग्म का प्रत्येक परमाणु आबंध-लंबाई में योगदान देता है (चित्र 4.1)। सहसंयोजी आबंध में प्रत्येक परमाणु का योगदान उस परमाणु की ‘सहसंयोजी त्रिज्या’ कहलाती है।
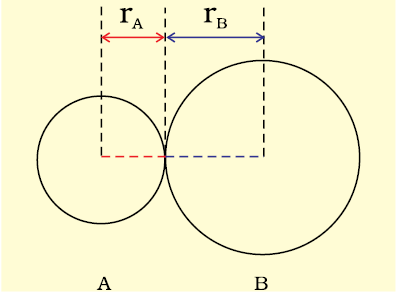
आबंधित अवस्था में किसी परमाणु के क्रोड, जो संलग्न परमाणु के क्रोड के संपर्क में होता है, की त्रिज्या उसकी सहसंयोजी त्रिज्या मानी जाती है। सहसंयोजी त्रिज्या एक ही अणु में आबंधित दो समरूप परमाणुओं के बीच की दूरी का आधा भाग होती है। वांडरवाल त्रिज्या अनाबंधित अवस्था में संयोजी कोश सहित परमाणु का समग्र आकार निरूपित करती है। वांडरवाल त्रिज्या ठोस अवस्था में विभिन्न अणुओं के दो समरूप परमाणुाओं के बीच की दूरी का आधा भाग होती है। क्लोरीन अणु के लिए सहसंयोजी तथा वांडर वाल त्रिज्याओं को चित्र 4.2 में दर्शाया गया है।
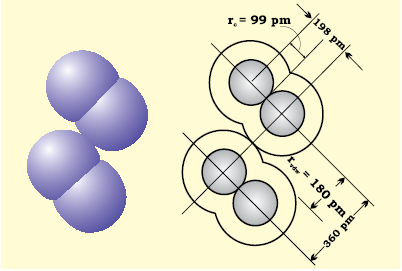
चित्र 4.2: क्लोरीन के अणु हेतु सहसंयोजी एवं वांडरवाल त्रिज्याएं। अंदर के वृत्त क्लोरीन के परमाणु का आकार इंगित करते हैं। (rvdw एवं rc क्रमशः वांडरवाल और सहसंयोजी त्रिज्याएं दर्शाते हैं)।
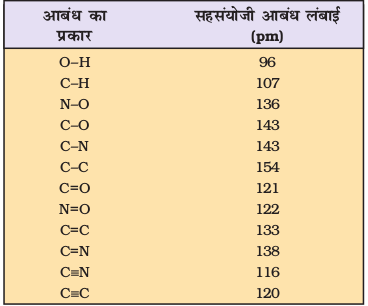
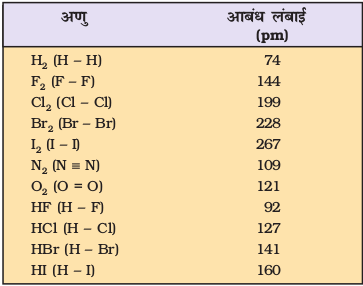
कुछ एकल, द्वि तथा त्रि आबंधों की औसत लंबाइयाँ सारणी 4.2 में दी गई हैं; कुछ सामान्य अणुओं की आबंध लंबाइयाँ सारणी 4.3 में दी गई हैं, जबकि कुछ सामान्य तत्त्वों की सहसंयोजी त्रिज्याएँ सारणी 4.4 में क्रमबद्ध की गई हैं।
4.3.2 आबंध-कोण
किसी अणु के केंद्रीय परमाणु के आसपास उपस्थित आबंधन इलेक्ट्रॉन युग्म को धारण करने वाले अॉर्बिटलों के बीच बनने वाले कोण को ‘आबंध कोण’ कहते हैं। आबंध कोण को डिग्री के रूप में व्यक्त किया जाता है तथा प्रायोगिक तौर पर स्पेक्ट्रमी विधियों द्वारा ज्ञात किया जाता है। आबंध कोण अणु के केंद्रीय परमाणु के आसपास अॉर्बिटलों के वितरण की जानकारी देता है। अतः इससे हमें अणु/जटिल आयन की आकृति को ज्ञात करने में सहायता मिलती है। जैसे–जल के अणु में H–O–H आबंध कोण को इस प्रकार निरूपित किया जाता है।
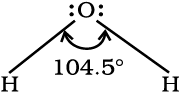
4.3.3 आबंध एन्थैल्पी
गैसीय स्थिति में दो परमाणुओं के बीच विशिष्ट आबंधों के एक मोल को तोड़ने के लिए आवश्यक ऊर्जा को ‘आबंध एन्थैल्पी’ कहते हैं। आबंध एन्थैल्पी का मात्रक kJ mol–1 होता है। उदाहरणार्थ– हाइड्रोजन के अणु में H – H आबंध की आबंध एन्थैल्पी 435.8 kJ mol–1 होती है, अर्थात्
H2(g) → H(g) + H(g); ∆aHV = 435.8 kJ mol–1
इसी प्रकार, बहुआबंधन वाले परमाणुओं (जैसे– O2 तथा N2) के लिए आबंध एन्थैल्पी होगी–
O2 (O = O) (g) → O(g) + O(g);
∆aHV = 498 kJ mol–1
N2 (N ≡ N) (g) → N(g) + N(g);
∆aHV = 946.0 kJ mol–1
यह तथ्य महत्त्वपूर्ण है कि यदि आबंध विघटन एन्थैल्पी अधिक है, तो आबंध अधिक प्रबल होगा। HCl जैसे एक विषम नाभिकीय द्विपरमाणुक अणु के लिए
HCl (g) → H(g) + Cl (g); ∆aHV = 431.0 kJ mol–1
सारणी 4.2 कुछ एकल, द्वि तथा त्रि आबंधों की औसत लंबाइयाँ
सारणी 4.3 कुछ सामान्य अणुओं की आबंध लंबाइयाँ
सारणी 4.4 सह संयोजी त्रिज्याएँ* rcov/(pm)

* दिए गए मान एकल आबंधों के लिए हैं। अन्य प्रकार के आबंधों को कोष्ठक में दर्शाया गया है। (आवर्ती प्रवृत्ति के लिए एकक 3 भी देखें।)
बहुपरमाणुक अणुओं में आबंध-सामर्थ्य का निर्धारण अधिक जटिल होता है। उदाहरणार्थ– H2O अणु में दो O – H आबंधों के विच्छेदन हेतु आवश्यक ऊर्जा समान नहीं है।
H2O(g) → H(g) + OH(g); ∆aH1V = 502 kJ mol–1
OH(g) → H(g) + O(g); ∆aH2V = 427 kJ mol–1
∆HV मानों में अंतर यह दर्शाता है कि परिवर्तित रासायनिक परिस्थिति के कारण द्वितीय O – H आबंध में कुछ परिवर्तन आता है। यही कारण है कि O – H आबंध की एन्थैल्पी विभिन्न अणुओं (जैसे– C2H5OH एेथेनॉल) तथा जल में भिन्न होती है। इसीलिए बहुपरमाणुक अणुओं में माध्य अथवा औसत आबंध ऊर्जा नामक पद का प्रयोग किया जाता है। इसे प्राप्त करने के लिए कुल आबंध वियोजन एन्थैल्पी के मान को विच्छेदित आबंधों की संख्या द्वारा विभाजित किया जाता है।
उदाहरण के लिए– जल अणु में O – H आबंध की औसत आबंध एन्थैल्पी
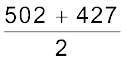 = 464.5 kJ mol–1
= 464.5 kJ mol–1
4.3.4 आबंध कोटि
सहसंयोजी आबंध की लूइस व्याख्या के अनुसार किसी अणु में दो परमाणुओं के मध्य आबंधों की संख्या आबंध कोटि (Bond Order) कहलाती है। उदाहरण के लिए– H2 (जिसमें एक सहभाजित इलेक्ट्रॉन युग्म है), O2 (जिसमें दो सहभाजित इलेक्ट्रॉन युग्म होते हैं) तथा N2 (जिसमें तीन सहभाजित इलेक्ट्रॉन युग्म होते हैं) में आबंध कोटि क्रमशः 1, 2 तथा 3 है। इसी प्रकार CO में, जहाँ पर कार्बन तथा अॉक्सीजन के बीच तीन सहभाजित युग्म हैं, आबंध कोटि 3 है। N2 की आबंध कोटि 3 है तथा इसका ∆aHV मान 946 kJ mol–1 है, जो किसी द्वि-परमाणवीय अणु के लिए सर्वाधिक है।
समइलेक्ट्रॉनी अणुओं तथा आयनों में आबंध कोटि समान होती है। उदाहरण के लिए– F2 तथा 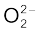 में आबंध कोटि 1 है।
में आबंध कोटि 1 है।
इसी प्रकार N2, CO तथा NO+ की आबंध कोटि 3 है। अणुओं के स्थायित्व को समझने के लिए एक उपयोगी सामान्य सहसंबंध यह है कि आबंध-कोटि बढ़ने पर आबंध एन्थैल्पी बढ़ती है, जबकि आबंध लंबाई घटती है।
4.3.5 अनुनाद संरचनाएँँ
प्रायोगिक निर्धारित प्राचलों (Parameters) के संदर्भ में किसी अणु के निरूपण के लिए एक लूइस-संरचना कई बार पर्याप्त नहीं होती है। उदाहरणार्थ– ओज़ोन अणु को निम्नलिखित संरचनाओं (I व II) द्वारा समान रूप से निरूपित किया जा सकता है–
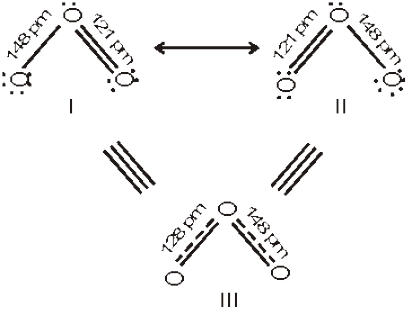
दोनों ही संरचनाओं में एक O – O एकल आबंध तथा एक O = O द्विआबंध उपस्थित हैं। O – O एकल तथा द्विआबंधों की सामान्य आबंध लंबाइयाँ क्रमशः 148 pm तथा 121 pm है। प्रयोग द्वारा ज्ञात होता है कि O3 अणु में दोनों O – O आबंधों की लंबाई एक समान 128 pm होती है। अतः O3 के अणु में अॉक्सीजन-अॉक्सीजन आबंध, एकल तथा द्विआबंधों का मध्यवर्ती है। अतः उपर्युक्त लूइस संरचनाओं I तथा II में से कोई भी एक संरचना O3 अणु को निरूपित नहीं कर सकती।
O3 जैसे अणुओं की वास्तविक संरचना को स्पष्ट करने के लिए अनुनाद संकल्पना (Resonance Concept) को प्रस्तावित किया गया। इस कल्पना के अनुसार जब किसी अणु को केवल एक लूइस संरचना द्वारा निरूपित नहीं किया जा सके, तो समान ऊर्जा, नाभिकों की समान स्थितियों तथा समान आबंधी एवं अनाबंधी इलेक्ट्रॉन युग्मों वाली कई संरचनाएँँ विहित (Canonical) संरचनाओं के रूप में लिखी जाती हैं। इन विहित संरचनाओं का अनुनाद संकर (Resonance Hybrid) अणु की वास्तविक स्थिति को निरूपित करता है। अतः O3 की उपर्युक्त दो संरचनाएँँ (I व II) उसकी विहित संरचनाएँ हैं तथा उनका संकरित रूप (संरचना III) उसकी वास्तविक संरचना को निरूपित करता है। अनुनाद को दो सिरों वाले तीर द्वारा दर्शाया जाता है। कार्बोनेट आयन तथा कार्बन डाइअॉक्साइड अणु अनुनाद संरचना के दो अन्य उदाहरण हैं।
उदाहरण 4.3
CO32– आयन की संरचना की व्याख्या अनुनाद द्वारा कीजिए।
हल
कार्बन तथा अॉक्सीजन परमाणुओं के मध्य दो एकल आबंध तथा एक द्वि-आबंध वाली लूइस-संरचना कार्बोनेट आयन की वास्तविक संरचना को निरूपित करने के लिए अपर्याप्त है, क्योंकि इसके अनुसार तीन कार्बन- अॉक्सीजन आबंधों की लंबाई भिन्न होनी चाहिए। परंतु प्रायोगिक परिणामों के अनुसार कार्बाेनेट आयन के तीनों कार्बन-अॉक्सीजन आबंधों की लंबाई समान होती है। अतः कार्बाेनेट आयन की वास्तविक संरचना को निम्न- लिखित तीन विहित संरचनाओं (I, II, तथा III) के अनुनाद संकर के रूप में दर्शाया जा सकता है–
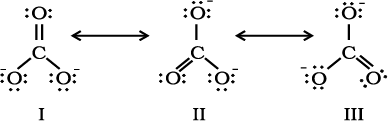
चित्र 4.4 CO32– के अणु की संरचना I, II ओर III तीन विहित संरचनाएँ
उदाहरण 4.4
CO2 अणु की संरचना की व्याख्या करें।
हल
CO2 के अणु में कार्बन-अॉक्सीजन आबंध की लंबाई का प्रायोगिक मान 115 pm है। सामान्य कार्बन- अॉक्सीजन द्वि-आबंध (C = O) तथा कार्बन-अॉक्सीजन त्रिआबंध (C ≡ O) की लंबाइयाँ क्रमशः 121 pm तथा 110 pm हैं। CO2 में कार्बन-अॉक्सीजन आबंध की लंबाई (115 pm), (C = O) तथा (C ≡ O) की सामान्य लंबाइयाें के बीच होती है। इससे यह स्पष्ट होता है कि CO2 अणु की वास्तविक संरचना को केवल एक लूइस संरचना के आधार पर प्रदर्शित नहीं किया जा सकता। अतः यह आवश्यक हो जाता है कि इसके लिए एक से अधिक लूइस संरचनाएँँ लिखी जाएँ तथा CO2 की संरचना को इन विहित संरचनाओं (I, II तथा III) के संकर के रूप में प्रदर्शित किया जाए।
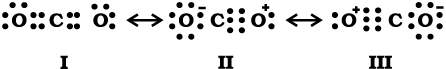
चित्र 4.5 CO2 अणु में अनुनाद संरचनाएँँ I, II, तथा III तीन विहित संरचनाओं को दर्शाते हैं।
सामान्य रूप से यह कहा जा सकता है कि
• अनुनाद अणु को स्थायित्व प्रदान करता है, क्योंकि अनुनाद संकर की ऊर्जा किसी भी विहित संरचना की ऊर्जा से कम होती है।
• अनुनाद के कारण आबंधों के लक्षण औसत मान प्राप्त करते हैं। इस प्रकार O3 अणु में अनुनाद संकर रूप III की ऊर्जा, केनानिकल रूप I तथा II की ऊर्जा के मान से भी कम होती है।
अनुनाद संकल्पना से संबंधित कई भ्राँतिया हैं, जिनका निवारण आवश्यक है। आपको स्मरण रहे कि–
• वास्तव में विहित संरचनाओं का कोई अस्तित्त्व नहीं होता है।
• एेसा नहीं होता कि अणु कुछ समय के लिए किसी विहित संरचना के रूप में उपस्थित रहता है, जबकि अन्य समय किसी दूसरी विहित संरचना को अपनाता है।
• विहित संरचनाओं में चलावयवों (कीटो तथा इनॉल) के मध्य पाए जाने वाले साम्य जैसा कोई साम्य नहीं होता है।
• वास्तविक रूप में अणु की केवल एक संरचना होती है, जो विहित संरचनाओं की अनुनाद संकर होती है। उसे केवल एक लूइस संरचना द्वारा प्रदर्शित नहीं किया जा सकता है।
4.3.6 आबंध-ध्रुवणता
किसी आबंध का सौ प्रतिशत आयनिक या सहसंयोजी होना एक आदर्श स्थिति है। परंतु वास्तव में कोई भी आबंध या यौगिक पूर्ण रूप से सहसंयोजी या आयनिक नहीं होता है। यहाँ तक कि दो हाइड्रोजन परमाणुओं के बीच बनने वाले सहसंयोजी आबंध की प्रकृति भी आंशिक रूप से आयनिक होती है।
जब सह संयोजी आबंध दो समान परमाणुओं के बीच, (जैसे– H2, O2, Cl2, N2 तथा F2) बनता है, तब संयोजी इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है। इसके परिणामस्वरूप इलेक्ट्रॉन युग्म दो समान नाभिकों के ठीक मध्य में उपस्थित होता है। इस प्रकार प्राप्त आबंध ‘अध्रुΡुवीय सहसंयोजी आबंध’ कहलाता है। इसके विपरित HF जैसे विषम परमाणुक अणु में दो परमाणुओं के बीच संयोजित इलेक्ट्रॉन युग्म फ्लुओरीन की ओर विस्थापित हो जाता है, क्योंकि फ्लुओरीन की विद्युत् ऋणात्मकता हाइड्रोजन की अपेक्षा अधिक होती है। इस प्रकार निर्मित H–F आबंध एक ध्रुवीय सहसंयोजक आबंध है।
ध्रुवण के कारण एेसे अणु में द्विध्रुव आघूर्ण (Dipole Moment) उत्पन्न हो जाता है। द्विध्रुव को आवेश के मान तथा धनात्मक और ऋणात्मक आवेशों के बीच की दूरी के गुणनफल के रूप में परिभाषित किया जाता है। इसे सामान्यतः ग्रीक शब्द ‘µ’ द्वारा दर्शाया जाता है। इसे निम्नलिखित समीकरण द्वारा व्यक्त किया जाता है–
डच रसायनज्ञ पीटर डिबाए को सन् 1936 में उनके X-किरणों के विवर्तन तथा द्विध्रुव आघूर्ण से संबंधित उनके कार्य के लिएनोबेल पुरस्कार दिया गया। उनको सम्मानित करने के लिए द्विध्रुव आघूर्ण के मान को डिबाए मात्रक में दिया जाता है।

द्विध्रुव आघूर्ण (µ) = आवेश (Q) × आवेश पृथक्करण की दूरी (r)
द्विध्रुव आघूर्ण को सामान्यतः डिबाए (Debye) मात्रक (D) के रूप में व्यक्त किया जाता है।
1D = 3.33564 × 10–30 C m
जहाँ पर C कुलॉम तथा m मीटर है।
इसके अलावा द्विध्रुव आघूर्ण एक सदिश राशि है। परंपरा के अनुसार इसे एक छोटे तीर द्वारा दर्शाया जाता है, जिसका पुच्छल सिरा ऋणात्मक केंद्र पर स्थित होता है तथा अग्र सिरा घनात्मक केंद्र की ओर उन्मुख रहता है। परंतु रसायन में द्विध्रुव आघूर्ण की उपस्थिति अणु की लूइस संरचना के उपर क्रॉस तीर  द्वारा दर्शाई जाती है। तीर का क्रॉस अणु के घनात्मक सिरे पर और शीर्ष ऋणात्मक सिरे पर होता है। उदाहरण के लिए– HF में द्विध्रुव आघूर्ण को इस प्रकार दर्शाया जा सकता है–
द्वारा दर्शाई जाती है। तीर का क्रॉस अणु के घनात्मक सिरे पर और शीर्ष ऋणात्मक सिरे पर होता है। उदाहरण के लिए– HF में द्विध्रुव आघूर्ण को इस प्रकार दर्शाया जा सकता है–

यह तीर अणु में इलेक्ट्रॉन घनत्व के बदलाव की दिशा बतलाता है। ध्यान दीजिए की क्रॉस तीर की दिशा द्विध्रुव आघूर्ण के सदिश की पारम्परिक दिशा के विपरीत है।
बहुपरमाणुक अणुओं में द्विध्रुव आघूर्ण केवल आबंधों के अपने द्विध्रुव, जिन्हें ‘आबंध आघूर्ण’ कहा जाता है, पर ही निर्भर नहीं करता, अपितु यह विभिन्न आबंधों की स्थानिक व्यवस्था पर भी निर्भर करता है। एेसे में द्विध्रुव अणु के विभिन्न आबंधों के द्विध्रुव आघूर्ण अणु के विभिन्न आबंधों के द्विध्रुव आघूर्णो का सदिश-योग (Vector sum) होता है। उदाहरण के लिए– जल के अणु, जिसकी आकृति बंकित होती है, के दो O – H आबंध 104.5° के कोण पर होते हैं। इस अणु में कुल द्विध्रुव आघूर्ण का मान 6.17 × 10–30 Cm [ID = 3.33564 × 10–30 Cm] होता है, जो दो O—H आबंधों के द्विध्रुवों के आघूर्णों के सदिश-योग से प्राप्त होता है।
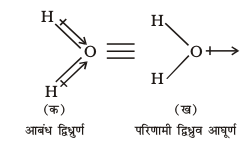
कुल द्विध्रुव आघूर्ण, µ = 1.85 D
= 1.85 × 3.33564 × 10–30 C m
= 6.17 × 10–30 C m
BeF2 के लिए द्विध्रुव आघूर्ण का मान शून्य होता है। एेसा इसलिए होता है कि इस अणु में दो समान आबंध द्विध्रुव विपरीत दिशा में होते हैं तथा एक दूसरे के प्रभाव को समाप्त (Cancel) कर देते हैं।
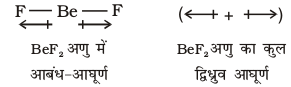
BF3 जैसे चतुष्क परमाणुवीक अणु में द्विध्रुव आघूर्ण शून्य होता है, यद्यपि इस अणु में B – F आबंध 120° के कोण पर होते हैं इस अणु में दो आबंध-आघूर्णों के समान तथा विपरीत दिशा में होता है। इसके फलस्वरूप तीनों आबंध-आघूर्णों का कुल सदिश-योग शून्य के बराबर होता है।
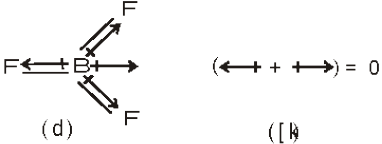
BF3 अणु (क) आबंध द्विध्रुव का निरूपण (ख) परिणामी द्विध्रुव आघूर्ण का निरूपण
आइए, NH3 तथा NF3 के अणुओं का एक रोचक उदाहरण लें। दोनों अणुओं की पिरामिडीय आकृति होती है, जिनसे नाइट्रोजन के परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है। हालाँकि फ्लुओरीन, विद्युत् ऋणात्मकता नाइट्रोजन की अपेक्षा अधिक होती है, परंतु NH3 का परिणामी द्विध्रुव आघूर्ण (4.9 × 10–30 Cm) NF3 के द्विध्रुव आघूर्ण (0.80 × 10–30 Cm) की अपेक्षा अधिक होता है। एेसा है कि NH3 में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म का कक्षक द्विध्रुव आघूर्ण तीन N – F आबंधों के द्विध्रुव-आघूर्णों के परिणामी द्विध्रुव-आघूर्ण की विपरीत दिशा में होता है। कक्षक द्विध्रूव आघूर्ण एकाकी इलेक्ट्रॉन युग्म के कारण N – F आबंध-आघूर्णों के परिणामी द्विध्रुव-आघूर्ण के प्रभाव को कम करता है। इसके फलस्वरूप NF3 के अणु का द्विध्रुव आघूर्ण कम होता है।
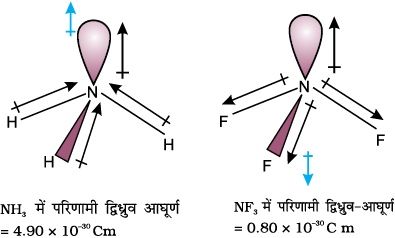
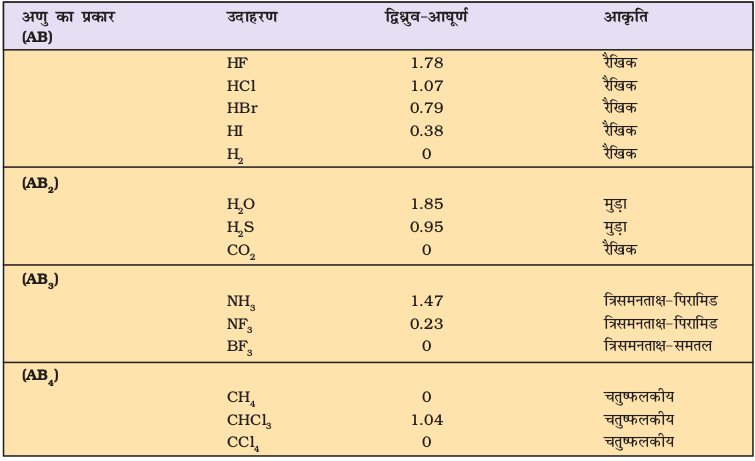
कुछ अणुओं के द्विध्रुव आघूर्णों को सारणी 4.5 में दिया गया है।
जिस प्रकार सहसंयोजी आबंध में आंशिक आयनिक लक्षण होता है, उसी प्रकार आयनिक आबंध में भी आंशिक सहसंयोजी लक्षण होता है। आयनिक आबंधों के आंशिक सहसंयोजी लक्षण की विवेचना फाजान्स (Fajans) ने निम्नलिखित नियमों के अनुसार की–
• धनायन के आकार के घटने तथा ऋणायन के आकार के बढ़ने पर आयनिक आबंध के सहसंयोजी लक्षण में वृद्धि होती है।
• धनायन तथा ऋणायन पर आवेश की मात्रा बढ़ने से आयनिक आबंध के सहसंयोजी लक्षण में वृद्धि होती है।
• समान आकार तथा आवेश के धनायनों में से उस धनायन की ध्रुवण-क्षमता अपेक्षाकृत अधिक होती है, जिसका इलेक्ट्रॉनिक विन्यास क्षार तथा क्षारीय मृदा धातुओं के धनायनों के उत्कृष्ट गैस विन्यास ns2 np6 की अपेक्षा संक्रमण धातुओं के अनुरूप (n – 1) dnnso होता है।
धनायन, ऋणायन के इलेक्ट्रॉनीय आवेश को आकर्षित कर उसे ध्रुवित करता है। फलतः उनके मध्य आवेश की मात्रा बढ़ती है। यह प्रक्रिया सहसंयोजी आबंध निर्माण के अनुरूप है, जिसमें दो नाभिकों के मध्य इलेक्ट्रॉनीय आवेश घनत्व में वृद्धि होती है। धनायन की ध्रुवण-क्षमता, ऋणायन की ध्रुवता तथा ऋणायन के ध्रुवण की मात्रा इत्यादि वे कारक हैं, जो सम्मिलित रूप से किसी आयनिक आबंध की सहसंयोजकता के प्रतिशत को निर्धारित करते हैं।
सारणी 4-5 कुछ चयनित अणुओं के द्विध्रुव-आघूर्ण
4.4 संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत
जैसा पहले बताया गया है, लूइस अवधारणा अणुओं की आकृति की व्याख्या में असमर्थ है। वी. एस. ई. पी. आर. सिद्धांत सहसंयोजी आकृति को समझने के लिए एक सरल कार्यविधि उपलब्ध कराता है। यह विधि सर्वप्रथम सन् 1940 में सिजविक तथा पॉवेल (Sidgwick and Powell) ने परमाणुओं के संयोजकता कोश में उपस्थित इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योग्य क्रियाओं के आधार पर प्रतिपादित की थी। इस विधि को नाइहोम तथा गिलेस्पी (Nyholm and Gillespie) ने सन् 1957 में और अधिक विकसित तथा संशोधित किया।
वी. एस. ई. पी. आर. सिद्धांत की मूलभूत धारणाएँ हैं–
• अणु की आकृति, केंद्रीय परमाणु के आसपास उपस्थित संयोजीकोश इलेक्ट्रॉन युग्मों (संयोजित अथवा असंयोजित) की संख्या पर निर्भर करती है।
• केंद्रीय परमाणु के संयोजकता कोश में उपस्थित इलेक्ट्रॉन युग्म एक-दूसरे को प्रतिकर्षित करते हैं, क्योंकि उनके इलेक्ट्रॉन अभ्र (Electron Cloud) पर ऋणात्मक आवेश होता है।
• ये इलेक्ट्रॉन युग्म त्रिविम में उन स्थितियों में अवस्थित होने का प्रयत्न करते हैं, जिसके फलस्वरूप उनमें प्रतिकर्षण कम से कम हो। इस स्थिति में उनके मध्य अधिकतम दूरी होती है।
• संयोजकता-कोश को एक गोले के रूप में माना जाता है तथा इलेक्ट्रॉन युग्म गोलीय (Spherical) सतह पर एक दूसरे से अधिकतम दूरी पर स्थित होते हैं।
• बहुआबंध को एक एकल इलेक्ट्रॉन युग्म के रूप में तथा इस बहुआबंध के दो या तीन इलेक्ट्रॉन युग्मों को एकल सुपर युग्म समझा जाता है।
• यदि अणु को दो या अधिक अनुनाद संरचनाओं द्वारा दर्शाया जा सके, तो इस स्थिति में वी. एस. ई. पी. आर मॉडल एेसी प्रत्येक संरचना पर लागू होता है।
इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्य क्रियाएँ निम्न- लिखित क्रम में घटती हैं–
एकाकी युग्म - एकाकी युग्म > एकाकी युग्म - आबंधी युग्म >
(lp) (lp) (lp) (lp)
> आबंधी युग्म - आबंधी युग्म
(bp) (bp)
नाईहोम तथा गिलेस्पी ने इलेक्ट्रॉनों के एकाकी युग्मों तथा आबंधी युग्मों के महत्त्वपूर्ण अंतरों की व्याख्या करते हुए वी. एस. ई. पी. आर. मॉडल में सुधार किया। एकाकी इलेक्ट्रॉन युग्म केंद्रीय परमाणु पर स्थानगत (Localised) होते हैं, जबकि प्रत्येक आबंधी युग्म दो परमणुओं के बीच सहभाजित होता है। अतः किसी अणु में आबंधी इलेक्ट्रॉन युग्म की अपेक्षा एकाकी युग्म अधिक स्थान घेरते हैं। इसके फलस्वरूप एकाकी इलेक्ट्रॉन युग्मों के बीच एकाकी युग्म-आबंधी युग्म तथा आबंधी युग्म- आबंधी युग्म की अपेक्षा अधिक प्रतिकषर्ण होता है। इन प्रतिकर्षण- प्रभावों के कारण अणु की संभावित आकृति में भिन्नता होती है तथा अणु के आबंध कोणों में भी अंतर आ जाता है।
वी. एस. ई. पी. आर. मॉडल की सहायता से अणुओं की ज्यामितीय आकृतियों का पूर्वानुमान लगाने के लिए अणुओं को दो श्रेणियों में बाँटा जाता है–
(i) वे अणु, जिनके केंद्रीय परमाणु पर कोई भी एकाकी युग्म उपस्थित नहीं होता है।
(ii) वे अणु, जिनके केंद्रीय परमाणु पर एक या एक से अधिक एकाकी युग्म उपस्थित होते हैं।
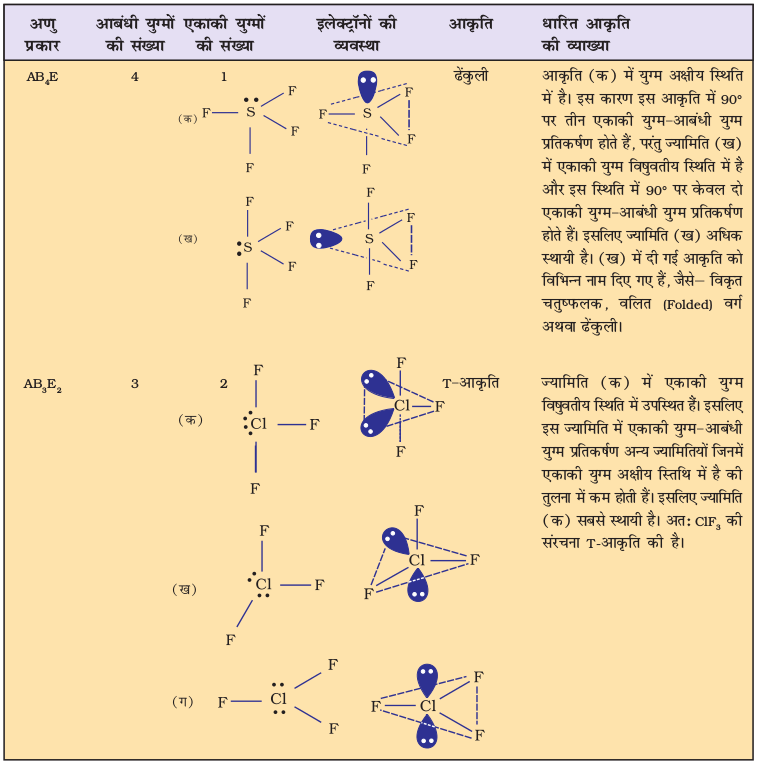
सारणी 4.6 में एकाकी युग्मरहित केंद्रीय परमाणु A के चारों ओर इलेक्ट्रॉन युग्मों की व्यवस्था तथा AB प्रकार के कुछ अणुओं अथवा आयनों की ज्यामितियाँ दर्शाई गई हैं। सारणी 4.7 में कुछ उन सरल अणुओं तथा आयनों की ज्यामिति दी गई है, जिनके केंद्रीय परमाणु पर एक या एक से अधिक एकाकी युग्म उपस्थित होते हैं। सारणी 4.8 अणुओं की ज्यामिति में विरूपण (Distortion) की व्याख्या करती है।
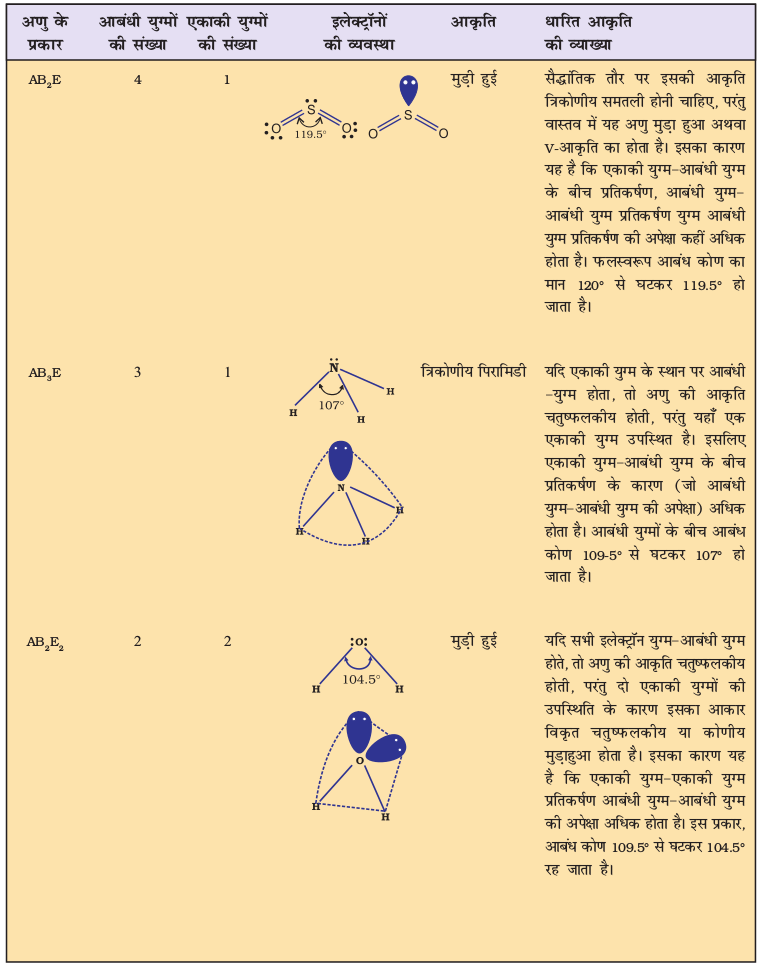
जैसा सारणी 4.6 में दर्शाया गया है, AB2, AB3, AB4, AB5, तथा AB6 प्रकार के यौगिकों के अणुओं में केंद्रीय परमाणु A की चारों ओर इलेक्ट्रॉन युग्मों तथा B परमाणुओं की व्यवस्था क्रमशः इस प्रकार है– रैखिक, त्रिकोणीय समतल, चतुष्फलकीय, त्रिफलकीय-द्विपिरामिडी तथा अष्टफलकीय। इस प्रकार की ज्यामितियाँ BF3 (AB3), CH4 (AB4) तथा PCl5 (AB5) अणुओं द्वारा दर्शाई जाती हैं। इन अणुओं की ज्यामितियों को गेंद-डंडी (Ball-stick) मॉडलों द्वारा नीचे प्रदर्शित किया गया है–
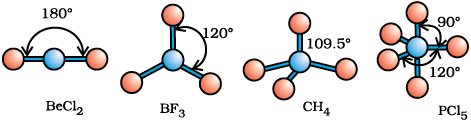
चित्र 4.8 बिना एकाकी युग्म वाले केंद्रीय परमाणु युक्त अणुओं की आकृतियाँ
सारणी 4.6 एकाकी युग्मरहित
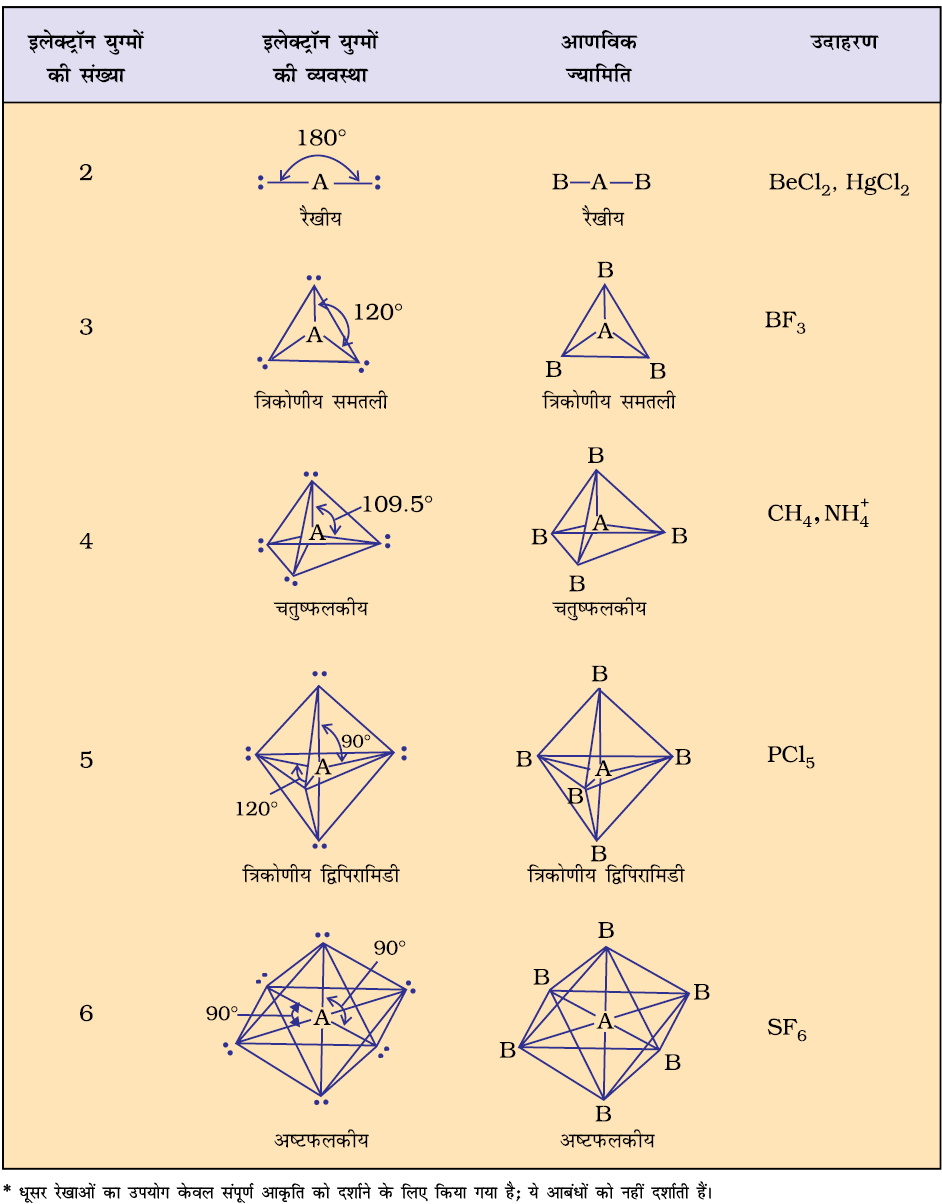
सारणी 4.7 कुछ सरल अणुओं/आयनों की आकृतियाँ (ज्यामिति), जिनके केंद्रीय परमाणु पर एक या एक से अधिक एकाकी इलेक्ट्रॉन युग्म उपस्थित हैं।
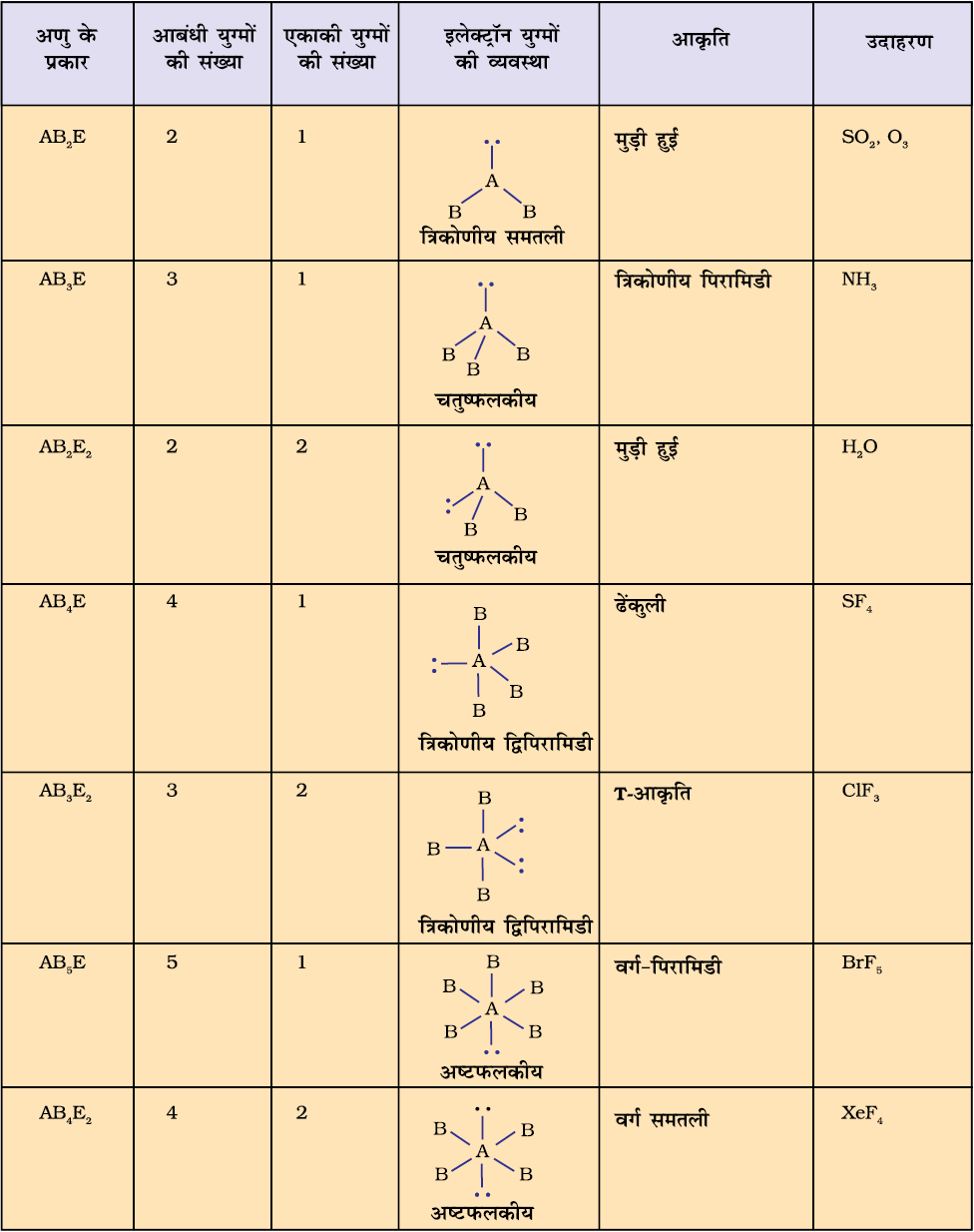
सारणी 4.8 आबंधी-युग्म तथा एकाकी युग्म वाले कुछ अणुओं की आकृति
वी. एस. ई. पी. आर. मॉडल की सहायता से अनेक अणुओं, विशेष रूप से p-ब्लाक के तत्त्वों द्वारा निर्मित यौगिकों की ज्यामितियों का पूर्वानुमान सही रूप से लगाया जा सकता है। यहाँ तक कि संभावित संरचनाओं में ऊर्जा का अंतर कम होने पर भी इसके द्वारा वास्तविक संरचना का पूर्वानुमान सफलतापूर्वक लगाया जा सकता है। आण्विक ज्यामिति पर ‘इलेक्ट्रॉन युग्म’ प्रतिकर्षण के प्रभाव के विषय में वी. एस. ई. पी. आर. मॉडल का सैद्धांतिक आधार स्पष्ट नहीं है। इस विषय में अभी भी शंकाएँ उठाई जाती हैं फलतः यह विवेचन का विषय बना हुआ है।
4.5 संयोजकता आबंध सिद्धांत
जैसा आप जानते हैं लूइस अवधारणा से अणुओं की संरचनाओं को लिखने में सहायता मिलती है, परंतु रासायनिक आबंध बनने की व्याख्या करने में यह असमर्थ है। उक्त अवधारणा यह भी स्पष्ट नहीं करती कि अणुआें की आबंध वियोजन ऊर्जाएँ (Bond Dissociation Energies) तथा आबंध लंबाइयाँ जैसे– H2 (435.8 kJ mol–1, 74 pm) और F2(150.6 kJ mol–1, 144 pm) भिन्न क्यों हैं, जबकि दोनों ही अणुओं में संबंधित परमाणुओं के बीच एक इलेक्ट्रॉन युग्म के सहभाजन के फलस्वरूप एकल सहसंयोजी आबंध बनता है। यह मॉडल बहुपरमाणुक अणुओं की आकृतियों की विभिन्नता पर भी प्रकाश नहीं डालता।
इसी प्रकार वी. एस. ई. पी. आर. सिद्धांत सरल अणुओं की आकृति के बारे में जानकारी देता है, परंतु यह उनकी व्याख्या नहीं कर सकता था। इसका उपयोग भी सीमित है। इन कमियों को दूर करने के लिए दो महत्त्वपूर्ण सिद्धांतों का प्रतिपादन किया गया है, जो क्वान्टम यांत्रिकी (Quantum Mechanical) सिद्धांत पर आधारित हैं। ये सिद्धांत है– संयोजकता आबंध सिद्धांत तथा अणु-कक्षक सिद्धांत(Molecular Orbital Theory)।
संयोजकता आबंध सिद्धांत को सर्वप्रथम हाइटलर तथा लंडन (Heitler and London) ने सन् 1927 में प्रस्तुत किया था, जिसका विकास पॉलिंग (Pauling) तथा अन्य वैज्ञानिकों ने बाद में किया। इस सिद्धांत का विवेचन परमाणु कक्षकों, तत्त्वों के इलेक्ट्रॉनिक विन्यासों (इकाई 2), परमाणु कक्षकों के अतिव्यापन और संकरण तथा विचरण (Variation) एवं अध्यारोपण (Superposition) के सिद्धांतों के ज्ञान पर आधारित है। इन सभी पहलुओं के परिपेक्ष्य में संयोजकता आबंध सिद्धांत का गूढ़ विवेचन इस पुस्तक की विषय-वस्तु से बाहर है। अतः इस सिद्धांत का वर्णन केवल गुणात्मक दृष्टि से तथा गणित का उपयोग किए बिना ही किया जाएगा। आइए, प्रारंभ में सरलतम अणु, (H2) के विरचन पर विचार करते हैं।
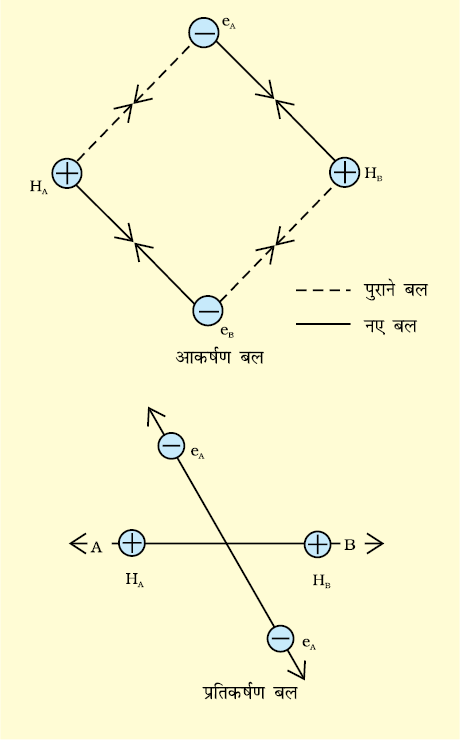
मान लीजिए कि हाइड्रोजन के दो परमाणु A व B, जिनके नाभिक क्रमशः NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉनों को eA और eB द्वारा दर्शाया गया है, एक दूसरे की ओर बढ़ते हैं। जब ये दो परमाणु एक दूसरे से अत्यधिक दूरी पर होते हैं, तब उनके बीच कोई अन्योन्य क्रिया नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे के पास आते जाते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते जाते हैं।
आकर्षण बल निम्नलिखित में उत्पन्न होते हैं–
चित्र 4.10 (क) s तथा p कक्षकों द्वारा sp संकर कक्षकों का निर्माण
(ख) BeCl2 रैखिक अणु का विरचन
(i) एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA – eA, NB – eB
(ii) एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA – eB, NB – eA
इसी प्रकार प्रतिकर्षण बल निम्नलिखित में उत्पन्न होते हैं–
(i) दो परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB तथा
(ii) दो परमाणुओं के नाभिकों के बीच NA – NB।
चित्र 4.7 H2 अणु के विरचन में आकर्षण तथा प्रतिकर्षण बल
आकर्षण बल दोनों परमाणुओं को एक-दूसरे के पास लाते हैं, जबकि प्रतिकर्षण बल उन्हें दूर करने का प्रयास करते हैं (चित्र 4.7)।
प्रायोगिक तौर पर यह पाया गया है कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान से अधिक होता है। इसके परिणाम- स्वरूप दोनों परमाणु एक-दूसरे के करीब आते हैं तथा उनकी स्थितिज ऊर्जा कम हो जाती है। अंततः एेसी स्थिति है, नेट आकर्षण बल तथा प्रतिकर्षण बल के बराबर हो जाता है और निकाय की ऊर्जा न्यून स्तर पर पहुँच जाती है। इस अवस्था में हाइड्रोजन के परमाणु ‘आबंधित’ कहलाते हैं और एक स्थायी अणु बनाते हैं, जिसकी आबंध लंबाई 74 pm होती है।
चूँकि हाइड्रोजन के दो परमाणुओं के बीच आबंध बनने पर ऊर्जा मुक्त होती है, इसलिए हाइड्रोजन अणु दो पृथक् परमाणुओं की अपेक्षा अधिक स्थायी होता है। इस प्रकार मुक्त ऊर्जा ‘आबंध एन्थैल्पी’ कहलाती है। यह चित्र 4.8 में दिए गए आरेख में न्यूनतम के संगत होती है। विलोमतः H2 के एक मोल अणुओं के वियोजन के लिए 435.8 kJ ऊर्जा की आवश्यकता होती है।
H2(g) + 435.8 kJ mol–1 → H(g) + H(g)
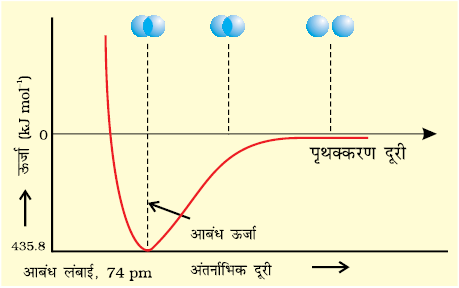
चित्र 4.8ः H2 अणु के विरचन के लिए H परमाणुओं के बीच अंतरानाभिक दूरी की सापेक्ष स्थितिज ऊर्जा का आरेख, आरेख में न्यूनतम ऊर्जा स्थिति H2 की सर्वाधिक स्थायी अवस्था दर्शाती है।
4.5.1 कक्षक अतिव्यापन अवधारणा
हाइड्रोजन अणु के विरचन में इस अवस्था में न्यूनतम ऊर्जा अवस्था प्राप्त होती है। इस अवस्था में दो परमाणु इतने करीब हो जाते हैं कि उनके परमाणु-कक्षक आंशिक रूप से अंतरभेदन ‘परमाणु-कक्षक अतिव्यापन’ कहलाता है। इसके परिणामस्वरूप इलेक्ट्रॉन संयुग्मित होते हैं। अतिव्यापन की सीमा सहसंयोजी आबंध की प्रबलता को निर्धारित करती है। सामान्यतः अधिक अतिव्यापन दो परमाणुओं के बीच प्रबल आबंध बनाने से संबंधित है। इस प्रकार, कक्षक अतिव्यापन अवधारणा के अनुसार दो परमाणुओं के बीच सहसंयोजी आबंध का बनना संयोजकता कक्ष में उपस्थित विपरीत चक्रण (Spin) वाले इलेक्ट्रॉनों के संयुग्मन के परिणामस्वरूप होता है।
4.5.2 आबंधों के दिशात्मक गुणधर्म
जैसा आप जानते हैं, सहसंयोजी आबंध परमाणु कक्षकों के अतिव्यापन से बनते हैं। उदाहरण के लिए– हाइड्रोजन का अणु बनने में इसके दो परमाणुओं के संयोजन में उनके 1s कक्षकों का अतिव्यापन होता है।
CH4, NH3 तथा H2O जैसे बहुपरमाणुक अणुओं में आबंध बनने के साथ-साथ अणु की ज्यामिति भी महत्त्वपूर्ण होती है। उदाहरण के लिए– CH4 के अणु की आकृति चतुष्फलकीय क्यों होती है और HCH आबंध कोण का मान 109°28' क्यों होता है? अथवा NH3 अणु की आकृति पिरामिडी क्यों होती है?
‘संयोजकता आबंध सिद्धांत’ के आधार पर CH4, NH3 H2O आदि बहुपरमाणुक अणुओं की आकृति, उनमें आबंध विरचन तथा उनके दिशात्मक गुणों को परमाणु कक्षकों के संकरण तथा अतिव्यापन की सहायता से स्पष्ट किया जा सकता है।
4.5.3 परमाणु कक्षकों का अतिव्यापन
जब दो परमाणु आबंध विचरण के लिए पास आते हैं, तब उनके कक्षकों का अतिव्यापन धनात्मक, ऋणात्मक या शून्य हो सकता है। यह अॉर्बिटल तरंग फलन के आयाम (amplitude) की दिक्स्थान (स्पेस) में दिशा और चिह्न (.फेज़) पर निर्भर करता है (चित्र 4.9)। सीमा- सतह आरेखों पर दर्शाए गए धनात्मक और ऋणात्मक चिह्न तरंग फलन का चिह्न (.फेज़) बतलाते हैं। इनका आवेश से कोई संबंध नहीं होता। आबंध बनाने के लिए अॉर्बिटलों का चिह्न (.फेज़) और अभिविन्यास एक समान होना चाहिए। इसे धनात्मक अतिव्यापन कहते हैं।
s तथा p परमाणु कक्षकों के धनात्मक, ऋणात्मक या शून्य अतिव्यापन की विभिन्न अवस्थाएँ, चित्र 4.9 में दर्शाई गई हैं।
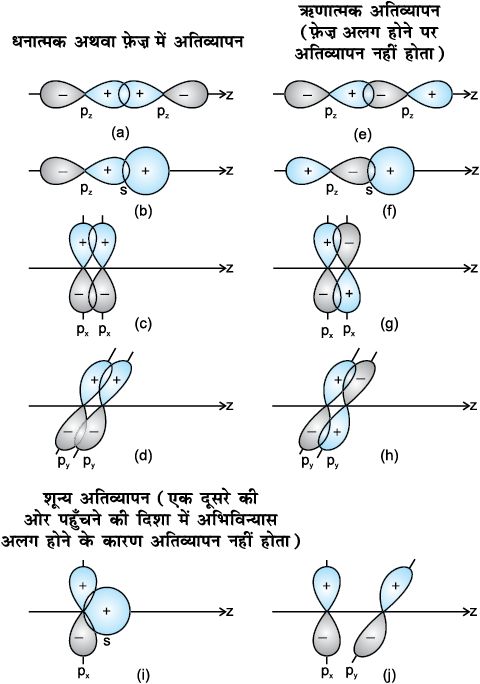
सहसंयोजी आबंध के विरचन के मुख्य कारक के रूप में अतिव्यापन की कसौटी समनाभिकीय विषमनाभिकीय द्विपरमाणुक अणुओं तथा बहुपरमाणुक अणुओं पर समान रूप से लागू होता है। हम जानते हैं कि CH4, NH3 तथा H2O अणुओं की आकृति क्रमशः चतुष्फलकीय, पिरामिडी तथा मुड़ी हुई होती है। अतः संयोजकता आबंध सिद्धांत का उपयोग करके यह जानना रोचक होगा कि क्या इन ज्यामितीय आकृतियों को कक्षक-अतिव्यापन के आधार पर स्पष्ट किया जा सकता है।
आइए, सर्वप्रथम हम मेथेन (CH4) के अणु पर विचार करते हैं। तलस्थ अवस्था (Ground State) में कार्बन का इलेक्ट्रॉन विन्यास [He] 2s2 2p2 है, जो उत्तेजित अवस्था में [He] 2s1 2px1 2py1 2pz1 हो जाता है। इसके उत्तेजन के लिए आवश्यक ऊर्जा की पूर्ति संकरित कक्षकों तथा हाइड्रोजन के बीच अतिव्यापन के फलस्वरूप मुक्त अतिरिक्त ऊर्जा से होती है। कार्बन के चार परमाणु कक्षक, जिनमें से प्रत्येक में एक अयुग्मित इलेक्ट्रॉन उपस्थित होता है, चार हाइड्रोजन परमाणुओं के एक-एक इलेक्ट्रॉनयुक्त 1s कक्षकों के साथ अतिव्यापन कर सकते हैं। परंतु इस प्रकार निर्मित चार C – H आबंध समरूप नहीं होंगे। कार्बन के तीन 2p कक्षकों के मध्य 90° का कोण होने के कारण इन कक्षकों द्वारा निर्मित आबंधों के बीच HCH कोण का माचित्र 4.15 एथीन में सिग्मा तथा π- आबंधों का बनना
न भी 90° होगा, अर्थात् तीन C – H आबंध एक-दूसरे के साथ 90° का कोण बनाएंगे। कार्बन का 2s कक्षक तथा H का 1s कक्षक गोलीय सममित का होने के कारण किसी भी दिशा में अतिव्यापन कर सकता है। अतः चौथे C – H आबंध की दिशा अनिश्चित होगी। यह निरूपण CH4 की वास्तविक आकृति से मेल नहीं खाता है, जिसमें चारों HCH कोण चतुष्फलकीय होते हैं तथा प्रत्येक का मान 109.5° होता है। इससे स्पष्ट होता है कि केवल कक्षकों के अतिव्यापन के आधार पर CH4 के आबंधों के दिशात्मक गुणों को स्पष्ट नहीं किया जा सकता है। इन्हीं तर्काें के आधार पर NH3 तथा H2O अणुओं में HNH तथा HOH कोणों के मान 90° होने चाहिए, जो वास्तविक तथ्यों के अनुरूप नहीं है। NH3 तथा H2O में वास्तविक आबंध कोण क्रमशः 107° तथा 104.5° होते हैं।
4.5.4 अतिव्यापन के प्रकार तथा सहसंयोजी आबंध की प्रकृति
कक्षकों के अतिव्यापन के प्रकार के आधार पर सहसंयोजी आबंध के दो प्रकार होते हैं–
(i) सिग्मा (σ) आबंध तथा (ii) पाई (π) आबंध
(i) सिग्मा (σ) आबंध– इस प्रकार का सहसंयोजी आबंध, आबंधी कक्षकों के अंतर्नाभिकीय अक्ष पर सिरेवार (Head on) अतिव्यापन या अक्षीय (axial) अतिव्यापन कहते हैं। इस प्रकार का आबंध, परमाणु कक्षकों के निम्नलिखित में से किसी एक प्रकार के संयोजन द्वारा प्राप्त किए जा सकते हैं–
• s–s अतिव्यापन– इस प्रकार के संयोजन में दो अर्ध-भृत (Half Filled) s-कक्षक अंतर्नाभिकीय अक्ष पर अतिव्यापन करते हैं, जैसा नीचे दिखाया गया है–

• s-p अतिव्यापन– इस प्रकार का अतिव्यापन एक परमाणु की अर्ध-भृत s-कक्षक तथा दूसरे परमाणु का अर्ध-भृत p-कक्षक के बीच होता है।

• p-p अतिव्यापन– इस प्रकार का अतिव्यापन दो परमाणुओं के अर्ध-भृत p-कक्षकों के बीच होता है।

(ii) पाई (π आबंध)– पाई आबंध के बनने के आण्विक कक्षक इस प्रकार अतिव्यापन करते हैं कि उनके अक्ष एक दूसरे के समांतर तथा अंतर्नाभिकीय कक्ष से लंबवत होते हैं। इस प्रकार पार्श्व अतिव्यापन के फलस्वरूप निर्मित कक्षक में परमाणुओं के तल के ऊपर तथा नीचे दो प्लेटनुमा आवेशित अभ्र होते हैं।
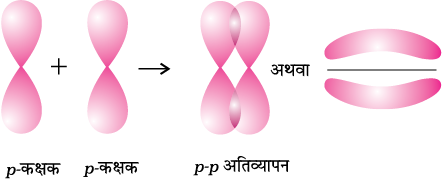
4.5.5 सिग्मा तथा पाई आबंधों की प्रबलता
मूलतः आबंध की प्रबलता अतिव्यापन की सीमा पर निर्भर करती है। सिग्मा आबंध में कक्षकों का अतिव्यापन अधिक होता है। इसलिए सिग्मा आबंध, पाई आबंध (जिसमें कम अतिव्यापन होता है) की तुलना में अधिक प्रबल होता है। इसके अलावा यह जानना भी महत्त्वपूर्ण है कि दो परमाणुओं के बीच पाई आबंध कभी अकेला नहीं पाया जाता है। यह सदैव सिग्मा आबंध के साथ ही होता है। यह सदैव उन अणुओं में पाया जाता है, जिनमें द्विआबंध या त्रिआबंध उपस्थित होते हैं।
4.6 संकरण
CH4, NH3, H2O जैसे बहुपरमाणुक अणुओं की विशिष्ट ज्यामितीय आकृतियों को स्पष्ट करने के लिए पॉलिंग ने परमाणु कक्षकों के संकरण का सिद्धांत प्रस्तावित किया। पॉलिंग के अनुसार परमाणु कक्षक संयोजित होकर समतुल्य कक्षकों का समूह बनाते हैं। इन कक्षकों को संकर कक्षक कहते हैं। आबंध विरचन में परमाणु शुद्ध कक्षकों के स्थान पर संकरित कक्षकों का प्रयोग करते हैं। इस परिघटना को हम संकरण कहते हैं। लगभग समान ऊर्जा वाले कक्षकों के आपस में मिलकर ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा तथा आकार वाले कक्षकों को बनाने की प्रक्रिया को संकरण कहते हैं। उदाहरण के लिए– कार्बन का एक 2s कक्षक तथा तीन 2p कक्षक संकरण द्वारा चार नए sp3 संकर कक्षक बनाते हैं।
संकरण के महत्त्वपूर्ण लक्षण– संकरण के मुख्य लक्षण इस प्रकार हैं–
1. संकर कक्षकों की संख्या संकरण की प्रक्रिया में भाग लेने वाले कक्षकों की संख्या के बराबर होती है।
2. संकर कक्षक सदैव समान ऊर्जा तथा आकार के होते हैं।
3. संकर कक्षक स्थायी आबंध बनाने में शुद्ध कक्षकों की अपेक्षा अधिक सक्षम होते हैं।
4. संकर कक्षक स्थायी व्यवस्था पाने के लिए त्रिविम में विशिष्ट दिशाओं में निर्देशित होते हैं। इसलिए संकरण का प्रकार अणु की ज्यामिति दर्शाता है।
संकरण की मुख्य परिस्थितियाँ
(i) परमाणु के संयोजकता कक्ष के कक्षक संकरित होते हैं।
(ii) संकरित होने वाले कक्षकों की ऊर्जा लगभग समान होनी चाहिए।
(iii) संकरण के लिए इलेक्ट्रॉन का उत्तेजन आवश्यक नहीं है।
(iv) यह आवश्यक नहीं है कि केवल अर्ध-भृत कक्षक ही संकरण में भाग लें। कभी-कभी संयोजकता कक्ष के पूर्ण-भृत तथा खाली कक्षक भी संकरित हो सकते हैं।
4.6.1 संकरण के प्रकार
s, p तथा d कक्षकों के संकरण निम्नलिखित प्रकार के होते हैं–
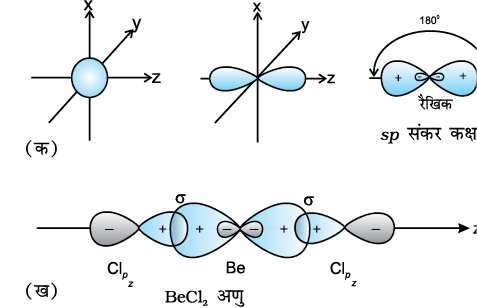
(I) sp संकरण इस प्रकार के संकरण में एक s तथा एक p कक्षक संकरित होकर दो समान sp संकर कक्षकों का निर्माण करते हैं। z-अक्ष पर संकरण कक्षकों को पाने हेतु, sp संकरण के लिए s तथा pz कक्षक उपयुक्त होते हैं। प्रत्येक sp संकर कक्षक में 50% s-लक्षण तथा 50% p-लक्षण होता है। यदि किसी अणु में केंद्रीय परमाणु के संयोजकता कक्ष के कक्षक sp संकरित होते हैं तथा दो परमाणुओं से आबंध बनाते हैं, तो अणु की रैखिक ज्यामिति होती है। इस प्रकार के संकरण को ‘विकर्ण संकरण’ भी कहते हैं।
sp संकर कक्षकों के दो उभरे हुए धन लोब (पालि) तथा अत्यंत छोटे ऋण लोब विपरीत दिशाओं में z-अक्ष की ओर दृष्ट होते हैं। इसके कारण प्रभावी अतिव्यापन होता है, जिसके फलस्वरूप प्रबलतर आबंध निर्मित होते हैं।
sp संकरण वाले अणुओं के उदाहरण
BeCl2– तलस्थ अवस्था में Be का इलेक्ट्रॉनी विन्यास 1s2 2s2 होता है। उत्तेजित अवस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में Be की द्वि-संयोजकता के कारण प्रोन्नत (Promote) हो जाता है। एक 2s कक्षक तथा एक 2p कक्षक संकरित होकर दो sp संकर कक्षक बनाते हैं। ये 180° का कोण बनाते हैं। प्रत्येक sp संकर कक्षक क्लोरीन के 2p कक्षक से अक्षीय अतिव्यापन द्वारा दो Be – Cl सिग्मा आबंध बनाते हैं। इसे चित्र 4.10 में दर्शाया गया है।
(II) sp2 संकरण– संकरण के इस प्रकार में एक s कक्षक तथा दो p कक्षक संकरित होकर तीन समान sp2 संकर कक्षकों का निर्माण करते हैं। उदाहरण के लिए– BCl3 के अणु में केंद्रीय बोरॉन परमाणु की तलस्थ अवस्था विन्यास 1s2 2s2 2p1 होता है। उत्तेजित अवस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में प्रोन्नत हो जाता है, जिसके परिणामस्वरूप बोरॉन में तीन अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं। तीन (एक 2s तथा दो 2p) कक्षक संकरित होकर तीन sp2 संकर कक्षक बनाते हैं। तीन संकर कक्षक त्रिकोणीय समतली व्यवस्था में होते हैं तथा क्लोरीन परमाणुओं के 2p कक्षकों से अतिव्यापन द्वारा तीन B – Cl आबंध बनाते हैं। इसलिए BCl3 (चित्र 4.11) अणु की त्रिकोणीय समतली ज्यामिति होती है, जिसमें Cl-B-Cl आबंध कोण 120° का होता है।
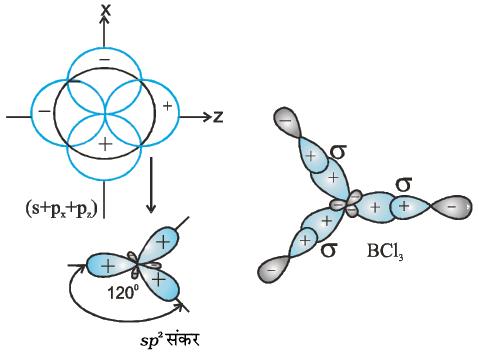
चित्र 4.11 sp2 संकर कक्षकों तथा BCl3 अणु का निर्माण
(III) sp3 संकरण– इस प्रकार के संकरण की व्याख्या CH4 अणु के उदाहरण द्वारा की जा सकती है। इसमें सहसंयोजी कक्ष के एक s कक्षक तथा p कक्षकों के संकरण से चार sp3 संकर कक्षक बनते हैं। ये कक्षक समान ऊर्जा तथा आकार के होते हैं। प्रत्येक sp3 कक्षक में 25% s-लक्षण तथा 75% p-लक्षण होता है। sp3 संकरण द्वारा प्राप्त चार sp3 संकर कक्षक चतुषफलक के चार कोनों की ओर होते हैं। जैसा चित्र 4.12 में दर्शाया गया है, sp3 संकर कक्षकों के बीच कोण का मान 109.5° होता है।
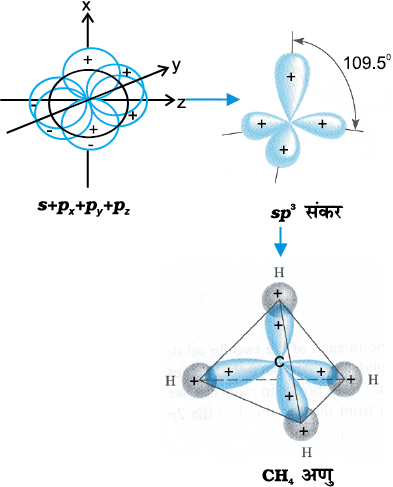
चित्र 4.12 कार्बन के s, px, py और pz परमाणु कक्षकों के सम्मिश्रण से sp3 संकर कक्षकों का निर्माण तथा CH4 का विरचन।
NH3 तथा H2O की संरचनाओं की व्याख्या भी sp3 संकरण द्वारा की जा सकती है। NH3 में नाइट्रोजन परमाणु का तलरूप अवस्था इलेक्ट्रॉनी विन्यास 2s2 2px1 2py1 2pz1 होता है। sp3 संकर कक्षकों में तीन sp3 संकर कक्षकों में अयुग्मित इलेक्ट्रॉन होता है, जबकि चौथेे sp3 संकर में एक एकांकी इलेक्ट्रॉन युग्म होता है। नाइट्रोजन के तीन sp3 संकर कक्षक तीन हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ अतिव्यापन द्वारा तीन N–H आबंध निर्मित करते हैं। हम जानते हैं कि एकांकी युग्म तथा आबंधी युग्म के बीच आबंधी युग्म की अपेक्षा प्रतिकर्षण आबंधी युग्म अधिक होता है। इसके परिणाम स्वरूप NH3 के अणु में आबंध कोण 109.5° से घटकर 107° हो जाता है। एेसे अणु की ज्यामिति विकृत होकर पिरामिडी हो जाती है, जैसा चित्र 4.13 में दर्शाया गया है।
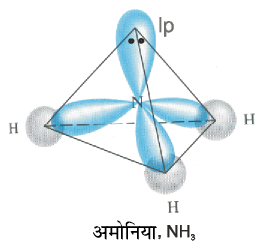
चित्र 4.13 NH3 अणु का बनना
जल के अणु में अॉक्सीजन परमाणु के चार संयोजकता कक्ष, कक्षक (एक 2s तथा तीन 2p) sp3 संकरण द्वारा चार sp3 संकर कक्षक बनाते हैं। इनमें से दो संकर कक्षकों में एक-एक युग्म होता है। ये चार sp3 संकर कक्षक चतुष्टफलकीय ज्यामिति प्राप्त करते हैं, जिसमें दो कोनों पर हाइड्रोजन परमाणु आबंधित होते हैं तथा अन्य दो कोनों पर एकांकी इलेक्ट्रॉन युग्म उपस्थित होते हैं। इस अणु में आबंध कोण 109.5° से घटकर 104.5° हो जाता है (चित्र 4.14) तथा अणु V-आकृति अथवा कोणीय ज्यामिति ग्रहण करता है।
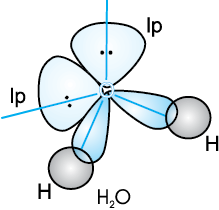
चित्र 4.14 H2O अणु का बनना
4.6.2 sp3, sp2 तथा sp संकरण के अन्य उदाहरण
C2H6 अणु में sp3 संकरण– इथेन के अणु में कार्बन के दोनों कार्बन sp3 संकरित होते हैं। कार्बन परमाणु के चार sp3 संकर कक्षकों में परमाणु से एक, अन्य कार्बन परमाणु के एक sp3 संकर कक्षक से अक्षीय अतिव्यापन द्वारा sp3 – sp3 सिग्मा आबंध बनाते हैं, जबकि प्रत्येक कार्बन परमाणु के अन्य तीन sp3 संकर कक्षक हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ sp3–s सिग्मा आबंध बनाते हैं। इसके परिणामस्वरूप इथेन में C – C आबंध लंबाई 154 pm और C–H आबंध लंबाई 109 pm होती है।
C2H4 में sp2 संकरण– एथीन अणु के बनने में कार्बन परमाणु का एक sp2 संकर कक्षक से अक्षीय अतिव्यापन द्वारा C – C सिग्मा आबंध बनाता है, जबकि प्रत्येक कार्बन परमाणु के अन्य दो sp2 संकर कक्षक हाइड्रोजन परमाणुओं के साथ sp2 – s सिग्मा आबंध बनाते हैं। एक कार्बन परमाणु का असंकरित कक्षक 2px अथवा 2py दूसरे कार्बन परमाणु के समान कक्षक के साथ पार्श्व (Sidewise) अतिव्यापन द्वारा दुर्बल π आबंध बनाता है जिसमें कार्बन तथा हाइड्रोजन परमाणुओं के तल के ऊपर तथा नीचे समान इलेक्ट्रॉन अभ्र होता है।
इस प्रकार एथीन अणु में C–C के मध्य एक sp2–sp2 संकरित कक्षकों में सिग्मा (σ) आबंध तथा एक पाई (π) आबंध (जिसकी लंबाई 134 pm होती है, जो p-कक्षकों के मध्य होता है) संकरण में प्रयोग नही होते एवं अणु के तल के लंबवत होते हैं। C–H आबंध में (sp2-s) सिग्मा (σ) आबंध की लंबाई 108 pm होती है एवं H–C–H एवं H–C–C आबंध कोण क्रमशः 117.6° 121° होता है।
एथीन अणु में सिग्मा (σ) एवं पाई (π) आबंधों का बनना चित्र 4.15 में दर्शाया गया है।
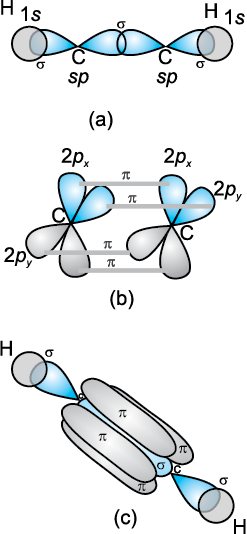
C2H2 में sp संकरण– इथाइन अणु के बनने में दोनों कार्बन परमाणु sp संकरण दर्शाते हैं। उनपर दो-दो असंकरित (2py तथा 2px) कक्षक होते हैं।
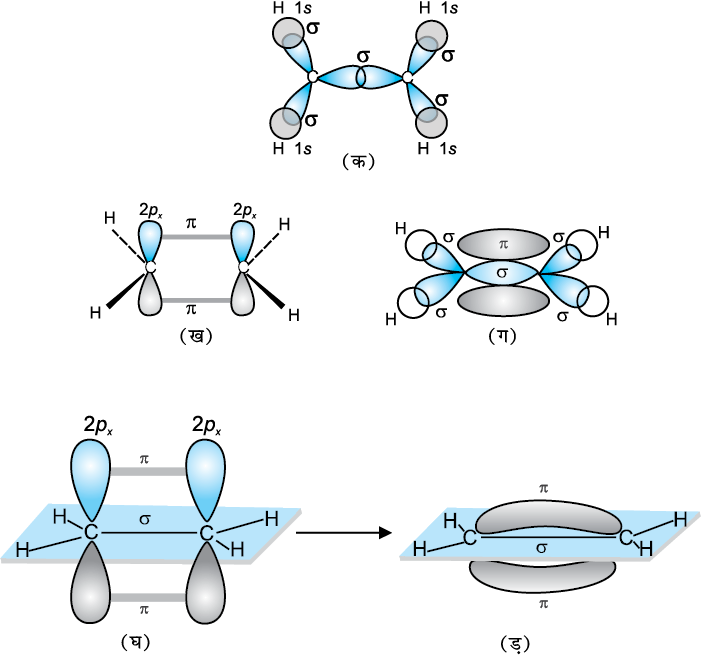
चित्र 4-15 एथीन में सिग्मा तथा π -आबंधों का बनना
 .
.
चित्र 4.16 एथाइन में सिग्मा तथा पाई-आबंधों का बनना
एक कार्बन परमाणु का sp संकर कक्षक दूसरे कार्बन परमाणु के sp संकर कक्षक से अक्षीय अतिव्यापन द्वारा C – C सिग्मा आबंध बनाता है। बचे हुए संकर कक्षक हाइड्रोजन के अर्ध-भृत 1s कक्षकों से अक्षीय अतिव्यापन द्वारा सिग्मा आबंध बनाते हैं। दोनों कार्बन परमाणुओं पर उपस्थित दो-दो असंकरित कक्षक पार्श्व अतिव्यापन द्वारा दो पाई-आबंध बनाते हैं। इस प्रकार इथाइन में दो कार्बन परमाणुओं के बीच उपस्थित त्रि-आबंध, एक सिग्मा तथा दो पाई आबंधों से बना होता है, जैसा चित्र 4.16 में दर्शाया गया है।
4.6.3 d-कक्षकों वाले तत्त्वों में संकरण
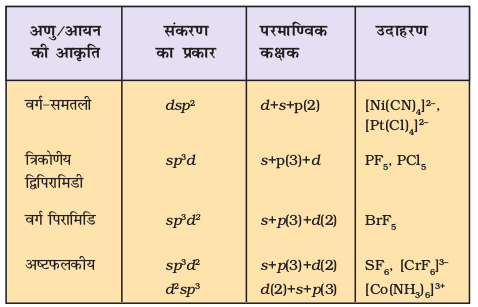
तृतीय आवर्त तत्त्वों में s तथा p कक्षकों के साथ-साथ d कक्षक भी उपस्थित होते हैं। इन d कक्षकों की ऊर्जा 3s 3p एवं 4s, 4p कक्षकों की ऊर्जा के समतुल्य होती है। 3p ओर 4s कक्षकों की ऊर्जा में अधिक अंतर होने के कारण 3p, 3d एवं 4s कक्षकों का संकरण संभव नहीं है।
s, p तथा d कक्षकों के संकरण के मुख्य प्रकारों को यहाँ नीचे सारांश में दिया गया है–
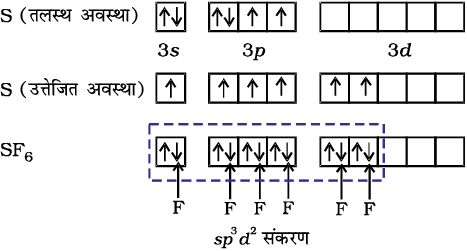
(i) PCl5 का बनना (sp3d संकरण)– फॉस्फोरस परमाणु (Z = 15) की तलस्थ अवस्था इलेक्ट्रॉनी विन्यास को नीचे दर्शाया गया है। फॉस्फोरस की आबंध निर्माण परिस्थितियों में 3s कक्षक से एक इलेक्ट्रॉन अयुग्मित होकर रिक्त 3dz2 कक्षक में प्रोन्नत हो जाता है।
इस प्रकार फॉस्फोरस की उत्तेजित अवस्था के विन्यास को इस प्रकार दर्शाया जा सकता है–
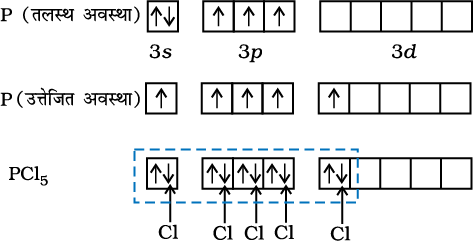
पाँच क्लोरीन परमाणुओं द्वारा प्रदत्त इलेक्ट्रॉन युग्मों द्वारा भरे गए sp3d संकरित कक्षक
इस प्रकार पाँच कक्षक (एक s, तीन p तथा एक d कक्षक) संकरण के लिए उपलब्ध होते हैं। इनके संकरण द्वारा पाँच sp3d संकर कक्षक प्राप्त होते हैं, जो त्रिकोणीय द्वि-पिरामिड के पाँच कोनों की ओर उन्मुख होते हैं, जैसा चित्र 4.17 में दर्शाया गया है।
चित्र 4.17 PCl5 अणु की त्रिकोणीय द्वि-पिरामिडी ज्यामिति
यहाँ यह ध्यान देने योग्य बात है कि त्रिकोणीय द्विपिरामिडी ज्यामिति में सभी आबंध कोण बराबर नहीं होते हैं। PCl5 में फॉस्फोरस के पाँच sp3d संकर कक्षक क्लोरीन परमाणुओं के अर्ध-भृत कक्षकों से अतिव्यापन द्वारा पाँच P – Cl सिग्मा- आबंध बनाते हैं। इनमें से तीन P – Cl आबंध एक तल में होते हैं तथा परस्पर 120° का कोण बनाते हैं। इन्हें ‘विषुवतीय आबंध, (Equatorial) कहते हैं। अन्य दो P – Cl आबंध क्रमशः विषुवतीय तल के ऊपर और नीचे होते हैं तथा तल से 90° का कोण बनाते हैं। इन्हें अक्षीय आबंध (Axial) कहते हैं। चूँकि अक्षीय आबंध इलेक्ट्रॉन युग्मों में विषुवतीय आबधी-युग्मों से अधिक प्रतिकर्षण अन्योन्यक्रियाएँ होती हैं, अतः ये आबंध विषुवतीय आबंधों से लंबाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं। इसके परिणामस्वरूप PCl5 अत्यधिक क्रियाशील होता है।
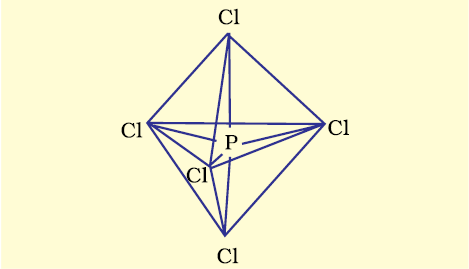
(ii) SF6 का बनना (sp3d2 संकरण)– SF6 में केंद्रीय सल्फर परमाणु की तलस्थ अवस्था इलेक्ट्रॉन विन्यास 3s2 3p4 है। उत्तेजित अवस्था में उपलब्ध छः कक्षक, अर्थात् एक s, तीन p तथा d कक्षक अर्ध-भृत होते हैं। ये संकरण द्वारा छः sp3 d2 संकर बनाते हैं, जो एक समअष्टफलक के छः कोणों की ओर प्रक्षिप्त होते हैं। ये संकर कक्षक फ्लुओरीन परमाणुओं के अर्ध-भृत कक्षकों से अतिव्यापन द्वारा छः S – F सिग्मा आबंध बनाते हैं। इस प्रकार SF6 अणु की एक समअष्टफलकीय ज्यामिति होती है, जैसा चित्र 4.18 में दर्शाया गया है।
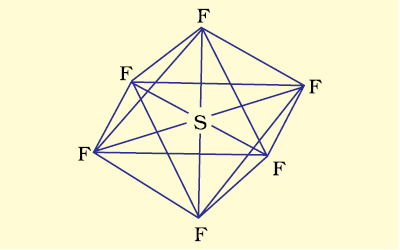
चित्र 4.18 SF6 अणु की अष्टफलकीय ज्यामिति
4.7 आण्विक कक्षक सिद्धांत
आण्विक कक्षक सिद्धांत एफ. हुंड तथा आर.एस. मुलिकन द्वारा सन् 1932 में विकसित किया गया। इस सिद्धांत के मुख्य लक्षण निम्नलिखित हैं–
(i) जिस प्रकार परमाणु में इलेक्ट्रॉन विभिन्न परमाणु कक्षकों में उपस्थित रहते हैं, उसी प्रकार अणु में इलेक्ट्रॉन विभिन्न आण्विक कक्षकों में उपस्थित रहते हैं।
(ii) आण्विक कक्षक तुल्य ऊर्जाओं एवं उपयुक्त सममिति परमाणु कक्षकों के संयोग से बनते हैं।
(iii) परमाणु कक्षक में कोई इलेक्ट्रॉन केवल एक ही नाभिक के प्रभाव में रहता है, जबकि आण्विक कक्षक में उपस्थित इलेक्ट्रॉन दो या दो से अधिक नाभिकों द्वारा प्रभावित होता है। यह संख्या अणु में परमाणुओं की संख्या पर निर्भर करती है। इस प्रकार परमाणु कक्षक एकलकेंद्रीय होता है, जबकि आण्विक कक्षक बहुकेंद्रीय होता है।
(iv) बने हुए आण्विक कक्षकों की संख्या संयोग करने वाले परमाणु कक्षकों की संख्या के बराबर होती है। जब दो परमाणु कक्षकों को मिलाया जाता है, तो दो आण्विक कक्षक प्राप्त होते हैं। इनमें से एक ‘आबंधन आण्विक कक्षक’ और दूसरा प्रतिआबंधन आण्विक कक्षक कहाजाता है।
(v) आबंधन आण्विक कक्षक की ऊर्जा कम होती है। अतः उसका स्थायित्व संगत प्रतिआबंधन आण्विक कक्षक से अधिक होता है।
(vi) जिस प्रकार किसी परमाणु के नाभिक के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण परमाणु कक्षक द्वारा दिया जाता है, उसी प्रकार किसी अणु में नाभिकों के समूह के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण आण्विक कक्षक द्वारा दिया जाता है।
(vii) परमाणु कक्षकों की भाँति आण्विक कक्षकों को भी पाउली सिद्धांत तथा हुंड के नियम का पालन करते हुए अॉफबाऊ नियम के अनुसार भरा जाता है।
4.7.1 आण्विक कक्षकों का निर्माण : परमाणु-कक्षकों का रैखिक संयोग
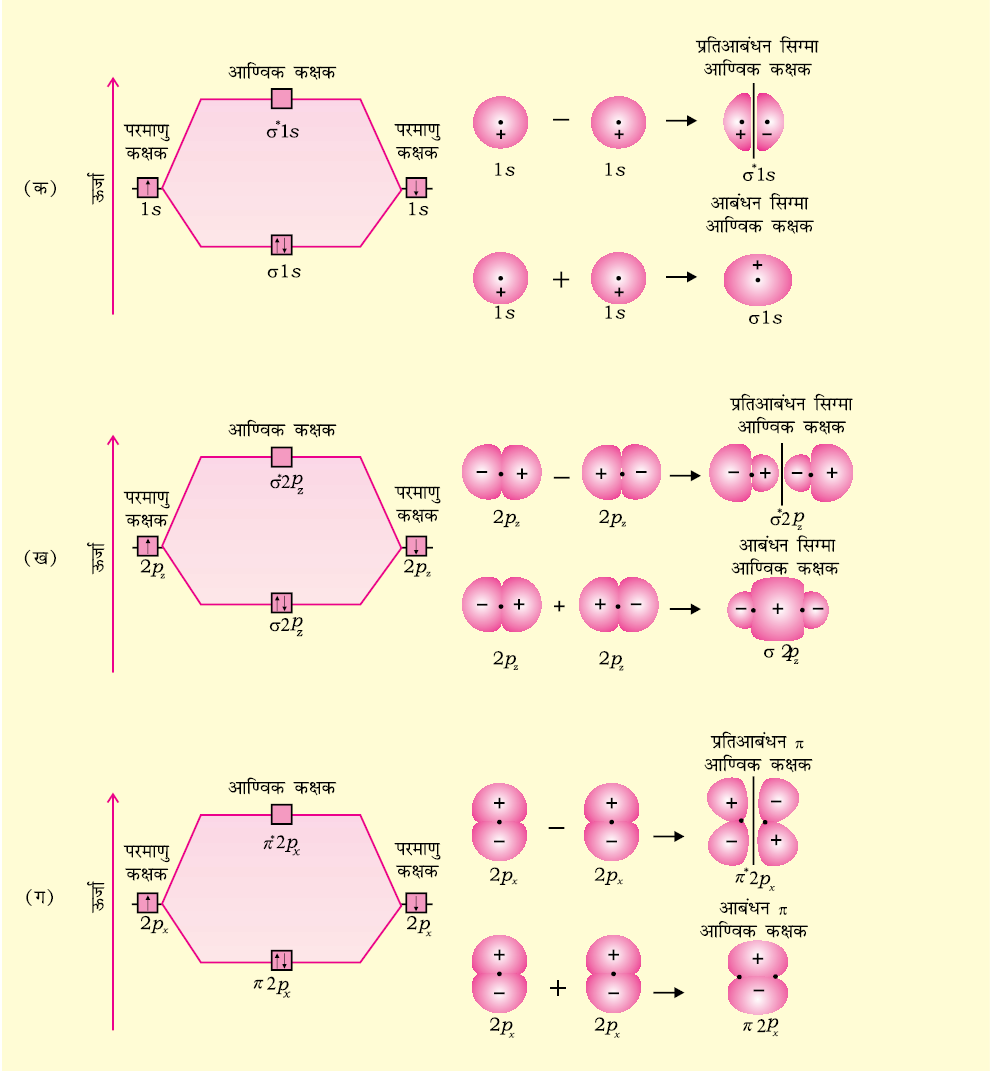
जैसा आप जानते हैं, तरंग यांत्रिकी के अनुसार परमाणु कक्षक को एक तरंग फलन (ψ) के रूप में दर्शाया जा सकता है। यह फलन इलेक्ट्रॉन तरंग के आयाम (Amplitude) को दर्शाता है तथा इसे श्रोडिंगर समीकरण के हल द्वारा प्राप्त किया जाता है, परंतु एक से अधिक इलेक्ट्रॉन वाले निकाय के लिए श्रोडिंगर समीकरण का हल नहीं किया जा सकता। इसलिए आण्विक कक्षक, जो अणुओं के लिए एक इलेक्ट्रॉन तरंग फलन है, को श्रोडिंगर समीकरण के हल से सीधे प्राप्त करना कठिन है। इस कठिनाई का निराकरण एक सन्निकट (Approximation) विधि के सहारे किया जाता है। इस विधि को ‘परमाणु कक्षकों का रैखिक संयोग’ (Linear Combination of Atomic Orbitals, LCAO) कहते हैं।
आइए, हम एक समनाभिकीय द्वि-परमाणुक अणु, H2 पर इस विधि का अनुप्रयोग करें। मान लें कि हाइड्रोजन अणु दो हाइड्रोजन परमाणुओं A तथा B से बना है। दोनों परमाणु एक समान ही हैं, केवल सुविधा के लिए उन्हें A तथा B से चिह्नित किया गया है। प्रत्येक हाइड्रोजन परमाणु की मूल अवस्था में उसके 1s कक्षक में एक इलेक्ट्रॉन होता है। इन परमाणु कक्षकों को हम तरंग फलनों ψA तथा ψB द्वारा प्रदर्शित कर सकते हैं। गणितीय रूप से आण्विक कक्षकों को परमाणु कक्षकों के रैखिक संयोग व्यक्तिगत परमाणु कक्षकों के तरंग फलनों ψA तथा ψB के योग या अंतर द्वारा किया जाता है, जैसा नीचे दर्शाया गया है।
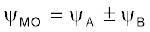
इस प्रकार दो आण्विक कक्षक σ तथा σ∗ प्राप्त होते हैं।
σ = ψA + ψB
σ* = ψA – ψB
परमाणु कक्षकों के योग से बनने वाले आण्विक कक्षक σ को आबंधन आण्विक कक्षक तथा परमाणु कक्षकों के अंतर से बनने वाले आण्विक कक्षक, σ∗, को ‘प्रतिआबंधन आण्विक कक्षक’ कहते हैं (चित्र 4.19)।
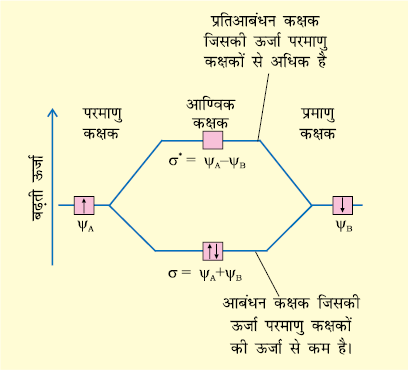
चित्र 4.19 दो परमाणु क्रमशः A तथा B पर केंद्रित परमाणु कक्षकों ψA तथा ψB के रैखिक संयोग से आबंधन (σ) तथा प्रतिआबंधन (σ*) आण्विक कक्षकों का निर्माण।
गुणात्मक तौर पर आण्विक कक्षकों का बनना संयोग करने वाले परमाणुओं के इलेक्ट्रॉन तरंगों के रचनात्मक (Constructive) तथा विनाशी (Destructive) व्यतिकरण (Interference) के रूप में समझा जा सकता है। आबंधन आण्विक कक्षक के निर्माण में आबंधी परमाणुओं की दो इलेक्ट्रॉन तरंगें एक दूसरे को प्रबलित करती हैं, अर्थात् इनमें रचनात्मक व्यतिकरण होता है। दूसरी ओर प्रतिआबंधन आण्विक कक्षक के निर्माण में ये इलेक्ट्रॉन तरंगें एक-दूसरे को निरस्त करती हैं, अर्थात् इनमें विनाशी व्यतिकरण होता है। इनके परिणामस्वरूप आबंधन आण्विक कक्षक में अधिकांश इलेक्ट्रॉन घनत्व आबंधित परमाणुओं के बीच अवस्थित होता है। नाभिकों के बीच प्रतिकर्षण बहुत कम होता है, जबकि प्रतिआबंधी आण्विक कक्षक में अधिकांश इलेक्ट्रॉन घनत्व दोनों नाभिकों के बीच के क्षेत्र से दूर अवस्थित होता है। वास्तव में दोनों नाभिकों के मध्य एक निस्पंद तल (Nodal Plane) होता हैं, जहाँ पर इलेक्ट्रॉन घनत्व शून्य होता है। अतः नाभिकों के बीच उच्च प्रतिकर्षण होता है। आबंधी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉन नाभिकों को परस्पर बांधे रखने की प्रवृत्ति रखते हैं। अतः ये अणु को स्थायित्व प्रदान करते हैं। इस प्रकार एक आबंधन आण्विक कक्षक उन परमाणु कक्षकों से सदैव कम ऊर्जा रखता है, जिनके संयोग से वह बनता है। इसके विपरीत प्रतिआबंधन आण्विक कक्षक में इलेक्ट्रॉन अणु को अस्थायी कर देते हैं। इलेक्ट्रॉनों एवं नाभिकों के बीच आकर्षण इस कक्षक में इलेक्ट्रॉनों के बीच परस्पर प्रतिकर्षण से कम होता है और इससे ऊर्जा में सकल वृद्धि होती है।
यहाँ ध्यान देने योग्य बात यह है कि प्रतिआबंधन कक्षक की ऊर्जा संयोग करने वाले परमाणु कक्षकों की ऊर्जा से उतनी मात्रा में अधिक हो जाती है, जितनी मात्रा में आबंधन आण्विक कक्षक की ऊर्जा कम होती है। इस प्रकार दोनों आण्विक कक्षकों की कुल ऊर्जा वही रहती है, जो दो मूल परमाणु-कक्षकों की होती है।
4.7.2 परमाणु कक्षकों के संयोग की शर्तें
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षकों के निर्माण के लिए निम्नलिखित शर्तें अनिवार्य हैं–
1. संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए। इसका तात्पर्य यह है कि एक 1s कक्षक दूसरे 1s कक्षक से संयोग कर सकता है परंतु 2s कक्षक से नहीं, क्योंकि 2s कक्षक की ऊर्जा 1s कक्षक की ऊर्जा से कहीं अधिक होती है। यह सत्य नहीं है यदि परमाणु भिन्न प्रकार के हैं।
2. संयोग करने वाले परमाणु कक्षकों की आण्विक अक्ष के परितः समान सममिति होनी चाहिए। परिपाटी के अनुसार z-अक्ष को आण्विक अक्ष मानते हैं। यहाँ यह तथ्य महत्त्वपूर्ण है कि समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करेंगे, जब उनकी सममिति समान है, अन्यथाः नहीं। उदाहरणार्थ–2pZ परमाणु-कक्षक दूसरे परमाणु के 2pZ कक्षक से संयोग करेगा, परंतु 2px या 2py कक्षकों से नहीं, क्योंकि उनकी सममितियाँ समान नहीं हैं।
3. संयोग करने वाले परमाणु कक्षकों को अधिकतम अतिव्यापन करना चाहिए। जितना अधिक अतिव्यापन होगा, आण्विक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन घनत्व उतना ही अधिक होगा।
4.7.3 आण्विक कक्षकों के प्रकार
द्वि-परमाणुक अणुओं के आण्विक कक्षकों को σ (सिग्मा), π (पाई), δ (डेल्टा) आदि द्वारा नामित किया जाता है। इस नामकरण में सिग्मा आण्विक कक्षक आबंध अक्ष के परितः सममित होते हैं, जबकि π आण्विक कक्षक सममित नहीं होते। उदाहरण के लिए– दो नाभिकों पर केंद्रित 1s कक्षकों का रैखिक संयोग दो आण्विक कक्षकों को उत्पन्न करता है। जो आबंध अक्ष के परितः सममित होते हैं। इन्हें σ1s तथा σ1s* आण्विक कक्षक कहते हैं [(चित्र 4.20(अ)]। यदि अंतरनाभिकीय अक्ष को z-दिशा में लिया जाए, तो यह देखा जा सकता है कि दो परमाणुओं के 2pz कक्षकों के रैखिक संयोग से भी दो सिग्मा आण्विक कक्षक उत्पन्न होंगे। इन्हें σ2pz तथा σ*2pz से निरूपित करते हैं [चित्र 4.20 ख]।
2px तथा 2py कक्षकों के अतिव्यापन से मिलने वाले आण्विक कक्षक आबंध कक्ष के परितः सममित नहीं होते। एेसा आण्विक तल के ऊपर धनात्मक लोब तथा आण्विक तल के नीचे ऋणात्मक लोब होने के कारण होता है। एेसे आण्विक कक्षकों को π और π∗ द्वारा चिह्नित करते हैं [चित्र 4.20 ग]। आबंधन आण्विक कक्षक में अंतरानाभिक अक्ष के ऊपर एवं नीचे अधिकतम इलेक्ट्रॉन घनत्व रहता है, परंतु प्रतिबंधन आण्विक कक्षक π∗ में नाभिकों के मध्य एक नोड़ होता है।
4.7.4 आण्विक कक्षकों का ऊर्जा-स्तर आरेख
हमने देखा कि दो परमाणुओं पर उपस्थित 1s परमाणु कक्षक संयोग द्वारा दो आण्विक कक्षकों का निर्माण करते हैं, जिन्हें σ1s तथा σ∗1s नामित किया जाता है। इसी प्रकार दो परमाणुओं के आठ परमाणु कक्षक (2s तथा 2p) रैखिक संयोग द्वारा निम्नलिखित आठ आण्विक कक्षकों का निर्माण करते हैं–
प्रतिआबंधी आण्विक कक्षक σ∗2s, σ∗2pz, π∗2px, π∗2py आबंधी आण्विक कक्षकः σ2s, σ2pz, π2px, π2py
इन आण्विक कक्षकों के ऊर्जा-स्तर प्रायोगिक तौर पर स्पेक्ट्रमी विधि द्वारा प्राप्त किए जाते हैं। द्वितीय आवर्त के तत्त्वों के समनाभिकीय द्विपरमाणुक अणुओं (O2, F2) के आण्विक कक्षकों की ऊर्जा का बढ़ता क्रम इस प्रकार है–
σ1s < σ*1s < σ2s < σ*2s <σ2pz<(π 2px = π 2py)
< (π *2px= π *2py)<σ*2pz
द्वितीय आवर्त के शेष अणुओं (जैसे– Li2, Be2, B2, C2, N2) के द्विपरमाणुक अणुओं के लिए आण्विक कक्षकों की ऊर्जा का क्रम ऊपर दिए गए क्रम से भिन्न होता है। उदाहरण के लिए– B2, C2, N2 आदि द्विपरमाण्क अणुओं के आण्विक कक्षकों का प्रायोगिक तौर पर निर्धारित ऊर्जा-क्रम इस प्रकार है–
σ1s < σ*1s < σ2s < σ*2s < (π 2px = π 2py) <σ2pz
< (π *2px= π *2py) < σ*2pz
आणिवक कक्षकों की ऊर्जा के क्रमों में महत्त्वपूर्ण अंतर यह है कि σ2pz कक्षक की ऊर्जा π2px तथा π2py आण्विक कक्षकों से अधिक होती है।
4.7.5 इलेक्ट्रॉनी विन्यास तथा आण्विक व्यवहार
विभिन्न आण्विक कक्षकों में इलेक्ट्रॉनों का वितरण ‘इलेक्ट्रॉनिक विन्यास’ कहलाता है। इलेक्ट्रॉनों को कक्षकों की ऊर्जा के बढ़ते हुए क्रम में भरा जाता है।
अणु के इलेक्ट्रॉनिक विन्यास से अणु के बारे में महत्त्वपूर्ण सूचना प्राप्त हो सकती है, जैसा आगे विवेचित है।
अणुओं का स्थायित्व : यदि आबंधी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या Nb तथा प्रतिआबंधन कक्षकों में संख्या Na हो, तो
(i) अणु स्थायी होगा, यदि Nb > Na हो
(ii) अणु अस्थायी होगा, यदि Na > Nb हो
(i) में आबंधन इलेक्ट्रॉनों की संख्या अधिक होने के कारण आबंधी प्रभाव प्रबलतम होता है, जिससे एक स्थायी अणु प्राप्त होता है। दूसरी ओर (ii) में प्रति-आबंधन प्रभाव प्रबल होता है, जिसके परिणामस्वरूप अणु अस्थायी होता है।
आबंध कोटि (Bond Order) :
आबंध कोटि को आबंधी आण्विक कक्षकों एवं प्रति-
आबंधी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अंतर के आधे के रूप में परिभाषित किया जाता है–
आबंध कोटि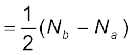
आबंध कोटि किसी अणु में उपस्थित सहसंयोजी
आबंधों की संख्या बताती है। यदि Nb > Na हो, तो आबंध कोटि धनात्मक होगी तथा अणु स्थायी होगा और यदि आबंध कोटि ऋणात्मक (Nb < Na) या शून्य (Nb = Na) हो, तो अणु अस्थायी होगा।
आबंध की प्रकृति
जैसा बताया गया है, आबंध-कोटि किसी अणु में उपस्थित सहसंयोजी आबंधों की संख्या बताती है। उदाहरणार्थ– यदि आबंध कोटि 1, 2 या 3 हो, तो उसमें क्रमशः एकल, द्वि अथवा त्रि आबंध होंगे।
आबंध-लंबाई
सामान्यतः किसी अणु में दो परमाणुओं के बीच आबंध कोटि आबंध लंबाई का एक सन्निकट माप होता हैं। आबंध लंबाई आबंध-कोटि के व्युत्क्रमानुपी होती है। जैसे-जैसे आबंध कोटि बढ़ती है, वैसे-वैसे आबंध लंबाई घटती जाती है।
चुंबकीय स्वभाव
यदि किसी अणु के सभी आण्विक कक्षक द्वि-पूरित युग्मित हों, तो पदार्थ प्रतिचुंबकीय (Diamagnetic) होता है। एेसे अणु चुंबकीय क्षेत्र में प्रतिकर्षित होते हैं, परंतु यदि किसी अणु के एक या अधिक आण्विक कक्षकों में अयुग्मित इलेक्ट्रॉन हों, तो वह अणु अनुचुंबकीय (Paramagnetic) होता है। एेसे अणु चुंबकीय क्षेत्र में आकर्षित होते हैं।
4.8 समनाभिकीय द्विपरमाणुक अणुओं में आबंधन
इस खंड में हम कुछ समनाभिकीय अणुओं में आबंधन की चर्चा करेंगे।
1. हाइड्रोजन अणु (H2) : यह हाइड्रोजन के दो परमाणुओं के संयोजन से बनता है। प्रत्येक हाइड्रोजन के 1s कक्षक में एक इलेक्ट्रॉन होता है। अतः हाइड्रोजन के अणु में कुल दो इलेक्ट्रॉन होंगे, जो σ1s आण्विक कक्षक में उपस्थित होंगे। हाइड्रोजन अणु का इलेक्ट्रॉनिक विन्यास होगा।
H2: (σ1s)2
हाइड्रोजन अणु की आबंध कोटि को इस प्रकार परिकलित किया जा सकता है।
आबंध कोटि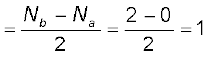
इसका अर्थ यह है कि हाइड्रोजन अणु में हाइड्रोजन के दो परमाणु एक-दूसरे से एकल सहसंयोजी आबंध द्वारा आबंधित होते हैं। हाइड्रोजन अणु की वियोजन ऊर्जा 438 kJ mol–1 पाई गई है तथा आबंध लंबाई का प्रायोगिक मान 74 pm है। चूँकि हाइड्रोजन अणु में कोई अयुग्मित इलेक्ट्रॉन नहीं है, इसलिए यह प्रतिचुंबकीय है।
2. हीलियम अणु (He2) : हीलियम परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 है। प्रत्येक हीलियम परमाणु में दो इलेक्ट्रॉन होते हैं, अर्थात् He2 अणु में कुल चार इलेक्ट्रॉन होंगे।
ये इलेक्ट्रॉन σ1s तथा σ1s आण्विक कक्षकों में भरे जाएँगे तथा He2 का इलेक्ट्रॉनिक विन्यास होगा।
He2 : (σ1s)2 (σ∗1s)2 तथा
He2 की आबंध कोटि 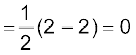
चूँकि He2 के लिए आबंध कोटि शून्य है, अतः यह अणु अस्थायी होगा तथा इसका अस्तित्व नहीं होगा! इसी प्रकार यह दर्शाया जा सकता है कि Be2 अणु [(σ1s)2 (σ∗1s)2 (σ2s)2 (σ∗2s)2] भी नहीं बनेगा।
3. लीथियम अणु (Li2) ः लीथियम का इलेक्ट्रॉनिक विन्यास 1s2 2s1 है। लीथियम के प्रत्येक परमाणु में तीन इलेक्ट्रॉनिक होंगे। इसलिए Li2 अणु का इलेक्ट्रॉनिक विन्यास होगा–
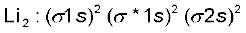
इस विन्यास को KK (σ2s)2 द्वारा भी प्रदार्शित किया जाता है, जहाँ KK, पूर्ण K कोश रचना 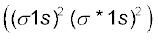 दर्शाता है।
दर्शाता है।
Li2 अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि इसमें चार इलेक्ट्रॉन आबंधी आण्विक कक्षकों में तथा दो इलेक्ट्रॉन प्रतिआबंधी आण्विक कक्षक में उपस्थित हैं। अतः इसकी आबंध काटी 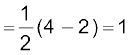 होगी। इसका अभिप्राय यह है कि Li2 अणु स्थायी है। चूँकि इसमें कोई अयुग्मित इलेक्ट्रॉन नही है, इसलिए यह प्रतिचुंबकीय होगा। वास्तव में यह पाया गया है कि वाष्प प्रावस्था में Li2 अणुओं का अस्तित्व होता है, जो प्रतिचुंबकीय होते हैं।
होगी। इसका अभिप्राय यह है कि Li2 अणु स्थायी है। चूँकि इसमें कोई अयुग्मित इलेक्ट्रॉन नही है, इसलिए यह प्रतिचुंबकीय होगा। वास्तव में यह पाया गया है कि वाष्प प्रावस्था में Li2 अणुओं का अस्तित्व होता है, जो प्रतिचुंबकीय होते हैं।
4. कार्बन अणु (C2) : कार्बन का इलेक्ट्रॉनिक विन्यास 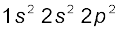 है। (C2) के अणु में कुल 12 इलेक्ट्रॉन होंगे। तथा इसका इलेक्ट्रॉनिक विन्यास होगा।
है। (C2) के अणु में कुल 12 इलेक्ट्रॉन होंगे। तथा इसका इलेक्ट्रॉनिक विन्यास होगा।
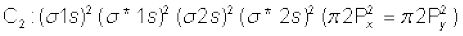
अथवा 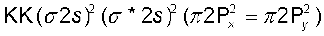
C2 की आबंध कोटि 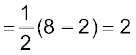 तथा
तथा
C2 को प्रतिचुंबकीय होना चाहिए! वस्तुतः वाष्प अवस्था में C2 प्रतिचुंबकीय है C2 के अणुओं में दोनों आबंध पाई-आबंध होते है, क्योंकि दो π.आबंधन आण्विक कक्षकों में चार इलेक्ट्रॉन उपस्थित होते हैं। अधिकांश अन्य अणुओं में द्वि-आबंध, एक सिग्मा तथा एक पाई आबंध से बना होता है। समान रूप से N2 अणु में आबंधन को समझाया जा सकता है।
5. अॉक्सीजन अणु (O2) : अॉक्सीजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p4 है। चूँकि प्रत्येक अॉक्सीजन परमाणु में 8 इलेक्ट्रॉन होते हैं, अॉक्सीजन अणु में कुल 16 इलेक्ट्रॉन होंगे। O2 अणु का इलेक्ट्रॉनिक विन्यास होगा–
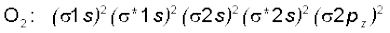
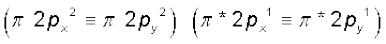
अथवा
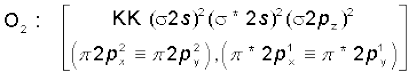
O2 के इलेक्ट्रॉनिक विन्यास से यह स्पष्ट है कि इसमें 10 इलेक्ट्रॉन आबंधन आण्विक कक्षकों में तथा 6 इलेक्ट्रॉन प्रतिआबंधन आण्विक कक्षकों में उपस्थित होते हैं। अतः इसकी आबंध-कोटि होगी–
आबंध-कोटि 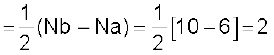
इसलिए O2 के अणु में अॉक्सीजन परमाणु एक द्वि-आबंध द्वारा जुड़े होते हैं। इसके अॉक्सीजन अणु के π *2px तथा π *2py आण्विक कक्षकों में एक-एक अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं। इसके अनुसार, अॉक्सीजन अणु को अनुचुंबकीय होना चाहिए। एेसा प्रायोगिक तौर पर पाया भी गया है। इस प्रकार आण्विक कक्षक सिद्धांत अॉक्सीजन के अनुचुंबकीय व्यवहार की व्याख्या करने में समर्थ है।
इसी प्रकार आवर्त सारणी के द्वितीय आवर्त के अन्य समनाभिकीय द्विपरमाणुक अणुओं के इलेक्ट्रॉनिक विन्यास लिखे जाकते हैं। B2 से Ne2 तक के अणुओं के लिए आण्विक कक्षक विन्यास तथा आण्विक गुण चित्र 4.21 में दिए गए हैं।
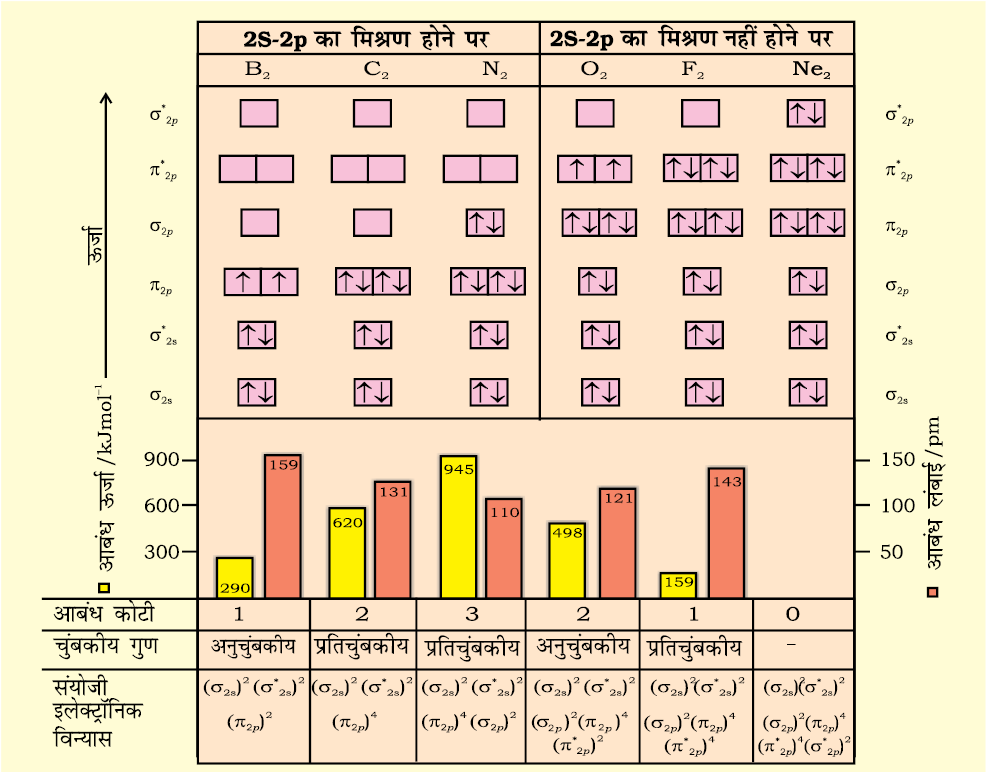
चित्र 4-21 ठ 2 से छम 2 तक के लिए आण्विक कक्षक तथा आण्विक गुण
आण्विक कक्षकों का क्रम तथा उनमें इलेक्ट्रॉनों की संख्या दर्शाई गई है। आबंध-ऊर्जा, आबंध-कोटि, चुंबकीय गुण तथा संयोजी इलेक्ट्रॉन विन्यास कक्षक आरेखों के नीचे प्रदार्शित हैं।
4.9 हाइड्रोजन आबंधन
नाइट्रोजन, अॉक्सीजन तथा फ्लुओरीन–ये तीन अत्यधिक विद्युत् ऋणात्मक तत्त्व जब परमाणु सहसंयोजक आबंध द्वारा हाइड्रोजन परमाणु से जुड़े होते हैं, तब सहसंयोजी आबंध के इलेक्ट्रॉन अधिक विद्युत् ऋणात्मक तत्त्व की ओर स्थानांतरित हो जाते हैं। फलस्वरूप प्राप्त आंशिक धनावेशित हाइड्रोजन परमाणु किसी दूसरे विद्युत् ऋणात्मक परमाणु के साथ एक नया आबंध बनाता है। इस आबंध को ‘हाइड्रोजन आबंध’ कहते हैं। यह आबंध सहसंयोजी आबंध से दुर्बल होता है। उदाहरणार्थ– HF में एक अणु के हाइड्रोजन परमाणु तथा दूसरे अणु के फ्लुओरीन परमाणु के बीच हाइड्रोजन आबंध बनता है। इसे इस प्रकार दर्शाया जा सकता है–
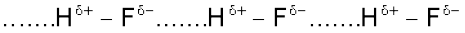
यहाँ पर हाइड्रोजन आबंध दो परमाणुओं के बीच एक सेतु का कार्य करता है, जो एक परमाणु को सहसंयोजक आबंध तथा दूसरे को हाइड्रोजन आबंध द्वारा जोड़कर रखता है। हाइड्रोजन आबंध को डॉटेड रेखा (.......) द्वारा दर्शाते हैं, जबकि सहसंयोजन आबंध को ठोस रेखा (–) द्वारा दर्शाते हैं। इस प्रकार हाइड्रोजन आबंध को उस आकर्षण बल के रूप में परिभाषित किया जा सकता है, जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत् ऋणात्मक परमाणु (F,O या N) से बांधता है।
4.9.1 हाइड्रोजन आबंध बनने का कारण
जब हाइड्रोजन परमाणु किसी प्रबल विद्युत् ऋणात्मक तत्त्व 'X' से आबंधित होता है, तो सहभाजित इलेक्ट्रॉन युग्म हाइड्रोजन परमाणु से दूर हो जाता है। परिणामस्वरूप हाइड्रोजन परमाणु दूसरे परमाणुओं 'X' के सापेक्ष अत्यधिक विद्युत् धनात्मक हो जाता है। चूँकि इलेक्ट्रॉन 'X' परमाणु की ओर स्थानांतरित हो जाते हैं, इसलिए हाइड्रोजन परमाणु आंशिक धनात्मक आवेश 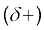 ग्रहण करता है, जबकि X परमाणु पर आंशिक ऋणात्मक आवेश
ग्रहण करता है, जबकि X परमाणु पर आंशिक ऋणात्मक आवेश 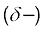 आ जाता है। इससे एक द्विध्रुवी अणु प्राप्त होता है, जिसके बीच स्थिर वैद्युत बल होता है। इसे इस प्रकार दर्शाया जा सकता है–
आ जाता है। इससे एक द्विध्रुवी अणु प्राप्त होता है, जिसके बीच स्थिर वैद्युत बल होता है। इसे इस प्रकार दर्शाया जा सकता है–
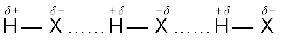
हाइड्रोजन आबंध का परिमाण यौगिक की भौतिक अवस्था पर निर्भर करता है। ठोस अवस्था में यह अधिकतम होता है तथा गैसीय अवस्था में न्यूनतम। इस तरह से हाइड्रोजन आबंध यौगिकों की संरचना तथा गुणधर्मों को प्रबलता से प्रभावित करते हैं।
4.9.2 हाइड्रोजन आबंधों के प्रकार
हाइड्रोजन आबंध दो प्रकार के होते हैं–
(i) अंतर-अणुक हाइड्रोजन आबंध
(ii) अंतरा-अणुक हाइड्रोजन आबंध
(i) अंतर-अणुक हाइड्रोजन आबंध– ये आबंध समान अथवा विभिन्न यौगिकों के दो अलग-अलग अणुओं के बीच बनते हैं। उदाहरणार्थ– HF अणु, एल्कोहॉल या जल के अणुओं के बीच हाइड्रोजन आबंध।
(ii) अंतरा-अणुक हाइड्रोजन आबंध– ये आबंध एक ही अणु में उपस्थित हाइड्रोजन परमाणु तथा अधिक विद्युत् ऋणात्मक परमाणु (F,O,N) के बीच बनता है। उदाहरणार्थ– o-नाइट्रो फिनॉल में हाइड्रोजन, जो अॉक्सीजन के मध्य रहता है।
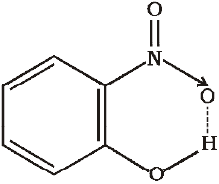
चित्र 4.22 o-नाइट्रोफ़ीनॉल अणु में अंतर-अणुक हाइड्रोजन आबंध
सारांश
इलेक्ट्रो धनायनों तथा इलेक्ट्रो ऋणायनों के विरचन की क्रियाविधि को सर्वप्रथम कॉसेल ने संबंधित आयन द्वारा उत्कृष्ट गैस विन्यास की प्राप्ति के साथ संबंधित किया। आयनों के बीच वैद्युत आकर्षण के कारण स्थायित्व उत्पन्न होता है, जो वैद्युत संयोजकता का आधाार है।
लूइस ने सर्वप्रथम सहसंयोजी आबंधन की व्याख्या परमाणुओं द्वारा इलेक्ट्रॉन युग्म के सहभाजन के रूप में की। इस प्रक्रिया द्वारा संबंधित परमाणु उत्कृष्ट गैस विन्यास प्राप्त करते हैं। लूइस बिंदु चिह्न किसी तत्त्व के परमाणु के संयोजकता इलेक्ट्रॉनों को दर्शाते हैं तथा लूइस बिंदु संरचनाएँँ अणुओं में आबंधन का चित्रण करती हैं।
आयनिक यौगिक धनायनों तथा ऋणायनों की निश्चित क्रम में त्रिविमीय व्यवस्था होती है, जिसे ‘क्रिस्टल जालक’ कहा जाता है। क्रिस्टलीय गैसों में धनायन एवं ऋणायन के मध्य आवेश संतुलित होता है। क्रिस्टल जालक का जालक विरचन एंथैल्पी द्वारा स्थिरीकरण होता है।
दो परमाणुओं के बीच एकल सहसंयोजी आबंध का विरचन एक-एक इलेक्ट्रॉन युग्म के सहभाजन द्वारा होता है, जबकि दो या तीन इलेक्ट्रॉन युग्मों के सहभाजन के फलस्वरूप बहु आबंध निर्मित होते हैं। कुछ आबंधी परमाणुओं पर एेसे इलेक्ट्रॉन युग्म उपस्थित होते हैं, जो आबंधन में भाग नहीं लेते। ये ‘इलेक्ट्रॉनों के एकाकी युग्म’ कहलाते हैं। लूइस बिंदु संरचना अणु में प्रत्येक परमाणु पर आबंधी युग्मों तथा एकाकी युग्मों को दर्शाती है। रासायनिक आबंधों के कुछ प्रमुख प्राचल, जैसे–आबंध एंथैल्पी, आबंध कोटि विद्युत् ऋणात्मक्ता तथा आबंध ध्रुवणता यौगिकों के गुणों को प्रभावित करते हैं।
बहुत से अणुओं तथा बहुपरमाणुक आयनों को मात्र एक लूइस संरचना द्वारा प्रदर्शित नहीं किया जा सकता है। एेसी स्पीशीज़ के लिए अनेक संरचनाएँँ लिखी जाती हैं, जिनके ढाँचे की संरचना समान होती है। ये सभी संरचनाएँँ सम्मिलित रूप में अणु या आयन की वास्तविक संरचना प्रदर्शित करती हैं। यह एक महत्त्वपूर्ण तथा अति उपयोगी अवधारणा है, जिसे ‘अनुनाद’ कहा जाता है। योगदान देने वाली विहित संरचनाओं का अनुनाद संकर अणु या आयन की वास्तविक संरचना प्रदर्शित करता है।
वी. एस. ई. पी. आर. मॉडल का उपयोग अणुओं की ज्यामितीय आकृतियों के पूर्वानुमान के लिए किया जाता है। यह मॉडल इस कल्पना पर आधारित है कि अणु में इलेक्ट्रॉन युग्म एक-दूसरे को प्रतिकर्षित करते हैं। इस मॉडल के अनुसार, आण्विक ज्यामिति एकाकी युग्म-एकाकी युग्म, एकाकी युग्म-आबंधी युग्म तथा आबंधी युग्म-आबंधी युग्म प्रतिकर्षणों पर निर्भर करती हैं। इन प्रतिकर्षण बलों का क्रम इस प्रकार है– lp-lp > lp-bp > bp-bp
सहसंयोजी आबंधन का सहसंयोजकता आबंध सिद्धांत सहसंयोजी आबंध बनने के ऊर्जा-विज्ञान पर आधारित है, जिसपर लूइस तथा वी. एस. ई. पी. आर. मॉडल प्रकाश नहीं डालते। मूलतः VB सिद्धांत कक्षकों के अतिव्यापन पर आधारित है। उदाहरणस्वरूप–H2 अणु का विरचन दो हाइड्रोजन परमाणुओं के एक इलेक्ट्रॉन वाले 1s कक्षकों के अतिव्यापन के फलस्वरूप होता है। दो हाइड्रोजन परमाणु जैसे-जैसे निकट आते हैं, वैसे-वैसे निकाय की स्थितिज ऊर्जा कम होती जाती है। साम्य अंतर्नाभिकीय दूरी (आबंध लंबाई) पर निकाय की ऊर्जा न्यूनतम होती है। नाभिकों को और समीप लाने पर निकाय की ऊर्जा तेजी से बढ़ती है, अर्थात् अणु का स्थायित्व कम हो जाता है। कक्षक अतिव्यापन के कारण दोनों नाभिकों के बीच इलेक्ट्रॉन घनत्व बढ़ जाता है, जिसके कारण नाभिक आपस में पास-पास आ जाते हैं। परंतु यह पाया गया है कि केवल अतिव्यापन के आधार पर आबंध एंथैल्पी तथा आबंध लंबाइयों के वास्तविक मान प्राप्त नहीं होते हैं। इसके लिए कुछ अन्य कारकों पर भी विचार करना आवश्यक है।
बहुपरमाणुक अणुओं की विशिष्ट आकृतियों को स्पष्ट करने के लिए पॉलिंग ने परमाणु कक्षकों के संकरण की अवधारणा को प्रस्तुत किया। Be, B, C, N तथा O के परमाणु कक्षकों के sp, sp2, sp3 संकरों के आधार पर BeCl2, BCl3, CH4, NH3 तथा H2O आदि अणुओं का विरचन तथा उनकी ज्यामितीय आकृतियाँ स्पष्ट की जा सकती हैं। इसके आधार पर C2H2 तथा C2H4 आदि अणुओं में बहु-आबंधों का निर्भाण भी स्पष्ट किया जा सकता है।
आण्विक कक्षक सिद्धांत परमाणु कक्षकों के संयोग एवं व्यवस्था से संपूर्ण अणु से संबद्ध आण्विक कक्षकों के बनने के रूप में आबंधन का वर्णन करता है। आण्विक कक्षकों की संख्या संयोग करनेवाले परमाणु कक्षकों की संख्या के बराबर होती है। आबंधी आण्विक कक्षक नाभिकों के मध्य इलेक्ट्रॉन घनत्व बढ़ा देते हैं तथा इनकी ऊर्जा व्यक्तिगत परमाणु कक्षकों की ऊर्जा से कम होती है। प्रतिआबंधी आण्विक कक्षक में नाभिकों के मध्य शून्य इलेक्ट्रॉन घनत्व होता है। इन कक्षकों की ऊर्जा व्याक्तिगत परमाणु कक्षकों की अपेक्षा उच्च होती है।
अणुओं का इलेक्ट्रॉन विन्यास आण्विक कक्षकों में इलेक्ट्रॉनों को ऊर्जा के बढ़ते क्रम में भरते हुए लिखा जाता है। परमाणुओं की तरह यहाँ भी पॉउली अपवर्जन नियम तथा हुंड के नियम लागू होते हैं। यदि अणु के आबंधी आण्विक कक्षकों में इलेक्ट्रॉनों की संख्या प्रति-आबंधी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या से अधिक होती है, तो अणु स्थायी होता है।
जब एक हाइड्रोजन परमाणु दो अत्यंत विद्युत् ऋणात्मक परमाणुओं (F, N, O) के बीच होता है, तो उसमें हाइड्रोजन आबंध बनाता है। यह अंतर-अणुक (समान या भिन्न अणुओं के अलग-अलग अणुओं के बीच) या अंतरा-अणुक (एक अणु में ही) प्रकार का हो सकता है। हाइड्रोजन आबंध कई यौगिकों की संरचनाओं तथा गुणधर्मों पर प्रबलकारी प्रभाव डालते हैं।
अभ्यास
4.1 रासायनिक आबंध के बनने की व्याख्या कीजिए।
4.2 निम्नलिखित तत्त्वों के परमाणुओं के लूइस बिंदु प्रतीक लिखिए–
Mg, Na, B, O, N, Br.
4.3 निम्नलिखित परमाणुओं तथा आयनों के लूइस बिंदु प्रतीक लिखिए।
S और S2–, Al तथा Al3+, H और H–
4.4 निम्नलिखित अणुओं तथा आयनों की लूइस संरचनाएँ लिखिए–
H2S, SiCl4, BeF2, 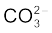 , HCOOH
, HCOOH
4.5 अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्त्व और सीमाओं को लिखिए।
4.6 आयनिक आबंध बनाने के लिए अनुकूल कारकों को लिखिए।
4.7 निम्नलिखित अणुओं की आकृति की व्याख्या वी. एस. ई. पी. आर. सिद्धांत के अनुरूप कीजिए–
BeCl2, BCl3, SiCl4, AsF5, H2S, PH3
4.8 यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबंध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
4.9 आबंध प्रबलता को आबंध-कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
4.10 आबंध लंबाई की परिभाषा दीजिए।
4.11 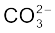 आयन के संदर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
आयन के संदर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
4.12 नीचे दी गई संरचनाओं (1 तथा 2) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकल) रूप माने जा सकते है? यदि नहीं, तो उसका कारण बताइए।
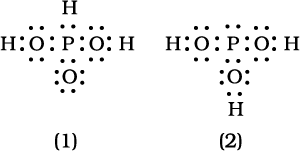
4.13 SO3, NO2 तथा  की अनुनाद-संरचनाएँँ लिखिए।
की अनुनाद-संरचनाएँँ लिखिए।
4.14 निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानांतरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिंदु-प्रतीकों की सहायता से दर्शाइए–
(क) K तथा S (ख) Ca तथा O (ग) Al तथा N
4.15 हालाँकि CO2 तथा H2O दोनों त्रिपरमाणुक अणु हैं, परंतु H2O अणु की आकृति बंकित होती है, जबकि CO2 की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
4.16 द्विघ्रुव आधूर्ण के महत्त्वपूर्ण अनुप्रयोग बताएँ।
4.17 विद्युत-ऋणात्मकता को परिभाषित कीजिए। यह इलेक्ट्रॉन बंधुता से किस प्रकार भिन्न है?
4.18 ध्रूवीय सहसंयोजी आबंध से आप क्या समझते हैं? उदाहरणसहित व्याख्या कीजिए।
4.19 निम्नलिखित अणुओं को आबंधों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए–
LiF, K2O, N2, SO2, तथा ClF3
4.20 CH3COOH की नीचे दी गई ढाँचा-संरचना सही है, परंतु कुछ आबंध त्रुटिपूर्ण दर्शाए गए है। एेसिटिक अम्ल की सही लूइस-संरचना लिखिए–
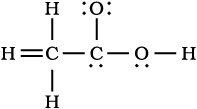
4.21 चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और संभव ज्यामिति वर्ग-समतली है, जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते है। व्याख्या कीजिए कि CH4 की अणु वर्ग-समतली नहीं होता है।
4.22 यद्यपि Be–H आबंध ध्रुवीय है, तथापि BeH2 अणु का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
4.23 NH3 तथा NF3 में किस अणु का द्विध्रुव-आघूर्ण अधिक है और क्यों?
4.24 परमाणु-कक्षकों के संकरण से आप क्या समझते हैं। sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन कीजिए।
4.25 निम्नलिखित अभिक्रिया में Al परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है, तो) को समझाइए–
4.26 क्या निम्नलिखित अभिक्रिया के फलस्वरूप B तथा N परमाणुओं की संकरण-अवस्था में परिवर्तन होता है?
4.27 C2H4 तथा C2H2 अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबंध तथा त्रि-आबंध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
4.28 निम्नलिखित अणुओं में सिग्मा 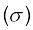 तथा पाई
तथा पाई 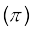 आबंधों की कुल संख्या कितनी है?
आबंधों की कुल संख्या कितनी है?
(क) C2H2 (ख) C2H4
4.29 x-अक्ष को अंतर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौन से कक्षक सिग्मा 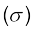 आबंध नहीं बनाएँगे और क्यों?
आबंध नहीं बनाएँगे और क्यों?
(क) 1s तथा 1s (ख) 1s तथा 2px (ग) 2py तथा 2py (ल) 1s तथा 2s
4.30 निम्नलिखित अणुओं में कार्बन परमाणु कौन से संकर कक्षक प्रयुक्त करते हैं?
(क) CH3–CH3 (ख) CH3–CH = CH2
(ग) CH3–CH2–OH (घ) CH3CHO
(ड़) CH3COOH
4.31 इलेक्ट्रॉनों के आबंधी युग्म तथा एकांकी युग्म से आप क्या समझते हैं? प्रत्येक के एक उदाहरण द्वारा स्पष्ट कीजिए।
4.32 सिग्मा तथा पाई आबंध में अंतर स्पष्ट कीजिए।
4.33 संयोजकता आबंध सिद्धांत के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
4.34 परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों कों लिखें।
4.35 आण्विक कक्षक सिद्धांत के आधार पर समझाइए कि Be2 अणु का अस्तित्व क्यों नहीं होता।
4.36 निम्नलिखित स्पीशीज़ के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुंबकीय गुण इंगित कीजिए– 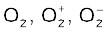 (सुपर अॉक्साइड) तथा
(सुपर अॉक्साइड) तथा 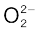 (परअॉक्साइड)
(परअॉक्साइड)
4.37 कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋणा (-) चिह्नों का क्या महत्त्व होता है?
4.38 PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबंध विषुवतीय आबंधों की अपेक्षा अधिक लंबे क्यों होते हैं?
4.39 हाइड्रोजन आबंध की परिभाषा दीजिए। यह वान्डरवाल्स बलों की अपेक्षा प्रबल होते है या दुर्बल?
4.40 ‘आबंध कोटि’ से आप क्या समझते हैं? निम्नलिखित में आबंध-कोटि का परिकलन कीजिए–
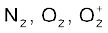 तथा
तथा