Table of Contents
एकक 7
साम्यावस्था
Equilibrium
उद्देश्य
इस एकक के अध्ययन के बाद आप –
• भौतिक एवं रासायनिक प्रक्रियाओं में साम्य की गतिक प्रकृति को पहचान सकेंगे;
• भौतिक एवं रासायनिक प्रक्रियाओं के साम्य के नियम को व्यक्त कर सकेंगे;
• तथा साम्य के अभिलक्षणों को अभिव्यक्त कर सकेंगे;
• किसी दी गई अभिक्रिया के लिए साम्य स्थिरांक व्यंजक लिख सकेंगे;
• Kp एवं Kc के मध्य संबंध स्थापित कर सकेंगे;
• अभिक्रिया की साम्यावस्था को प्रभावित करनेवाले विभिन्न कारकों की व्याख्या कर सकेंगे;
• आरेनियस, ब्रान्स्टेड-लोरी एवं लूइस धारणाओं के आधार पर पदार्थाें को अम्ल अथवा क्षारों में वर्गीकृत कर सकेंगे;
• अम्ल तथा क्षारों के सामर्थ्य की व्याख्या उनके आयनन स्थिरांकों के रूप में कर सकेंगे;
• वैद्युत् अपघट्य तथा समआयन की सांद्रता पर आयनन की मात्रा की निर्भरता की व्याख्या कर सकेंगे;
• हाइड्रोजन आयन की मोलर सांद्रता का pH स्केल के रूप में वर्णन कर सकेंगे;
• जल के आयनन एवं इसकी अम्ल तथा क्षार के रूप में दोहरी भूमिका का वर्णन कर सकेंगे;
• जल के आयनिक गुणनफल (KW) तथा pKW में विभेद कर सकेंगे;
• बफर विलयनों के उपयोग को समझ सकेंगे एवं
• विलेयता गुणनफल स्थिरांक की गणना कर सकेंगे।
अनेक जैविक एवं पर्यावरणीय प्रक्रियाओं में रासायनिक साम्य महत्त्वपूर्ण है। उदाहरणार्थ– हमारे फेफड़ों से मांसपेशियों तक O2 के परिवहन एवं वितरण में O2 अणुओं तथा हीमोग्लोबिन के मध्य साम्य की एक निर्णायक भूमिका है। इसी प्रकार CO अणुओं तथा हीमोग्लोबिन के मध्य साम्य CO की विषाक्तता का कारण बताता है।
जब किसी बंद पात्र में एक द्रव वाष्पित होता है, तो उच्च गतिज ऊर्जा वाले अणु द्रव की सतह से वाष्प प्रावस्था में चले जाते हैं तथा अनेक जल के अणु द्रव की सतह से टकराकर वाष्प प्रावस्था से द्रव प्रावस्था में समाहित हो जाते हैं। इस प्रकार द्रव एवं वाष्प के मध्य एक गतिज साम्य स्थापित हो जाता है, जिसके परिणामस्वरूप द्रव की सतह पर एक निश्चित वाष्प-दाब उत्पन्न होता है। जब जल का वाष्पन प्रारंभ हो जाता है, तब जल का वाष्प-दाब बढ़ने लगता है और अंत में स्थिर हो जाता है। एेसी स्थिति में हम कहते हैं कि निकाय (System) में साम्यावस्था स्थापित हो गई है। यद्यपि यह साम्य स्थैतिक नहीं है तथा द्रव की सतह पर द्रव एवं वाष्प के बीच अनेक क्रियाकलाप होते रहते हैं। इस प्रकार साम्यावस्था पर वाष्पन की दर संघनन-दर के बराबर हो जाती है। इसे इस प्रकार दर्शाया जाता है
H2O (द्रव) H2O (वाष्प)
यहाँ दो अर्ध तीर इस बात को दर्शाते हैं कि दोनों दिशाओं में प्रक्रियाएँ साथ-साथ होती हैं तथा अभिक्रियकों एवं उत्पादों के साम्यावस्था पर मिश्रण को ‘साम्य मिश्रण’ कहते हैं। भौतिक प्रक्रमों तथा रासायनिक अभिक्रियाओं दोनों में साम्यावस्था स्थापित हो सकती है। अभिक्रिया का तीव्र अथवा मंद होना उसकी प्रकृति एवं प्रायोगिक परिस्थितियों पर निर्भर करता है। जब स्थिर ताप पर एक बंद पात्र में अभिक्रियक क्रिया कर के उत्पाद बनाते हैं, तो उनकी सांद्रता धीरे-धीरे कम होती जाती है तथा उत्पादों की सांद्रता बढ़ती रहती है। किंतु कुछ समय पश्चात् न तो अभिक्रियकों के सांद्रण में और न ही उत्पादों के सांद्रण में कोई परिवर्तन होता है। एेसी स्थिति में निकाय में गतिक साम्य (Dynamic Equilibrium) स्थापित हो जाता है तथा अग्र एवं पश्चगामी अभिक्रियाओं की दरें समान हो जाती हैं। इसी कारण इस अवस्था में अभिक्रिया-मिश्रण में उपस्थित विभिन्न घटकों के सांद्रण में कोई परिवर्तन नहीं होता है। इस आधार पर कि साम्यावस्था पहुँचने तक कितनी अभिक्रिया पूर्ण हो चुकी है, समस्त रासायनिक अभिक्रियाओं को निम्नलिखित तीन समूहों में वर्गीकृत किया जाता है–
(i) प्रथम समूह में वे अभिक्रियाएँ आती हैं, जो लगभग पूर्ण हो जाती हैं तथा अभिक्रियकों की सांद्रता नगण्य रह जाती है। कुछ अभिक्रियाओं में तो अभिक्रियकों की सांद्रता इतनी कम हो जाती है कि उनका परीक्षण प्रयोग द्वारा संभव नहीं हो पाता है।
(ii) द्वितीय समूह में वे अभिक्रियाएँ आती हैं, जिनमें बहुत कम मात्रा में उत्पाद बनते हैं तथा साम्यावस्था पर अभिक्रियकों का अधिकतर भाग अपरिवर्तित रह जाता है।
(iii) तृतीय समूह में उन अभिक्रियाओं को रखा गया है, जिनमें अभिक्रियकों एवं उत्पादों की सांद्रता साम्यावस्था में तुलना योग्य हो।
साम्यावस्था पर अभिक्रिया किस सीमा तक पूर्ण होती है यह उसकी प्रायोगिक परिस्थितियों जैसे–अभिक्रियकों की सांद्रता, ताप आदि) पर निर्भर करती है। उद्योग तथा प्रयोगशाला में परिचालन परिस्थितियों (Operational Conditions) का इष्टतमीकरण (Optimize) करना बहुत महत्त्वपूर्ण होता है, ताकि साम्यावस्था का झुकाव इच्छित उत्पाद की दिशा में हो। इस एकक में हम भौतिक तथा रासायनिक प्रक्रमों में साम्य के कुछ महत्त्वपूर्ण पहलुओं के साथ-साथ जलीय विलयन में आयनों के साम्य, जिसे आयनिक साम्य कहते हैं, को भी सम्मिलित करेंगे।
7.1 भौतिक प्रक्रमों में साम्यावस्था
भौतिक प्रक्रमों के अध्ययन द्वारा साम्यावस्था में किसी निकाय के अभिलक्षणों को अच्छी तरह समझा जा सकता है। प्रावस्था रूपांतरण प्रक्रम (Phase Transformation Processes) इसके सुविदित उदाहरण हैं। उदाहरणार्थ–
ठोस ⇌ द्रव
द्रव ⇌ गैस
ठोस ⇌ गैस
7.1.1 ठोस-द्रव साम्यावस्था
पूर्णरूपेण रोधी (Insulated) थर्मस फ्लास्क में रखी बर्फ़ एवं जल (यह मानते हुए कि फ्लास्क में रखे पदार्थ एवं परिवेश में ऊष्मा का विनिमय नहीं होता है) 273 K तथा वायुमंडलीय दाब पर साम्यावस्था में होते हैं। यह निकाय रोचक अभिलक्षणों को दर्शाता है। हम यहाँ देखते हैं कि समय के साथ-साथ बर्फ तथा जल के द्रव्यमानों का कोई परिवर्तन नहीं होता है तथा ताप स्थिर रहता है, परंतु साम्यावस्था स्थैतिक नहीं है। बर्फ़ एवं जल के मध्य अभी भी तीव्र प्रतिक्रियाएँ होती हैं। द्रव जल के अणु बर्फ से टकराकर उसमें समाहित हो जाते हैं तथा बर्फ़ के कुछ अणु द्रव प्रावस्था में चले जाते हैं। बर्फ एवं जल के द्रव्यमानों में कोई परिवर्तन नहीं होता है, क्योंकि जल-अणुओं की बर्फ से जल में स्थानांतरण की दर तथा जल से बर्फ में स्थानांतरण की दर 273 K और एक वायुमंडलीय दाब पर बराबर होती है।
यह स्पष्ट है कि बर्फ एवं जल केवल किसी विशेष ताप एवं दाब पर ही साम्यावस्था में होते हैं। वायुमंडलीय दाब पर किसी शुद्ध पदार्थ के लिए वह ताप, जिसपर ठोस एवं द्रव प्रावस्थाएँ साम्यावस्था में होती हैं, पदार्थ का ‘मानक गलनांक’ या ‘मानक हिमांक’ कहलाता है। यह निकाय दाब के साथ केवल थोड़ा-सा ही परिवर्तित होता है। इस प्रकार यह निकाय गतिक साम्यावस्था में होता है। इससे निम्नलिखित निष्कर्ष प्राप्त होते हैं –
(i) दोनों विरोधी प्रक्रियाएँ साथ-साथ होती हैं।
(ii) दोनों प्रक्रियाएँ समान दर से होती हैं। इससे बर्फ़ एवं जल का द्रव्यमान स्थिर रहता है।
7.1.2 द्रव-वाष्प साम्यावस्था
इस तथ्य को निम्नलिखित प्रयोग के माध्यम से समझा जा सकता है। एक U आकार की नलिका, जिसमें पारा भरा हो (मैनोमीटर), को एक काँच (या प्लास्टिक) के पारदर्शी बॉक्स से जोड़ देते हैं। बॉक्स में एक वाच ग्लास या पैट्री डिश में निर्जलीय कैल्सियम क्लोराइड (या फॉस्फोरस पेंटाअॉक्साइड) जैसा जलशोषक रखकर बॉक्स की वायु को कुछ घंटों तक सुखाया जाता है। इसके पश्चात् जलशोषक को बाहर निकाल लिया जाता है। बॉक्स को एक तरफ टेढ़ाकर उसमें जलसहित एक वाच ग्लास (या पेट्री डीश) को शीघ्र रख दिया जाता है। मैनोमीटर को देखने पर पता चलता है कि कुछ समय पश्चात् इसकी दाईं भुजा में पारा धीरे-धीरे बढ़ता है और अंततः स्थिर हो जाता है, अर्थात् बॉक्स में दाब पहले बढ़ता है और फिर स्थिर हो जाता है। वाच ग्लास में लिये गए जल का आयतन भी कम हो जाता है (चित्र 7.1)। प्रारंभ में बॉक्स में जलवाष्प नहीं होती है या थोड़ी सी हो सकती है, किंतु जब जल का वाष्पन होने से गैसीय प्रावस्था में जल-अणुओं के बदलने के कारण वाष्प-दाब बढ़ जाता है, तब वाष्पन होने की दर स्थिर रहती है। समय के साथ-साथ दाब की वृद्धि-दर में कमी होने लगती है। जब साम्य स्थापित हो जाता है तो प्रभावी-वाष्पन नहीं होता है। इसका तात्पर्य यह है, कि जैसे-जैसे जल के अणुओं की संख्या गैसीय अवस्था में बढ़ने लगती है, वैसे-वैसे गैसीय अवस्था से जल के अणुओं की द्रव-अवस्था में संघनन की दर साम्यावस्था स्थापित होने तक बढ़ती रहती है। अर्थात्–
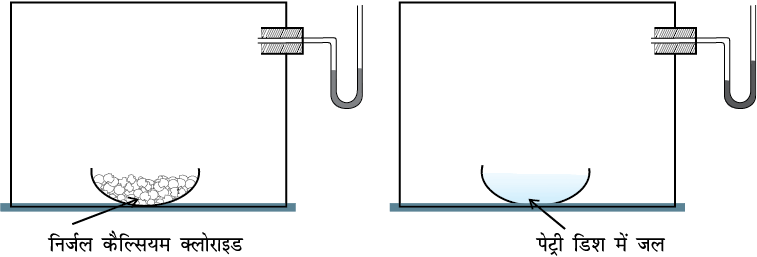
चित्र 7.1: स्थिर ताप पर जल की साम्यावस्था का वाष्प-दाब मापन
सामयावस्था पर: वाष्पन की दर ⇌ संघनन की दर
H2O (जल) ⇌ H2O (वाष्प)
साम्यावस्था में जल-अणुओं द्वारा उत्पन्न दाब किसी दिए ताप पर स्थिर रहता है, इसे जल का साम्य वाष्प दाब, (या जल का वाष्प-दाब) कहते हैं। द्रव का वाष्प-दाब ताप के साथ बढ़ता है। यदि यह प्रयोग मेथिल एेल्कोहॉल, एेसीटोन तथा ईथर के साथ दोहराया जाए, तो यह प्रेक्षित होता है कि इनके साम्य वाष्प-दाब विभिन्न होते हैं। अपेक्षाकृत उच्च वाष्प दाब वाला द्रव अधिक वाष्पशील होता है एवं उसका क्वथानांक कम होता है।
यदि तीन वाच-ग्लासों में एेसीटोन, एथिल एेल्कोहॉल एवं जल में प्रत्येक का 1 mL वायुमंडल में खुला रखा जाए तथा इस प्रयोग को एक गरम कमरे में इन द्रवों के भिन्न-भिन्न आयतनों के साथ दोहराया जाए तो हम यह पाएँगे कि इन सभी प्रयोगों में द्रव का पूर्ण वाष्पीकरण हो जाता है। पूर्ण वाष्पन का समय (i) द्रव की प्रकृति, (ii) द्रव की मात्रा तथा (iii) ताप पर निर्भर करता है। जब वाच ग्लास को वायुमंडल में खुला रखा जाता है। तो वाष्पन की दर तो स्थिर रहती है, परंतु वाष्प के अणु कमरे के पूरे आयतन में फैल जाते हैं। अतः वाष्प से द्रव-अवस्था में संघनन की दर वाष्पन की दर से कम होती है। इसके परिणामस्वरूप संपूर्ण द्रव वाष्पित हो जाता है। यह एक खुले निकाय का उदाहरण है। खुले निकाय में साम्यावस्था की स्थापना होना संभव नहीं है।
बंद पात्र में जल एवं जल-वाष्प एक वायुमंडलीय दाब (1.013 bar) तथा 100°C ताप पर साम्य स्थिति में हैं। 1.013 bar दाब पर जल का सामान्य क्वथनांक 100°C है।
किसी शुद्ध द्रव के लिए एक वायुमंडलीय दाब (1.013 bar) पर वह ताप, जिसपर द्रव एवं वाष्प साम्यावस्था में हों, ‘द्रव का सामान्य क्वथनांक’ कहलाता है। द्रव का क्वथनांक वायुमंडलीय दाब पर निर्भर करता है। यह स्थान के उन्नतांश (ऊँचाई) पर भी निर्भर करता है। अधिक उन्नतांश पर द्रव का क्वथनांक घटता है।
7.1.3 ठोस-वाष्प साम्यावस्था
अब हम एेसे निकायों पर विचार करेंगे, जहाँ ठोस वाष्प अवस्था में ऊर्ध्वपातित होते हैं। यदि हम आयोडीन को एक बंद पात्र में रखें, तो कुछ समय पश्चात् पात्र बैगनी वाष्प से भर जाता है तथा समय के साथ-साथ रंग की तीव्रता में वृद्धि होती है। परंतु कुछ समय पश्चात् रंग की तीव्रता स्थिर हो जाती है। इस स्थिति में साम्यावस्था स्थापित हो जाती है। अतः ठोस आयोडीन ऊर्ध्वपातित होकर आयोडीन वाष्प देती है तथा साम्यावस्था को इस रूप में दर्शाया जा सकता है –
I2 (ठोस) ⇌ I2 (वाष्प)
इस प्रकार के साम्य के अन्य उदाहरण हैंः
कपूर (ठोस) ⇌ कपूर (वाष्प)
NH4Cl (ठोस) ⇌ NH4Cl (वाष्प)
7.1.4 द्रव में ठोस अथवा गैस की घुलनशीलता- संबंधी साम्य
द्रवों में ठोस
हम अपने अनुभव से यह जानते हैं कि दिए गए जल की एक निश्चित मात्रा में सामान्य ताप पर लवण या चीनी की एक सीमित मात्रा ही घुलती है। यदि हम उच्च ताप पर चीनी की चाशनी बनाएं और उसे ठंडा करें, तो चीनी के क्रिस्टल पृथक् हो जाएंगे। किसी ताप पर दिए गए विलयन में यदि और अधिक विलेय न घुल सके, तो एेसे विलयन को ‘संतृप्त विलयन, (Saturated) कहते हैं। विलेय की विलेयता ताप पर निर्भर करती है। संतृप्त विलयन में अणुओं की ठोस अवस्था एवं विलेय के विलयन में अणुओं के बीच गतिक साम्यावस्था रहती है।
चीनी (विलयन) ⇌ चीनी (ठोस)
तथा साम्यावस्था में,
चीनी के घुलने की दर = चीनी के क्रिस्टलन की दर
रेडियोएेक्टिवतायुक्त चीनी की सहायता से उपरोक्त दरों एवं साम्यावस्था की गतिक प्रकृति को सिद्ध किया गया है। यदि हम रेडियोएक्टिवताहीन (Non-radioactive) चीनी के संतृप्त विलयन में रेडियोएेक्टिवता युक्त चीनी की कुछ मात्रा डाल दें, तो कुछ समय बाद हमें दोनों विलयन एवं ठोस चीनी, जिसमें प्रारंभ में रेडियोएेक्टिवता युक्त चीनी के अणु नहीं थे, किंतु साम्यावस्था की गतिक प्रकृति के कारण रेडियोएेक्टिवतायुक्त एवं रेडियोएेक्टिवताहीन चीनी के अणुओं का विनियम दोनों प्रावस्थाओं में होता है। इसलिए रेडियोएेक्टिव एवं रेडियोएेक्टिवतायुक्त चीनी अणुओं का अनुपात तब तक बढ़ता रहता है, जब तक यह एक स्थिर मान तक नहीं पहुँच जाता।
द्रवों में गैसें
जब सोडा-वाटर की बोतल खोली जाती है, तब उसमें घुली हुई कार्बन डाइअॉक्साइड गैस की कुछ मात्रा तेजी से बाहर निकलने लगती है। भिन्न दाब पर जल में कार्बन डाइअॉक्साइड की भिन्न विलेयता के कारण एेसा होता है। स्थिर ताप एवं दाब पर गैस के अविलेय अणुओं एवं द्रव में घुले अणुओं के बीच साम्यावस्था स्थापित रहती है। उदाहरणार्थ–
CO2 (गैस) ⇌ CO2 (विलयन में)
यह साम्यावस्था हेनरी के नियमानुसार है। जिसके अनुसार, "किसी ताप पर दी एक गई मात्रा के विलायक में घुली हुई गैस की मात्रा विलायक के ऊपर गैस के दाब के समानुपाती होती है।" ताप बढ़ने के साथ-साथ यह मात्रा घटती जाती है। CO2 गैस को सोडा-वाटर की बोतल में अधिक दाब पर सीलबंद किया है। इस दाब पर गैस के बहुत अधिक अणु द्रव में विलेय हो जाते हैं। जैसे ही बोतल खोली जाती है। वैसे ही बोतल के द्रव की सतह पर दाब अचानक कम हो जाता है, जिससे जल में घुली हुई कार्बन डाइअॉक्साइड निकलकर निम्न वायुमंडलीय दाब पर नई साम्यावस्था की ओर अग्रसर होती है। यदि सोडा-वाटर की इस बोतल को कुछ समय तक हवा में खुला छोड़ दिया जाए, तो इसमें से लगभग सारी गैस निकल जाएगी।
यह सामान्य रूप से कहा जा सकता है कि–
(i) ठोस ⇌ द्रव, साम्यावस्था के लिए वायुमंडलीय दाब पर (1.013 bar) एक ही ताप (गलनांक) एेसा होता है, जिसपर दोनों प्रावस्थाएँ पाई जाती हैं। यदि परिवेश से ऊष्मा का विनिमय न हो, तो दोनों प्रावस्थाओं के द्रव्यमान स्थिर होते हैं।
(ii) वाष्प ⇌ द्रव, साम्यावस्था के लिए किसी निश्चित ताप पर वाष्प-दाब स्थिर होता है।
(iii) द्रव में ठोस की घुलनशीलता के लिए किसी निश्चित ताप पर द्रव में ठोस की विलेयता निश्चित होती है।
(iv) द्रव में गैस की विलेयता द्रव के ऊपर गैस के दाब (सांद्रता) के समानुपाती होती है।
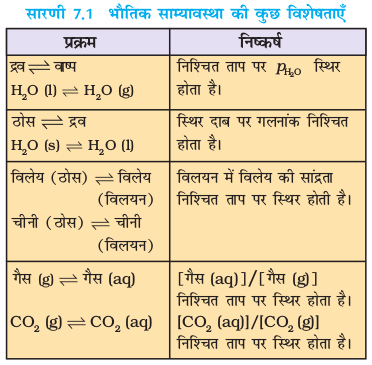
इन निष्कर्षों को सारणी 7.1 में दिया गया है –
7.1.5 भौतिक प्रक्रमों में साम्यावस्था के सामान्य अभिलक्षण
उपरोक्त भौतिक प्रक्रमों में सभी निकाय-साम्यावस्था के सामान्य अभिलक्षण निम्नलिखित हैंः
(i) निश्चित ताप पर केवल बंद निकाय (Closed System) में ही साम्यावस्था संभव है।
(ii) साम्यावस्था पर दोनों विरोधी अभिक्रियाएँ बराबर वेग से होती हैं। इनमें गतिक, किंतु स्थायी अवस्था होती है।
(iii) निकाय के सभी मापने योग्य गुण-धर्म स्थिर होते हैं।
(iv) जब किसी भौतिक प्रक्रम में साम्यावस्था स्थापित हो जाती है, तो सारणी 7.1 में वर्णित मापदंडों में से किसी एक का मान निश्चित ताप पर स्थिर होना वर्णित साम्यावस्था की पहचान है।
(v) किसी भी समय इन राशियों का मान यह दर्शाता है कि साम्यावस्था तक पहुँचने के पूर्व भौतिक प्रक्रम किस सीमा तक आगे बढ़ चुका है।
7.2 रासायनिक प्रक्रमों में साम्यावस्था-गतिक साम्य
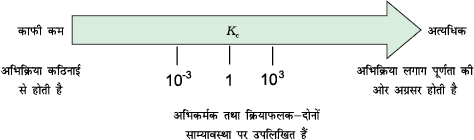
यह पहले ही बताया जा चुका है कि बंद निकाय में की जाने वाली रासायनिक अभिक्रियाएँ अंततः साम्यावस्था की स्थिति में पहुँच जाती हैं। ये अभिक्रियाएँ भी अग्रिम तथा प्रतीप दिशाओं में संपन्न हो सकती हैं। जब अग्रिम एवं प्रतीप अभिक्रियाओं की दरें समान हो जाती हैं, तो अभिकारकों तथा उत्पादों की सांद्रताएँ स्थिर रहती हैं। यह रासायनिक साम्य की अवस्था है। यह गतिक साम्यावस्था अग्र अभिक्रिया (जिसमें अभिकारक उत्पाद में बदल जाते हैं) तथा प्रतीप अभिक्रिया (जिसमें उत्पाद मूल अभिकारक में बदल जाते हैं) से मिलकर उत्पन्न होती है। इसे समझने के लिए हम निम्नलिखित उत्क्रमणीय अभिक्रिया पर विचार करें (चित्र 7.2)–
A + B ⇌ C + D
समय बीतने के साथ अभिकारकों (A तथा B) की सांद्रता घटती है तथा उत्पादों (C तथा D) का संचयन होता है। अग्र अभिक्रिया की दर घटती जाती है और प्रतीप अभिक्रिया की दर बढ़ती जाती है। फलस्वरूप एक एेसी स्थिति आती है, जब दोनों अभिक्रियाओं की दर समान हो जाती है। एेसी स्थिति में निकाय में साम्यावस्था स्थापित हो जाती है। यही साम्यावस्था C तथा D के बीच अभिक्रिया कराकर भी प्राप्त की जा सकती है। दोनों में से किसी भी दिशा से इस साम्यावस्था की प्राप्यता संभव है।
A + B ⇌ C + D या C + D ⇌ A + B
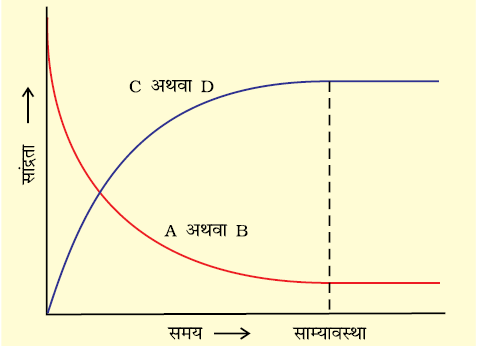
चित्र 7.2: रासायनिक साम्यावस्था की प्राप्ति
हाबर-विधि द्वारा अमोनिया के संश्लेषण में रासायनिक साम्यावस्था की गतिक प्रकृति को दर्शाया जा सकता है। हाबर ने उच्च ताप तथा दाब पर डाइनाइट्रोजन तथा डाइहाइड्रोजन की विभिन्न ज्ञात मात्राओं के साथ अभिक्रिया कराकर नियमित अंतराल पर अमोनिया की मात्रा ज्ञात की। इसके आधार पर उन्होंने अभिक्रिया में शेष डाइनाइट्रोजन तथा डाइहाइड्रोजन की सांद्रता ज्ञात की। चित्र 7.4, (पेज 195) दर्शाता है कि एक निश्चित समय के बाद कुछ अभिकारकों के शेष रहने पर भी अमोनिया का सांद्रण एवं मिश्रण का संघटन वही बना रहता है। मिश्रण के संघटन की स्थिरता इस बात का संकेत देती है कि साम्यावस्था स्थापित हो गई है। अभिक्रिया की गतिक प्रकृति को समझने के लिए अमोनिया का संश्लेषण उन्हें करीब-करीब प्रारंभिक परिस्थितियों (उसी आंशिक दाब एवं ताप पर), किंतु H2 की जगह D2 (Deuterium) लेकर किया गया। H2 या D2 के साथ अभिक्रिया कराने पर साम्यावस्था पर समान संघटनवाला अभिक्रिया-मिश्रण प्राप्त होता है, किंतु अभिक्रिया-मिश्रण में H2 एवं NH3 के स्थान पर क्रमशः D2 एवं ND3 मौज़ूद रहते हैं। साम्यावस्था स्थापित होने के बाद दोनों मिश्रण (जिसमें H2, N2, NH3 तथा D2, N2, ND3 होते हैं) को आपस में मिलाकर कुछ समय के लिए छोड़ देते हैं। बाद में इस मिश्रण का विश्लेषण करने पर पता चलता है कि अमोनिया की सांद्रता अपरिवर्तित रहती है।
हालाँकि जब इस मिश्रण का विश्लेषण द्रव्यमान स्पेक्ट्रोमीटर (Mass Spectrometer) द्वारा किया जाता है, तो इसमें ड्यूटीरियमयुक्त विभिन्न अमोनिया अणु (NH3, NH2D, NHD2 तथा ND3) एवं डाइहाइड्रोजन अणु (H2, HD तथा D2) पाए जाते हैं। इससे यह निष्कर्ष निकलता है कि साम्यावस्था के बाद भी मिश्रण में अग्रिम एवं प्रतीप अभिक्रियाएँ होते रहने के कारण अणुओं में H तथा D परमाणुओं का व्यामिश्रण (Scrambling) होता रहता है। साम्यावस्था स्थापित होने के बाद यदि अभिक्रिया समाप्त हो जाती है, तो इस प्रकार का मिश्रण प्राप्त होना संभव नहीं होता।
अमोनिया के संश्लेषण में समस्थानिक (Deuterium) के प्रयोग से यह स्पष्ट होता है कि रासायनिक अभिक्रियाओं में गतिक साम्यावस्था स्थापित होने पर अग्रिम एवं प्रतीप अभिक्रियाओं की दर समान होती है तथा इसके मिश्रण के संघटन में कोई प्रभावी परिवर्तन नहीं होता है।
साम्यावस्था दोनों दिशाओं द्वारा स्थापित की जा सकती है, चाहे H2(g) तथा N2(g) की अभिक्रिया कराकर NH3(g) प्राप्त की जाए या NH3(g) का विघटन कराकर N2(g) एवं H2(g) प्राप्त की जाए।
गतिक साम्यावस्था–छात्रों के लिए एक प्रयोग
भौतिक या रासायनिक अभिक्रियाओं में साम्यावस्था की प्रकृति हमेशा गतिक होती है। रेडियोएेक्टिव समस्थानिकों के प्रयोग द्वारा इस तथ्य को प्रदर्शित किया जा सकता है। किंतु किसी विद्यालय की प्रयोगशाला में इसे प्रदर्शित करना संभव नहीं है। निम्नलिखित प्रयोग करके इस तथ्य को 5-6 विद्यार्थियों के समूह को आसानी से दिखाया जा सकता है –
100 mL के दो मापन सिलिंडर (जिनपर 1 तथा 2 लिखा हो) एवं 30 cm लंबी काँच की दो नलियाँ लीजिए। नलियों का व्यास या तो समान हो सकता है या उनमें 3 से 5 mm तक भिन्नता हो सकती है। मापन सिलिंडर-1 के आधे भाग में रंगीन जल (जल में पोटैशियम परमैंगनेट का एक क्रिस्टल डालकर रंगीन जल बनाएँ) भरते हैं तथा सिलिंडर-2 को खाली रखते हैं। सिलिंडर-1 में एक नली तथा सिलिंडर-2 में दूसरी नली रखते हैं। सिलिंडर-1 वाली नली के ऊपरी छिद्र को अंगुली से बंद करें एवं इसके निचले हिस्से में भरे गए जल को सिलिंडर-2 में डालें। सिलिंडर-2 में रखी नली का प्रयोग करते हुए उसी प्रकार सिलिंडर-2 से सिलिंडर-1 में जल स्थानांतरित करें। इस प्रकार दोनों नलियों की सहायता से सिलिंडर-1 से सिलिंडर-2 में एवं सिलिंडर-2 से सिलिंडर-1 में रंगीन जल बार-बार तब तक स्थानांतरित करते हैं। जब तक दोनों सिलिंडरों में रंगीन जल का स्तर समान हो जाए।
यदि इन दो सिलिंडरों में रंगीन विलयन का स्थानांतरण एक से दूसरे में करते, तो इन सिलिंडरों में रंगीन जल के स्तर में अब कोई परिवर्तन नहीं होगा। यदि इन दो सिलिंडरों में रंगीन जल के स्तर को हम क्रमशः अभिकारकों एवं उत्पादों के सांद्रण के रूप में देखें तो हम कह सकते हैं कि यह प्रक्रिया इस प्रक्रिया की गतिक प्रकृति को इंगित करती है, जो रंगीन जल का स्तर स्थायी होने पर भी जारी रहती है। यदि हम इस प्रयोग को विभिन्न व्यासवाली दो नलियों की सहायता से दोहराएँ, तो हम देखेंगे कि इन दो सिलिंडरों में रंगीन जल के स्तर भिन्न होंगे। इन दो सिलिंडरों में रंगीन जल के स्तर में अंतर भिन्न व्यास की नलियों के कारण होता है।
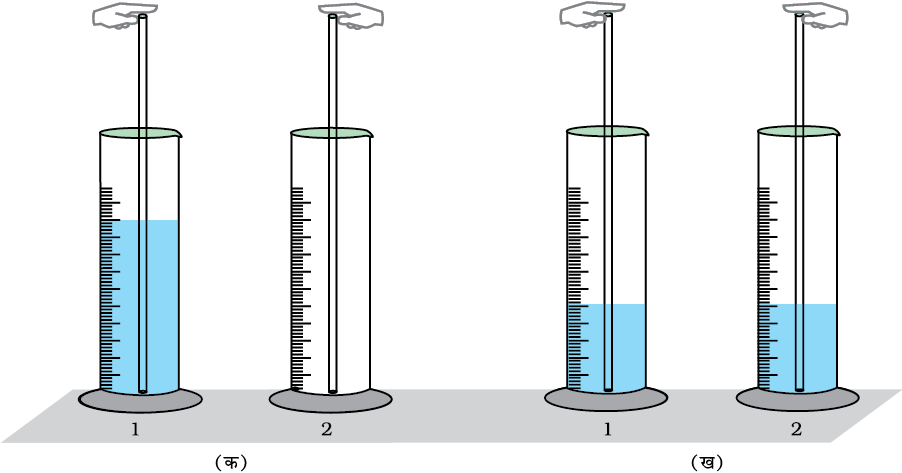
चित्र 7.3 गतिक साम्यावस्था का प्रदर्शन (क) प्रारंभिक अवस्था (ख) अंतिम अवस्था
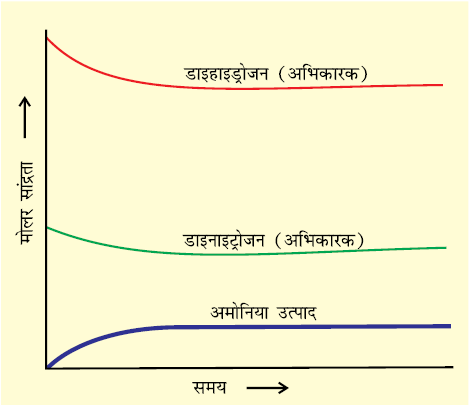
चित्र 7.4: अभिक्रिया N2(g) + 3H2(g) ⇌ 2NH3(g) की साम्यावस्था का निरूपण
N2(g) + 3H2(g) ⇌ 2NH3(g)
2NH3(g) ⇌ N2(g) + 3H2(g)
इसी प्रकार हम अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) पर विचार करें। यदि हम H2 एवं I2 के बराबर-बराबर प्रारंभिक सांद्रण से अभिक्रिया शुरू करें, तो अभिक्रिया अग्रिम दिशा में अग्रसर होगी। H2 एवं I2 की सांद्रता कम होने लगेगी है एवं HI का सांद्रता बढ़ने लगेगी, जब तक साम्यावस्था स्थापित न हो जाए (चित्र 7.5)। अगर हम HI से शुरू कर अभिक्रिया को विपरीत दिशा में होने दें, तो HI की सांद्रता कम होने लगेगी। तथा H2 एवं I2 की सांद्रता तब तक बढ़ती रहेगी जब तक साम्यावस्था स्थापित न हो जाए (चित्र 7.5)।
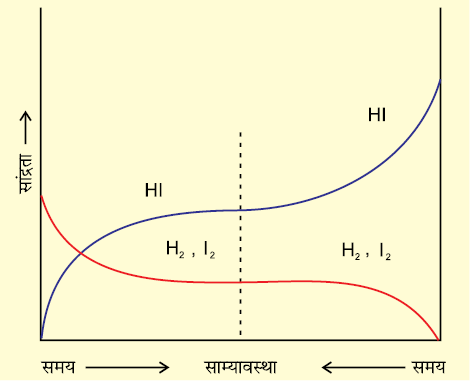
चित्र 7.5: H2(g) + I2(g) ⇌ 2HI(g) अभिक्रिया में रासायनिक साम्यावस्था किसी भी दिशा से स्थापित हो सकती है।
यदि निश्चित आयतन में H एवं I के परमाणुओं की कुल संख्या वही हो, तो चाहे हम शुद्ध अभिकर्मकों से अभिक्रिया शुरू करें, या शुद्ध उत्पादों से वही साम्यावस्था मिश्रण प्राप्त होता है।
7.3 रासायनिक साम्यावस्था का नियम तथा साम्यावस्था स्थिरांक
साम्यावस्था में अभिकारकों एवं उत्पादों के मिश्रण को ‘साम्य मिश्रण’ कहते हैं। एकक के इस भाग में साम्य मिश्रण के संघटन के संबंध में अनेक प्रश्नों पर हम विचार करेंगे। ∆Gएक साम्य मिश्रण में अभिकारकों तथा उत्पादों की सांद्रताओं में क्या संबंध है? प्रारंभिक सांद्रताओं से साम्य सांद्रताओं को कैसे ज्ञात किया जा सकता है? साम्य मिश्रण के संघटन को कौन से कारक परिवर्तित कर सकते हैं? औद्योगिक दृष्टि से उप ∆Gयोगी रसायन जैसे – (H2, NH3 तथा CaO) के संश्लेषण के लिए आवश्यक शर्तों का निर्धारण कैसे किया जाता है?
इन प्रश्नों के उत्तर के लिए हम निम्नलिखित सामान्य उत्क्रमणीय अभिक्रिया पर विचार करेंगे –
A + B ⇌ C + D
यहाँ इस संतुलित समीकरण में A तथा B अभिकारक एवं C तथा D उत्पाद हैं। अनेक उत्क्रमणी अभिक्रियाओं के प्रायोगिक अध्ययन के आधार पर नॉर्वे के रसायनज्ञों कैटो मैक्सिमिलियन गुलबर्ग (Cato Maximillian Guldberg) एवं पीटर वाजे (Peter Waage) ने सन् 1864 में प्रतिपादित किया कि किसी मिश्रण में सांद्रताओं को निम्नलिखित साम्य-समीकरण द्वारा दर्शाया जा सकता है–

यहाँ Kc साम्य स्थिरांक है तथा दाईं ओर का व्यंजक ‘साम्य स्थिरांक व्यंजक’ कहलाता है। इस साम्य-समीकरण को ‘द्रव्य अनुपाती क्रिया का नियम’ (Law of Mass Action) भी कहते हैं।
गुलबर्ग तथा वाजे द्वारा प्रतिपादित सुझावों को अच्छी तरह समझने के लिए एक मुँहबंद पात्र (Sealed Vessel) में 731 K पर गैसीय H2 एवं गैसीय I2 के बीच अभिक्रिया पर विचार करें। इस अभिक्रिया का अध्ययन विभिन्न प्रायोगिक परिस्थितियों में छः प्रयोगों द्वारा किया गया–
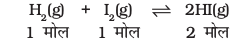
पहले चार (1, 2, 3 तथा 4) प्रयोगों में प्रारंभ में बंद पात्रों में केवल गैसीय H2 एवं गैसीय I2 थे। प्रत्येक प्रयोग हाइड्रोजन एवं आयोडीन के भिन्न-भिन्न सांद्रण के साथ किया गया। कुछ समय बाद बंद पात्र में मिश्रण के रंग की तीव्रता स्थिर हो गई, अर्थात्–साम्यावस्था स्थापित हो गई। अन्य दो प्रयोग (सं. 5 एवं 6) केवल गैसीय HI लेकर प्रारंभ किए गए। इस प्रकार विपरीत अभिक्रिया से साम्यावस्था स्थापित हुई। सारणी 7.2 में इन सभी छः प्रयोगों के आँकड़े दिए गए हैं।
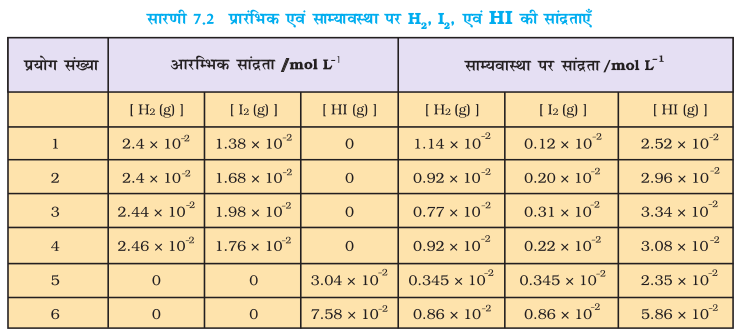
प्रयोग-संख्या 1, 2, 3 एवं 4 से यह देखा जा सकता है कि– अभिकृत H2 के मोल की संख्या = अभिकृत I2 के मोल की संख्या = ½ (उत्पाद HI के मोल की संख्या)
प्रयोग-संख्या 5 तथा 6 में हम देखते हैं कि–
[H2(g)]eq = [I2(g)]eq
साम्यावस्था पर अभिकारकों एवं उत्पादों की सांद्रता के बीच संबंध स्थापित करने के लिए हम कई संभावनाओं के विषय में सोच सकते हैं। नीचे दिए गए सामान्य व्यंजक पर हम
विचार करें–
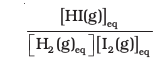
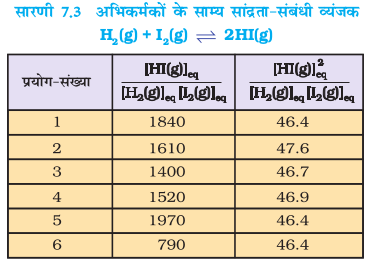
सारणी 7.3 में दिए गए आँकड़ों की सहायता से यदि हम अभिकारकों एवं उत्पादों की साम्यावस्था-सांद्रता को उपरोक्त व्यंजक में रखें, तो उस व्यंजक का मान स्थिर नहीं, बल्कि भिन्न-भिन्न होगा (सारणी 7.3)। यदि हम निम्नलिखित व्यंजक लें–

तो हम पाएँगे कि सभी छः, प्रयोगों में यह व्यंजक स्थिर मान देता हैै (जैसा सारणी 7.3 में दिखाया गया है)। यह देखा जा सकता है कि इस व्यंजक में अभिकारकों एवं उत्पाद के सांद्रणों में घात (Power) का मान वही है, जो रासायनिक अभिक्रिया के समीकरण में लिखे उनके रससमीकरणमितीय गुणांक (Stoichiometric Coefficients) हैं। साम्यावस्था में इस व्यंजक के मान को ‘साम्यावस्था स्थिरांक’ कहा जाता है तथा इसे 'Kc' प्रतीक द्वारा दर्शाया जाता है। इस प्रकार अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) के लिए Kc, अर्थात् साम्यावस्था स्थिरांक को इस रूप में लिखा जाता है–
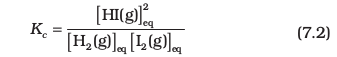
ऊपर दिए गए व्यंजक, सांद्रता के पादांक के रूप में जो 'eq' लिखा गया है, वह सामान्यतः नहीं लिखा जाता है, क्योंकि यह माना जाता है कि Kc के व्यंजक में सांद्रता का मान साम्यावस्था पर ही है। अतः हम लिखते हैं–
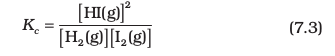
पदांक 'c' इंगित करता है कि Kc का मान सांद्रण के मात्रक mol L–1 में व्यक्त किया जाता है।
दिए गए किसी ताप पर अभिक्रिया-उत्पादों की सांद्रता एवं अभिकारकों की सांद्रता के गुणनफल का अनुपात स्थिर रहता है। एेसा करते समय सांद्रता व्यक्त करने के लिए संतुलित रासायनिक समीकरण में अभिकारकों एवं उत्पादों के रस समीकरणमितीय गुणांक को उनकी सांद्रता के घातांक के रूप में व्यक्त किया जाता है।
इस प्रकार एक सामान्य अभिक्रिया aA + bB ⇌ cC + cD के लिए साम्यावस्था स्थिरांक को निम्नलिखित व्यंजक से व्यक्त किया जाता है–

अभिक्रिया उत्पाद (C या D) अंश में तथा अभिकारक (A तथा B) हर में होते हैं। प्रत्येक सांद्रता (उदाहरणार्थ– [C], [D] आदि) को संतुलित अभिक्रिया में रससमीकरणमितीय अनुपात गुणांक के घातांक के रूप में व्यक्त किया जाता है। जैसे– 4NH3 + 5O2 (g) ⇌ 4NO(g) + 6H2O(g) अभिक्रिया के लिए साम्यावस्था स्थिरांक को हम इस रूप में व्यक्त
करते हैं–
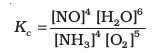
विभिन्न अवयवों (Species) की मोलर-सांद्रता को उन्हें वर्गाकार कोष्ठक में रखकर दर्शाया जाता है तथा यह माना जाता है कि ये साम्यावस्था सांद्रताएँ हैं। जब तक बहुत आवश्यक न हो, तब तक साम्यावस्था स्थिरांक के व्यंजक में प्रावस्थाएँ (ठोस, द्रव या गैस) नहीं लिखी जाती हैं।
हम रससमीकरणमितीय अनुपात गुणांक बदल देते हैं, जैसे– यदि पूरे अभिक्रिया समीकरण को किसी घटक (Factor) से गुणा करें, तो साम्यावस्था स्थिरांक के लिए व्यंजक लिखते समय यह सुनिश्चित करना चाहिए कि वह व्यंजक उस परिवर्ततन को भी व्यक्त करे।
अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) (7.5)
के साम्यावस्था व्यंजक को इस प्रकार लिखते हैं–

तो प्रतीप अभिक्रिया 2HI(g) ⇌ H2(g) + I2(g) के लिए साम्यावस्था-स्थिरांक उसी ताप पर इस प्रकार होगा–
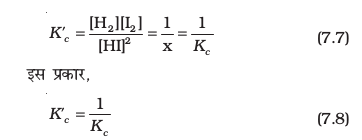
उत्क्रम अभिक्रिया का साम्यावस्था स्थिरांक अग्रिम अभिक्रिया के साम्यावस्था स्थिरांक के व्युत्क्रम होता है।
उपरोक्त अभिक्रिया को इस रूप में लिखने पर
½ H2(g) + ½ I2(g) ⇌ HI(g) (7.9)
साम्यावस्था स्थिरांक का मान होगा
सारणी 7.5 में कुछ चयनित अभिक्रियाओं के साम्यावस्था स्थिरांक Kp के मान
K″c = [HI] / [H2]1/2[I2]1/2 = x1/2 = Kc1/2 (7.10)
इस प्रकार यदि हम समीकरण 7.5 को n से गुणा करें, तो अभिक्रिया nH2(g) + nI2(g) ⇌ 2nHI(g) प्राप्त होगी तथा इसके साम्यावस्था-स्थिरांक का मान Kcn होगा। इन परिणामों को सारणी 7.4 में सारांशित किया गया है।
सारणी 7.4 एक सामान्य उत्क्रमणीय अभिक्रिया के साम्यावस्था स्थिरांकों एवं उनके गुणकाें में संबंध
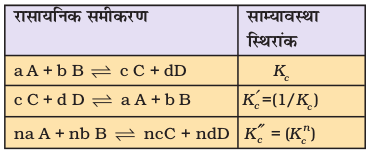
यहाँ यह ध्यान रखना चाहिए कि Kc व K'c के आंकिक मान भिन्न होते हैं। इसलिए यह आवश्यक है कि साम्य-अवस्था स्थिरांक का मान लिखते समय संतुलित रासायनिक समीकरण का उल्लेख करें।
उदाहरण 7.1
500 K पर N2 तथा H2 से NH3 बनने के दौरान साम्यावस्था में निम्नलिखित सांद्रताएँ प्राप्त हुईंः
[N2] = 1.5 × 10–2 M, [H2] = 3.0 ×10–2 M तथा [NH3] = 1.2 ×10–2 M. साम्यावस्था स्थिरांक की गणना कीजिए।
हल
अभिक्रिया N2(g) + 3H2(g) ⇌ 2NH3(g) के लिए साम्य स्थिरांक इस रूप में लिखा जा सकता है–
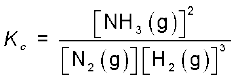
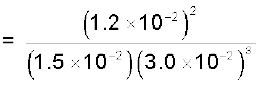
= 0.106 × 104 = 1.06 × 103
उदाहरण 7.2
800 K पर अभिक्रिया N2(g) + O2(g) ⇌ 2NO(g) के लिए साम्यावस्था सांद्रताएँ निम्नलिखित हैं–
N2=3.0 × 10–3M, O2 = 4.2 × 10–3M
तथा NO = 2.8 × 10–3M
अभिक्रिया के लिए Kc का मान क्या होगा?
हल
अभिक्रिया के लिए साम्य स्थिरांक इस प्रकार लिखा जा सकता है–

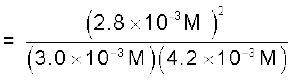 = 0.622
= 0.622
7.4 समांग साम्यावस्था
किसी समांग निकाय में सभी अभिकारक एवं उत्पाद एक समान प्रावस्था में होते हैं। उदाहरण के लिए–गैसीय अभिक्रिया N2(g) + 3H2(g) ⇌ 2NH3(g) में अभिकारक तथा उत्पाद सभी समांग गैस-प्रावस्था में हैं।
इसी प्रकार
CH3COOC2H5 (aq) + H2O (l) ⇌ CH3COOH (aq)
+ C2H5OH (aq)
तथा Fe3+ (aq) + SCN–(aq) ⇌ Fe(SCN)2+ (aq) अभिक्रियाओं में सभी अभिकारक तथा उत्पाद संमाग विलयन-प्रावस्था में हैं। अब हम कुछ समांग अभिक्रियाओं के साम्यावस्था-स्थिरांक के बारे में पढ़ेंगे।
7.4.1 गैसीय निकाय में साम्यावस्था स्थिरांक ( Kp )
हमने अभी तक अभिकारकों एवं उत्पादों के मोलर सांद्रण के रूप में साम्यावस्था स्थिरांक को व्यक्त किया है तथा इसे प्रतीक Kc द्वारा दर्शाया है। गैसीय अभिक्रियाओं के लिए साम्यावस्था स्थिरांक को आंशिक दाब के रूप में प्रदर्शित करना अधिक सुविधाजनक है।
आदर्श गैस-समीकरण (एकक-2) को हम इस रूप में व्यक्त करते हैं–
pV = nRT
या
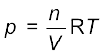
यहाँ दाब (p) को bar में, गैस की मात्रा को मोलों की संख्या 'n' द्वारा आयतन, 'V' को लिटर (L) में तथा ताप को केल्विन (K) में व्यक्त करने पर 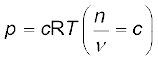 स्थिरांक 'R' का मान 0.0831 bar L mol–1K–1 होता है।
स्थिरांक 'R' का मान 0.0831 bar L mol–1K–1 होता है।
जब n/V को हम mol/L में व्यक्त करते हैं, तो यह सांद्रण 'c' दर्शाता है। अतः
p = cRT
स्थिर ताप पर गैस का दाब उसके सांद्रण के समानुपाती होता है, अर्थात् p α [गैस] अतः उक्त संबंध को
p = [गैस] RT के रूप में भी लिखा जा सकता है।
साम्यावस्था में अभिक्रिया H2(g) + I2(g) ⇌ 2HI(g) के लिए 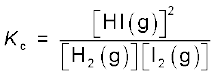
अथवा 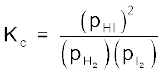 (7.12)
(7.12)
चूँकि 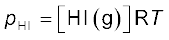
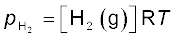
तथा 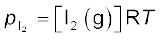
इसलिए 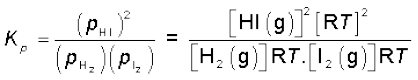
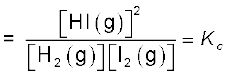 (7.13)
(7.13)
उपरोक्त उदाहरण में Kp = Kc, हैं अर्थात्दो नों साम्यावस्था स्थिरांकों के मान बराबर हैं, किंतु यह हमेशा सत्य नहीं होता है।
उदाहरण के लिए – अभिक्रिया N2(g) + 3H2(g) ⇌
2NH3(g) में
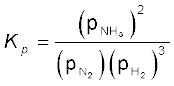
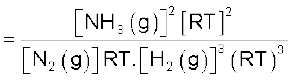

अर्थात् 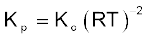 होगा। (7.14)
होगा। (7.14)
इस प्रकार एक समांगी गैसीय अभिक्रिया
a A + b B ⇌ c C + d D

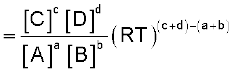
 (7.15)
(7.15)
यहाँ संतुलित रासायनिक समीकरण में ∆n = [(गैसीय उत्पादों के मोलों की संख्या)–(गैसीय अभिक्रियकों के मोलों की संख्या)] है। यह आवश्यक है कि Kp की गणना करते समय दाब का मान bar में रखना चाहिए, क्योंकि दाब की प्रामाणिक अवस्था 1 bar है। एकक 1 से हमें ज्ञात है कि 1 pascal, Pa = 1 Nm–2 तथा 1 bar = 105Pa।
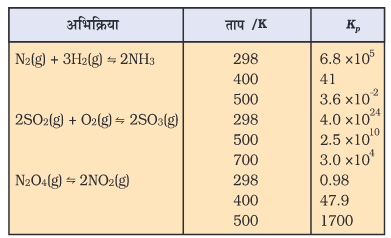
सारणी 7.5 में कुछ चयनित अभिक्रियाओं के लिए Kp के मान दिए गए हैं।
उदाहरण 7.3
500 K पर PCl5, PCl3 और Cl2 साम्यावस्था में हैं तथा सांद्रताएँ क्रमशः 1.41 M, 1.59 M एवं 1.59 M हैं।
अभिक्रिया PCl5 ⇌ PCl3 + Cl2 के लिए Kc की गणना कीजिए।
हल
उपरोक्त अभिक्रिया के लिए साम्यावस्था स्थिरांक इस रूप में प्रकट किया जा सकता है–

उदाहरण 7.4
इस अभिक्रिया के लिए 800 K पर Kc = 4.24 है–
CO (g) + H2O (g) ⇌ CO2 (g) + H2 (g)
800 K पर CO2 एवं H2, CO तथा H2O के साम्य पर सांद्रताओं की गणना कीजिए, यदि प्रारंभ में केवल CO तथा H2O ही उपस्थित हों तथा प्रत्येक की सांद्रता 0.1 M हो।
हल
निम्नलिखित अभिक्रिया के लिएःCO (g) + H2O (g) ⇌ CO2 (g) + H2(g)
प्रारंभ में :
0.1M 0.1M 0 0
साम्य पर
(0.1–x)M (0.1–x)M xM xM
जहाँ साम्य पर CO2 तथा H2 की मात्रा x mol L–1 है।
अतः साम्य स्थिरांक को इस प्रकार लिखा जा सकता है–
Kc = x2/(0.1– x)2 = 4.24
x2 = 4.24(0.01 + x2 – 0.2x)
x2 = 0.0424 + 4.24x2 – 0.848x
3.24x2 – 0.848x + 0.0424 = 0
a = 3.24, b = – 0.848, c = 0.0424
एक द्विघात समीकरण के लिए ax2 + bx + c = 0,
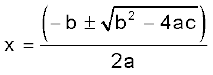
x = 0.848
±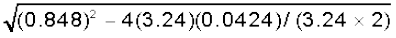
x = (0.848 ± 0.4118)/ 6.48
x1 = (0.848 – 0.4118)/6.48 = 0.067
x2 = (0.848 + 0.4118)/6.48 = 0.194
मान 0.194 की उपेक्षा की जा सकती है, क्योंकि यह अभिकारकों की सांद्रता बतलाएगा, जो प्रारंभिक सांद्रता से अधिक है।
अतः साम्यावस्था पर सांद्रताएँ ये हैं,
[CO2] = [H2-] = x = 0.067 M
[CO] = [H2O] = 0.1 – 0.067 = 0.033 M
उदाहरण 7.5
इस साम्य 2NOCl(g) ⇌ 2NO(g) + Cl2(g) हेतु
1069 K ताप पर साम्य स्थिारांक Kc का मान 3.75 × 10–6 है। इस ताप पर उक्त अभिक्रिया के लिए Kp की गणना कीजिए।
हल
हम जानते हैं कि
Kp = Kc(RT)∆n
उपरोक्त अभिक्रिया के लिए,
∆n = (2+1) – 2 = 1
Kp = 3.75 ×10–6 (0.0831 × 1069)
Kp = 0.033
साम्यावस्था स्थिरांक के मात्रक
साम्यावस्था Kc का मान निकालते समय सांद्रण को mol L–1
में तथा Kp का मान निकालते समय आंशिक दाब को Pa, kPa, bar अथवा atm में व्यक्त किया जाता है। इस प्रकार साम्यावस्था स्थिरांक का मात्रक सांद्रता या दाब के मात्रक पर आधारित है। यदि साम्यावस्था व्यंजक के अंश में घातांकों का योग हर में घातांकों के योग के बराबर हो। अभिक्रिया
H2(g) + I2(g) 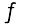 2HI, Kc तथा Kp में कोई मात्रक नहीं होता। N2O4(g)
2HI, Kc तथा Kp में कोई मात्रक नहीं होता। N2O4(g) 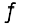 2NO2 (g), Kc का मात्रक mol/L तथा Kp का मात्रक bar है।
2NO2 (g), Kc का मात्रक mol/L तथा Kp का मात्रक bar है।
यदि अभिकारकों एवं उत्पादों को प्रमाणिक अवस्था में लिया जाए तो साम्यावस्था स्थिरांकों को विमाहीन (Dimensionless) मात्राओं में व्यक्त करते हैं। अभिकारकों एवं उत्पादों को प्रामाणिक अवस्था में शुद्ध गैस की प्रामाणिक अवस्था एक bar होती है। इस प्रकार 4 barदाब प्रामाणिक अवस्था के सापेक्ष में 4 bar/ 1 bar = 4 होता है, जो विमाहीन है। एक विलेय के लिए प्रामाणिक अवस्था (CO) 1 मोलर विलयन है तथा अन्य सांद्रताएँ इसी के सापेक्ष में मापी जाती हैं। साम्यस्थिरांक का आंकित मान चुनी हुई प्रामाणिक अवस्था पर निर्भरकरता है। इस प्रकार इस प्रणाली में Kp तथा Kc दोनों विमाहीन राशियाँ हैं किंतु उनका आंकिक मान भिन्न प्रमाणिक अवस्था होने के कारण भिन्न हो सकता है।
7.5 विषमांग साम्यावस्था
एक से अधिक प्रावस्था वाले निकाय में स्थापित साम्यावस्था को ‘विषमांग साम्यावस्था’ कहा जाता है। उदाहरण के लिए–एक बंद पात्र में जल-वाष्प एवं जल-द्रव के बीच स्थापित साम्यावस्था ‘विषमांग साम्यावस्था’ है।
H2O(l) ⇌H2O(g)
इस उदाहरण में एक गैस प्रावस्था तथा दूसरी द्रव प्रावस्था है। इसी तरह ठोस एवं इसके संतृप्त विलयन के बीच स्थापित साम्यावस्था भी विषमांग साम्यावस्था है। जैसे–
Ca(OH)2 (s) + (aq) ⇌Ca2+ (aq) + 2OH–(aq)
विषमांग साम्यावस्थाओं में अधिकतर शुद्ध ठोस या शुद्ध द्रव भाग लेते हैं। विषमांग साम्यावस्था (जिसमें शुद्ध ठोस या शुद्ध द्रव हो) के साम्यावस्था-व्यंजक को सरल बनाया जा सकता है, क्योंकि शुद्ध ठोस एवं शुद्ध द्रव का मोलर सांद्रण उनकी मात्रा पर निर्भर नहीं होता, बल्कि स्थिर होता है। दूसरे शब्दों में–साम्यावस्था पर एक पदार्थ 'X' की मात्रा कुछ भी हो, [X(s)] एवं [X(l)] के मान स्थिर होते हैं। इसके विपरीत यदि 'X' की मात्रा किसी निश्चित आयतन में बदलती है, तो [X(g)] तथा [X(aq)] के मान भी बदलते हैं। यहाँ हम एक रोचक एवं महत्त्वपूर्ण विषमांग रासायनिक साम्यावस्था केल्सियम कार्बोनेट के तापीय वियोजन पर विचार करेंगे–
CaCO3 (s) ⇌ CaO (s) + CO2 (g) (7.16)
उपरोक्त समीकरण के आधार पर हम लिख सकते हैं कि
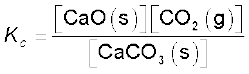
चूँकि [CaCO3(s)] एवं [CaO(s)] दोनों स्थिर हैं। इसलिए उपरोक्त अभिक्रिया के लिए सरलीकृत साम्यावस्था स्थिरांक
K'c = [CO2(g)] (7.17)
या 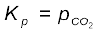 (7.18)
(7.18)
इससे स्पष्ट होता है कि एक निश्चित ताप पर CO2(g) की एक निश्चित सांद्रता या दाब CaO(s) तथा CaCO3(s) के साथ साम्यावस्था में रहता है। प्रयोग करने पर यह पता चलता है कि 1100 K पर CaCO3(s) एवं CaO (s) के साथ साम्यावस्था में उपस्थित CO2 का दाब 2.0 × 105 Pa है। इसलिए उपरोक्त अभिक्रिया के लिए साम्यावस्था स्थिरांक का मान इस प्रकार होगा–
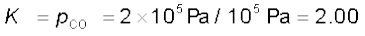
इसी प्रकार निकैल, कार्बन मोनोअॉक्साइड एवं निकैल कार्बाेनिल के बीच स्थापित विषमांग साम्यावस्था (निकैल के शुद्धिकरण में प्रयुक्त) समीकरण –
Ni (s) + 4 CO (g) ⇌ Ni(CO ∆G ∆G)4 (g)
में साम्यावस्था स्थिरांक का मान इस रूप में लिखा जाता है–

यह ध्यान रहे कि साम्यावस्था स्थापित होने के लिए शुद्ध पदार्थों की उपस्थिति आवश्यक है (भले ही उनकी मात्रा थोड़ी हो), किंतु उनके सांद्रण या दाब, साम्यावस्था–स्थिरांक के व्यंजक में नहीं होंगे। अतः सामान्य स्थिति में शुद्ध द्रव एवं शुद्ध ठोस को साम्यावस्था-स्थिरांक के व्यंजक में नहीं लिखा जाता है। अभिक्रिया–
Ag2O (s) + 2HNO3 (aq) ⇌ 2AgNO3 (aq) + H2O (l)
में साम्यावस्था स्थिरांक का मान इस रूप में लिखा जाता है–
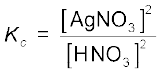
उदाहरण 7.6
अभिक्रिया CO2 (g) + C (s) ⇌ 2CO (g), के लिए
1000 K पर Kp का मान 3.0 है। यदि प्रारंभ में 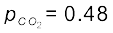 bar तथा
bar तथा 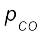 = 0 bar हो तथा शुद्ध ग्रेफाइट उपस्थित हो, तो CO तथा CO2 के साम्य पर आंशिक दाबों की गणना कीजिए।
= 0 bar हो तथा शुद्ध ग्रेफाइट उपस्थित हो, तो CO तथा CO2 के साम्य पर आंशिक दाबों की गणना कीजिए।
हल
इस अभिक्रिया के लिए–
यदि CO2 दाब में कमी x हो तो–
CO2 (g) + C (s) ⇌2CO (g)
प्रारंभ में : 0.48 bar 0
साम्य पर : (0.48 – x)bar 2x bar
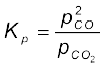
Kp = (2x)2/(0.48 – x) = 3
4x2 = 3(0.48 – x)
4x2 = 1.44 – x
4x2 + 3x – 1.44 = 0
a = 4, b = 3, c = –1.44
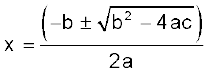
= [–3 ± 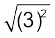 – 4(4)(–1.44)]"/2 × 4
– 4(4)(–1.44)]"/2 × 4
= (–3 ± 5.66)/ 8
(चूँकि x का मान ऋणात्मक नहीं होता, अतः इस मान की उपेक्षा कर देते हैं।)
x = 2.66/8 = 0.33
साम्य पर आंशिक दाबों के मान इस प्रकार होंगे–
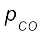 = 2 x = 2 x 0.33 = 0.66 bar
= 2 x = 2 x 0.33 = 0.66 bar
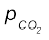 = 0.48 – x = 0.48 – 0.33 = 0.15 bar
= 0.48 – x = 0.48 – 0.33 = 0.15 bar
7.6 साम्यावस्था स्थिरांक के अनुप्रयोग
साम्यावस्था-स्थिरांक के अनुप्रयोगों पर विचार करने से पहले हम इसके निम्नलिखित महत्त्वपूर्ण लक्षणों पर ध्यान दें–
क. साम्यावस्था-स्थिरांक का व्यंजक तभी उपयोगी होता है, जब अभिकारकों एवं उत्पादों की सांद्रता साम्यावस्था पर स्थिर हो जाए।
ख. साम्यावस्था-सिथरांक का मान अभिकारकों एवं उत्पादों की प्रारंभिक सांद्रता पर निर्भर नहीं करता है।
ग. स्थिरांक का मान एक संतुलित समीकरण द्वारा व्यक्त रासायनिक क्रिया के लिए निश्चित ताप पर विशिष्ट होता है, जो ताप बदलने के साथ बदलता है।
घ. उत्क्रम अभिक्रिया का साम्यावस्था-स्थिरांक अग्रवर्ती अभिक्रिया के साम्यावस्था-स्थिरांक के मान का व्युत्क्रम होता है।
ङ. किसी अभिक्रिया का साम्यावस्था-स्थिरांक K उस संगत अभिक्रिया के साम्यावस्था स्थिरांक से संबंधित होता है जिसका समीकरण मूल अभिक्रिया के समीकरण में किसी छोटे पूर्णांक से गुणा या भाग देने पर प्राप्त होता है।
अब हम साम्यावस्था स्थिरांक के अनुप्रयोगों पर विचार करेंगे तथा इसका प्रयोग निम्नलिखित बिंदुओं से संबंधित प्रश्नों के उत्तर देने में करेंगे।
• साम्यावस्था-स्थिरांक के परिमाण की सहायता से अभिक्रिया की सीमा का अनुमान लगाना।
• अभिक्रिया की दिशा का पता लगाना एवं
• साम्यावस्था-सांद्रण की गणना करना।
7.6.1 अभिक्रिया की सीमा का अनुमान लगाना
साम्यावस्था-स्थिरांक का आंकिक मान अभिक्रिया की सीमा को दर्शाता है, परंतु यह जानना महत्त्वपूर्ण है कि साम्यावस्था स्थिरांक यह नहीं बतलाता कि साम्यावस्था किस दर से प्राप्त हुई है। Kc या Kp का परिमाण उत्पादों की सांद्रता के समानुपाती होता है (क्योंकि यह साम्यावस्था-स्थिरांक व्यंजक के अंश (Numerator) में लिखा जाता है) तथा क्रियाकारकों की सांद्रता के व्युत्क्रमानुपाती होता है (क्योंकि यह व्यंजक के हर (Denominator) में लिखी जाती है)। साम्यावस्था स्थिरांक K का उच्च मान उत्पादों की उच्च सांद्रता का द्योतक है। इसी प्रकार K का निम्न मान उत्पादों के निम्न मान को दर्शाता है।
साम्य मिश्रणों के संघटन से संबंधित निम्नलिखित सामान्य नियम बना सकते हैंः
यदि Kc > 103 हो, तो उत्पाद अभिकारक की तुलना में ज्यादा बनेंगे। यदि K का मान काफी ज्यादा है, तो अभिक्रिया लगभग पूर्णता के निकट होती है। उदाहरणार्थ–
(क) 500 K पर H2 तथा O2 की अभिक्रिया साम्यावस्था हेतु स्थिरांक Kc = 2.4 × 1047।
(ख) 300 K पर H2(g) + Cl2(g) 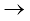 2HCl(g);
2HCl(g);
Kc = 4.0 × 1031
(ग) 300 K पर H2(g) + Br2(g) 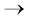 2HBr(g);
2HBr(g);
Kc = 5.4 × 1018
यदि Kc < 10–3, अभिकारक की तुलना में उत्पाद कम होंगे। यदि Kc का मान अल्प है, तो अभिक्रिया दुर्लभ अवस्था में ही संपन्न होती है। निम्नलिखित उदाहरणों द्वारा यह स्पष्ट हो जाता है–
(क) 500 K पर H2O का H2 तथा O2 में विघटन का साम्य-स्थिरांक बहुत कम है Kc = 4.1 × 10–48
(ख) 298 K पर N2(g) + O2(g) ⇌ 2NO(g);
Kc = 4.8 ×10–31
यदि Kc 10–3 से 103 की परास (Range) में होता है, तो उत्पाद तथा अभिकारक दोनों की सांद्रताएँ संतोषजनक होती हैं। निम्नलिखित उदाहरण पर विचार करने पर–
(क) 700 K पर H2 तथाI2 से HI बनने पर Kc = 57.0 है।
(ख) इसी प्रकार एक अन्य अभिक्रिया N2O4 का NO2 में विघटन है, जिसके लिए 25°C पर Kc = 4.64 × 10–3, जो न तो कम है और न ज्यादा। अतः साम्य मिश्रण में N2O4 तथा NO2 की सांद्रताएँ संतोषजनक होंगी। इस सामान्यीकरण को चित्र 7.7 में दर्शाया गया है।
7.6.2 अभिक्रिया की दिशा का बोध
अभिकारक एवं उत्पादों के किसी अभिक्रिया-मिश्रण में अभिक्रिया की दिशा का पता लगाने में भी साम्यावस्था स्थिरांक का उपयोग किया जाता है। इसके लिए हम अभिक्रिया भागफल (Reaction Quotient) 'Q' की गणना करते हैं। साम्यावस्था स्थिरांक की ही तरह अभिक्रिया भागफल को भी अभिक्रिया की किसी भी स्थिति के लिए परिभाषित (मोलर सांद्रण से Qc तथा आंशिक दाब से Qp) किया जा सकता है। किसी सामान्य अभिक्रिया के लिए
a A + b B ⇌ c C + d D (7.19)
Qc = [C]c[D]d / [A]a[B]b (7.20)
यदि Qc > Kc हो, तो अभिक्रिया अभिकारकों की ओर अग्रसरित होगी (विपरीत अभिक्रिया)
यदि Qc < Kc हो, तो अभिक्रिया उत्पादों की ओर अग्रसरित होगी,
यदि Qc = Kc हो, तो अभिक्रिया मिश्रण साम्यावस्था में है।
H2 के साथ I2 की गैसीय अभिक्रिया पर विचार
करते हैं–
H2(g) + I2(g) ⇌ 2HI(g)
700 K पर Kc = 57.0
माना कि हमने [H2]t=0.10M, [I2]t = 0.20 M
और [HI]t = 0.40 M. लिया
(सांद्रता संकेत पर पादांक t का तात्पर्य यह है कि सांद्रताओं का मापन किसी समय t पर किया गया है, न कि साम्य पर।)
इस प्रकार, अभिक्रिया भागफल Qc अभिक्रिया की इस स्थिति में दिया गया है–
Qc = [HI]t2 / [H2]t [I2]t = (0.40)2/ (0.10)×(0.20) = 8.0
इस समय Qc (8.0), Kc (57.0) के बराबर नहीं है। अतः H2(g), I2(g) तथा HI(g) का मिश्रण साम्य में नहीं है। इसीलिए H2(g) व I2(g) अभिक्रिया करके और अधिक HI(g) बनाएँगे तथा उनके सांद्रण तब तक घटेंगे, जब तक Qc = Kc न हो जाए।
अभिक्रिया-भागफल Qc, तथा Kc के मानों की तुलना करके अभिक्रिया-दिशा का बोध करने में उपयोगी हैं।
इस प्रकार, अभिक्रिया की दिशा के संबंध में हम निम्नलिखित सामान्य धारणा बना सकते हैं–
• यदि Qc < Kc हो, तो नेट अभिक्रिया बाईं से दाईं ओर अग्रसरित होती है।
• यदि Qc > Kc हो, तो नेट अभिक्रिया दाईं से बाईं ओर अग्रसरित होती है।
• यदि Qc = Kc हो, तो नेट अभिक्रिया नहीं होती है।
चित्र : 7.7 अभिक्रिया की दिशा का बोध
उदाहरण 7.7
2A ⇌ B + C अभिक्रिया के लिए Kc का मान
2 × 10–3 है।
दिए गए समय में अभिक्रिया-मिश्रण का संघटन [A] = [B] = [C] = 3 × 10–4 M है। अभिक्रिया कौन सी दिशा में अग्रसित होगी?
हल
अभिक्रिया के लिए अभिक्रिया भागफल 
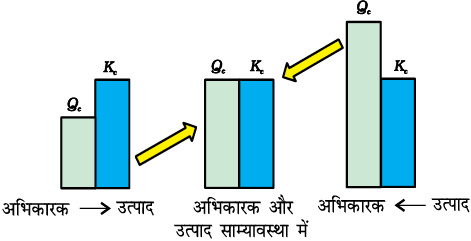
[A] = [B] = [C] = 3 × 10–4 M
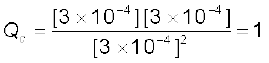
इस प्रकार Qc > Kc इसलिए अभिक्रिया विपरीत दिशा में अग्रसित होती है।
7.6.3 साम्य सांद्रताओं की गणना
यदि प्रारंभिक सांद्रता ज्ञात हो, लेकिन साम्य सांद्रता ज्ञात नहीं हो, तो निम्नलिखित तीन पदों से उसे प्राप्त करेंगे–
पद 1 : अभिक्रिया के लिए संतुलित समीकरण लिखो।
पद 2 : संतुलित समीकरण के लिए एक सारणी बनाएँ, जिसमें अभिक्रिया में सन्निहित प्रत्येक पदार्थ को सूचीबद्ध किया होः
(क) प्रारंभिक सांद्रता
(ख) साम्यावस्था पर जाने के लिए सांद्रता में परिवर्तन और
(ग) साम्यावस्था सांद्रता
सारणी बनाने में किसी एक अभिकारक की सांद्रता को x के रूप में, जो साम्यावस्था पर है को परिभाषित करें और फिर अभिक्रिया की रससमीकरणमितीय से अन्य पदार्थों की सांद्रता को x के रूप में व्यक्त करें।
पद 3 : x को हल करने के लिए साम्य समीकरण में साम्य सांद्रताओं को प्रतिस्थापित करते हैं। यदि आपको वर्ग समीकरण हल करना हो, तो वह गणितीय हल चुनें, जिसका रासायनिक अर्थ हो।
पद 4 : परिकलित मान के आधार पर साम्य सांद्रताओं की गणना करें।
पद 5 : इन्हें साम्य समीकरण में प्रतिस्थापित कर अपने परिणाम की जाँच करें।
उदाहरण 7.8
13.8 ग्राम N2O4 को 1 L पात्र में रखा जाता है तो इस प्रकार साम्य स्थापित होता है–
N2O4(g) ⇌ 2NO2(g)
यदि साम्यावस्था पर कुल दाब 9.15 bar पाया गया, तो Kc, Kp तथा साम्यावस्था पर आंशिक दाब की गणना कीजिए।
हल
हम जानते हैं कि pV = nRT
कुल आयतन (V) = 1 L
अणुभार (N2O)4 = 92 g
गैस के मोल = 13.8 g/92 g
= 0.15
गैस-स्थिरांक (R) = 0.083 bar L मोल–1 K–1
ताप = 400 K
pV = nRT
p × 1 लिटर = 0.15 मोल × (0.083 bar L
mol–1 K–1) × 400 K
p = 4.98 bar
N2O4 ⇌ 2NO2
प्रारंभ में 4.98 bar 0
साम्य पर (4.98 – x) bar 2x bar
अतः साम्य पर pकुल 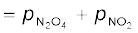
9.15 = (4.98 – x) + 2x
9.15 = 4.98 + x
x = 9.15 – 4.98 = 4.17 bar
साम्यावस्था पर आंशिक दाब,
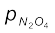 = 4.98 – 4.17 = 0.81bar
= 4.98 – 4.17 = 0.81bar
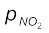 = 2x = 2 × 4.17 = 8.34 bar
= 2x = 2 × 4.17 = 8.34 bar
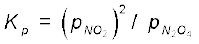
= (8.34)2/0.81 = 85.87
Kp = Kc(RT)∆n
85.87 = Kc(0.083 × 400)1
Kc = 2.586 = 2.6
उदाहरण 7.9
380 K पर 3.00 मोल PCl5 को 1 L बंद पात्र में रखा जाता है। साम्यावस्था पर मिश्रण का संघटन ज्ञात कीजिए
यदि Kc = 1.80 है।
हल
PCl5 ⇌ PCl3 + Cl2
प्रारंभ में 3.0 0 0
मान लीजिए PCl5 के प्रति मोल में सेे x mol वियोजित होते हैं। तब-
साम्य पर (3-x) x x
Kc = 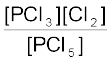
1.8 = x2/ (3 – x)
x2 + 1.8x – 5.4 = 0
x = [–1.8 ± √(1.8)2 – 4(–5.4)]/2
x = [–1.8 ± √3.24 + 21.6]/2
x = [–1.8 ± 4.98]/2
x = [–1.8 + 4.98]/2 = 1.59
[PCl5] = 3.0 – x = 3 –1.59 = 1.41 M
[PCl3] = [Cl2] = x = 1.59 M
7.7 साम्यावस्था स्थिरांक K, अभिक्रिया भागफल Q तथा गिब्ज़ ऊर्जा G में संबंध
किसी अभिक्रिया के लिए Kc का मान अभिक्रिया की गतिकी पर निर्भर नहीं करता है। जैसा कि आप एकक - 6 में पढ़ चुके हैं, यह अभिक्रिया की ऊष्मागतिकी, विशेषतः गिब्ज़ ऊर्जा में परिवर्तन पर निर्भर करता है–
यदि ∆G ऋणात्मक है, तब अभिक्रिया स्वतः प्रवर्तित मानी जाती है तथा अग्र दिशा में संपन्न होती है।
यदि ∆G धनात्मक है, तब अभिक्रिया स्वतः प्रवर्तित नहीं होगी। इसकी बजाय प्रतीप अभिक्रिया हेतु ∆G ऋणात्मक होगा। अतः अग्र अभिक्रिया के उत्पाद अभिकारक में परिवर्तित हो जाएँगे।
यदि ∆G शून्य हो तो, अभिक्रिया साम्यावस्था को प्राप्त करेगी।
इस ऊष्मागतिक तथ्य की व्याख्या इस समीकरण से की जा सकती है–
∆G = ∆G0 + RT lnQ (7.21)
जबकि ∆G0 मानक गिब्ज़ ऊर्जा है।
साम्यावस्था पर जब ∆G = 0 तथा Q = Kc हो, तो समीकरण (7.21) इस प्रकार होगी–
∆G = ∆G0 + RT ln K = 0 (Kc के स्थान पर K मानते हुए)
∆G0 = – RT lnK (7.22)
lnK = – ∆G0 / RT
दोनों ओर प्रतिलघु गुणक लेने पर–
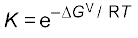 (7.23)
(7.23)
अतः समीकरण 7.23 का उपयोग कर, ∆G0 के पदों के रूप में अभिक्रिया की स्वतःप्रवर्तिता को समझाया जा सकता है–
यदि ∆Gθ < 0 हो, तो –∆Gθ/RT धनात्मक होगा। अतः 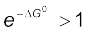 होने से K > 1 होगा, जो अभिक्रिया की स्वतःप्रवर्तिता को दर्शाता है अथवा अग्र दिशा में उस सीमा तक होती है जिससे कि उत्पाद आधिक्य में बने।
होने से K > 1 होगा, जो अभिक्रिया की स्वतःप्रवर्तिता को दर्शाता है अथवा अग्र दिशा में उस सीमा तक होती है जिससे कि उत्पाद आधिक्य में बने।
यदि ∆Gθ > 0 हो, तो –∆Gθ/RT ऋणात्मक होगा। अतः 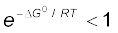 , होने से K < 1 होगा। जो अभिक्रिया की अस्वतःप्रवर्तिता दर्शाता है या अभिक्रिया अग्र दिशा में उस सीमा तक होती है, जिससे उत्पाद न्यूनतम बने।
, होने से K < 1 होगा। जो अभिक्रिया की अस्वतःप्रवर्तिता दर्शाता है या अभिक्रिया अग्र दिशा में उस सीमा तक होती है, जिससे उत्पाद न्यूनतम बने।
उदाहरण 7.10
ग्लाइकोलाइसिस में ग्लूकोस के फॉस्फोराइलेशन के लिए ∆Gθ का मान 13.8 kJ mol–1 है। 298 K पर Kc का मान ज्ञात करें।
हल
∆Gθ = 13.8 kJ mol–1 = 13.8 × 103 J mol–1
∆Gθ = –RT lnKc
ln Kc = –13.8 × 103J/mol
(8.31 J mol–1 K–1 × 298 K)
ln Kc = – 5.569
Kc = e–5.569
Kc = 3.81 × 10–3
उदाहरण 7.11
सूक्रोस के जल-अपघटन से ग्लूकोस और फ्रक्टोस निम्नलिखित अभिक्रिया के अनुसार मिलता है–
सूक्रोस + H2O ⇌ ग्लूकोस + फ्रक्टोस
300 K पर अभिक्रिया के लिए साम्यावस्था स्थिरांक Kc, 2 × 1013 है। 300 K पर ∆G0 के मान की गणना कीजिए।
हल
∆Gθ = – RT lnKc
∆Gθ = – 8.314 J mol–1 K–1
× 300K × ln(2×1013)
∆Gθ = – 7.64 ×104 J mol–1
7.8 साम्य को प्रभावित करने वाले कारक
रासायनिक संश्लेषण के प्रमुख उद्देश्यों में से एक यह है कि न्यूनतम ऊर्जा के व्यय के साथ अभिकारकों का उत्पादों में अधिकतम परिवर्तन हो, जिसका अर्थ है– उत्पादों की अधिकतम लब्धि ताप तथा दाब की मध्यम परिस्थितियों में हो। यदि एेसा नहीं होता है, तो प्रायोगिक परिस्थितियों में परिवर्तन की आवश्यकता है। उदाहरणार्थ– N2 तथा H2 से अमोनिया के संश्लेषण के हाबर प्रक्रम में प्रायोगिक परिस्थितियों का चयन वास्तव में आर्थिक रूप से महत्त्वपूर्ण है। विश्व में अमोनिया का वार्षिक उत्पादन 100 मिलियन टन है। इसका मुख्य उपयोग उर्वरकों के रूप में होता है।
साम्यावस्था स्थिरांक Kc प्रारंभिक सांद्रताओं पर निर्भर नहीं करता है। परंतु यदि साम्यावस्थावाले किसी निकाय में अभिकारकों या उत्पादों में से किसी एक के सांद्रण में परिवर्तन किया जाए, तो निकाय में साम्यावस्था नहीं रह पाती है तथा नेट अभिक्रिया पुनः तब तक होती रहती है, जब तक निकाय में पुनः साम्यावस्था स्थापित न हो जाए। प्रावस्था साम्यावस्था पर ताप का प्रभाव एवं ठोसों की विलेयता के बारे में हम पहले ही पढ़ चुके हैं। हम यह भी देख चुके हैं कि ताप का परिवर्तन किस प्रकार होता है। यह भी बताया जा चुका है कि किसी ताप पर यदि अभिक्रिया के साम्यावस्था-स्थिरांक का मान ज्ञात हो तो किसी प्रारंभिक सांद्रण से उस अभिक्रिया के अभिकारकों एवं उत्पादों के साम्यावस्था में सांद्रण की गणना की जा सकती है। यहाँ तक कि हमें यदि साम्यावस्था स्थिरांक का ताप के साथ परिवर्तन नहीं भी ज्ञात हो, तो नीचे दिए गए ला-शातेलिए सिद्धांत की मदद से परिस्थितियों के परिवर्तन से साम्यावस्था पर पड़नेवाले प्रभाव के बारे में गुणात्मक निष्कर्ष हम प्राप्त कर सकते हैं। इस सिद्धांत के अनुसार किसी निकाय की साम्यावस्था परिस्थितियों को निर्धारित करनेवाले कारकों (सांद्रण, दाब एवं ताप) में से किसी में भी परिवर्तन होने पर साम्यावस्था उस दिशा में अग्रसर होती है। जिससे निकाय पर लगाया हुआ प्रभाव कम अथवा समाप्त हो जाए। यह भी भौतिक एवं रासायनिक साम्यावस्थाओं में लागू होता है। एक साम्य मिश्रण के संघटन को परिवर्तित करने के लिए अनेक कारकों का उपयोग किया जा सकता है–
निम्नलिखित उपखंडों में हम साम्यावस्था पर सांद्रण, दाब, ताप एवं उत्प्रेरक के प्रभाव पर विचार करेंगे–
7.8.1 सांद्रता-परिवर्तन का प्रभाव
सामान्यतया जब किसी अभिकारक/उत्पाद को अभिक्रिया में मिलाने या निकालने से साम्यावस्था परिवर्तित होती है, तो इसका अनुमान ‘ला-शातेलिए सिद्धांत’ के आधार पर लगाया जा सकता है–
• अभिकारक/उत्पाद को मिलाने से सांद्रता पर पड़े दबाव को कम करने के लिए अभिक्रिया उस दिशा की ओर अग्रसर होती है, ताकि मिलाए गए पदार्थ का उपभोग हो सके।
• अभिकारक/उत्पाद के निष्कासन से सांद्रता पर दबाव को कम करने के लिए अभिक्रिया उस दिशा की ओर अग्रसर होती है ताकि अभिक्रिया से निकाले गए पदार्थ की पूर्ति हो सकें अन्य शब्दों में–
"जब किसी अभिक्रिया के अभिकारकों या उत्पादों में से किसी एक का भी सांद्रण साम्यावस्था पर बदल दिया जाता है, तो साम्यावस्था मिश्रण के संघटन में इस प्रकार परिवर्तन होता है कि सांद्रण परिवर्तन के कारण पड़नेवाला प्रभाव कम अथवा शून्य हो जाए।"
आइए, H2(g) + I2(g) ⇌ 2HI(g) अभिक्रिया पर विचार करें। यदि साम्यावस्था पर अभिक्रिया मिश्रण में बाहर से H2 गैस डाली जाए, तो साम्यवस्था के पुनः स्थापन के लिए अभिक्रिया उस दिशा में अग्रसर होगी जिस में H2 उपभोगित हो अर्थात् और अधिाक H2 एवं I2 क्रिया कर HI विरचित करगी तथा अंततः साम्यावस्था दाईं (अग्रिम) दिशा में विस्थापित होगी (चित्र 7.8)। यह ला-शातेलिए के सिद्धांत के अनुरुप है जिसके अनुसार अधिकारक/उत्पाद के योग की स्थिति में नई साम्यावस्था स्थापित होगी जिसमें अभिकारक/उत्पाद की सांद्रता उसके योग करने के समय से कम तथा मूल मिश्रण से अधिक होनी चाहिए।
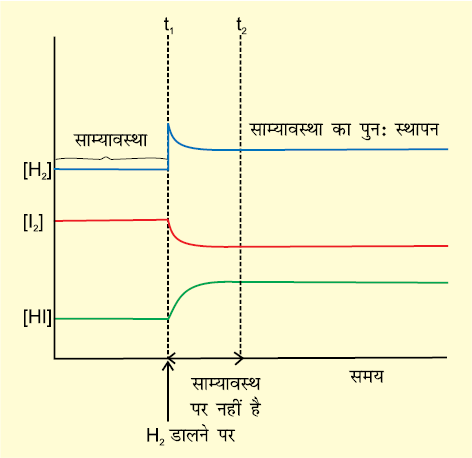
चित्र 7.8 H2(g) + I2(g) ⇌ 2HI(g) अभिक्रिया में साम्यावस्था पर H2 के डालने पर अभिकारकों एवं उत्पादों के सांद्रण में परिवर्तन
निम्नलिखित अभिक्रिया भागफल के आधार पर भी हम इसी निष्कर्ष पर पहुँच सकते हैं–
Qc = [HI]2/ [H2][I2]
यदि साम्यावस्था पर H2 मिलाया जाता है, तो [H2] बढ़ता है और Qc का मान Kc से कम हो जाता है। इसलिए अभिक्रिया दाईं (अग्र) दिशा की ओर से अग्रसर होती है। अर्थात् [H2] तथा [I2] घटता है और [HI] तब तक बढ़ता है, जब तक Qc = Kc न हो जाए। अर्थात् नई साम्यावस्था स्थापित न हो जाए। औद्योगिक प्रक्रमों में उत्पाद को अलग करना अधिकतर बहुत महत्त्वपूर्ण होता है। जब साम्यावस्था पर किसी उत्पाद को अलग कर दिया जाता है, तो अभिक्रिया, जो पूर्ण हुए बिना साम्यावस्था पर पहुँच गई है, पुनः अग्रिम दिशा में चलने लगती है। जब उत्पादों में से कोई गैस हो या वाष्पीकृत होने वाला पदार्थ हो, तो उत्पाद का अलग करना आसान होता है। अमोनिया के औद्योगिक निर्माण में अमोनिया का द्रवीकरण कर के, उसे अलग कर लिया जाता है जिससे अभिक्रिया अग्रिम दिशा में होती रहती है। इसी प्रकार CaCO3 से CaO जो भवन उद्योग की एक महत्त्वपूर्ण सामग्री है, के औद्योगिक निर्माण में भट्टी से CO2 को लगातार हटाकर अभिक्रिया पूर्ण कराई जाती है। यह याद रखना चाहिए कि उत्पाद लगातार हटाते रहने से Qc का मान Kc से हमेशा कम बना रहता है, जिससे अभिक्रिया अग्रिम दिशा में होती रहती है।
सांद्रता का प्रभाव-एक प्रयोग
इसे निम्नलिखित अभिक्रिया द्वारा प्रदर्शित किया जा सकता है–
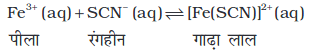
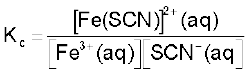 (7.25)
(7.25)
एक परखनली में आयरन (III) नाइट्रेट विलयन का 1mL लेकर उसमें दो बूँद पोटैशियम थायोसाइनेट विलयन डालकर परखनली को हिलाने पर विलयन का रंग लाल हो जाता है, जो [Fe(SCN)]2+ बनने के कारण होता है। साम्यावस्था स्थापित होने पर रंग की तीव्रता स्थिर हो जाती है। अभिकारक या उत्पाद को अभिक्रिया की साम्यावस्था पर मिलाने से साम्यावस्था को अग्रिम या प्रतीप दिशाओं में अपनी इच्छानुसार विस्थापित कर सकते हैं। [Fe3+]/[SCN–] आयनों की कमी करने वाले अभिकारकों को मिलाने पर साम्य विपरीत दिशा में विस्थापित कर सकते हैं। जैसे–अॉक्जेलिक अम्ल (H2 C2 O4), Fe3+ आयन से क्रिया करके स्थायी संकुल आयन [Fe(C2O4)3]3– बनाते हैं। अतः मुक्त Fe3+ आयन की सांद्रता कम हो जाती है। ला-शातेलिए सिद्धांत के अनुसार Fe3+ आयन को हटाने से उत्पन्न सांद्रता दबाव को [Fe(SCN)]2+ के वियोजन द्वारा Fe3+ आयनों की पूर्ति कर मुक्त किया जाता है। चूँकि [Fe (SCN)]2+ की सांद्रता घटती है, अतः लाल रंग की तीव्रता कम हो जाती है। जलीय HgCl2 मिलाने पर भी लाल रंग की तीव्रता कम होती है।
क्योंकि Hg2+ आयन, SCN– आयनों के साथ अभिक्रिया कर स्थायी संकुल आयन [Hg (SCN)4]–2 बनाते हैं। मुक्त SCN– आयनों की कमी समीकरण [7.24] में साम्य को बाईं से दाईं ओर SCN– आयनों की पूर्ति हेतु विस्थापित करती है। पोटैशियम थायोसाइनेट मिलाने पर SCN– का सांद्रण बढ़ जाता है। अतः इसलिए साम्यावस्था अग्र दिशा में (दाईं तरफ) बढ़ जाती है तथा विलयन के रंग की तीव्रता बढ़ जाती है।
7.8.2 दाब-परिवर्तन का प्रभाव
किसी गैसीय अभिक्रिया में आयतन परिवर्तन द्वारा दाब बदलने से उत्पाद की मात्रा प्रभावित होती है। यहतभी होता है, जब अभिक्रिया को दर्शाने वाले रासायनिक समीकरण में गैसीय अभिकारकों के मोलों की संख्या तथा गैसीय उत्पादों के मोलों की संख्या में भिन्नता होती है। विषमांगी साम्य पर ला-शातेलिए सिद्धांत, के प्रयुक्त करने पर ठोसों एवं द्रवों पर दाब के परिवर्तन की उपेक्षा की जा सकती है। क्योंकि ठोस/द्रव का आयतन (एवं सांद्रता) दाब पर निर्भर नहीं करता है। निम्नलिखित अभिक्रिया में–
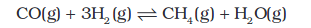
गैसीय अभिकर्मकों (CO + 3H2) के चार मोल से उत्पादों (CH4 + H2O) के दो मोल बनते हैं। उपरोक्त अभिक्रिया में साम्यावस्था मिश्रण को एक निश्चित ताप पर पिस्टन लगे एक सिलिंडर में रखकर दाब दोगुना कर उसके मूल आयतन को आधा कर दिया गया। इस प्रकार अभिकारकों एवं उत्पादों का आंशिक दाब एवं इसके फलस्वरूप उनका सांद्रण बदल गया है। अब मिश्रण साम्यावस्था में नहीं रह गया है। ला-शातेलिए सिद्धांत, लागू करके अभिक्रिया जिस दिशा में जाकर पुनः साम्यावस्था स्थापित करती है, उसका पता लगाया जा सकता है। चूँकि दाब दुगुना हो गया है, अतः साम्यावस्था अग्र दिशा (जिसमें मोलों की संख्या एवं दाब कम होता है) में अग्रसर होता है। (हम जानते हैं कि दाब गैस के मोलों की संख्या के समानुपाती होता है)। इसे अभिक्रिया भागफल Qc द्वारा समझा जा सकता है। ऊपर दी गई मेथेन बनाने की अभिक्रिया में [CO], [H2], [CH4] एवं [H2O] क्रियाभिकारकों की साम्यावस्था के सांद्रण को प्रदर्शित करते हैं। जब अभिक्रिया मिश्रण का आयतन आधा कर दिया जाता है, तो उनके आंशिक दाब एवं सांद्रण दुगुने हो जाते हैं। अब हम अभिक्रिया भागफल का मान साम्यावस्था का दुगुना मान रखकर प्राप्त कर सकते हैं।
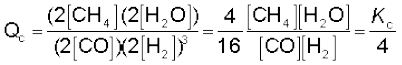
चूँकि Qc < Kc है, अतः अभिक्रिया अग्र दिशा में अग्रसर होती है।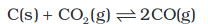 अभिक्रिया में जब दाब बढ़ाया जाता है तो अभिक्रिया विपरीत (या उत्क्रम) दिशा में होती है, क्याेंकि अग्र दिशा में मोलों की संख्या बढ़ जाती है।
अभिक्रिया में जब दाब बढ़ाया जाता है तो अभिक्रिया विपरीत (या उत्क्रम) दिशा में होती है, क्याेंकि अग्र दिशा में मोलों की संख्या बढ़ जाती है।
7.8.3 अक्रिय गैस के योग का प्रभाव
यदि आयतन स्थिर रखते हैं और एक अक्रिय गैस (जैसे– अॉर्गन) जो अभिक्रिया में भाग नहीं लेती है, को मिलाते हैं तो साम्य अपरिवर्तित रहता है। क्योंकि स्थिर आयतन पर अक्रिय गैस मिलाने पर अभिक्रिया में भाग लेने वाले पदार्थ की मोलर सांद्रताओं अथवा दाबों में कोई परिवर्तन नहीं होता है। अभिक्रिया भागफल में परिवर्तन केवल तभी होता है जब मिलाई गई गैस अभिक्रिया में भाग लेने वाला अभिकारक या उत्पाद हो।
7.8.4 ताप-परिवर्तन का प्रभाव
जब कभी दाब या आयतन में परिवर्तन के कारण साम्य सांद्रता विक्षुब्ध होती है, तब साम्य मिश्रण का संघटन परिवर्तित होता है, क्योंकि अभिक्रिया भागफल (Q) साम्यावस्था स्थिरांक (Kc) के बराबर नहीं रह पाता, लेकिन जब तापक्रम में परिवर्तन होता है, साम्यावस्था स्थिरांक (Kc) का मान परिवर्तित हो जाता है। सामान्यतः तापक्रम पर स्थिरांक की निर्भरता अभिक्रिया के <H के चिह्न पर निर्भर करती है।
• ऊष्माक्षेपी अभिक्रिया (<H ऋणात्मक) का साम्यावस्था स्थिरांक तापक्रम के बढ़ने पर घटता है।
• ऊष्माशेषी अभिक्रिया (<H धनात्मक) का साम्यावस्था स्थिरांक तापक्रम के बढ़ने पर बढ़ता है।
तापक्रम में परिवर्तन साम्यावस्था स्थिरांक एवं अभिक्रिया के वेग में परिवर्तन लाता है।
निम्नलिखित अभिक्रिया के अनुसार अमोनिया का उत्पादन
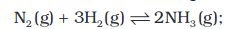
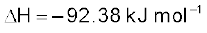
एक उष्माक्षेपी प्रक्रम है। ‘ला-शातालिए सिद्धांत’ के अनुसार, तापक्रम बढ़ने पर साम्यावस्था बाई दिशा में स्थानान्तरित हो जाती है एवं अमोनिया की साम्यावस्था सांद्रता कम हो जाती है। अन्य शब्दों में, कम तापक्रम अमोनिया की उच्च लब्धि के लिए उपयुक्त है, लेकिन प्रायोगिक रूप से अत्यधिक कम ताप पर अभिक्रिया की गति धीमी हो जाती है, अतः उत्प्रेरक प्रयोग में लिया जाता है।
ताप का प्रभाव - एक प्रयोग
NO2 गैस (भूरी) का N2O4 गैस में द्वितयन (Dimerization) की अभिक्रिया के द्वारा साम्यावस्था पर ताप का प्रभाव प्रदर्शित किया जा सकता है।

सांद्र HNO3 में ताँबे की छीलन डालकर हम NO2 गैस तैयार करते हैं तथा इसे एक निकासनली की सहायता से 5mL वाली दो परखनलियों में इकट्ठा करते हैं। दोनों परखनलियों में रंग की तीव्रता समान होनी चाहिए। अब एरल्डाइट (araldit) की सहायता से परखनली के स्टॉपर (stopper) को बन्द कर देते हैं। 250mL के तीन बीकर इनपर क्रमशः 1, 2 एवं 3 अंकित करते हैं। बीकर नं. 1 को हिमकारी मिश्रण (Freezing mixture) से बीकर नं. 2 को कमरे के तापवाले जल से एवं बीकर नं. 3 को गरम (363K) जल से भर दीजिए। जब दोनों परखनलियों को बीकर नं. 2 में रखा जाता है, तब गैस के भूरे रंग की तीव्रता एक समान दिखाई देती है। कमरे के ताप वाले पानी में 8 - 10 मिनट तक परखनलियों को रखने के बाद उसे निकालकर एक परखनली को बीकर नं. 1 के जल में तथा दूसरी परखनली को बीकर नं. 3 के जल में रखिए। अभिक्रिया की दिशा पर ताप का प्रभाव इस प्रयोग से चित्रित किया जा सकता है। कम ताप पर बीकर नं. 1 में ऊष्माशोषी अग्र अभिक्रिया द्वारा N2O4 बनने को तरजीह मिलती है तथा NO2 की कमी होने के कारण भूरे रंग की तीव्रता घटती है, जबकि बीकर नं. 3 में उच्च ताप पर उत्क्रम अभिक्रिया को तरजीह मिलती है, जिससे NO2 बनता है। परिणामतः भूरे रंग की तीव्रता बढ़ जाती है।
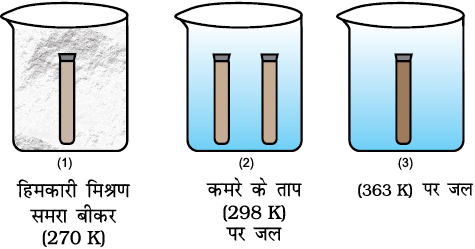
चित्र 7.9 : अभिक्रिया 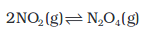 की साम्यावस्था पर ताप का प्रभाव
की साम्यावस्था पर ताप का प्रभाव
साम्यावस्था पर ताप का प्रभाव एक दूसरी ऊष्माशोषी अभिक्रिया से भी समझा जा सकता है।
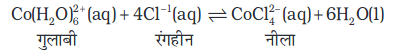
कमरे के ताप पर 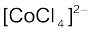 के कारण साम्यावस्था मिश्रण का रंग नीला हो जाता है। जब इसे हिमकारी मिश्रण में ठंडा किया जाता जाता है, तो मिश्रण का रंग [Co(H2O)6]3+ के कारण गुलाबी हो जाता है।
के कारण साम्यावस्था मिश्रण का रंग नीला हो जाता है। जब इसे हिमकारी मिश्रण में ठंडा किया जाता जाता है, तो मिश्रण का रंग [Co(H2O)6]3+ के कारण गुलाबी हो जाता है।
7.8.5 उत्प्रेरक का प्रभाव
उत्प्रेरक क्रियाकारकों के उत्पादों में परिवर्तन हेतु कम ऊर्जा वाला नया मार्ग उपलब्ध करवाकर अभिक्रिया के वेग को बढ़ा देता है। यह एक ही संक्रमण-अवस्था में गुजरने वाली अग्र एवं प्रतीप अभिक्रियाओं के वेग को बढ़ा देता है, जबकि साम्यावस्था को परिवर्तित नहीं करता। उत्प्रेरक अग्र एवं प्रतीप अभिक्रिया के लिए संक्रियण ऊर्जा को समान मात्रा में कम कर देता है। उत्प्रेरक अग्र एवं प्रतीप अभिक्रिया मिश्रण पर साम्यावस्था संघटन को परिवर्तित नहीं करता है। यह संतुलित समीकरण में या साम्यावस्था स्थिरांक समीकरण में प्रकट नहीं होता है।
NH3 के नाइट्रोजन एवं हाइड्रोजन से निर्माण पर विचार करें, जो एक अत्यंत ऊष्माक्षेपी अभिक्रिया है इसमें उत्पाद के कुल मोलों की संख्या अभिकारकों के मोलों से कम होती है। साम्यावस्था स्थिरांक तापक्रम को बढ़ाने से घटता है। कम ताप पर अभिक्रिया वेग घटता है एवं साम्यावस्था पर पहुँचने में अधिक समय लगता है, जबकि उच्च ताप पर क्रिया की दर संतोषजनक होती है, परंतु लब्धि कम होती है।
जर्मन रसायनज्ञ फ्रीस हाबर ने दर्शाया है कि लौह उत्प्रेरक की उपस्थिति में अभिक्रिया संतोषजनक दर से होती है, जबकि NH3 की साम्यावस्था सांद्रता संतोषजनक होती है। चूँकि उत्पाद के मोलो की संख्या अभिकारकों के मोलों की संख्या से कम है। अतः NH3 का उत्पादन दाब बढ़ाकर अधिक किया जा सकता है।
NH3 के संश्लेषण हेतु ताप एवं दाब की अनुकूलतम परिस्थितियाँ 500°C एवं 200 वायुमंडलीय दाब होती है।
इसी प्रकार, संपर्क विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण में
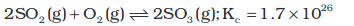
साम्यावस्था स्थिरांक के परिणाम के अनुसार अभिक्रिया को लगभग पूर्ण हो जाना चाहिए, किंतु SO2 का SO3 में अॉक्सीकरण बहुत धीमी दर से होता है। प्लेटिनम अथवा डाइवैनेडियम पेन्टॉक्साईड (V2O5) उत्प्रेरक की उपस्थिति में अभिक्रिया वेग काफी बढ़ जाता है।
नोटः यदि किसी अभिक्रिया के साम्यावस्था स्थिरांक का मान काफी कम होता हो, तो उसमें उत्प्रेरक बहुत कम सहायता कर पाता है।
7.9 विलयन में आयनिक साम्यावस्था
साम्य की दिशा पर सांद्रता परिवर्तन के प्रभाव वाले प्रसंग में आप निम्नलिखित आयनिक साम्य के संपर्क में आए हैं–
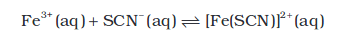
एेसे अनेक साम्य हैं, जिनमें केवल आयन सम्मिलित होते हैं यहाँ हम उन साम्यों का अध्ययन करेंगे। यह सर्वविदित है कि चीनी के जलीय विलयन में विद्युत् धारा प्रवाहित नहीं होती है, जबकि जल में साधारण नमक (सोडियम क्लोराइड) मिलाने पर इसमें विद्युत् धारा का प्रवाह होता है तथा लवण की सांद्रता बढ़ने के साथ विलयन की चालकता बढ़ती है। माइकल फैराडे ने पदार्थों को उनकी विद्युत् चालकता क्षमता के आधार पर दो वर्गाें में वर्गीकृत किया– एक वर्ग के पदार्थ जलीय विलयन में विद्युत् धारा प्रवाहित करते हैं, ये ‘विद्युत् अपघट्य’ कहलाते हैं, जबकि दूसरे जो एेसा नहीं करते, वैद्युत अन अपघट्य कहलाते हैं। फैराडे ने विद्युत् अपघट्यों को पुनः प्रबल एवं दुर्बल वैद्युत अपघट्यों में वर्गीकृत किया। प्रबल वैद्युत अपघट्य जल में विलेय होकर लगभग पूर्ण रूप से आयनित होते हैं, जबकि दुर्बल अपघट्य आंशिक रूप से आयनित होते हैं। उदाहरणार्थ-सोडियम क्लोराइड के जलीय विलयन में मुख्य रूप से सोडियम आयन एवं क्लोराइड आयन पाए जाते हैं, जबकि एेसीटिक अम्ल में एसीटेट आयन एवं हाइड्रोनियम आयन होते हैं। इसका कारण यह है कि सोडियम क्लोराइड का लगभग 100% आयनन होता है, जबकि एेसीटिक अम्ल, जो दुर्बल, विद्युत्-अपघट्य है, 5% ही आयनित होता हैै। यह ध्यान रहे कि दुर्बल विद्युत् अपघट्यों में आयनों तथा अनायनित अणुओं के मध्य साम्य स्थापित होता है। इस प्रकार का साम्य, जिसमें जलीय विलयन में आयन पाए जाते हैं, आयनिक साम्य कहलाता है। अम्ल, क्षारक तथा लवण वैद्युत् अपघट्यों के वर्ग में आते हैं। ये प्रबल अथवा दुर्बल वैद्युत अपघट्यों की तरह व्यवहार करते हैं।
फैराडे का जन्म लंदन के पास एक सीमित साधन वाले परिवार में हुआ था। 14 वर्ष की उम्र में वह एक दयालु जिल्दसाज (Book binder) के यहाँ काम सीखने लगे। उसने उन्हें उन किताबों को पढ़ने की छूट दे दी थी। जिनकी जिल्द वह बाँधता था। भाग्यवश डेवी वह (Davy) का प्रयोगशाला सहायक बन गए तथा सन् 1813-1814 में फैराडे उनके साथ महाद्वीप की यात्रा पर चले गए। उस यात्रा के दौरान वे उस समय के कई अग्रणी वैज्ञानिकों के संपर्क में आए और उनके अनुभवों से बहुत सीखा।

माईकल फैराडे (1791–1867)
सन् 1825 में डेवी के बाद वे रॉयल संस्थान प्रयोगशालाओं (Royal Institute Laboratories) के निदेशक बनें तथा सन् 1833 में वे रसायन शास्त्र के प्रथम फुलेरियन आचार्य (First Fullerian Professor) बने। फैराडे का पहला महत्त्वपूर्ण कार्य-विश्लेषण रसायन में था। सन् 1821 के बाद उनका अधिकतर कार्य विद्युत् एवं चुंबकत्व तथा अन्य वैद्युत चुम्बकत्व सिद्धांतों से संबंधित थे। उन्हीं के विचारों के आधार पर ‘आधुनिक क्षेत्र सिद्धांत’ का प्रतिपादन हुआ। सन् 1834 में उन्होंने विद्युत् अपघटन से संबंधित दो नियमों की खोज की। फैराडे एक बहुत ही अच्छे एवं दयालु प्रकृति के व्यक्ति थे उन्होंने सभी सम्मानों को लेने से इंकार कर दिया। वे सभी वैज्ञानिक विवादों से दूर रहे। वे हमेशा अकेले काम करना पसंद करते थे। उन्होंने कभी भी सहायक नहीं रखा। उन्होंने विज्ञान को भिन्न-भिन्न तरीकों से प्रसारित (Disseminated) किया, जिसमें उनके द्वारा रॉयल संस्थान में प्रारंभ की गई प्रत्येक शुक्रवार के शाम की भाषणमाला सम्मिलित हैै। ‘मोमबत्ती के रासायनिक इतिहास’ विषय पर अपने क्रिसमस व्याख्यान के लिए वे प्रख्यात थे। उन्होंने लगभग 450 वैज्ञानिक शोधपत्र प्रकाशित किए।
7.10 अम्ल, क्षारक एवं लवण
अम्ल, क्षारक एवं लवण प्रकृति में व्यापक रूप से पाए जाते हैं। जठर रस, जिसमें हाइड्रोक्लोरिक अम्ल पाया जाता है, हमारे आमाशय द्वारा प्रचुर मात्रा (1.2-1.5 L/दिन) में स्रावित होता है। यह पाचन प्रक्रिया के लिए अति आवश्यक है। सिरके का मुख्य अवयव एसीटिक अम्ल है। नीबू एवं संतरे के रस में सिट्रिक अम्ल एवं एस्कॉर्बिक अम्ल तथा इमली में टार्टरिक अम्ल पाया जाता है। अधिकांश अम्ल स्वाद में खट्टे होते हैं, लैटिन शब्द Acidus से बना ‘एसिड’ शब्द इनके लिए प्रयुक्त होता है, जिसका अर्थ है खट्टा। अम्ल नीले लिटमस को लाल कर देते हैं तथा कुछ धातुओं से अभिक्रिया करके डाइहाइड्रोजन उत्पन्न करते हैं। इसी प्रकार क्षारक लाल लिटमस को नीला करते हैं तथा स्वाद में कड़वे और स्पर्श में साबुनी होते हैं। क्षारक का एक सामान्य उदाहरण कपड़े धोने का सोडा है, जो धुलाई के लिए प्रयुक्त होता है। जब अम्ल एवं क्षारक को सही अनुपात में मिलाते हैं, तो वे आपस में अभिक्रिया कर के लवण देते हैं। लवणों के कुछ सामान्य उदाहरण सोडियम क्लोराइड, बेरियम सल्फेट, सोडियम नाइट्रेट आदि है। सोडियम क्लोराइड (साधारण नमक) हमारे भोजन का एक मुख्य घटक है, जो हाइड्रोक्लोरिक अम्ल एवं सोडियम हाइड्रॉक्साइड की क्रिया से प्राप्त होता है। यह ठोस अवस्था में पाया जाता है, जिसमें धनावेशित सोडियम तथा ऋणावेशित क्लोराइड आयन आपस में विपरीत आवेशित स्पीशीज़ के मध्य स्थिर वैद्युत आकर्षण के कारण गुच्छे बना लेते हैं। दो आवेशों के मध्य स्थिर वैद्युत बल माध्यम के परावैद्युतांक के व्युत्क्रमानुपाती होता है। जल सार्वत्रिक विलायक है, जिसका परावैद्युतांक 80 हैै। इस प्रकार जब सोडियम क्लोराइड को जल में घोला जाता है, तब आयनों के मध्य स्थित वैद्युत आकर्षण बल 80 के गुणक में दुर्बल हो जाते है, जिससे आयन विलयन में मुक्त रूप से गमन करते हैं। ये जल-अणुओं के साथ जलयोजित होकर पृथक् हो जाते हैं।
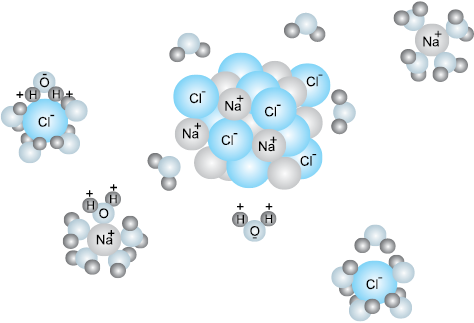
चित्र 7.10 जल में सोडियम क्लोराइड का वियोजन। Na+ तथा Cl– आयन ध्रुवीय जल-अणु के साथ जलयोजित होकर स्थायी हो जाते हैं।
जल में हाइड्रोक्लोरिक अम्ल के आयनन की तुलना एेसीटिक अम्ल के आयनन से करने पर हमें ज्ञात होता है कि यद्यपि दोनों ही ध्रुवी अणु हैं, फिर भी हाइड्रोक्लोरिक अम्ल अपने अवयवी आयनों में पूर्ण रूप से आयनित होता है, परंतु एेसीटिक अम्ल आंशिक रूप से (<5%) ही आयनित होता है। आयनन की मात्र इनके मध्य उपस्थित बंधों की सामर्थ्य तथा आयनों के जलयोजन की मात्र पर निर्भर करती है। पूर्व में वियोजन तथा आयनन पद भिन्न-भिन्न अर्थों में प्रयुक्त किए जाते रहे हैं। विलेय के आयन, जो उसकी ठोस अवस्था में भी विद्यमान रहते हैं, के जल में पृथक्करण की प्रक्रिया को ‘वियोजन’ कहते हैं (उदाहरणार्थ-सोडियम क्लोराइड), जबकि आयनन वह प्रक्रिया है, जिसमें उदासीन अणु विलयन में टूटकर आवेशित आयन देते हैं। यहाँ हम इन दोनों पदों को अंतर्बदल कर प्रयुक्त करेंगे।
7.10.1 अम्ल तथा क्षारक की आरेनियस धारणा-
आरेनियस के सिद्धांतानुसार अम्ल वे पदार्थ हैं, जो जल में अपघटित होकर हाइड्रोजन आयन 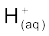 देते हैं तथा क्षारक वे पदार्थ हैं, जो हाइड्रॉक्सिल आयन
देते हैं तथा क्षारक वे पदार्थ हैं, जो हाइड्रॉक्सिल आयन देते हैं। इस प्रकार जल में एक अम्ल HX का आयनन निम्नलिखित समीकरणों में से किसी एक के द्वारा प्रदर्शित किया जा सकता है-
देते हैं। इस प्रकार जल में एक अम्ल HX का आयनन निम्नलिखित समीकरणों में से किसी एक के द्वारा प्रदर्शित किया जा सकता है-
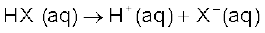
या 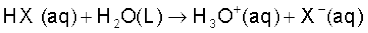
एक मुक्त प्रोट्रॉन, H+ अत्यधिक क्रियाशील होता है। स्वतंत्र रूप से जलीय विलयन में इसका अस्तित्व नहीं है। यह विलायक जल अणु के अॉक्सीजन से बंधित होकर त्रिकोणीय पिरामिडी हाइड्रोनियम आयन, H3O+ देता है (बॉक्स देखें)। हम H+(aq) तथा H3O+(aq) दोनों को ही जलयोजित हाइड्रोजन आयन, जो जल अणुओं से घिरा हुआ एक प्रोेटॉन है, के रूप में प्रयोग में लाते हैं। इस अध्याय में इसे साधारणतः H+(aq) या H3O+(aq) को अंतर्बदल कर प्रयोग करेंगे। इसका अर्थ जलयोजित प्रोटॉन है।
हाइड्रोनियम एवं हाइड्रॉक्सिल आयन
हाइड्रोजन आयन, जो स्वयं एक प्रोटॉन है, बहुत छोटा (व्यास =10–13cm) होने एवं जल अणु
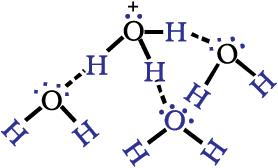
पर गहन विद्युत् क्षेत्र होने के कारण स्वयं को जल-अणु पर उपस्थित दो एकाकी युग्मों में किसी एक के साथ जुड़कर H3O+देता है। इसस्पीशीज को कई यौगिकों (उदाहरणार्थ- H3O+Cl-) में ठोस अवस्था में पहचाना गया है। जलीय विलयन में हाइड्रोनियमआयन फिर से जलयोजित होकर H5O2+, H7O3+ एवं H9O4+सदृश स्पीशीज बनाती है। इसी प्रकार हाइड्रॉक्सिल आयनजलयोजित होकर कई ऋणात्मक स्पीशीज H3O2-, H503- तथा H7O4-आदि बनाता है।
आरेनियस का जन्म स्वीडन में उपसाला के निकट हुआ था। सन् 1884 में उन्होंने उपसाला विश्वविद्यालय मेंविद्युत् अपघट्य विलयन की चालकताओं पर शोध ग्रंथ (Thesis) प्रस्तुत किया। अगले 5 वर्षों तक उन्होंने बहुत यात्राएँ कीं तथा यूरोप के शोध केंद्रों पर गए। सन् 1895 में वे नव स्थापित स्टॉकहोम विश्वविद्यालय में भौतिकी के आचार्य पद पर नियुक्त किए गए सन् 1897 से 1902 तक वे इसके रेक्टर भी रहे। सन् 1905 से अपनी मृत्यु तक वे स्टॉकहोम के नोबेल संस्थान में भौतिकी रसायन के निदेशक पद पर काम करते रहे। वे कई वर्षों तक विद्युत्-अपघट्य विलयनों पर काम करते रहे। 1899 में उन्होंने एक समीकरण, जो आज सामान्यतः आरेनियस समीकरण, कहलाता है, के आधार पर अभिक्रिया-दर की ताप पर निर्भरता कावर्णन किया।

उन्होंने कई क्षेत्रों में काम किया। प्रतिरक्षा रसायन (Immuno Chemistry), ब्रह्मांड विज्ञान (Cosmology), जीवन का स्रोत(Origin In Life) तथा हिम-युग के कारण (Cause Of Ice Age) संबंधी क्षेत्रों में उनका महत्त्वपूर्ण योगदान रहा। वे एेसे प्रथम व्यक्ति थे, जिन्होंने ‘ग्रीन हाउस प्रभाव’ को यह नाम देकर इसकी विवेचना की। सन् 1903 में विद्युत्-अपघट्यों के विघटन के सिद्धांत एवं रसायन विज्ञान के विकास में इसकी उपयोगिता पर उन्हें रसायन विज्ञान का नोबेल पुरस्कार मिला।
इसी प्रकार MOH सदृश्य किसी क्षारक का अणु जलीय विलयन में निम्नलिखित समीकरण के अनुसार आयनित होता है–
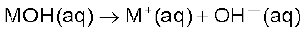
हाइड्रोक्सिल आयन भी जलीय विलयन में जलयोजित रूप से रहता है (बॉक्स देखें)। परंतु आरेनियस की अम्ल-क्षारक धारणा की अनेक सीमाएँ हैं। यह केवल पदार्थों के जलीय विलयन पर ही लागू होती है। यह अमोनिया जैसे पदार्थों के क्षारीय गुणों की स्पष्ट नहीं कर पाती है, जिनमें हाइड्रॉक्सिल समूह नहीं है।
7.10.2 ब्रन्स्टेद लोरी अम्ल एवं क्षारक
डेनिश रसायनज्ञ जोहान्स ब्रन्स्टेद (1874-1936) तथा अंग्रेज रसायनज्ञ थॉमस एम. लोरी (187
सारणी 7.5 कुछ सामान्य पदार्थों की pH के मान
4-1936) ने अम्लों एवं क्षारकाें की एक अधिक व्यापक परिभाषा दी। ब्रान्स्टेद-लोरी सिद्धांत के अनुसार वे पदार्थ, जो विलयन में प्रोटॉन H+ देने में सक्षम हैं, अम्ल हैं तथा वे पदार्थ, जो विलयन से प्रोेटॉन H+ ग्रहण करने में सक्षम हैं, क्षारक हैं।
संक्षेप में अम्ल प्रोटॉनदाता तथा क्षारक प्रोटॉन ग्राही हैं।
यहाँ हम NH3 के H2O में विलयन के उदाहरण पर विचार करें, जिसे निम्नलिखित समीकरण में दर्शाया गया है,
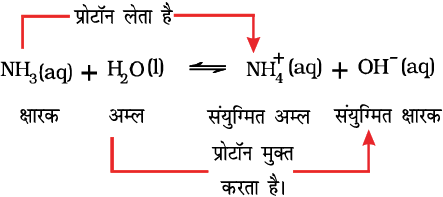
हाइड्रॉक्सिल आयनों की उपस्थिति के कारण क्षारीय विलयन बनता है। उपरोक्त अभिक्रिया में जल प्रोटॉन दाता है तथा अमोनिया प्रोटॉनग्राही है। इसलिए इन्हें क्रमशः ब्रन्स्टेद अम्ल तथा क्षारक कहते हैं। उत्क्रम अभिक्रिया में प्रोटॉन  से OH– को स्थानांतरित होता है। यहाँ
से OH– को स्थानांतरित होता है। यहाँ  ब्रन्स्टेद अम्ल एवं OH– ब्रन्स्टेद क्षारक का कार्य करते हैं। H2O एवं OH– अथवा
ब्रन्स्टेद अम्ल एवं OH– ब्रन्स्टेद क्षारक का कार्य करते हैं। H2O एवं OH– अथवा  एवं NH3 सदृश अम्ल और क्षार के युग्म, जो क्रमशः एक प्रोटॉन की उपस्थिति या अनुपस्थिति के कारण दूसरे भिन्न हैं, संयुग्मी अम्ल-क्षारक युग्म कहलाते हैं। इस प्रकार H2O का संयुग्मी क्षारक OH– है तथा क्षारक NH3 का संयुग्मी अम्ल
एवं NH3 सदृश अम्ल और क्षार के युग्म, जो क्रमशः एक प्रोटॉन की उपस्थिति या अनुपस्थिति के कारण दूसरे भिन्न हैं, संयुग्मी अम्ल-क्षारक युग्म कहलाते हैं। इस प्रकार H2O का संयुग्मी क्षारक OH– है तथा क्षारक NH3 का संयुग्मी अम्ल  है। यदि ब्रन्स्टेद अम्ल प्रबल है तो इसका संयुग्मी क्षारक दुर्बल होगा तथा यदि ब्रन्स्टेद अम्ल दुर्बल है, तो इसका संयुग्मी क्षारक प्रबल होगा। यहाँ ध्यान देने योग्य बात यह है कि संयुग्मी अम्ल में एक अतिरिक्त प्रोटॉन हेाता है तथा प्रत्येक संयुग्मी क्षार में एक प्रोट्रॉन कम होता है।
है। यदि ब्रन्स्टेद अम्ल प्रबल है तो इसका संयुग्मी क्षारक दुर्बल होगा तथा यदि ब्रन्स्टेद अम्ल दुर्बल है, तो इसका संयुग्मी क्षारक प्रबल होगा। यहाँ ध्यान देने योग्य बात यह है कि संयुग्मी अम्ल में एक अतिरिक्त प्रोटॉन हेाता है तथा प्रत्येक संयुग्मी क्षार में एक प्रोट्रॉन कम होता है।
जल में हाइड्रोक्लोरिक अम्ल के अन्य उदाहरण पर विचार करें। HCl (aq), H2O अणु को प्रोटॉन देकर अम्ल की भाँति एवं भ्2व् क्षारक की भाँति व्यवहार करता है।
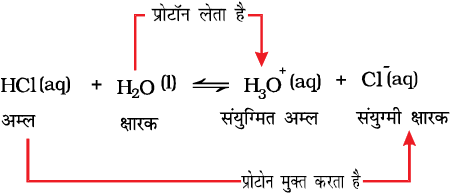
उपरोक्त समीकरण से देखा जा सकता है कि जल भी एक क्षारक की भाँति व्यवहार करता है, क्योंकि यह प्रोटॉन ग्रहण करता है। जब जल HCl से प्रोटॉन ग्रहण करता है, तो H3O+ स्पीशीज़ का निर्माण होता है। अत: Cl– आयन HCl अम्ल का संयुग्मी क्षारक है एवं HCl, Cl– क्षारक का संयुग्मी अम्ल है। इसी प्रकार, H2O भी H3O+ अम्ल का संयुग्मी क्षारक एवं H3O+, H2O क्षारक का संयुग्मी अम्ल है।
यह रोचक तथ्य है कि जल एक अम्ल तथा एक क्षारक की तरह दोहरी भूमिका दर्शाता है। HCl के साथ अभिक्रिया में जल क्षार की तरह व्यवहार करता है, जबकि अमोनिया के साथ प्रोटॉन त्यागकर एक अम्ल की भाँति व्यवहार करता है।
उदाहरण 7.12
निम्नलिखित ब्रन्स्टेद अम्लों के लिए संयुग्मी क्षारक क्या है?
HF, H2SO4 तथा HCO–3
हल
प्रत्येक के संयुग्मी क्षारकों में एक प्रोटॉन कम होना चाहिए। अतः संगत संयुग्मी क्षारक क्रमशः F–, HSO–4 तथा HCO–3 हैं।
उदाहरण 7.13
ब्रन्स्टेद क्षारकों NH2–, NH3 तथा HCOO– के लिए संगत ब्रन्स्टेद अम्ल लिखिए।
हल
संयुग्मी अम्ल के पास क्षारक की अपेक्षा एक प्रोटॉन अधिक होना चाहिए। अतः संगत संयुग्मी अम्ल क्रमशः NH3, NH+4 तथा HCOOH हैं।
उदाहरण 14
H2O, HCO3–, HSO4– तथा NH3 ब्रन्स्टेदअम्ल तथा ब्रन्स्टेद क्षारक-दोनों प्रकार से काम कर सकते हैं। प्रत्येक के लिए संगत संयुग्मी अम्ल तथा क्षारक लिखिए।
हल
उत्तर निम्नलिखित सारणी में दिया गया है–

7.10.3 लूइस अम्ल एवं क्षारक
जी.एन. लूइस ने सन् 1923 में अम्ल को ‘इलेक्ट्रॉनयुग्मग्राही’ तथा क्षारक को ‘इलेक्ट्रॉन युग्मदाता’ के रूप में पारिभाषित किया। जहाँ तक क्षारकों का प्रश्न है, ब्रन्स्टेद-लोरी क्षारक तथा लूइस क्षारक में कोई विशेष अंतर नहीं है, क्योंकि दोनों ही सिद्धांतों में क्षारक एकाकी इलेक्ट्रॉन युग्म देता है, परंतु लूइस अम्ल सिद्धांत के अनुसार, बहुत से एेसे पदार्थ भी अम्ल हैं, जिनमें प्रोटॉन नहीं है। कम इलेक्ट्रॉन वाले BF3 की NH3 से अभिक्रिया इसका एक विशिष्ट उदाहरण है। इस प्रकार प्रोटॉनरहित एवं इलेक्ट्रॉन की कमी वाला BF3 यौगिक NH3 के साथ क्रिया कर उसका एकाकी इलेक्ट्रॉन युग्म लेकर अम्ल का कार्य करता है। इस अभिक्रिया को निम्नलिखित समीकरण द्वारा प्रदर्शित किया जा सकता है–
BF3 + :NH3 → BF3:NH3
इलेक्ट्रॉन क्षुद्र स्पीशीज़, जैसे – AlCl3, Co3+, Mg2+ आदि लूइस अम्ल की भाँति व्यवहार करती हैं, जबकि H2O, NH3, OH– स्पीशीज़ जो एक इलेक्ट्रॉन युग्म दान कर सकती है, लूइस क्षारक की तरह व्यवहार करती है।
उदाहरण 7.15
निम्नलिखित को लूइस अम्लों तथा क्षारकों में वर्गीकृत कीजिए और बताइए कि ये एेसा व्यवहार क्यों दर्शाते हैं?
(क) HO– (ख) F– (ग) H+ (घ) BCl3
हल
(क) चूँकि हाइड्रॉक्सिल आयन एक लूइस क्षारक है, अतः यह इलेक्ट्रॉन युग्म दान कर सकता है।
(ख) चूँकि फ्लुओराइड आयन लूइस क्षारक है, अतः यह चारों इलेक्ट्रॉन युग्म में से किसी एक का दान कर सकता है।
(ग) चूँकि प्रोटॉन लूइस अम्ल है, अतः हाइड्रॉक्सिल आयन तथा फ्लुओराइड आयनों, जैसे– क्षारकों से इलेक्ट्रॉन युग्म ले सकता है।
(घ) चूँकि बोरोन ट्राइक्लोराइड BCl3 लूइस अम्ल है, अतः अमोनिया अथवा अमीन अणुओं आदि क्षारकों से इलेक्ट्रॉन युग्म ले सकता है।
7.11 अम्लों एवं क्षारकों का आयनन
अधिकतर रासायनिक एवं जैविक अभिक्रियाएं जलीय माध्यम में होती हैं। इन्हें समझने के लिए आर्रेनियस की परिभाषा के अनुसार अम्लों एवं क्षारकेां के आयनन की विवेचना उपयोगी होगी। परक्लोरिक अम्ल (HClO4) हाइड्रोक्लोरिक अम्ल (HCl), हाइड्रोब्रोमिक अम्ल (HBr) हाइड्रोआयोडिक अम्ल (HI), नाइट्रिक अम्ल (HNO3) एवं सल्फ्यूरिक अम्ल (H2SO4) आदि अम्ल ‘प्रबल’ कहलाते हैं, क्योंकि यह जलीय माध्यम में संगत आयनों में लगभग पूर्णतः वियोजित होकर प्रोेटॉनदाता के समान कार्य करते हैं। इसी प्रकार लीथियम हाइड्रॉक्साइड (LiOH), सोडियम हाइड्रॉक्साइड (NaOH), पोटैशियम हाइड्रॉक्साइड (KOH), सीज़ियम हाइड्रॉक्साइड (CsOH) एवं बेरियम हाइड्रॉक्साइड Ba (OH)2, जलीय माध्यम में संगत आयनों में लगभग पूर्णतः वियोजित होकर H3O तथा OH– आयन देते हैं। आरेनियस सिद्धांत के अनुसार, ये प्रबल क्षारक हैं, क्योंकि ये माध्यम में पूर्णतः वियोजित होकर क्रमशः OH– आयन प्रदान करते हैं। विकल्पतः अम्ल या क्षार का सामर्थ्य अम्लों एवं क्षारकों के ब्रन्स्टेदलौरी सिद्धांत के अनुसार मापा जा सकता है। इसके अनुसार, ‘प्रबल अम्ल’ से तात्पर्य ‘एक उत्तम प्रोटॉनदाता’ एवं प्रबल क्षारक से तात्पर्य ‘उत्तम प्रोटॉनग्राही’ है।
दुर्बल अम्ल HA के अम्ल-क्षार वियोजन साम्य पर विचार करें–
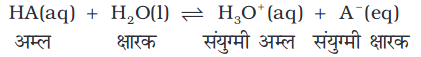
खंड 7.10.2 में हमने देखा कि अम्ल (या क्षारक) वियोजन साम्य एक प्रोेटॉन के अग्र एवं प्रतीप दिशा में स्थानांतरण से युक्त एक गतिक अवस्था है। अब यह प्रश्न उठता है कि यदि साम्य गतिक है, तो वह समय के साथ किस दिशा में अग्रसर होगा? इसे प्रभावित करनेवाला प्रेरक बल कौन सा है? इन प्रश्नों के उत्तर देने के लिए हम वियोजन साम्य में सम्मिलित दो अम्लों (या क्षारकों) के सामर्थ्य की तुलना के संदर्भ में विचार करेंगे। उपरोक्त वर्णित अम्ल-वियोजन साम्य में उपस्थित दो अम्लों HA एवं H3O+ पर विचार करें। हमें यह देखना होेगा कि इनमें से कौन-सा प्रबल प्रोटॉनदाता है। प्रोटॉन देने की जिसकी भी प्रवृत्ति अन्य से अधिक होगी, वह ‘प्रबल अम्ल’ कहलाएगा एवं साम्य दुर्बल अम्ल की दिशा में अग्रसर होगा। जैसे, यदि HA, H3O+ से प्रबल अम्ल है, तो HA प्रोेटॉन दान करेगा, H3O+ नहीं। विलयन में मुख्य रूप से A– एवं H3O+ आयन होंगे। साम्य दुर्बल अम्ल एवं क्षार की दिशा में अग्रसर होता है, क्योंकि प्रबल अम्ल प्रबल क्षार को प्रोटॉन देते हैं।
इसके अनुसार, प्रबल अम्ल जल में पूर्णतः आयनित होता है। परिणामी क्षारक अत्यंत दुर्बल होगा, अर्थात् प्रबल अम्लों के संयुग्मी क्षारक अत्यंत दुर्बल होते हैं। प्रबल अम्ल जैसे परक्लोरिक अम्ल HClO4, हाइड्रोक्लोरिक अम्ल HCl, हाइड्रोब्रामिक अम्ल HBr, हाइड्रोआयोडिक अम्ल HI, नाइट्रिक अम्ल HNO3, सल्फ्यूरिक अम्ल H2SO4 आदि प्रबल अम्लों के संयुग्मी क्षारक ClO4–, Cl–, Br–, I–, NO3– आयन होंगे, जो H2O से अधिक दुर्बल क्षारक है। इसी प्रकार अत्यंत प्रबल क्षार, अत्यंत दुर्बल अम्ल देगा, जबकि एक दुर्बल अम्ल, जैसे– HA अणु उपस्थित रहेंगे। नाइट्रस अम्ल (HNO2), हाइड्रोफ्लुओरिक अम्ल (HF) एवं एसिटिक अम्ल (CH3COOH) प्रतीकात्मक दुर्बल अम्ल हैं। यह बात ध्यान रखने योग्य है कि दुर्बल अम्लों के संयुग्मी क्षारक अत्यंत प्रबल होते हैं। उदाहरण के लिए, NH–2, O2– एवं H– उत्तम प्रोटॉनग्राही है। अतः H2O से अत्यंत प्रबल क्षारक है। फिनाफ्थालीन, ब्रोमोथाइमोल ब्लू आदि जल में विलेय कार्बनिक यौगिक दुर्बल अम्लों की भाँति व्यवहार करते हैं। इनके अम्ल (HIn) तथा संयुक्त क्षार (In–) भिन्न रंग दर्शाते हैं।
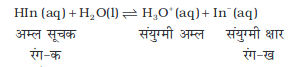
एेसे यौगिकाें का उपयोग अम्ल क्षार अनुमापन में सूचकों के रूप में H+ आयनों की सांद्रता निकालने के लिए किया जाता है।
7.11.1 जल का आयनन स्थिरांक एवं इसका आयनिक गुणनफल
हमने खंड 7.10.2 में यह देखा कि कुछ पदार्थ (जैसे जल) अपने विशिष्ट गुणों के कारण अम्ल एवं क्षारक– दोनों की तरह व्यवहार कर सकते हैं। अम्ल HA की उपस्थिति में यह प्रोटॉन ग्रहण करता है एवं क्षारक की तरह व्यवहार करता है, जबकि क्षारक B– की उपस्थिति में यह प्रोटॉन देकर अम्ल की तरह व्यवहार करता है। शुद्ध जल H2O का एक अणु प्रोटॉन देता है एवं अम्ल की तरह व्यवहार करता है तथा जल का दूसरा अणु एक प्रोटॉन ग्रहण करता है एवं उसी समय क्षारक की तरह व्यवहार करता है। निम्नलिखित साम्यावस्था स्थापि त होती है–
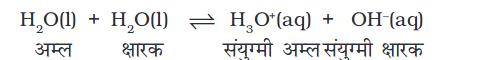
वियोजन स्थिरांक को हम इस तरह प्रदर्शित करते हैं–
K = [H3O+] [OH–] / [H2O] (7.26)
जल की सांद्रता को हर से हटा देते हैं, क्योंकि इसकी सांद्रता स्थिर रहती है। [H2O] को साम्य स्थिरांक सम्मिलित करने पर नया स्थिरांक Kw प्राप्त होता है, जिसे जल का आयनिक गुणनफल कहते हैं।
Kw = [H+][OH–] (7.27)
298 K पर प्रायोगिक रूप H+ आयन की सांद्रता
1.0 × 10–7 M पाई गई है और जल के वियोजन से उत्पन्न H+ और OH– आयनों की संख्या बराबर होती है,
हाइड्रॉक्सिल आयनों की सांद्रता, [OH–] = [H+] =
1.0 × 10–7 M
इस प्रकार, 298 K पर Kw का मान
Kw = [H3O+][OH–] = (1 × 10–7)2 = 1 × 10–14 M2 (7.28)
Kw का मान ताप पर निर्भर करता है, क्योंकि यह साम्यावस्था स्थिरांक है।
शुद्ध जल का घनत्व 1000 g/L है और इसका मोलर द्रव्यमान 18.0 g /mol है। इससे शुद्ध जल की मोलरता हम इस तरह निकाल सकते हैं–
[H2O] = (1000 g /L)(1 mol/18.0 g) = 55.55 M.
इस प्रकार, वियोजित एवं अवियोजित योजित जल का अनुपात–
10–7 / (55.55) = 1.8 × 10–9 or ~ 2 in 10–9
(इस प्रकार साम्य मुख्यतः अवियोजित जल के अणुओं की ओर रहता है।)
अम्लीय, क्षारीय और उदासीन जलीय विलयनों को H3O+ एवं OH– की सांद्रताओं के सापेक्षिक मानों द्वारा विभेदित किया जा सकता है–
अम्लीय : [H3O+] > [OH– ]
उदासीन: [H3O+] = [OH– ]
क्षारीय: [H3O+] < [OH–]
7.11.2 pH स्केल
हाइड्रोनियम आयन की मोलरता में सांद्रता को एक लघुगुणकीय मापक्रम (Logarithmic Scale) में सरलता से प्रदर्शित किया जाता है, जिसे pH स्केल कहा जाता है।
हाइड्रोजन आयन की सक्रियता 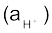 के ऋणात्मक 10 आधारीय लघुगुणकीय मान को pH कहते हैं। कम सांद्रता (<0.01M) पर हाइड्रोजन आयन की सक्रियता, संख्यात्मक रूप से इसकी मोलरता, जो (H+) द्वारा प्रदर्शित की जाती है, के तुल्य होती है। हाइड्रोजन आयन की सक्रियता की कोई इकाई नहीं होती है, इसे इस समीकरण द्वारा परिभाषित किया जा सकता है–
के ऋणात्मक 10 आधारीय लघुगुणकीय मान को pH कहते हैं। कम सांद्रता (<0.01M) पर हाइड्रोजन आयन की सक्रियता, संख्यात्मक रूप से इसकी मोलरता, जो (H+) द्वारा प्रदर्शित की जाती है, के तुल्य होती है। हाइड्रोजन आयन की सक्रियता की कोई इकाई नहीं होती है, इसे इस समीकरण द्वारा परिभाषित किया जा सकता है–
 = [H+] / mol L–1
= [H+] / mol L–1
निम्नलिखित समीकरण pH एवं हाइड्रोजन आयन सांद्रता में संबंध दर्शाता है–
pH = – log aH+ = – log {[H+] / mol L–1}
इस प्रकार HCl के अम्लीय विलयन (10–2 M) के pH का मान = 2 होता है। इसी तरह NaOH के एक क्षारीय विलयन, जिसमें [OH–] = 10–4 तथा [H3O+] = 10–10 M की pH = 10 होगी। शुद्ध तथा उदासीन जल में 298 K पर हाइड्रोजन आयन की सांद्रता 10–7M होती है, इसलिए इसका pH = –log (10–7) = 7 होगा।
यदि कोई जलीय विलयन अम्लीय है, तो उसका pH 7 से कम एवं यदि वह क्षारीय है, तो उसका pH 7 से अधिक होगा।
इस प्रकार,
अम्लीय विलयन की pH < 7
क्षारीय विलयन की pH < 7
उदासीन विलयन की pH = 7
अब 298K पर पुनर्विचार समीकरण 7.28 पर करें–
Kw = [H3O+] [OH–] = 10–14
समीकरण के दोनों ओर का ऋणात्मक लघुगुणक लेने परः
–log Kw = – log {[H3O+] [OH–]}
= – log [H3O+] – log [OH–]
= – log 10–14
pKw = pH + pOH = 14 (7.29)
ध्यान देने योग्य बात यह है कि यद्यपि Kw का मान तापक्रम के साथ परिवर्तित होता है। तथापि तापक्रम के साथ pH के मान में परिवर्तन इतने कम होते हैं कि हम अकसर उसकी उपेक्षा कर देते हैं।
pKw जलीय विलयनों के लिए महत्त्वपूर्ण राशि होती है। यह हाइड्रोजन तथा हाइड्रोक्सिल आयनों की सांद्रता को नियंत्रित करती है, चूँकि इनका गुणनफल स्थिरांक होता है। अतः यह ध्यानवत रहे कि pH मापक्रम लघुगुणक होता है। pH के मान में एक इकाई परिवर्तन का अर्थ है [H+] की सांद्रता में गुणक 10 का परिवर्तन। इसी प्रकार यदि हाइड्रोजन आयन सांद्रता [H+] में 100 गुणक का परिवर्तन हो, तो pH के मान में 2 इकाई का परिवर्तन होगा। अब आप समझ गए होंगे कि क्यों ताप द्वारा pH में परिवर्तन की उपेक्षा हम कर देते हैं।
जैविक एवं प्रसाधन-संबंधी अनुप्रयोगों में विलयन के pH का मापन अत्यधिक आवश्यक है। pH पेपर, जो विभिन्न pH वाले विलयन में भिन्न-भिन्न रंग देता है, की सहायता से pH के लगभग मान का पता लगाया जा सकता है। आजकल चार पट्टीवाला pH पेपर मिलता है। एक ही पर भिन्न-भिन्न पट्टियाँ भिन्न-भिन्न रंग देती हैं (चित्र 7.11) pH पेपर द्वारा 1-14 तक के pH मान लगभग 0.5 की यथार्थता तक ज्ञात किया जा सकता है।
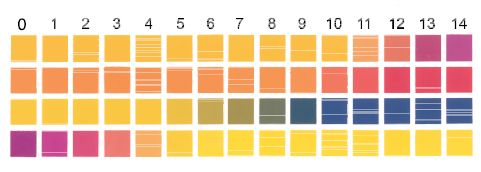
चित्र 7.11: समान pH पर भिन्न रंग देनेवाली pH पेपर की चार पट्टियाँ
उच्च यथार्थता के लिए pH मीटर का उपयोग किया जाता है। pH मीटर एक एेसा यंत्र है, जो परीक्षण-विलयन के विद्युत्-विभव पर आधारित pH का मापन 0.001 यथार्थता तक करता है। आजकल बाजार में कलम के बराबर आकारवाले pH मीटर उपलब्ध हो गए हैं। कुछ सामान्य पदार्थों की pH सारणी 7.5 में दी गई है–
उदाहरण 7.16
पेय पदार्थ के नमूने में हाइड्रोजन आयन की सांद्रता 3.8 × 10–3M है। इसका pH क्या होगा?
हल
pH = – log[3.8 × 10–3]= – {log[3.8] +
log[10–3]}
= – {(0.58) + (– 3.0)} = – { – 2.42} = 2.42
अतः पेय पदार्थ का pH 2.42 है यह अम्लीय है।
उदाहरण 7.17
1.0 × 10–8M HCl विलयन के pH की गणना करें।
हल
2H2O (l) ⇌ H3O+ (aq) + OH–(aq) Kw = [OH–][] = 10–14
माना x=[OH–]= जल से प्राप्त H3O+ A
H3O+ सांद्रता (I) जो घुलित HCl से प्राप्त होती है जैसे- HCl (aq) + H2O (l)⇌ H3O+ (aq)+Cl– (aq) तथा (ii)जलके आयनीकाण से प्राप्त होती है। यहाँ दोनों H3O+ उद्गमों पर विचार करना होगा-
[H3O+] = 10–8 + x
Kw = (10–8 + x)(x) = 10–14
अथवा x2 + 10–8 x – 10–14 = 0
[OH– ] = x = 9.5 × 10–8
अतः pOH = 7.02 तथा pH = 6.98
7.11.3 दुर्बल अम्लों के आयनन स्थिरांक
आइए, जलीय विलयन में आंशिक रूप से आयनित एक दुर्बल अम्ल HX पर विचार करें। निम्नलिखित समीकरणों में से किसी भी समीकरण द्वारा अवियोजित HX एवं आयनों H+(aq) तथा X–(aq) के मध्य स्थापित साम्यावस्था को प्रदर्शित किया जा सकता है।
HX(aq) + H2O(l) ⇌ H3O+(aq) + X–(aq)
प्रारंभिक सांद्रता (M)
c 0 0
माना α आयनीकरण की मात्रा है।
सांद्रता में परिवर्तन (M)
-cα +cα +cα
साम्य सांद्रता (M)
c -cα cα cα
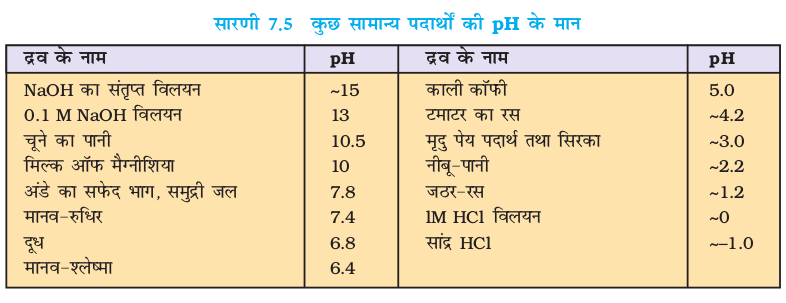
जहाँ c = अवियोजित अम्ल HX की प्रारंभिक सांद्रता तथा α = HX के आयनन की मात्रा है।
इन संकेतकों का उपयोग कर के हम उपर्युक्त अम्ल वियोजन साम्य के लिए साम्यावस्था स्थिरांक व्युत्पन्न कर सकते हैं।
Ka = c2α2 / c(1-α) = cα2 / (1-α)
Ka को अम्ल HX का वियोजन या आयनन स्थिरांक कहते हैं। इसे वैकल्पिक रूप से हम इस प्रकार मोलरता के रूप में प्रदर्शित कर सकते हैं–
Ka = [H+][X–] / [HX] (7.30)
किसी निश्चित ताप पर Ka का मान अम्ल HX की प्रबलता का माप है, अर्थात्् Ka का मान जितना अधिक होगा, अम्ल उतना ही अधिक प्रबल होगा। Ka विमारहित राशि है, जिसमें सभी स्पीशीज़ की सांद्रता की मानक-अवस्था 1M है।
कुछ चुने हुए अम्लों के आयनन-स्थिरांक सारणी 7.6 में दिए गए हैं।
हाइड्रोजन आयन सांद्रता के लिए pH मापक्रम इतना उपयोगी है कि इसे pKw के अतिरिक्त अन्य स्पीशीज़ एवं राशियों के लिए भी प्रयुक्त किया गया है।
इस प्रकार,
pKa = – log (Ka) (7.31)
अम्ल के आयनन स्थिरांक Ka तथा प्रारंभिक सांद्रता c ज्ञात होने पर समस्त स्पीशीज़ की साम्य सांद्रता तथा अम्ल के आयनन की मात्रा से विलयन की pH की गणना संभव है।
सारणी 7.6 298K पर कुछ चुने हुए दुर्बल अम्लों के आयनन स्थिरांक के मान
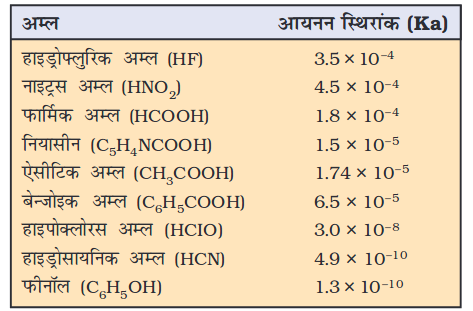
दुर्बल वैद्युत्अपघट्य की pH इन पदों से निकाली जा सकती है–
पद-1 वियोजन से पूर्व उपस्थित स्पीशीज़ को ब्रॅन्स्टेद लोरी अम्ल/क्षारक के रूप में ज्ञात किया जाता है।
पद-2 सभी संभावित अभिक्रियाओं के लिए संतुलित समीकरण लिखे जाते हैं, जैसे–स्पीशीज़, जो अम्ल एवं क्षारक दोनों के रूप में कार्य करती है।
पद-3 उच्च Ka वाली अभिक्रिया को प्राथमिक अभिक्रिया के रूप में चिह्नित किया जाता है, जबकि अन्य अभिक्रियाएं पूरक अभिक्रियाएं होती हैं।
पद-4 प्राथमिक अभिक्रिया की सभी स्पीशीज़ के निम्न मानों को सारणी के रूप में सूचीबद्ध किया जाता है–
(क) प्रारंभिक सांद्रता, c
(ख) साम्य की ओर अग्रसर होने पर आयनन की मात्रा α के रूप में सांद्रता में परिवर्तन
(ग) साम्य सांद्रता
पद-5 मुख्य अभिक्रिया के लिए साम्यावस्था स्थिरांक समीकरण में साम्य सांद्रताओं को रखकर α के लिए हल
करते हैं।
पद-6 मुख्य अभिक्रिया की स्पीशीज़ की सांद्रता की गणना करते हैं।
पद-7 pH की गणना
pH = – log [H3O+]
उपर्युक्त विधि को इस उदाहरण से समझाया गया है–
उदाहरण 7.18
HF का आयनन स्थिरांक 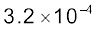 है। 0.22M विलयन में HF की आयनन की मात्रा की और विलयन में उपस्थित समस्त स्पीशीज़ (H3O+, F– तथा HF) की सांद्रता तथा pH की गणना कीजिए।
है। 0.22M विलयन में HF की आयनन की मात्रा की और विलयन में उपस्थित समस्त स्पीशीज़ (H3O+, F– तथा HF) की सांद्रता तथा pH की गणना कीजिए।
हल
निम्नलिखित प्रोटॉन स्थानांतरण अभिक्रियाएं संभव हैं–
(1) HF + H2O ⇌ H3O+ + F– Ka = 3.2 × 10–4
(2) H2O + H2O ⇌ H3O+ + OH–
Kw = 1.0 × 10–14
क्याेंकिKa >> Kw,मुख्य अभिक्रिया
HF + H2O ⇌ H3O+ + F–
प्रारंभिक सांद्रता (M)
0.02 0 0 (0)
सांद्रता परिवर्तन (M)
–0.02α +0.02α +0.02α
साम्य सांद्रता (M)
0.02 – 0.02 α 0.02 α 0.02α
साम्य अभिक्रिया के लिए साम्य सांद्रताओं को प्रतिस्थापित करने पर
Ka = (0.02α)2 / (0.02 – 0.02α) = 0.02 α2 / (1 –α) = 3.2 × 10–4
हमें निम्नलिखित द्विघात समीकरण प्राप्त होता है–
α2 + 1.6 × 10–2α – 1.6 × 10–2 = 0
द्विघात-समीकरण को हल करने पर α के दो मान प्राप्त होते हैं–
α = + 0.12 और –0.12
α का ऋणात्मक मान संभव नहीं है। अतः α = 0.12
स्पष्ट है कि आयनन मात्रा, α = 0.12 हो तो अन्य स्पीशीज़ (जैसे–HF, F– तथा H3O+) की साम्य सांद्रताएँ इस प्रकार हैं–
[H3O+] = [F –] = cα = 0.02 × 0.12 =
2.4 × 10–3 M
[HF] = c(1 – α) = 0.02 (1 – 0.12) =
17.6 × 10-3 M
pH = – log[H+] = –log(2.4 × 10–3) = 2.62
उदाहरण 7.19
0.1M एकल क्षारीय अम्ल का pH 4.50 है। साम्यावस्था पर H+,A– तथा HA की सांद्रता की गणना कीजिए। साथ ही एकल क्षारीय अम्ल के Ka तथा pKa के मान की भी गणना कीजिए।
हल
pH = – log
