Table of Contents

एकक 8
अपचयोपचय अभिक्रियाएँ
Redox Reactions
उद्देश्य
- अपचयन तथा अॉक्सीकरण द्वारा होने वाली अपचयोपचय अभिक्रियाआें के वर्ग की पहचान कर सकेंगे;
- अॉक्सीकरण, अपचयन (अॉक्सीडेंट), अॉक्सीकारक तथा अपचायक (रिडक्टेंट) को परिभाषित कर सकेंगे;
- इलेक्ट्रॉन-स्थानांतरण द्वारा अपचयोपचय अभिक्रियाओं की क्रियाविधि की व्याख्या कर सकेंगे;
- यौगिकों में तत्त्वों की अॉक्सीकरण-संख्या के आधार पर अॉक्सीकारक या अपचायक की पहचान कर सकेंगे;
- अपचयोपचय अभिक्रियाओं का वर्गीकरण, योग, अपघटन, विस्थापन एवं असमानुपातन अभिक्रियाओं के रूप में कर सकेंगे;
- विभिन्न अपचायकों तथा अॉक्सीकारकों के तुलनात्मक क्रम का निर्धारण कर सकेंगे;
- रासायनिक समीकरणों को (i) अॉक्सीकरण- संख्या तथा (ii) अर्द्ध-अभिक्रिया या आयन-इलेक्ट्रॉन विधियों द्वारा संतुलित कर सकेंगे;
- इलेक्ट्रोड विधि (प्रक्रम) की सहायता से अपचयोपचय अभिक्रियाओं की अवधारणा को सीख सकेंगे।
8.1 अपचयोपचय अभिक्रियाएँ
2 Mg (s) + O2 (g) → 2 MgO (s) (8.1)
S (s) + O2 (g) → SO2 (g) (8.2)
अभिक्रिया 8.1 तथा 8.2 में मैग्नीशियम और सल्फर तत्त्वों का अॉक्सीजन से मिलकर अॉक्सीकरण हो जाता है। समान रूप से अॉक्सीजन से संयोग के कारण मेथैन का अॉक्सीकरण हो जाता है।
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) (8.3)
यदि ध्यान से देखें, तो अभिक्रिया 8.3 में मेथैन में हाइड्रोजन के स्थान पर अॉक्सीजन आ गया है। इससे रसायनशास्त्रियों को प्रेरणा मिली कि हाइड्रोजन के निष्कासन को ‘अॉक्सीकरण’ कहा जाए। इस प्रकार अॉक्सीकरण पद को विस्तृत करके पदार्थ से हाइड्रोजन के निष्कासन को भी ‘अॉक्सीकरण’ कहते हैं। निम्नलिखित अभिक्रिया में भी हाइड्रोजन का निष्कासन अॉक्सीकरण का उदाहरण है–
2 H2S(g) + O2 (g) → 2 S (s) + 2 H2O (l) (8.4)
रसायनशास्त्रियों के ज्ञान में जैसे-जैसे वृद्धि हुई, वैसे-वैसे उन अभिक्रियाओं, जिनमेें 8.1 से 8.4 की भाँति अॉक्सीजन के अलावा अन्य ऋणविद्युती तत्त्वों का समावेश होता है, को वे ‘अॉक्सीकरण’ कहने लगे। मैग्नीशियम का अॉक्सीकरण फ्लुओरीन, क्लोरीन तथा सल्फर द्वारा निम्नलिखित अभिक्रियाआें में दर्शाया गया है–
Mg (s) + F2 (g) → MgF2 (s) (8.5)
Mg (s) + Cl2 (g) → MgCl2 (s) (8.6)
Mg (s) + S (s) → MgS (s) (8.7)
8.5 से 8.7 तक की अभिक्रियाएँ अॉक्सीकरण अभिक्रिया समूह में शामिल करने पर रसायनशास्त्रियों को प्रेरित किया कि वे हाइड्रोजन जैसे अन्य धनविद्युती तत्त्वों के निष्कासन को भी ‘अॉक्सीकरण’ कहने लगे। इस प्रकार अभिक्रिया–
2K4[Fe(CN)6](aq)+ H2O2 (aq) → 2K3 [Fe(CN)6](aq) + 2 KOH (aq)
को धनविद्युती तत्त्व K के निष्कासन के कारण ‘पोटैशियम फैरोसाइनाइड का अॉक्सीकरण’ कह सकते हैं। सारांश में अॉक्सीकरण पद की परिभाषा इस प्रकार है– किसी पदार्थ
में अॉक्सीजन/ऋणविद्युती तत्त्व का समावेश या हाइड्रोजन/धनविद्युती तत्त्व का निष्कासन अॉक्सीकरण कहलाता है।
पहले किसी यौगिक से अॉक्सीजन का निष्कासन अपचयन माना जाता था, लेकिन आजकल अपचयन पद को विस्तृत करके पदार्थ से अॉक्सीजन/ऋणविद्युती तत्त्व के निष्कासन को या हाइड्रोजन/धनविद्युती तत्त्व के समावेश को अपचयन कहते हैं।
उपरोक्त परिभाषा के अनुसार निम्नलिखित अभिक्रिया अपचयन प्रक्रम का उदाहरण है–
2 HgO (s) 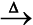 2 Hg (l) + O2 (g) (8.8)
2 Hg (l) + O2 (g) (8.8)
(मरक्यूरिक अॉक्साइड से अॉक्सीजन का निष्कासन)
2 FeCl3 (aq) + H2 (g) → 2 FeCl2 (aq) + 2 HCl(aq) (8.9)
(विद्युत्ऋणी तत्त्व क्लोरीन का फेरिक क्लोराइड से निष्काषन)
CH2 = CH2 (g) + H2 (g) → H3C – CH3 (g) (8.10)
(हाइड्रोजन का योग)
2HgCl2 (aq) + SnCl2 (aq) → Hg2Cl2 (s)+SnCl4 (aq) (8.11)
(मरक्युरिक क्लोराइड से योग)
क्योंकि अभिक्रिया 8.11 में स्टैनसक्लोराइड में वैद्युत ऋणी तत्त्व क्लोरीन का योग हो रहा है, इसलिए साथ-साथ स्टैनिक क्लोराइड के रूप में इसका अॉक्सीकरण भी हो रहा है। उपरोक्त सभी अभिक्रियाओं को ध्यान से देखने पर शीघ्र ही इस बात का आभास हो जाता है कि अॉक्सीकरण तथा अपचयन हमेशा साथ-साथ घटित होते हैं। इसीलिए इनके लिए अपचयोपचय शब्द दिया गया।
उदाहरण 8.1
नीचे दी गई अभिक्रियाओं में पहचानिए कि किसका अॉक्सीकरण हो रहा है और किसका अपचयन–
(i) H2S (g) + Cl2 (g) → 2 HCl (g) + S (s)
(ii) 3Fe3O4 (s)+ (s) 8 Al (s) → 9 Fe (s) + 4Al2O3 (s)
(iii) 2 Na (s) + H2 (g) → 2 NaH (s)
हल
(i) H2S का अॉक्सीकरण हो रहा है, क्योंकि हाइड्रोजन से ऋणविद्युती तत्त्व क्लोरीन का संयोग हो रहा है या धनविद्युती तत्त्व हाइड्रोजन का सल्फर से निष्कासन हो रहा है। हाइड्रोजन के संयोग के कारण क्लोरीन का अपचयन हो रहा है।
(ii) अॉक्सीजन के संयोग के कारण एेलुमीनियम का अॉक्सीकरण हो रहा है। अॉक्सीजन के निष्कासन के कारण फैरस फैरिक अॉक्साइड (Fe3O4) का अपचयन हो रहा है।
(iii) विद्युत्ऋणता की अवधारणा के सावधानीपूर्वक अनुप्रयोग से हम यह निष्कर्ष निकालते हैं कि सोडियम अॉक्सीकृत तथा हाइड्रोजन अपचयित होता है।
अभिक्रिया (iii) का चयन यहाँ इसलिए किया गया है, ताकि हम अपचयोपचय अभिक्रियाओं को अलग तरह से परिभाषित कर सकें।
8.2 इलेक्ट्रॉन स्थानांतरण अभिक्रियाओं के रूप में अपचयोपचय अभिक्रियाएँ
हम यह जान चुके हैं कि निम्नलिखित सभी अभिक्रियाआें में या तो अॉक्सीजन या अधिक ऋणविद्युती तत्त्व के संयोग के कारण सोडियम का अॉक्सीकरण हो रहा है; साथ-साथ क्लोरीन, अॉक्सीजन तथा सल्फर का अपचयन भी हो रहा है, क्योंकि इन तत्त्वों से धनविद्युती तत्त्व सोडियम का संयोग हो रहा है–
2Na(s) + Cl2(g) → 2NaCl (s) (8.12)
4Na(s) + O2(g) → 2Na2O(s) (8.13)
2Na(s) + S(s) → Na2S(s) (8.14)
रासायनिक आबंध के नियमों के आधार पर सोडियम क्लोराइड, सोडियम अॉक्साइड तथा सोडियम सल्फाइड हमें आयनिक यौगिकों के रूप में विदित हैं। इन्हें Na+Cl– (s), (Na+)2O2–(s) तथा (Na+)2 S2– (s) के रूप में लिखना ज्यादा उचित होगा। विद्युत् आवेश उत्पन्न होने के कारण 8.12 से 8.14 तक की अभिक्रियाओं को हम यों लिख सकते हैं–
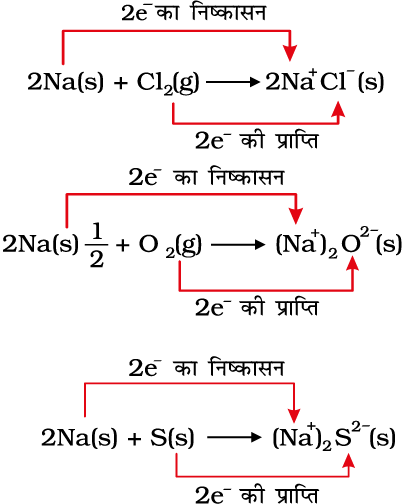
सुविधा के लिए उपरोक्त अभिक्रियाओं को दो चरणों में लिखा जा सकता है। एक में इलेक्ट्रॉनों का निष्कासन तथा दूसरे में इलेक्ट्रॉनों की प्राप्ति होती है। दृष्टांत रूप में सोडियम क्लोराइड के संभवन को अधिक परिष्कृत रूप में इस प्रकार भी लिख सकते हैं–
2 Na(s) → 2 Na+(g) + 2e–
Cl2(g) + 2e– → 2 Cl–(g)
उपरोक्त दोनों चरणों को ‘अर्द्ध अभिक्रिया’ कहते हैं, जिनमें इलेक्ट्रॉनों की अभिलिप्तता साफ-साफ दिखाई देती है। दो अर्द्धक्रियाओं को जोड़ने से एक पूर्ण अभिक्रिया प्राप्त होती है–
2 Na(s) + Cl2 (g) → 2 Na+ Cl– (s) या 2 NaCl (s)
8.12 से 8.14 तक की अभिक्रियाओं में इलेक्ट्रॉन निष्कासन वाली अर्द्धअभिक्रियाओं को ‘अॉक्सीकरण अभिक्रिया’ तथा इलेक्ट्रॅान ग्रहण करनेवाली अर्द्धअभिक्रिया को ‘अपचयन अभिक्रिया’ कहते हैं। यहाँ यह बताना प्रासंगिक होगा कि स्पीशीज़ के आपसी व्यवहार की पारंपरिक अवधारणा तथा इलेक्ट्रॉन स्थानांतरण के परस्पर मिलाने से ही अॉक्सीकरण और अपचयन की नई परिभाषा प्राप्त हुई है। 8.12 से 8.14 तक की अभिक्रियाओं में सोडियम, जिसका अॉक्सीकरण होता है, अपचायक के रूप में कार्य करता है, क्याेंकि यह क्रिया करनेवाले प्रत्येक तत्त्व को इलेक्ट्रॉन देकर अपचयन में सहायता देता है। क्लोरीन, अॉक्सीजन तथा सल्फर अपचयित हो रहे हैं और अॉक्सीकारक का कार्य करते हैं, क्योंकि ये सोडियम द्वारा दिए गए इलेक्ट्रॉन स्वीकार करते हैं। सारांश रूप में हम यह कह सकते हैं–
अॉक्सीकरण: किसी स्पीशीज़ द्वारा इलेक्ट्रॉन का निष्कासन
अपचयन: किसी स्पीशीज़ द्वारा इलेक्ट्रॉन की प्राप्ति
अॉक्सीकारकः इलेक्ट्रॉनग्राही अभिकारक
अपचायक: इलेक्ट्रॉनदाता अभिकारक
उदाहरण 8.2
निम्नलिखित अभिक्रिया एक अपचयोपचय अभिक्रिया है, औचित्य बताइए–
2 Na(s) + H2(g) → 2 NaH (s)
हल
क्योंकि उपरोक्त अभिक्रिया में बननेवाला यौगिक एक आयनिक पदार्थ है, जिसे Na+H– से प्रदर्शित किया जा सकता है, अतः इसकी अर्द्धअभिक्रिया इस प्रकार होगी–
2 Na (s) → 2 Na+ (g) + 2e–
तथा दूसरी
H2 (g) + 2e– → 2 H– (g)
इस अभिक्रिया का दो अर्द्धअभिक्रियाओं में विभाजन, सोडियम के अॉक्सीकरण तथा हाइड्रोजन के अपचयन का प्रदर्शन करता है। इस पूरी अभिक्रिया को अपचयोपचय अभिक्रिया कहते हैं।

चित्र 8.1 बीकर में रखे कॉपर नाइट्रेट तथा ज़िंक के बीच होनेवाली अपचयोपचय अभिक्रिया
8.2.1 प्रतियोगी इलेक्ट्रॉन स्थानांतरण अभिक्रियाएँ
जैसा चित्र 8.1 में दर्शाया गया है, ज़िंक धातु की एक पट्टी को एक घंटे के लिए कॉपर नाइट्रेट के जलीय विलयन में रखा गया है। आप देखेंगेे कि धातु की पट्टी पर कॉपर धातु की लाल रंग की परत जम जाती है तथा विलयन का नीला रंग गायब हो जाता है। ज़िक आयन Zn2+ का उत्पाद के रूप में बनना Cu2+ के रंग के विलुप्त होने से लिया जा सकता है। यदि Zn2+ वाले रंगहीन घोल में हाइड्रोजन सल्फाइड गैस गुजारें, तो ज़िंक सल्फाइड ZnS अवक्षेप का सफेद रंग अमोनिया द्वारा विलयन को क्षारीय करके देखा जा सकता है।
ज़िंक धातु तथा कॉपर नाइट्रेट के जलीय घोल के बीच होनेवाली अभिक्रिया निम्नलिखित है–
Zn(s) + Cu2+ (aq) → Zn2+ (aq) + Cu(s) (8.15)
अभिक्रिया 8.15 में ज़िंक से इलेक्ट्रॉनों के निष्कासन से Zn2+ बनता है। इसलिए ज़िंक का अॉक्सीकरण होता है। स्पष्ट है कि इलेक्ट्रॉनों के निष्कासन से ज़िंक का अॉक्सीकरण हो रहा है, तो किसी वस्तु का इलेक्ट्रॉनों को ग्रहण करने से अपचयन भी हो रहा है। ज़िंक द्वारा दिए गए इलेक्ट्रॉनों की प्राप्ति से कॉपर आयन अपचयित हो रहा है। अभिक्रिया 8.15 को हम इस प्रकार दुबारा लिख सकते हैं–

अब हम समीकरण 8.15 द्वारा दर्शाई गई अभिक्रिया की साम्यावस्था का अध्ययन करेंगे। इसके लिए हम कॉपर धातु की पट्टी को ज़िंक सल्फेट के घोल में डुबोकर रखते हैं। कोई भी प्रतिक्रिया दिखलाई नहीं देती और न ही Cu2+ का वह परीक्षण सफल होता है, जिसमें विलयन में H2S गैस प्रवाहित करने पर क्युपरिक सल्फाइड CuS अवक्षेप का काला रंग मिलता है। यह परीक्षण बहुत संवेदनशील है, परंतु फिर भी Cu2+ आयन का बनना नहीं देखा जा सकता है। इससे हम यह निष्कर्ष निकालते हैं कि अभिक्रिया 8.15 की साम्यावस्था की अनुकूलता उत्पादों की ओर है। आइए, अब हम कॉपर धातु तथा सिल्वर
नाइट्रेट के जलीय विलयन के बीच होनेवाली अभिक्रिया को चित्र 8.2 में दर्शाई गई व्यवस्था के अनुसार घटित करें।
आयन बनने के कारण घोल का रंग नीला हो जाता है, जो निम्नलिखित अभिक्रिया के कारण है–
 (8.16)
(8.16)
यहाँ Cu(s) का Cu2+ में अॉक्सीकरण होता है तथा Ag+ का Ag(s) में अपचयन हो रहा है। साम्यावस्था Cu2+ (aq) तथा Ag(s) उत्पादों की दिशा में बहुत अनुकूल है। विषमता के तौर पर निकैल सल्फेट के घोल में रखी गई कोबाल्ट धातु के बीच अभिक्रिया का तुलनात्मक अध्ययन करें। यहाँ निम्नलिखित अभिक्रिया घटित हो रही है–

 (8.17)
(8.17)
रासायनिक परीक्षणों से यह विदित होता है कि साम्यावस्था की स्थिति में Ni2+ (aq) व Co2+(aq) दोनों की सांद्रता मध्यम होती है। यह परिस्थिति न तो अभिकारकों (Co (s), न Ni2+ (aq)), न ही उत्पादों (Co2+(aq) और न Ni (s)) के पक्ष में है।
इलेक्ट्रॉन ग्रहण करने के लिए यह प्रतियोगिता प्रसंगवश हमें अम्लों के बीच होनेवाली प्रोटॉन निष्कासन की प्रतियोगिता की याद दिलाती है। इस समरूपता के अनुसार इलेक्ट्रॉन निष्कासन की प्रवृत्ति पर आधारित धातुओं तथा उनके आयनों की एक सूची उसी प्रकार तैयार कर सकते हैं, जिस प्रकार अम्लों की प्रबलता की सूची तैयार की जाती है। वास्तव में हमने कुछ तुलनाएँ भी की हैं। हम यह जान गए हैं कि ज़िंक कॉपर को तथा कॉपर सिल्वर को इलेक्ट्रॅान देता है। इसलिए इलेक्ट्रॅान निष्कासन-क्षमता का क्रम Zn > Cu > Ag हुआ। हम इस क्रम को विस्तृत करना चाहेंगे, ताकि धातु सक्रियता सीरीज़ अथवा विद्युत् रासायनिक सीरीज़ बना सकें। विभिन्न धातुओं के बीच इलेक्ट्रॉनों की प्रतियोगिता की सहायता से हम एेसे सेल बना सकते हैं, जो विद्युत् ऊर्जा का स्रोत हों। इन सेलों को ‘गैलवेनिक सेल’ कहते हैं। इनके बारे में हम अगली कक्षा में विस्तार से पढ़ेंगे।
8.3 अॉक्सीकरण-संख्या
निम्नलिखित अभिक्रिया, जिसमें हाइड्रोजन अॉक्सीजन से संयोजन करके जल बनाता है, इलेक्ट्रॅान स्थानांतरण का एक अल्पविदित उदाहरण है–
2H2(g) + O2 (g) → 2H2O (l) (8.18)
यद्यपि यह एक सरल तरीका तो नहीं है, फिर भी हम यह सोच सकते हैं कि H2 अणु में H परमाणु उदासीन (शून्य) स्थिति से H2O में धन् स्थिति प्राप्त करता है। अॉक्सीजन परमाणु O2 में शून्य स्थिति से द्विऋणी स्थिति प्राप्त करते हैं। यह माना गया है कि H से O की ओर इलेक्ट्रॉन स्थानांतरित हो गया है। परिणामस्वरूप H2 का अॉक्सीकरण तथा O2 का अपचयन हो गया है। बाद में हम यह पाएँगे कि यह आवेश स्थानांतरण आंशिक रूप से ही होता है। यह बेहतर होगा कि इसे इलेक्ट्रॉन विस्थापन (शिफ्ट) से दर्शाया जाए, न कि H द्वारा इलेक्ट्रॉन निष्कासन तथा O द्वारा इलेक्ट्रॉन की प्राप्ति। यहाँ समीकरण 8.18 के बारे में जो कुछ कहा गया है, वही अन्य सहसंयोजक यौगिकों वाली अन्य अभिक्रियाओं के बारे में कहा जा सकता है। इनके दो उदाहरण हैं–
H2(s) + Cl2(g) → 2HCl(g) (8.19)
और
CH 4(g) + 4Cl2(g) → CCl4(l) +4HCl(g) (8.20)
सहसंयोजक यौगिकों के उत्पाद की अभिक्रियाओं में इलेक्ट्रॉन विस्थापन को ध्यान में रखकर अॉक्सीकरण-संख्या विधि का विकास किया गया है, ताकि अपचयोपचय अभिक्रियाओं का रिकॉर्ड रखा जा सके। इस विधि में यह माना गया है कि कम ऋणविद्युत् परमाणु से अधिक ऋणविद्युत् तथा इलेक्ट्रॉन स्थानांतरण पूरी तरह से हो जाता है। उदाहरणार्थ–8.18 से
8.20 तक के समीकरणों को हम दोबारा इस प्रकार लिखते हैं। यहाँ के सभी परमाणुओं पर आवेश भी दर्शाया गया है–
0 0 +1 –2
2H2(g) + O2(g) → 2H2O (l) (8.21)
0 0 +1–1
H2 (s) + Cl2(g) → 2HCl(g) (8.22)
–4 +1 0 +4 –1 +1–1
CH4(g) + 4Cl2(g) → 4CCl4(l) + 4HCl(g) (8.23)
इसपर बल दिया जाए कि इलेक्ट्रॉन स्थानांतरण की कल्पना केवल लेखा-जोखा रखने के लिए की गई है। इस एकक में आगे चलने पर स्पष्ट हो जाएगा कि यह अपचयोपचय अभिक्रियाओं को सरलता से दर्शाती है।
किसी यौगिक में तत्त्व की अॉक्सीकरण-संख्या उसकी अॉक्सीकरण स्थिति को दर्शाती है, जिसे इस नियम के आधार पर किया जाता है कि सहसंयोजक आबंधन में इलेक्ट्रॉन युगल केवल अधिक वैद्युत-ऋणी तत्त्व से संबद्ध होता है।
इसे हमेशा याद रखना या जान लेना संभव नहीं है कि यौगिक में कौन सा तत्त्व अधिक वैद्युत-ऋणी है। इसलिए यौगिक/आयन के किसी तत्त्व की अॉक्सीकरण-संख्या का मान जानने के लिए कुछ नियम बनाए गए हैं। यदि किसी अणु/ आयन में किसी तत्त्व के दो अथवा दो से अधिक परमाणु उपस्थित हों, (जैसे Na2S2O3 / Cr2O72–) तो उस तत्त्व की अॉक्सीकरण-संख्या उसके सभी परमाणुओं की अॉक्सीकरण-
संख्या की औसत होगी। अब हम अॉक्सीकरण-संख्या की गणना के निम्नलिखित नियमों को बताएँगे–
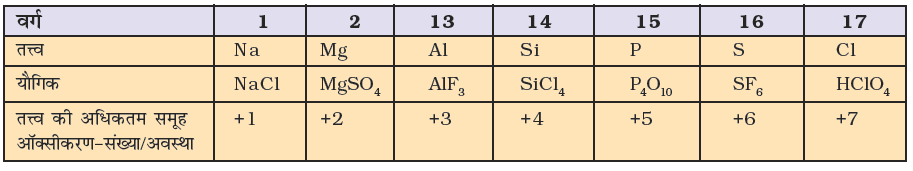
- तत्त्वों में स्वतंत्र या असंयुक्त दशा में प्रत्येक परमाणु की अॉक्सीकरण-संख्या शून्य होती है। प्रत्यक्षतः H2, O2, Cl2, O3, P4, S8, Na, Mg तथा Al में सभी परमाणुओं की अॉक्सीकरण-संख्या समान रूप से शून्य है।
- केवल एक परमाणु वाले आयनों में परमाणु की अॉक्सीकरण- संख्या उस आयन में स्थित आवेश का मान है। इस प्रकार Na+ आयन की अॉक्सीकरण-संख्या +1, Mg2+ आयन की +2, Fe3+आयन की +3, Cl– आयन की –1 तथा O2– आयन की –2 है। सभी क्षार धातुओं की उनके यौगिकों में अॉक्सीकरण-संख्या +1 होती है तथा सभी क्षारीय मृदा धातुओं की अॉक्सीकरण-संख्या +2 हेाती है। एेलुमीनियम की उसके यौगिकों में अॉक्सीकरण-संख्या सामान्यतः +3 मानी जाती है।
- अधिकांश यौगिकों में अॉक्सीजन की अॉक्सीकरण-संख्या –2 होती है। हमें दो प्रकार के अपवाद मिलते हैं। पहला–परॉक्साइडों तथा सुपर अॉक्साइडों में और उन यौगिकों में, जहाँ अॉक्सीजन के परमाणु एक-दूसरे से सीधे-सीधे जुड़े रहते हैं। परॉक्साइडों (जैसे–H2O2, NO2O2) में प्रत्येक अॉक्सीजन परमाणु अॉक्सीकरण-संख्या –1 है। सुपर अॉक्साइड (जैसे–KO2 RbO2 में प्रत्येक अॉक्सीजन परमाणु के लिए अॉक्सीकरण-संख्या -½ निर्धारित की गई है। दूसरा अपवाद बहुत दुर्लभ है, जिसमें अॉक्सीजन डाइफ्लुओराइड (OF2)तथा डाइअॉक्सीजन डाइफ्लुओराइड (O2F2) जैसे यौगिकों में अॉक्सीजन की अॉक्सीकरण-संख्या क्रमशः +2 तथा +1 है। यह संख्या अॉक्सीजन की आबंधन स्थिति पर निर्भर है, लेकिन यह सदैव धनात्मक ही होगी।
- हाइड्रोजन की अॉक्सीकरण-संख्या +1 होती है। केवल उस दशा को छोड़कर, जहाँ धातुएँ इससे द्विअंगी यौगिक बनाती हैं (केवल दो तत्त्वों वाले यौगिक)। उदाहरण के लिए LiH, NaH तथा CaH2 में हाइड्रोजन की अॉक्सीकरण-संख्या 1 है।
- सभी यौगिकों में फ्लुओरीन की अॉक्सीकरण-संख्या 1 होती है। यौगिकों में हैलाइड आयनों के अन्य हैलोजनों (Cl, Br, तथा I) की अॉक्सीकरण-संख्या भी –1 है। क्लोरीन, ब्रोमीन तथा आयोडीन जब अॉक्सीजन से संयोजित होते हैं, तो इनकी अॉक्सीकरण-संख्या धनात्मक होती है। उदाहरणार्थ–अॉक्सीअम्लों तथा अॉक्सीएनायनों में।
- यौगिक में सभी परमाणुओं की अॉक्सीकारक-संख्याओं का बीजीय योग शून्य ही होता है। बहुपरमाणुक आयनों में इसके सभी परमाणुओं की अॉक्सीकरण-संख्या का बीजीय योग उस आयन के आवेश के बराबर होता है। इस तरह (CO3)2– में तीनों अॉक्सीजन तथा एक कार्बन परमाणु की अॉक्सीकरण-संख्याओं का योग –2 ही होगा।
इन नियमों के अनुपालन से अणु या आयन में उपस्थित अपेक्षित इच्छित तत्त्व की अॉक्सीकरण-संख्या हम ज्ञात कर सकते हैं। यह स्पष्ट है कि धात्विक तत्त्वों की अॉक्सीकरण-संख्या धनात्मक होती है तथा अधात्विक तत्त्वों की अॉक्सीकरण-संख्या धनात्मक या ऋणात्मक होती है। संक्रमण धातु तत्त्व अनेक धनात्मक अॉक्सीकरण-संख्या दर्शाते हैं। पहले दो वर्गों के परमाणुओं के लिए उनकी वर्ग-संख्या ही उनकी उच्चतम अॉक्सीकरण-संख्या होगी तथा अन्य वर्गों में यह वर्ग-संख्या में से 10 घटाकर होगी। इसका अर्थ यह है कि किसी तत्त्व के परमाणु की उच्चतम अॉक्सीकरण-संख्या आवर्तसारणी में आवर्त में सामान्यतः बढ़ती जाती है। तीसरे आवर्त में अॉक्सीकरण-संख्या 1 से 7 तक बढ़ती है, जैसा निम्नलिखित यौगिकों के तत्त्वों द्वारा इंगित किया गया है।
अॉक्सीकरण-संख्या के स्थान पर अॉक्सीकरण-अवस्था पद का प्रयोग भी कई बार किया जाता है। अतः CO2 में कार्बन की अॉक्सीकरण-अवस्था +4 है, जो इसकी अॉक्सीकरण- संख्या भी है। इसी प्रकार अॉक्सीजन की अॉक्सीकरण अवस्था –2 है। इसका तात्पर्य यह है कि तत्त्व की अॉक्सीकरण-संख्या उसकी अॉक्सीकरण-अवस्था को दर्शाती है। जर्मन रसायनज्ञ अल्फ्रेड स्टॉक के अनुसार यौगिकों में धातु की अॉक्सीकरण- अवस्था को रोमन संख्यांक में कोष्ठक में लिखा जाता है। इसे स्टॉक संकेतन कहा जाता है। इस प्रकार अॉरस क्लोराइड तथा अॉरिक क्लोराइड को Au(I)Cl और Au(III)Cl3 लिखा जाता है। इसी प्रकार स्टेनस क्लोराइड तथा स्टेनिक क्लोराइड को Sn(II)Cl2 और Sn(IV)Cl4 लिखा जाता है। अॉक्सीकरण-संख्या में परिवर्तन को अॉक्सीकरण अवस्था में परिवर्तन के रूप में माना जाता है, जो यह पहचानने में भी सहायता देता है कि स्पीशीज़ अॉक्सीकृत अवस्था में है या अपचित अवस्था में इस प्रकार Hg(II)Cl2 की अपचित अवस्था Hg2(I)Cl2 है।
उदाहरण 8.3
स्टॉक संकेतन का उपयोग करते हुए निम्नलिखित यौगिकों को निरूपित कीजिए–
HAuCl4, Tl2O, FeO, Fe2O3, CuI, CuO, MnO तथा MnO2
हल
अॉक्सीकरण-संख्या की गणना के विभिन्न नियमों के अनुसार प्रत्येक धातु की अॉक्सीकरण-संख्या इस
प्रकार है–
HAuCl4 → Au की 3
Tl2O → Tl की 1
FeO → Fe की 2
Fe2O3 → Fe की 3
CuI → Cu की 1
CuO → Cu की 2
MnO → Mn की 2
MnO2 → Mn की 4
इसलिए इन यौगिकों का निरूपण इस प्रकार है–
HAu(III)Cl4, Tl2(I)O, Fe(II)O, Fe2(III)O3, Cu(I)I, Cu(II)O, Mn(II)O, Mn(IV)O2
अॉक्सीकरण-संख्या के विचार का प्रयोग अॉक्सीकरण, अपचयन, अॉक्सीकारक, अपचायक तथा अपचयोपचय अभिक्रिया को परिभाषित करने के लिए होता है। संक्षेप में हम यह कह सकते हैं–
अॉक्सीकरण: दिए गए पदार्थ में तत्त्व की अॉक्सीकरण-संख्या में वृद्धि।
अपचयन: दिए गए पदार्थ में तत्त्व की अॉक्सीकरण-संख्या में ह्रास।
अॉक्सीकारक: वह अभिकारक, जो दिए गए पदार्थ में तत्त्व की अॉक्सीकरण-संरख्या में वृद्धि करे। अॉक्सीकारकों को ‘अॉक्सीडेंट’ भी कहते हैं।
अपचायक: वह अभिकारक, जो दिए गए पदार्थ में तत्त्व की अॉक्सीकरण-संख्या में कमी करे। इन्हें रिडक्टेंट भी कहते हैं।
उदाहरण 8.4
सिद्ध कीजिए कि निम्नलिखित अभिक्रिया अपचयोपचय अभिक्रिया है–
2Cu2O(s) + Cu2S(s) → 6Cu(s) + SO2(g)
उन स्पीशीज़ की पहचान कीजिए, जो अॉक्सीकृत तथा अपचयित हो रही हैं, जो अॉक्सीडेंट और रिडक्टेंट की तरह कार्य कर रही हैं।
हल
आइए, इस अभिक्रिया के सभी अभिकारकों की अॉक्सीकरण-संख्या लिखें, जिसके परिणामस्वरूप हम पाते हैं–
+1 –2 +1 –2 0 +4 –2
2Cu2O(s) + Cu2S(s) → 6Cu(s) + SO2
इससे हम यह निष्कर्ष निकालते हैं कि इस अभिक्रिया में कॉपर का +1 अवस्था से शून्य अॉक्सीकरण अवस्था तक अपचयन तथा सल्फर का –2 से +4 तक अॉक्सीकरण हो रहा है। इसलिए उपरोक्त अभिक्रिया अपचयोपचय अभिक्रिया है। इसके अतिरिक्त Cu2S में सल्फर की अॉक्सीकरण-संख्या की वृद्धि में Cu2O सहायक है। अतः Cu(I) अॉक्सीडेंट हुआ तथा Cu2S का सल्फर स्वयं Cu2S और Cu2O में कॉपर की अॉक्सीकरण- संख्या की कमी में सहायक है। अतः Cu2S रिडक्टेंट हुआ।
8.3.1 अपचयोपचय अभिक्रियाओं के प्रारूप
1. योग अभिक्रियाएँ
योग अभिक्रिया को इस प्रकार लिखा जाता है– A + B → C। एेसी अभिक्रियाओं की अपचयोपचय अभिक्रिया होने के लिए A या B में से एक को या दोनों को तत्त्व रूप में ही होना चाहिए। एेसी सभी दहन अभिक्रियाएँ, जिनमें तत्त्व रूप में अॉक्सीजन या अन्य अभिक्रियाएँ संपन्न होती है तथा एेसी अभिक्रियाएँ, जिनमें डाइअॉक्सीजन से अतिरिक्त दूसरे तत्त्वों का उपयोग हो रहा है, ‘अपचयोपचय अभिक्रियाएँ’ कहलाती हैं। इस श्रेणी के कुछ महत्त्वपूर्ण उदाहरण हैं–
0 0 +4 –2
C(s) + O2 (g) → CO2(g) (8.24)
0 0 +2 –3
3Mg(s) + N2(g) → Mg3N2(s) (8.25)
–4+1 0 +4–2 +1 –2
CH4(g) + 2O2(g) → CO2(g) + 2H2O (l)
2. अपघटन अभिक्रियाएँ
अपघटन अभिक्रियाएँ संयोजन अभिक्रियाओं के विपरीत होती हैं। विशुद्ध रूप से अपघटन अभिक्रियाओं के अंतर्गत यौगिक दो या अधिक भागों में विखंडित होता है, जिसमें कम से कम एक तत्त्व रूप में होता है। इस श्रेणी की अभिक्रियाओं के उदाहरण हैं–
+1 –2 0 0
2H2O (l)  2H2 (g) + O2(g) (8.26)
2H2 (g) + O2(g) (8.26)
+1 –1 0 0
2NaH (s)  2Na (s) + H2(g) (8.27)
2Na (s) + H2(g) (8.27)
+1 +5 –2 +1 –1 0
2KClO3 (s)  2KCl (s) + 3O2(g) (8.28)
2KCl (s) + 3O2(g) (8.28)
ध्यान से देखने पर हम पाते हैं कि योग अभिक्रियाओं में मेथैन के हाइड्रोजन की तथा अभिक्रिया (8.28) में पोटैशियम क्लोरेट के पोटैशियम की अॉक्सीकरण-संख्या में कोई परिवर्तन नहीं होता। यहाँ यह बात भी ध्यान देने योग्य है कि सभी अपघटन अभिक्रियाएँ अपचयोपचय नहीं होती हैं, जैसे–
+2 +4 –2 +2 –2 +4–2
CaCO3 (s)  CaO(s) + CO2(g)
CaO(s) + CO2(g)
3. विस्थापन अभिक्रियाएँ
विस्थापन अभिक्रियाओं में यौगिक के आयन (या परमाणु) दूसरे तत्त्व के आयन (या परमाणु) द्वारा विस्थापित हो जाते हैं। इसे इस प्रकार प्रदर्शित किया जाता है–
X + YZ → XZ + Y
विस्थापन अभिक्रियाएँ दो प्रकार की होती हैं– धातु विस्थापन तथा अधातु विस्थापन।
(अ) धातु विस्थापन: यौगिक में एक धातु दूसरी धातु को मुक्त अवस्था में विस्थापित कर सकती है। खंड 8.2.1 के अंर्तगत हम इस प्रकार की अभिक्रियाओं का अध्ययन कर चुके हैं। धातु विस्थापन अभिक्रियाओं का उपयोग धातुकर्मीय प्रक्रमों में, अयस्कों में यौगिकों से शुद्ध धातु प्राप्त करने के लिए होता है। इनके कुछ उदाहरण हैं–
+2+ 6–2 0 0 +2+6–2
CuS O4(aq) + Zn (s) → Cu(s) + ZnS O4 (aq) (8.29)
+5–2 0 0 +2–2
V2O5 (s) + 5Ca (s)  2V (s) + 5CaO (s) (8.30)
2V (s) + 5CaO (s) (8.30)
+4 –1 0 0 +2 –1
TiCl4 (l) + 2Mg (s)  Ti (s) + 2 MgCl2 (s) (8.31)
Ti (s) + 2 MgCl2 (s) (8.31)
+3 –2 0 +3 –2 0
Cr2O3 (s) + 2 Al (s)  Al2O3 (s) + 2Cr(s) (8.32)
Al2O3 (s) + 2Cr(s) (8.32)
इन सभी में अपचायक धातु अपचित धातु की अपेक्षा श्रेष्ठ अपचायक है, जिनकी इलेक्ट्रॉन निष्कासन-क्षमता अपचित धातु की तुलना में अधिक है।
(ब) अधातु विस्थापन: अधातु विस्थापन अपचयोपचय अभिक्रियाओं में हाइड्रोजन विस्थापन, अॉक्सीजन विस्थापन आदि दुर्लभ अभिक्रियाएँ शामिल हैं।
सभी क्षार धातुएँ तथा कुछ क्षार मृदा धातुएँ (Ca, Sr या Ba) श्रेष्ठ रिडक्टेंट हैं, जो शीतल जल से हाइड्रोजन का विस्थापन कर देती हैं।
0 +1 –2 +1–2+1 0
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g) (8.33)
0 +1 –2 +2–2+1 0
Ca(s) + 2H2O(l) → Ca(OH)2 (aq) + H2(g) (8.34)
मैग्नीशियम, आयरन आदि कम सक्रिय धातुएँ भाप से डाइहाइड्रोजन गैस का उत्पादन करती हैं।
0 +1–2 +2 –2+1 0
Mg(s) + 2H2O(l)  Mg(OH)2(s) + H2(g) (8.35)
Mg(OH)2(s) + H2(g) (8.35)
0 +1–2 +3 –2 0
2Fe(s) + 3H2O(l) 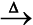 Fe2O3(s) + 3H2(g) (8.36)
Fe2O3(s) + 3H2(g) (8.36)
बहुत सी धातुएँ, जो शीतल जल से क्रिया नहीं करतीं, अम्लों से हाइड्रोजन को विस्थापित कर सकती हैं। अम्लों से डाइहाइड्रोजन उन धातुओं द्वारा भी उत्पादित होती हैं, जो भाप से क्रिया नहीं करती। केडमियम तथा टिन इसी प्रकार की धातुओं के उदाहरण हैं। अम्लों से हाइड्रोजन के विस्थापन के कुछ उदाहरण हैं–
0 +1–1 +2 –1 0
Zn(s) + 2HCl(aq) → ZnCl2 (aq) + H2 (g) (8.37)
0 +1–1 +2 –1 0
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g) (8.38)
0 +1 –1 +2 –1 0
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g) (8.39)
8.37 से 8.39 तक की अभिक्रियाएँ प्रयोगशाला में डाइहाइड्रोजन गैस तैयार करने में उपयोगी हैं। हाइड्रोजन गैस की निकास की गति धातुओं की सक्रियता की परिचायक है, जो Fe जैसी कम सक्रिय धातुओं में न्यूनतम तथा Mg जैसी अत्यंत सक्रिय धातुओं के लिए उच्चतम होती है। सिल्वर (Ag), गोल्ड (Au) आदि धातुएँ, जो प्रकृति में प्राकृत अवस्था में पाई जाती हैं, हाइड्रोक्लोरिक अम्ल से भी क्रिया नहीं करती हैं।
खंड 8.2.1 में हम यह चर्चा कर चुके हैं कि ज़िंक (Zn), कॉपर (Cu) तथा सिल्वर (Ag) धातुओं की इलेक्ट्रॉन त्यागने की प्रवृत्ति उनका अपचायक क्रियाशीलता-क्रम
Zn > Cu > Ag दर्शाती है। धातुओं के समान हैलोजनों की सक्रियता श्रेणी का अस्तित्त्व है। आवर्त सारणी के 17वें वर्ग में फ्लुओरीन से आयोडीन तक नीचे जाने पर इन तत्त्वों की अॉक्सीकारक क्रियाशीलता शिथिल होती जाती है। इसका अर्थ यह हुआ कि फ्लुओरीन इतनी सक्रिय है कि यह विलयन से क्लोराइड, ब्रोमाइड या आयोडाइड आयन विस्थापित कर सकती है। वास्तव में फ्लुओरीन की सक्रियता इतनी अधिक है कि यह जल से क्रिया करके उससे अॉक्सीजन विस्थापित कर देती है।
+1–2 0 +1–1 0
2 H2O (l) + 2F2 (g) → 4HF(aq) + O2(g) (8.40)
यही कारण है कि क्लोरीन, ब्रोमीन तथा आयोडीन की फ्लुओरीन द्वारा विस्थापन अभिक्रियाएँ सामान्यतः जलीय विलयन में घटित नहीं करते हैं। दूसरी ओर ब्रोमाइड तथा आयोडाइड आयनों को उनके जलीय विलयनों से क्लोरीन इस प्रकार विस्थापित कर सकती है–
0 +1 –1 +1–1 0
Cl2 (g) + 2KBr (aq) → 2 KCl (aq) + Br2 (l) (8.41)
0 +1–1 +1–1 0
Cl2 (g) + 2KI (aq) → 2 KCl (aq) + I2 (s) (8.42) Br2 तथा I2 के रंगीन तथा CCl4 में विलेय होने के कारण इनको विलयन के रंग द्वारा आसानी से पहचाना जा सकता है। उपरोक्त अभिक्रियाओं को आयनिक रूप में इस प्रकार लिख सकते हैं–
0 –1 –1 0
Cl2 (g) + 2Br– (aq) → 2Cl– (aq) + Br2 (l) (8.41a)
0 –1 –1 0
Cl2 (g) + 2I– (aq) → 2Cl– (aq) + I2 (s) (8.42b)
प्रयोगशाला में Br– तथा I– की परीक्षण-विधि, जिसका प्रचलित नाम ‘परत परीक्षण’ (Layer test) है, का आधार अभिक्रियाएँ 8.41 तथा 8.42 हैं। यह बताना अप्रासंगिक नहीं होगा कि इसी प्रकार विलयन में ब्रोमीन आयोडाइड आयन का विस्थापन कर सकती है।
0 –1 –1 0
Br2 (l) + 2I – (aq) → 2Br– (aq) + I2 (s) (8.43)
हैलोजेन विस्थापन की अभिक्रियाओं का औद्योगिक अनुप्रयोग होता है। हैलाइडों से हैलोजेन की प्राप्ति के लिए अॉक्सीकरण विधि की आवश्यकता होती है, जिसे निम्नलिखित अभिक्रिया से दर्शाते हैं–
2X– → X2 + 2e– (8.44)
यहाँ X हैलोजेन तत्त्व को प्रदर्शित करता है। यद्यपि रासायनिक साधनों द्वारा Cl–, Br– तथा I– को अॉक्सीकृत करने के लिए शक्तिशाली अभिकारक फ्लुओरीन उपलब्ध है, परंतु F– को F2 में बदलने के लिए कोई भी रासायनिक साधन संभव नहीं है। F– से F2 प्राप्त करने के लिए केवल विद्युत्-अपघटन द्वारा अॉक्सीकरण ही एक साधन है, जिसका अध्ययन आप आगे चलकर करेंगे।
4. असमानुपातन अभिक्रियाएँ
असमानुपातन अभिक्रियाएँ विशेष प्रकार की अपचयोपचय अभिक्रियाएँ हैं। असमानुपातन अभिक्रिया में तत्त्व की एक अॉक्सीकरण अवस्था एक साथ अॉक्सीकृत तथा अपचयित होती है। असमानुपातन अभिक्रिया में सक्रिय पदार्थ का एक तत्त्व कम से कम तीन अॉक्सीकरण अवस्थाएँ प्राप्त कर सकता है। क्रियाशील पदार्थ में यह तत्त्व माध्यमिक अॉक्सीकरण अवस्था में होता है तथा रासायनिक परिवर्तन में उस तत्त्व की उच्चतर तथा निम्नतर अॉक्सीकरण अवस्थाएँ प्राप्त होती हैं। हाइड्रोजन परॉक्साइड का अपघटन एक परिचित उदाहरण है, जहाँ अॉक्सीजन तत्त्व का असमानुपातन होता है।
+1 –1 +1–2 0
2H2O2 (aq) → 2H2O(l) + O2(g) (8.45)
यहाँ परॉक्साइड की अॉक्सीजन, जो -1 अवस्था में है, O2 में शून्य अवस्था में तथा H2O में –2 अवस्था में परिवर्तित हो जाती है ।
फॅास्फोरस, सल्फर तथा क्लोरीन का क्षारीय माध्यम में असमानुपातन निम्नलिखित ढंग से होता है -
0 +1 –3 +1
P4(s) + 3OH–(aq)+ 3H2O(l) → PH3(g) + 3H2PO2– (aq) (8.46)
0 2 +2
S8(s) + 12 OH– (aq) → 4S2– (aq) + 2S2O32–(aq) + 6H2O(l) (8.47)
0 +1 –1
Cl2 (g) + 2 OH– (aq) → ClO– (aq) + Cl– (aq) + H2O (l) (8.48)
अभिक्रिया 8.48 घरेलू विरंजक के उत्पाद को दर्शाती है। अभिक्रिया में बननेवाला हाइपोक्लोराइट आयन (ClO–) रंगीन धब्बों को अॉक्सीकृत करके रंगहीन यौगिक बनाता है। यह बताना रुचिकर होगा कि ब्रोमीन तथा आयोडीन द्वारा वही प्रकृति प्रदर्शित होती है, जो क्लोरीन द्वारा अभिक्रिया 8.48 में प्रदर्शित होती है, लेकिन क्षार से फ्लुओरीन की अभिक्रिया भिन्न ढंग से, अर्थात् इस प्रकार होती है–
2 F2(g) + 2OH–(aq) → 2 F–(aq) + OF2(g) + H2O(l) (8.49)
यह ध्यान देने की बात है कि अभिक्रिया 8.49 में निस्संदेह फ्लुओरीन जल से क्रिया करके कुछ अॉक्सीजन भी देती है। फ्लुओरीन द्वारा दिखाया गया भिन्न व्यवहार आश्चर्यजनक नहीं है, क्योंकि हमें ज्ञात है कि फ्लुओरीन सर्वाधिक विद्युत् ऋणी तत्त्व होने के कारण धनात्मक अॉक्सीकरण अवस्था प्रदर्शित नहीं कर सकती।
इसका तात्पर्य यह हुआ कि हैलोजनों में फ्लुओरीन असमानुपातन प्रवृत्ति नहीं दर्शा सकती।
उदाहरण 8.5
इनमें से कौन सा स्पीशीज़ असमानुपातन प्रवृत्ति नहीं दर्शाती और क्यों?
ClO–, ClO2–, ClO3– तथा ClO4–
उन सभी स्पीशीज़ की अभिक्रियाएँ भी लिखिए, जो असमानुपातन दर्शाती है।
हल
क्लोरीन के उपरोक्त अॉक्सीजन आयनों में ClO4– असमानुपातन नहीं दर्शाती, क्योंकि इन अॉक्सोएनायनों में क्लोरीन अपनी उच्चतर अॉक्सीकरण अवस्था +7 में उपस्थित है। शेष तीनों अॉक्सोएनायनों की असमानुपातन अभिक्रियाएँ इस प्रकार हैं–
+1 –1 +5
3ClO– → 2Cl– + ClO–3
+3 –1 +5
6 ClO2– 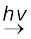 Cl– + 2ClO–3
Cl– + 2ClO–3
+5 –1 +7
4 ClO–3 → Cl– + 3 ClO4–
उदाहरण 8.6
निम्नलिखित अपचयोपचय अभिक्रियाओं को वर्गीकृत कीजिए -
(क) N2 (g) + O2 (g) → 2 NO (g)
(ख) 2Pb(NO3)2(s) → 2PbO(s) + 4 NO2 (g)
+ O2 (g)
(ग) NaH(s) + H2O(l) → NaOH(aq) + H2 (g)
(घ) 2NO2(g) + 2OH–(aq) → NO2–(aq) +
NO3– (aq)+H2O(l)
हल
अभिक्रिया ‘क’ का यौगिक नाइट्रिक अॉक्साइड तत्त्वों के संयोजन द्वारा बनता है। यह संयोजन अभिक्रिया का उदाहरण है। अभिक्रिया ‘ख’ में लेड नाइट्रेट तीन भागों में अपघटित होता है। इसलिए इस अभिक्रिया को अपघटन श्रेणी में वर्गीकृत करते हैं। अभिक्रिया ‘ग’ में जल में उपस्थित हाइड्रोजन का विस्थापन हाइड्राइड आयन द्वारा होने के फलस्वरुप डाइहाइड्रोजन गैस बनती है। इसलिए इसे ‘विस्थापन अभिक्रिया’ कहते हैं। अभिक्रिया ‘घ’ में NO2 (+4 अवस्था) का NO2– (+3 अवस्था) तथा NO3– (+5 अवस्था) में असमानुपातन होता है। इसलिए यह अभिक्रिया असमानापातन अपचयोपचय अभिक्रिया है।
उदाहरण 8.7
निम्नलिखित अभिक्रियाएँ अलग ढंग से क्यों होती हैं?
Pb3O4 + 8HCl → 3PbCl2 + Cl2 + 4H2O तथा
Pb3O4 +4HNO3 → 2Pb(NO3)2 + PbO2 + 2H2O
हल
वास्तव में Pb3O4 2 मोल PbO तथा 1 मोल PbO2 का रससमीकरणमिती मिश्रण है। PbO2 में लेड की अॉक्सीकरण अवस्था +4 है, जबकि PbO में लेड की स्थायी अॉक्सीकरण अवस्था +2 है। PbO2 इस प्रकार अॉक्सीडेंट (अॉक्सीकरण के रूप में) की भाँति अभिक्रिया कर सकता है। इसलिए HCl के क्लोराइड आयन को क्लोरीन में अॉक्सीकृत कर सकता है। हमें यह भी ध्यान में रखना चाहिए कि PbO एक क्षारीय अॉक्साइड है। इसलिए अभिक्रिया–
Pb3O4 + 8HCl → 3PbCl2 + Cl2 + 4H2O
को दो भागों में विभक्त कर सकते हैं। जैसे-
2PbO+ 4HCl → 2PbCl2 + 2H2O
(अम्ल-क्षार अभिक्रिया)
+4 –1 +2 0
PbO2 + 4HCl → PbCl2 + Cl2 +2H2O (अपचयोपचय अभिक्रिया)
चूँकिHNO3 स्वयं एक अॉक्सीकारक है, अतः PbO3 तथा HNO3 के बीच होने वाली अम्ल-क्षार अभिक्रिया है-
2PbO + 4HNO3 → 2Pb(NO3)2 + 2H2O
इस अभिक्रिया में PbO2 की HNO3के प्रति निष्क्रियता HCI से होने वाली अभिक्रिया से अलग होती है।
भिन्नात्मक अॉक्सीकरण-संख्या विरोधाभास
कभी-कभी हमें कुछ एेसे यौगिक भी मिलते हैं, जिनमें किसी एक तत्त्व की अॉक्सीकरण-संख्या भिन्नात्मक होती है। उदाहरणार्थ C3O2 (जहाँ कार्बन की अॉक्सीकरण-संख्या 4/3 है) Br3O8 (जहाँ ब्रोमीन की अॉक्सीकरण-संख्या 16/3 है) तथा Na2S4O6 (जहाँ सल्फर की अॉक्सीकरण-संख्या 5/2 है)।
हमें यह ज्ञात है कि भिन्नात्मक अॉक्सीकरण-संख्या स्वीकार्य नहीं है, क्योंकि इलेक्ट्रॉनों का सहभाजन/स्थानांतरण आंशिक नहीं हो सकता। वास्तव में भिन्नात्मक अॉक्सीकरण अवस्था प्रेक्षित किए जा रहे तत्त्व की अॉक्सीकरण-संख्याओं का औसत है तथा संरचना प्राचलों से ज्ञात होता है कि वह तत्त्व, जिसकी भिन्नात्मक अॉक्सीकरण अवस्था होती है, अलग-अलग अॉक्सीकरण अवस्था में उपस्थित है। C3O2, Br3O8 तथा S4O62– स्पीशीज़ की संरचनाओं में निम्नलिखित परिस्थितियाँ दिखती हैं–
(कार्बन सबॉक्साइड) C3O2 की संरचना है–
+2 0 +2
O = C = C*= C = O
Br3O8 (ट्राइब्रोमोअॉक्टोसाइड) की संरचना है– 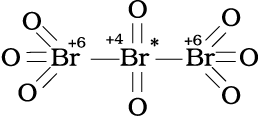
S4O62– (टेट्रा थायोनेट) की संरचना है– 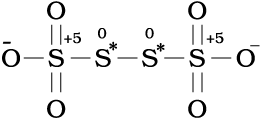
प्रत्येक स्पीशीज़ के तारांकित परमाणु उसी तत्त्व के अन्य परमाणुओं से अलग अॉक्सीकरण अवस्था दर्शाता है। इससे यह प्रतीत होता है कि C3O2 में दो कार्बन परमाणु +2 अॉक्सीकरण अवस्था में तथा तीसरा शून्य अॉक्सीकरण अवस्था में है और इनकी औसत संख्या 4/3 है। वास्तव में किनारे वाले दोनों कार्बनों की अॉक्सीकरण-संख्या +2 तथा बीच वाले कार्बन की शून्य है। इसी प्रकार Br3O8 में किनारे वाले दोनों प्रत्येक ब्रोमीन की अॉक्सीकरण अवस्था +6 है तथा बीच वाले ब्रोमीन परमाणु की अॉक्सीकरण अवस्था +4 है। एक बार फिर औसत संख्या 16/3 वास्तविकता से दूर है। इसी प्रकार से स्पीशीज़ S4O62– में किनारे वाले दोनों सल्फर +5 अॉक्सीकरण अवस्था तथा बीच वाले दोनों सल्फर परमाणु शून्य दर्शाते हैं। चारों सल्फर परमाणु की अॉक्सीकरण-संख्या का औसत 5/2 होगा, जबकि वास्तव में प्रत्येक सल्फर परमाणु की अॉक्सीकरण-संख्या क्रमशः +5,0,0 तथा +5 है।
इस प्रकार हम यह निष्कर्ष निकाल सकते हैं कि भिन्नात्मक अॉक्सीकरण अवस्था को हमें सावधानी से लेना चाहिए तथा वास्तविकता अॉक्सीकरण-संख्या उसकी संरचना से ही प्रदर्शित होती है। इसके अतिरिक्त जब भी हमें किसी विशेष तत्त्व की भिन्नात्मक अॉक्सीकरण अवस्था दिखे, तो हमें समझ लेना चाहिए कि यह केवल औसत अॉक्सीकरण अवस्था है। वास्तव में इस स्पीशीज़ विशेष में एक से अधिक पूर्णाक अॉक्सीकरण अवस्थाएँ हैं (जो केवल संरचना द्वारा दर्शाई जा सकती है)। Fe3O4, Mn3O4, Pb3O4 कुछ अन्य एेसे यौगिक हैं, जो मिश्र अॉक्साइड हैं, जिनमें प्रत्येक धातु की भिन्नात्मक अॉक्सीकरण होती हैं। O+2 एवं O–2में भी भिन्नात्मक अॉक्सीकरण अवस्था पाई जाती है। यह क्रमशः +½ तथा –½ है।
8.3.2 अपचयोपचय अभिक्रियाओं का संतुलन
अपचयोपचय अभिक्रियाओं के संतुलन के लिए दो विधिओं का प्रयोग होता है। इनमें से एक विधि अपचायक की अॉक्सीकरण-संख्या में परिवर्तन पर आधारित है तथा दूसरी विधि में अपचयोपचय अभिक्रिया को दो भागों में विभक्त किया जाता है–एक में अॉक्सीकरण तथा दूसरे में अपचयन। दोनों ही विधिओं का प्रचलन है तथा व्यक्ति-विशेष अपनी इच्छानुसार इनका प्रयोग करता है।
(क) अॉक्सीकरण-संख्या विधि
अन्य अभिक्रियाओं की भाँति अॉक्सीकरण-अपचयन अभिक्रियाओं के लिए भी क्रिया में भाग लेने वाले पदार्थों तथा बनने वाले उत्पादों के सूत्र ज्ञात होने चाहिए। इन पदाें द्वारा अॉक्सीकरण-संख्या विधि को हम प्रदर्शित करते हैं–
पद 1: सभी अभिकारकों तथा उत्पादों के सही सूत्र लिखिए।
पद 2: अभिक्रिया के सभी तत्त्वों के परमाणुओं को लिखकर उन परमाणुओं को पहचानिए, जिनकी अॉक्सीकरण-संख्या में परिवर्तन हो रहा है।
पद 3: प्रत्येक परमाणु तथा पूरे अणु/आयन की अॉक्सीकरण- संख्या में वृद्धि या ह्रास की गणना कीजिए। यदि इनमें समानता न हो, तो उपयुक्त संख्या से गुणा कीजिए, ताकि ये समान हो जाएँ (यदि आपको लगे कि दो पदार्थ अपचयित हो रहे हैं तथा दूसरा कोई अॉक्सीकृत नहीं हो रहा है या विलोमतः हो रहा है, तो समझिए कि कुछ न कुछ गड़बड़ है। या तो अभिकारकों तथा उत्पादों के सूत्र में त्रुटि है या अॉक्सीकरण-संख्याएँ ठीक प्रकार से निर्धारित नहीं की गई हैं।
पद 4: यह भी निश्चित कर लें कि यदि अभिक्रिया जलीय माध्यम में हो रही है, तो H+ या OH– आयन उपयुक्त स्थान पर जोड़िए, ताकि अभिकारकों तथा उत्पादों का कुल आवेश बराबर हो। यदि अभिक्रिया अम्लीय माध्यम में संपन्न होती है, तो H+ आयन का उपयोग कीजिए। यदि क्षारीय माध्यम हो, तो OH– आयन का उपयोग कीजिए।
पद 5: अभिकारकाें या उत्पादों में जल-अणु जोड़कर, व्यंजक से दोनों ओर हाड्रोजन परमाणुओं की संख्या एक समान बनाइए। अब अॉक्सीजन के परमाणुओं की संख्या की भी जाँच कीजिए। यदि अभिकारकों तथा उत्पादोें में (दोनों ओर) अॉक्सीजन परमाणुओं की संख्या एक समान है, तो समीकरण संतुलित अपचयोपचय अभिक्रिया दर्शाता है।
आइए, हम कुछ उदाहरणों की सहायता से इन पदाें को समझाएँ–
उदाहरण 8.8
पोटैशियम डाइक्रोमेट (VI), K2Cr2O7 की सोडियम सल्फाइट, Na2SO3 से अम्लीय माध्यम में क्रोमियम (III) आयन तथा सल्फेट आयन देने वाली नेट आयनिक अभिक्रिया लिखिए।
हल
पद 1: अभिक्रिया का ढाँचा इस प्रकार है–
Cr2O72–(aq) + SO32–(aq) → Cr3+(aq) + SO42– (aq)
पद 2: Cr एवं S की अॉक्सीकरण-संख्या लिखिए–
+6 +4– 3+ +6–
Cr2O72– (aq) + SO32– (aq) → Cr (aq) + SO42– (aq)
यह इस बात का सूचक है कि डाइक्रोमेट आयन अॉक्सीकारक तथा सल्फाइट आयन अपचायक है।
पद 3: अॉक्सीकरण-संख्याओं की वृद्धि और ह्रास की गणना कीजिए तथा इन्हें एक समान बनाइए–
पद 2 से हम देख सकते हैं कि क्रोमियम और सल्फर की अॉक्सीकरण संख्या में परिवर्तन हुआ है। क्रोमियम की आक्सीकरण संख्या +6 से +3 में परिवर्तित होती है। अभिक्रिया में दाईं ओर क्रोमियम की अॉक्सीकरण संख्या में +3 की कमी आई है। सल्फर की आक्सीकरण संख्या +4 से +6 में परिवर्तित हो जाती है। दाईं ओर सल्फर की अॉक्सीकरण संख्या में +2 की वृद्धि हुई है। वृद्धि और ह्रास को एक समान बनाने के लिए दाईं ओर क्रोमियम आयन के सम्मुख संख्या 2 लिखिए और सल्फेट आयन के सम्मुख संख्या 3 लिखिए। अब समीकरण के दोनों ओर परमाणुओं की संख्या संतुलित कीजिए। इस प्रकार हम प्राप्त करते हैं –
+6 +4 +3
Cr2O72–(aq) + 3SO32– (aq) → 2Cr3+ (aq) + +6 3SO42– (aq)
पद 4: क्योंकि यह अभि्क्रिया अम्लीय माध्यम में संपन्न हो रही है तथा दोनों ओर के आयनों का आवेश एक समान नहीं है। इसलिए बाईं ओर 8H+ जोड़िए, जिससे आयनिक आवेश एक समान हो जाए।
Cr2O72–(aq) + 3SO32–(aq)+ 8H+→ 2Cr3+(aq) + 3SO42– (aq)
पद 5: अंत में हाड्रोजन अणुओं की गणना कीजिए। संतुलित अपचयोपचय अभिक्रिया प्राप्त करने के लिए दाईं ओर उपयुक्त संख्या में जल के अणुओं (यानी 4H2O) को जोड़िए–
Cr2O72– (aq) + 3SO32– (aq)+ 8H+ (aq) →
2Cr3+ (aq) + 3SO42– (aq) +4H2O (l)
उदाहरण 8.9
क्षारीय माध्यम में परमैंगनेट आयन ब्रोमाइड आयन से संतुलित आयनिक अभिक्रिया समीकरण लिखिए।
हल
पद 1: समीकरण का ढाँचा इस प्रकार से है–
MnO4–(aq) + Br–(aq) → MnO2(s) + BrO3– (aq)
पद 2: Mn व Br की अॉक्सीकरण-संख्या लिखिए।
+7 –1 +4 +5
MnO4–(aq) + Br–(aq) →MnO2 (s) + BrO3– (aq)
यह इस बात का सूचक है कि परमैंगनेट आयन अॉक्सीकारक है तथा ब्रोमाइड आयन अपचायक है।
पद 3: अॉक्सीकरण-संख्या में वृद्धि और ह्रास की गणना कीजिए तथा वृद्धि और ह्रास को एक समान बनाइए।
+7 –1 +4 +5
2MnO4–(aq)+Br –(aq) → 2MnO2(s)+BrO3–(aq)
पद 4: क्योंकि अभिक्रिया क्षारीय माध्यम में संपन्न हो रही है तथा आयनिक आवेश एक समान नहीं है, इसलिए आयनिक आवेश एक समान बनाने के लिए दाईं ओर 2OH– आयन जोड़िए–
2MnO4– (aq) + Br– (aq) → 2MnO2(s) +
BrO3–(aq) + 2OH–(aq)
पद 5 : अंत में हाइड्रोजन परमाणुओं की गणना कीजिए तथा बाईं ओर उपयुक्त संख्या में जल-अणुओं (यानी एक H2O अणु) को जोड़िए, जिससे संतुलित अपचयोपचय अभिक्रिया प्राप्त हो जाए–
2MnO4–(aq) + Br–(aq) + H2O(l) → 2MnO2(s) + BrO3– (aq) + 2OH– (aq)
(ख) अर्द्ध-अभिक्रिया विधि
इस विधि द्वारा दोनों अर्द्ध-अभिक्रियाओं को अलग-अलग संतुलित करते हैं तथा बाद में दोनों को जोड़कर संतुलित अभिक्रिया प्राप्त करते हैं।
मान लीजिए कि हमें Fe2+ आयन से Fe3+ आयन में डाइक्रोमेट आयन (Cr2O7)2– द्वारा अम्लीय माध्यम में अॉक्सीकरण अभिक्रिया संपन्न करनी है, जिसमें (Cr2O7)2– आयनों का Cr3+ आयन में अपचयन होता है। इसके लिए हम निम्नलिखित कदम उठाते हैं-
पद 1: असंतुलित समीकरण को आयनिक रूप में लिखिए-
Fe2+(aq) + Cr2O72– (aq) → Fe3+ (aq) + Cr3+(aq) (8.50)
पद 2: इस समीकरण को दो अर्द्ध-अभिक्रियाओं में विभक्त कीजिए-
अॉक्सीकरण अर्द्ध: Fe2+ (aq) → Fe3+(aq) (8.51)
अपचयन अर्द्ध: Cr+62O72–(aq) → Cr+3(aq) (8.52)
पद 3: प्रत्येक अर्द्ध-अभिक्रिया के O तथा H में अतिरिक्त सभी परमाणुओं को संतुलित कीजिए। अर्द्ध-अभिक्रिया में अतिरिक्त परमाणुओं को संतुलित करने के लिए Cr3+ को 2 से गुणा करते हैं। अॉक्सीकरण अर्द्ध-अभिक्रिया Fe परमाणु के लिए पहले ही संतुलित है–
Cr2O7 2–(aq) → 2 Cr3+(aq) (8.53)
पद 4: अम्लीय माध्यम में संपन्न होनेवाली अर्द्ध-अभिक्रिया में O परमाणु के संतुलन के लिए H2O तथा H परमाणु के संतुलन के लिए H+ जोड़िए। इस प्रकार हमें निम्नलिखित अभिक्रिया मिलती है–
Cr2O7 2– (aq) + 14H+ (aq) → 2 Cr3+(aq) + 7H2O (l) (8.54)
पद 5: अर्द्ध-अभिक्रियाओं में आवेशाें के संतुलन के लिए इलेक्ट्रॉन जोड़िए। दोनों अर्द्ध-अभिक्रियाओं में इलेक्ट्रॉनों की संख्या एक जैसी रखने के लिए आवश्कतानुसार किसी एक को या दोनों को उपयुक्त संख्या से गुणा कीजिए। आवेश को संतुलित करते हुए अॉक्सीकरण को दोबारा इस प्रकार लिखते हैं–
Fe2+ (aq) → Fe3+ (aq) + e– (8.55)
अब अपचयन अर्द्ध-अभिक्रिया की बाईं ओर 12 धन आवेश हैं, 6 इलेक्ट्रॉन जोड़ देते हैं–
Cr2O7 2– (aq) + 14H+ (aq) + 6e– → 2Cr3+(aq) + 7H2O (l) (8.56)
दोनों अर्द्ध-अभिक्रियाओं में इलेक्ट्रॉनाें की संख्या समान बनाने के लिए अॉक्सीकरण अर्द्ध-अभिक्रिया को 6 से गुणा करके इस प्रकार लिखते हैं–
6Fe2+(aq) → 6 Fe3+(aq) + 6e– (8.57)
पद 6: दोनों अर्द्ध-अभिक्रियाओं को जोड़ने पर हम पूर्ण अभिक्रिया प्राप्त करते हैं तथा दोनों ओर के इलेक्ट्रॉन निरस्त कर देते हैं।
6Fe2+(aq) + Cr2O72–(aq) + 14H+(aq) → 6 Fe3+(aq) + 2Cr 3+(aq) + 7H2O(l) (8.58)
पद 7: सत्यापित कीजिए कि समीकरण के दोनों ओर परमाणुओं की संख्या तथा आवेश समान हैं। यह अंतिम परीक्षण दर्शाता है कि समीकरण में परमाणुओं की संख्या तथा आवेश का पूरी तरह संतुलन है।
क्षारीय माध्यम में अभिक्रिया को पहले तो उसी प्रकार संतुलित कीजिए, जैसे अम्लीय माध्यम में करते हैं। बाद में समीकरण के दोनों ओर H+ आयन की संख्या के बराबर OH– जोड़ दीजिए। जहाँ H+ तथा OH– समीकरण एक ओर साथ हों, वहाँ दोनों को जोड़कर H2O लिख दीजिए।
उदाहरण 8.10
परमैंगनेट (VII) आयन क्षारीय माध्यम में आयोडाइड आयन, I– आण्विक आयोडीन I2 तथा मैंग्नीज (IV) अॉक्साइड (MnO2) में अॉक्सीकृत करता है। इस अपचयोपचय अभिक्रिया को दर्शाने वाली संतुलित आयनिक अभिक्रिया लिखिए।
हल
पद 1: पहले हम ढाँचा समीकरण लिखते हैं–
MnO4– (aq) + I– (aq) → MnO2(s) + I2(s)
पद 2: दो अर्द्ध-अभिक्रियाएँ इस प्रकार हैं–
–1 0
अॉक्सीकरण अर्द्ध-अभिक्रिया I–(aq) → I2 (s)
+7 +4
अपचयन अर्द्ध-अभिक्रिया MnO4–(aq) → MnO2(s) पद 3: अॉक्सीकरण अर्द्ध-अभिक्रिया में I परमाणु का संतुलन करने पर हम लिखते हैं-
2I– (aq) → I2 (s)
पद 4: O परमाणु के संतुलन के लिए हम उपचयन अभिक्रिया में दाईं ओर 2 जल-अणु जोड़ते हैं-
MnO4– (aq) → MnO2 (s) + 2 H2O (l)
H परमाणु के संतुलन के लिए हम बाईं ओर चार H+ आयन जोड़ देते हैं।
MnO4 – (aq) + 4 H+ (aq) → MnO2(s) + 2H2O (l)
क्योंकि अभिक्रिया क्षारीय माध्यम में होती है, इसलिए 4H+ के लिए समीकरण के दोनों ओर हम 4OH– जोड़ देते हैं।
MnO4– (aq) + 4H+ (aq) + 4OH–(aq) →
MnO2 (s) + 2 H2O(l) + 4OH– (aq)
H+ आयन तथा OH– आयन के योग को H2O से बदलने पर परिणामी समीकरण बन गए–
MnO4– (aq) + 2H2O (l) → MnO2 (s) + 4 OH– (aq)
पद 5: इस पद में हम दोनों अर्द्ध-अभिक्रियाओं में आवेश का संतुलन दर्शाई गई विधि द्वारा करते हैं।
2I– (aq) → I2 (s) + 2e–
MnO4–(aq) + 2H2O(l) + 3e– → MnO2(s)
+ 4OH–(aq)
इलेक्ट्रॉनों की संख्या एक समान बनाने के लिए अॉक्सीकरण अर्द्ध-अभिक्रिया को 3 से तथा अपचयन अर्द्ध-अभिक्रिया को 2 से गुणा करते हैं।
6I–(aq) → 3I2 (s) + 6e–
2 MnO4– (aq) + 4H2O (l) +6e– → 2MnO2(s) + 8OH– (aq)
पद 6: दोनों अर्द्ध-अभिक्रियाओं को जोड़कर दोनाें ओर के इलेक्ट्रॉनों को निरस्त करने पर यह समीकरण प्राप्त होता है–
6I–(aq) + 2MnO4–(aq) + 4H2O(l) → 3I2(s) + 2MnO2(s) +8 OH–(aq)
पद 7: अंतिम सत्यापन दर्शाता है कि दोनों ओर के परमाणुओं की संख्या तथा आवेश की दृष्टि से समीकरण संतुलित है।
8.3.3 अपचयोपचय अभिक्रियाओं पर आधारित अनुमापन
अम्लक्षार निकाय में हम एेसी अनुमापन विधि के संपर्क में आते हैं, जिससे एक विलयन की प्रबलता pH संवेदनशील संसूचक का प्रयोग कर दूसरे विलयन से ज्ञात करते हैं। समान रूप से अपचयोपचयन निकाय में अनुमापन विधि अपनाई जा सकती है, जिसमें अपचयोपचय संवेदनशील संसूचक का प्रयोग कर रिडक्टेंट/अॉक्सीडेंट की प्रबलता ज्ञात की जा सकती है। अपचयोपचय अनुमापन में संसूचक का प्रयोग निम्नलिखित उदाहरण द्वारा निरूपित किया गया है–
(i) यदि कोई अभिकारक (जो स्वयं किसी गहरे रंग का हो, जैसे–परमैंगनेट आयन MnO4– स्वयंसूचक (Self indicator) की भाँति कार्य करता है। जब अपचायक (Fe2+ या C2O4 2–) का अंतिम भाग अॉक्सीकृत हो चुका हो, तो दृश्य अंत्यबिंदु प्राप्त होता है। MnO4– आयन की सांद्रता 10–6 mol dm–3 (10–6 mol L–1) से कम होने पर भी गुलाबी रंग की प्रथम स्थायी झलक दिखती है। इससे तुल्यबिंदु पर रंग न्यूनता से अतिलंघित हो जाता है, जहाँ अपचायक तथा अॉक्सीकारक अपनी मोल रससमीकरण- मिति के अनुसार समान मात्रा में होते हैं।
(ii) जैसा MnO4– के अनुमापन में होता है, यदि वैसा कोई रंग– परिवर्तन स्वतः नहीं होता है, तो एेसे भी सूचक हैं, जो अपचायक के अंतिम भाग के उपभोगित हो जाने पर स्वयं अॉक्सीकृत होकर नाटकीय ढंग से रंग-परिवर्तन करते हैं। इसका सर्वोत्तम उदाहरण Cr2O7 2– द्वारा दिया जाता है, जो स्वयं सूचक नहीं है, लेकिन तुल्यबिंदु के बाद यह डाइफेनिल एमीन सूचक को अॉक्सीकृत करके गहरा नीला रंग प्रदान करता है। इस प्रकार यह अंत्यबिंदु का सूचक होता है।
(iii) एक अन्य विधि भी उपलब्ध है, जो रोचक और सामान्य भी है। इसका प्रयोग केवल उन अभिकारकों तक सीमित है, जो I– आयनों को अॉक्सीकृत कर सकते हैं। उदाहरण के तौर पर–
2Cu2+(aq) + 4I–(aq) → Cu2I2(s) + I2(aq) (8.59)
इस विधि का आधार आयोडीन का स्टार्च के साथ गहरा नीला रंग देना तथा आयोडीन की थायोसल्फेट आयन से विशेष अभिक्रिया है, जो अपचयोपचय अभिक्रिया भी है।
I2(aq) + 2 S2O32–(aq)→2I–(aq) + S4O62–(aq) (8.60)
यद्यपि I2 जल में अविलेय है, KI के विलयन में KI3 के रूप में विलेय है।
अंत्यबिंदु को स्टार्च डालकर पहचाना जाता हैं। शेष स्टाइकियोमिती गणनाएँ ही हैं।
8.3.4 अॉक्सीकरण अंकधारणा की सीमाएँ
उपरोक्त विवेचना से आप यह जान गए हैं कि उपचयोपचय
विधियों का विकास समयानुसार होता गया है। विकास का यह क्रम अभी जारी है। वास्तव में कुछ समय पहले तक अॉक्सीकरण पद्धति को अभिक्रिया में संलग्न परमाणु (एक या अधिक) के चारों ओर इलेक्ट्रॉन घनत्व में ह्रास के रूप में तथा अपचयन पद्धति को इलेक्ट्रॉन घनत्व-वृद्धि के रूप में देखा जाता था।
8.4 अपचयोपचन अभिक्रियाएँ तथा इलेक्ट्रोड प्रक्रम
यदि ज़िंक की छड़ को कॉपर सल्फेट के विलयन में डुबोएँ, तो अभिक्रिया (8.15) के अनुसार संगत प्रयोग दिखाई देता है। इस अपचयोपचय अभिक्रिया के दौरान ज़िंक से कॉपर पर इलेक्ट्रॉन के प्रत्यक्ष स्थानांतरण द्वारा ज़िंक का अॉक्सीकरण ज़िंक आयन के रूप में होता है तथा कॉपर आयनों का अपचयन कॉपर धातु के रूप में होता है। इस अभिक्रिया में ऊष्मा का उत्सर्जन होता है। अभिक्रिया की ऊष्मा विद्युत् ऊर्जा में परिवर्तित हो जाती है। इसके लिए कॉपर सल्फेट विलयन से ज़िंक धातु का पृथक्करण करना आवश्यक हो जाता है। हम कॉपर सल्फेट घोल को एक बीकर में रखते हैं, कॉपर की छड़ या पत्ती को इसमें डाल देते हैं। एक दूसरे बीकर में ज़िंक सल्फेट घोल डालते हैं तथा ज़िंक की छड़ या पत्ती इसमें डालते हैं। किसी भी बीकर में कोई भी अभिक्रिया नहीं होती तथा दोनों बीकरों में धातु और उसके लवण के घोल के अंतरापृष्ठ पर एक ही रसायन के अपचयित और अॉक्सीकृत रूप एक साथ उपस्थित होते हैं। ये अपचयन तथा अॉक्सीकरण अर्द्ध-अभिक्रियाओं में उपस्थित स्पीशीज़ को दर्शाते हैं। अॉक्सीकरण तथा अपचयन अभिक्रियाओं में भाग ले रहे पदार्थों के अॉक्सीकृत तथा अपचयित स्वरूपों की एक साथ उपस्थिति से रेडॉक्स युग्म को परिभाषित करते हैं।
इस अॉक्सीकृत स्वरूप को अपचयित स्वरूप से एक सीधी रेखा या तिरछी रेखा द्वारा पृथक् करना दर्शाया गया है, जो अंतरापृष्ठ (जैसे-ठोस/घोल) को दर्शाती है। उदाहरण के लिए, इस प्रयोग में दो रेडॉक्स युग्मों को Zn2+/Zn तथा Cu2+/Cu द्वारा दर्शाया गया है। दोनों में अॉक्सीकृत स्वरूप को अपचयित स्वरूप से पहले लिखा जाता है। अब हम कॉपर सल्फेट घोल वाले बीकर को ज़िंक सल्फेट घोल वाले बीकर के पास रखते हैं (चित्र 8.3)। दोनों बीकरों के घोलों को लवण-सेतु द्वारा जोड़ते हैं (लवण-सेतु U आकृति की एक नली है, जिसमें पोटैशियम क्लोराइड या अमोनियम नाइट्रेट के घोल को सामान्यतया ‘एेगर-एेगर’ के साथ उबालकर U नली में भरकर तथा ठंडा करके जेली बना देते हैं)। इन दोनों विलयनों को बिना एक-दूसरे से मिलाए हुए वैद्युत् संपर्क प्रदान किया जाता है। ज़िंक तथा कॉपर की छड़ों को एेमीटर तथा स्विच के प्रावधान द्वारा धातु के तार से जोड़ा जाता है।
चित्र 8.3, पृष्ठ 276 में दर्शाई गई व्यवस्था को ‘डेनियल सेल’ कहते हैं। जब स्विच ‘अॉफ’ (बंद) स्थिति में होता है, तो किसी बीकर में कोई भी अभिक्रिया नहीं होती और धातु के तार से विद्युत्-धारा प्रवाहित नहीं होती है। स्विच को अॉन करते ही हम पाते हैं कि–
- Zn से Cu2+ तक इलेक्ट्रॉनों का स्थानांतरण प्रत्यक्ष रूप से न होकर दोनों छड़ों को जोड़ने वाले धात्विक तार के द्वारा होता है, जो तीर द्वारा विद्युत्-धारा में प्रवाह के रूप में दर्शाया गया है।
- एक बीकर में रखे घोल से दूसरे बीकर के घोल की ओर लवण-सेतु के माध्यम से आयनों के अभिगमन द्वारा विद्युत् प्रवाहित होती है। हम जानते हैं कि कॉपर और ज़िंक की छड़ों, जिन्हें ‘इलेक्ट्रोड’ कहते हैं, में विभव का अंतर होने पर ही विद्युत्-धारा का प्रवाह संभव है।
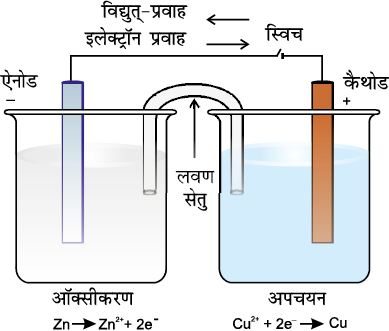
चित्र 8.3 डेनियल सेल की आयोजना। एेनोड पर Zn के अॉक्सीकरण द्वारा उत्पन्न इलेक्ट्रॉन बाहरी परिपथ से कैथोड तक पहुँचते हैं। सेल के अंदर का परिपथ लवण-सेतु के माध्यम से आयनों के विस्थापन द्वारा पूरा होता है। ध्यान दीजिए कि विद्युत्-प्रवाह की दिशा इलेक्ट्रॉनों के प्रवाह की दिशा के विपरीत है।
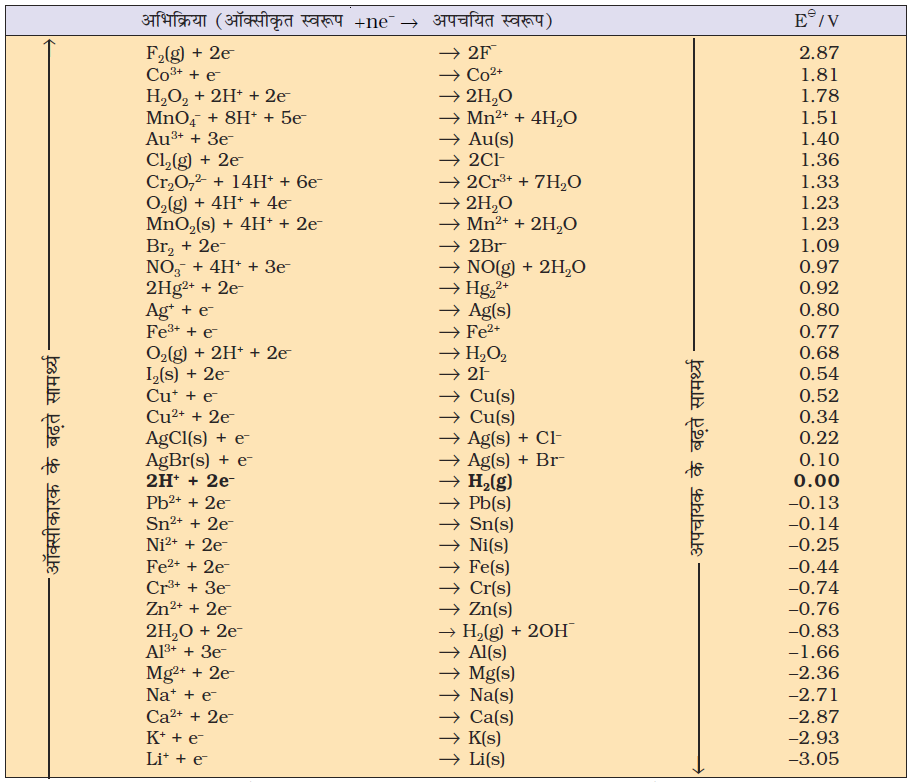
तालिका 8.1 298 K पर मानक इलेक्ट्रोड विभव-आयन
आयन जलीय स्पीशीज़ के रूप में तथा जल द्रव के रूप में उपस्थित हैंः गैस तथा ठोस को g तथा s द्वारा दर्शाया गया है।
1. ऋणात्मक E0 का अर्थ यह है कि रेडॉक्स युग्म H+/H2 की तुलना में प्रबल अपचायक है।
2. धनात्मक E0 का अर्थ यह है कि रेडॉक्स युग्म H+/H2 की तुलना में दुर्बल अपचायक है।
प्रत्येक इलेक्ट्रोड के विभव को ‘इलेक्ट्रोड विभव’ कहते हैं। यदि इलेक्ट्रोड अभिक्रिया में भाग लेने वाले सभी स्पीशीज़ की इकाई सांद्रता हो (यदि इलेक्ट्रोड अभिक्रिया में कोई गैस निकलती है, तो उसे एक वायुमंडलीय दाब पर होना चाहिए) तथा अभिक्रिया 298K पर होती हो, तो प्रत्येक इलेक्ट्रोड पर विभव को मानक इलेक्ट्रोड विभव कहते हैं। मान्यता के अनुसार, हाइड्रोजन का मानक इलेक्ट्रोड विभव 0.00 वोल्ट होता है। प्रत्येक इलेक्ट्रोड अभिक्रिया के लिए इलेक्ट्रोड विभव का मान सक्रिय स्पीशीज़ की अॉक्सीकृत/अपचयित अवस्था की आपेक्षिक प्रवृत्ति का माप है। E° के ऋणात्मक होने का अर्थ है कि रेडॉक्स युग्म H+/H2 की तुलना में अधिक शक्तिशाली अपचायक है। धनात्मक E° का अर्थ यह है कि H+/H2 की तुलना में एक दुर्बल अपचायक है। मानक इलेक्ट्रोड विभव बहुत महत्त्वपूर्ण है। इनसे हमें बहुत सी दूसरी उपयोगी जानकारियाँ भी मिलती हैं। कुछ चुनी हुई इलेक्ट्रोड अभिक्रियाओं (अपचयन अभिक्रिया) के मानक इलेक्ट्रोड विभव के मान तालिका 8.1 में दिए गए हैं। इलेक्ट्रोड अभिक्रियाओं तथा सेलों के बारे में और अधिक विस्तार से आप अगली कक्षा में पढ़ेंगे।
सारांश
अभिक्रियाओं का एक महत्त्वपूर्ण वर्ग अपचयोपचय अभिक्रिया है, जिसमें अॉक्सीकरण तथा अपचयन साथ-साथ होते हैं। इस पाठ में तीन प्रकार की संकल्पनाएँ विस्तार से दी गई हैं–चिरप्रतिष्ठित (Classical), इलेक्ट्रॉनिक तथा अॉक्सीकरण-संख्या। इन संकल्पनाओं के आधार पर अॉक्सीकरण, अपचयन, अॉक्सीकारक (अॉक्सीडेंट) तथा अपचायक (रिडक्टेंट) को समझाया गया है। संगत नियमों के अंतर्गत अॉक्सीकरण-संख्या का निर्धारण किया गया है। ये दोनों अॉक्सीकरण-संख्या तथा आयन इलेक्ट्रॉन विधियाँ अपचयोपचय अभिक्रियाओं के समीकरण लिखने में उपयोगी हैं। अपचयोपचय अभिक्रियाओं को चार वर्गों में विभाजित किया गया है–योग, अपघटन, विस्थापन तथा असमानुपातन। रिडॉक्स युग्म तथा इलेक्ट्रॉड प्रक्रम की अवधारणा को प्रस्तुत किया गया है। रेडॉक्स अभिक्रियाओं का इलेक्ट्रोड अभिक्रियाओं तथा सेलों के अध्ययन में व्यापक अनुप्रयोग होता है।
अभ्यास
8.1 निम्नलिखित स्पीशीज़ में प्रत्येक रेखांकित तत्त्व की अॉक्सीकरण-संख्या का निर्धारण कीजिए—
(क) NaH2PO4 (ख)  (ग) H4P2O7 (घ) K2MnO4
(ग) H4P2O7 (घ) K2MnO4
(ङ) CaO2 (च) 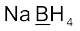 (छ) H2S2O7 (ज) KAl(SO4)2.12 H2O
(छ) H2S2O7 (ज) KAl(SO4)2.12 H2O
8.2 निम्नलिखित यौगिकों के रेखांकित तत्त्वों की अॉक्सीकरण-संख्या क्या है तथा इन परिणामों को आप कैसे प्राप्त करते हैं?
(क) 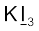 (ख)
(ख)  (ग)
(ग) 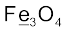 (घ)
(घ) 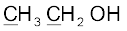 (ङ)
(ङ) 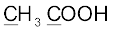
8.3 निम्नलिखित अभिक्रियाओं का अपचयोपचय अभिक्रियाओं के रूप में औचित्य स्थापित करने का प्रयास करें—
(क) CuO(s) + H2(g) → Cu(s) + H2O(g)
(ख) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
(ग) 4BCl3(g) + 3LiAlH4(s) → 2B2H6(g) + 3LiCl(s) + 3 AlCl3 (s)
(घ) 2K(s) + F2(g) → 2K+F– (s)
(ङ) 4 NH3(g) + 5 O2(g) → 4NO(g) + 6H2O(g)
8.4 फ्लुओरीन बर्फ से अभिक्रिया करके यह परिवर्तन लाती है—
H2O(s) + F2(g) → HF(g) + HOF(g)
इस अभिक्रिया का अपचयोपचय औचित्य स्थापित कीजिए।
8.5 H2SO5, Cr2O2– तथा  में सल्फर, क्रोमियम तथा नाइट्रोजन की अॉक्सीकरण-संख्या कीगणना कीजिए। साथ ही इन यौगिकों की संरचना बताइए तथा इसमें हेत्वाभास (Fallacy) का स्पष्टीकरण दीजिए।
में सल्फर, क्रोमियम तथा नाइट्रोजन की अॉक्सीकरण-संख्या कीगणना कीजिए। साथ ही इन यौगिकों की संरचना बताइए तथा इसमें हेत्वाभास (Fallacy) का स्पष्टीकरण दीजिए।
8.6 निम्नलिखित यौगिकों के सूत्र लिखिए–
(क) मरक्यूरी (II) क्लोराइड (ख) निकल (II) सल्फेट
(ग) टिन (IV) अॉक्साइड (घ) थेलियम (I) सल्फेट
(ङ) आयरन (III) सल्फेट (च) क्रोमियम (III) अॉक्साइड
8.7 उन पदार्थों की सूची तैयार कीजिए, जिनमें कार्बन – 4 से +4 तक की तथा नाइट्रोजन –3 से +5 तक की अॉक्सीकरण अवस्था होती है।
8.8 अपनी अभिक्रियाओं में सल्फर डाइअॉक्साइड तथा हाइड्रोजन परॉक्साइड अॉक्सीकारक तथा अपचायक—दोनों ही रूपों में क्रिया करते हैं, जबकि ओज़ोन तथा नाइट्रिक अम्ल केवल अॉक्सीकारक के रूप में ही। क्यों?
8.9 इन अभिक्रियाओं को देखिए—
(क) 6 CO2(g) + 6H2O(l) → C6 H12 O6(aq) + 6O2(g)
(ख) O3(g) + H2O2(l) → H2O(l) + 2O2(g)
बताइए कि इन्हें निम्नलिखित ढंग से लिखना ज्यादा उचित क्यों है?
(क) 6CO2(g) + 12H2O(l) → C6 H12 O6(aq) + 6H2O(l) + 6O2(g)
(ख) O3(g) + H2O2 (l) → H2O(l) + O2(g) + O2(g)
उपरोक्त अपचयोपचय अभिक्रियाओं (क) तथा (ख) के अन्वेषण की विधि सुझाइए।
8.10 AgF2 एक अस्थिर यौगिक है। यदि यह बन जाए, तो यह यौगिक एक अति शक्तिशाली अॉक्सीकारक की भाँति कार्य करता है। क्यों?
8.11 ‘‘जब भी एक अॉक्सीकारक तथा अपचायक के बीच अभिक्रिया संपन्न की जाती है, तब अपचायक के आधिक्य में निम्नतर अॉक्सीकरण अवस्था का यौगिक तथा अॉक्सीकारक के आधिक्य में उच्चतर अॉक्सीकरण अवस्था का यौगिक बनता है।’’ इस वक्तव्य का औचित्य तीन उदाहरण देकर दीजिए।
8.12 इन प्रेक्षणों की अनुकूलता को कैसे समझाएँगे?
(क) यद्यपि क्षारीय पोटैशियम परमैंगनेट तथा अम्लीय पोटैशियम परमैंगनेट–दोनों ही अॉक्सीकारक हैं। फिर भी टॉलुइन से बेंजोइक अम्ल बनाने के लिए हम एल्कोहॉलक पोटैशियम परमैंगनेट का प्रयोग अॉक्सीकारक के रूप में क्यों करते हैं? इस अभिक्रिया के लिए संतुलित अपचयोपचय समीकरण दीजिए।
(ख) क्लोराइडयुक्त अकार्बनिक यौगिक में सांद्र सल्फ्युरिक अम्ल डालने पर हमें तीक्ष्ण गंध वाली HCl गैस प्राप्त होती है, परंतु यदि मिश्रण में ब्रोमाइड उपस्थित हो, तो हमें ब्रोमीन की लाल वाष्प प्राप्त होती है, क्यों?
8.13 निम्नलिखित अभिक्रियाओं में अॉक्सीकृत, अपचयित, अॉक्सीकारक तथा अपचायक पदार्थ पहचानिए–
(क) 2AgBr (s) + C6H6O2(aq) → 2Ag(s) + 2HBr (aq) + C6H4O2(aq)
(ख) HCHO(l) + 2[Ag (NH3)2]+(aq) + 3OH–(aq) → 2Ag(s) + HCOO–(aq) + 4NH3(aq)
+ 2H2O(l)
(ग) HCHO (l) + 2 Cu2+(aq) + 5 OH–(aq) → Cu2O(s) + HCOO–(aq) + 3H2O(l)
(घ) N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(l)
(ङ) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
8.14 निम्नलिखित अभिक्रियाओं में एक ही अपचायक थायोसल्फेट, आयोडीन तथा ब्रोमीन से अलग-अलग प्रकार से अभिक्रिया क्यों करता है?
2 S2O32– (aq) + I2(s) → S4 O6 2–(aq) + 2I–(aq)
S2O3 2–(aq) + 2Br2(l) + 5 H2O(l) → 2SO42–(aq) + 4Br–(aq) + 10H+(aq)
8.15 अभिक्रिया देते हुए सिद्ध कीजिए कि हैलोजनों में फ्लुओरीन श्रेष्ठ अॉक्सीकारक तथा हाइड्रोहैलिक यौगिकों में हाइड्रोआयोडिक अम्ल श्रेष्ठ अपचायक है।
8.16 निम्नलिखित अभिक्रिया क्यों होती है—
XeO64– (aq) + 2F– (aq) + 6H+(aq) → XeO3(g)+ F2(g) + 3H2O(l)
यौगिक Na4XeO6 (जिसका एक भाग XeO64– है) के बारे में आप इस अभिक्रिया में क्या निष्कर्ष निकाल सकते हैं?
8.17 निम्नलिखित अभिक्रियाओं में
(क) H3PO2(aq) + 4 AgNO3(aq) + 2 H2O(l) → H3PO4(aq) + 4Ag(s) + 4HNO3(aq)
(ख) H3PO2(aq) + 2CuSO4(aq) + 2 H2O(l) → H3PO4(aq) + 2Cu(s) + H2SO4(aq)
(ग) C6H5CHO(l) + 2[Ag (NH3)2]+(aq) + 3OH–(aq) → C6H5COO–(aq) + 2Ag(s) +
4NH3 (aq) + 2 H2O(l)
(घ) C6H5CHO(l) + 2Cu2+(aq) + 5OH–(aq) → कोई परिवर्तन नहीं।
इन अभिक्रियाओं से Ag+ तथा Cu2+ के व्यवहार के विषय में निष्कर्ष निकालिए।
8.18 आयन इलेक्ट्रॉन विधि द्वारा निम्नलिखित रेडॉक्स अभिक्रियाओं को संतुलित कीजिए —
(क) MnO4– (aq) + I– (aq) → MnO2 (s) + I2(s) (क्षारीय माध्यम)
(ख) MnO4– (aq) + SO2 (g) → Mn2+ (aq) + HSO4– (aq)(अम्लीय माध्यम)
(ग) H2O2 (aq) + Fe2+ (aq) → Fe3+ (aq) + H2O (l) (अम्लीय माध्यम)
(घ) Cr2O7 2– + SO2(g) → Cr3+ (aq) + SO42– (aq) (अम्लीय माध्यम)
8.19 निम्नलिखित अभिक्रियाओं के समीकरणों को आयन इलेक्ट्रॉन तथा अॉक्सीकरण-संख्या विधि (क्षारीय माध्यम में) द्वारा संतुलित कीजिए तथा इनमें अॉक्सीकरण और अपचायकों की पहचान कीजिए—
(क) P4(s) + OH–(aq) → PH3(g) + HPO2– (aq)
(ख) N2H4(l) + ClO3 –(aq) → NO(g) + Cl–(g)
(ग) Cl2O7 (g) + H2O2(aq) → ClO2–(aq) + O2(g) + H+
8.20 निम्नलिखित अभिक्रिया से आप कौन सी सूचनाएँ प्राप्त कर सकते हैं—
(CN)2(g) + 2OH–(aq) → CN–(aq) + CNO–(aq) + H2O(l)
8.21 Mn3+ आयन विलयन में अस्थायी होता है तथा असमानुपातन द्वारा Mn2+, MnO2 और H+ आयन देता है। इस अभिक्रिया के लिए संतुलित आयनिक समीकरण लिखिए—
8.22 Cs, Ne, I, तथा F में एेसे तत्त्व की पहचान कीजिए, जो
(क) केवल ऋणात्मक अॉक्सीकरण अवस्था प्रदर्शित करता है।
(ख) केवल धनात्मक अॉक्सीकरण अवस्था प्रदर्शित करता है।
(ग) ऋणात्मक तथा धनात्मक दोनों अॉक्सीकरण अवस्था प्रदर्शित करता है।
(घ) न ऋणात्मक और न ही धनात्मक अॉक्सीकरण अवस्था प्रदर्शित करता है।
8.23 जल के शुद्धिकरण में क्लोरीन को प्रयोग में लाया जाता है। क्लोरीन की अधिकता हानिकारक होती है। सल्फरडाइअॉक्साइड से अभिक्रिया करके इस अधिकता को दूर किया जाता है। जल में होने वाले इस अपचयोपचय परिवर्तन के लिए संतुलित समीकरण लिखिए।
8.24 इस पुस्तक में दी गई आवर्त सारणी की सहायता से निम्नलिखित प्रश्नों के उत्तर दीजिए—
(क) संभावित अधातुओं के नाम बताइए, जो असमानुपातन की अभिक्रिया प्रदर्शित कर सकती हों।
(ख) किन्हीं तीन धातुओं के नाम बताइए, जो असमानुपातन अभिक्रिया प्रदर्शित कर सकती हों।
8.25 नाइट्रिक अम्ल निर्माण की ओस्टवाल्ड विधि के प्रथम पद में अमोनिया गैस के अॉक्सीजन गैस द्वारा अॉक्सीकरण से नाइट्रिक अॉक्साइड गैस तथा जलवाष्प बनती है। 10.0 ग्राम अमोनिया तथा 20.00 ग्राम अॉक्सीजन द्वारा नाइट्रिक अॉक्साइड की कितनी अधिकतम मात्रा प्राप्त हो सकती है?
8.26 सारणी 8.1 में दिए गए मानक विभवों की सहायता से अनुमान लगाइए कि क्या इन अभिकारकों के बीच अभिक्रिया संभव है?
(क) Fe3+ तथा I–(aq)
(ख) Ag+ तथा Cu(s)
(ग) Fe3+(aq) तथा Br–(aq)
(घ) Ag(s) तथा Fe3+(aq)
(ङ) Br2(aq) तथा Fe2+
8.27 निम्नलिखित में से प्रत्येक के विद्युत्-अपघटन से प्राप्त उत्पादों के नाम बताइए–
(क) सिल्वर इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(ख) प्लैटिनम इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(ग) प्लैटिनम इलेक्ट्रोड के साथ H2SO4 का तनु विलयन
(घ) प्लैटिनम इलेक्ट्रोड के साथ CuCI2 का जलीय विलयन
2.28 निम्नलिखित धातुओं को उनके लवणें के विलयन में से विस्थापन की क्षमता के क्रम में लिखिए–
Al, Cu, Fe, Mg तथा Zn
2.29 नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधाार पर धातुओं को उनकी बढ़ती अपचायक क्षमता के क्रम में लिखिए–
K+/K = –2.93V, Ag+/Ag = 0.80V,
Hg2+/Hg = 0.79V
Mg2+/Mg = –2.37V, Cr3+/Cr = – 0.74V
8.30 उस गैल्वेनी सेल को चित्रित कीजिए, जिसमें निम्नलिखित अभिक्रिया होती है–
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s)
अब बताइए कि–
(क) कौन सा इलेक्ट्रोड ऋण आवेशित है?
(ख) सेल में विद्युत्धारा के वाहक कौन हैं?
(ग) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रियाएँ क्या हैं?