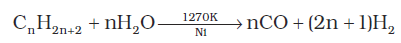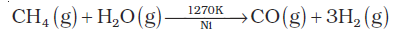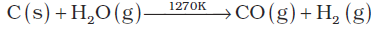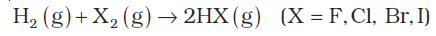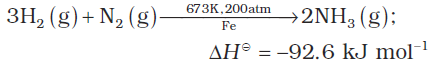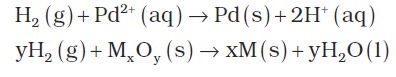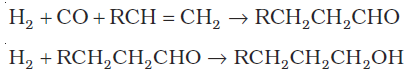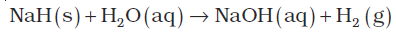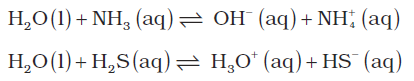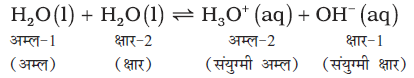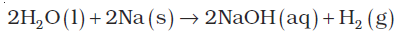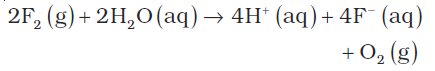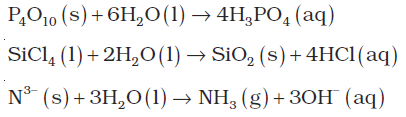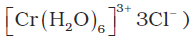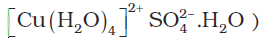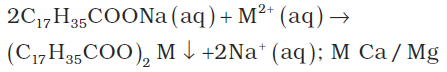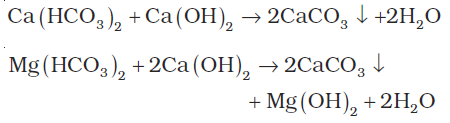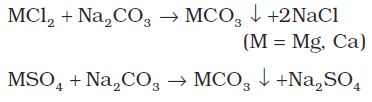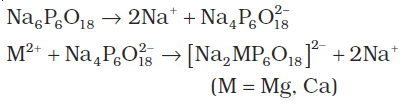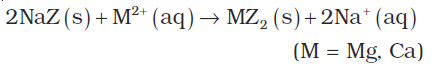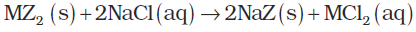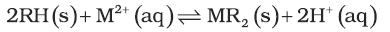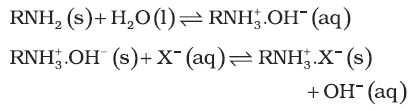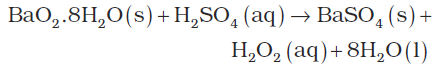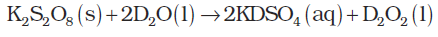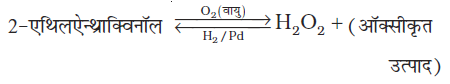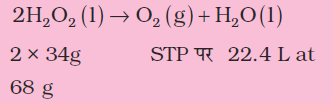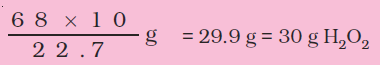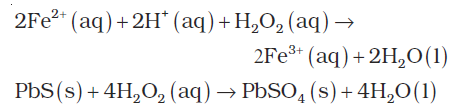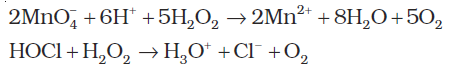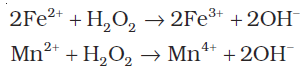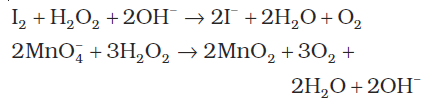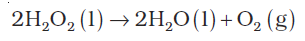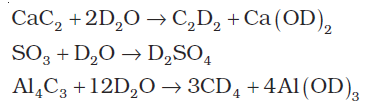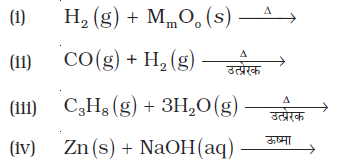Table of Contents
एकक 9
हाइड्रोजन
Hydrogen
हाइड्रोजन ब्रह्मांड में अतिबहुल तत्व है। पृथ्वी की सतह पर अतिबहुलता के क्रम में यह तीसरे स्थान पर है। यह भविष्य में ऊर्जा के प्रमुख स्रोत के रूप में दृष्टिगोचर होता है।
उद्देश्य
इस एकक के अध्ययन के बाद आप–
- आवर्त सारणी में हाइड्रोजन की स्थिति की ज्ञात धारणाओं को बता सकेंगे;
- हाइड्रोजन के लघु तथा व्यापारिक स्तर पर बनाने की विधियों का तथा उनके समस्थानिकों का वर्णन कर सकेंगे;
- डाइहाइड्रोजन किस प्रकार विभिन्न तत्वों से संयुक्त होकर आयनिक, आण्विक तथा अरसमीकरणमितीय यौगिकों को बनाती है, इसे समझ सकेंगे;
- इसके गुणों की समझ के आधार पर उपयोगी पदार्थों तथा नयी तकनीकों के उत्पादन का वर्णन कर सकेंगे;
- वातावरणीय जल की गुणवत्ता किस प्रकार विभिन्न विलेय पदार्थों पर निर्भर करती है, यह समझा सकेंगे। साथ ही कठोर और मृदु जल में अंतर कर सकेंगे तथा जल के मृदुकरण को समझ सकेंगे;
- भारी जल और उसके महत्त्व के संबंध में ज्ञान अर्जित कर सकेंगे;
- हाइड्रोजन परॉक्साइड की संरचना समझ सकेंगे तथा इसे बनाने की विधियों और इसके गुणों के आधार पर उपयोगी रसायनों के उत्पादन तथा पर्यावरण की स्वच्छता को समझ सकेंगे;
- इलेक्ट्रॉन-न्यून, इलेक्ट्रॉन-परिशुद्ध, इलेक्ट्रॉन- समृद्ध, हाइड्रोजनीकरण, हाइड्रोजन अर्थव्यवस्था इत्यादि पदों को समझ सकेंगे तथा इनका उपयोग कर पाएँगे;
- जल की संरचना के आधार पर उसके भौतिक तथा रासायनिक गुणों का वर्णन कर सकेंगे।
प्रकृति में समस्त ज्ञात तत्वों में हाइड्रोजन की परमाणु-संरचना सरलतम है। इसके परमाणु में एक प्रोट्रॉन तथा एक इलेक्टॉन होता है। तात्विक हाइड्रोजन का अस्तित्व द्विपरमाणुक H2 अणु के रूप में है, जिसे डाइहाइड्रोजन (H2) कहते हैं। क्या आप यह जानते हैं कि हाइड्रोजन अन्य तत्वों की तुलना में अधिक यौगिक बनाते हैं? हाइड्रोजन का उपयोग ऊर्जा-स्रोत के रूप में करके अत्यधिक स्तर तक सार्वभौमिक ऊर्जा की पूर्ति की जा सकती है। इस एकक में आप हाइड्रोजन के औद्योगिक महत्त्व के बारे में अध्ययन कर सकेंगे।
9.1 आवर्त सारणी में हाइड्रोजन का स्थान
हाइड्रोजन आवर्त सारणी का प्रथम तत्व है, यद्यपि आवर्त सारणी में हाइड्रोजन का उचित स्थान विवेचना का विषय रहा है। जैसा आप जानते हैं, आवर्त सारणी में तत्व इलेक्ट्रॉनिक विन्यास के आधार पर व्यवस्थित रहते हैं।
हाइड्रोजन का इलेक्ट्रॉनिक विन्यास 1s1 है। एक तरफ इसका बाह्यतम इलेक्ट्रॉनिक विन्यास क्षार धातुओं (ns1) के समान होता है, जो आवर्त सारणी के प्रथम वर्ग से संबंधित है, जबकि दूसरी तरफ हैलोजनों की भाँति (ns2 np5 इलेक्ट्रॉनिक विन्यास के साथ आवर्त सारणी के सत्रहवें वर्ग से संबंधित है) जो संगत उत्कृष्ट गैस विन्यास से एक इलेक्ट्रॉन कम है। इस प्रकार हाइड्रोजन क्षार धातुओं से समानता दर्शाता है, जो एक इलेक्ट्रॉन त्यागकर एकधनीय आयन बनाते हैं। साथ ही यह हैलोजन की भाँति एक इलेक्ट्रॉन ग्रहण कर एकऋणीय आयन बनाता है। क्षार धातुओं के समान हाइड्रोजन, अॉक्साइड, हैलाइड एवं सल्फाइड बनाता है, यद्यपि सामान्य परिस्थितियों में इसकी क्षार धातुओं के विपरीत उच्च आयनन एन्थैल्पी होती है एवं धात्विक अभिलक्षण नहीं दर्शाता है। यथार्थ में आयनन ऊर्जा के पदों में हाइड्रोजन हैलोजन से अधिक समानता दर्शाता है। Li की ∆iH 520 kJ mol–1, F की 1680 kJ mol–1 एवं H की 1312 kJ mol–1 । यह हैलोजेन के समान द्विपरमाणवीय अणु तथा विभिन्न तत्वों से संयुक्त होकर हाइड्राइड एवं बहुत से सहसंयोजी यौगिक बनाता है। क्रियाशीलता के आधार पर यह हैलोजनों की तुलना में कम सक्रिय है।
कुछ सीमा तक क्षार धातुओं एवं हैलोजनों से समानता दर्शाने के बावजूद उनसे असमानताएँ भी दर्शाता है। अब प्रासंगिक प्रश्न यह है कि इसे आवर्त सारणी में कहाँ रखा जाए? हाइड्रोजन से इलेक्ट्रॉन का परित्याग कर नाभिक (H+) देता है, जिसका आकार ~ 1.5 × 10–3 pm है, जो सामान्य परमाणवीय एवं आयनिक आकार 50 से 200 pm की तुलना में बहुत कम है। परिणामत: H+ स्वतंत्र अवस्था में नहीं मिलता है एवं दूसरे परमाणुओं या अणुओं से संयुक्त रहता है। अत: इसके अद्वितीय व्यवहार के कारण इसे आवर्त सारणी में अलग रखा गया है (एकक-3)।
9.2 डाइहाइड्रोजन (H2)
9.2.1 प्राप्ति
डाइहाइड्रोजन ब्रह्मांड में अतिबाहुल्य तत्व (ब्रह्मांड के संपूर्ण द्रव्यमान का 70 प्रतिशत) है तथा यह सौरवायुमंडल का प्रमुख तत्व है। बड़े ग्रहों–बृहस्पति (Jupiter) तथा शनि (Saturn) में अधिकांशत: हाइड्रोजन होती है, हालाँकि अपनी हलकी प्रकृति के कारण यह पृथ्वी के वायुमंडल में कम मात्रा (द्रव्यमानानुसार लगभग 0.15 प्रतिशत) में पाया जाती है। संयुक्त अवस्था में हाइड्रोजन तत्व भू-पर्पटी तथा महासागर में 15.4 प्रतिशत भाग का निर्माण करता है। संयुक्त अवस्था में जल के अतिरिक्त यह पादप तथा जंतु-ऊतकों, कार्बोहाइड्रेट, प्रोटीन, हाइड्राइड, हाइड्रोकार्बन और कई अन्य यौगिकों में पाया जाता है।
9.2.2 हाइड्रोजन के समस्थानिक
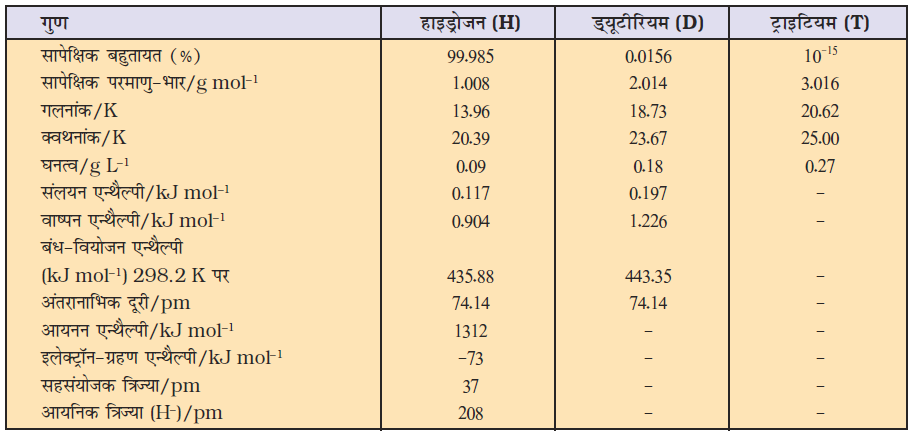
हाइड्रोजन के तीन समस्थानिक प्रोटियम (11H), ड्यूटीरियम (12H या D) तथा ट्राइटियम (13H या T) होते हैं। क्या आप अनुमान लगा सकते हैं कि ये समस्थानिक एक-दूसरे से कैसे भिन्न होते हैं? ये तीनों समस्थानिक से न्यूट्रॉन की संख्या के आधार पर एक-दूसरे भिन्न होते हैं। सामान्य हाइड्रोजन (प्रोटियम) में कोई न्यूट्रॉन नहीं है। ड्यूटीरियम (जिसे ‘भारी हाइड्रोजन’ भी कहा जाता है) में एक तथा ट्राइटियम के नाभिक में दो न्यूट्रॉन होते हैं। सन् 1934 में एक अमेरिकी वैज्ञानिक हेरॉल्ड सी. यूरे को भौतिक विधियों द्वारा 2 परमाणु द्रव्यमान वाले हाइड्रोजन के समस्थानिक का पृथक्करण करने पर नोबेल पुरस्कार प्राप्त हुआ था।
हाइड्रोजन का प्रमुख समस्थानिक प्रोटियम है। ड्यूटीरियम लौकिक हाइड्रोजन में 0.0156 प्रतिशत तक मुख्यत: HD के रूप में निहित है। ट्राइटियम की सांद्रता लगभग 1018 प्रोटियम परमाणुओं में एक ट्राइटियम के परमाणु की है। इन समस्थानिकों में से केवल ट्राइटियम रेडियो सक्रिय (t1/2 = 12.33 वर्ष) है तथा न्यून ऊर्जा वाले β कणों को उत्सर्जित करता है।
चूँकि समस्थानिकों के इलेक्ट्रॉनिक विन्यास समान हैं, इसलिए इनके रासायनिक गुण भी लगभग समान हैं। इनकी केवल अभिक्रिया की गति मुख्य रुप से अपने विभिन्न बंध-वियोजन एन्थैल्पी के कारण भिन्न होती है (सारणी 9.1) तथापि भौतिक गुणों में ये समस्थानिक परमाणु-भार में अंतर के कारण भिन्नता दर्शाते हैं।
9.3 डाइहाइड्रोजन बनाने की विधियाँ (H2)
धातुओं तथा धातु हाइड्राइडों से डाइहाइड्रोजन बनाने की अनेक विधियाँ हैं।
9.3.1 डाइहाइड्रोजन बनाने की प्रयोगशाला विधि–
(i) सामान्यत: यह दानेदार जिंक की तनु हाइड्रोक्लोरिक अम्ल से अभिक्रिया करके बनाई जाती है–
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
(ii) यह जिंक धातु की जलीय क्षार के साथ अभिक्रिया करके भी बनाई जाती है–
Zn(s) + 2NaOH(aq) → Na2ZnO2(aq) + H2(g)
सोडियम जिंकेट
9.3.2 डाइहाइड्रोजन का व्यापारिक उत्पादन
इसके लिए प्रयुक्त साधारण प्रक्रमों की रूपरेखा नीचे दी जा रही है–
(i) प्लैटिनम इलेक्ट्रॉड का उपयोग कर अम्लीय जल के विद्युत्-अपघटन से डाइहाइड्रोजन प्राप्त की जाती है।
(ii) अति शुद्ध हाइड्रोजन (> 99.95%) निकैल इलेक्ट्रोडों के बीच रखे गए बेरियम हाइड्रॉक्साइड के जलीय विलयन को गरम अवस्था में विद्युत्-अपघटन कराकर प्राप्त की जाती है।
(iii) ब्राइन विलयन के विद्युत्-अपघटन द्वारा क्लोरीन तथा सोडियम हाइड्रॉक्साइड के औद्योगिक निर्माण में डाइहाइड्रोजन उप-उत्पाद (by-product) के रूप में प्राप्त होता है। विद्युत्-अपघटन में होने वाली अभिक्रियाएँ हैं–
एनोड पर : 2 Cl–(aq) → Cl2(g) + 2e–
कैथोड पर : 2H2O (l) 2e– → H2(g) + 2OH– (aq)
कुल अभिक्रिया : 2Na+ (aq) + 2 Cl– (aq) + 2H2O(l) → Cl2(g) + H2(g) + 2Na+ (aq) + 2OH– है।
(iv) हाइड्रोकार्बन अथवा कोक की उच्च ताप पर एवं उत्प्रेरक की उपस्थिति में भाप से अभिक्रिया कराने पर डाइहाइड्रोजन प्राप्त होती है।
उदाहरणस्वरूप-
CO एवं H2 के मिश्रण को वाटर गैस कहते हैं। CO एवं H2 का यह मिश्रण मेथेनॉल तथा अन्य कई हाइड्रोकार्बनों के संश्लेषण में काम आता है। अत: इसे ‘संश्लेषण गैस’ या ‘सिन्गैस’ (Syngas) भी कहते हैं। आजकल सिन्गैस वहितमल (Sewage waste), अखबार, लकड़ी का बुरादा, लकड़ी की छीलन आदि से प्राप्त की जाती है। कोल से सिन्गैस का उत्पादन करने की प्रक्रिया को ‘कोलगैसीकरण’ (Coal-gasification) कहते हैं–
सिन्गैस में उपस्थित कार्बन मोनोअॉक्साइड को आयरन क्रोमेट उत्प्रेरक की उपस्थिति में भाप से क्रिया कराने पर डाइहाइड्रोजन का उत्पादन बढ़ाया जा सकता है–
यह भाप ‘अंगार गैस सृति-अभिक्रिया’ (Water gas shift reaction) कहलाती है। वर्तमान में ~77 प्रतिशत डाइहाइड्रोजन का औद्योगिक उत्पादन शैल रसायनों (Petrochemicals), 18 प्रतिशत कोल, 4 प्रतिशत जलीय विलयनों के विद्युत्-अपघटन तथा 1 प्रतिशत उत्पादन अन्य स्रोतों से होता है।
9.4 डाइहाइड्रोजन के गुण
9.4.1 भौतिक गुण
डाइहाइड्रोजन एक रंगहीन, गंधहीन तथा स्वादहीन दहनशील गैस होती है। यह वायु से हलकी तथा जल में अघुलनशील है। इनके तथा ड्यूटीरियम के अन्य भौतिक गुण सारणी 9.1 में दिए गए हैं।
9.4.2 रासायनिक गुण
डाइहाइड्रोजन अथवा (किसी भी अणु) का रासायनिक व्यवहार काफी हद तक बंध वियोजन एन्थैल्पी द्वारा निर्धारित किया जाता है। H–H बंध वियोजन एन्थैल्पी किसी तत्व के दो परमाणुओं के एकल बंध के लिए अधिकतम है। इस तथ्य से आप क्या निष्कर्ष निकालते हैं? यह इस कारक के कारण है कि डाइहाइड्रोजन का इसके परमाणुओं में वियोजन केवल 2000 K के ऊपर लगभग 0.081 प्रतिशत ही होता है, जो 5000 K पर बढ़कर 95.5 प्रतिशत तक पहुँच जाता है। उच्च H–H बंध एन्थैल्पी के कारण कक्ष ताप पर डाइहाइड्रोजन अपेक्षाकृत निष्क्रिय है। अत: विद्युत् आर्क या पराबैंगनी विकिरणों द्वारा परमाण्विक हाइड्रोजन का उत्पादन किया जाता है। चूँकि इसका एक कक्षक 1s1 इलेक्ट्रॉनिक विन्यास के साथ अपूर्ण है, अत: यह लगभग सभी तत्वों के साथ संयोग करता है। डाइहाइड्रोजन अभिक्रियाओं में– (i) एक इलेक्ट्रॉन का परित्याग कर H+ देता है। (ii) एक इलेक्ट्रॉन ग्रहण करके H– आयन बनाता है। (iii) इलेक्ट्रॉन का साझा करके एकल सहसंयोजक बंध बनाता है।
हैलोजन के साथ अभिक्रिया : डाइहाइड्रोजन हैलोजेन के साथ अभिक्रिया करके हाइड्रोजन हैलाइड देते हैं–
फलुओरीन की अभिक्रिया अँधेरे में भी हो सकती है। आयोडीन के साथ उत्प्रेरक की आवश्यकता पड़ती है।
डाइअॉक्सीजन के साथ अभिक्रिया : यह डाइअॉक्सीजन के साथ अभिक्रिया करके जल बनाता है। यह अभिक्रिया प्रबल ऊष्माक्षेपी (Exothermic) है-
डाइनाइट्रोजन के साथ अभिक्रिया : डाइनाइट्रोजन के साथ अभिक्रिया करके अमोनिया बनाती है-
अमोनिया को व्यापारिक मात्रा में इस विधि से हाबर प्रक्रम द्वारा बनाया जाता है।
धातुओं के साथ क्रिया : डाइहाइड्रोजन उच्च ताप पर कई धातुओं के साथ क्रिया करके संगत हाइड्राइड देता है (अनुभाग 9.5)।
H2(g) +2M(g) → 2MH(s); जहाँ M क्षारीय धातु है।
धातु आयन तथा धातु अॉक्साइड के साथ अभिक्रिया : डाइहाइड्रोजन कुछ धातु आयनों को जलीय विलयन तथा उनके धातु (आयरन से कम क्रियाशील) अॉक्साइड से अभिक्रिया करके संगत धातुओं में अपचयित कर देती है–
कार्बनिक यौगिकों के साथ अभिक्रिया : उत्प्रेरकाें की उपस्थिति में डाइहाइड्रोजन कार्बनिक यौगिकों से अभिक्रिया करके कई महत्त्वपूर्ण औद्योगिक हाइड्रोजनीकृत उत्पाद बनाती है। उदाहरणार्थ–
(i) वनस्पति तेलों को निकैल उत्प्रेरक की उपस्थिति में हाइड्रोजनीकरण कराने पर खाद्य वसा (मार्गेरीन तथा वनस्पति घी) प्राप्त होता है।
(ii) ओलिफीन का हाइड्रोफॅार्मिलीकरण कराने पर एेल्डिहाइड प्राप्त होता है, जो आगे एल्कोहॉल में अपचयित हो जाता है–
उदाहरण 9.1
निम्नलिखित से डाइहाइड्रोजन की अभिक्रिया पर टिप्पणी कीजिए-
(i)क्लोरीन (ii) सोडियम (iii)कॉपर (II) अॉक्साइड
हल
(i) डाइहाइड्रोजन क्लोरीन को क्लोराइड (Cl–) आयन में अपचयित करती है तथा स्वयं क्लोरीन द्वारा अॉक्सीकृत होकर हाइड्रोजन आयन (H+) हाइड्रोक्लोराइड के रूप में बनाती है। H एवं Cl के मध्य एक इलेक्ट्रॉन युग्म का साझा होकर एक सहसंयोजक अणु बनता है।
(ii) डाइहाइड्रोजन सोडियम के द्वारा अपचयित होकर सोडियम हाइड्राइड बनाता है। एक इलेक्ट्रॉन सोडियम से हाइड्रोजन पर स्थानांतरित होकर आयनिक Na+ H– का निर्माण करता है।
(iii) डाइहाइड्रोजन कॉपर (II) अॉक्साइड को कॉपर की शून्य अॉक्सीकरण अवस्था में अपचयित कर देती है और स्वयं जल, जो एक सहसंयोजक अणु है, में अॉक्सीकृत हो जाती है।
9.4.3 डाइहाइड्रोजन के अनुप्रयोग
- डाइहाइड्रोजन का एकल बृहद् अनुप्रयोग अमोनिया के संश्लेषण में होता है, जो नाइट्रिक अम्ल तथा नाइट्रोजनी उर्वरक उत्पादन में काम आता है।
- डाइहाइड्रोजन का उपयोग बहुअसंतृप्त वनस्पति तेलों (जैसे– सोयाबीन, बिनौला आदि) से वनस्पति वसा के उत्पादन में होता है।
- डाइहाइड्रोजन का उपयोग अनेक कार्बनिक रसायनों, मुख्यत: मेथेनॉल के उत्पादन में होता है–
- डाइहाइड्रोजन का उपयोग धात्विक हाइड्राइड के निर्माण में होता है। (खण्ड-9.5)
- डाइहाइड्रोजन का उपयोग अति उपयोगी रसायन (जैसे– हाइड्रोजन क्लोराइड) के निर्माण में होता है।
- धातुकर्म प्रक्रमों में डाइहाइड्रोजन का उपयोग भारी धातु अॉक्साइडों को धातु में अपचयित करने में होता है।
- परमाण्विक हाइड्रोजन तथा अॉक्सी-हाइड्रोजन टॉर्च का उपयोग कर्तन तथा वेल्डिंग में होता है। परमाण्विक हाइड्रोजन परमाणु (जो विद्युत् आर्क की सहायता से डाइहाइड्रोजन के वियोजन से बनते हैं) का पुनर्संयोग वेल्डिंग की जाने वाली धातुओं की सतह पर लगभग 4000 K तक ताप पैदा कर देता है।
- डाइहाइड्रोजन का उपयोग अंतरिक्ष अनुसंधान में रॉकेट ईंधन के रूप में किया जाता है।
- डाइहाड्रोजन का उपयोग ईंधन सेलों में विद्युत् उत्पादन के लिए किया जाता है। परंपरागत जीवाश्मी ईंधन और विद्युत् शक्ति की तुलना में हाइहाड्रोजन का प्रयोग ईंधन के रूप में करने से अनेक लाभ होते हैं। यह ईंधन प्रदूषण मुक्त है और पेट्रोल तथा अन्य ईंधन की तुलना में इकाई द्रव्यमान से अधिक ऊर्जा मुक्त करता है।
9.5 हाइड्राइड
डाइहाइड्रोजन निश्चित परिस्थितियों में उत्कृष्ट गैसों के अलावा लगभग सभी तत्वों के साथ संयोग करके द्विअंगी यौगिक बनाती हैं, जिन्हें हाइड्राइड कहते हैं। अगर E किसी तत्व का प्रतीक है, तो हाइड्राइड को EHX (उदाहरणस्वरूप- MgH2) या EmHn, (उदाहरणस्वरूप- B2H6) द्वारा प्रदर्शित किया जा सकता है।
हाइड्राइडों को तीन विभिन्न श्रेणियों में वर्गीकृत किया गया है–
(i) आयनिक या लवणीय या लवण-समान हाइड्राइड (Saline Hydride)
(ii) सहसंयोजक या आण्विक हाइड्राइड (Molecular Hydride)
(iii) धात्विक या अरससमीकरणमितीय हाइड्राइड (Non-stoichometric Hydride)
9.5.1 आयनिक या लवणीय हाइड्राइड
s ब्लॉक के अधिकांश तत्व, जो उच्च विद्युत् धनीय प्रकृति के होते हैं, डाइहाइड्रोजन के साथ रससमीकरणमितीय यौगिक बनाते हैं। यद्यपि हलके धात्विक हाइड्राइड (जैसे LiH, BeH2 तथा MgH2) में सार्थक सहसंयोजक गुण पाया जाता है। वस्तुत: LiH, BeH2 तथा MgH2 में सहसंयोजी बहुलक (Polymeric) संरचना होती है। आयनिक हाइड्राइड ठोस अवस्था में क्रिस्टलीय, अवाष्पशील तथा ठोस अवस्था में अचालक होते हैं, तथापि क्षार-धातुओं के गलित हाइड्राइड विद्युत् का चालन करते हैं और विद्युत्-अपघटन द्वारा डाइहाइड्रोजन एनोड पर मुक्त होती है, जो हाइड्राइड H– आयन के अस्तित्व की पुष्टि करता है।
लवणीय हाइड्राइड जल के साथ विस्फोटीय रूप से अभिक्रिया करके डाइहाइड्रोजन गैस देते हैं–
लिथियम हाइड्रइड साधारण ताप पर O2 एवं Cl2 के साथ अक्रियाशील है। अत: इसका उपयोग अन्य उपयोगी हाइड्राइड बनाने में किया जाता है। उदाहरणस्वरूप–
8LiH + Al2Cl6 → 2LiAlH4 + 6LiCl
2LiH + B2H6 → 2LiBH4
9.5.2 सहसंयोजक या आण्विक हाइड्राइड
डाइहाइड्रोजन अधिकांश p–ब्लॉक के तत्वों के साथ संयुक्त होकर आण्विक यौगिक बनाती है। इसके कुछ सुपरिचित उदाहरण CH4, NH3, H2O तथा HF हैं। सुविधा के लिए अधातुओं के हाइड्रोजन यौगिकों को भी हाइड्राइड माना गया है। सहसंयोजक होने के कारण ये वाष्पशील यौगिक हैं।
आण्विक हाइड्राइड का पुन: वर्गीकरण उनके लूइस संरचना (Lewis structure) में आपेक्षिक इलेक्ट्रॉन की संख्या तथा आबंधों की संख्या पर किया गया है–
(i) इलेक्ट्रॉन न्यून (Electron-defecient)
(ii) इलेक्ट्रॉन परिशुद्ध (Electron-precise)
(iii) इलेक्ट्रॉन समृद्ध (Electron-rich)
इलेक्ट्रॉन न्यून हाइड्राइड, जैसा नाम से पता चलता है, परंपरागत लूइस-संरचना लिखने के लिए इनमें इलेक्ट्रॉन की संख्या अपर्याप्त होती है। इसका उदाहरण डाइबोरेन (B2H6) है। वस्तुत: आवर्त सारणी के 13वें वर्ग के सभी तत्व इलेक्ट्रॉन न्यून यौगिक बनाते हैं। आप इनके व्यवहार से क्या अपेक्षा रखते हैं? ये लूइस अम्ल की भाँति कार्य करते हैं। ये इलेक्ट्रॉनग्राही होते हैं।
इलेक्ट्रॉन परिशुद्ध हाइड्राइड में परंपरागत लूइस-संरचना के लिए आवश्यक इलेक्ट्रॉन की संख्या होती है। आवर्त सारणी के 14वें वर्ग के सभी तत्व इस प्रकार के यौगिक (जैसे– CH4) बनाते हैं, जो चतुष्फलकीय ज्यामिति के होते हैं।
इलेक्ट्रॉन समृद्ध हाइड्राइड इलेक्ट्रॉन आधिक्य एकांकी इलेक्ट्रॉन युग्म के रूप में उपस्थित होते हैं। आवर्त सारणी के 15वें से 17वें वर्ग तक के तत्व इस प्रकार के यौगिक बनाते हैं– (NH3 में एकांकी युग्म, H2O में दो तथा HF में तीन एकांकी युग्म होते हैं)। आप इनके व्यवहार से क्या अपेक्षा रखते हैं? ये लूइस क्षार के रूप में व्यवहार करते हैं। ये इलेक्ट्रॉनदाता होते हैं। उच्च विद्युत्-ऋणात्मकता वाले परमाणु, जैसे– नाइट्रोजन, अॉक्सीजन तथा फ्लूओरीन के हाइड्राइड पर एकांकी इलेक्ट्रॉन युग्म होने के कारण अणुओं में हाइड्रोजन बंध बनता है, जिनके कारण अणुओं में संगुणन होता है।
उदाहरण 9.2
क्या आप यह अपेक्षा करते हैं कि N,O तथा F के हाइड्रइडों के क्वथनांक उनके वर्ग के संगत सदस्यों के हाइड्राइडों से निम्न होते हैं? कारण बताइए।
हल
NH3, H2O तथा HF के आण्विक भारों के आधार पर इनके क्वथनांक संगत सदस्यों के हाइड्राइडों से कम होने चाहिए, परंतु N,O,F की उच्च विद्युत्ऋणता के कारण हाइड्राइडों में हाइड्रोजन बंध बनाने की क्षमता उल्लेखनीय है। अत: NH3, H2O तथा HF के क्वथनांक उनके वर्ग के सदस्यों से उच्च होते हैं।
9.5.3 धात्विक या अरसमीकरणमितीय (या अंतराकाशी) हाइड्राइड
ये अधिकांश d-ब्लॉक तथा f-ब्लॉक के तत्वों से बनते हैं, हालाँकि सातवें, आठवें तथा नौवें वर्ग की धातुएँ इस प्रकार के हाइड्राइड नहीं बनाती है, छठे वर्ग में केवल क्रोमियम ही CrH हाइड्राइड बनाता है। इस प्रकार के हाइड्राइड ऊष्मा एवं विद्युत् का चालन करते हैं, किंतु उनकी चालकता जनक धातु की तरह कार्यक्षम नहीं हैं। हाइड्रोजन की न्यूनता के कारण लवणीय हाइड्राइड के विषम ये हमेशा अरससमीकरणमितीय होते हैं। उदाहरणस्वरूप- LaH2.87, YbH2.55, TiH1.5-1.8, ZrH1.3-1.75, VH0.56, NiH0.6-0.7, PdH0.6-0.8 आदि। एेसे हाइड्राइड्रो में स्थित संगठन का नियम लागू नहीं होता है।
पूर्व में यह सोचा जाता था कि इन हाइड्राइडों के धातु-जालक में हाइड्रोजन अंतराकाशी स्थिति ग्रहण करते हैं, जिससे इनमें बिना किसी परिवर्तन की विकृति उत्पन्न होती है। फलत: इन्हें ‘अंतराकाशी हाइड्राइड’ कहा गया, यद्यपि बाद में अध्ययन से यह स्पष्ट हुआ कि Ni, Pd, Ce एवं Ac के हाइड्राइड को छोड़कर इस वर्ग के अन्य हाइड्राइड अपने जनक धातु की तुलना में भिन्न जालक रखते हैं। संक्रमण धातुओं पर हाइड्रोजन के अवशोषण के गुण को उत्प्रेरकीय अपचयन अथवा हाइड्रोजनीकरण अभिक्रियाओं द्वारा अनेक यौगिक बनाने में बृहद् रूप से प्रयुक्त होता है। कुछ धातुएँ (जैसे- Pd एवं Pt) हाइड्रोजन के बृहद् आयतन को समायोजित कर सकती हैं। अत: इन्हें भंडारण-माध्यम के रूप में प्रयुक्त किया जाता है। हाइड्रोजन भंडारण एवं ऊर्जा-स्रोत के रूप में इस गुण के प्रयोग की प्रबल संभावना है।
उदाहरण 9.3
क्या फॉस्फोरस बाह्य इलेक्ट्रॉनिक विन्यास 3s23p3 के आधार पर PH5 बनाएगा?
हल
यद्यपि फॉस्फोरस +3 तथा +5 अॉक्सीकरण अवस्था दर्शाता है, तथापि यह PH5 नहीं बनाता है। कुछ अन्य तथ्यों के अतिरिक्त डाइहाइड्रोजन के उच्च ∆a तथा ∆egH मान P को सर्वोच्च अॉक्सीकरण अवस्था प्रदर्शित करने तथा फलस्वरूप pH5 के विरचन का समर्थन नहीं करते।
9.6 जल
सभी सजीवों का एक बृहद् भाग जल द्वारा निर्मित है। मानव शरीर में लगभग 65 प्रतिशत एवं कुछ पौधों में लगभग 95 प्रतिशत जल होता है। जीवों को जीवित रखने के लिए जल एक महत्त्वपूर्ण यौगिक है। यह एक अतिमहत्त्वपूर्ण विलायक है। पृथ्वी की सतह पर जल का वितरण एक समान नहीं है। विश्व की आकलित जल-आपूर्ति सारणी 9.2 में दी गई है–
सारणी 9.2 विश्व की आकलित जल-आपूर्ति
| स्रोत | संपूर्ण % मात्रा |
|---|---|
| महासागर (Oceans) | 97.33 |
| खारी झील (Saline lakes) तथा अंत:स्थलीय समुद्र (Inland sea) | 0.008 |
| ध्रुवीय बर्फ (Polar ice) तथा हिमानी (Glaciers) | 2.04 |
| भौम जल (Ground water) | 0.61 |
| झील (Lakes) | 0.009 |
| मृदा-आर्द्रता (Soil moisture) | 0.005 |
| वायुमंडलीय जलवाष्प (Atomospheric water vapour) | 0.001 |
| नदियाँ (River) | 0.0001 |
9.6.1 जल के भौतिक गुण
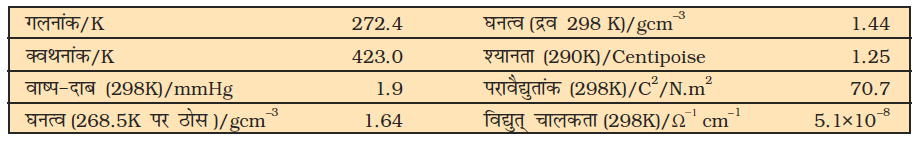
यह एक रंगहीन तथा स्वादहीन द्रव है। जल (H2O) तथा भारी जल (D2O) के भौतिक गुण सारणी 9.3 में दिए गए हैं।
संघनित प्रावस्था (द्रव तथा ठोस अवस्था) में जल के असामान्य गुणों का कारण जल के अणुओं के बीच विस्तृत हाइड्रोजन बंधन का होना है। इसी वर्ग के अन्य तत्वों के हाइड्राइड H2S तथा H2Se की तुलना में जल का उच्चहिमांक, उच्च क्वथनांक, उच्च वाष्पन ऊष्मा, उच्च संलयन ऊष्मा का कारण हाइड्रोजन-बंधन का होना है। अन्य द्रवों की तुलना में जल की विशिष्ट ऊष्मा, तापीय चालकता, पृष्ठ-तनाव, द्विध्रुव आघूर्ण तथा परावैद्युतांक के मान उच्च होते हैं। इन्हीं गुणों के कारण जीवमंडल में जल की महत्त्वपूर्ण भूमिका है।
जल की उच्च वाष्पन ऊष्मा तथा उच्च ऊष्माधारिता ही जीवों के शरीर तथा जलवायु के सामान्य ताप को बनाए रखने के लिए उत्तरदायी है। वनस्पतियों एवं प्राणियों के उपापचय (Metabolism) में अणुओं के अभिगमन के लिए जल एक उत्तम विलायक का कार्य करता है। जल ध्रुवीय अणुओं के साथ हाइड्रोजन बंध बनाता है, जिससे सहसंयोजक यौगिक,जैसे– एेल्कोहॉल तथा कार्बोहाइड्रेट यौगिक जल में विलेय होते हैं।
9.6.2 जल की संरचना
गैस-प्रावस्था में जल एक बंकित अणु है। आबंध कोण तथा O–H आबंध दूरी के मान क्रमश: 104.5° तथा 95.7 pm हैं, जैसा चित्र 9.1 (क) में प्रदर्शित किया गया है। अत्यधिक ध्रुवित अणु चित्र 9.1 (ख) में तथा चित्र 9.1 (ग) में जल के अणु में आर्बिटल अतिव्यापन दर्शाया गया है।

चित्र 9.1 (क) जल की बंकित संरचना (ख) जल अणु द्विध्रुव के रूप में और (ग) जल के अणु में आर्बिटल अतिव्यापन
जल का क्रिस्टलीय प्रारूप बर्फ है। वायुमंडलीय दाब पर बर्फ का क्रिस्टलीकरण षट्कोणीय आकृति के रूप में होता है। परंतु न्यून ताप पर इसका संघनन घनीय आकृति के रूप में होता है। बर्फ का घनत्व जल से कम होता है। फलत: बर्फ का टुकड़ा जल में तैरता रहता है। शीतकाल में झीलों में पानी की सतह पर जमी बर्फ की सतह ऊष्मारोधन (Thermal insulation) प्रदान करती है, जिससे जलीय जीवन सुरक्षित रहता है। यह तथ्य पारिस्थितिकी (Eological) दृष्टि से अति महत्त्वपूर्ण है।
9.6.3 बर्फ की संरचना
बर्फ एक अतिव्यवस्थित त्रिविम हाइड्रोजन आबंधित संरचना (Highly ordered three dimensional hydrogen bonded structure) है, जिसे चित्र 9.2 में दर्शाया गया है।
X-किरणों द्वारा परीक्षण से पता चला है कि बर्फ क्रिस्टल में अॉक्सीजन परमाणु चार अन्य हाइड्रोजन परमाणुओं से 276 pm दूरी पर चतुष्फलकीय रूप से घिरा रहता है।
हाइड्रोजन आबंध बर्फ में बृहद छिद्रयुक्त एक प्रकार की खुली संरचना बनाते हैं। ये छिद्र उपयुक्त आकार के कुछ दूसरे अणुओं को अंतराकाश में ग्रहण कर सकते हैं।
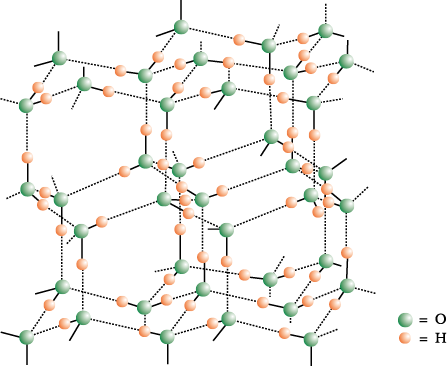
चित्र 9.2 बर्फ की संरचना
9.6.4 जल के रासायनिक गुण
जल अनेक पदार्थों के साथ अभिक्रिया करता है। कुछ महत्त्वपूर्ण अभिक्रियाएँ निम्नलिखित हैं–
(1) उभयधर्मी प्रकृति : जल अम्ल तथा क्षार-दोनों रूपों में व्यवहार करता है। अत: यह उभयधर्मी है। ब्रांस्टेड
अवधारणा के संदर्भ में जल NH3 के साथ अम्ल के रूप में तथा H2S के साथ क्षार के रूप में कार्य करता है–
जल के स्वत: प्रोटोअपघटन (स्वत: आयनन) को निम्नलिखित रूप में प्रदर्शित किया जा सकता है–
(2) जल की अपोपचयन अभिक्रिया : उच्च विद्युत् धनीय धातुओं द्वारा जल आसानी से डाइहाइड्रोजन में अपचयित हो जाता है–
अत: यह अभिक्रिया हाइड्रोजन के प्रमुख स्रोत के रूप में उपयोगी है।
प्रकाश संश्लेषण की प्रक्रिया में जल O2 में अॉक्सीकृत होता है।
6CO2(g) + 12H2O(l) → C6H12O6 (aq) + 6H2O(l) + 6O2(g)
फ्लुओरीन द्वारा भी H2O का अॉक्सीजन में अॉक्सीकरण होता है–
(3) जल-अपघटन अभिक्रिया : जल का परावैद्युतांक उच्च होने के कारण इसमें प्रबल जलयोजन गुण पाया जाता है। यह अनेक आयनिक यौगिक को घोलने में सक्षम है। फलस्वरुप कुछ आयनिक तथा सहसंयोजी यौगिकों का जल-अपघटन हो जाता है–
(4) हाइड्रेट-विरचन : जलीय विलयन से अनेक लवण जलयोजित लवण के रूप में क्रिस्टलीकृत किए जा सकते हैं। जल का संगुणन विभिन्न प्रकार से होता है–
(i) उपसहसंयोजित जल
(उदाहरणस्वरूप
(ii) अंतराकाशीय जल
(उदाहरणस्वरूप)
(iii) हाइड्रोजन आबंधी जल
(उदाहरणस्वरूप 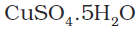
उदाहरण 9.4
CuSO4, 5H2O में कितने जल-अणु हाइड्रोजन बंध द्वारा संगुणित हैं?
हल
केवल जल का एक अणु, जो बड़े कोष्ठक के बाहर (सहसंयोजन क्षेत्र) है, हाइड्रोजन बंध द्वारा संगुणित है। जल के शेष चार अणु उपसहसंयोजित हैं।
9.6.5 कठोर एवं मृदु जल
सामान्यत: वर्षा का जल लगभग शुद्ध होता है। (वायुमंडल की कुछ विलयशील गैसें घुली हो सकती हैं)। जब जल पृथ्वी की सतह पर बहता है, तब इसका अस्तित्व उत्तम विलायक के रूप में होता है। यह कई लवणों को घोल लेता है। जल में उपस्थित विलयशील कैल्सियम तथा मैग्नीशियम लवण, (जो हाइड्रोजन कार्बोनेट, क्लोराइड तथा सल्फेट के रूप में रहते हैं) उसकी कठोरता के कारण होते हैं। कठोर जल साबुन के साथ आसानी से झाग नहीं देता है। विलयशील कैल्सियम तथा मैग्नीशियम लवण से मुक्त जल को ‘मृदु जल’ (Soft water) कहते हैं। मृदु जल साबुन के साथ आसानी से झाग देता है।
कठोर जल साबुन के साथ मलफेन/अवक्षेप देता है। साबुन, जिसमें सोडियम स्टीअरेट (C17H35COONa) होता है, कठोर जल के साथ अभिक्रिया करके Ca/Mg स्टीअरेट के रूप में अवक्षेपित हो जाता है–
अत: कठोर जल धुलाई के लिए उपयुक्त नहीं है। यह भाप क्वथित्र (Steam boiler) के लिए भी हानिकारक है, क्योंकि पपड़ी के रूप में इसमें लवण जम जाते हैं, जिससे भाप क्वथित्र की दक्षता में कमी आ जाती है। जल की कठोरता दो प्रकार की होती है–
(i) अस्थायी कठोरता
(ii) स्थायी कठोरता
9.6.6 अस्थायी कठोरता
अस्थायी कठोरता जल में कैल्सियम तथा मैग्नीशियम के हाइड्रोजन कार्बोनेट की उपस्थिति के कारण होती है। जल की अस्थायी कठोरता निम्नलिखित विधियों द्वारा दूर की जाती है–
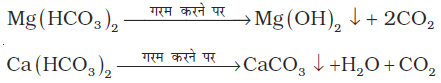
(i) उबालना : उबालने की प्रक्रिया में Mg(HCO3)2 एवं Ca (HCO3)2 के विलयशील लवण क्रमश: अविलयशील Mg(OH)2 तथा CaCO3 में परिवर्तित हो जाते हैं। MgCO3 की तुलना में Mg(OH2) का विलेयता-गुणनफल उच्च होता है, अत: Mg(HO)2 अवक्षेपित हो जाता है। इस अवक्षेप को छानकर अलग कर लिया जाता है। प्राप्त छनित ही मृदु जल है।
(ii) क्लार्क विधि (Clark's method) : इस विधि में बुझे चूने की परिकलित मात्रा को कठोर जल में मिला दिया जाता है। फलत: कैल्सियम कार्बोनेट तथा मैग्नेशियम हाइड्रॉक्साइड अवक्षेपित हो जाता है। उसे छानकर अलग कर लिया जाता है।
9.6.7 स्थायी कठोरता
इस प्रकार की कठोरता जल में विलयशील कैल्सियम तथा मैग्नीशियम के क्लोराइड तथा सल्फेट के रूप में घुले रहने के कारण होती है। यह (स्थायी कठोरता) उबालने से दूर नहीं की जा सकती है।
इसे निम्नलिखित विधियों द्वारा दूर किया जा सकता है-
(i) धावन सोडा (सोडियम कार्बोनेट) के उपचार से : धावन सोडा कठोर जल में विलयशील कैल्सियम एवं मैग्नीशियम क्लोराइड तथा सल्फेट के साथ क्रिया करके अविलयशील कार्बोनेट बनाता है।
(ii) केलगॉन विधि–सोडियम हेक्सामेटाफॉस्फेट [Sodium hexametaphosphate, Na6P6O18] को व्यापारिक रूप में ‘केलगॉन’ कहते हैं। जब यह कठोर जल में मिलाया जाता है, तब निम्नलिखित अभिक्रिया देता है–
यह ऋणायन संकुल Mg2+ एवं Ca2+ आयन को विलयन में रखता है।
(iii) आयन विनिमय विधि (Ion exchange method) : इस विधि को ‘जीओलाइट/परम्यूटिट विधि’ भी कहते हैं। जलयुक्त सोडियम एेलुमीनोसिलिकेट (NaAISiO4.3H2O)जीओलाइट/परम्यूटिट (Permuitit) कहलाता है। सरलता के लिए सोडियम एेलुमीनियम सिलिकेट को NaZ भी लिख सकते हैं। कठोर जल में इसके मिलाने पर निम्नलिखित विनिमय अभिक्रिया होती है–
परम्यूटिट/ जीओलाइट में से जब सारा सोडियम पूर्ण रूप से समाप्त हो जाता है, तब जलीय सोडियम क्लारोइड विलयन द्वारा उपचार कराकर इनका पुन: प्रयोग करने के लिए पुनर्जनन (Regenerated) कर लिया जाता है–
(iv) संश्लेषित रेजिन (Resin) विधि : आजकल कठोर जल का मृदुकरण मुख्य रूप से संश्लेषित धनायन विनिमयक द्वारा किया जाता है। यह विधि जीओलाइट की तुलना में अधिक दक्ष है। धनायन विनिमयक रेजिन –SO3H समूहयुक्त बृहद् कार्बनिक अणु होते हैं तथा जल में अविलेय होते हैं। आयन विनियम रेजिन (R–SO3H) को NaCl से उपचार करके
R–Na में परिवर्तित किया जाता है। रेजन Na+ आयन का जल में उपस्थित Ca2+ एवं Mg2+ आयन से विनिमय करके कठोर जल को मृदु बना देता है, जहाँ (R = रेजिन ऋणायन है)–
रेजिन का पुनर्जनन (Regeneration) सोडियम क्लोराइड विलयन मिलाकर किया जाता है।
जल को उत्तरोत्तर (Successively) धनायन-विनिमयक (H+ आयन के रूप में) तथा ऋणायन-विनिमयक (OH– के रूप में) रेजिन से प्रवाहित करने पर शुद्ध विखनिजित (Demineralised) तथा विआयनित (Deionised) जल प्राप्त किया जाता है–
धनायन विनिमय के इस प्रक्रम में, H+ का विनिमय जल में उपस्थित Na+, Ca2+, Mg2+ एवं अन्य धनायनों द्वारा हो जाता है। फलत: प्रोटान का निष्कासन होता है तथा जल अम्लीय हो जाता है।
ऋण आयन विनिमय के दूसरे प्रक्रम में
OH– का विनिमय जल में उपस्थित ऋणायन (जैसे– Cl–, HCO3–, SO42–) द्वारा होता है। इस प्रकार मुक्त OH– आयन धनायन विनिमय से मुक्त H+ आयन से अभिक्रिया करके जल को उदासीन कर देता है।
धनायन तथा ऋणायन विनिमयकों के रेजिन तल (Resin bed) का उपयोग जब पूर्ण रूप से हो जाता है, तब इन्हें क्रमश: तनु अम्ल तथा तनु क्षारक विलयनों से अभिक्रिया कराकर पुनर्जनित कर लिया जाता है।
9.7 हाइड्रोजन परॉक्साइड (H2O2)
हाइड्रोजन परॉक्साइड एक महत्त्वपूर्ण रसायन है, जो पर्यावरण- नियंत्रण में घरेलू तथा औद्योगिक बहि:स्राव (Effluents) के उपचार के रूप में काम आता है।
9.7.1 बनाने की विधियाँ
यह निम्नलिखित विधियों द्वारा बनाया जा सकता है–
(i) बेरियम परॉक्साइड को अम्लीकृत करके तथा जल की आधिक्य मात्रा को कम दाब पर वाष्पीकृत करके हाइड्रोजन परॉक्साइड प्राप्त किया जाता है–
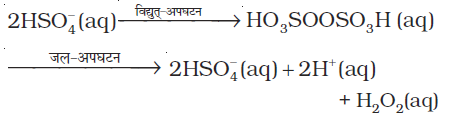
(ii) उच्च धारा घनत्व पर अम्लीकृत सल्फेट विलयन के विद्युत्-अपघटनी अॉक्सीकरण से प्राप्त परॉक्साइड सल्फेट के जल-अपघटन से हाइड्रोजन परॉक्साइड प्राप्त किया जाता है।
अब यह विधि प्रयोगशाला में (D2O2) बनाने के काम में आती है।
(iii) हाइड्रोजन परॉक्साइड का औद्योगिक उत्पादन 2-एल्किलएेन्थ्राक्विनॉल (2-alkylanthraquinol) के स्वत: अॉक्सीकरण द्वारा किया जाता है।
इस विधि से प्राप्त (~1प्रतिशत) हाइड्रोजन परॉक्साइड का निष्कर्षण जल द्वारा कर लिया जाता है। तत्पश्चात् कम दाब पर इसका आसवन कराकर हाइड्रोजन परॉक्साइड का सांद्रण (द्रव्यमानानुसार 30 प्रतिशत) तक कर लिया जाता है। हाइड्रोजन परॉक्साइड के 85 प्रतिशत तक सांद्रण हेतु कम दाब पर विलयन का आसवन सावधानीपूर्वक कराकर किया जाता है। अवशेष को हिमशीतित (Frozen) करके शुद्ध हाइड्रोजन परॉक्साइड प्राप्त की जाती है।
9.7.2 भौतिक गुण
शुद्ध अवस्था में हाइड्रोजन परॉक्साइड लगभग रंगहीन (अति हलका नीला) द्रव है। इसके मुख्य भौतिक गुण सारणी 9.4 में दिए गए हैं।
हाइड्रोजन परॉक्साइड जल के प्रत्येक अनुपात के साथ मिश्रणीय है। यह हाइड्रेट H2O2.H2O (क्वथनांक 221K) बना लेता है। बाजार में उपलब्ध 30 प्रतिशत सांद्रता वाले हाइड्रोजन परॉक्साइड विलयन की आयतन सांद्रता (Volume strength) ‘100 आयतन’ होती है। ‘100 आयतन’ H2O2 सांद्रता से अभिप्राय यह है कि 1mL H2O2 विलयन के पूर्ण अपघटन के फलस्वरूप मानक ताप तथा दाब पर 100 mL अॉक्सीजन मुक्त होती है। बाजार में यह ‘10 आयतन’ के रूप में बेचा जाता है, अर्थात् इसकी सांद्रता 3 प्रतिशत होती है।
उदाहरण 9.5
10 आयतन H2O2 विलयन की सामर्थ्य परिकलित करें।
हल
H2O2 के ‘10 आयतन विलयन’ का अर्थ है कि H2O2 के इस विलयन का 1 लिटर मानक ताप एवं दाब पर 10 लिटर अॉक्सीजन देगा–
उपरोक्त समीकरण के आधार पर 68 ग्राम H2O2 से मानक ताप एवं दाब पर 22.7 L O2 प्राप्त होगी। मानक ताप एवं दाब पर 10L लिटर O2 उत्पन्न करने के लिए H2O2 आवश्यक मात्रा होगी–
अत: 10 आयतन H2O2 की सामर्थ्य = 30.0 g/L है।
यानी 3% H2O2 विलयन है।
9.7.3 संरचना
हाइड्रोजन परॉक्साइड की संरचना असमतलीय होती है। गैसीय प्रावस्था तथा ठोस प्रावस्था में इसकी आण्विक संरचना को चित्र 9.3 में दर्शाया गया है।
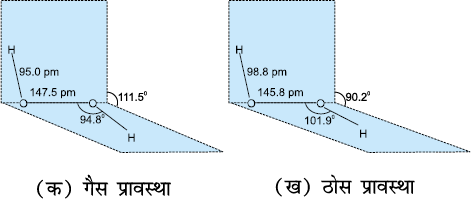
चित्र 9.3 (क) गैसीय प्रावस्था में H2O2 की संरचना द्वितल कोण 111.5° है।
(ख) ठोस प्रावस्था में 110 K ताप पर H2O2 की संरचना द्वितल कोण 90.2° है।
9.7.4 रासायनिक गुण
अम्लीय तथा क्षारीय–दोनों माध्यम में हाइड्रोजन परॉक्साइड अपचायक तथा अॉक्सीकारक, दोनों कार्य करता है। कुछ सरल अभिक्रियाओं का वर्णन नीचे किया जा रहा है–
(i) अम्लीय माध्यम में H2O2 अॉक्सीकारक के रूप में–
(ii) अम्लीय माध्यम में H2O2 अपचायक के रूप में–
(iii) क्षारीय माध्यम में H2O2 अॉक्सीकारक के रूप में–
(iv) क्षारीय माध्यम में H2O2 अपचायक के रूप में–
9.7.5 भंडारण
प्रकाश के मंद प्रभाव से H2O2 अपघटित हो जाता है।
धातुओं की सतह तथा क्षार की सूक्ष्म मात्रा (जो काँच में निहित रहती है) की उपस्थिति के कारण उपरोक्त अभिक्रिया उत्प्रेरित होती है। अत: इसे मोम के स्तर से युक्त काँच या प्लास्टिक पात्रों में अँधेरे में रखा जाता है। यूरिया एक स्थायीकारी के रूप में मिलाया जाता है। इसे धूल के कण से दूर रखा जाता है, क्योंकि धूल हाइड्रोजन परॉॅक्साइड के विस्फोटी अपघटन को प्रेरित कर देती है।
9.7.6 उपयोग
H2O2 के बृहद् रूप में उपयोग के कारण इसके औद्योगिक उत्पादन में वृद्धि होती जा रही है। इसके कुछ उपयोग नीचे दिए जा रहे हैं–
(i) दैनिक जीवन में इसका उपयोग मंद कीटनाशी तथा बालों के विरंजन के रूप में किया जाता है। पूतिरोधी (Antiseptic) के रूप में यह बाजार में ‘परहाइडॅΡाल’ (Perhydrol) नाम से बेचा जाता है।
(ii) इसका उपयोग सोडियम परबोरेट तथा सोडियम परकार्बोनेट के निर्माण में किया जाता है, जो उच्च कोटि के अपमार्जकों के लिए उपयोगी है।
(iii) इसका उपयोग हाइड्रोक्यूनोन, टार्टरिक अम्ल, खाद्य-उत्पादों तथा औषधियों (सिफैलोस्पोरिन) के संश्लेषण में किया जाता है।
(iv) उद्योगों में H2O2 का उपयोग वस्त्रों, कागज की लुगदी, चमड़ा, तेल, वसा आदि के विरंजन कारक (Bleaching Agent) के रूप में किया जाता है।
(v) आजकल H2O2 का उपयोग पर्यावरणीय (हरित) रसायन (उदाहरणस्वरूप–पर्यावरण-नियंत्रण में, घरेलू तथा औद्योगिक बहिस्राव (Effluents) उपचार में, सायनाइड के अॉक्सीकरण में, वाहित मल के लिए वायुजीवी दशाओं पुनर्स्थापन आदि) में किया जाता है।
9.8 भारी जल, D2O
भारी जल विस्तृत रूप से नाभिकीय रिएक्टरों में न्यूटॉन मंदक के रूप में तथा विनिमय अभिक्रियाओं की क्रियाविधियों के अध्ययन में काम आता है। इसका उत्पादन जल के वैद्युत अपघटन द्वारा तथा उर्वरक उद्योगों में उपोत्पाद (By products) के रूप में होता है। भारी जल के भौतिक गुण सारणी 9.3 में दिए गए हैं। भारी जल का उपयोग ड्यूटीरियम के अनेक यौगिक बनाने के लिए किया जाता है। उदाहरणार्थ–
9.9 डाइहाइड्रोजन ईंधन के रूप में
दहन में डाइहाइड्रोजन अधिक मात्रा में ऊष्मा मुक्त करती है। ईंधन (जैसे–हाइहाइड्रोजन, मेथैन, एल.पी.जी. आदि) की समान आण्विक मात्रा, द्रव्यमान तथा आयतन के दहन से मुक्त ऊर्जा के आँकड़े सारणी 9.5 में दर्शाए गए हैं।
सारणी 9.5 विभिन्न ईंधनों द्वारा दहन से मुक्त ऊर्जा मोल, द्रव्यमान तथा आयतन में
| दहन से मुक्त हुई ऊर्जा kJ में | डाइहाइड्रोजन (गैसीय प्रावस्था) | डाइहाइड्रोजन (द्रव-प्रावस्था) | एल.पी.जी. | मेथैन गैस | अॉक्टेन (द्रव-अवस्था) |
|---|---|---|---|---|---|
| प्रति मोल | 286 | 285 | 2220 | 880 | 5511 |
| प्रति ग्राम | 143 | 142 | 50 | 53 | 47 |
| प्रति लिटर | 12 | 9968 | 25590 | 35 | 34005 |
इस सारणी से स्पष्ट है कि डाइहाइड्रोजन, पेट्रोल के (समान द्रव्यमान की) तुलना में तीनगुना अधिक ऊर्जा मुक्त कर सकती है, हालाँकि डाइहाइड्रोजन के दहन में प्रदूषक पेट्रोल से कम होते हैं। केवल डाइनाइट्रोजन के अॉक्साइड ही प्रदूषक हाेंगेे। (डाइहाइड्रोजन के साथ डाइनाइट्रोजन की अशुद्धि के रूप में उपस्थिति के कारण) गैस सिलेंडर में थोड़ी मात्रा में जल अंत:क्षिप्त (Inject) करने पर डाइनाइट्रोजन तथा डाइअॉक्सीजन की अभिक्रिया नहीं हो पाती, हालाँकि पात्र (जिसमें डाइहाइड्रोजन रखी जाती है) के द्रव्यमान का भी ध्यान रखना चाहिए। संपीडित डाइहाइड्रोजन के एक सिलिंडर का भार समान ऊर्जा वाले पेट्रोल टैंक से लगभग 30 गुना अधिक होता। डाइहाइड्रोजन को 20 K पर ठंडा कर द्रवित भी किया जा सकता है। इसके लिए महँगे रोधी टैंकों की आवश्यकता पड़ती है। भिन्न-भिन्न धातुओं, जैसे– NaNi5, Ti–TiH2, Mg–MgH2 आदि के टैंकों का प्रयोग डाइहाइड्रोजन की कम मात्रा का भंडारण करने हेतु किया जाता है। इन सीमाओं ने शोधकर्त्ताओं को डाइहाइड्रोजन के सफल प्रयोग की वैकल्पिक तकनीकों की खोज करने के लिए प्रोत्साहित किया है।
इस संदर्भ में भावी विकल्प ‘हाइड्रोजन अर्थव्यवस्था’ है। हाइड्रोजन अर्थव्यवस्था का मूल सिद्धांत ऊर्जा का द्रव हाइड्रोजन अथवा गैसीय हाइड्रोजन के रूप में अभिगमन तथा भंडारण है। हाइड्रोजन अर्थव्यवस्था का मुख्य ध्येय तथा लाभ-ऊर्जा का संचरण विद्युत्-ऊर्जा के रूप में न होकर हाइड्रोजन के रूप में होना है। हमारे देश में पहली बार अक्तूबर, 2005 में आरंभ परियोजना में डाइहाइड्रोजन स्वचालित वाहनों के ईंधन के रूप में प्रयुक्त किया गया। प्रारंभ में चौपहिया वाहन के लिए 5 प्रतिशत डाइहाइड्रोजन मिश्रित CNG को प्रयोग किया गया। बाद में डाइहाइड्रोजन की प्रतिशतता धीरे-धीरे अनुकूलतम स्तर तक बढ़ाई जाएगी।
आजकल डाहहाइड्रोजन का उपयोग ईंधन सेलों में विद्युत्- उत्पादन के लिए किया जाता है। एेसी आशा की जाती है कि आर्थिक रूप से व्यवहार्य तथा डाइहाइड्रोजन के सुरक्षित स्रोत का पता आने वाले वर्षों में लग सकेगा तथा उसका उपयोग ऊर्जा के रूप में हो सकेगा।
सारांश
हाइड्रोजन केवल एक इलेक्ट्रॅान से युक्त सबसे हलका परमाणु है। यह इलेक्ट्रॉन को परित्याग कर मूल कण प्रोट्रॉन बनाता है। यह इसका विशिष्ट व्यवहार है। इसके तीन समस्थानिक प्रोटियम (11H), ड्यूटीरियम (D या 12H), ट्राइटियम ( T या 13H) हैं। इन तीनों में केवल ट्राइटियम रेडियोसक्रिय हैं। क्षार धातुओं तथा हैलोजेन में समानताओं के बावजूद इसके विशिष्ट गुणों के कारण आवर्त्त सारणी में पृथक् स्थान दिया गया है।
ब्रह्मांड में हाइड्रोजन अतिबहुल तत्व है। मुक्त अवस्था में यह पृथ्वी के वायुमंडल में नहीं पाया जाता, हालाँकि संयुक्त अवस्था में पृथ्वी की सतह पर अतिबहुल्य तत्वों के क्रम में हाइड्रोजन का स्थान तीसरा है।
शैल रसायनों से भाप अंगार सृति अभिक्रिया (Water gas shift reaction) द्वारा डाइहाइड्रोजन का औद्योगिक उत्पादन किया जाता है। यह लवणी जल के विद्युत्-अपघटन में सह-उत्पादन के रूप में प्राप्त होता है। डाइहाइड्रोजन H–H एकलबंध वियोजन एन्थैल्पी (435.88kJ mol–1) तत्वों के दो परमाणुओं के मध्य एकल बंध के लिए अधिकतम है। इस गुण के आधार पर डाइहाइड्रोजन का उपयोग परमाण्विय टॉर्च (Atomic torch) में किया जाता है। फलस्वरूप तापमान ~4000K तक पहुँच जाता है, जो उच्च गलनांक वाले धातुओं की वेल्डिंग के लिए उपयुक्त होती है।
कक्ष ताप पर डाइहाइड्रोजन उच्च वियोजन एन्थैल्पी के कारण अक्रिय होती है। यह लगभग सभी तत्वों के साथ उपयुक्त परिस्थितियों में संयुक्त होकर हाइड्राइड बनाता है। सभी हाइड्राइडों को तीन श्रेणियों–आयनिक या लवणीय (Saline) हाइड्राइड, सहसंयोजक या आण्विक हाइड्राइड तथा धात्विक या अरससमीकरणमितीय हाइड्राइड में वर्गीकृत किया गया है। अन्य हाइड्राइड बनाने के लिए क्षार-धातु हाइड्राइड उपयुक्त अभिकर्मक हैं। आण्विक हाइड्राइड (उदाहरणस्वरूप B2H6, CH4, NH3, H2O) का दैनिक जीवन में अत्यधिक महत्त्व है। धात्विक हाइड्राइडों का उपयोग डाइहाइड्रोजन के अतिशुद्धिकरण (Ultrapurification) तथा डाइहाइड्रोजन-संग्रह हेतु माध्यम (Medium) के रूप में होता है।
डाइहाइड्रोजन से हाइड्रोजन हैलाइड, जल, अमोनिया मेथेनॉल, वनस्पति घी आदि महत्त्वपूर्ण यौगिकों का विरचन अपचयन अभिक्रियाओं द्वारा होता है। धातुकर्मीय अभिक्रियाओं में यह धात्विक अॉक्साइड को धातु में अपचयित करता है। अंतरिक्ष-अनुसंधान में डाइहाइड्रोजन का उपयोग रॉकेट ईंधन के रूप में होता है। वस्तुत: भविष्य में डाइहाइड्रोजन का उपयोग प्रदूषणमुक्त ईंधन के रूप में महत्त्वपूर्ण होगा (हाइड्रोजन अर्थव्यवस्था)।
जल अति सामान्य, बहुतायत तथा आसानी से उपलब्ध पदार्थ है। रासायनिक एवं जैविक दृष्टिकोण से यह अतिमहत्त्वपूर्ण है। द्रव-अवस्था से ठोस अवस्था तथा द्रव अवस्था का गैसीय अवस्था में इसका रूपांतरण सरल है, जो जीवमंडल में महत्त्वपूर्ण भूमिका निभाता है। जल के अणु की बंकित संरचना के कारण अत्यधिक ध्रुवीय प्रकृति होती है, जिससे जल बर्फ में सबसे ज्यादा एवं जलवाष्प में सबसे कम हाइड्रोजन बंधन के लिए उत्तरदायी है। जल (क) ध्रुवीय प्रकृति के आधार पर यह आयनिक तथा आंशिक आयनिक यौगिकों में उत्तम विलायक के रूप में व्यवहार करता है (ख) एक उभयधर्मी (अम्ल अथवा क्षार) पदार्थ के रूप में व्यवहार करता है तथा (ग) यह कई प्रकार के हाइड्रेट बनाता है। जल में अनेक लवणों की अधिक मात्रा घुलने से जल कठोर हो जाता है, जो व्यापारिक महत्त्व के लिए हानिकारक है। जल की अस्थायी तथा स्थायी कठोरता जीओलाइट और संश्लेषित आयन विनिमयकों का उपयोग करके दूर की जाती है।
भारी जल D2O एक अन्य महत्त्वपूर्ण यौगिक है, जिसका निर्माण साधारण जल के विद्युत्-अपघटन द्वारा किया जाता है। इसका उपयोग नाभिकीय रिएक्टरों में मंदक के रूप में किया जाता है।
हाइड्रोजन परॉक्साइड H2O2 की असमतलीय संरचना होती है। इसका उपयोग औद्योगिक विरंजन, औषधि, प्रदूषण-नियंत्रण, औद्योगिक तथा घरेलू बहिस्राव उपचार में बृहद् रूप से किया जाता है।
अभ्यास
9.1 हाइड्रोजन के इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में इसकी स्थिति को युक्तिसंगत ठहराइए।
9.2 हाइड्रोजन के समस्थानिकों के नाम लिखिए तथा बताइए कि इन समस्थानिकों का द्रव्यमान अनुपात क्या है।
9.3 सामान्य परिस्थितियों में हाइड्रोजन एक परमाण्विक की अपेक्षा द्विपरमाण्विक रूप में क्यों पाया जाता है?
9.4 ‘कोल गैसीकरण’ से प्राप्त डाइहाइड्रोजन का उत्पादन कैसे बढ़ाया जा सकता है?
9.5 विद्युत्-अपघटन विधि द्वारा डाइहाइड्रोजन बृहद् स्तर पर किस प्रकार बनाई जा सकती है? इस प्रक्रम में वैद्युत-अपघट्य की क्या भूमिका है?
9.6 निम्नलिखित समीकरणों को पूरा कीजिए–
9.7 डाइहाड्रोजन की अभिक्रियाशीलता के पदों में H–H बंध की उच्च एन्थैल्पी के परिणामों की विवेचना कीजिए।
9.8 हाइड्रोजन के (i) इलेक्ट्रॉन न्यून, (ii) इलेक्ट्रॉन परिशुद्ध तथा (iii) इलेक्ट्रॉन समृद्ध यौगिकों से आप क्या समझते हैं? उदाहरणों द्वारा समझाइए।
9.9 संरचना एवं रासायनिक अभिक्रियाओं के आधार पर बताइए कि इलेक्ट्रॉन न्यून हाइड्राइड के कौन-कौन से अभिलक्षण होते हैं।
9.10 क्या आप आशा करते हैं कि (CnH2n + 2) कार्बनिक हाइड्राइड लूइस अम्ल या क्षार की भाँति कार्य करेंगे? अपने उत्तर को युक्तिसंगत ठहराइए।
9.11 अरससमीकरणमितीय हाइड्राइड (Non stochiometric hydride) से आप क्या समझते हैं? क्या आप क्षारीय धातुओं से एेसे यौगिकों की आशा करते हैं? अपने उत्तर को न्यायसंगत ठहराइए।
9.12 हाइड्रोजन भंडारण के लिए धात्विक हाइड्राइड किस प्रकार उपयोगी है? समझाइए।
9.13 कर्तन और वेल्डिंग में परमाण्विय हाइड्रोजन अथवा अॉक्सी हाइड्रोजन टॉर्च किस प्रकार कार्य करती है? समझाइए।
9.14 NH3, H2O तथा HF में से किसका हाइड्रोजन बंध का परिमाण उच्चतम अपेक्षित है और क्यों?
9.15 लवणीय हाइड्राइड जल के साथ प्रबल अभिक्रिया करके आग उत्पन्न करती है। क्या इसमें CO2 (जो एक सुपरिचित अग्निशामक है) का उपयोग हम कर सकते हैं? समझाइए।
9.16 निम्नलिखित को व्यवस्थित कीजिए–
(i) CaH2, BeH2 तथा TiH2 को उनकी बढ़ती हुई विद्युत्चालकता के क्रम में।
(ii) LiH, NaH तथा CsH आयनिक गुण के बढ़ते हुए क्रम में।
(iii) H–H, D–D तथा F–F को उनके बंध-वियोजन एन्थैल्पी के बढ़ते हुए क्रम में।
(iv) NaH, MgH2 तथा H2O को बढ़ते हुए अपचायक गुण के क्रम में।
9.17 H2O तथा H2O2 की संरचनाओं की तुलना कीजिए।
9.18 जल के स्वत: प्रोटोनीकरण से आप क्या समझते हैं? इसका क्या महत्त्व है?
9.19 F2 के साथ जल की अभिक्रिया में अॉक्सीकरण तथा अपचयन के पदों पर विचार कीजिए एवं बताइए कि कौन सी स्पीशीज़ अॉक्सीकृत/अपचयित होती है।
9.20 निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए–
(i) 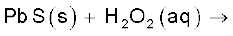
(ii) 
(iii) 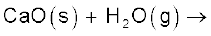
(iv) 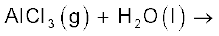
(v) 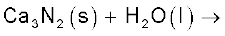
उपरोक्त को (क) जल-अपघटन, (ख) अपचयोपचय (Redox) तथा (ग) जलयोजन अभिक्रियाओं में वर्गीकृत कीजिए।
9.21 बर्फ के साधारण रूप की संरचना का उल्लेख कीजिए।
9.22 जल की अस्थायी एवं स्थायी कठोरता के क्या कारण हैं? वर्णन कीजिए।
9.23 संश्लेषित आयन विनिमयक विधि द्वारा कठोर जल के मृदुकरण के सिद्धांत एवं विधि की विवेचना कीजिए।
9.24 जल के उभयधर्मी स्वभाव को दर्शाने वाले रासायनिक समीकरण लिखिए।
9.25 हाइड्रोजन परॉक्साइड के अॉक्सीकारक एवं अपचायक रूप को अभिक्रियाओं द्वारा समझाइए।
9.26 विखनिजित जल से क्या अभिक्रिया है? यह कैसे प्राप्त किया जा सकता है?
9.27 क्या विखनिजित या आसुत जल पेय-प्रयोजनों में उपयोगी है? यदि नहीं, तो इसे उपयोगी कैसे बनाया जा सकता है?
9.28 जीवमंडल एवं जैव प्रणालियों में जल की उपादेयता को समझाइए।
9.29 जल का कौन सा गुण इसे विलायक के रूप में उपयोगी बनाता है? यह किस प्रकार के यौगिक-
(i) घोल सकता है और (ii) जल-अपघटन कर सकता है?
9.30 H2O एवं D2O के गुणों को जानते हुए क्या आप मानते हैं कि D2O का उपयोग पेय-प्रयोजनों के रूप में लाया जा सकता है?
9.31 ‘जल-अपघटन’ (Hydrolysis) तथा ‘जलयोजन’ (Hydration) पदों में क्या अंतर है?
9.32 लवणीय हाइड्राइड किस प्रकार कार्बनिक यौगिकों से अति सूक्ष्म जल की मात्रा को हटा सकते हैं?
9.33 परमाणु क्रमांक 15, 19, 23 तथा 44 वाले तत्व यदि डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाते हैं, तो उनकी प्रकृति से आप क्या आशा करेंगे? जल के प्रति इनके व्यवहार की तुलना कीजिए।
9.34 जब एेलुमिनियम (III) क्लोराइड एवं पोटैशियम क्लोराइड को अलग-अलग (i) सामान्य जल, (ii) अम्लीय जल एवं (iii) क्षारीय जल से अभिकृत कराया जाएगा, तो आप किन-किन विभिन्न उत्पादों की आशा करेंगे? जहाँ आवश्यक हो, वहाँ रासायनिक समीकरण दीजिए।
9.35 H2O2 विरंजन कारक के रूप में कैसे व्यवहार करता है? लिखिए।
9.36 निम्नलिखित पदों से आप क्या समझते हैं?
(i) हाइड्रोजन अर्थव्यवस्था, (ii) हाइड्रोजनीकरण, (iii) सिन्गैस, (iv) भाप अंगार गैस सृति अभिक्रिया तथा (v) ईंधन सेल।