Table of Contents
उद्देश्य
- इस एकक के अध्ययन के बाद आप–
- क्षार-धातुओं एवं उनके यौगिकों के सामान्य अभिलक्षणों की व्याख्या कर सकेंगे;
- क्षारीय मृदा-धातुओं एवं उनके यौगिकों के सामान्य अभिलक्षणों को समझ सकेंगे;
- पोर्टलैंड सीमेन्ट सहित सोडियम एवं कैल्सियम के महत्त्वपूर्ण यौगिकों के निर्माण, गुणों एवं उपयोगों का वर्णन कर सकेंगे;
- सोडियम, पोटैशियम, मैग्नीशियम व कैल्सियम की जैव महत्ता के बारे में जान सकेंगे।
क्षार एवं क्षारीय मृदा धातु-समूहों के प्रथम तत्त्व इन समूहों के अन्य तत्त्वों से कई गुणों में भिन्न होते हैं।
आवर्त सारणी में s-ब्लॉक के तत्त्व वे तत्त्व हैं। जिनमें अंतिम इलेक्ट्रॉन बाह्यतम s-कक्षक में जाता है। चूँकि s-कक्षक में अधिकतम दो ही इलेक्ट्रॉन हो सकते हैं, अतः केवल दो ही वर्ग (1 तथा 2) s-ब्लॉक तत्त्वों के अंतर्गत आते हैं। प्रथम वर्ग के तत्त्व हैं– लीथियम (Li), सोडियम (Na), पोटैशियम (K), रूबीडियम (Rb), सीजियम (Cs) एवं फ्रेन्सियम (Fr)। सामान्य रूप से ये तत्त्व क्षार धातुओं के रूप में जाने जाते हैं। चूँकि ये जल के साथ अभिक्रिया करके क्षारीय प्रकृति के हाइड्रॉक्साइड बनाते हैं, इसलिए इन्हें ‘क्षार धातुएं’ कहते हैं। द्वितीय वर्ग के तत्त्व हैं– बेरीलियम (Be), मैग्नीशियम (Mg), कैल्सियम (Ca), स्ट्रॉन्शियम (Sr), बेरियम (Ba) एवं रेडियम (Ra)। बेरीलियम के अतिरिक्त शेष तत्त्व क्षारीय मृदा धातुओं के नाम से जाने जाते हैं। चूँकि इनके अॉक्साइड एवं हाइड्रॉक्साइड की प्रकृति क्षारीय होती है एवं ये अॉक्साइड सामान्यतः भू-पर्पटी* (Earth-Crust) में मिलते हैं, इसलिए इन्हें ‘क्षारीय मृदा धातु’ कहते हैं।
क्षार धातुओं में सोडियम एवं पोटैशियम प्रचुर मात्रा में मिलते हैं, जबकि लीथियम, रूबीडियम एवं सीजियम अल्प मात्रा में पाए जाते हैं। फ्रेन्सियम एक अति रेडियो सक्रिय तत्त्व है (सारणी 10.1)। फ्रेन्सियम के अधिकतम दीर्घ आयु वाले समस्थानिक 223Fr की अर्ध आयु मात्र 21 मिनट है। क्षारीय मृदा धातुओं की भू-पर्पटी में उपस्थिति के आधार पर कैल्सियम तथा मैग्नीशियम का स्थान क्रमशः पाँचवाँ तथा छठवाँ है। स्ट्रॉन्शियम एवं बेरियम की उपलब्धता बहुत कम है। बेरीलियम एक दुर्लभ धातु है, जबकि रेडियम की मात्रा आग्नेय शैल+ में केवल 10–10 प्रतिशत है (सारणी 10.2)।
क्षार धातुओं का सामान्य इलेक्ट्रॉनिक विन्यास [उत्कृष्ट गैस]ns1 तथा क्षारीय मृदा-धातुओं का विन्यास [उत्कृष्ट गैस]ns2 है। लीथियम एवं बेरीलियम, जो क्रमशः वर्ग 1 व वर्ग 2 के प्रथम तत्त्व हैं, के कुछ गुण इन वर्गों के अन्य तत्त्वों से भिन्न होते हैं। इस असंगत व्यवहार के कारण दोनों तत्त्व अपने ठीक आगे वाले वर्ग के दूसरे तत्त्वों से गुणों में समानताएँ प्रदर्शित करते हैं। लीथियम के बहुत से गुण मैग्नीशियम तथा बेरीलियम के बहुत से गुण एेलुमीनियम के गुणों के समान हैं। इस प्रकार की विकर्ण समानताएँ आवर्त सारणी में विकर्ण संबंध (Diagonal Relationship) के रूप में संदर्भित की जाती हैं। तत्त्वों के आयनिक आकार या उनके आवेश/त्रिज्या अनुपात का समान होना ही विकर्ण संबंध का मुख्य आधार है।

* पृथ्वी सतह पर पतली चट्टानी सतह भू-पर्पटी कहलाती है। + मेग्मा (पिघली हुई चट्टान) के शीतलन से बनी कठोर चट्टान।
एकल संयोजी सोडियम तथा पोटैशियम आयन एवं द्विसंयोजी मैग्नीशियम और कैल्सियम आयन जैव तरलों में बहुतायत में पाए जाते हैं। ये आयन जैवीय क्रियाओं, जैसे– आयन का संतुलन (Maintenance Of Ion Balance) और शिरा आवेग संचरण (Nerve-impulse Conduction) आदि में महत्त्वपूर्ण भूमिका निभाते हैं।
10.1 वर्ग 1 के तत्त्व ः क्षार-धातुएं
क्षार धातुओं के रासायनिक तथा भौतिक गुणों में परमाणु-क्रमांक के साथ एक नियमित प्रवृत्ति पाई जाती है। इन तत्त्वों के परमाण्वीय, भौतिक तथा रासायनिक गुणों का विवेचन यहाँ किया जा रहा है।
10.1.1 इलेक्ट्रॉनिक विन्यास
सभी क्षार धातुओं के तत्त्वों में एक संयोजी इलेक्ट्रॉन होता है तथा अंतिम दूसरे कोश की उत्कृष्ट गैस की संरचना होती है (सारणी 10.1)। इन तत्त्वों के बाह्यतम कोश में उपस्थित
s-इलेक्ट्रॉन को आसानी से त्यागने के कारण ये अत्यधिक धनविद्युतीय तत्त्व एक संयोजी आयन M+ देते हैं। अतः ये प्रकृति में मुक्त अवस्था में नहीं पाए जाते हैं।
| तत्त्व | प्रतीक | इलेक्ट्रॉनिक विन्यास |
| लीथियम | Li | 1s22s1 |
| सोडियम | Na | 1s22s22p63s1 |
| पोटैशियम | K | 1s22s22p63s23p64s1 |
| रूबीडियम | Rb | 1s22s22p63s23p63d104s24p65s1 |
| सीजियम | Cs | 1s22s22p63s23p63d104s2 |
| 4p64d105s25p66s1या [Xe]6s1 | ||
| फ्रेन्सियम | Fr | [Rn]7s1 |
10.1.2 परमाणु तथा आयनी त्रिज्या
क्षार धातुओं के परमाणुओं का आकार आवर्त सारणी के किसी विशेष आवर्त में सर्वाधिक होता है। परमाणु-क्रमांक में वृद्धि होने के साथ-साथ परमाणु का आकार बढ़ता जाता है। एक संयोजी आयन (M+) का आकार उसके जनक परमाणु के आकार की तुलना में कम होता है। क्षार धातुओं की परमाणु तथा आयनी त्रिज्या वर्ग में ऊपर से नीचे जाने पर बढ़ती जाती है, अर्थात् इनका आकार Li से Cs तक बढ़ता है।
10.1.3 आयनन एन्थैल्पी
क्षार धातुओं के आयनन एन्थैल्पी का मान बहुत कम होता है। यह वर्ग में लीथियम से सीजियम की ओर नीचे जाने पर कम होता जाता है। इसका कारण यह है कि बढ़ते हुए नाभिकीय आवेश की तुलना में बढ़ते हुए परमाणु-आकार का प्रभाव अधिक हो जाता है तथा बाह्यतम इलेक्ट्रॉन नाभिकीय आवेश द्वारा भली-भाँति परिरक्षित होते हैं।
10.1.4 जलयोजन एन्थैल्पी
क्षार धातुओं की जलयोजन एन्थैल्पी आयनिक आकार के बढ़ने पर घटती जाती है।
Li+>Na+>K+>Rb+>Cs+
Li की जलयोजन की मात्रा अधिकतम होती है, इसीलिए लीथियम के अधिकांश लवण (उदाहरणार्थ– LiCl.2H2O) जलयोजित होते हैं।
10.1.5 भौतिक गुण
क्षार धातुएं बहुत ही नरम, हलकी तथा चाँदी के समान श्वेत होती हैं। बड़ा आकार होने के कारण इनका घनत्व कम होता है, जो लीथियम से सीजियम की ओर नीचे जाने पर कम होता जाता है, यद्यपि पोटैशियम धातु सोडियम की तुलना में हलका होता है। क्षार धातुओं के गलनांक एवं क्वथनांक कम होते हैं, जो इन धातुओं के मात्र एक संयोजी इलेक्ट्रॉन की उपस्थिति के कारण इनके बीच दुर्बल धात्विक बंध को दर्शाते हैं। क्षार धातुएं तथा इनके लवण अॉक्सीकारक ज्वाला को अभिलाक्षणिक रंग प्रदान करते हैं। इसका कारण यह है कि ज्वाला की ऊष्मा इनके बाह्यतम इलेक्ट्रॉन को उच्च ऊर्जा-स्तर पर उत्तेजित कर देती है। जब ये इलेक्ट्रॉन पुनः अपनी तलस्थ अवस्था में आता है, तो स्पेक्ट्रम के दृश्य क्षेत्र में विकिरण उत्सर्जन के कारण ज्वाला को रंग प्रदान करता है। अॉक्सीकारक ज्वाला को मिले रंग इस सारणी में दर्शाए गए हैं–
| धातु | Li | Na | K | Rb | Cs |
| रंग | किरमिजी लाल | पीला | बैंगनी | लाल बैंगनी | नीला |
| λ/nm | 670.8 | 589.2 | 766.5 | 780.0 | 455.5 |
अतः क्षार धातुओं को इनके ज्वाला-परीक्षण के द्वारा पहचाना जा सकता है तथा इनकी सांद्रता का निर्धारण ज्वाला- प्रकाशमापी (फ्लेम फोटोमीट्री) अथवा परमाण्वीय अवशोषण स्पेक्ट्रोमिती (एटॉमिक एेब्जॉर्ब्शन स्पेक्ट्रोस्कोपी) द्वारा किया जा सकता है। इन तत्त्वों को जब प्रकाश द्वारा विकरित किया जाता है, तब प्रकाश-अवशोषण के कारण ये इलेक्ट्रॉन का परित्याग करते हैं। इसी गुण के कारण सीजियम तथा पोटैशियम का प्रयोग प्रकाश-विद्युत् सेल में इलेक्ट्रोड के रूप में किया जाता है।
10.1.6 रासायनिक गुण
बड़े आकार तथा कम आयनन एन्थैल्पी के कारण धातुएं अत्यधिक क्रियाशील होती हैैं। इनकी क्रियाशीलता वर्ग में ऊपर से नीचे क्रमशः बढ़ती जाती है।
(i) वायु के साथ अभिक्रियाशीलता : क्षार धातुएं वायु की उपस्थिति में मलिन हो जाती हैं, क्योंकि वायु की उपस्थिति में इनपर अॉक्साइड तथा हाइड्रॉक्साइड की परत बन जाती है। ये अॉक्सीजन में तीव्रता से जलकर अॉक्साइड बनाती हैं। लीथियम और सोडियम क्रमशः मोनोअॉक्साइड तथा परॉक्साइड का निर्माण करती हैं, जबकि अन्य
धातुओं द्वारा सुपर अॉक्साइड आयन का निर्माण होता है। सुपर अॉक्साइड आयन O2– बड़े धनायनों, जैसे– K+, Rb+ तथा Cs+ की उपस्थिति में स्थायी होता है।
 (अॉक्साइड)
(अॉक्साइड)
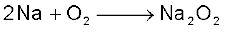 (परॉक्साइड)
(परॉक्साइड)
 (सुपर अॉक्साइड)
(सुपर अॉक्साइड)
(M = K, Rb, Cs)
इन सभी अॉक्साइडों में क्षार की अॉक्सीकरण अवस्था +1 होती है। लीथियम अपवादस्वरूप वायु में उपस्थित नाइट्रोजन से अभिक्रिया करके नाइट्राइड, Li3N बना लेता है। इस प्रकार लीथियम भिन्न स्वभाव दर्शाता है। क्षार धातुओं को वायु एवं जल के प्रति उनकी अति सक्रियता के कारण साधारणतया कैरोसिन में रखा जाता है।
उदाहरण 10.1
KO2 में K की अॉक्सीकरण अवस्था क्या है?
हल
सुपर अॉक्साइड को 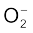 से दर्शाया जाता है। चूँकि यौगिक उदासीन है, अतः इसमें K की अॉक्सीकरण अवस्था +1 है।
से दर्शाया जाता है। चूँकि यौगिक उदासीन है, अतः इसमें K की अॉक्सीकरण अवस्था +1 है।
(ii) जल के साथ अभिक्रियाशीलता : क्षार धातुएं जल के साथ अभिक्रिया करके हाइड्रॉक्साइड एवं डाइहाइड्रोजन बनाती हैं।
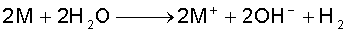
(M = क्षार धातु)
सारणी 10.1 क्षार धातुओं के परमाण्विक एवं भौतिक गुण
(Atomic and Physical Properties of the Alkali Metals)
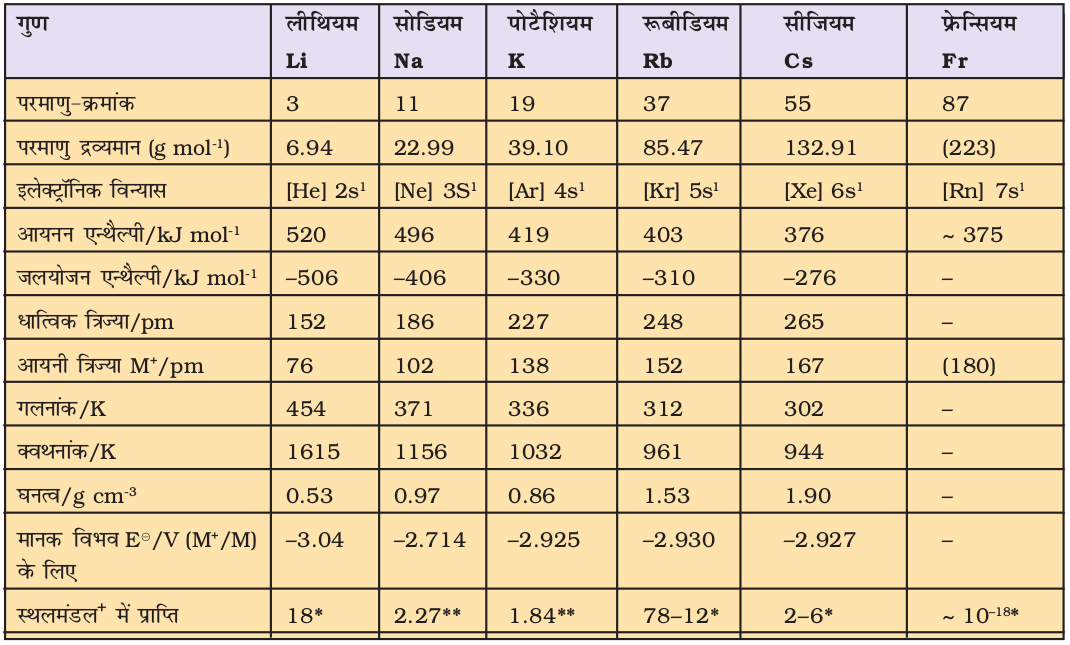
* ppm (Part per million), **भारात्मक %, +स्थलमंडलः पृथ्वी का बाह्यतल; इसकी पर्पटी तथा ऊपरी मेंटल का भाग।
यद्यपि लीथियम के E0 का मान अधिकतम ऋणात्मक होता है, परंतु जल के साथ इसकी अभिक्रियाशीलता सोडियम की तुलना में कम है, जबकि सोडियम के E0 का मान अन्य क्षार धातुओं की अपेक्षा न्यून ऋणात्मक होता है। लीथियम के इस व्यवहार का कारण इसके छोटे आकार तथा अत्यधिक जलयोजन ऊर्जा का होना है। अन्य क्षार धातुएं जल के साथ विस्फोटी अभिक्रिया करती हैं।
ये क्षार धातुएं प्रोटॉनदाता (जैसे–एेल्कोहॉल, गैसीय अमोनिया, एेल्काइन आदि) से भी अभिक्रियाएं करती हैं।
(iii) डाइहाइड्रोजन से अभिक्रियाशीलता : लगभग 673K (लीथियम के लिए 1073K) पर क्षार धातुएं डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाती हैं। सभी क्षार धातुओं के हाइड्राइड ठोस एवं आयनिक होते हैं। इन हाइड्राइडों के गलनांक उच्च होते हैं।

(iv) हैलोजन से अभिक्रियाशीलता : क्षार धातुएं हैलोजन से शीघ्र प्रबल अभिक्रिया करके आयनिक हैलाइड M+ X– बनाती हैं, हालाँकि लीथियम के हैलाइड आंशिक रूप से सहसंयोजक होते हैं। इसका कारण लीथियम की उच्च ध्रुवण-क्षमता है। (धनायन के कारण ऋणायन के इलेक्ट्रॉन अभ्र का विकृत होना ‘ध्रुवणता’ कहलाता है।) लीथियम आयन का आकार छोटा है, अतः यह हैलाइड आयन के इलेक्ट्रॉन अभ्र को विकृत करने की अधिक क्षमता दर्शाता है। चूँकि बड़े आकार का ऋणायन आसानी से विकृत हो जाता है, इसलिए लीथियम आयोडाइड सहसंयोजक प्रकृति सबसे अधिक दर्शाते हैं।
(v) अपचायक प्रकृति : क्षार धातुएं प्रबल अपचायक के रूप में कार्य करती हैं, जिनमें लीथियम प्रबलतम एवं सोडियम दुर्बलतम अपचायक हैं (सारणी 10.1)। मानक इलेक्ट्रोड विभव (E0), जो अपचायक क्षमता का मापक है, संपूर्ण परिवर्तन का प्रतिनिधित्व करता है–
 ऊर्ध्वपातन एन्थैल्पी
ऊर्ध्वपातन एन्थैल्पी
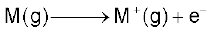 आयनन एन्थैल्पी
आयनन एन्थैल्पी
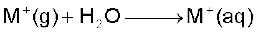 जलयोजन एन्थैल्पी
जलयोजन एन्थैल्पी
लीथियम आयन का आकार छोटा होने के कारण इसकी जलयोजन एन्थैल्पी का मान अधिकतम होता है, जो इसके उच्च ऋणात्मक E0 मान तथा इसके प्रबल अपचायक होने की पुष्टि करता है।
उदाहरण 10.2
Cl2/Cl– के लिए E0 का मान +1.36, I2/I– के लिए + 0.53, Ag+/Ag के लिए +0.79, Na+/Na के लिए –2.71 एवं Li+/Li के लिए –3.04 है। निम्नलिखित को उनकी घटती हुई अपचायक क्षमता के अनुसार व्यवस्थित कीजिए–
I–, Ag, Cl–, Li, Na
हल
क्रम इस प्रकार है ः Li > Na > l– > Ag > Cl–
(vi) द्रव अमोनिया में विलयन : क्षार धातुएं द्रव अमोनिया में घुलनशील हैं। अमोनिया में इनके विलयन का रंग गहरा नीला होता है एवं विलयन प्रकृति में विद्युत् का सुचालक होता है–
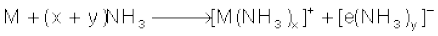
विलयन का नीला रंग अमोनीकृत इलेक्ट्रॉनों के कारण होता है, जो दृश्यप्रकाश क्षेत्र की संगत ऊर्जा का अवशोषण करके विलयन को नीला रंग प्रदान करते हैं। अमोनीकृत विलयन अनुचुंबकीय (Paramagnetic) होता है, जो कुछ समय पड़े रहने पर हाइड्रोजन को मुक्त करता है। फलस्वरूप विलयन में एेमाइड बनता है।
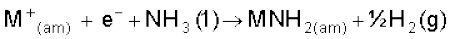
(जहाँ 'am' अमोनीकृत विलयन दर्शाता है।) सांद्र विलयन में नीला रंग ब्रॉन्ज रंग में बदल जाता है और विलयन प्रतिचुंबकीय (Diamagnetic) हो जाता है।
10.1.7 उपयोग
लीथियम का उपयोग महत्त्वपूर्ण मिश्रातुओं के निर्माण में होता है। उदाहरणार्थ–लैड के साथ यह श्वेत धातु (White metal) बनाता है, जिससे इंजन की बियरिंग बनाई जाती है। एेलुमीनियम के साथ मिलकर लीथियम उच्च शक्ति का मिश्रातु बनाता है, जिसका उपयोग वायुयानों के निर्माण में होता है। मैग्नीशियम के साथ उसकी मिश्रातु का उपयोग कवच-प्लेट (Armour-plate) बनाने में तथा लीथियम का उपयोग ताप नाभिकीय अभिक्रियाओं के अतिरिक्त विद्युत् रासायनिक सेलों में भी होता है। सोडियम का उपयोग Na/Pb मिश्रातु में होता है, जो PbEt4 तथा PbMe4 के निर्माण के लिए आवश्यक है। इन कार्बलैड यौगिकों का उपयोग पूर्व में पेट्रोल में अपस्फोटरोधी (Antihknock) के रूप में होता था, परंतु अब अधिकतर वाहनों में सीसारहित (Lead-free) पेट्रोल का उपयोग होने लगा है। द्रव सोडियम धातु का उपयोग नाभिकीय रिएेक्टर में शीतलक (Coolant) के रूप में होता है। जैवीय क्रियाओं में पोटैशियम की महत्त्वपूर्ण भूमिका है। पोटैशियम क्लोराइड का उपयोग उर्वरक के रूप में तथा पोटैशियम हाइड्रॉक्साइड का उपयोग मृदु साबुन के निर्माण में और कार्बन डाइअॉक्साइड के अवशोषक के रूप में भी होता है। सीजियम का उपयोग प्रकाश वैद्युत् सेल (Photoelectric cells) में होता है।
10.2 क्षार धातुओं के यौगिकों के सामान्य अभिलक्षण
क्षार धातुओं के सभी यौगिक साधारणतया आयनिक प्रकृति के होते हैं। इनमें से कुछ यौगिकों के सामान्य अभिलक्षणों की विवेचना यहाँ की जा रही है।
10.2.1 अॉक्साइड एवं हाइड्रॉक्साइड
वायु के आधिक्य में दहन करने पर लीथियम मुख्य रूप से मोनोअॉक्साइड Li2O (एवं कुछ परॉक्साइड Li2O2), सोडियम परॉक्साइड Na2O2 (एवं कुछ सुपर अॉक्साइड NaO2 भी) बनाते हैं, जबकि पोटैशियम, रूबीडियम तथा सीजियम सुपर अॉक्साइड (MO2) बनाते हैं। अनुकूल परिस्थितियों में M2O, M2O2 एवं MO2 शुद्ध रूप मेें बनाए जा सकते हैं। धातु-आयनों का आकार बढ़ने के साथ-साथ परॉक्साइडों तथा सुपर अॉक्साइडों के स्थायित्व में भी वृद्धि होती है। इसका कारण जालक ऊर्जा-प्रभाव (Lattice Energy Effect) के फलस्वरूप बड़े ऋणायनों का बड़े धनायनों द्वारा स्थायित्व प्रदान करना है। ये अॉक्साइड सरलतापूर्वक जल अपघटित होकर हाइड्रॉक्साइड में परिवर्तित हो जाते हैं।
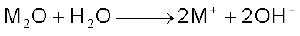
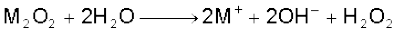
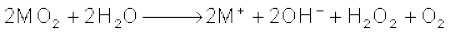
शुद्ध अवस्था में अॉक्साइड एवं परॉक्साइड रंगहीन होते हैं, परंतु सुपर अॉक्साइड पीले या नारंगी रंग के होते हैं। सुपर अॉक्साइड भी अनुचुंबकीय (Paramagnetic) होते हैं। अकार्बनिक रसायन में सोडियम परॉक्साइड को अॉक्सीकारक के रूप में प्रयोग में लाया जाता है।
उदाहरण 10.3
KO2 अनुचुंबकीय क्यों होता है?
हल
KO2 तथा O2– में एक अयुग्मित इलेक्ट्रॉन π*2p
आण्विक आर्बिटल में होने के कारण KO2 अनुचुंबकीय होता है।
अॉक्साइड तथा जल-अभिक्रिया से प्राप्त हाइड्रॉक्साइड श्वेत क्रिस्टलीय ठोस होते हैं। क्षार धातुओं के हाइड्रॉक्साइड प्रबलतम क्षारक होते हैं। ये जल में अत्यधिक ऊष्मा के उत्सर्जन के साथ आसानी से घुल जाते हैं। जल में इनके घुलने का कारण तीव्र जलयोजन है।
10.2.2 हैलाइड
क्षार धातुओं के हैलाइड, MX, (X = F, Cl, Br, l) उच्च गलनांक वाले रंगहीन, क्रिस्टलीय ठोस पदार्थ होते हैं। इन्हें उपयुक्त अॉक्साइड, हाइड्रॉक्साइड या कार्बाेनेट की हाइड्रोहेलिक अम्ल (HX) के साथ अभिक्रिया करके बनाया जा सकता है। इन सभी हैलाइडों की संभवन एन्थैल्पी उच्च ऋणात्मक होती है। क्षार धातुओं के फ्लुओराइडों के ∆fH0 का मान वर्ग में नीचे की ओर बढ़ने पर कम ऋणात्मक होता जाता है, जबकि इन क्षार धातुओं के क्लोराइड, ब्रोमाइड तथा आयोडाइड के ∆fH0 का मान ठीक इससे विपरीत होता है। किसी धातु-विशेष के लिए ∆fH0 का मान फ्लुओराइड से आयोडाइड तक हमेशा कम ऋणात्मक होता जाता है।
गलनांक एवं क्वथनांक का क्रम हमेशा फ्लुओराइड > क्लोराइड > ब्रोमाइड > आयोडाइड के अनुसार होता है। ये सभी हैलाइड जल में घुलनशील होते हैं। जल में LiF की निम्न विलेयता इसकी उच्च जालक ऊर्जा (Latice Energy) के कारण तथा Csl की निम्न विलेयता Cs+ तथा I– की निम्न जलयोजन ऊर्जा (Hydration Energy) के कारण है। लीथियम के अन्य हैलाइड एथानॉल, एेसीटोन और एथिल एेसीटेट में घुलनशील हैं। LiCl पिरीडीन में भी घुलनशील हैं।
10.2.3 अॉक्सो-अम्लों के लवण
अॉक्सो-अम्ल वे होते हैं, जिनमें जिस परमाणु पर अम्लीय प्रोटॉन से युक्त हाइड्रॉक्सिल समूह होता है, उसी परमाणु पर अॉक्सो समूह जुड़ा रहता है। जैसे–कार्बाेनिक अम्ल, H2CO3 [OC(OH)2] सल्फ्यूरिक अम्ल, H2SO4 [O2S(OH)2] क्षार धातुएं–सभी अॉक्सो-अम्लों के साथ लवण बनाते हैं। ये साधारणतया जल में घुलनशील होते हैं तथा तापीय स्थायी होते हैं। इनके कार्बाेनेटों (M2CO3) एवं हाइड्रोजन कार्बाेनेटों (MHCO3) का तापीय स्थायित्व अत्यधिक होता है। चूँकि वर्ग में ऊपर से नीचे धनविद्युतीय स्वभाव बढ़ता है, अतः कार्बोनेटों एवं हाइड्रोजन कार्बाेनेटों का स्थायित्व भी बढ़ता है। लीथियम कार्बाेनेट ताप के प्रति अधिक स्थायी नहीं होता है। लीथियम का आकार छोटा होने के कारण यह बड़े ऋणापन CO32– को ध्रुवित कर अधिक स्थायी Li2O एवं CO2 का विरचन करता है। इसके हाइड्रोजन कार्बोनेट का अस्तित्व ठोस अवस्था में नहीं होता है।
10.3 लीथियम का असंगत व्यवहार
निम्नलिखित कारणों से लीथियम का व्यवहार असंगत है–
(क) इसके परमाणु एवं आयन (Li+) का असामान्य छोटा आकार, (ख) उच्च ध्रुवण-क्षमता (अर्थात् आवेश/त्रिज्या अनुपात)। परिणामस्वरूप लीथियम यौगिकों की सहसंयोजक प्रवृत्ति अधिक होती है। इसी कारण ये कार्बनिक विलायकों में घुलनशील होते हैं। लीथियम मैग्नीशियम से विकर्ण संबंध दर्शाता है, जिसका वर्णन आगे (खंड 10.3.2 में) दिया गया है।
10.3.1 लीथियम एवं अन्य क्षार धातुओं में असमानताओं के मुख्य बिंदु
(i) लीथियम अत्यधिक कठोर है। इसका गलनांक एवं क्वथनांक अन्य क्षार धातुओं की तुलना में अधिक है।
(ii) लीथियम की अभिक्रियाशीलता अन्य क्षार धातुओं की अपेक्षा सबसे कम है, परंतु यह प्रबलतम अपचायक का कार्य करता है। वायु में दहन के फलस्वरूप लीथियम मुख्यतः मोनोअॉक्साइड (Li2O) बनाता है। अन्य क्षार धातुओं के विपरीत लीथियम नाइट्रोजन के साथ अभिक्रिया करके नाइट्राइड (Li3N) भी बना लेता है।
(iii) LiCl प्रस्वेद्य (Deliquescent) है एवं हाइड्रेट, LiCl.2H2O के रूप में क्रिस्टलित होता है, जबकि अन्य क्षार धातुओं के क्लोराइड हाइड्रेट नहीं बनाते हैं।
(iv) लीथियम हाइड्रोजनकार्बाेनेट ठोस अवस्था में प्राप्य नहीं है, जबकि अन्य क्षार धातु ठोस हाइड्रोजनकार्बोनेट बनाते हैं।
(v) लीथियम एथाइन (Ethyne) से अभिक्रिया करके एथाइनाइड (Ethynide) नहीं बनाता है, जबकि अन्य क्षार धातुएं एेसा करती हैं।
(vi) लीथियम नाइट्रेट गरम करने पर लीथियम अॉक्साइड, Li2O देता है, जबकि अन्य क्षार धातुएं नाइट्रेट विघटित होकर नाइट्राइट देती हैं।
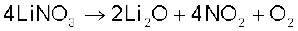
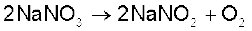
(vii) अन्य क्षार धातुओं के फ्लुओराइड एवं अॉक्साइड की तुलना में LiF एवं Li2O जल में कम विलेय हैं।
10.3.2 लीथियम एवं मैग्नीशियम में समानताओं के बिंदु
लीथियम एवं मैग्नीशियम में समानताएँ मुख्य रूप से विचारणीय हैं। इनके समान आकार के कारण एेसा होता है। Li तथा Mg की परमाण्वीय त्रिज्या क्रमशः 152 pm तथा 160 pm है। Li+ तथा Mg2+ की आयनिक त्रिज्या क्रमशः 76 pm एवं 72 pm है। लीथियम एवं मैग्नीशियम में समानताएँ निम्नलिखित हैं–
(i) लीथियम एवं मैग्नीशियम अपने वर्गाें की अन्य धातुओं की तुलना में कठोर तथा हलकी धातुएं हैं।
(ii) लीथियम एवं मैग्नीशियम जल के साथ धीमी गति से अभिक्रिया करते हैं। इनके अॉक्साइड एवं हाइड्रॉक्साइड बहुत कम घुलनशील हैं। हाइड्रॉक्साइड गरम करने पर विघटित हो जाते हैं। दोनों ही नाइट्रोजन से सीधे संयोग करके नाइट्राइड क्रमशः Li3N एवं Mg3N2 बनाते हैं।
(iii) Li2O एवं MgO अॉक्सीजन के आधिक्य से अभिक्रिया करके सुपर अॉक्साइड नहीं बनाते हैं।
(iv) लीथियम एवं मैग्नीशियम धातुओं के कार्बाेनेट गरम करने पर सरलतापूर्वक विघटित होकर उनके अॉक्साइड एवं CO2 बनाते हैं। दोनों ही ठोस हाइड्रोजनकार्बोनेट नहीं बनाते हैं।
(v) LiCl एवं MgCl2 एथेनॉल में विलेय हैं।
(vi) LiCl एवं MgCl2 दोनों ही प्रस्वेद्य (Deliquescent) यौगिक हैं। ये जलीय विलयन से LiCl.2H2O एवं MgCl2.8H2O के रूप में क्रिस्टलीकृत होते हैं।
10.4 सोडियम के कुछ महत्त्वपूर्ण यौगिक
औद्योगिक स्तर पर सोडियम के महत्त्वपूर्ण यौगिक हैंः सोडियम कार्बोनेट, सोडियम हाइड्रॉक्साइड, सोडियम क्लोराइड एवं सोडियम बाइकार्बोनेट। इन यौगिकों के औद्योगिक निर्माण एवं उपयोगों का वर्णन नीचे किया जा रहा है।
सोडियम कार्बाेनेट (धावन सोडा) Na2CO3.10H2O
साधारणतया सोडियम कार्बाेनेट ‘साल्वे विधि’ द्वारा बनाया जाता है। इस प्रक्रिया में लाभ यह है कि सोडियम हाइड्रोजनकार्बाेनेट, जो अमोनियम हाइड्रोजनकार्बाेनेट एवं सोडियम क्लोराइड के संयोग से अवक्षेपित होता है, अल्प विलेय होता है। अमोनियम हाइड्रोजनकार्बाेनेट, CO2 गैस को सोडियम क्लोराइड के अमोनिया से संतृप्त सांद्र विलयन में प्रवाहित कर बनाया जाता है। वहाँ पहले अमोनियम कार्बाेनेट और फिर अमोनियम हाइड्रोजनकार्बाेनेट बनता है। संपूर्ण प्रक्रम की अभिक्रियाएं निम्नलिखित हैं–
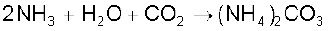
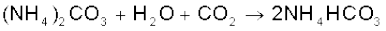
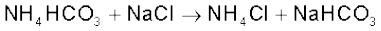
इस प्रकार सोडियम बाइकार्बोनेट के क्रिस्टल पृथक् हो जाते हैं, जिन्हें गरम करके सोडियम कार्बाेनेट प्राप्त किया जाता है–

इस प्रक्रम में NH4Cl युक्त विलयन की Ca(OH)2 से अभिक्रिया पर NH3 को पुनः प्राप्त किया जा सकता है। कैल्सियम क्लोराइड सह-उत्पाद के रूप में प्राप्त होता है–
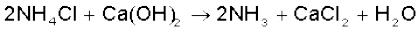
यहाँ यह उल्लेखनीय है कि साल्वे विधि का उपयोग पोटैशियम कार्बाेनेट के निर्माण में नहीं किया जा सकता है, क्योंकि पोटैशियम हाइड्रोजनकार्बाेनेट की अधिक विलेयता के कारण इसे पोटैशियम क्लोराइड के संतृप्त विलयन में अमोनियम हाइड्रोजनकार्बाेनेट के संयोग द्वारा अवक्षेपित करना संभव नहीं है।
गुण
सोडियम कार्बाेनेट श्वेत क्रिस्टलीय ठोस है, जो डेकाहाइड्रेट 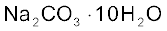 के रूप में पाया जाता है। इसे ‘धावन सोडा’ (Washing Soda) भी कहते हैं। यह जल में आसानी से घुल जाता है। गरम करने पर डेकाहाइड्रेट क्रिस्टलीय जल त्यागकर मोनोहाइड्रेट में बदल जाता है। 373 K से उच्च ताप पर मोनोहाइड्रेट पूर्ण रूप से शुष्क हो जाता है एवं एक श्वेत रंग के चूर्ण में बदल जाता है, जिसे ‘सोडा एेश’ (Soda Ash) कहते हैं।
के रूप में पाया जाता है। इसे ‘धावन सोडा’ (Washing Soda) भी कहते हैं। यह जल में आसानी से घुल जाता है। गरम करने पर डेकाहाइड्रेट क्रिस्टलीय जल त्यागकर मोनोहाइड्रेट में बदल जाता है। 373 K से उच्च ताप पर मोनोहाइड्रेट पूर्ण रूप से शुष्क हो जाता है एवं एक श्वेत रंग के चूर्ण में बदल जाता है, जिसे ‘सोडा एेश’ (Soda Ash) कहते हैं।
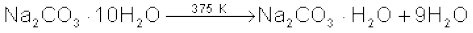
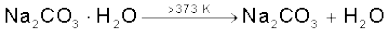
सोडा एेश
सोडियम कार्बाेनेट का कार्बाेनेट वाला भाग जल-अपघटित होकर क्षारीय विलयन बनाता है–
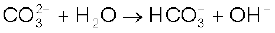
उपयोग
(1) जल के मृदुकरण, धुलाई एवं निर्मलन में;
(2) काँच, साबुन, बोरेक्स एवं कास्टिक सोडा के निर्माण में;
(3) कागज़, पेन्ट एवं वस्त्र उद्योग में; और
(4) प्रयोगशाला में गुणात्मक एवं मात्रात्मक विश्लेषण में अभिकर्मक के रूप में।
सोडियम क्लोराइड (NaCl)
सोडियम क्लोराइड का मुख्य स्रोत समुद्री जल है, जिसमें लगभग 2.7 से 2.9 प्रतिशत (भारात्मक) तक लवण होता है। हमारे देश जैसे देशों में समुद्री जल के वाष्पीकरण द्वारा साधारण नमक प्राप्त किया जाता है। हमारे देश में सूर्य से वाष्पीकरण द्वारा लगभग 50 लाख टन नमक का उत्पादन प्रतिवर्ष किया जाता है। अपरिष्कृत नमक, जो ब्राइन विलयन के क्रिस्टलीकरण से प्राप्त किया जाता है, में सोडियम सल्फेट, कैल्सियम सल्फेट, कैल्सियम क्लोराइड एवं मैग्नीशियम क्लोराइड अशुद्धि के रूप में होते हैं। कैल्सियम क्लोराइड CaCl2 एवं मैग्नीशियम क्लोराइड MgCl2 की अशुद्धि का कारण उनका प्रस्वेद्य (Deliquescent) होना है (अर्थात् ये सरलतापूर्वक वायुमंडल से नमी का अवशोषण करते हैं)। शुद्ध सोडियम क्लोराइड प्राप्त करने के लिए अपरिष्कृत लवण को जल की न्यूनतम मात्रा में घोला जाता है, जिसमें अविलेय अशुद्धियाँ पृथक् हो जाती हैं। जब विलयन को हाइड्रोजन क्लोराइड गैस से संतृप्त करते हैं, तब सोडियम क्लोराइड के क्रिस्टल पृथक् हो जाते हैं। कैल्सियम एवं मैग्नीशियम क्लोराइड सोडियम क्लोराइड से अधिक विलेय होने के कारण विलयन में ही रहते हैं।
सोडियम क्लोराइड का गलनांक 1081 K है। जल में इसकी विलेयता 273 K पर 36.0 g प्रति 100 g जल है। ताप बढ़ाने पर विलेयता पर विशेष प्रभाव नहीं पड़ता है।
उपयोग
(i) साधारण नमक के रूप में, तथा
(ii) Na2O2, NaOH एवं Na2CO3 बनाने में।
सोडियम हाइड्रॉक्साइड (कास्टिक सोडा), NaOH
औद्योगिक स्तर पर सोडियम हाइड्रॉक्साइड का उत्पादन कास्टनर-कैलनर सेल में सोडियम क्लोराइड के विद्युत्-अपघटन द्वारा किया जाता है। मर्करी कैथोड एवं कार्बन एेनोड का उपयोग करके लवण-जल का विद्युत्-अपघटन सेल में किया जाता है। सोडियम धातु मर्करी कैथोड पर विसर्जित होकर मर्करी के साथ संयुक्त होकर सोडियम अमलगम बनाता है। एेनोड पर क्लोरीन गैस मुक्त होती है।
कैथोड ः 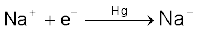 अमलगम
अमलगम
एेनोड ः 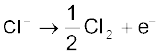
अमलगम जल से अभिक्रिया करके सोडियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस देता है।
2Na– अमलगम 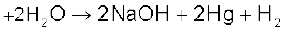
सोडियम हाइड्रॉक्साइड पारभासी श्वेत ठोस पदार्थ है। इसका गलनांक 591 K है। यह जल में शीघ्रता से विलेय होकर क्षारीय विलयन बनाता है। सोडियम हाइड्रॉक्साइड के क्रिस्टल प्रस्वेद्य (Deliquescent) होते हैं। सतह पर सोडियम हाइड्रॉक्साइड विलयन वायुमंडलीय CO2 से अभिक्रिया करके Na2CO3 बनाता है।
उपयोग
(i) साबुन, कागज़, कृत्रिम रेशम तथा कई अन्य रसायनों के निर्माण में;
(ii) पेट्रोलियम के परिष्करण में;
(iii) बॉक्साइट के शुद्धिकरण में;
(iv) वस्त्र-उद्योग में सूती वस्त्रों के मर्सरीकरण में;
(v) शुद्ध वसा एवं तेलों के निर्माण में; तथा
(vi) प्रयोगशाला-अभिकर्मक के रूप में।
सोडियम हाइड्रोजन-कार्बाेनेट (बेकिंग सोडा), NaHCO3
सोडियम हाइड्रोजन कार्बाेनेट को ‘बेकिंग सोडा’ भी कहा जाता है, क्योंकि यह गरम करने पर विघटित होकर कार्बन-डाइअॉक्साइड के बुलबुले देता है। (इसीलिए पेस्ट्री, केक आदि में छोट-छोटे छिद्र हो जाते हैं। फलत : वे हलके तथा परिफुल्लित (Fluffy) बन जाते हैं।)
सोडियम हाइड्रोजन-कार्बाेनेट को सोडियम कार्बाेनेट के विलयन में CO2 गैस से संतृप्त करके बनाया जाता है। सोडियम हाइड्रोजनकार्बाेनेट का श्वेत चूर्ण कम विलेय होने के कारण पृथक् हो जाता है।
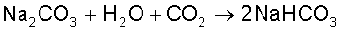
सोडियम हाइड्रोजन-कार्बाेनेट चर्म रोगों में मंद पूतिराधी (Mild Antiseptic) के रूप में; साथ ही अग्निशमन यंत्र में भी होता है।
10.5 सोडियम एवं पोटैशियम की जैव उपयोगिता
70 किलो के वज़न वाले एक सामान्य व्यक्ति में लगभग
90 ग्राम सोडियम एवं 170 ग्राम पोटैशियम होता है, जबकि लोहा केवल 5 ग्राम तथा ताँबा 0.06 ग्राम होता है।
सोडियम आयन मुख्यतः अंतराकाशीय द्रव में उपस्थित रक्त प्लाज़्मा, जो कोशिकाओं को घेरे रहता है, में पाया जाता है। यह आयन शिरा-संकेतों के संचरण में भाग लेते हैं, जो कोशिका झिल्ली में जलप्रवाह को नियमित करते हैं तथा कोशिकाओं में शर्करा और एमीनो अम्लों के प्रवाह को भी नियंत्रित करते हैं। सोडियम एवं पोटैशियम रासायनिक रूप से समान होते हुए भी कोशिका झिल्ली को पार करने की क्षमता एवं एन्ज़ाइम को सक्रिय करने में मात्रात्मक रूप से भिन्न हैं। इसीलिए कोशिका द्रव में पोटैशियम धनायन बहुतायत में होते हैं। जहाँ ये एन्ज़ाइम को सक्रिय करते हैं तथा ग्लूकोज़ के अॉक्सीकरण से ATP बनने में भाग लेते हैं। सोडियम आयन शिरा-संकेतों के संचरण के लिए उत्तरदायी है।
कोशिका झिल्ली के अन्य हिस्सों में पाए जाने वाले सोडियम एवं पोटैशियम आयनों की सांद्रता में उल्लेखनीय भिन्नता पाई जाती है। उदाहरण के लिए– रक्त प्लाज़्मा में लाल रक्त कोशिकाओं में सोडियम की मात्रा 143 m molL-1 है, जबकि पोटैशियम का स्तर केवल 5 m molL-1 है। यह सांद्रता 10 m molL-1 (Na+) एवं 105 m molL-1(K+) तक परिवर्तित हो सकती है। यह असाधारण आयनिक उतार-चढ़ाव, जिसे ‘सोडियम पोटैशियम पंप’ कहते हैं, सेल झिल्ली पर कार्य करता है, जो मनुष्य की विश्रामावस्था के कुल उपभोगित ATP की एक-तिहाई से ज़्यादा का उपयोग कर लेता है, जो मात्रा लगभग 15 किलो प्रति 24 घंटे तक हो सकती है।
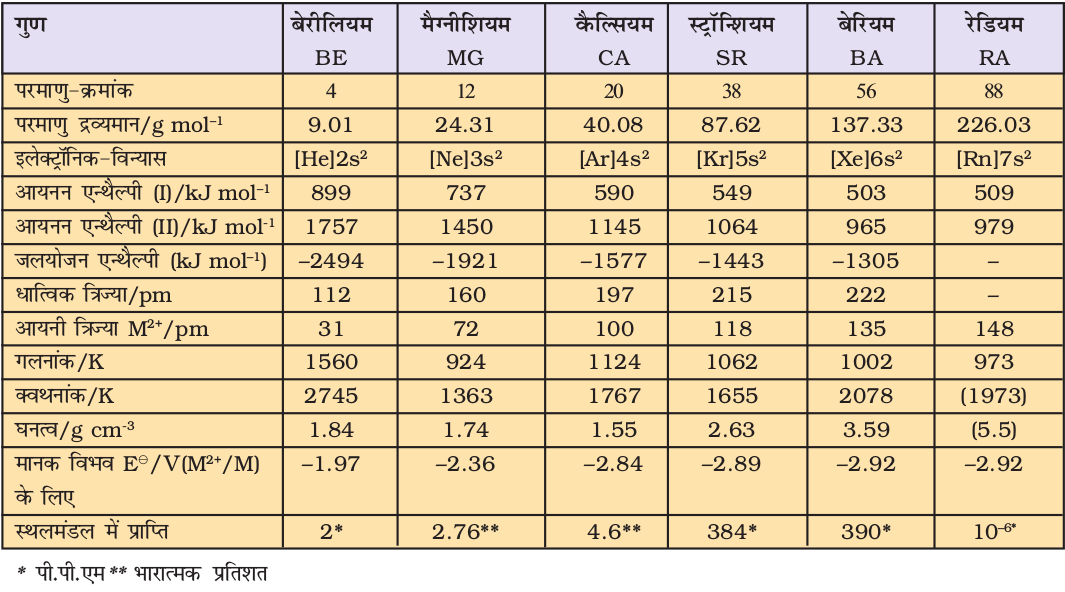
10.6 वर्ग 2 के तत्त्वः क्षारीय मृदा धातुएं
आवर्त सारणी के वर्ग 2 के तत्त्व हैं– बेरीलियम, मैग्नीशियम, कैल्सियम, स्ट्रॉन्शियम, बेरियम एवं रेडियम। बेरीलियम के अतिरिक्त अन्य तत्त्व संयुक्त रूप से ‘मृदा धातुएं’ कहलाती हैं। प्रथम तत्त्व बेरीलियम वर्ग के अन्य तत्त्वों से भिन्नता दर्शाता है एवं एेलुमीनियम के साथ विकर्ण संबंध (Diagonal Relationship) दर्शाता है। मृदा धातुओं के परमाण्वीय तथा भौतिक गुण सारणी 10.2 में दर्शाए गए हैं।
10.6.1 इलेक्ट्रॉनिक विन्यास
इन तत्त्वों के संयोजकता-कोश के s–कक्षक में 2 इलेक्ट्रॉन होते हैं (सारणी 10.2)। इनका सामान्य इलेक्ट्रॉनिक विन्यास [उत्कृष्ट गैस] ns2 होता है। क्षार धातुओं के समान ही इनके भी यौगिक मुख्यतः आयनिक प्रकृति के होते हैं।
| तत्त्व | प्रतीक | इलेक्ट्रॉनिक विन्यास |
| बेरीलियम | Be | 1s22s2 |
| मैग्नीशियम | Mg | 1s22s22p63s2 |
| कैल्सियम | Ca | 1s22s22p63s23p64s2 |
| स्ट्रॉन्शियम | Sr | 1s22s22p63s23p63d104s24p65s2 |
| बेरियम | Ba | 1s22s22p63s23p63d104s24p6 |
| 4d105s25p66s2 या [Xe] 6s2 | ||
| रेडियम | Ra | [Rn]7s2 |
10.6.2 परमाणु एवं आयनी त्रिज्या
आवर्त सारणी के संगत आवर्तों में क्षार धातुओं की तुलना में क्षारीय मृदा धातुओं की परमाणु एवं आयनी त्रिज्याएं छोटी होती हैं। इसका कारण इन तत्त्वों के नाभिकीय आवेशों में वृद्धि होना है।
10.6.3 आयनन एन्थैल्पी
क्षारीय मृदा धातुओं के परमाणुओं के बड़े आकार के कारण इनकी आयनन एन्थैल्पी के मान न्यून होते हैं। चूँकि वर्ग में आकार ऊपर से नीचे क्रमशः बढ़ता जाता है, अतः इनकी आयनन एन्थैल्पी के मान कम होते जाते हैं (सारणी 10.2)। क्षारीय मृदा धातुओं के प्रथम आयनन एन्थैल्पी का मान क्षार धातुओं के प्रथम आयनन एन्थैल्पी के मानों की तुलना में अधिक है। यह इनकी क्षार धातुओं की संगत तुलनात्मक रूप से छोटे आकार होने के कारण होती है, परंतु यह देखना रुचिकर है कि इनके द्वितीय आयनन एन्थैल्पी के मान क्षार धातुओं के द्वितीय आयनन एन्थैल्पी के मानों की तुलना में कम हैं।
10.6.4 जलयोजन एन्थैल्पी
क्षार धातुओं के समान इसमें भी वर्ग में ऊपर से नीचे आयनिक आकार बढ़ने पर इनकी जलयोजन एन्थैल्पी के मान कम होते जाते हैं।
Be2+ > Mg2+ > Ca2+ > Sr2+ > Ba2+
क्षारीय मृदा धातुओं की जलयोजन एन्थैल्पी क्षार धातुओं की जलयोजन एन्थैल्पी की तुलना में ज़्यादा होती है। इसीलिए मृदा धातुओं के यौगिक क्षार धातुओं के यौगिकों की तुलना में अधिक जलयोजित होते हैं। जैसे–MgCl2 एवं CaCl2 जलयोजित अवस्था MgCl2.6H2O एवं CaCl2.6H2O में पाए जाते हैं, जबकि NaCl एवं KCl एेेसे हाइड्रेट नहीं बनाते हैं।
सारणी 10.2 क्षारीय मृदा धातुओं के परमाण्विक एवं भौतिक गुण
(Atomic and Physical Properties of the Alkaline Earth Metals)
10.6.5 भौतिक गुण
क्षारीय मृदा धातुएं सामान्यतया चाँदी की भाँति सफेद, चमकदार एवं नरम, परंतु अन्य धातुओं की तुलना में कठोर होती हैं। बेरीलियम तथा मैग्नीशियम लगभग धूसर रंग (Greyish) के होते हैं। इनके गलनांक एवं क्वथनांक क्षार धातुओं की तुलना में उच्च होते हैं, क्योंकि इनका आकार छोटा होता है। फिर भी इनके गलनांकाें तथा क्वथनांकों में कोई नियमित परिवर्तन नहीं दिखता है। निम्न आयनन एन्थैल्पी के कारण ये प्रबल धन-विद्युतीय होते हैं। धन-विद्युतीय गुण ऊपर से नीचे Be से Ba तक बढ़ता है। कैल्सियम, स्ट्रॉन्शियम एवं बेरियम ज्वाला को क्रमशः ईंट जैसा लाल (Brick Red) रंग, किरमिजी लाल (Crimson Red) एवं हरा (Apple Green) रंग प्रदान करते हैं। ज्वाला में उच्च ताप पर वाष्प-अवस्था में क्षारीय मृदा धातुओं के बाह्यतम कोश के इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा-स्तर पर चले जाते हैं। ये उत्तेजित इलेक्ट्रॉन जब पुनः अपनी तलस्थ अवस्था में लौटते हैं, तब दृश्य प्रकाश के रूप में ऊर्जा उत्सर्जित होती है। फलतः ज्वाला रंगीन दिखने लगती है। बेरीलियम तथा मैग्नीशियम के बाह्यतम कोशों के इलेक्ट्रॉन इतनी प्रबलता से बँधे रहते हैं कि ज्वाला की ऊर्जा द्वारा इनका उत्तेजित होना कठिन हो जाता है। अतः ज्वाला में इन धातुओं का अपना कोई अभिलाक्षणिक रंग नहीं होता है। गुणात्मक विश्लेषण में Ca, Sr एवं Ba मूलकों की पुष्टि ज्वाला-परीक्षण के आधार पर की जाती है तथा इनकी सांद्रता का निर्धारण ज्वाला प्रकाशमापी द्वारा किया जाता है। क्षारीय मृदा धातुओं की क्षार धातुओं की तरह वैद्युत् एवं ऊष्मीय चालकता उच्च होती है। यह इनका अभि-लाक्षणिक गुण होता है।
10.6.6 रासायनिक गुण
क्षारीय मृदा धातुएं क्षार धातुओं से कम क्रियाशील होती हैं। इन तत्त्वों की अभिक्रियाशीलता वर्ग के ऊपर से नीचे जाने पर बढ़ती है।
(i) वायु एवं जल के प्रति अभिक्रियाशीलता : बेरीलियम एवं मैग्नीशियम गतिकीय रूप से अॉक्सीजन तथा जल के प्रति निष्क्रिय हैं, क्योंकि इन धातुओं के पृष्ठों पर अॉक्साइड की फिल्म जम जाती है। फिर भी, बेरीलियम चूर्ण रूप में वायु में जलने पर BeO एवं Be3N2 बना लेता है। मैग्नीशियम अधिक धनविद्युतीय है, जो वायु में अत्यधिक चमकीले प्रकाश के साथ जलते हुए MgO तथा Mg3N2 बना लेता है। कैल्सियम, स्ट्रॉन्शियम एवं बेरियम वायु से शीघ्र अभिक्रिया करके अॉक्साइड तथा नाइट्राइड बनाते हैं। ये जल से और भी अधिक तीव्रता से अभिक्रिया करते हैं; यहाँ तक कि ठंडे जल से अभिक्रिया कर हाइड्रॉक्साइड बनाते हैं।
(ii) हैलोजन के प्रति अभिक्रियाशीलता : सभी क्षारीय मृदा धातुएं हैलोजन के साथ उच्च ताप पर अभिक्रिया करके हैलाइड बना लेती हैं–
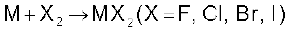
BeF2 बनाने की सबसे सरल विधि (NH4)2 BeF4 का तापीय अपघटन है, जबकि BeCl2, अॉक्साइड से सरलतापूर्वक बनाया जा सकता है–
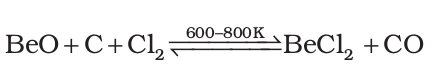
(iii) हाइड्रोजन के प्रति अभिक्रियाशीलता : बेरीलियम के अतिरिक्त सभी क्षारीय मृदा धातुएं गरम करने पर हाइड्रोजन से अभिक्रिया करके हाइड्राइड बनाती हैं। BeH2 को BeCl2 एवं LiAlH4 की अभिक्रिया से बनाया जा सकता है–
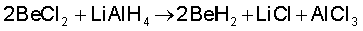
(iv) अम्लों के प्रति अभिक्रियाशीलता : क्षारीय मृदा धातुएं शीघ्र ही अम्लों से अभिक्रिया कर हाइड्रोजन गैस मुक्त करती हैं।
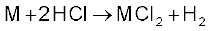
(v) अपचायक प्रकृति : प्रथम वर्ग की धातुओं के समान क्षारीय मृदा धातुएं प्रबल अपचायक हैं। इसका बोध इनके अधिक ऋणात्मक अपचयन विभव के मानों से होता है (सारणी 10.2), यद्यपि इनकी अपचयन-क्षमता क्षार धातुओं की तुलना में कम होती है। बेरीलियम के अपचयन विभव का मान अन्य क्षारीय मृदा धातुओं से कम ऋणात्मक होता है। फिर भी इसकी अपचयन-क्षमता का कारण Be2+ आयन के छोटे आकार, इसकी उच्च जलयोजन ऊर्जा एवं धातु की उच्च परमाण्वीय- करण एन्थैल्पी का होना है।
(vi) द्रव अमोनिया में विलयन : क्षार धातुओं की भाँति क्षारीय मृदा धातुएं भी द्रव अमोनिया में विलेय होकर गहरे नीले काले रंग का विलयन बना लेती हैं। इस विलयन से धातुओं के अमोनीकृत आयन प्राप्त होते हैं–

इन विलयनों से पुनः अमोनिएट्स (Ammoniates) [M(NH3)6]2+ प्राप्त किए जा सकते हैं।
10.6.7 उपयोग
बेरीलियम का उपयोग मिश्रातु के निर्माण में होता है। Cu-Be मिश्रातु का उपयोग उच्च शक्ति के सि्ंप्रग बनाने में होता है। धात्विक बेरीलियम का उपयोग एक्स-किरण नली में वातायन (window) के लिए किया जाता है। मैग्नीशियम एेलुमीनियम, जिंक, मैंगनीज एवं टिन के साथ मिश्रातु बनाता है। Mg–Al मिश्रधातु हलकी होने के कारण वायुयानों के निर्माण में प्रयुक्त होती है। मैग्नीशियम (चूर्ण एवं फीता) का उपयोग चमकीले पाउडर तथा बल्ब, तापदीप्त बमों (Incendiary Bombs) और संकेतकों (Signals) में होता है। जल में मैग्नीशियम हाइड्रॉक्साइड के निलंबन (जिसे ‘मिल्क अॉफ मैग्नीशियम’ कहते हैं) का उपयोग एेन्टाएसिड (Antacid) दवा के रूप में होता है। मैग्नीशियम कार्बोनेट किसी भी टूथपेस्ट का मुख्य घटक है। कैल्सियम का उपयोग अॉक्साइडाें से उन धातुओं के निष्कर्षण में होता है, जिन्हें कार्बन द्वारा अपचयित करना संभव नहीं है। चूँकि कैल्सियम तथा बेरियम उच्च ताप पर अॉक्सीजन एवं नाइट्रोजन से अभिक्रिया करते हैं, अतः इस गुण का उपयोग निर्वात् नली से वायु-निष्कासन करने में किया जाता है। रेडियम के लवणों का उपयोग विकिरण चिकित्सा (उदाहरणार्थ– कैन्सर के उपचार) में किया जाता है।
10.7 क्षारीय मृदा धातुओं के यौगिकों के सामान्य अभिलक्षण
वर्ग 2 के तत्त्वों की द्विधनीय अॉक्सीकरण अवस्था (M2+) इनकी प्रमुख संयोजकता है। क्षारीय मृदा धातुओं के यौगिक प्रायः आयनिक होते हैं, लेकिन यह क्षार धातुओं के संगत यौगिकों की तुलना में कम आयनिक प्रकृति के होते हैं। इसका कारण इनका अधिक नाभिकीय आवेश एवं छोटा आकार है। बेरीलियम एवं मैग्नीशियम के अॉक्साइड तथा अन्य यौगिक इस वर्ग के भारी और बड़े आकार वाले अन्य तत्त्वों (Ca, Sr, Ba) के अॉक्साइडों एवं अन्य यौगिकों की तुलना में अधिक सहसंयोजी होते हैं। क्षारीय मृदा धातुओं के यौगिकों के सामान्य अभिलक्षण यहाँ बताए जा रहे हैं।
(i) अॉक्साइड एवं हाइड्रॉक्साइड ः क्षारीय मृदा धातु वायु में जलकर मोनोअॉक्साइड (MO) बनाते हैं, जिनकी संरचना BeO को छोड़कर, रॉक-साल्ट (Rock-Salt) जैसी होती है। BeO आवश्यक रूप से सहसंयोजक प्रकृति का होता है। इन यौगिकों की संभवन ऊष्माएँ उच्च होती हैं। यही कारण है कि ये ऊष्मा के प्रति अति स्थायी होते हैं। BeO उभयधर्मी है, जबकि अन्य तत्त्वों के आक्सॉइड क्षारीय प्रकृति के होते हैं, जो जल से अभिक्रिया कर अल्प विलेय हाइड्रॉक्साइड बनाते हैं।
इन हाइड्रॉक्साइडों की विलेयता, तापीय स्थायित्व एवं क्षारीय प्रकृति Mg(OH)2 से Ba(OH)2 तक परमाणु क्रमांक बढ़ने पर बढ़ती है। क्षारीय मृदा धातुओं के हाइड्रॉक्साइड क्षार धातुओं के संगत हाइड्रॉक्साइडों की तुलना में कम स्थायी होते हैं। बेरीलियम हाइड्रॉक्साइड प्रकृति में उभयधर्मी है, क्योंकि यह अम्ल तथा क्षार दोनों से अभिक्रिया करता है।
Be(OH)2 + 2OH– → [Be (OH4)]2-
बेरीलेट आयन
Be(OH)2 + 2HCl + 2H2O → [Be (OH)4]Cl2
(ii) हैलाइड : बेरीलियम हैलाइड के अतिरिक्त अन्य धातुओं के हैलाइडों की प्रकृति आयनिक होती है। बेरीलियम हैलाइड मुख्य रूप से सहसंयोजक होते हैं एवं कार्बनिक विलायकों में विलेय होते हैं। बेरीलियम क्लोराइड की ठोस अवस्था में शृंखला-संरचना होती है, जैसाकि नीचे दर्शाया गया है–
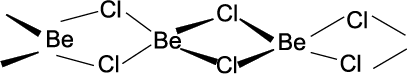
वाष्प-अवस्था में BeCl2 क्लोरो-सेतु (Chloro-Bridged) द्विलक बनाता है, जो 1200K के उच्च ताप पर रेखीय एकलक में वियोजित हो जाता है। वर्ग में ऊपर से नीचे हैलाइड हाइड्रेट बनाने की प्रवृत्ति कम होती जाती है। Ca, Sr एवं Ba के जलयोजित क्लोराइड, ब्रोमाइड एवं आयोडाइडों का निर्जलीकरण इन्हें गरम करके किया जा सकता है, जबकि Be एवं Mg के संगत जलयोजित हैलाइड का जल-अपघटन हो जाता है। उदाहरणार्थ– MgCl2 . 8H2O, CaCl2, 6H2O, SrCl2, 6H2O एवं BaCl2.2H2O) उच्च जालक ऊर्जा के कारण फ्लुओराइड क्लोराइड की तुलना में कम विलेय होते हैं।
(iii) अॉक्सो-अम्लों के लवण : क्षारीय मृदा धातुएं अॉक्सो-अम्लों के लवण भी बनाती हैं। इनमें से कुछ मुख्य निम्नलिखित हैं–
कार्बोनेट : क्षारीय मृदा धातुओं के कार्बोनेट जल में अविलेय होते हैं, जिन्हें इन तत्त्वों के विलेय लवणों के विलयन में सोडियम या अमोनियम कार्बोनेट विलयन मिलाकर अवक्षेपित किया जा सकता है। तत्त्व के परमाणु क्रमांक बढ़ने पर कार्बोनेटों की जल में विलेयता बढ़ती है। सभी कार्बोनेट गरम करने पर कार्बन डाइअॉक्साइड एवं अॉक्साइड में वियोजित हो जाते हैं। बेरीलियम कार्बोनेट अस्थायी होता है, जिसे केवल CO2 के वातावरण में रखा जा सकता है। कार्बोनेटों का तापीय स्थायित्व धनायन का आकार बढ़ने पर बढ़ता है।
सल्फेट : क्षारीय मृदा धातुओं के सल्फेट श्वेत एवं ठोस होते हैं तथा ताप के प्रति स्थायी होते हैं। BeSO4 एवं MgSO4 शीघ्रता से जल में विलेय हो जाते हैं। CaSO4 से BaSO4 तक विलेयता कम होती जाती है। Be2+ एवं Mg2+ आयनों की जलयोजन एन्थैल्पी इनके जालक एन्थैल्पी की तुलना में अधिक होती है। अतः इनके सल्फेट जल में विलेय होते हैं।
नाइट्रेट : इन धातुओं के कार्बोनेटों को तनु नाइट्रिक अम्ल में घोलकर इनके नाइट्रेट प्राप्त किए जाते हैं। मैग्नीशियम नाइट्रेट जल के छः अणुओं के साथ क्रिस्टलित होता है, जबकि बेरियम नाइट्रेट निर्जल लवण के रूप में क्रिस्टलित होता है। यह फिर बढ़ते आकार के साथ घटती जलयोजन एन्थैल्पी के कारण कम जलयोजित लवण बनाने की प्रवृत्ति को पुन: दर्शाता है। लीथियम नाइट्रेट के समान सभी नाइट्रेट गरम करने पर अपघटित होकर अॉक्साइड बनाते हैं।
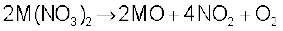
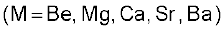
उदाहरण 10.4
क्षारीय मृदा धातुओं के हाइड्रॉक्साइडों की जल में विलेयता वर्ग में नीचे जाने पर क्यों बढ़ती है?
हल
क्षारीय मृदा धातुओं मेें ऋणायन समान हों, तो धनायन की त्रिज्या जालक एन्थैल्पी को प्रभावित करती है। चूँकि बढ़ती हुई आयनिक त्रिज्या के साथ जलयोजन एन्थैल्पी की तुलना में ऋणात्मक एन्थैल्पी तेजी से कम होती है, अतः वर्ग में नीचे जाने पर विलेयता बढ़ती है।
उदाहरण 10.5
क्षारीय मृदा धातुओं के कार्बोनेटों एवं सल्फेटों की जल में विलेयता वर्ग में ऊपर से नीचे क्यों घटती है?
हल
ऋणायन का आकार धनायन की तुलना में बहुत अधिक है एवं जालक एन्थैल्पी वर्ग में लगभग स्थिर रहती है। चूँकि वर्ग में जलयोजन ऊर्जा का मान ऊपर से नीचे घटता है, अतः धातु कार्बोनेटों एवं सल्फेटों की विलेयता वर्ग में ऊपर से नीचे जाने पर घटती जाती है।
10.8 बेरीलियम का असंगत व्यवहार
वर्ग 2 का प्रथम तत्त्व बेरीलियम वर्ग में मैग्नीशियम तथा अन्य तत्त्वों के साथ असंगत व्यवहार दिखलाता है। यह एेलुमीनियम से विकर्ण भी दर्शाता है, जो तदंतर विवेचित किए जाएँगे।
(i) बेरीलियम का परमाण्वीय एवं आयनिक आकार असाधारण रूप से छोटा होता है, जिसकी तुलना वर्ग के अन्य तत्त्वों से नहीं की जा सकती है। उच्च आयनन एन्थैल्पी तथा लघु परमाणु आकार के कारण बेरीलियम के यौगिक बृहद् रूप से सहसंयोजी होते हैं तथा आसानी से जल अपघटित हो जाते हैं।
(ii) बेरीलियम की उपसहसंयोजन संख्या (Co-ordination Number) चार से अधिक नहीं होती है, क्योंकि इसके संयोजी-कोश में केवल चार कक्षक हैं। वर्ग के अन्य सदस्यों की उपसहसंयोजन संख्या छः हो सकती है, क्योंकि ये d कक्षकों का उपयोग करते हैं।
(iii) अन्य सदस्यों के अॉक्साइड एवं हाइड्रॉक्साइड के विपरीत बेरीलियम के अॉक्साइड तथा हाइड्रॉक्साइड का स्वभाव उभयधर्मी (Amphoteric) होता है।
10.8.1 बेरीलियम एवं एेलुमीनियम में विकर्ण संबंध
Be2+ की अनुमानित आयनिक त्रिज्या 31 pm है। इसका आवेश/त्रिज्या अनुपात Al3+ आयन के लगभग समान है। अतः बेरीलियम कुछ मामलों में एेलुमीनियम के समान है। कुछ समानताएँ निम्नलिखित हैं–
(i) एेलुमीनियम के समान बेरीलियम शीघ्रता से अम्लों से प्रभावित नहीं होता है, क्योंकि धातु की सतह पर अॉक्साइड फिल्म की उपस्थिति होती है।
(ii) क्षार की अधिकता में बेरीलियम हाइड्रॉक्साइड घुल जाता है और बेरिलेट (Beryllate) आयन [Be(OH4)]2– देता है। ठीक इसी प्रकार एेलुमीनियम हाइड्रॉक्साइड एेलुमिनेट (Aluminate) आयन [Al(OH)4]– देता है।
(iii) बेरीलियम एवं एेलुमीनियम के क्लोराइड वाष्प प्रावस्था में सेतुबंधित क्लोराइड (Bridged Chloride) की रचना करते हैं। दोनों ही क्लोराइड कार्बनिक विलायकों में विलेय होते हैं एवं प्रबल लूइस अम्ल हैं। इनका उपयोग फ्रीडेल-क्राफ्ट के उत्प्रेरक (Friedel Craft Catalyst) के रूप में होता है।
(iv) बेरीलियम एवं एेलुमीनियम आयन जटिल यौगिक (Complexes) बनाने की प्रबल प्रवृत्ति रखते हैं जैसे–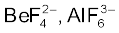 ।
।
10.9 कैल्सियम के कुछ महत्त्वपूर्ण यौगिक
कैल्सियम के महत्त्वपूर्ण यौगिक कैल्सियम अॉक्साइड, कैल्सियम हाइड्रॉक्साइड, कैल्सियम सल्फेट, कैल्सियम कार्बोनेट एवं सीमेन्ट हैं। ये औद्योगिक रूप से महत्त्वपूर्ण यौगिक हैं। वृहद् स्तर पर इनका विरचन एवं इनके उपयोग नीचे वर्णित किए जा रहे हैं।
कैल्सियम अॉक्साइड या बिना बुझा चूना, CaO
इसका वाणिज्यिक निर्माण घूर्णित भट्ठी (Rotary Kiln) में चूने के पत्थर (CaCO3) को लगभग 1070-1270 K पर गरम करके किया जाता है।
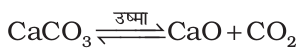
CO2 को अभिक्रिया से शीघ्रताशीघ्र हटाते रहते हैं, ताकि अभिक्रिया अग्र दिशा में पूर्ण हो सके। कैल्सियम अॉक्साइड एक श्वेत अक्रिस्टलीय ठोस पदार्थ है, जिसका गलनांक 2870 K है। वायुमंडल में खुला छोड़ने पर यह वायुमंडल से नमी एवं कार्बन डाइअॉक्साइड अवशोषित कर लेता है।
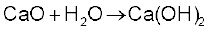
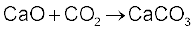
सीमित मात्रा में जल मिलाने पर चूने के पिंडक (Lumps) टूट जाते हैं। इस प्रक्रम को चूना बुझाने (Slaking of lime) की प्रक्रिया कहते हैं। बिना बुझे चूने को जब सोडा द्वारा बुझाया जाता है, तब सोडा लाइम (Soda Lime) प्राप्त होता है। यह क्षारीय अॉक्साइड होने के कारण उच्च ताप अम्लीय अॉक्साइडों से संयोग करता है।
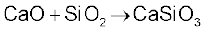
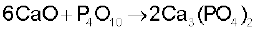
उपयोग
(i) सीमेंट के निर्माण के लिए प्राथमिक पदार्थ के रूप में तथा क्षार के सबसे सस्ते रूप में;
(ii) कास्टिक सोडा से सोडियम कार्बोनेट बनाने में; और
(iii) शर्करा के शुद्धिकरण में एवं रंजकों (Dye Stuffs) के निर्माण में।
कैल्सियम हाइड्रॉक्साइड अर्थात् बुझा चूना, Ca(OH)2
कैल्सियम हाइड्रॉक्साइड का निर्माण बिना बुझे चूने में जल मिलाकर किया जाता है। यह श्वेत पाउडर है। यह जल में अल्प विलेय है। इसके जलीय विलयन [चूने का पानी (Lime Water)] में जब कार्बन डाइअॉक्साइड गैस प्रवाहित की जाती है, तब कैल्सियम कार्बोनेट के विचरन के कारण चूने का पानी दूधिया हो जाता है।
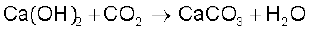
कार्बन डाइअॉक्साइड को अधिकता में प्रवाहित करने पर अवक्षेपित कैल्सियम कार्बोनेट जल में विलेय कैल्सियम हाइड्रोजन-कार्बोनेट में परिवर्तित हो जाता है।
CaCO3 + CO2 + H2O → Ca (HCO3)2
चूने का पानी क्लोरीन से अभिक्रिया कर हाइपोक्लोराइट (Hypochlorite) बना लेता है, जो विरजंक चूर्ण (ब्लीचि्ांग पाउडर) का एक अवयव है। 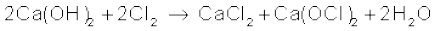
ब्लीचिंग पाउडर
उपयोग
(i) बृहद् स्तर पर चूना-लेप (Mortar) के रूप में भवन- निर्माण में;
(ii) रोगाणुनाशी (Disinfactant) प्रकृति के कारण सफेदी (White Wash) के रूप में; और
(iii) काँच के उत्पादन, चर्मशोधन उद्योग, विरंजक चूर्ण के उत्पादन एवं शर्करा-शोधन में।
कैल्सियम कार्बोनेट (CaCO3)
प्रकृति में कई रूपों, जैसे– चूना-पत्थर, खड़िया (Chalk), संगमरमर (Marble) आदि के रूप में चूना पाया जाता है। बुझे चूने पर कार्बन डाइअॉक्साइड गैस प्रवाहित कर या कैल्सियम क्लोराइड में सोडियम कार्बोनेट को मिलाकर इसे बनाया जाता है।
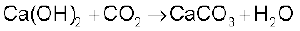
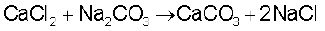
इस अभिक्रिया में कार्बन डाइअॉक्साइड के आधिक्य से बचना चाहिए, क्योंकि इसकी अधिकता में जल में घुलनशील कैल्सियम हाइड्रोजन-कार्बोनेट बन सकता है।
कैल्सियम कार्बोनेट श्वेत रवेदार पाउडर होता है। यह जल में लगभग अविलेय होता है। 1200 K पर गरम करने पर यह विघटित होकर कार्बन डाइअॉक्साइड देता है।
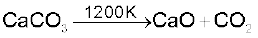
यह तनु अम्लों से अभिक्रिया करके कार्बन डाइअॉक्साइड मुक्त करता है।
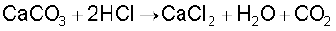
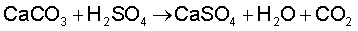
उपयोग
• संगमरमर के रूप में भवन-निर्माण में;
• बुझे चूने के निर्माण में;
• कैल्सियम कार्बोनेट को मैग्नीशियम कार्बोनेट के साथ लोहे जैसी धातुओं के निष्कर्षण में फ्लक्स (Flux) के रूप में;
• विशेष रूप से अवक्षेपित CaCO3 के प्रयोग से बृहद् रूप में उच्च गुणवत्ता वाले कागज के निर्माण में; और
• एेन्टासिड, टूथपेस्ट में अपघर्षक के रूप में, च्यूइंगम के संघटक एवं साैंदर्य प्रसाधनों में पूरक के रूप में।
कैल्सियम सल्फेट (प्लास्टर अॉफ पेरिस) CaSO4 . 1/2 H2O
यह कैल्सियम सल्फेट का अर्ध हाइड्रेट (Hemihydrate) है। इसे जिप्सम (CaSO4 . 2H2O) को 393K पर गरम करके प्राप्त किया जाता है।
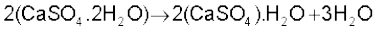
393 K से उच्च ताप पर क्रिस्टलीय जल नहीं बचता है एवं शुष्क कैल्सियम सल्फेट (CaSO4) बनता है। इसे ‘मृत तापित प्लास्टर’ (Dead Burnt Plaster) कहा जाता है। जल के साथ जमने की इसकी विशेष प्रकृति होती है। पर्याप्त मात्रा में जल मिलाने पर यह प्लास्टिक जैसा एक द्रव्य बनाता है, जो 5 से 15 मिनट में जमकर कठोर और ठोस हो जाता है।
उपयोग
प्लास्टर अॉफ पेरिस का बृहत्तर उपयोग भवन-निर्माण उद्योग के साथ-साथ टूटी हुई हड्डियों के प्लास्टर में भी होता है। इसका उपयोग दंत-चिकित्सा, अलंकरण-कार्य एवं मूर्तियों तथा अर्ध- प्रतिमाओं को बनाने में भी होता है।
सीमेन्ट
सीमेन्ट एक महत्त्वपूर्ण भवन-निर्माण सामग्री है। इसका उपयोग सर्वप्रथम ब्रिटेन में सन् 1824 में जोसेफ एस्पिडन ने किया था। इसे ‘पोर्टलैंड सीमेन्ट’ भी कहा जाता है, क्योंकि यह ब्रिटेन के पोर्टलैंड टापू पर प्राप्त प्राकृतिक चूने के पत्थर से मिलता- जुलता है। यह एक एेसा उत्पाद है, जो चूने के आधिक्य वाले पदार्थ CaO को अन्य पदार्थ (जैसे–मिट्टी, जिसमें सिलिका, SiO2 एवं एेलुमिनियम, लोहा तथा मैग्नेशियम के अॉक्साइड होते हैं) को मिलाकर बनाया जाता है। पोर्टलैंड सीमेन्ट का औसत संघटन है ः CaO, 50-60%, SiO2, 20-25%, Al2O3, 5-10%, MgO, 2-3%, Fe2O3, 1-2% एवं SO3 1-2%। एक अच्छी गुणवत्ता वाले सीमेन्ट में सिलिका (SiO2) एवं एेलुमिना (Al2O3) का अनुपात 2.5 से 4 के मध्य होना चाहिए एवं चूने (CaO) तथा अन्य कुल अॉक्साइडों, SiO2 और Al2O3 का अनुपात यथासंभव 2 के आस-पास होना चाहिए।
सीमेन्ट के निर्माण में कच्चे माल के रूप में चूने के पत्थर (Limestone) एवं चिकनी मिट्टी का उपयोग होता है। जब इन दोनों को तेजी से गरम किया जाता है तब ये संगलित होकर अभिक्रिया कर सीमेन्ट क्लिंकर (Cement Clinker) बनाते हैं। इस क्लिंकर में 2-3% (भारात्मक) जिप्सम (CaSO4.2H2O) मिश्रित कर सीमेन्ट बनाया जाता है। इस प्रकार पोर्टलैंड सीमेन्ट के मुख्य घटक डाइकैल्सियम सिलिकेट (Ca2SiO4) 26%, ट्राइकैल्सियम सिलिकेट (Ca3SiO5) 51% तथा ट्राइकैल्सियम एेलुमिनेट (Ca3Al2O6) 11% हैं।
सीमेन्ट का जमना
जल मिलाने पर सीमेन्ट जमकर कठोर हो जाता है। इसका कारण घटकों के अणुओं का जलयोजन एवं पुनः व्यवस्थित होना है। जिप्सम मिलाने का कारण सीमेन्ट के जमने के प्रक्रम को धीमा करना है ताकि यह पूरी तरह ठोस हो सके।
उपयोग
लोहा तथा स्टील के पश्चात् सीमेन्ट ही एक एेसा पदार्थ है, जो किसी राष्ट्र की उपयोगी वस्तुओं की श्रेणी में रखा जा सकता है। इसका उपयोग कंक्रीट (Concrete), प्रबलित कंक्रीट (Reinforced Concrete), प्लास्टरिंग, पुल-निर्माण, भवन-निर्माण आदि में किया जाता है।
10.10 मैग्नीशियम व कैल्सियम की जैव महत्ता
एक वयस्क व्यक्ति में करीब 25 ग्राम मैग्नीशियम एवं 1200 ग्राम कैल्सियम होता है, जबकि लोहा मात्र 5 ग्राम एवं ताँबा 0.06 ग्राम होता है। मानव-शरीर में इनकी दैनिक आवश्यकता 200-300 mg अनुमानित की गई है।
समस्त एन्ज़ाइम, जो फॉस्फेट के संचरण में ATP का उपयोग करते हैं, मैग्नीशियम का उपयोग सह-घटक के रूप में करते हैं। पौधों में प्रकाश-अवशोषण के लिए मुख्य रंजक (Pigment) क्लोरोफिल में भी मैग्नीशियम होता है। शरीर में कैल्सियम का 99% दाँतों तथा हड्डियों में होता है। यह अंतरतांत्रिकीय पेशीय कार्यप्रणाली, अंतरतांत्रिकीय प्रेषण, कोशिका झिल्ली अखंडता (Cell Membrane Integrity) तथा रक्त-स्कंदन (Blood-coagulation) में भी महत्त्वपूर्ण भूमिका निभाता है। प्लाज़्मा में कैल्सियम की सांद्रता लगभग 100 mgL-1 होती है। दो हॉर्मोन कैल्सिटोनिन एवं पैराथायराइड इसे बनाए रखते हैं। क्या आप जानते हैं कि हड्डी अक्रिय तथा अपरिवर्तनशील पदार्थ नहीं है, यह किसी मनुष्य में लगभग 400 mg प्रतिदिन के हिसाब से विलेयित और निक्षेपित होती है। इसका सारा कैल्सियम प्लाज़्मा में से ही गुजरता है।
सारांश
वर्ग 1 की क्षार धातुएं तथा वर्ग 2 की क्षारीय मृदा धातुएं संयुक्त रूप से आवर्त सारणी के s-ब्लॉक तत्त्वों की रचना करती हैं। इन्हें ‘क्षार धातुएँ’ कहने का कारण यह है कि इनके अॉक्साइड एवं हाइड्रॉक्साइड क्षारीय प्रकृति के होते हैं। क्षार धातुओं तथा क्षारीय मृदा धातुओं की पहचान उनके परमाणुओं के संयोजी कोशों में क्रमशः एक s-इलेक्ट्रॉन एवं दो s-इलेक्ट्रॉन के आधार पर होती है। ये अत्यंत अभिक्रियाशील धातुएं हैं, जो क्रमशः एक धनीय (M+) एवं द्विधनीय (M2+) आयन बनाती हैं।
क्षार धातुओं के बढ़ते हुए परमाणु-क्रमांक के साथ इनके भौतिक एवं रासायनिक गुणों में एक नियमित प्रवृत्ति पाई जाती है। वर्ग में ऊपर से नीचे व्यवस्थित क्रम में परमाण्वीय एवं आयनिक आकार में वृद्धि होती जाती है तथा आयनन एन्थैल्पी घटती जाती है। क्षारीय मृदा धातुओं के गुणों में भी लगभग इसी प्रकार की प्रवृत्ति पाई जाती है।
इन वर्गों में प्रत्येक वर्ग का प्रथम तत्त्व वर्ग 1 में लीथियम एवं वर्ग 2 में बेरीलियम अपने ठीक बाद वाले वर्ग के दूसरे तत्त्व से समानताएँ प्रदर्शित करता है। आवर्त सारणी में इस प्रकार की समानताओं को विकर्ण संबंध की संज्ञा दी जाती है। इन वर्गों के प्रथम तत्त्व अपने ही वर्ग के अन्य तत्त्वों से असमानताएँ प्रदर्शित करते हैं। क्षार धातुएं रजत श्वेत (Silver White), मुलायम एवं निम्न गलनांकी होती हैं। ये अत्यंत अभिक्रियाशील होती हैं। क्षार धातुओं के यौगिक मुख्य रूप से आयनिक होते हैं। इनके अॉक्साइड एवं हाइड्रॉक्साइड जल में विलेय होते हैं तथा प्रबल क्षार बनाते हैं। सोडियम के प्रमुख यौगिकों में सोडियम कार्बोनेट, सोडियम क्लोराइड, सोडियम हाइड्रॉक्साइड एवं सोडियम हाइड्रोजन कार्बोनेट हैं। सोडियम हाइड्रॉक्साइड का निर्माण कास्टनर-कैलनर विधि एवं सोडियम कार्बोनेट का निर्माण साल्वे विधि के अनुसार किया जाता है।
क्षारीय मृदा धातुओं का रसायन अधिकांशतः क्षार धातुओं के समान है। क्षारीय मृदा धातुओं के छोटे परमाण्वीय तथा आयनिक आकार एवं बढ़े हुए धनायनिक आवेश के कारण कुछ असमानताएँ उत्पन्न होती हैं। इनके अॉक्साइड एवं हाइड्रॉक्साइड, क्षार धातुओं के अॉक्साइड हाइड्रॉक्साइड की तुलना में कम क्षारीय होते हैं। कैल्सियम की औद्योगिक महत्ता के यौगिकों में कैल्सियम अॉक्साइड (चूना), कैल्सियम हाइड्रॉक्साइड (बुझा चूना), कैल्सियम सल्फेट (प्लास्टर अॉफ पेरिस), कैल्सियम कार्बोनेट (चूना-पत्थर) तथा सीमेन्ट प्रमुख हैं। पोर्टलैंड सीमेन्ट एक महत्त्वपूर्ण निर्माण-सामग्री है। चूना-पत्थर एवं चिकनी मिट्टी के चूर्ण-मिश्रण को घूर्णी भट्ठी में गरम करने के उपरांत इसका निर्माण किया जाता है। इस प्रकार प्राप्त क्लिंकर में जिप्सम की कुछ मात्रा (2-3%) मिलाकर सीमेन्ट का महीन पाउडर प्राप्त किया जाता है। ये सभी पदार्थ विभिन्न क्षेत्रों में विविध प्रकार के उपयोग दर्शाते हैं।
एकल संयोजी सोडियम एवं पोटैशियम आयन तथा द्विसंयोजी मैग्नीशियम एवं कैल्सियम आयन जैव तरलों (Biological Fluids) में उच्च अनुपातों में पाए जाते हैं। ये आयन कई जैव क्रियाओं, जैसे–आयन-संतुलन का निर्वाह, शिरा-आवेग संचरण (Nerve Impulse Conduction) आदि में महत्त्वपूर्ण भूमिका निभाते हैं।
अभ्यास
10.1 क्षार धातुओं के सामान्य भौतिक तथा रासायनिक गुण क्या हैं?
10.2 क्षारीय मृदा धातुओं के सामान्य अभिलक्षण एवं गुणों में आवर्तिता की विवेचना कीजिए।
10.3 क्षार धातुएं प्रकृति में क्यों नहीं पाई जाती हैं?
10.4 Na2O2 में सोडियम की अॉक्सीकरण अवस्था ज्ञात कीजिए।
10.5 पोटैशियम की तुलना में सोडियम कम अभिक्रियाशील क्यों है? बताइए।
10.6 निम्नलिखित के संदर्भ में क्षार धातुओं एवं क्षारीय मृदा धातुओं की तुलना कीजिए–
(क) आयनन एन्थैल्पी, (ख) अॉक्साइडों की क्षारकता, (ग) हाइड्रॉक्साइडों की विलेयता।
10.7 लीथियम किस प्रकार मैग्नीशियम से रासायनिक गुणों में समानताएं दर्शाता है?
10.8 क्षार धातुएं तथा क्षारीय मृदा धातुएं रासायनिक अपचयन विधि से क्यों नहीं प्राप्त किए जा सकते हैं? समझाइए।
10.9 प्रकाश वैद्युत सेल में लीथियम के स्थान पर पोटैशियम एवं सीजियम क्यों प्रयुक्त किए जाते हैं?
10.10 जब एक क्षार धातु को द्रव अमोनिया में घोला जाता है, तब विलयन विभिन्न रंग प्राप्त कर सकता है। इस प्रकार के रंग-परिवर्तन का कारण बताइए।
10.11 ज्वाला को बेरीलियम एवं मैग्नीशियम कोई रंग नहीं प्रदान करते हैं, जबकि अन्य क्षारीय मृदा धातुएं एेसा करती हैं। क्यों?
10.12 साल्वे प्रक्रम में होने वाली विभिन्न अभिक्रियाओं की विवेचना कीजिए।
12.13 पोटैशियम कार्बाेनेट साल्वे विधि द्वारा नहीं बनाया जा सकता है। क्यों?
10.14 Li2CO3 कम ताप पर एवं Na2CO3 उच्च ताप पर क्यों विघटित होता है?
10.15 क्षार धातुओं के निम्नलिखित यौगिकों की तुलना क्षारीय मृदा धातुओं के संगत यौगिकों से विलेयता एवं तापीय स्थायित्व के आधार पर कीजिए– (क) नाइट्रेट (ख) कार्बाेनेट (ग) सल्फेट।
10.16 सोडियम क्लोराइड से प्रारंभ करके निम्नलिखित को आप किस प्रकार बनाएँगे?
(i) सोडियम धातु
(ii) सोडियम हाइड्रॉक्साइड
(iii) सोडियम परॉक्साइड
(iv) सोडियम कार्बाेनेट
10.17 क्या होता है, जब–
(i) मैग्नीशियम को हवा में जलाया जाता है।
(ii) बिना बूझे चूने को सिलीका के साथ गरम किया जाता है।
(iii) क्लोरीन बुझे चूने से अभिक्रिया करती है।
(iv) कैल्सियम नाइट्रेट को गरम किया जाता है।
10.18 निम्नलिखित में से प्रत्येक के दो-दो उपयोग बताइए–
(i) कास्टिक सोडा
(ii) सोडियम कार्बाेनेट
(iii) बिना बुझा चूना
10.19 निम्नलिखित की संरचना बताइए– (i) BeCl2 (वाष्प), (ii) BeCl2 (ठोस)
10.20 सोडियम एवं पोटैशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में विलेय हैं, जबकि मैग्नीशियम एवं कैल्सियम के संगत लवण जल में अल्प विलेय हैं। समझाइए।
10.21 निम्नलिखित की महत्ता बताइए–
(i) चूना-पत्थर (ii) सीमेन्ट (iii) प्लास्टर अॉफ पेरिस
10.22 लीथियम के लवण साधारणतया जलयोजित होते हैं, जबकि अन्य क्षार-धातुओं के लवण साधारणतया निर्जलीय होते हैं। क्यों?
10.23 LiF जल में लगभग अविलेय होता है, जबकि LiCl न सिर्फ जल में, बल्कि एेसीटोन में भी विलेय होता है। कारण बताइए?
10.24 जैव द्रवों में सोडियम, पोटैशियम, मैग्नीशियम एवं कैल्सियम की सार्थकता बताइए।
10.25 क्या होता है, जब–
(i) सोडियम धातु को जल में डाला जाता है।
(ii) सोडियम धातु को हवा की अधिकता में गरम किया जाता है।
(iii) सोडियम परॉक्साइड को जल में घोला जाता है।
10.26 निम्नलिखित में से प्रत्येक प्रेक्षण पर टिप्पणी लिखिए–
(क) जलीय विलयनों में क्षार धातु आयनों की गतिशीलता Li+<Na+<K+<Rb+<Cs+ क्रम में होती है।
(ख) लीथियम एेसी एकमात्र क्षार धातु है, जो नाइट्राइड बनाती है।
(ग) 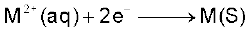 हेतु EV (जहाँ M = Ca, Sr या Ba ) लगभग स्थिरांक है।
हेतु EV (जहाँ M = Ca, Sr या Ba ) लगभग स्थिरांक है।
10.27 समझाइए कि क्यों–
(क) Na2CO3 का विलयन क्षारीय होता है।
(ख) क्षार धातुएं उनके संगलित क्लोराइडों के वैद्युत-अपघटन से प्राप्त की जाती हैं।
(ग) पोटैशियम की तुलना में सोडियम अधिक उपयोगी है।
10.28 निम्नलिखित के मध्य क्रियाओं के संतुलित समीकरण लिखिए–
(क) Na2CO3 एवं जल
(ख) KO2 एवं जल
(ग) Na2O एवं CO2
10.29 आप निम्नलिखित तथ्यों को कैसे समझाएँगे–
(क) BeO जल में अविलेय है, जबकि BeSO4 विलेय है।
(ख) BaO जल में विलेय है, जबकि BaSO4 अविलेय है।
(ग) ईथानॉल में LiI, KI की तुलना में अधिक विलेय है।
10.30 इनमें से किस क्षार-धातु का गलनांक न्यूनतम है?
(क) Na (ख) K (ग) Rb (घ) Cs
10.31 निम्नलिखित में से कौन सी क्षार-धातु जलयोजित लवण देती है?
(क) Li (ख) Na (ग) K (घ) Cs
10.32 निम्नलिखित में कौन सी क्षारीय मृदा धातु कार्बाेनेट ताप के प्रति सबसे अधिक स्थायी है?
(क) MgCO3 (ख) CaCO3 (ग) SrCO3 (घ) BaCO3
