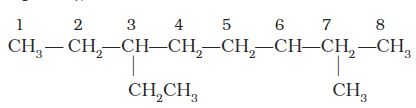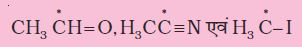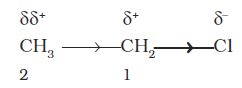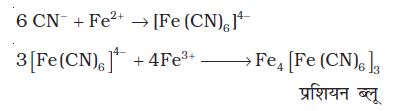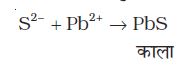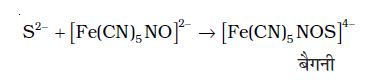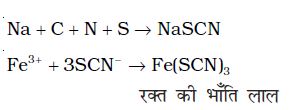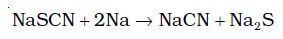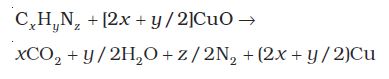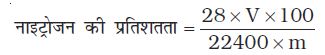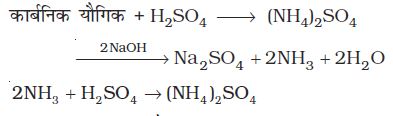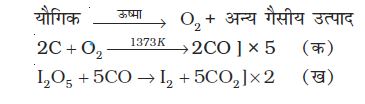Table of Contents
एकक 12
कार्बनिक रसायन: कुछ आधारभूत सिद्धांत तथा तकनीकें
Organic Chemistry: some basic principles & Techniques
उद्देश्य
इस एकक के अध्ययन के बाद आप –
• कार्बन की चतुर्संयोजकता तथा कार्बनिक अणुआें की आकृतियों को समझ सकेंगे;
• कार्बनिक अणुओं की संरचनाओं को विभिन्न प्रकार से लिख सकेंगे;
• कार्बनिक यौगिकों का वर्गीकरण कर सकेंगे;
• नामांकरण की IUPAC पद्धति के अनुसार यौगिकों को नाम दे सकेंगे तथा उन नामों के आधार पर उनकी संरचना लिख सकेंगे;
• कार्बनिक अभिक्रियाओं की क्रियाविधि की धारणा को समझ सकेंगे;
• कार्बनिक यौगिकों की संरचना तथा अभिक्रियाशीलता पर इलेक्ट्रॉन-विस्थापन के प्रभाव की व्याख्या कर सकेंगे;
• कार्बनिक अभिक्रियाओं के प्रकार को पहचान सकेंगे;
• कार्बनिक यौगिकों के शुद्धिकरण की तकनीकों को सीख सकेंगे;
• कार्बनिक यौगिकों के गुणात्मक विश्लेषण में सम्मिलित रासायनिक अभिक्रियाओं को लिख सकेंगे;
• कार्बनिक यौगिकों के मात्रात्मक विश्लेषण में सम्मिलित सिद्धांतों को समझ सकेंगे।
पिछले एकक में आपने सीखा कि कार्बन का एक अद्वितीय गुण होता है, जिसे ‘शृंखलन’ (Catenation) कहते हैं। इस कारण यह अन्य कार्बन परमाणुआें के साथ सहसंयोजक आबंध बनाता है। यह अन्य तत्त्वों, जैसे–हाइड्रोजन, अॉक्सीजन, नाइट्रोजन, सल्फर, फास्फोरस तथा हैलोजेनों के परमाणुओं के साथ भी सहसंयोजक आबंध बनाता है। इस प्रकार के यौगिकों का अध्ययन रसायन शास्त्र की एक अलग शाखा के अंतर्गत किया जाता है, जिसे कार्बनिक रसायन कहते हैं। इस एकक में कुछ आधारभूत सिद्धांत तथा विश्लेषण-तकनीकें सम्मिलित हैं, जो कार्बनिक यौगिकों के विरचन तथा गुणों को समझने के लिए आवश्यक हैं।
12.1 सामान्य प्रस्तावना
पृथ्वी पर जीवन को बनाए रखने के लिए कार्बनिक यौगिक अनिवार्य हैं। इसके अंतर्गत जटिल अणु हैं, जैसे–आनुवांशिक सूचना वाले डीअॉक्सी राइबोन्यूक्लीक अम्ल (डी.एन.ए.) तथा प्रोटीन, जो हमारे रक्त, माँसपेशी एवं त्वचा के आवश्यक यौगिक बनाते हैं। कार्बनिक यौगिक कपड़ों, ईधनों, बहुलकों, रंजकों, दवाओं आदि पदार्थों में होते हैं। इन यौगिकों के अनुप्रयोगों के ये कुछ महत्त्वपूर्ण क्षेत्र हैं।
कार्बनिक रसायन का विज्ञान लगभग 200 वर्ष पुराना है। सन् 1780 के आसपास रसायनज्ञों ने पादपों तथा जंतुओं से प्राप्त कार्बनिक यौगिकों एवं खनिज स्रोतों से विरचित अकार्बनिक यौगिकों के बीच विभेदन करना आरंभ कर दिया था। स्वीडिश वैज्ञानिक बर्जिलियस ने प्रतिपादित किया कि ‘जैवशक्ति’ (Vital force) कार्बनिक यौगिकों के निर्माण के लिए उत्तरदायी है, जब सन् 1828 में एफ. वोलर ने कार्बनिक यौगिक यूरिया का संश्लेषण अकार्बनिकयौगिक अमोनियम सायनेट से किया, तब यह धारणा निर्मूल सिद्ध हो गई।
कोल्बे (सन् 1845) द्वारा एेसिटिक अम्ल तथा बर्थलोट (सन् 1856) द्वारा मेथैन के नवीन संश्लेषण के परिणामस्वरूप दर्शाया गया कि कार्बनिक यौगिकों को अकार्बनिक स्रोतों से प्रयोगशाला में संश्लेषित किया जा सकता है।
सहसंयोजक आबंधन के इलेक्ट्रॉनिक सिद्धांत के विकास ने कार्बनिक रसायन को आधुनिक रूप दिया।
12.2 कार्बन की चतुर्संयोजकता:
कार्बनिक यौगिकों की आकृतियाँ
12.2.1 कार्बनिक यौगिकों की आकृतियाँ
आण्विक संरचना की मौलिक अवधारणाओं का ज्ञान कार्बनिक यौगिकों के गुणों को समझने और उनकी प्रागुक्ति करने में सहायक होता है। संयोजकता सिद्धांत एवं आण्विक संरचना को आप एकक-4 में समझ चुके हैं। आप यह भी जानते हैं कि कार्बन की चतुर्संयोजकता तथा इसके द्वारा सहसंयोजक आबंध- निर्माण को इलेक्ट्रॉनीय विन्यास तथा s और p कक्षकों के संकरण (Hybridisation) के आधार पर समझाया जा सकता है। आपको यह याद होगा कि मेथैन (CH4), एथीन (C2H4) तथा एथाइन (C2H2) के समान अणुओं की आकृतियों को कार्बन परमाणुओं द्वारा निर्मित क्रमशः sp3, sp2 तथा sp संकर कक्षकों की सहायता से स्पष्ट किया जा सकता है।
संकरण किसी यौगिक में आबंध लंबाई तथा आबंध एंथैल्पी (आबंध-सामर्थ्य) को प्रभावित करता है। sp संकरित कक्षक में s गुण अधिक होने के कारण यह नाभिक के समीप होता है। अतः sp संकरित कक्षक द्वारा निर्मित आबंध sp3 संकरित कक्षक द्वारा निर्मित आबंध की अपेक्षा अधिक निकट तथा अधिक सामर्थ्यवान होता है। sp2 संकरित कक्षक sp तथा sp3 संकरित कक्षक के मध्यवर्ती होता है। अतः इससे बनने वाले आबंध की लंबाई तथा एंथैल्पी–दोनों के मध्यवर्ती होती हैं। संकरण का परिवर्तन कार्बन की विद्युत् ऋणात्मकता को प्रभावित करता है। कार्बन पर स्थित संकरित कक्षक की s प्रकृति बढ़ने पर उसकी विद्युत् ऋणात्मकता में वृद्धि हो जाती है। अतः sp संकरित कक्षक (जिसमें s-प्रकृति 50% है) sp2 तथा sp3 संकरित कक्षकों की अपेक्षा अधिक विद्युत् ऋणात्मक होते हैं। संकरित कक्षकों की अपेक्षित विद्युत् ऋणात्मकता का प्रभाव कार्बनिक यौगिकों के भौतिक तथा रासायनिक गुणों पर भी पड़ता है, जिनका वर्णन आगामी एककों में किया गया है।
12.1.2 π आबंधों के कुछ अभिलक्षण
π (पाइ) आबंध के निर्माण में दो निकटवर्ती परमाणुओं के p कक्षकों का समानांतर अभिविन्यास समुचित पार्श्व अतिव्यापन के लिए आवश्यक है। अतः CH2= CH2 अणु में सभी परमाणु एक ही तल में होने चाहिए। इस अणु के प्रत्येक कार्बन पर उपस्थित p- कक्षक समानांतर तथा अणु के तल के लंबवत होते हैं। एक CH2 को दूसरे के सापेक्ष में घुमाने पर p- कक्षकों के अधिकतम अतिव्यापन में बाधा उत्पन्न होती है। फलतः (C=C) कार्बन-कार्बन द्विआबंध के चारों ओर घूर्णन प्रतिबंधित हो जाता है। π आबंध का इलेक्ट्रॉन आवेशअभ्र आबंधित परमाणुओं के तल के ऊपर एवं नीचे स्थित होता है। सामान्यतः π आबंध बहुआबंधयुक्त यौगिकों में मुख्य सक्रिय केंद्र उपलब्ध कराते हैं। यह आक्रामक अभिकर्मकों के लिए इलेक्ट्रॉनों को आसानी से उपलब्ध कराता है।
उदाहरण 12.1
निम्नलिखित अणुओं में से प्रत्येक में कितने σ तथा π आबंध हैं?
(क) 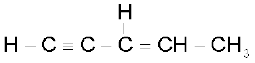
(ख) CH2= C=CH CH3
हल
(क) σ C-C: 4; σ C-H: 6; π C = C:I; πC C:2
C:2
(ख) σ C-C:3; σ C-H: 6; π C = C;2
उदाहरण 12.2
निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था क्या है?
(क) CH3Cl, (ख) (CH3)2CO, (ग) CH3CN, (घ) HCONH2, (ङ) CH3 CH=CHCN
हल
(क) sp3, (ख) sp3, sp2, (ग) sp3, sp,
(घ) sp2, (ङ) sp3, sp2, sp2, sp
उदाहरण 12.3
निम्नलिखित यौगिकों में कार्बन की संकरण अवस्था एवं अणुओं की आकृतियाँ क्या हैं?
(क) H2C = O, (ख) CH3F, (ग) HC ≡ N
हल
(क) sp2 संकरित कार्बन, त्रिकोणीय समतल,
(ख) sp3 संकरित कार्बन, चतुष्फलकीय, (ग) sp3 संकरित कार्बन, रैखीय।
12.3 कार्बनिक यौगिक का संरचनात्मक निरूपण
12.3.1 पूर्ण संघनित तथा आबंध-रेखा संरचनात्मक सूत्र
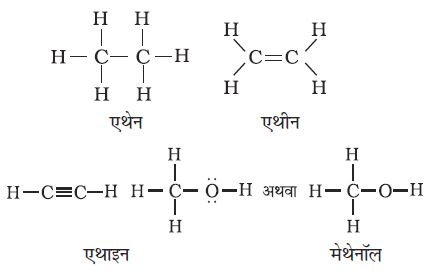
कार्बनिक यौगिकों के संरचनात्मक सूत्र लिखने की कई विधियाँ हैं। इनमें कुछ विधियाँ लूइस-संरचना अथवा बिंदु-संरचना, लघु आबंध संरचना (Dash structure), संघनित संरचना (Condensed structure) तथा आबंध रेखा संरचना है। लघु रेखा (–) द्वारा इलेक्ट्रॉन-युग्म सहसंयोजक आबंध को दर्शाकर लूइस संरचना सरल की जा सकती है। आबंध बनाने वाले इलेक्ट्रॉनों पर एेसे संरचनात्मक सूत्र केंद्रित होते हैं। एकल आबंध, द्विआबंध तथा त्रिआबंध को क्रमशः एक लघु रेखा (–), द्विलघु रेखा (=) तथा त्रिलघु रेखा ( ) द्वारा दर्शाया जाता है। विषम परमाणुओं (जैसे–अॉक्सीजन, नाइट्रोजन, सल्फर, हैलोजेन आदि) पर उपस्थित एकाकी इलेक्ट्रॉन–युग्म को दो बिंदुओं (..) द्वारा दर्शाया जाता है, परंतु कभी-कभी एेसा नहीं भी होता है। अतः एथेन (C2H6), एथीन (C2H4), एथाइन (C2H2) तथा मेथेनॉल (CH3 OH) के संरचनात्मक सूत्रों को निम्नलिखित प्रणाली द्वारा निरूपित किया जाता है। एेसे संरचनात्मक निरूपणों को ‘पूर्ण संरचनात्मक सूत्र’ (Complete structure formula) कहा जाता है।
) द्वारा दर्शाया जाता है। विषम परमाणुओं (जैसे–अॉक्सीजन, नाइट्रोजन, सल्फर, हैलोजेन आदि) पर उपस्थित एकाकी इलेक्ट्रॉन–युग्म को दो बिंदुओं (..) द्वारा दर्शाया जाता है, परंतु कभी-कभी एेसा नहीं भी होता है। अतः एथेन (C2H6), एथीन (C2H4), एथाइन (C2H2) तथा मेथेनॉल (CH3 OH) के संरचनात्मक सूत्रों को निम्नलिखित प्रणाली द्वारा निरूपित किया जाता है। एेसे संरचनात्मक निरूपणों को ‘पूर्ण संरचनात्मक सूत्र’ (Complete structure formula) कहा जाता है।
इन संरचना–सूत्रों को कुछ या सारे सहसंयोजक आबंधों को हटाकर तथा एक परमाणु से जुड़े समान समूह को कोष्ठक में लिखकर उनकी संख्या को पादांक में प्रदर्शित कर, संक्षिप्त किया जा सकता है। इन संक्षिप्त सूत्रों को ‘संघनित संरचनात्मक सूत्र’ (Condenstructural formula) कहते हैं। अतः एथेन, एथीन, एथाइन तथा मेथेनॉल को इस प्रकार लिखा जा सकता है–
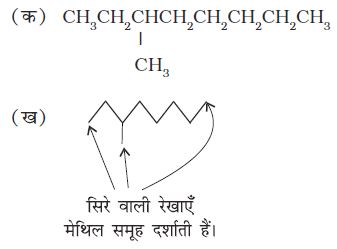
इस प्रकार, CH3CH2CH2CH2CH2CH2CH2CH3 को और भी संघनित रूप CH3 (CH2)6 CH3 द्वारा प्रदर्शित किया जा सकता है। इसे और सरल बनाने के लिए कार्बनिक रसायनज्ञों ने संरचनाओं को निरूपित करने हेतु केवल रेखाओं का उपयोग किया। इसे आबंध-रेखा संरचनात्मक सूत्र (bond-line structural) में कार्बन तथा हाइड्रोजन परमाणुओं को नहीं लिखा जाता, बल्कि कार्बन-कार्बन आबंधों को टेढ़ी-मेढ़ी (जिग-जैग) रेखाओं द्वारा दर्शाया जाता है। केवल अॉक्सीजन, क्लोरीन, नाइट्रोजन इत्यादि परमाणुओं को विशेष रूप से लिखा जाता है। सिरे पर स्थित रेखा मेथिल (—CH3) समूह इंगित करती है (जब तक किसी क्रियात्मक समूह द्वारा नहीं दर्शाया गया हो)। आंतरिक रेखाएँ उन कार्बन परमाणुओं को इंगित करती हैं, जो अपनी संयोजकता को पूर्ण करने के लिए आवश्यक हाइड्रोजन से आबंधित होते हैं। जैसे–
(i) 3-मेथिलअॉक्टेन को निम्नलिखित रूपों में दर्शाया जा सकता है–
(ii) 3–ब्रोमोब्यूटेन को दर्शाने के विभिन्न तरीके ः
(क) CH3CH BrCH2CH3
(ख) 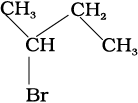
(ग) 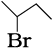
चक्रीय यौगिकों में आबंध-रेखा सूत्रों को इस प्रकार दर्शाया जा सकता है–
 ≡
≡ 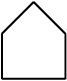
साइक्लोप्रोपेन

साइक्लोपेन्टेन
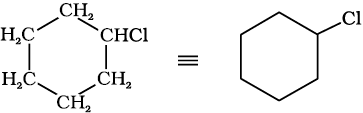
क्लोरोसाइक्लोहेक्सेन
उदाहरण 12.4
निम्नलिखित संघनित सूत्रों को पूर्ण संरचनात्मक सूत्रों में लिखिए–
(क) CH3CH2COCH2CH3
(ख) CH3CH=CH(CH2)3CH3
हल
(क) 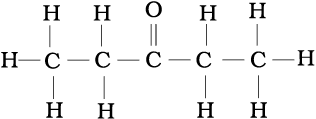
उदाहरण 12.5
निम्नलिखित यौगिकों का संरचना–सूत्र संघनित रूप में लिखिए तथा उनका आबंध-रेखा सूत्र भी दीजिए–
(क) HOCH2 CH2CH2CH (CH3) CH
(CH3) CH3
(ख) 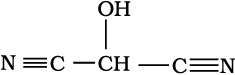
हल
संघनित सूत्रः
(क) HO(CH2)3 CHCH3 CH(CH3)2
(ख) HOCH(CN)2
आबंध रेखा सूत्र
(क) 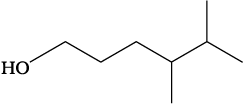
(ख) 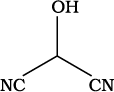
उदाहरण 12.6
निम्नलिखित आबंध रेखा-सूत्रों को विस्तारित रूप में कार्बन तथा हाइड्रोजन सहित सभी परमाणुओं को दर्शाते हुए लिखिए–
(क) 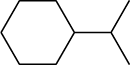
(ख) 
(ग) 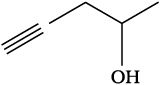
(घ) 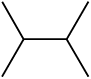
हल
(क) 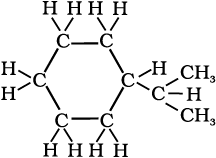
(ख) 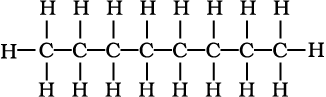
(ग) 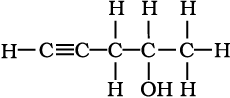
(घ) 
12.3.2 कार्बनिक यौगिकों का त्रिविमी सूत्र
कागज पर कार्बनिक यौगिकों के त्रिविमी (3D) सूत्र में कुछ पद्धतियों का प्रयोग किया जाता है। उदाहरणार्थ–द्विविमी संरचना को त्रिविमी संरचना में देखने के लिए ठोस तथा डैश वेज सूत्र का उपयोग किया जाता है। इन सूत्रों में ठोस वेज उस आबंध को दर्शाता है, जो कागज के तल से दर्शक की ओर प्रक्षेपी है और डैश वेज विपरीत दिशा में, अर्थात्् दर्शक के दूर जाने वाले आबंध को दर्शाता है। कागज के तल में स्थित आबंध को साधारण रेखा (–) द्वारा प्रदर्शित किया जाता है। चित्र 12.1 में मेथैन अणु का त्रिविमी सूत्र दर्शाया गया है।
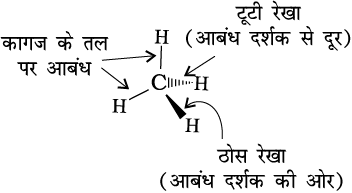
चित्र 12.1 CH4 के वेज तथा डैश सूत्र प्रदर्शन
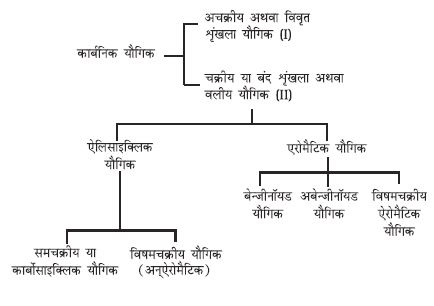
12.4 कार्बनिक यौगिकों का वर्गीकरण
कार्बनिक यौगिकों की वर्तमान बड़ी संख्या और बढ़ती हुई संख्या के कारण इन्हें संरचनाओं के आधार पर वर्गीकृत करना आवश्यक हो गया है। कार्बनिक यौगिकों को मोटे तौर पर इस प्रकार वर्गीकृत किया गया है–
आण्विक मॉडल
कार्बनिक अणुओं की त्रिविमी आकृति आण्विक मॉडलों की सहायता से भली-भाँति समझी जा सकती है। लकड़ी या प्लास्टिक या धातु के बने ये मॉडल बाज़ार में उपलब्ध होते है। सामान्यतः तीन प्रकार के आण्विक मॉडलों का उपयोग किया जाता है– (1) फ्रेमवर्क, अर्थात् ढाँचागत मॉडल, (2) बॉल तथा स्टिक, अर्थात् गेंद और छड़ी मॉडल तथा (3) स्पेस फिलिंग, अर्थात् स्थानीय पूरक मॉडल। फ्रेमवर्क मॉडल अणु में केवल आबंधों को दर्शाता है। इसमें परमाणु नहीं दिखाए जाते। यह मॉडल अणु के परमाणुओं के आकार की अनदेखी करते हुए आबंधों का प्रारूप दर्शाता है। बॉल तथा स्टिक मॉडल में आबंध तथा परमाणु–दोनाें को दर्शाया जाता है। बॉल परमाणु को दर्शाते हैं, जबकि स्टिक आबंध को दर्शाती है। असंतृप्त अणुओं (जैसे C=C) को दर्शाने के लिए स्टिक के स्थान पर स्प्रिंग प्रयुक्त की जाती है। स्पेस-फिलिंग मॉडल में प्रत्येक परमाणु का आपेक्षिक आकार प्रदर्शित किया जाता है, जो उसकी वांडरवाल्स त्रिज्या पर आधारित होता है। इस मॉडल में आबंध नहीं दर्शाए जाते हैं। यह अणु में प्रत्येक परमाणु द्वारा घेरे गए आयतन को प्रदर्शित करता है। इन मॉडलों के अतिरिक्त आण्विक मॉडल के लिए कंप्यूटर ग्राफिक्स का उपयोग किया जा सकता है।
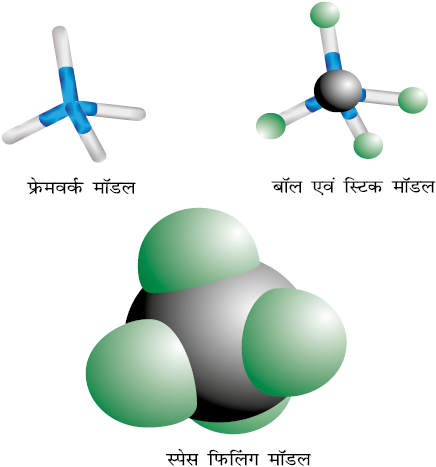
चित्र 12.2
I अचक्रीय अथवा विवृत शृंखला यौगिक
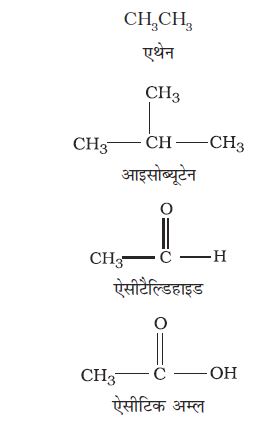
इन यौगिकों को एेलिफेटिक (वसीय यौगिक) भी कहा जाता है, जिनमें सीधा या शाखित शृंखला यौगिक होते हैं। जैसे–
II चक्रीय या बंद शृंखला अथवा वलीय यौगिक
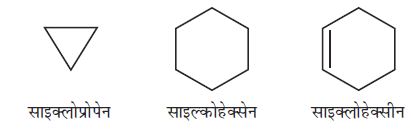
(क) एेलिसाइक्लिक यौगिक
एेलिसाइक्लिक (एेलिफेटिक चक्रीय) यौगिकों में कार्बन परमाणु जुड़कर एक समचक्रीय (Homocyclic) वलय बनाते हैं।
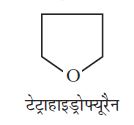
कभी-कभी वलय में कार्बन परमाणु के अलावा अन्य परमाणु जुड़कर विषमचक्रीय वलय बनाते हैं। टैट्राहाइड्रोफ्यूरैन इस प्रकार के यौगिकों का एक उदाहरण
ये एलिफेटिक यौगिकों के समान कुछ गुणधर्म प्रदर्शित करते हैं।
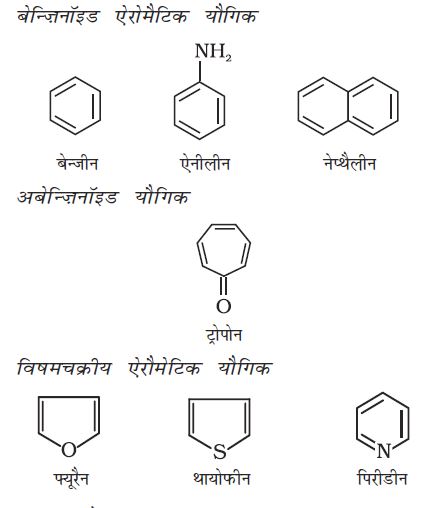
(ख) एेरोमैटिक यौगिक
एेरोमैटिक यौगिक एक विशेष प्रकार के यौगिक हैं, जिनके विषय में आप एकक 13 में विस्तार से अध्ययन करेंगे। इनमें बेंज़ीन तथा अन्य संबंधित चक्रीय यौगिक (बेन्ज़िनॉइड) सम्मिलित हैं। एेलिसाइक्लिक यौगिक के समान एेरोमैटिक यौगिकों की वलय में विषम परमाणु हो सकते हैं। एेसे यौगिकों को ‘विषमचक्रीय एेरोमैटिक यौगिक’ कहा जाता है। इन यौगिकों के कुछ उदाहरण ये हैं–
कार्बनिक यौगिकों को क्रियात्मक समूहों के आधार पर सजातीय श्रेणियों (Honologous series) में वर्गीकृत किया जाता है।
12.4.1 क्रियात्मक समूह या प्रकार्यात्मक समूह
किसी कार्बनिक यौगिक की कार्बन शृंखला से जुड़ा परमाणु या परमाणुओं का समूह, जो कार्बनिक यौगिकों में अभिलाक्षणिक रासायनिक गुणों के लिए उत्तरदायी होता है, क्रियात्मक समूह या प्रकार्यात्मक समूह (Functional Group) कहलाता है। उदाहरणार्थ– हाइड्रॉक्सिल समूह (- OH) एेल्डिहाइड समूह (- CHO) कार्बोक्सिलिक अम्ल-समूह (- COOH) आदि।
12.4.2 सजातीय श्रेणियाँ
कार्बनिक यौगिकों के समूह अथवा एेसी श्रेणी, जिसमें एक विशिष्ट क्रियात्मक समूह हो, सजातीय श्रेणी बनाते हैं। इसके सदस्यों को ‘सजात’ (Homologous) कहते हैं। सजातीय श्रेणी के सदस्यों को एक सामान्य सूत्र द्वारा प्रदर्शित किया जा सकता है। इसके क्रमागत सदस्यों के अणुस्त्रों में मध्य - CH2 इकाई का अंतर होता है। कार्बनिक यौगिकों की कई सजातीय श्रेणियाँ हैं। इनमें से कुछ हैं–एेल्केन, एेल्कीन, एेल्काइन, एेल्किल हैलाइड, एेल्केनॉल, एेल्कनैल, एेल्केनोन, एेल्केनॉइक अम्ल, एेमीन इत्यादि।
यह भी संभव है कि किसी यौगिक में दो या अधिक समान अथवा भिन्न-भिन्न प्रकार्यात्मक (क्रियात्मक) समूह हो, यह बहुक्रियात्मक यौगिक प्रदान करते हैं।
12.5 कार्बनिक यौगिकों की नामपद्धति
कार्बनिक रसायन लाखों कार्बनिक यौगिकों से संबंधित है। उनकी स्पष्ट पहचान के लिए यौगिकों के नामांकन की एक सुव्यवस्थित विधि विकसित की गई है, जिसे आई.यू.पी.ए.सी. (IUPAC Internatinal Union of Pure And Applied Chemistry) विधि कहते हैं। इस सुव्यवस्थित नामांकन प्रणाली में यौगिकों के नाम को उसकी संरचना से सहसंबंधित किया गया है, जिससे पढ़ने या सुनने वाला व्यक्ति यौगिक के नाम के आधार पर उसकी संरचना उत्पन्न कर सके।
आई.यू.पी.ए.सी. पद्धति से पूर्व कार्बनिक यौगिकों का नाम उनके स्रोत अथवा किसी गुण के आधार पर दिया जाता था। उदाहरणार्थ– सिट्रिक अम्ल का नाम उसके सिट्रस फलों में पाए जाने के कारण दिया गया है। लाल चींटी में पाए जाने वाले अम्ल का नाम ‘फॉर्मिक अम्ल’ दिया गया है, क्योंकि चींटी के लिए लैटिन शब्द ‘फार्मिका’ (Formica) है। यह नाम पारंपरिक है। ये रूढ़ (trivial) अथवा सामान्य (Common) नाम कहलाते हैं। वर्तमान समय में भी कुछ यौगिकों को सामान्य नाम दिए जाते हैं। उदाहरणार्थ– कुछ वर्ष पूर्व प्राप्त कार्बन के एक नवीन रूप C60 गुच्छे (क्लस्टर) का नाम ‘बकमिंस्टर फुलेरीन’ (Buckminster fullerene) रखा गया, क्योंकि इसकी आकृति अल्पांतरी गुंबदों (Geodesic Domes) से मिलती-जुलती है। प्रसिद्ध अमेरिकी वास्तुशिल्पी आर. बुकमिंस्टर फुलेर (R. Buckminster fuller) ने इन्हें लोकप्रिय बनाया था। कुछ यौगिकों के संबंध में आई.यू.पी.ए.सी. नाम अधिक लंबे अथवा जटिल होते हैं। इस कारण भी उनका सामान्य नाम रखना आवश्यक हो जाता है। कुछ कार्बनिक यौगिकों के सामान्य नाम सारणी 12.1 में दिए गए हैं।
12.5.1 आई.यू.पी.ए.सी. नामकरण
किसी कार्बनिक यौगिक को सुव्यवस्थित नाम देने के लिए मूल हाइड्रोकार्बन तथा उससे जुड़े क्रियात्मक समूहों की पहचान करनी होती है। नीचे दिए गए उदाहरण को देखिए।
जनक हाइड्रोकार्बन के नाम में उपयुक्त पूर्वलग्न, अंतर्लग्न तथा अनुलग्न को संयुक्त करके वास्तविक यौगिक का नाम प्राप्त किया जा सकता है। केवल कार्बन तथा हाइड्रोजन युक्त यौगिक ‘हाइड्रोकार्बन’ कहलाते हैं। कार्बन-कार्बन एकल आबंधवाले हाइड्रोकार्बन को ‘संतृप्त हाइड्रोकार्बन’ कहते हैं। एेसे यौगिकों की सजातीय श्रेणी के सुव्यवस्थित IUPAC नाम को एेल्केन (alkane) कहते हैं। इनका पूर्व नाम ‘पैराफिन’ (लैटिन ः लिटिल, एेफिनिटी, अर्थात्् कम क्रियाशील) था। असंतृप्त हाइड्रोकार्बन में कम से कम एक कार्बन-कार्बन द्विआबंध या त्रिआबंध होता है।
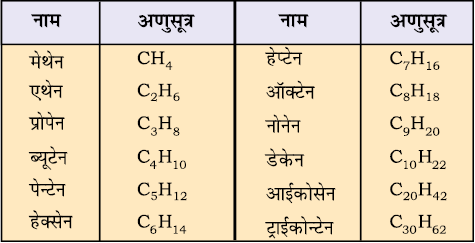
12.5.2 एेल्केनों की IUPAC नामपद्धति
सीधी शृंखलायुक्त हाइड्रोकार्बन ः मेथेन और ब्यूटेन के अतिरिक्त शेष यौगिकों के नाम सीधी शृंखला-संरचना पर आधारित है, जिनके पश्चलग्न में ‘एेन’ (ane) तथा इससे पूर्व शृंखला में उपस्थित कार्बन परमाणु की संख्या से संगित किया जाता है। कुछ संतृप्त सीधी शृंखला हाइड्रोकार्बनों के IUPAC नाम सारणी 12.2 में दिए गए हैं। इस सारणी में दिए गए एेल्केनों के दो क्रमागत सदस्यों के मध्य केवल CH2 समूह का अंतर है। ये एेल्केन श्रेणी के सजात (Homologues) हैं।
सारणी 12.1 कुछ कार्बनिक यौगिकों के सामान्य अथवा रूढ़ नाम
| यौगिक | सामान्य नाम | यौगिक | सामान्य नाम |
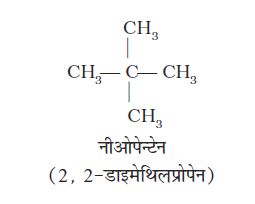
| CH4 H3CCH2CH2CH3 (H3C)2 CH CH3 (H3C)4C H3CCH2CH2OH HCHO (H3C)2 CO | मेथेन n—ब्यूटेन आइसोब्यूटेन निओपेन्टेन n—प्रोपिलएेल्कोहॉल फार्मेल्डिहाइड एेसीटोन | CHCl3 CH3COOH C6H6 C6H5OCH3 C6H5NH2 C0H5COCH3 CH3OCH2CH3 | क्लोरोफार्म एेसीटिक अम्ल बेन्जीन एेनीसॉल एेनिलीन एेसीटोफ़ीनोन एथिल मेथिल ईथर |
सारणी 12.2
शाखित शृंखलायुक्त हाइड्रोकार्बन
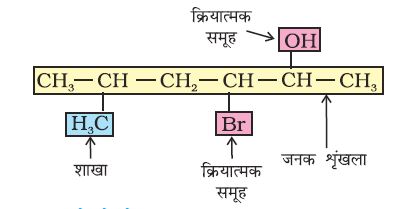
शाखित शृंखला (Branced Chain) से युक्त यौगिकों में कार्बन परमाणुओं की छोटी शृंखलाएँ जनक के शृंखला एक या कई कार्बनों के साथ जुड़ी रहती हैं। ये छोटी कार्बन- शृंखला (शाखाएँ) ‘एेल्किल समूह’ कहलाती है। उदाहरणार्थ–
(क)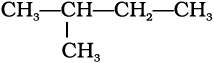
(ख) 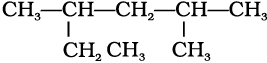
एेसे यौगिक का नाम देने के लिए एेल्किल समूह का नाम पूर्वलग्न के रूप में जनक एेल्केन के नाम के साथ संयुक्त कर देते हैं। संतृप्त हाइड्रोकार्बन के कार्बन से एक हाइड्रोजन परमाणु हटाने पर एेल्किल समूह प्राप्त होता है। इस प्रकार CH4 से –CH3 प्राप्त होता है। इसे ‘मेथिल समूह’ कहा जाता है। एेल्किल समूह का नाम प्राप्त करने के लिए संबंधित एेल्केन के नाम से एेन (ane) को (इल) (yl) द्वारा विस्थापित करते हैं। कुछ एेल्किल समूहों के नाम सारणी 12.3 में दिए गए हैं।
सारणी 12.3 कुछ एेल्किल समूह
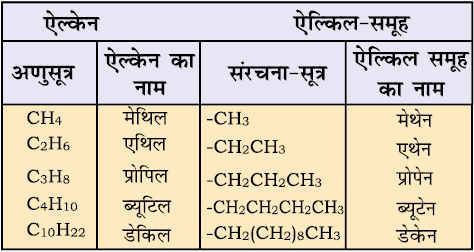
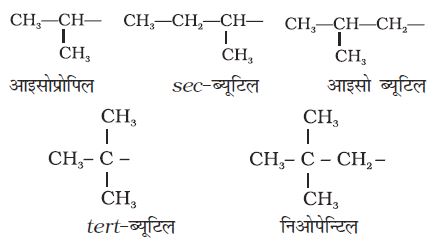
कुछ एेल्किल समूहों के नाम लघु रूप में भी लिखे जाते हैं। जैसे– मेथिल को Me, एथिल को Et, प्रोपिल को Pr तथा ब्यूटिल को Bu लिखते हैं। एेल्किल समूह शाखित भी होती है, जैसा नीचे दिखाया गया है। साधारण शाखित समूहों के विशिष्ट रूढ़ नाम होते हैं। उदाहरणार्थ– ब्यूटिल समूहों के नाम द्वितीयक (sec)-ब्यूटिल, आइसोब्यूटिल तथा तृतीयक(tert)-ब्यूटिल हैं।
—CH–2C(CH3)3 संरचना के लिए ‘निओपेन्टिल समूह’ नाम का प्रयुक्त किया जाता है।
हमें शाखित शृंखला वाले एेल्केन बड़ी संख्या में मिलते हैं। उनके नामकरण के नियम निम्नलिखित हैं–
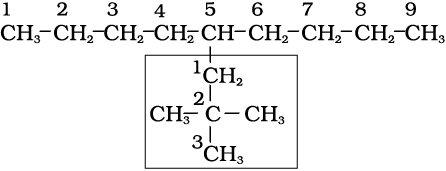
1. सर्वप्रथम अणु में दीर्घतम कार्बन शृंखला का चयन किया जाता हैै। अग्रलिखित उदाहरण (I) में दीर्घतम शृंखला में नौ कार्बन हैं। यही जनक शृंखला (Parent Chain) है। संरचना II में प्रदर्शित जनक शृंखला का चयन सही नहीं है, क्योंकि इसमें केवल आठ ही कार्बन हैं।
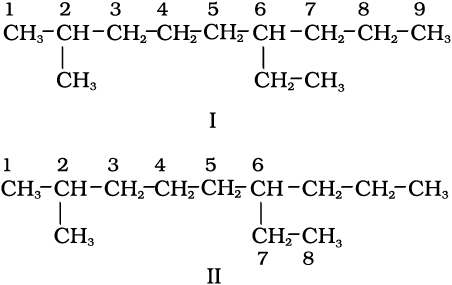
2. जनक एेल्केन को पहचानने के लिए जनक शृंखला के कार्बन परमाणुओं का अंकन किया जाता है तथा हाइड्रोजन परमाणु को प्रतिस्थापित करने वाले एेल्किल समूह के कारण शाखित होनेवाले कार्बन परमाणु के स्थान का पता लगाया जाता है। क्रमांकन उस छोर से प्रारंभ करते हैं, जिससे शाखित कार्बन परमाणुओं को लघुतम अंक मिले। अतः उपर्युक्त उदाहरण में क्रमांकन बाईं से दाईं ओर होना चाहिए (कार्बन 2 और 6 पर शाखन), न कि दाईं से बाईं ओर (जब शाखित कार्बन परमाणुओं को 4 और 8 संख्या मिलेंगी)।
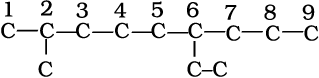
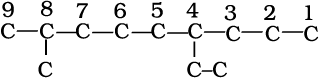
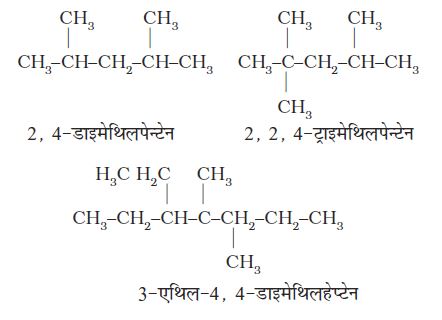
3. मूल एेल्केन के नाम में शाखा के रूप में एेल्किल समूहों के नाम पूर्वलग्न के रूप में संयुक्त करते हैं और प्रतिस्थापी समूहों की स्थिति को उचित संख्या द्वारा दर्शाते हैं। भिन्न एेल्किल-समूहों के नामों को अंग्रेजी वर्णमाला के क्रम में लिखा जाता है। अतः उपर्युक्त यौगिक का नाम 6-एथिल-2-मेथिलनोनेन होगा। (ध्यान देने योग्य बात यह है कि समूह तथा संख्या के मध्य संयोजक-रेखा (Hyphen) तथा मेथिल और नोनेन को साथ मिलाकर लिखा जाता है।)
4. यदि दो या दो से अधिक समान प्रतिस्थापी समूह हों, तो उनकी संख्याओं के मध्य अल्पविराम (, ) लगाया जाता है। समान प्रतिस्थापी समूहाें के नाम को दुबारा न लिखकर उचित पूर्वलग्न, जैसे– डाइ (2 के लिए), ट्राइ (3 के लिए), टेट्रा (4 के लिए), पेंटा (5 के लिए), हेक्सा
(6 के लिए) आदि प्रयुक्त करते हैं, परंतु नाम लिखते समय प्रतिस्थापी समूहों के नामों को अंग्रेजी वर्णमाला के क्रम में लिखते हैं। निम्नलिखित उदाहरण इन नियमों को स्पष्ट करते हैं–
5. यदि दो प्रतिस्थापियों की स्थितियाँ तुल्य हों, तो अंग्रेजी वर्णमाला के क्रम में पहले आनेवाले अक्षर को लघु अंक दिया जाता है। अतः निम्नलिखित यौगिक का सही नाम 3-एथिल-6-मेथिलअॉक्टेन है, न कि 6-एथिल- 3-मेथिलअॉक्टेन।
6. शाखित एेल्किल समूह का नाम उपर्युक्त नियमों की सहायता से प्राप्त किया जा सकता है, परंतु शाखित शृंखला का कार्बन परमाणु, जो जनक शृंखला से बंधित होता है, को इस उदाहरण की तरह संख्या 1 दी जाती है।
एेसे शाखित शृंखला समूह के नाम को कोष्ठक में लिखा जाता है। प्रतिस्थापी समूहों के रूढ़ नाम वर्णमाला-क्रम में लिखते समय आइसो (iso) और निओ (neo) पूर्वलग्नों को मूल एेल्किल समूह के नाम का भाग माना जाता है। परंतु द्वितीयक (sec–) तथा तृतीयक (tert–) पूर्वलग्नों को मूल एेल्किल समूह के नाम का भाग नहीं माना जाता। आइसो और अन्य संबंधित पूर्वलग्नों का उपयोग आई.यू.पी.ए.सी. पद्धति में भी किया जाता है, लेकिन तभी तक, जब तक ये और आगे शाखित न हों। बहुप्रतिस्थापित यौगिकों में निम्नलिखित नियमों को आप याद रखें–
• यदि समान संख्या की दो शृंखलाएँ हों, तो अधिक पार्श्व शृंखलाओं वाली शृंखला का चयन करना चाहिए।
• शृंखला के चयन के बाद क्रमांकन उस छोर से आरंभ करना चाहिए, जिस छोर से प्रतिस्थापी समीप हो।
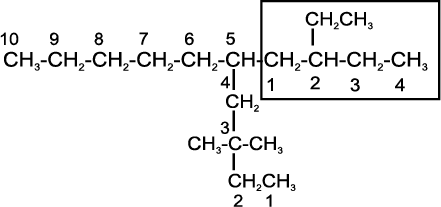
उपर्युक्त यौगिक का नाम 5–(2–एथिलब्यूटिल)–3, 3– डाइमेथिलडेकेन हैं,
न कि 5–(2,2–डाइमेथिलब्यूटिल)– 3–एेथिलडेकेन
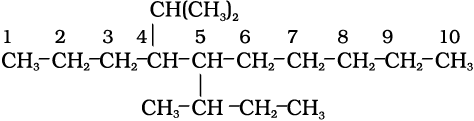
5-sec-ब्यूटिल-4-आइसोप्रोपिल डेकेन
5-(2, 2-डाइमेथिलप्रोपिल)-नोनेन
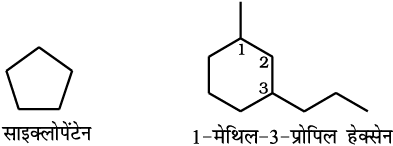
चक्रीय यौगिक ः एकलचक्रीय संतृप्त यौगिक का नाम संबंधित विवृत– शृंखला एेल्केन के नाम के प्रारंभ में ‘साइक्लो’ पूर्वलग्न लगाकर प्राप्त करते हैं। यदि पार्श्व- शृंखलाएँ उपस्थित हों, तो उपर्युक्त नियमाें का पालन हम करते हैं। कुछ चक्रीय यौगिकों के नाम नीचे दिए गए हैं–
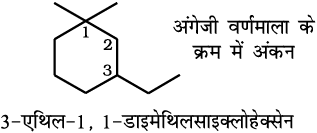
(1-एथिल-3, 3-डाइमेथिलसाइक्लोहेक्सेन गलत है)
उदाहरण 12.7
कुछ हाइड्रोकार्बनों के IUPAC नाम तथा संरचनाएँ नीचे दी गई हैं। कारणसहित बताइए कि कोष्ठक में दिए गए नाम अशुद्ध क्यों हैं–
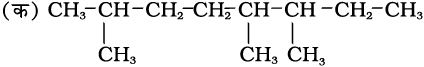
2, 5, 6, ट्राइमेथिलअॉक्टेन
[3, 4, 7-ट्राइमेथिलअॉक्टेन गलत है]
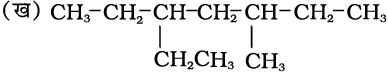
3-एथिल-5-मेथिलहेप्टेन
[5-एथिल-3-मेथिलहेप्टेन गलत है]
हल
(क) 2, 5, 6 लघुतम अंक 3, 5, 7 की अपेक्षा न्यून है।
(ख) प्रतिस्थापी समूह तुल्य स्थितियों में हैं। इस दशा में क्रमांकन उस छोर से आरंभ करते हैं, जिस छोर से वर्णमाला क्रम में पहले आने वाले समूह को न्यून अंक मिले।
12.5.3 क्रियात्मक समूह से युक्त कार्बनिक यौगिकों की नामपद्धति
किसी कार्बनिक यौगिक में परमाणु अथवा परमाणुओं का समूह, जिसके कारण वह यौगिक विशिष्ट रासायनिक अभिक्रियाशीलता प्रदर्शित करता है, ‘क्रियात्मक समूह’ (Functional Group) कहलाता है। समान क्रियात्मक समूहवाले यौगिक समान अभिक्रियाएँ देते हैं। उदाहरणार्थ– CH3OH, CH3CH2OH तथा (CH3)2CHOH इन सभी में –OH क्रियात्मक समूह है, जिसके कारण वे सभी सोडियम धातु के साथ अभिक्रिया करके हाइड्रोजन मुक्त करते हैं। क्रियात्मक समूह की उपस्थिति के कारण कार्बनिक यौगिकों को क्रमानुसार विभिन्न वर्गो में वर्गीकृत किया जा सकता है। कुछ क्रियात्मक समूह उनके पूर्वलग्न और अनुलग्न तथा कुछ कार्बनिक यौगिकों के नाम, जिनमें वे उपस्थित हैं, सारणी 12.4 में दिए गए हैं।
सर्वप्रथम उपस्थित क्रियात्मक समूह की पहचान की जाती है, ताकि उपयुक्त अनुलग्न का चयन हो सके। क्रियात्मक समूह की स्थिति दर्शाने के लिए दीर्घतम शृंखला का क्रमांकन उस छोर से करते हैं, ताकि उस कार्बन जिससे क्रियात्मक समूह बंधित है को न्यूनतम अंक मिले। सारणी 2.4 में दिए गए अनुलग्न का उपयोग करके यौगिक का नाम प्राप्त कर लिया जाता है।
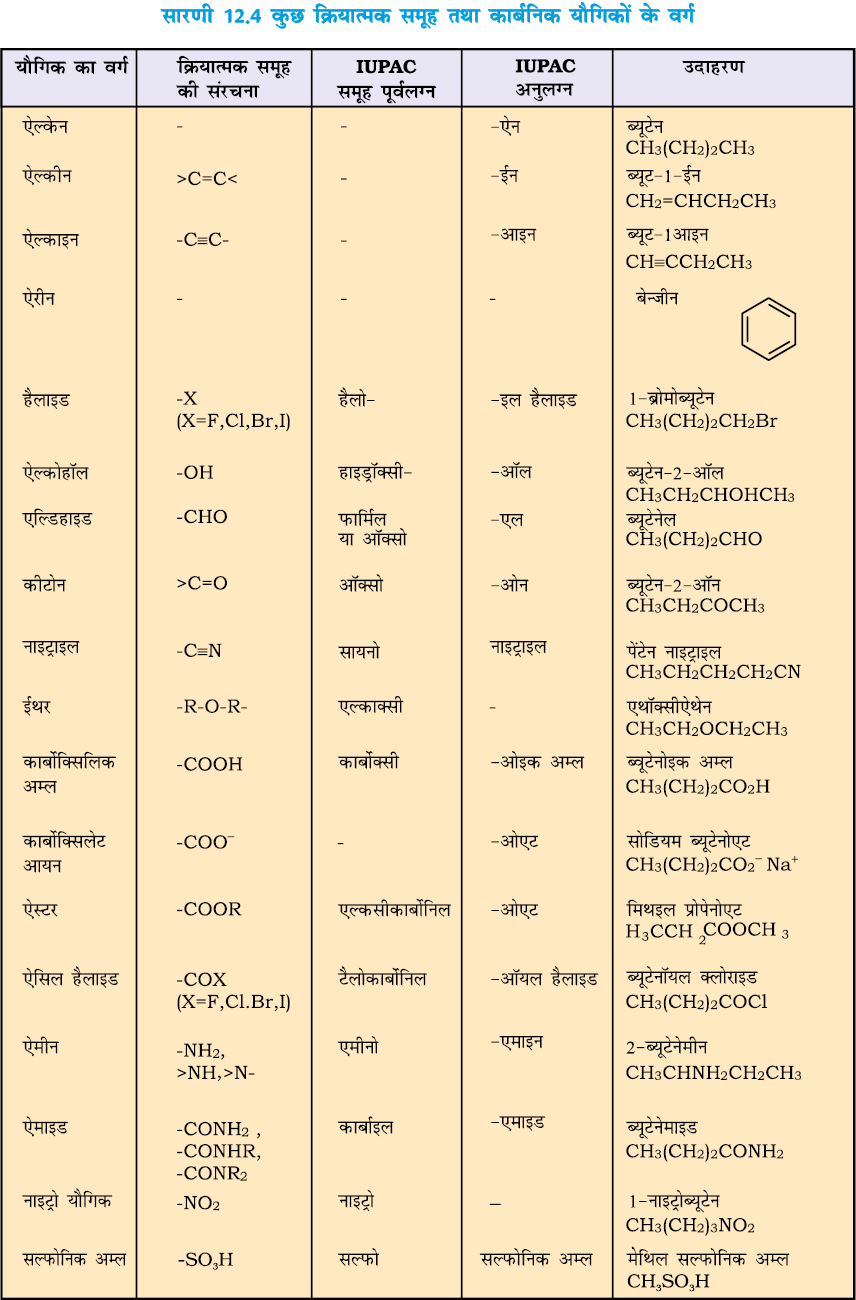
बहुक्रियात्मक समूह वाले यौगिकों में उनमें से एक क्रियात्मक समूह को मुख्य क्रियात्मक समूह मान लिया जाता है और उस आधार पर यौगिक का नाम दिया जाता है। उचित पूर्वलग्नों का उपयोग करके बचे हुए क्रियात्मक समूहों को प्रतिस्थापी के रूप में नाम दिया जाता है। मुख्य क्रियात्मक समूह का चयन प्राथमिकता के आधार पर किया जाता है। कुछ क्रियात्मक समूहों का घटता हुआ प्राथमिकता क्रम इस प्रकार है–
–COOH, –SO3H, –COOR (R = एेल्किल समूह), –COCl,
–CONH2 –CN, –HC = O, >C = O, –OH, –NH2, >C =
C<, –C ≡ C–
R, C6 H5–, हैलोजन (F, Cl, Br, I), NO2, एेल्कॉक्सी (OR) आदि को हमेशा प्रतिस्थापी पूर्वलग्न के रूप में लिखा जाता है। अतः यदि किसी यौगिक में एेल्कोहॉल और कीटो समूह–दोनों हों, तो उसे ‘हाइड्रोक्सीएल्केनोन’ नाम ही दिया जाएगा, क्योंकि हाइड्रॉक्सी समूह की अपेक्षा कीटो समूह को उच्च प्राथमिकता प्राप्त है।
उदाहरणार्थ–HO CH2 (CH2)3 CH2 CO CH3 का नाम 7- हाइड्रॉक्सीहेप्टेन-2-ओन होगा, न कि 2-ओक्सोहेप्टेन-7-अॉल। इसी प्रकार Br CH2 CH = CH2 का सही नाम 3-ब्रोमोप्रोप -1-ईन है, न कि 1-ब्रोमोप्रोप -2-ईन।
यदि एक ही प्रकार के क्रियात्मक समूहों की संख्या एक से अधिक हो, तो उनकी संख्या दर्शाने के लिए उपयुक्त पूर्वलग्न, डाइ, ट्राई आदि वर्ग-अनुलग्न के पूर्व लिखा जाता है। एेसे में वर्ग-अनुलग्न के पूर्व मूल एेल्केन का पूर्ण नाम लिखते हैं। उदाहरणार्थ-CH2(OH) CH2(OH) का नाम एथेन-1,2 डाइअॉल है, परंतु एक से अधिक द्विआबंध या त्रिआबंध होने पर एेल्केन का ‘न’ प्रयुक्त नहीं किया जाता है। जैसे–CH2 = CH – CH = CH2 का नाम ब्यूटा -1, 3- डाइईन है।
उदाहरण 12.8
निम्नलिखित यौगिकों (i-iv) के IUPAC नाम लिखिए–
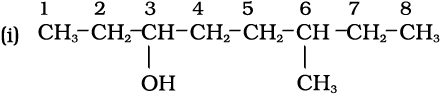
हल
हाइड्रॉक्सी (OH) क्रियात्मक समूह होने के कारण अनुलग्न अॉल होगा।
दीर्घतम शृंखला में आठ कार्बन हैं। अतः मूल हाइड्रोकार्बन अॉक्टेन है।
OH कार्बन-संख्या 3 पर है। एक अन्य प्रतिस्थापी मेथिल समूह कार्बन -6 पर है। अतः यौगिक का नाम 6-मेथिलअॉक्टेन -3- अॉल है।
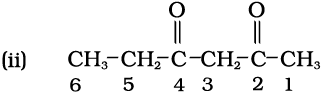
हल
क्रियात्मक समूह कीटोन (> C = O) होने के कारण अनुलग्न ‘ओन’ होगा। दो कीटो-समूह होने के कारण ‘डाइओन’ अनुलग्न प्रयुक्त करेंगे। कीटो समूहों की स्थितियाँ 2 और 4 हैं। दीर्घतम शृंखला में 6 कार्बन परमाणु होने के कारण मूल एेल्केन हेक्सेन है। अतः सही नाम हेक्सेन-2,4- डाइओन है।
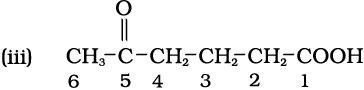
हल
इसमें दो क्रियात्मक समूह (कीटो तथा कार्बोक्सी) हैं, जिनमें कॉर्बोक्सी-समूह मुख्य क्रियात्मक समूह है। अतः मूल शृंखला में अनुलग्न ‘ओइक’ अम्ल लगेगा। शृंखला का क्रमांकन उस कार्बन से आरंभ होगा, जिसमें-COOH क्रियात्मक समूह है। कार्बन-संख्या 5 पर स्थित कीटो को ‘अॉक्सो’ नाम दिया जाता है। दीर्घतम शृंखला, जिसमें क्रियात्मक समूह है, में 6 कार्बन परमाणु हैं। फलतः इसके मूल हाइड्रोकार्बन का नाम ‘हैक्सेन’ है। अतः यौगिक का नाम 5-अॉक्सोहेक्सोनोइक अम्ल है।
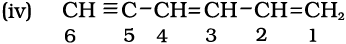
हल
दो क्रियात्मक समूह  कार्बन 1 तथा 3 पर हैं, जबकि
कार्बन 1 तथा 3 पर हैं, जबकि  समूह-स्थिति कार्बन-संख्या 5 पर है। इसके लिए क्रमशः डाइईन तथा ‘आइन’ अनुलग्न प्रयुक्त करेंगे। दीर्घतम शृंखला में 6 कार्बन हैं। इसलिए इसका मूल हाइड्रोकार्बन हेक्सेन है। अतः नाम हैक्सा-1, 3-डाइईन- 5-आइन होगा।
समूह-स्थिति कार्बन-संख्या 5 पर है। इसके लिए क्रमशः डाइईन तथा ‘आइन’ अनुलग्न प्रयुक्त करेंगे। दीर्घतम शृंखला में 6 कार्बन हैं। इसलिए इसका मूल हाइड्रोकार्बन हेक्सेन है। अतः नाम हैक्सा-1, 3-डाइईन- 5-आइन होगा।
उदाहरण 12.9
निम्नलिखित की संरचनाएँ लिखिए–
(i) 2-क्लोरोहेक्सेन,
(ii) पेंट-4-ईन-2-अॉल
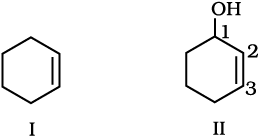
(iii) 3-नाइट्रोसाइक्लोहेक्सीन,
(iv) साइक्लोहेक्स -2- ईन -1- अॉल
(v) 6-हाइड्रॉक्सीहेप्टेनैल
हल
(i) हेक्सेन से स्पष्ट है कि दीर्घतम शृंखला में 6 कार्बन परमाणु हैं। क्रियात्मक समूह क्लोरो की स्थिति 2 है। अतः यौगिक की संरचना CH3 CH2 CH2 CH2 CH (Cl) CH3 है।
(ii) पेंट से स्पष्ट है कि मूल हाइड्रोकार्बन में 5 कार्बन परमाणु की शृंखला है। ईन तथा ‘अॉल’ क्रमश  तथा –OH क्रियात्मक समूह के द्योतक हैं, जो क्रमशः 4 तथा 2 स्थितियों पर उपस्थित हैं। अतः यौगिक की संरचना CH2 = CH CH2 CH (OH) CH3 है।
तथा –OH क्रियात्मक समूह के द्योतक हैं, जो क्रमशः 4 तथा 2 स्थितियों पर उपस्थित हैं। अतः यौगिक की संरचना CH2 = CH CH2 CH (OH) CH3 है।
(iii) साइक्लोहेक्सीन से स्पष्ट है कि छःसदस्यीय वलय में  उपस्थित है, जिसका क्रमांकन संरचना (I) में प्रदर्शित है। पूर्वलग्न 3-नाइट्रो यह इंगित करता है कि स्थिति 3 पर नाइट्रो समूह है। अतः यौगिक की संरचना II है। द्विबंध अनुलग्नक क्रियात्मक समूह है, जबकि NO2 पूर्वलग्नक क्रियात्मक समूह है, इसलिए द्विबंध को NO2 समूह से अधिक प्राथमिकता दी जाती है।
उपस्थित है, जिसका क्रमांकन संरचना (I) में प्रदर्शित है। पूर्वलग्न 3-नाइट्रो यह इंगित करता है कि स्थिति 3 पर नाइट्रो समूह है। अतः यौगिक की संरचना II है। द्विबंध अनुलग्नक क्रियात्मक समूह है, जबकि NO2 पूर्वलग्नक क्रियात्मक समूह है, इसलिए द्विबंध को NO2 समूह से अधिक प्राथमिकता दी जाती है।
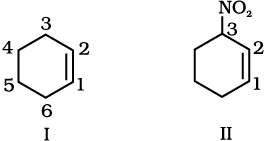
(iv) 1-अॉल इंगित करता है कि 1 की स्थिति कार्बन 1 C पर है। –OH अनुलग्नित क्रियात्मक समूह है। अतः  आबंध पर इसकी वरीयता होगी। इस प्रकार यौगिक की संरचना (II) है–
आबंध पर इसकी वरीयता होगी। इस प्रकार यौगिक की संरचना (II) है–
(v) ‘हेप्टेनैल’ से स्पष्ट है कि यौगिक एक एेल्डिहाइड है, जिसमें 7 कार्बन परमाणुओं की शृंखला है। ‘6-हाइड्रॉक्सी’ यह दर्शाता है कि स्थिति 6 पर- OH समूह है। अतः यौगिक का संरचनात्मक सूत्र निम्नलिखित है–
CH3 CH (OH) CH2 CH2 CH2 CH2 CHO कार्बन शृंखला के क्रमांकन में-CHO समूह का कार्बन परमाणु सम्मिलित होता है।
12.5.4 बेन्जीन व्युत्पन्नों की नामपद्वति
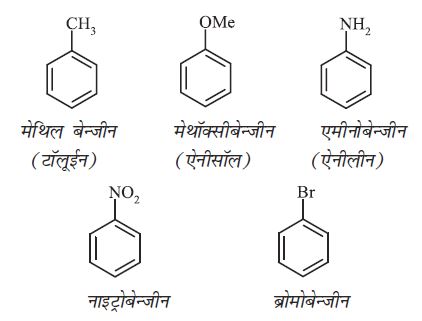
IUPAC पद्धति में बेन्जीन व्युत्पन्न का नाम प्राप्त करने के लिए प्रतिस्थापी समूह का नाम पूर्वलग्न के रूप में ‘बेन्जीन’ शब्द से पूर्व लिखते हैं, परंतु उनके यौगिकों के रूढ़ नाम (जो कोष्ठक में दिए गए हैं) भी काफी प्रचलित हैं।
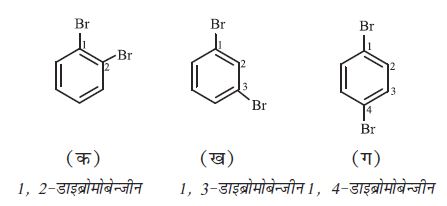
द्विप्रतिस्थापी बेन्जीन व्युत्पन्न में प्रतिस्थापी समूहों की स्थितियाँ संख्याओं द्वारा दर्शाई जाती हैं। क्रमांकन इस प्रकार किया जाता है कि प्रतिस्थापी समूह वाली स्थितियों को न्यूनतम संख्या मिले। जैसे– इस यौगिक (ख) का नाम 1, 3-डाइब्रोमोबेन्जीन होगा, न कि 1, 5-डाइब्रोमोबेन्जीन।
नामांकरण की रूढ़ पद्धति में 1, 2-; 1, 3- और 1, 4- स्थितियों को क्रमशः अॉर्थो (o), मेटा (m) तथा पैरा (p) पूर्वलग्नों द्वारा भी दर्शाया जाता है। अतः 1, 3- डाइब्रोमोबेन्जीन का नाम मेटा डाइब्रोमोबेन्जीन भी है (‘मेटा’ का संक्षिप्त रूप m है) और डाइब्रोमोबेन्जीन के अन्य समावयवों (क) 1, 2- तथा (ग) 1, 4- डाइब्रोमोबेन्जीन को क्रमशः अॉर्थो (o) तथा पैरा (p) डाइब्रोमोबेन्जीन कहेंगे।
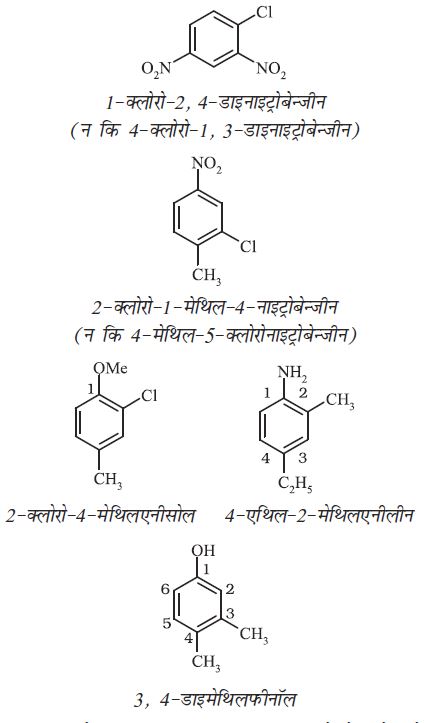
इन पूर्वलग्नों का उपयोग त्रि तथा बहुप्रतिस्थापी बेन्जीन के नामांकरण में नहीं किया जाता है। प्रतिस्थापियों की स्थितियाँ निम्नतम संख्या के नियम का पालन करते हुए की जाती हैं। कभी-कभी बेन्जीन व्युत्पन्न के रूढ़ नाम को मूल यौगिक लिया जाता है।
मूल यौगिक के प्रतिस्थापी की स्थिति को संख्या 1 देकर इस प्रकार क्रमांकन करते हैं कि शेष प्रतिस्थापियों को निम्नतम संख्याएं मिलें। प्रतिस्थापियों के नाम अंग्रेज़ी वर्णमाला क्रम में लिखे जाते हैं। इसके कुछ उदाहरण नीचे दिए जा रहे हैं–
जब बेन्जीन वलय एवं क्रियात्मक समूह एेल्केन से जुड़े रहते हैं तब बेन्जीन को मूल न मानकर प्रतिस्थापी के रूप में माना जाता है। (प्रतिस्थापी के रूप में बेन्जीन का नाम फेनिल है तथा C6H5– को लघु रूप में Ph लिखा जाता है)।
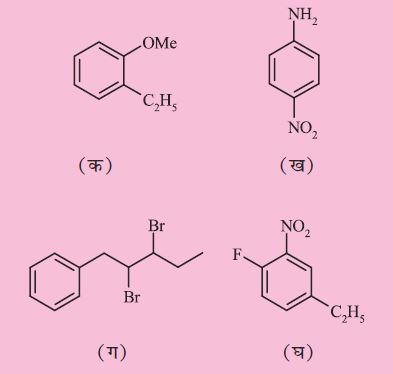
उदाहरण 12.10
निम्नलिखित के संरचनात्मक सूत्र लिखिए–
(क) o-एथिलएेनिसोल,
(ख) p– नाइट्रोएेनिलीन
(ग) 2, 3- डाइब्रोमो -1- फेनिलपेन्टेन
(घ) 4-एथिल -1-फ्लुओरो-2-नाइट्रोबेन्जीन
हल
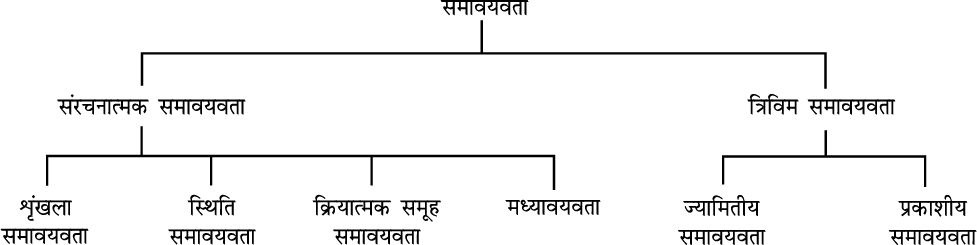
12.6 समावयवता
दो या दो से अधिक यौगिक (जिनके अणुसूत्र समान होते हैं, किंतु गुण भिन्न होते हैं) ‘समावयव’ कहलाते हैं और इस परिघटना को ‘समावयवता’ (isomerism) कहते हैं। विभिन्न प्रकार की समावयवता को इस तालिका में दर्शाया गया है।
12.6.1 संरचनात्मक समावयवता
यौगिक, जिनके अणुसूत्र समान होते हैं, किंतु संरचना (अर्थात् परमाणुओं का अणु के अंदर परस्पर आबंधित होने का क्रम) भिन्न होती है, उन्हें संरचनात्मक समावयवों में वर्गीकृत किया जाता है। विभिन्न प्रकार की संरचनात्मक समावयवों का उदाहरणसहित वर्णन यहाँ दिया जा रहा है–
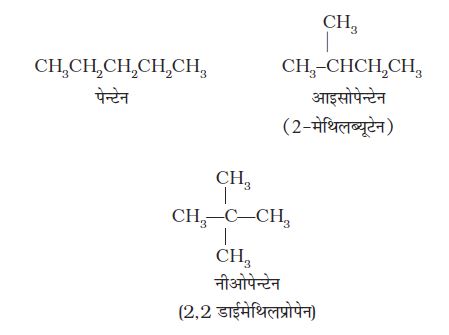
(i) शृंखला समावयवता ः समान अणुसूत्र एवं भिन्न कार्बन ढाँचे वाले दो या दो से अधिक यौगिक शृंखला समावयव बनाते हैं। इस परिघटना को ‘ शृंखला समावयवता’ कहते हैं। उदाहरणार्थ– C5H12 के निम्नलिखित तीन शृंखला समावयव हैं–
(ii) स्थिति-समावयवता ः यदि समावयवों में भिन्नता प्रतिस्थापी परमाणु या समूह की स्थिति-भिन्नता के कारण होती है, तो उन्हें ‘स्थिति-समावयव’ तथा इस परिघटना को ‘स्थिति-समावयवता’ (Position Isomerism) कहते हैं। उदाहरणार्थ–C3H8O अणुसूत्र से निम्नलिखित दो ‘स्थिति-समावयव’ एेल्कोहॉल संभव हैं–
(iii) क्रियात्मक समूह समावयवता ः यदि दो या दो से अधिक यौगिकों के अणुसुत्र समान हों, परंतु क्रियात्मक समूह भिन्न-भिन्न हों, तो एेसे समावयवियों को ‘क्रियात्मक समूह समावयव’ कहते हैं और यह परिघटना ‘क्रियात्मक समूह समावयवता’ (Functional group isomerism) कहलाती है। उदाहरण के लिए– C3H6O अणुसूत्र निम्नलिखित एेल्डिहाइड तथा कीटोन प्रदर्शित करता है–
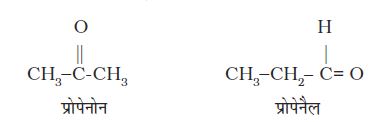
(iv) मध्यावयवता ः क्रियात्मक समूह से लगी भिन्न एेल्किल शृंखलाओं के कारण यह समावयवता उत्पन्न होती है। उदाहरणार्थ– C4H10O मध्यावयवी मेथॉक्सीप्रोपेन (CH3–O–C3H7) और एथॉक्सीएथेन (C2 H5–O–C2 H5) प्रदर्शित करता है।
12.6.2 त्रिविम समावयवता
त्रिविम समावयव वे यौगिक हैं, जिनमें संरचना एवं परमाणुओं के आबंधन का क्रम तो समान रहता है, परंतु उनके अणुओं में परमाणुओं अथवा समूहों की त्रिविम स्थितियाँ भिन्न रहती हैं। यह विशिष्ट प्रकार की समावयवता ‘त्रिविम समावयवता’ (Stereoisomerism) कहलाती है। इसे ज्यामितीय एवं प्रकाशीय समावयवता में वर्गीकृत किया जाता है।
12.7 कार्बनिक अभिक्रियाओं की क्रियाविधि में मूलभूत संकल्पनाएँ
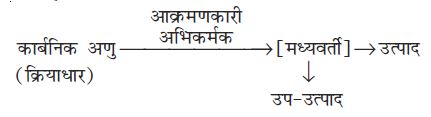
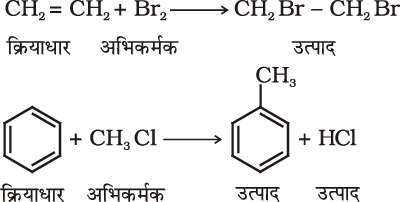
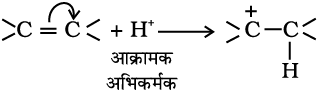
किसी कार्बनिक अभिक्रिया में कार्बनिक अणु (जो ‘क्रियाधारक’ भी कहलाता है) किसी उचित अभिकर्मक से अभिक्रिया करके पहले एक या अधिक मध्यवर्ती और अंत में एक या अधिक उत्पाद देता है।
एक सामान्य अभिक्रिया को इस रूप में प्रदर्शित किया जाता है–
नए आबंध में कार्बन की आपूर्ति करनेवाला ‘अभिक्रियक क्रियाधार’ (substrate) और दूसरा ‘अभिक्रियक अभिकर्मक’ (reagent) कहलाता है। यदि दोनों अभिक्रियक (अभिकारक) नए आबंध में कार्बन की आपूर्ति करते हैं, तो यह चयन किसी भी तरीके से किया जा सकता है। इस स्थिति में मुख्य अणु ‘क्रियाधार’ कहलाता है।
एेसी अभिक्रिया में दो कार्बन परमाणुओं अथवा एक कार्बन और एक अन्य परमाणु के बीच सहसंयोजक आबंध टूटकर एक नया आबंध बनता है। किसी अभिक्रिया में इलेक्ट्रॉनों का संचलन, आबंध-विदलन और आबंध-निर्माण के समय की और्जिकी तथा उत्पाद बनने के समय की विस्तृत जानकारी और क्रमबद्ध अध्ययन उस अभिक्रिया की क्रियाविधि (Mechanism) कहलाती है। क्रियाविधि की सहायता से यौगिकों की क्रियाशीलता को समझने में तथा नवीन कार्बनिक यौगिकों के संश्लेषण की रूपरेखा तैयार करने में सहायता मिलती है।
निम्नलिखित भागों में इन अभिक्रियाओं से संबंधित अवधारणाओं की व्याख्या की गई है।
12.7.1 सहसंयोजक आबंध का विदलन
सहसंयोजक आबंध का विदलन (cleavage) दो प्रकार से संभव है– (i) विषम अपघटनी विदलन तथा (ii) समापघटनी विदलन।
विषमअपघटनी विदलन में विदलित होने वाले आबंध के दोनों इलेक्ट्रॉन उनमें से किसी एक परमाणु पर चले जाते हैं, जो अभिकारक से आबंधित थे।
विषमअपघटन के पश्चात् एक परमाणु पर षष्टक तथा धनावेश होता है और दूसरे का पूर्ण अष्टक एवं कम से कम एक एकाकी युग्म तथा ऋणावेश होता है। अतः ब्रोमोमेथेन के विषम अपघटनी-विदलन से +CH3 तथा Br– प्राप्त होता है।
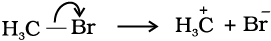
धनावेशित स्पीशीज़, जिसमें कार्बन पर षष्टक होता है, ‘कार्बधनायन’ कहलाती है (इसे पहले ‘कार्बोनियम आयन’ कहा जाता था)। +CH3 आयन को ‘मेथिल धनायन’ अथवा ‘मेथिल कार्बोनियम आयन’ कहते हैं। धनावेशित कार्बन के साथ बंधित कार्बन परमाणुओं की संख्या के आधार पर कार्बधनायनों को प्राथमिक, द्वितीयक तथा तृतीयक में वर्गीकृत किया जा सकता है। कार्बधनायनों के कुछ उदाहरण हैं– 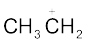 (एथिल धनायन–एक प्राथमिक कार्बधनायन),
(एथिल धनायन–एक प्राथमिक कार्बधनायन), 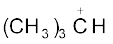 आइसोप्रोपिल धनायन (एक द्वितीयक कार्बधनायन) एवं
आइसोप्रोपिल धनायन (एक द्वितीयक कार्बधनायन) एवं 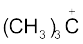 (ब्यूटिल धनायन–एक तृतीयक कार्बधनायन)। कार्बधनायन अत्यधिक अस्थायी तथा क्रियाशील स्पीशीज़ हैं। धनावेशित कार्बन के साथ आबंधित एेल्किल समूह कार्बधनायन के स्थायित्व में प्रेरणिक प्रभाव और अतिसंयुग्मन द्वारा वृद्धि करते हैं, जिसके विषय में आप भाग 12.7.5 और 12.7.9 में अध्ययन करेंगे। कार्बधनायन के स्थायित्व का क्रम इस प्रकार है–
(ब्यूटिल धनायन–एक तृतीयक कार्बधनायन)। कार्बधनायन अत्यधिक अस्थायी तथा क्रियाशील स्पीशीज़ हैं। धनावेशित कार्बन के साथ आबंधित एेल्किल समूह कार्बधनायन के स्थायित्व में प्रेरणिक प्रभाव और अतिसंयुग्मन द्वारा वृद्धि करते हैं, जिसके विषय में आप भाग 12.7.5 और 12.7.9 में अध्ययन करेंगे। कार्बधनायन के स्थायित्व का क्रम इस प्रकार है– 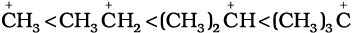 इन कार्बधनायनों की आकृति त्रिफलकीय समतल होती है, जिसमें धनावेशित कार्बन की संकरण-अवस्था sp2 होती है। अतः
इन कार्बधनायनों की आकृति त्रिफलकीय समतल होती है, जिसमें धनावेशित कार्बन की संकरण-अवस्था sp2 होती है। अतः 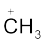 में कार्बन के तीन (sp2) संकरित कक्षक हाइड्रोजन के ls कक्षकों के साथ अतिव्यापित होकर C(sp2) –H (ls) सिग्मा आबंध बनाते हैं। असंकरित कार्बन कक्षक इस तल के लंबवत रहता है। इसमें कोई इलेक्ट्रॉन नहीं होता (चित्र 12.3(क))।
में कार्बन के तीन (sp2) संकरित कक्षक हाइड्रोजन के ls कक्षकों के साथ अतिव्यापित होकर C(sp2) –H (ls) सिग्मा आबंध बनाते हैं। असंकरित कार्बन कक्षक इस तल के लंबवत रहता है। इसमें कोई इलेक्ट्रॉन नहीं होता (चित्र 12.3(क))।
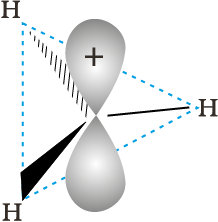
चित्र 12.3 (क) मेथिल कार्बधनायन की आकृति
विषम अपघटनी विदलन से एेसी स्पीशीज़ निर्मित हो सकती है, जिसमें कार्बन को सहभाजित इलेक्ट्रॉन युग्म प्राप्त होता है। उदाहरणार्थ–जब कार्बन से आबंधित Z समूह बिना इलेक्ट्रॉन युग्म लिये पृथक् होता है, तब मेथिल ऋणायन 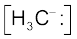 बनता है।
बनता है।

एेसी स्पीशीज़, जिसमें कार्बन पर ऋणावेश होता है, कार्बऋणायन (Carbanion) कहलाती है। कार्बन सामान्यतः sp3 संकरित होता है तथा इसकी आकृति विकृत चतुष्फलकीय होती है (चित्र 12.3(ख)) कार्बऋणायन भी अस्थायी और क्रियाशील स्पीशीज़ होती हैं। एेसी कार्बनिक अभिक्रियाएँ, जिनमें विषमांश विदलन होता है, आयनी अथवा विषम ध्रुवीय अथवा ध्रुवीय अभिक्रियाएँ कहलाती हैं।

चित्र 12.3 (ख) मेथिल कार्बऋणायन (carbanion) की आकृति
समापघटनी विदलन में सहभाजित युग्म का एक-एक इलेक्ट्रॉन उन दोनों परमाणुओं पर चला जाता है, जो अभिकारक में आबंधित होते हैं। अतः समापघटनी विदलन में इलेक्ट्रॉन युग्म के स्थान पर एक ही इलेक्ट्रॉन का संचलन होता है। एक इलेक्ट्रॉन के संचलन को अर्ध-शीर्ष तीर (फिशहुक, fish hook) द्वारा दर्शाते हैं। इस विदलन के फलस्वरूप उदासीन स्पीशीज़ (परमाणु अथवा समूह) बनती हैं, जिन्हें ‘मुक्त मूलक’ (free radicals) कहते हैं। कार्बधनायन एवं कार्बऋणायन की भाँति मुक्त मूलक भी अतिक्रियाशील होते हैं। कुछ समापघटनी विदलन नीचे दिखाए गए हैं–

एेल्किल मुक्त मूलकों को प्राथमिक, द्वितीयक अथवा तृतीयक में वर्गीकृत किया जा सकता है। एेल्किल मुक्त मूलक प्राथमिक से तृतीयक की ओर बढ़ने पर एेल्किल मूलक का स्थायित्व बढ़ता है।

समांश विदलन द्वारा होने वाली कार्बनिक अभिक्रियाएँ मुक्त मूलक या समध्रुवीय या अध्रुवीय अभिक्रियाएँ कहलाती हैं।
12.7.2 क्रियाधार एवं अभिकर्मक
सामान्यतः कार्बनिक यौगिकों की अभिक्रियाओं में आयन नहीं बनते। अणु स्वयं अभिक्रिया में भाग लेते हैं। यह सुविधाजनक होता है कि एक अभिकर्मक को क्रियाधार और दूसरे को अभिकर्मक नाम दिया जाए। सामान्यतः वह अणु जिसका कार्बन नया आबंध बनाता है क्रियाधार कहलाता है और दूसरे अणु को अभिकर्मक कहते हैं। जब कार्बन-कार्बन आबंध बनता है तो क्रियाधार एवं अभिकर्मक का चयन विवेकानुसार किया जाता है और यह अवलोकित किए जा रहे अणु पर निर्भर करता है। उदाहरण
अभिकर्मक क्रियाधार के क्रियाशील बिन्दु पर आक्रमण करते हैं। क्रियाशील स्थान अणु का इलेक्ट्रॉन के अभाव वाला क्षेत्र (एक धनात्मक क्रियाशील स्थल) हो सकता है। उदाहरणार्थ अणु में उपस्थित अपूर्ण इलेक्ट्रॉन कोश या किसी द्विध्रुव का
धानात्मक सिरा। यदि आक्रमणकारी स्पीशीज्.ा इलेक्ट्रॉन धनी होती है तो इन क्षेत्रों पर आक्रमण करती है। यदि आक्रमणकारी स्पीशीज्.ा में इलेक्ट्रॉनों का अभाव हो तो वह क्रियाधार अणु के उस भाग पर आक्रमण करती है जो इलेक्ट्रॉनों की आपूर्ति कर सकता हो। उदाहरण है द्विबंध के π इलेक्ट्रॉन।
नाभिकरागी और इलेक्ट्रॉनरागी
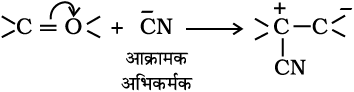
इलेक्ट्रॉन युग्म प्रदान करने वाला अभिकर्मक ‘नाभिकस्नेही’ या या नाभिकरागी (Nucleophile, Nu:) (अर्थात् नाभिक खोजने वाला) कहलाता है, तथा अभिक्रिया ‘नाभिकरागी अभिक्रिया’ कहलाती है। इलेक्ट्रॉन युग्म लेने वाले अभिकर्मक को इलेक्ट्रॉनस्नेही (Electrophile, E+), अर्थात् ‘इलेक्ट्रॉन चाहने वाला’ या इलेक्ट्रानरागी कहते हैं और अभिक्रिया ‘इलेक्ट्रानरागी अभिक्रिया’ कहलाती है।
ध्रुवीय कार्बनिक अभिक्रियाओं में क्रियाधार के इलेक्ट्रॉनरागी केंद्र पर नाभिकरागी आक्रमण करता है। इसी प्रकार क्रियाधारकों के इलेक्ट्रॉनधनी (नाभिक रागी केंद्र) पर इलेक्ट्रॉनरागी आक्रमण करता है। अतः आबंधन अन्योन्य क्रिया के फलस्वरूप इलेक्ट्रॉनरागी क्रियाधार से इलेक्ट्रॉन युग्म प्राप्त करता है। नाभिकरागी से इलेक्ट्रॉनरागी की ओर इलेक्ट्रॉनों का संचलन वक्र तीर द्वारा प्रदर्शित किया जाता है। हाइड्रॉक्साइड (OH–), सायनाइड आयन (–NC) तथा कार्बऋणायन (R3C–:) इलेक्ट्रॉन रागी के कुछ उदाहरण हैं। उदासीन अणु (जैसे–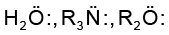 आदि) भी एकाकी इलेक्ट्रॉन युग्म की उपस्थिति के कारण नाभिकरागी की भाँति कार्य करते हैं। इलेक्ट्रॉनरागी के उदाहरणों में कार्बधनायन
आदि) भी एकाकी इलेक्ट्रॉन युग्म की उपस्थिति के कारण नाभिकरागी की भाँति कार्य करते हैं। इलेक्ट्रॉनरागी के उदाहरणों में कार्बधनायन 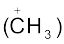 और कार्बोनिल समूह (> C = O) अथवा एेल्किल हैलाइड (R3 C–X, X = हैलोजेन परमाणु) वाले उदासीन अणु सम्मिलित हैं। कार्बधनायन का कार्बन केवल षष्टक होने के कारण इलेक्ट्रॉन-न्यून होता है तथा नाभिकरागी से इलेक्ट्रॉन-युग्म ग्रहण कर सकता है। एेल्किल हैलाइड का कार्बन आबंध ध्रुवता के कारण इलेक्ट्रॉनरागी-केंद्र बन जाता है, जिसपर नाभिकरागी आक्रमण कर सकता है।
और कार्बोनिल समूह (> C = O) अथवा एेल्किल हैलाइड (R3 C–X, X = हैलोजेन परमाणु) वाले उदासीन अणु सम्मिलित हैं। कार्बधनायन का कार्बन केवल षष्टक होने के कारण इलेक्ट्रॉन-न्यून होता है तथा नाभिकरागी से इलेक्ट्रॉन-युग्म ग्रहण कर सकता है। एेल्किल हैलाइड का कार्बन आबंध ध्रुवता के कारण इलेक्ट्रॉनरागी-केंद्र बन जाता है, जिसपर नाभिकरागी आक्रमण कर सकता है।
उदाहरण 12.11
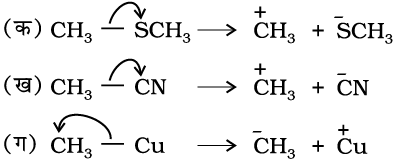
निम्नलिखित अणुओं में सहसंयोजी आबंध के विषम अपघटनी विदलन से सक्रिय मध्यवर्ती का निर्माण वक्र तीर की सहायता से प्रदर्शित कीजिए।
(क) CH3 – SCH3,
(ख) CH3 – CN,
(ग) CH3 – Cu
हल
उदाहरण 12.12
कारण स्पष्ट करते हुए निम्नलिखित को नाभिकरागी तथा इलेक्ट्रॉनरागी में वर्गीकृत कीजिए–
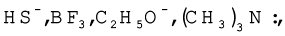
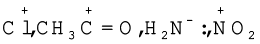
हल
नाभिकरागी ः 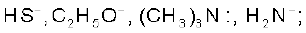
इन स्पीशीज़ पर एकाकी इलेक्ट्रॉन युग्म हैं, जो इलेक्ट्रॉनस्नेही द्वारा प्रदान किए जा सकते हैं।
इलेक्ट्रॉनरागी ः 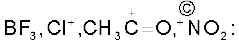 इनपर इलेक्ट्रॉनों का केवल षष्टक है, जिसके कारण ये नाभिकरागी से इलेक्ट्रॉन युग्म ग्रहण कर सकते हैं।
इनपर इलेक्ट्रॉनों का केवल षष्टक है, जिसके कारण ये नाभिकरागी से इलेक्ट्रॉन युग्म ग्रहण कर सकते हैं।
उदाहरण 12.13
निम्नलिखित में इलेक्ट्रॉनरागी केंद्र इंगित कीजिए।
CH3 CH = O, CH3CN एवं CH3I
हल
तारांकित कार्बन इलेक्ट्रॉनरागी केंद्र हैं, क्योंकि आबंध ध्रुवता के कारण इनपर आंशिक धनावेश उत्पन्न हो
जाता है।
12.7.3 कार्बनिक अभिक्रियाओं में इलेक्ट्रॉन संचलन
कार्बनिक अभिक्रियाओं में इलेक्ट्रॉनों का संचलन (Movement) मुड़े हुए तीरों (Curved Anows) द्वारा दर्शाया जा सकता है। अभिक्रिया में इलेक्ट्रॉनों के पुनर्वितरण के कारण होने वाले आबंधन परिवर्तनों को यह दर्शाता है। इलेक्ट्रॉन युग्म की स्थिति में परिवर्तन को दिखाने के लिए तीर उस इलेक्ट्रॉनयुग्म से आरंभ होता है, जो अभिक्रिया में उस स्थिति से संचलन कर रहा है। जहाँ यह युग्म संचलित हो जाता है, वहाँ तीर का अंत होता है।
इलेक्ट्रॉनयुग्म के विस्थापन इस प्रकार होते हैं–
(i) 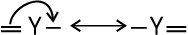 π आबंध से निकटवर्ती आबंध स्थिति पर
π आबंध से निकटवर्ती आबंध स्थिति पर
(ii) 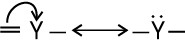 π आबंध से निकटवर्ती परमाणु पर
π आबंध से निकटवर्ती परमाणु पर
(iii) 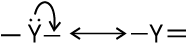 परमाणु से निकटवर्ती आबंध स्थिति पर
परमाणु से निकटवर्ती आबंध स्थिति पर
एक इलेक्ट्रॉन के संचलन को अर्ध-शीर्ष तीर (Single Barbed Half Headed) ‘फिश हुक’ द्वारा दर्शाया जाता है। उदाहरणार्थ–हाइड्रॉक्साइड से एथेनॉल प्राप्त होने में और
क्लोरो-मेथैन के विघटन में मुड़े तीरों का उपयोग करके इलेक्ट्रॉन के संचलन को इस प्रकार दर्शाया जा सकता है–
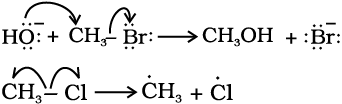
12.7.4 सहसंयोजी आबंधों में इलेक्ट्रॉन विस्थापन के प्रभाव
कार्बनिक अणु में इलेक्ट्रॉन का विस्थापन या तो परमाणु से प्रभावित तलस्थ अवस्था अथवा प्रतिस्थापी समूह अथवा उपयुक्त आक्रमणकारी अभिकर्मक की उपस्थिति में हो सकता है। किसी अणु में किसी परमाणु अथवा प्रतिस्थापी समूह के प्रभाव से इलेक्ट्रॉन का स्थानांतरण आबंध में स्थायी ध्रुवणता उत्पन्न करता है। प्रेरणिक प्रभाव (Inductive effect) एवं अनुनाद प्रभाव (Resonance effect) इस प्रकार के इलेक्ट्रॉन स्थानांतरण के उदाहरण हैं। अभिकर्मक की उपस्थिति में किसी अणु में उत्पन्न अस्थायी इलेक्ट्रॉन-प्रभाव को हम ध्रुवणता-प्रभाव भी कहते हैं। इस प्रकार के इलेक्ट्रॉन स्थानांतरण को ‘इलेक्ट्रोमेरी प्रभाव’ कहते हैं। हम निम्नलिखित खंडों में इन इलेक्ट्रॉन स्थानांतरणों का अध्ययन करेंगे।
12.7.5 प्रेरणिक प्रभाव
भिन्न विद्युत्-ऋणात्मकता के दो परमाणुओं के मध्य निर्मित सहसंयोजक आबंध में इलेक्ट्रॉन असमान रूप से सहभाजित होते हैं। इलेक्ट्रॉन घनत्व उच्च विद्युत् ऋणात्मकता के परमाणु की ओर अधिक होता हैै। इस कारण सहसंयोजक आबंध ध्रुवीय हो जाता है। आबंध ध्रुवता के कारण कार्बनिक अणुओं में विभिन्न इलेक्ट्रॉनिक प्रभाव उत्पन्न होते हैं। उदाहरणार्थ–क्लोरोएथेन (CH3CH2Cl) में C–Cl बंध ध्रुवीय है। इसकी ध्रुवता के कारण कार्बन क्रमांक–1 पर आंशिक धनावेश (δ+) तथा क्लोरीन पर आंशिक ऋणावेश (δ–) उत्पन्न हो जाता है। आंशिक आवेशों को दर्शाने के लिए δ (डेल्टा) चिह्न प्रयुक्त करते हैं। आबंध में इलेक्ट्रॉन-विस्थापन दर्शाने के लिए तीर (→) का उपयोग किया जाता है, जो δ+ से δ– की ओर आमुख
होता है।
कार्बन–1 अपने आंशिक धनावेश के कारण पास के C–C आबंध के इलेक्ट्रॉनों को अपनी ओर आकर्षित करने लगता है। फलस्वरूप कार्बन–2 पर भी कुछ धनावेश (δδ+) उत्पन्न हो जाता है। C–1 पर स्थित धनावेश की तुलना में δδ+ अपेक्षाकृत कम धनावेश दर्शाता है। दूसरे शब्दों में, C–Cl की ध्रुवता के कारण पास के आबंध में ध्रुवता उत्पन्न हो जाती है। समीप के σ आबंध के कारण अगले σ– आबंध के ध्रुवीय होने की प्रक्रिया प्रेरणिक प्रभाव (Inductive Effect) कहलाती है। यह प्रभाव आगे के आबंधोें तक भी जाता हैै, लेकिन आबंधों की संख्या बढ़ने के साथ-साथ यह प्रभाव कम होता जाता है और तीन आबंधों के बाद लगभग लुप्त हो जाता है। प्रेरणिक प्रभाव का संबंध प्रतिस्थापी से बंधित कार्बन परमाणु को इलेक्ट्रॉन प्रदान करने अथवा अपनी ओर आकर्षित कर लेने की योग्यता से है। इस योग्यता के आधार पर प्रतिस्थापियों को हाइड्रोजन के सापेक्ष इलेक्ट्रॉन-आकर्षी (Electron–withdrawing) या इलेक्ट्रॉनदाता समूह के रूप में वर्गीकृत किया जाता है। हैलोजेन तथा कुछ अन्य समूह, जैसे–नाइट्रो (–NO2), सायनो (–CN), कार्बोक्सी (–COOH), एस्टर (–COOR) एेरिलॉक्सी (–OAr) इलेक्ट्रॉन-आकर्षी समूह हैं, जबकि एेल्किल समूह, जैसे– मेथिल (CH3), एथिल (–CH2–CH3) आदि इलेक्ट्रॉनदाता-समूह हैं।
उदाहरण 12.14
इन युग्माें में कौन-सा आबंध अधिक ध्रुवीय है?
(क) H3C–H, H3C–Br
(ख) H3C–NH2, H3C–OH
(ग) H3C–OH, H3C–SH
हल
(क) H3C–Br, क्योंकि H की अपेक्षा Br अधिक विद्युत्ऋणी है।
(ख) C–O,
(ग) C–O
उदाहरण 12.15
CH3–CH2–CH2–Br के किस आबंध में ध्रुवता न्यूनतम होगी?
हल
जैसे-जैसे दूरी बढ़ती है, वैसे-वैसे प्रेरणिक प्रभाव की तीव्रता कम होती जाती है। इसलिए कार्बन 3 एवं हैलोजेन आबंध के मध्य ध्रुवता सबसे कम होगी।
12.7.6 अनुनाद-संरचना
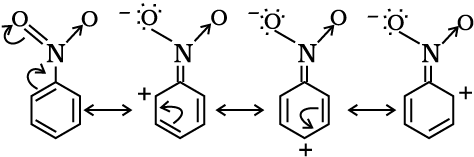
एेसे अनेक कार्बनिक यौगिक हैं, जिनका व्यवहार केवल एक लूइस संरचना के द्वारा नहीं समझाया जा सकता है। इसका एक उदाहरण बेंज़ीन है। एकांतर C–C तथा C=C आबंधयुक्त बेंज़ीन की चक्रीय संरचना इसके विशिष्ट गुणों की व्याख्या करने के लिए पर्याप्त नहीं है।
उपर्युक्त निरूपण के अनुसार, बेंज़ीन में एकल C–C तथा C=C द्विआबंधों के कारण दो भिन्न आबंध लंबाइयाँ होनी चाहिए, लेकिन प्रयोगात्मक निर्धारण से यह पता चला कि बेंज़ीन में समान C – C समान आबंध लंबाई 139pm है, जो एकल C–C आबंध (154pm) और द्विआबंध (C = C) का मध्यवर्ती मान है। अतः बेंज़ीन की संरचना उपर्युक्त संरचना द्वारा प्रदर्शित नहीं की जा सकती। बेंज़ीन को निम्नलिखित I तथा II समान ऊर्जा-संरचनाओं द्वारा प्रदर्शित किया जा सकता है।
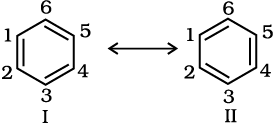
अतः अनुनाद सिद्धांत (एकक 4) के अनुसार बेंज़ीन की वास्तविक संरचना को उपरोक्त दोनों में से किसी एक संरचना द्वारा हम पूर्ण रूप से प्रदर्शित नहीं कर सकते। वास्तविक तौर पर यह दो संरचनाओं (I तथा II) की संकर (Hybrid) होती है, जिन्हें ‘अनुनाद-संरचनाएँ’ (Resonance Structures) कहते हैं। अनुनाद-संरचनाएँ (केनोनिकल संरचना या योगदान करनेवाली संरचना) काल्पनिक हैं। ये वास्तविक संरचना का प्रतिनिधित्व अकेले नहीं कर सकती हैं। ये अपने स्थायित्व-अनुपात के आधार पर वास्तविक संरचना में योगदान करती हैं।
अनुनाद का एक अन्य उदाहरण नाइट्रोमेथैन में मिलता है, जिसे दो लूइस संरचनाओं (I व II) द्वारा प्रदर्शित किया जा सकता है। इन संरचनाओं में दोप्रकार के N–O आबंध हैं।
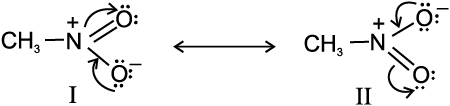
परंतु यह ज्ञात है कि दोनों N–O आबंधों की लंबाइयाँ समान हैं, (जो N–O एकल आबंध तथा N=O द्विआबंध की मध्यवर्ती हैं)। अतः नाइट्रोमेथैन की वास्तविक संरचना दो केनोनिकल रूपों I व II की अनुनाद संकर हैं।
वास्तविक अणु (अनुनाद संकर) की ऊर्जा किसी भी केनोनिकल संरचना से कम होती है। वास्तविक संरचना तथा न्यूनतम ऊर्जावाली अनुनाद-संरचना की ऊर्जा के अंतर को ‘अनुनाद-स्थायीकरण ऊर्जा’ (Resonance Stabilisation Energy) या ‘अनुनाद ऊर्जा’ कहते हैं। अनुनादी संरचनाएँ जितनी अधिक होंगी, उतनी ही अधिक अनुनाद ऊर्जा होगी। समतुल्य ऊर्जा वाली संरचनाओं के लिए अनुनाद विशेष रूप से महत्त्वपूर्ण हैं।
अनुनाद-संरचनाओं को लिखते समय निम्नलिखित नियमों का पालन किया जाता है-
(i) अनुनाद-संरचनाओं में नाभिक की स्थिति समान रहती है।
(ii) अनुनाद संरचनाओं में अयुग्मित इलेक्ट्रॉनों की संख्या समान रहती है।
अनुनाद-संरचनाओं में वह संरचना अधिक स्थायी होती हैं, जिसमें अधिक सहसंयोजी आबंध होते हैं। इसमें सारे परमाणु इलेक्ट्रानों के अष्टक (हाइड्रॉजन परमाणु को छोड़कर, जिसमें दो इलेक्ट्रॉन होते हैं)। विपरीत आवेश का पृथक्करण कम होता है। यदि ऋणात्मक आवेश है, तो अधिक विद्युत्ऋणी तत्त्व पर होता है। धनात्मक आवेश यदि है, तो वह अधिक विद्युत्धनी तत्त्व पर होता है तथा अधिक आवेश प्रसार होता है।
उदाहरण 12.16
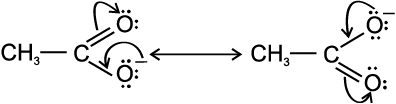
CH3COO– की अनुनाद-संरचनाएँ लिखें और वक्र तीरों द्वारा इलेक्ट्रॉन का संचलन दर्शाएँ।
हल
सर्वप्रथम संरचना लिखकर उपयुक्त परमाणुओं पर असहभाजित इलेक्ट्रॉन तथा इलेक्ट्रॉन का संचलन तीर द्वारा दर्शाइए।
उदाहरण 12.17
CH2 = CH – CHO की अनुनाद-संरचनाएँ लिखें तथा विभिन्न अनुनाद-संरचनाओं के आपेक्षिक स्थायित्व को दर्शाएँ।
हल
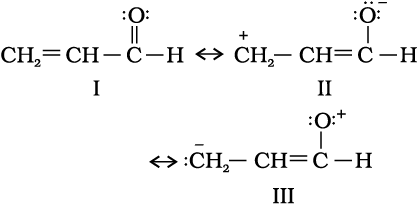
स्थायित्व ः I > II > III
I : सर्वाधिक स्थायी है, क्योंकि प्रत्येक कार्बन तथा अॉक्सीजन का अष्टक पूर्ण है तथा कार्बन और अॉक्सीजन पर विपरीत आवेशों का पृथक्करण नहीं है।
II : ऋणावेश अधिक ऋणविद्युत्ी परमाणु पर तथा धनावेश अधिक धनविद्युती परमाणु पर है।
III : न्यूनतम स्थायी है, क्योंकि धनावेश अधिक ऋणविद्युती परमाणु पर उपस्थित है, जबकि अधिक धनविद्युती कार्बन पर ऋणावेश उपस्थित है।
उदाहरण 12.18
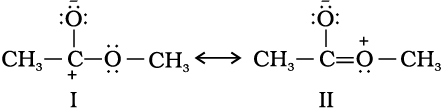
निम्नलिखित संरचनाएँ (I तथा II) CH3 COOCH3 की वास्तविक संरचना में कोई विशेष योगदान क्यों नहीं करती हैं?
हल
दोनों संरचनाओं का विशेष योगदान नहीं होगा, क्योंकि इनमें विपरीत आवेशों का पृथक्करण है। इसके अतिरिक्त संरचना I में कार्बन का अष्टक पूर्ण नहीं है।
12.7.7 अनुनाद-प्रभाव
दो π-आबंधों की अन्योन्य क्रिया अथवा π-बंध एवं समीप के परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म के बीच अन्योन्य क्रिया के कारण अणु में उत्पन्न ध्रुवता को ‘अनुनाद-प्रभाव’ (Resonance Effect) कहा जाता है। यह प्रभाव शृंखला में संचारित होता है। दो प्रकार के अनुनाद अथवा मेसोमेरिप्रभाव’ अथवा ‘M प्रभाव’ कहा जाता है।
(i) धनात्मक अनुनादक प्रभाव होते हैं, जिन्हें ‘R-प्रभाव (+ R प्रभाव)
इस प्रभाव में इलेक्ट्रॉन विस्थापन संयुग्मित अणु में बंधित परमाणु यह प्रतिस्थापी समूह से दूर होता है। इस इलेक्ट्रॉन-विस्थापन के कारण अणु में कुछ स्थितियाँ उच्च इलेक्ट्रॉन घनत्व की हो जाती हैं। एेनिलीन में इस प्रभाव को इस प्रकार दर्शाया जाता है–

(ii) ऋणात्मक अनुनाद-प्रभाव (–R प्रभाव)
यह प्रभाव तब प्रदर्शित होता है, जब इलेक्टॉन का विस्थापन संयुग्मित अणु में बंधित परमाणु अथवा प्रतिस्थापी समूह की ओर होता है। उदाहरणार्थ–नाइट्रोबेंज़ीन में इस इलेक्ट्रॉन- विस्थापन को इस प्रकार दर्शाया जाता है–
+R अथवा –R इलेक्ट्रॉन विस्थापन प्रभाव दर्शानेवाले परमाणु अथवा प्रतिस्थापी-समूह निम्नलिखित हैं–
+R :– हैलोजेन, OH, OR, OCOR, NH2, NHR, NR2, NHCOR
–R :– COOH, –CHO, >C = O, –CN, –NO2
किसी विवृत शृंखला अथवा चक्रीय निकाय में एकांतरी एकल और द्विआबंधों की उपस्थिति को ‘संयुग्मित निकाय’ कहते हैं। ये बहुधा असामान्य व्यवहार दर्शाते हैं। 1, 3– ब्यूटाडाइईन, एेनिलीन, नाइट्रोबेंज़ीन इत्यादि इसके उदाहरण हैं। एेसे निकायों में π- इलेक्ट्रॉन विस्थापित (Delocalised) हो जाते हैं तथा ध्रुवता उत्पन्न होती है।
12.7.8 इलेक्ट्रोमेरी प्रभाव (E प्रभाव)
यह एक अस्थायी प्रभाव है। केवल आक्रमणकारी अभिकारकों की उपस्थिति में यह प्रभाव बहुआबंध (द्विआबंध अथवा त्रिआबंध) वाले कार्बनिक यौगिकों में प्रदर्शित होता है। इस प्रभाव में आक्रमण करनेवाले अभिकारक की माँग के कारण बहु-आबंध से बंधित परमाणुओं में एक सहभाजित π इलेक्ट्रॉन युग्म का पूर्ण विस्थापन होता है। अभिक्रिया की परिधि से आक्रमणकारी अभिकारक को हटाते ही यह प्रभाव शून्य हो जाता है। इसे E द्वारा दर्शाया जाता है, जबकि इलेक्ट्रॉन के संचलन को वक्र तीर ( ) द्वारा प्रदर्शित किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं–
) द्वारा प्रदर्शित किया जाता है। स्पष्टतः दो प्रकार के इलेक्ट्रोमेरी प्रभाव होते हैं–
(i) धनात्मक इलेक्ट्रोमेरी प्रभाव (+ E प्रभाव)ः इस प्रभाव में बहुआबंध के π-इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित होता है। उदाहरणार्थ–
(ii) ऋणात्मक इलेक्ट्रोमेरी-प्रभाव (–E प्रभाव)ः इस प्रभाव में बहु-आबंध के π-इलेक्ट्रॉनों का स्थानांतरण उस परमाणु पर होता है, जिससे आक्रमणकारी अभिकर्मक बंधित नहीं होता है। इसका उदाहरण यह है–
जब प्रेरणिक तथा इलेक्ट्रोमेरी प्रभाव एक-दूसरे की विपरीत दिशाओं में कार्य करते हैं, तब इलेक्ट्रोमेरिक प्रभाव प्रबल होता है।
12.7.9 अतिसंयुग्मन
अतिसंयुग्मन एक सामान्य स्थायीकरण अन्योन्य क्रिया है। इसमें किसी असंतृप्त निकाय के परमाणु से सीधे वांछित एेल्किल समूह के C–H आबंध अथवा असहभाजित p कक्षक वाले परमाणु के σ इलेक्ट्रॉनों का विस्थानीकरण हो जाता है। एेल्किल समूह के C–H, आबंध के σ इलेक्ट्रॉन निकटवर्ती असंतृप्त निकाय अथवा असहभाजित p कक्षक के साथ आंशिक संयुग्मन (Partial Conjugation) दर्शाते हैं। अतिसंयुग्मन एक स्थायी प्रभाव है।
अतिसंयुग्मन को समझने के लिए हम 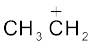 (एथिल धनायन) का उदाहरण लेते हैं, जिसमें धनावेशित कार्बन पर एक रिक्त π कक्षक है। मेथिल समूह का एक C–H आबंध रिक्त π कक्षक के तल के संरेखण में हो जाता है, जिसके कारण C–H आबंध के इलेक्ट्रॉन रिक्त π कक्षक में विस्थानीकृत हो जाते हैं, जैसा चित्र 12.4 (क) में दर्शाया गया है।
(एथिल धनायन) का उदाहरण लेते हैं, जिसमें धनावेशित कार्बन पर एक रिक्त π कक्षक है। मेथिल समूह का एक C–H आबंध रिक्त π कक्षक के तल के संरेखण में हो जाता है, जिसके कारण C–H आबंध के इलेक्ट्रॉन रिक्त π कक्षक में विस्थानीकृत हो जाते हैं, जैसा चित्र 12.4 (क) में दर्शाया गया है।

चित्र 12.4 (क) एथिल धनायन में अतिसंयुग्मन दर्शाता कक्षक आरेख
इस प्रकार के अतिव्यापन से कार्बधनायन का स्थायित्व बढ़ जाता है, क्योंकि निकटवर्ती σ आबंध धनावेश के विस्थानीकरण में सहायता करता है।
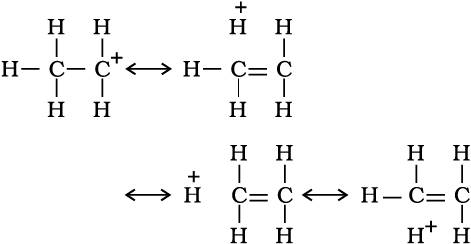
सामान्यतया धनावेशित कार्बन से संयुक्त एेल्किल समूहों की संख्या बढ़ने पर अतिसंयुग्मन अन्योन्य क्रिया अधिक होती है, जिसके कारण कार्बधनायन का स्थायित्व बढ़ता है। विभिन्न कार्बधनायन के स्थायित्व का क्रम इस प्रकार है–
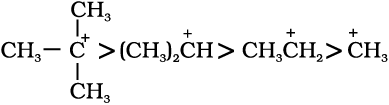
एेल्कीनों तथा एेल्किलएेरीनों में भी अतिसंयुग्मन संभव है। एेल्कीनों में अतिसंयुग्मन द्वारा इलेक्ट्रॉनों का विस्थानीकरण इस चित्र (12.4 ख) में दर्शाया गया है।
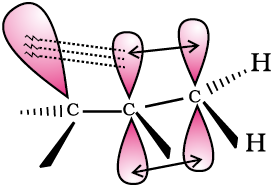
चित्र 12.4 (ख) प्रोपीन में अतिसंयुग्मन का कक्षक चित्र
अतिसंयुग्मन प्रभाव को समझने के कई तरीके हैं। उनमें से एक तरीके में अनुनाद के कारण C–H आबंध में आंशिक आयनीकरण होना माना गया है।
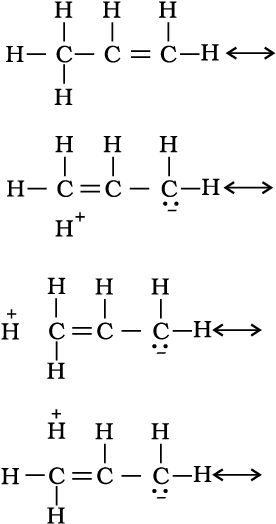
अतिसंयुग्मन आबंधरहित अनुनाद भी कहलाता है।
उदाहरण 12.19
(CH3)3C+, 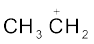 की अपेक्षा अधिक स्थायी क्यों है और +CH3 का स्थायित्व न्यूनतम क्यों है?
की अपेक्षा अधिक स्थायी क्यों है और +CH3 का स्थायित्व न्यूनतम क्यों है?
हल
(CH3)3C+ में नौ (C–H) बंध होने के कारण उसमें अतिसंयुग्मन अन्योन्य क्रिया की मात्रा 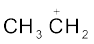 की तुलना में काफी अधिक होती है। +CH3 में रिक्त p कक्षक C – H आबंध के तल के लंबवत होने के कारण इसके साथ अतिव्यापन नहीं कर सकते हैं। अतः +CH3 में अतिसंयुग्मन नहीं होता है।
की तुलना में काफी अधिक होती है। +CH3 में रिक्त p कक्षक C – H आबंध के तल के लंबवत होने के कारण इसके साथ अतिव्यापन नहीं कर सकते हैं। अतः +CH3 में अतिसंयुग्मन नहीं होता है।
12.7.10 कार्बनिक अभिक्रियाएँ और उनकी क्रियाविधियाँ
कार्बनिक अभिक्रियाओं को निम्नलिखित वर्गों में वर्गीकृत किया जा सकता है–
(i) प्रतिस्थापन अभिक्रियाएँ
(ii) संकलन यानी योगज अभिक्रियाएँ
(iii) विलोपन अभिक्रियाएँ
(iv) पुनर्विन्यास अभिक्रियाएँ
आप इन अभिक्रियाओं के बारे में इस पुस्तक के एकक-13 एवं कक्षा XII में पढ़ेंगे।
12.8 कार्बनिक यौगिकों के शोधन की विधियाँ
किसी प्राकृतिक स्रोत से निष्कर्षण (Extraction) अथवा प्रयोगशाला में संश्लेषण के पश्चात् कार्बनिक यौगिक का शोधन (Purification) आवश्यक होता है। शोधन के लिए प्रयुक्त विभिन्न विधियों का चुनाव यौगिक की प्रकृति तथा उसमें उपस्थित अशुद्धियों के अनुसार किया जाता है।
शोधन के लिए साधाारणतः निम्नलिखित विधियाँ उपयोग में लाई जाती हैं–
(i) ऊर्ध्वपातन (Sublimation)
(ii) क्रिस्टलन (Crystallisation)
(iii) आसवन (Distillation)
(iv) विभेदी निष्कर्षण (Differential Extraction) तथा
(v) वर्णलेखन (क्रोमेटोग्राफी, Chromotography)
अंततः यौगिक का गलनांक अथवा क्वथनांक ज्ञात करके उसकी शुद्धता की जाँच की जाती है। अधिकांश शुद्ध यौगिकों का गलनांक या क्वथनांक सुस्पष्ट, अर्थात् तीक्ष्ण होता है। शुद्धता की जाँच की नवीन विधियाँ विभिन्न प्रकार के वर्णलेखन तथा स्पेक्ट्रमिकी तकनीकों पर आधारित हैं।
12.8.1 ऊर्ध्वपातन
आपने पूर्व में सीखा है कि कुछ ठोस पदार्थ गरम करने पर बिना द्रव अवस्था में आए, वाष्प में परिवर्तित हो जाते हैं। उपरोक्त सिद्धांत पर आधारित शोधन तकनीक को ‘ऊर्ध्वपातन’ कहते हैं। इसका उपयोग ऊर्ध्वपातनीय यौगिक का दूसरे विशुद्ध यौगिकों (जो ऊर्ध्वपातनीय नहीं होते) से पृथक् करने में होता है।
12.8.2 क्रिस्टलन
यह ठोस कार्बनिक पदार्थों के शोघन की प्रायः प्रयुक्त विधि है। यह विधि कार्बनिक यौगिक तथा अशुद्धि की किसी उपयुक्त विलायक में इनकी विलेयताओं में निहित अंतर पर आधाारित होती है। अशुद्ध यौगिक को किसी एेसे विलायक में घोलते हैं, जिसमें यौगिक सामान्य ताप पर अल्प-विलेय (Sparingly Soluble) होता है, परंतु उच्चतर ताप पर यथेष्ट मात्रा में वह घुल जाता है। तत्पश्चात् विलयन को इतना सांद्रित करते हैं कि वह लगभग संतृप्त (Saturate) हो जाए। विलयन को ठंडा करने पर शुद्ध पदार्थ क्रिस्टलित हो जाता है, जिसे निस्यंदन द्वारा पृथक् कर लेते हैं। निस्यंद (मात्र द्रव) में मुख्य रूप से अशुद्धियाँ तथा यौगिक की अल्प मात्रा रह जाती है। यदि यौगिक किसी एक विलायक में अत्यधिक विलेय तथा किसी अन्य विलायक में अल्प विलेय होता है, तब क्रिस्टलन उचित मात्रा में इन विलायकों की मिश्रण करके किया जाता है। सक्रियित काष्ठ कोयले (Achrated Charcoal) की सहायता से रंगीन अशुद्धियाँं निकाली जाती हैं। यौगिक तथा अशुद्धियों की विलेयताओं में कम अंतर होने की दशा में बार-बार क्रिस्टलन द्वारा शुद्ध यौगिक प्राप्त किया जाता है।
12.8.3 आसवन
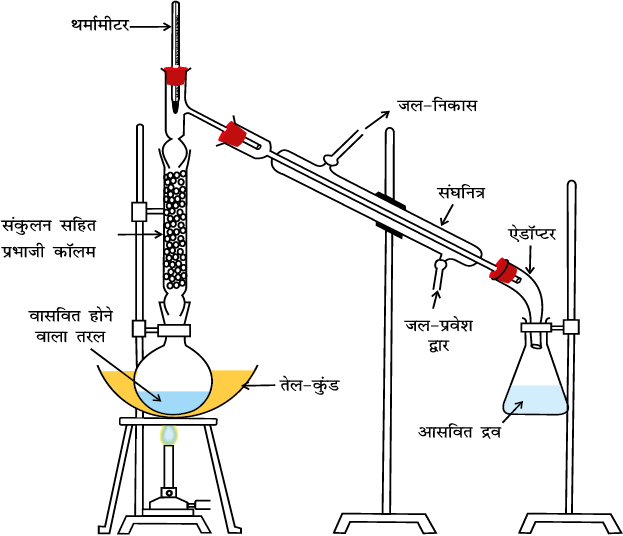
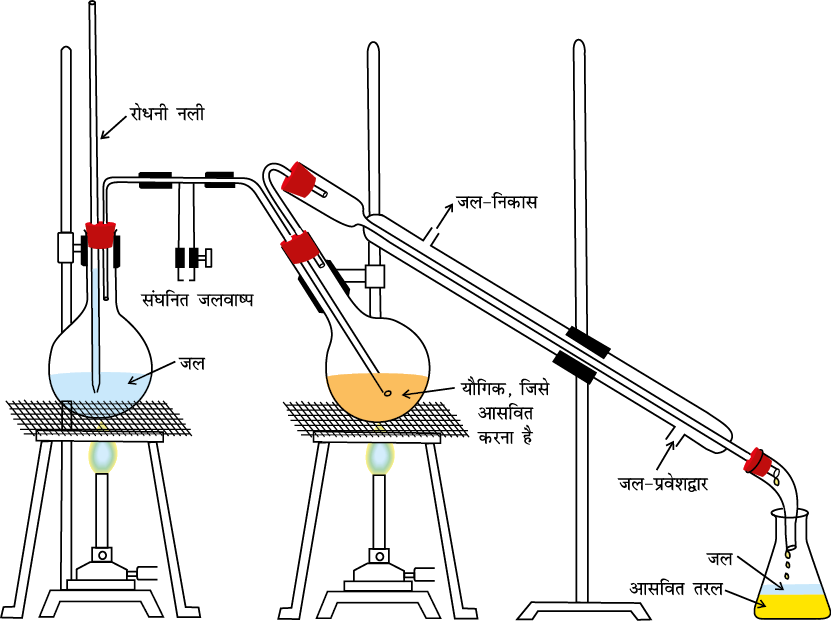
इस महत्त्वपूर्ण विधि की सहायता से (i) वाष्पशील (Volatile) द्रवों को अवाष्पशील अशुद्धियों एवं (ii) एेसे द्रवों, जिनके क्वथनांकों में पर्याप्त अंतर हो, को पृथक् कर सकते हैं। भिन्न क्वथनांकों वाले द्रव भिन्न ताप पर वाष्पित होते हैं। वाष्पों को ठंडा करने से प्राप्त द्रवों को अलग-अलग एकत्र कर लेते हैं। क्लोरोफार्म (क्वथनांक 334K) और एेनिलीन (क्वथनांक 457K) को आसवन विधि द्वारा आसानी से पृथक् कर सकते हैं (चित्र 12.5)। द्रव-मिश्रण को गोल पेंदे वाले फ्लास्क में लेकर हम सावधानीपूर्वक गरम करते हैं। उबालने पर कम क्वथनांक वाले द्रव की वाष्प पहले बनती है। वाष्प को संघनित्र की सहायता से संघनित करके प्राप्त द्रव को ग्राही में एकत्र कर लेते हैं। उच्च क्वथनांक वाले घटक के वाष्प बाद में बनते हैं। इनमें संघनन से प्राप्त द्रव को दूसरे ग्राही में एकत्र कर लेते हैं।

चित्र 12.5 साधारण आसवन। पदार्थ की वाष्प को संघनित कर द्रव के शंक्वाकार फ्लास्क में एकत्र किया जाता है।
प्रभाजी आसवन ः दो द्रवों के क्वथनांकों में पर्याप्त अंतर न होने की दशा में उन्हें साधारण आसवन द्वारा पृथक् नहीं किया जा सकता। एेसे द्रवों के वाष्प इसी ताप परास में बन जाते हैं तथा साथ-साथ संघनित हो जाते हैं। एेसी दशा में प्रभाजी आसवन की तकनीक का उपयोग किया जाता है। इस तकनीक में गोल पेंदे वाले फ्लास्क के मुख में लगे हुए प्रभाजी कॉलम से द्रव मिश्रण की वाष्प को प्रवाहित करते हैं (चित्र 12.6, पृष्ठ 258)।
उच्चतर क्वथनांक वाले द्रव के वाष्प निम्नतर क्वथनांक वाले द्रव के वाष्प की तुलना में पहले संघनित होती है। इस प्रकार प्रभाजी कॉलम में ऊपर उठने वाले वाष्प में अधिक वाष्पशील पदार्थ की मात्रा अधिक होती जाती है। प्रभाजी कॉलम के शीर्ष तक पहुँचते-पहुँचते वाष्प में मुख्यतः अधिक वाष्पशील अवयव ही रह जाता है। विभिन्न डिज़ाइन एवं आकार के प्रभाजी कॉलम चित्र 12.7, पृष्ठ 258 में दिखाए गए हैं। प्रभाजी कॉलम ऊपर उठती वाष्प तथा नीचे गिरते द्रव के बीच ऊष्मा-विनिमय के लिए कई पृष्ठ (Surface) उपलब्ध कराता है। प्रभाजी कॉलम में संघनित द्रव ऊपर उठती वाष्प से ऊष्मा लेकर पुनः वाष्पित हो जाता है। इस प्रकार वाष्प में कम क्वथनांक वाले द्रव की मात्रा बढ़ती जाती है। इस तरह की क्रमिक आसवन श्रेणी के उपरांत निम्नतर क्वथनांक वाले अवयव के शुद्ध वाष्प कॉलम के शीर्ष पर पहुँचते हैं। संघनित्र में संघनित होकर यह शुद्ध द्रव के रूप में ग्राही में एकत्र कर ली जाती है। क्रमिक आसवन श्रेणी के उपरांत आसवन फ्लास्क के शेष द्रव में उच्चतर क्वथनांक वाले द्रव की मात्रा बढ़ती जाती है। प्रत्येक क्रमिक संघनन तथा वाष्पन को सैद्धांतिक प्लेट (Theoretical Plate) कहते हैं। व्यापारिक स्तर पर उपयोग के लिए सैकड़ों प्लेटों वाले कॉलम उपलब्ध हैं।
प्रभाजी आसवन का एक तकनीकी उपयोग पेट्रोलियम उद्योग में कच्चे तेल के विभिन्न प्रभाजों को पृथक् करने में किया जाता है।
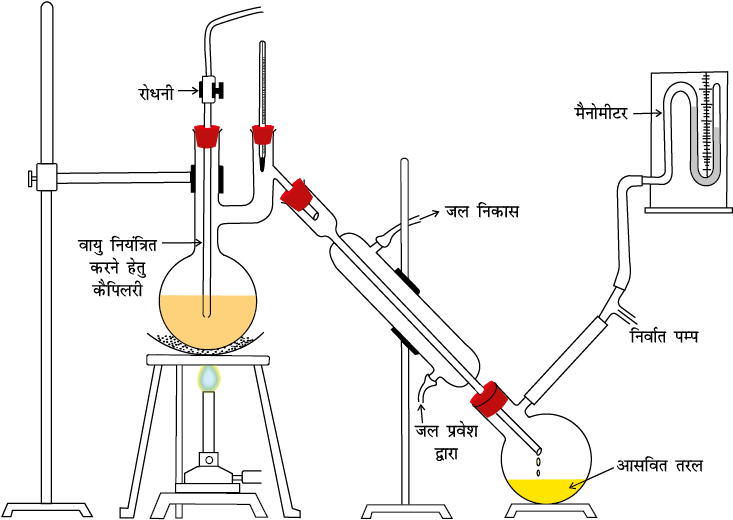
निम्न दाब पर आसवन ः यह विधि उन द्रवों के शोधन के लिए प्रयुक्त की जाती है, जिनके क्वथनांक अति उच्च होते हैं अथवा जो अपने क्वथनांक या उनसे भी कम ताप पर अपघटित हो जाते हैं। एेसे द्रवों के पृष्ठ पर दाब कम करके उनके क्वथनांक से कम ताप पर उबाला जाता है। कोई भी द्रव उस ताप पर उबलता है, जिसपर उसका वाष्प दाब बाह्य दाब के समान होता है। दाब कम करने के लिए जल पंप अथवा निर्वात पंप का उपयोग किया जाता है (चित्र 12.8, पृष्ठ 359)। साबुन उद्योग में युक्त शेष लाई (Spent Lye) से ग्लिसरॉल पृथक् करने के लिए इस विधि का उपयोग किया जाता है।
चित्र 12.6 प्रभाजी आसवन निम्न क्वथन प्रभाज की वाष्प कॉलम के शीर्ष तक पहले पहुँचती है। तत्पश्चात् उच्च क्वथन की वाष्प पहुँचती है।
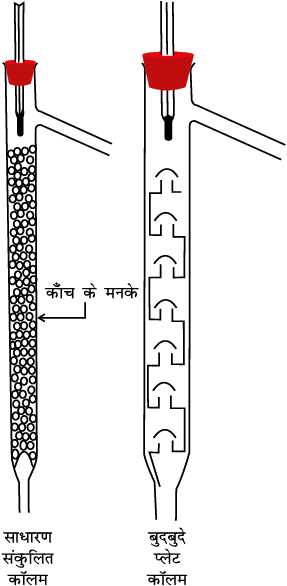
चित्र 12.7 विभिन्न प्रकार के प्रभाजी कॉलम
भाप आसवन ः यह तकनीक उन पदार्थों के शोधन के लिए प्रयुक्त की जाती है, जो भाप वाष्पशील हाें, परंतु जल में अमिश्रणीय हों। भाप आसवन में अशुद्ध द्रव को फ्लास्क में गरम करते हुए इसमें भाप प्रवाहित की जाती है। भाप तथा वाष्पशील द्रव का मिश्रण संघनित कर एकत्र कर लिया जाता है। तत्पश्चात् द्रव तथा जल को पृथक्कारी कीप द्वारा पृथक् कर लेते हैं। भाप आसवन में कार्बनिक द्रव (p1) तथा जल (p2) के वाष्प दाब का योग वायुमंडलीय दाब (p) के समान होने पर द्रव उबलता है, अर्थात् p = p1 + p2। चूँकि p1 का मान p से कम है, अतः द्रव अपने क्वथनांक की अपेक्षा निम्नतर ताप पर ही वाष्पित हो जाता है।
इस प्रकार जल तथा उसमें अविलेय पदार्थ का मिश्रण 373K के पास उससे निम्न ताप पर ही उबल जाता है। प्राप्त होने वाले पदार्थ तथा जल के मिश्रण को पृथक्कारी कीप की सहायता से अलग कर लेते हैं। एेनिलीन को इस विधि की सहायता से एेनिलीन जल के मिश्रण में से पृथक् किया जाता है (चित्र 12.9, पृष्ठ 359)।
12.8.4 विभेदी निष्कर्षण
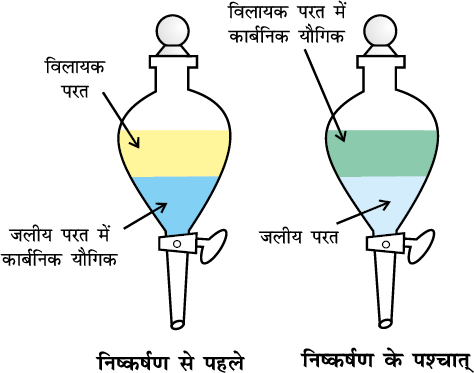
इस विधि की सहायता से कार्बनिक यौगिक को उसके जलीय विलयन में से एेसे कार्बनिक विलायक द्वारा निष्कर्षित किया जाता है, जिसमें कार्बनिक यौगिक की विलेयता जल की अपेक्षा अधिक होती है। जलीय विलयन तथा कार्बनिक विलायक अमिश्रणीय होने चाहिए, ताकि वे दो परत बना सकें, जिन्हें पृथक्कारी कीप द्वारा पृथक् किया जा सके। तत्पश्चात् यौगिक के विलयन में से कार्बनिक विलायक को आसवन द्वारा दूर करके शुद्ध यौगिक प्राप्त कर लिया जाता है। विभेदी निष्कर्षण एक पृथक्कारी कीप में किया जाता है, जैसा चित्र 12.10, पृष्ठ 360 में दर्शाया गया है। कार्बनिक विलायक में यौगिक की विलेयता अल्प होने की दशा में इस विधि में विलायक की काफी मात्रा की आवश्यकता पड़ेगी। इस दशा में एक परिष्कृत तकनीक का उपयोग हम करते हैं, जिसे सतत निष्कर्षण (Continous Extraction) कहते हैैं। इस तकनीक से उसी विलायक का उपयोग बार-बार होता है।
चित्र 12.8 कम दाब पर आसवन। निम्न दाब पर द्रव अपने क्वथनांक की अपेक्षा निम्न ताप पर उबलने लगता है।
चित्र 12.9 भाप आसवन। भाप वाष्पशील अवयव वाष्पीकृत होकर संघनित्र में संघनित होता हैै। तब द्रव को शंक्वाकार फ्लास्क में एकत्र कर लिया जाता है।
चित्र 12.10 विभेदी निष्कर्षण। अवयवों का पृथक्करण विलेयता में अंतर पर आधारित होता है।
12.8.5 वर्णलेखन (क्रोमेटोग्रैफी)
‘वर्णलेखन’ (क्रोमेटोग्रैफी) शोधन की एक अत्यंत महत्त्वपूर्ण तकनीक है, जिसका उपयोग यौगिकों का शोधन करने में, किसी मिश्रण के अवयवों को पृथक् करने तथा यौगिकों की शुद्धता की जाँच करने के लिए विस्तृत रूप से किया जाता है। क्रोमेटोग्रैफी विधि का उपयोग सर्वप्रथम पादपों में पाए जाने वाले रंगीन पदार्थों को पृथक् करने के लिए किया गया था। ‘क्रोमेटोग्रैफी’ शब्द ग्रीक शब्द ‘क्रोमा’ (Chroma) से बना है, जिसका अर्थ है ‘रंग’। इस तकनीक में सर्वप्रथम यौगिकों के मिश्रण को स्थिर प्रावस्था (Stationary Phase) पर अधिशोषित कर दिया जाता है। स्थिर प्रावस्था ठोस अथवा द्रव हो सकती है। इसके पश्चात् स्थिर प्रावस्था में से उपयुक्त विलायक, विलायकों के मिश्रण अथवा गैस को धीरे-धीरे प्रवाहित किया जाता है। इस प्रकार मिश्रण के अवयव क्रमशः एक-दूसरे से पृथक् हो जाते हैं। गति करनेवाली प्रावस्था को ‘गतिशील प्रावस्था’ (Mobile Phase) कहते हैं।
अंतर्गΡस्त सिद्धांतों के आधार पर वर्णलेखन को विभिन्न वर्गों में वर्गीकृत किया गया है। इनमें से दो हैं–
(क) अधिशोषण-वर्णलेखन (Adsorption Chromato-graphy)
(ख) वितरण-वर्णलेखन (Partition Chromatography)
(क) अधिशोषण-वर्णलेखन ः यह इस सिद्धांत पर आधारित है कि किसी विशिष्ट अधिशोषक (Adsorbent) पर विभिन्न यौगिक भिन्न अंशों में अधिशोषित होते हैं। साधारणतः एेलुमिना तथा सिलिका जेल अधिशोषक के रूप में प्रयुक्त किए जाते हैं। स्थिर प्रावस्था (अधिशोषक) पर गतिशील प्रावस्था प्रवाहित करने के उपरांत मिश्रण के अवयव स्थिर प्रावस्था पर अलग-अलग दूरी तय करते हैं। निम्नलिखित दो प्रकार की वर्णलेखन-तकनीकें हैं, जो विभेदी-अधिशोषण सिद्धांत पर आधारित हैं–
(क) कॉलम-वर्णलेखन, अर्थात् स्तंभ-वर्णलेखन (Column Chromatography)
(ख) पतली परत वर्णलेखन (Thin Layer Chromato-graphy)
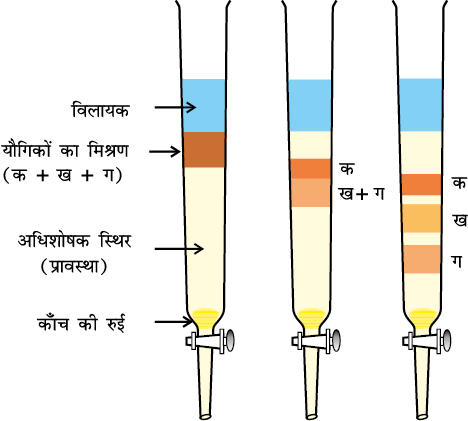
कॉलम वर्णलेखन ः इस तकनीक में काँच की एक लंबी नली में अधिशोषक (स्थिर प्रावस्था) भरा जाता है। नली के निचले सिरे पर रोधनी लगी रहती है (चित्र 12.11)। यौगिक के मिश्रण को उपयुक्त विलायक की न्यूनतम मात्रा में घोलकर कॉलम के ऊपरी भाग में अधिशोषित कर देते हैं। तत्पश्चात् एक उपयुक्त निक्षालक (जो द्रव या द्रवों का मिश्रण होता है) को कॉलम में धीमी गति से नीचे की ओर बहने दिया जाता है। विभिन्न यौगिकों के अधिशोषण की मात्रा के आधार पर उनका आंशिक या पूर्ण पृथक्करण हो जाता है। अधिक अधिशोषित यौगिक कॉलम के ऊपर अधिक सरलता से अधिशेष रह जाते हैं, जबकि अन्य यौगिक कॉलम में विभिन्न दूरियों तक नीचे आ जाते हैं (चित्र 12.11)।
चित्र 12.11 कॉलम क्रोमेटोग्रैफी। किसी मिश्रण के अवयवों के पृथक्करण की विभिन्न स्थितियाँ।
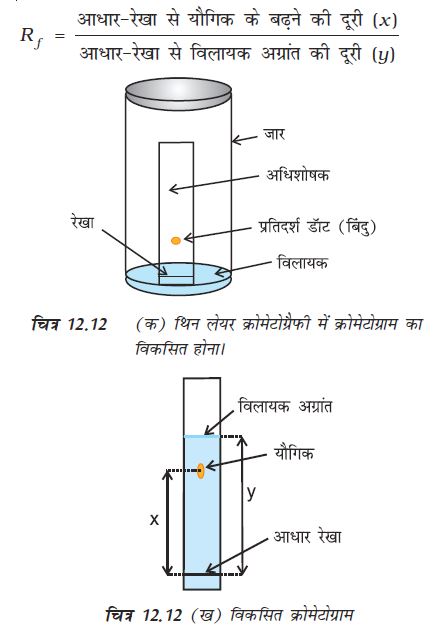
पतली परत वर्णलेखन ः पतली परत वर्णलेखन (थिन लेयर क्रोमेटोग्रैफी, टी.एल.सी.) एक अन्य प्रकार का अधिशोषण वर्णलेखन है। इसमें एक अधिशोषक की पतली परत पर मिश्रण के अवयवों का पृथक्करण होता है। इस तकनीक में काँच की उपयुक्त आमाप की प्लेट पर अधिशोषक (सिलिका जेल या एेलुमिना) की पतली (लगभग 0.2 mm की) परत फैला दी जाती है। इसे ‘पतली परत क्रोमेटोग्रैफी प्लेट’ कहते हैं। मिश्रण के विलयन का छोटा-सा बिंदु प्लेट के एक सिरे से लगभग 2 cm ऊपर लगाते हैं। प्लेट को अब कुछ ऊँचाई तक विलायक से भरे एक बंद जार में खड़ा कर देते हैं। जिसे चित्र 12.12 (क)। निक्षालक जैसे-जैसे प्लेट पर आगे बढ़ता है, वैसे-वैसे मिश्रण के अवयव भी निक्षालक के साथ-साथ प्लेट पर आगे बढ़ते हैं, परंतु अधिशोषण की तीव्रता के आधार पर ऊपर बढ़ने की उनकी गति भिन्न होती है। इस कारण वे पृथक् हो जाते हैं। विभिन्न यौगिकों के सापेक्ष अधिशोषण को मन्दन-गुणक (Retardation Factor), अर्थात् Rf मान द्वारा प्रदर्शित किया जाता है (12.12 ख)।
रंगीन यौगिकों के बिंदुओं को प्लेट पर बिना किसी कठिनाई के देखा जा सकता है। परंतु रंगहीन एवं पराबैगंनी प्रकाश में प्रतिदीप्त (Fluoresce) होने वाले यौगिकों के बिंदुओं को प्लेट पर पराबैगनी प्रकाश के नीचे रखकर देखा जा सकता है। एक अन्य तकनीक में जार में कुछ आयोडीन के क्रिस्टल रखकर भी रंगहीन बिंदुओं को देखा जा सकता है। जो यौगिक आयोडीन अवशोषित करते हैं, उनके बिंदु भूरे दिखाई देने लगते हैं। कभी-कभी उपयुक्त अभिकर्मक के विलयन को प्लेट पर छिड़ककर भी बिंदुओं को देखा जाता है। जैसे–एेमीनो अम्लों के बिंदुओं को प्लेट पर निनहाइड्रिन विलयन छिड़ककर देखते हैं।
वितरण क्रोमेटोग्रैफी ः वितरण क्रोमेटोग्रैफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत विभेदी वितरण पर आधारित है। कागज़ वर्णलेखन (Paper Chromatography) इसका एक उदाहरण है। इसमें एक विशिष्ट प्रकार का क्रोमेटोग्रैफी कागज़ का इस्तेमाल किया जाता है। इस कागज़ के छिद्रों में जल-अणु पाशित रहते हैं, जो स्थिर प्रावस्था का कार्य करते हैं।
क्रोमेटोग्रैफी कागज़ की एक पट्टी (Strip) के आधार पर मिश्रण का बिंदु लगाकर उसे जार में लटका देते हैं (चित्र 12.13, पृष्ठ 362)। जार में कुछ ऊँचाई तक उपयुक्त विलायक अथवा विलायकों का मिश्रण भरा होता है, जो गतिशील प्रावस्था का कार्य करता है। केशिका क्रिया के कारण पेपर की पट्टी पर विलायक ऊपर की ओर बढ़ता है तथा बिंदु पर प्रवाहित होता है। विभिन्न यौगिकों का दो प्रावस्थाओं में वितरण भिन्न-भिन्न होने के कारण वे अलग-अलग दूरियों तक आगे बढ़ते हैं। इस प्रकार विकसित पट्टी को ‘क्रोमेटोग्राम’ (Chromatogram) कहते हैं। पतली परत की भाँति पेपर की पट्टी पर विभिन्न बिंदुओं की स्थितियों को या तो पराबैगनी प्रकाश के नीचे रखकर या उपयुक्त अभिकर्मक के विलयन को छिड़ककर हम देख लेते हैं।
12.9 कार्बनिक यौगिकों का गुणात्मक विश्लेषण
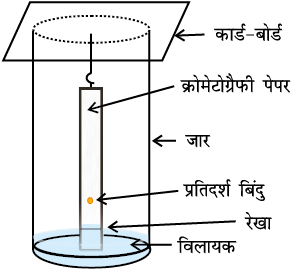
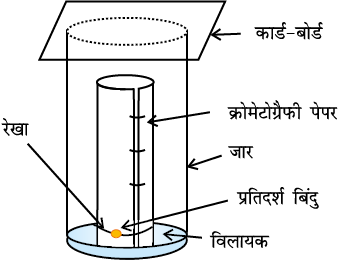
चित्र 12-13 कागज क्रोमेटोग्रैफी। दो भिन्न आकृतियों का क्रोमेटोग्रैफी पेपर।
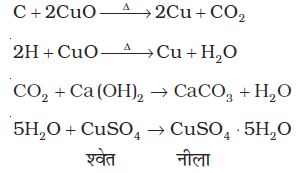
12.9.1 कार्बन तथा हाइड्रोजन की पहचान
इसके लिए यौगिक को कॉपर (II) अॉक्साइड के साथ गरम किया जाता है। यौगिक में उपस्थित कार्बन तथा हाइड्रोजन क्रमशः कार्बन डाइअॉक्साइड (जो चूने के पानी को दूधिया कर देती है) तथा जल (जो निर्जल कॉपर सल्फेट को नीला कर देता है) में परिवर्तित हो जाते हैं।
12.9.2 अन्य तत्त्वों की पहचान
किसी कार्बनिक यौगिक में उपस्थित नाइट्रोजन, सल्फर, हैलोजेन तथा फॉस्प.ηोरस की पहचान ‘लैसें-परीक्षण’ (Lassaigne's Test) द्वारा की जाती है। यौगिक को सोडियम धातु के साथ संगलित करने पर ये तत्त्व सहसंयोजी रूप से आयनिक रूप में परिवर्तित हो जाते हैं। इनमें निम्नलिखित अभिक्रियाएँ होती हैं–


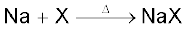
(X = Cl, Br अथवा I)
C, N, S तथा X कार्बनिक यौगिक में उपस्थित तत्त्व हैं। सोडियम संगलन से प्राप्त अवशेष को आसुत जल के साथ उबालने पर सोडियम सायनाइड सल्फाइड तथा हैलाइड जल में घुल जाते हैं। इस निष्कर्ष को ‘सोडियम संगलन निष्कर्ष’ (Sodium Fusion Extract) कहते हैं।
(क) नाइट्रोजन का परीक्षण
सोडियम संगलन निष्कर्ष को आयरन (II) सल्फेट के साथ उबालकर विलयन को सल्फ्यूरिक अम्ल द्वारा अम्लीकृत किया जाता है। प्रशियन ब्लू (Prussian Blue) रंग का बनना नाइट्रोजन की उपस्थिति निश्चित करता है। सोडियम सायनाइड आयरन (II) सल्फेट के साथ अभिक्रिया करके सोडियम हैक्सासायनिडोफैरेट (II) बनाता है। सांद्र सल्फ्यूरिक अम्ल के साथ गरम करने पर कुछ आयरन (II) आयरन (III) में अॉक्सीकृत हो जाता है। यह सोडियम हैक्सासायनिडोफैरेट (II) के साथ अभिक्रिया करके आयरन (III) हैक्सासायनिडोफैरेट (II) (फेरिफेरोसायनाइड) बनाता है, जिसका रंग प्रशियन ब्लू होता है।
(ख) सल्फर का परीक्षण
(i) सोडियम संगलन निष्कर्ष को एेसीटिक अम्ल द्वारा अम्लीकृत कर लैड एेसीटेट मिलाने पर यदि लैड सल्फाइड का काला अवक्षेप बने, तो सल्फर की उपस्थिति की पुष्टि होती है।
(ii) सोडियम संगलन निष्कर्ष को सोडियम नाइट्रोप्रुसाइड के साथ अभिकृत करने पर बैगनी रंग का बनना भी सल्फर की उपस्थिति को दर्शाता है।
कार्बनिक यौगिक में नाइट्रोजन तथा सल्फर – दोनों ही जब उपस्थित हाें, तब सोडियम थायोसायनेट बनता है, जो आयरन (II) सल्फेट के साथ गरम करने पर रक्त की भाँति लाल रंग उत्पन्न करता है। मुक्त सायनाइट आयनों की अनुपस्थिति होने के कारण प्रशियन ब्लू रंग नहीं बनता है।
यदि सोडियम की अधिक मात्रा को सोडियम संगलन में लिया जाता है, तो सायनाइड तथा सल्फाइड आयनों में थायोसायनेट अपघटित हो जाता है। ये आयन अपने सामान्य परीक्षण देते हैं।
(ग) हैलोजनों का परीक्षण
सोडियम संगलन निष्कर्ष को नाइट्रिक अम्ल द्वारा अम्लीकृत कर उसमें सिल्वर नाइट्रेट मिलाया जाता है। तब अमोनियम हाइड्रॉक्साइड में विलेय श्वेत अवक्षेप क्लोरीन की उपस्थिति को, अमोनियम हाइड्रॉक्साइड में अल्प-विलेय पीले अवक्षेप ब्रोमीन की उपस्थिति को तथा अमोनियम हाइड्रॉक्साइड में अविलेय पीले अवक्षेप आयोडीन की उपस्थिति को दर्शाता है।
X– + Ag+ → AgX
[X = Cl, Br या I]
यौगिक में नाइट्रोजन अथवा सल्फर की उपस्थिति होने की स्थिति में उपर्युक्त परीक्षण के पूर्व सोडियम संगलन निष्कर्ष को नाइट्रिक अम्ल के साथ उबाला जाता है, ताकि सायनाइड अथवा सल्फाइड विघटित हो जाएं, अन्यथा ये आयन हैलोजनों के सिल्वर नाइट्रेट परीक्षण में बाधा उत्पन्न करते हैं।
(घ) फ़ॉस्फोरस का परीक्षण
अॉक्सीकारक (सोडियम परॉक्साइड) के साथ गरम करने पर यौगिक में उपस्थित फ़ॉस्फोरस, फ़ॉस्फेट में परिवर्तित हो जाता है। विलयन को नाइट्रिक अम्ल के साथ उबालकर अमोनियम मॉलिब्डेट मिलाने पर पीला रंग अथवा अवक्षेप बनता है, जो फ़ॉस्फोरस की उपस्थिति को निश्चित करता है।
12.10 मात्रात्मक विश्लेषण
कार्बनिक रसायन में मात्रात्मक विश्लेषण बहुत महत्वपूर्ण है, क्योंकि इसके द्वारा रसायनज्ञ कार्बनिक यौगिक में तत्वों के द्रव्यमान प्रतिशत का निर्धारण करते हैं। आप एकक-1 में पहले ही पढ़ चुके हैं कि तत्वों के द्रव्यमान प्रतिशत से यौगिकों के मूलानुपाती सूत्र एवं अणुसूत्र की गणना की जाती है।
कार्बनिक यौगिक में उपस्थित विभिन्न तत्त्वों के प्रतिशत-संयोजन का निर्धारण निम्नलिखित सिद्धांतों पर आधारित विधियों द्वारा किया जाता है।
12.10.1 कार्बन तथा हाइड्रोजन
कार्बन तथा हाइड्रोजन – दोनों तत्त्वों का आकलन एक ही प्रयोग द्वारा किया जाता है। कार्बनिक यौगिक की ज्ञात मात्रा को कॉपर (II) अॉक्साइड तथा अॉक्सीजन के आधिक्य में जलाने पर कार्बन और हाइड्रोजन क्रमशः कार्बन डाइअॉक्साइड तथा जल में अॉक्सीकृत हो जाते हैं।
CxHy + (x + y/4)O2 → x CO2 + (y/2) H2O
उत्पन्न जल की मात्रा ज्ञात करने के लिए मिश्रण को निर्जल कैल्सियम क्लोराइडयुक्त U नली में से प्रवाहित किया जाता है। इस श्रेणी में जुड़ी दूसरी U नली में सांद्र पोटैशियम हाइड्रॉक्साइड विलयन लेते हैं, जिसमें कार्बन हाइड्रॉक्साइड अवशोषित होती है (चित्र 12.14, पृष्ठ 364)। कैल्सियम क्लोराइड तथा पोटैशियम हाइड्रॉक्साइड विलेयनों के द्रव्यमानों में वृद्धि से क्रमशः जल तथा कार्बन डाइअॉक्साइड की मात्राएँ ज्ञात हो जाती हैं। इनसे कार्बन तथा हाइड्रोजन की प्रतिशतता की गणना की जा सकती है।
यदि कार्बनिक यौगिक का द्रव्यमान m ग्राम और बननेवाले जल तथा कार्बन डाइअॉक्साइड के द्रव्यमान क्रमशः m1 तथा m2 ग्राम हैं।
कार्बन का प्रतिशत 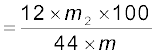
हाइड्रोजन का प्रतिशत 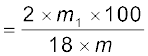

चित्र 12.14 कार्बन तथा हाइड्रोजन का आकलन पदार्थ के अॉक्सीकरण के फलस्वरूप बना जल तथा कार्बन डाइअॉक्साइड U नली में लिये गए क्रमशः निर्जल कैल्सियम क्लोराइड और पोटैशियम हाइड्रॉक्साइड विलयन में अवशोषित किए जाते हैं।
उदाहरण 12.20
0.246 g कार्बनिक यौगिक के पूर्ण दहन के फलस्वरूप 0.198 g कार्बन डाइअॉक्साइड तथा 0.1014 g जल प्राप्त होते हैं। यौगिक में कार्बन तथा हाइड्रोजन की प्रतिशतताओं की गणना कीजिए।
हल
कार्बन की प्रतिशत-मात्रा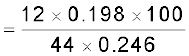
= 21.95%
हाइड्रोजन की प्रतिशत-मात्रा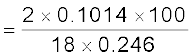
= 4.58%
12.10.2 नाइट्रोजन
नाइट्रोजन के आकलन की दो विधियाँ हैं–
(i) ड्यूमा विधि (Duma Method) तथा
(ii) कैल्डॉल विधि (Kjeldahl's Method)
(i) ड्यूमा विधि ः नाइट्रोजनयुक्त कार्बनिक यौगिक को कार्बन डाइअॉक्साइड के वातावरण में कॉपर अॉक्साइड के साथ गरम करने पर नाइट्रोजन मुक्त होती है। कार्बन तथा हाइड्रोजन क्रमशः कार्बन डाइअॉक्साइड एवं जल में परिवर्तित हो जाते हैं।
अल्प मात्रा में बने नाइट्रोजन अॉक्साइडों को गरम कॉपर तार पर प्रवाहित कर नाइट्रोजन में अपचयित कर दिया जाता है।
इस प्रकार प्राप्त गैसीय मिश्रण को हाइड्रॉक्साइड पोटैशियम के जलीय विलयन पर एकत्र कर लिया जाता है। कार्बन डाइअॉक्साइड पोटैशियम हाइड्रॉक्साइड द्वारा अवशोषित हो जाती है। नाइट्रोजन अंशांकित नली (Graduated Tube) के ऊपरी भाग में एकत्र हो जाती है (चित्र 12.15, पृष्ठ 365)।
माना कि कार्बनिक यौगिक का द्रव्यमान = m g
एक नाइट्रोजन का आयतन = V1mL
कक्ष का ताप = T1 K
मानक ताप तथा दाब (STP) पर नाइट्रोजन का आयतन 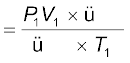
(माना कि इसका मान V mL है)
P1 तथा V1 क्रमशः नाइट्रोजन के दाब तथा आयतन हैं। P1 दाब, जिसपर नाइट्रोजन एकत्र की गई है, वायुमंडलीय दाब से भिन्न है। P1 का मान इस संबंध द्वारा प्राप्त किया जाता है–
P1 = वायुमंडलीय दाब-जलीय तनाव
STP पर 22400 mL N2 का द्रव्यमान 28g है
अतः STP पर V mL N2 का द्रव्यमान 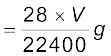
उदाहरण 12.21
नाइट्रोजन अणुमापन की ड्यूमा विधि में 0.3 g कार्बनिक यौगिक 300K ताप तथा 715 mm दाब पर 50 mL नाइट्रोजन देता है। यौगिक में नाइट्रोजन के प्रतिशत की गणना कीजिए (300 K ताप पर जलीय तनाव = 15 mm)।
हल
300 K ताप तथा 715 mm पर एकत्र नाइट्रोजन का
आयतन = 50 mL
वास्तविक दाब = 715 – 15 = 700 mm
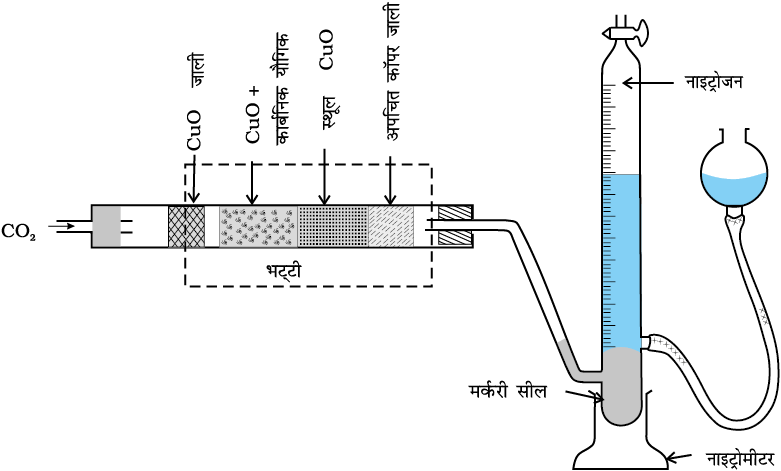
चित्र 12.15 ड्यूमा विधि। कार्बनिक यौगिक को CO2 गैस की उपस्थिति में Cu(II) अॉक्साइड के साथ गरम करने पर नाइट्रोजन गैस उत्पन्न होती है। गैसों के मिश्रण को पोटैशियम हाइड्रॉक्साइड विलयन में से प्रवाहित किया जाता है, जहाँ CO2 अवशोषित हो जाती है तथा नाइट्रोजन का आयतन माप लिया जाता है।
STP पर नाइट्रोजन का आयतन 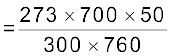
= 41.9 mL
22400 mL नाइट्रोजन का STP पर भार = 28 g
अतः 41.9 mL का नाइट्रोजन का STP पर द्रव्यमान 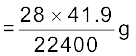
नाइट्रोजन की प्रतिशतता 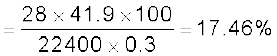
(ii) कैल्डॉल विधि ः इस विधि में नाइट्रोजनयुक्त यौगिक को सांद्र सल्फ्यूरिक अम्ल के साथ गरम किया जाता है। फलस्वरूप यौगिक की नाइट्रोजन, अमोनियम सल्फेट में परिवर्तित हो जाती है। तब प्राप्त अम्लीय मिश्रण को सोडियम हाइड्रॉक्साइड के आधिक्य के साथ गरम करने पर अमोनिया मुक्त होती है, जिसे मानक सल्फ्यूरिक अम्ल विलयन के ज्ञात आयतन में अवशोषित कर लिया जाता है। तत्पश्चात् अवशिष्ट सल्फ्यूरिक अम्ल को क्षार के मानक विलयन द्वारा अनुमापित कर लिया जाता है। अम्ल की आरंभिक मात्रा और अभिक्रिया के बाद शेष मात्रा के बीच अंतर से अमोनिया के साथ अभिकृत अम्ल की मात्रा प्राप्त होती है।
माना कि कार्बनिक यौगिक का द्रव्यमान = m g
M मोलरतावाले H2SO4 का लिया गया आयतन = V mL
अवशिष्ट H2SO4 के अनुमापन हेतु प्रयुक्त
M मोलरता के NaOH का आयतन = V1 mL
M मोलरता का V1mL NaOH = M मोलरता का V1/2mL H2SO4
M मोलरता का (V – V1/2)mL H2SO4 = M मोलरता का 2(V – V1/V2) NH3 विलयन
1M NH3 विलयन के 1000 mL में उपस्थित NH3 = 17 g या 14g नाइट्रोजन
1M NH3 विलयन का 2(V – V1/2) mL =
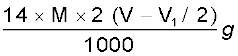 नाइट्रोजन
नाइट्रोजन
नाइट्रोजन की प्रतिशतता 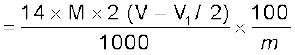
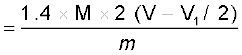
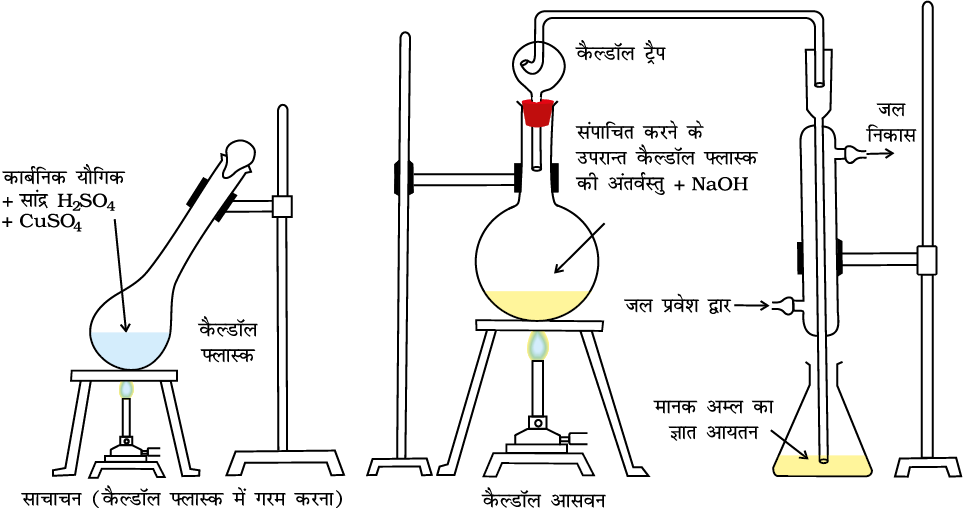
चित्र 12.16 कैल्डॉल विधि-नाइट्रोजनयुक्त यौगिक को सांद्र सल्फ्यूरिक अम्ल के साथ गरम करने पर अमोनियम सल्फेट बनता है, जो NaOH द्वारा अभिकृत करने पर अमोनिया मुक्त करता है। इसेे मानक अम्ल के ज्ञात आयतन में अवशोषित किया जाता है।
नाइट्रोजनयुक्त नाइट्रो तथा एेज़ो समूह और वलय में उपस्थित नाइट्रोजन (उदाहरणार्थ–पिरिडीन) में कैल्डॉल विधि लागू नहीं होती, क्योंकि इन परिस्थितियों में ये यौगिक नाइट्रोजन को अमोनियम सल्फेट में परिवर्तित नहीं कर सकते हैं।
उदाहरण 12.22
नाइट्रोजन आकलन की कैल्डॉल विधि में 0.5 g यौगिक में मुक्त अमोनिया 10 mL 1 M H2SO4 को उदासीन करती है। यौगिक में नाइट्रोजन की प्रतिशतता ज्ञात करें।
हल
1M 10 mL H2SO4 ≡ 1M 20 mL NH3
1000 mL 1M अमोनिया में उपस्थित नाइट्रोजन
= 14g
अतः 20 mL 1M अमोनिया में उपस्थित नाइट्रोजन
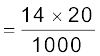 नाइट्रोजन
नाइट्रोजन
अतः नाइट्रोजन की प्रतिशतता 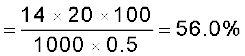
12.10.3 हैलोजन
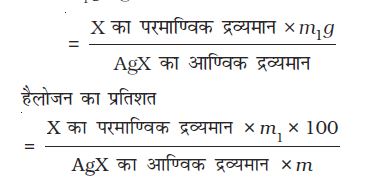
कैरिअस विधि ः कार्बनिक यौगिक की निश्चित मात्रा को कैरिअस नली (कठोर काँच की नली) में लेकर सिल्वर नाइट्रेट की उपस्थिति में सधूम नाइट्रिक अम्ल के साथ भट्ठी में गरम किया जाता है (चित्र 12.17, पृष्ठ 367)। यौगिक में उपस्थित कार्बन तथा हाइड्रोजन इन परिस्थितियों में क्रमशः कार्बन डाइअॉक्साइड तथा जल में अॉक्सीकृत हो जाते हैं, जबकि हैलोजन संगत सिल्वर हैलाइड (AgX) में परिवर्तित हो जाता है। अवक्षेप को छानकर सुखाने के बाद तोल लिया
जाता है।
माना कि यौगिक का द्रव्यमान = m g
प्राप्त AgX का द्रव्यमान = m1 g
1 मोल AgX में 1 मोल X की मात्रा उपलब्ध है।
m1 g AgX में हैलोजन का द्रव्यमान
हैलोजन का प्रतिशत
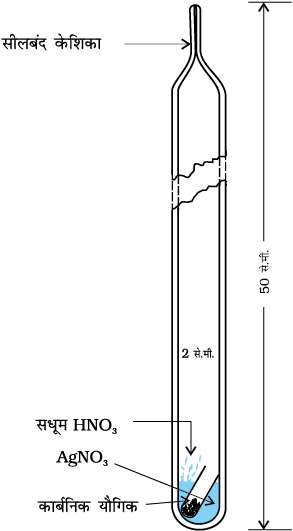
चित्र 12.17 केरीयस विधि-हैलोजनयुक्त कार्बनिक यौगिक को सिल्वर नाइट्रेट की उपस्थिति में सधूम नाइट्रिक अम्ल के साथ गरम किया जाता है।
उदाहरण 12.23
हैलोजन के आकलन की कैरिअस विधि में 0.15 g कार्बनिक यौगिक 0.12 g AgBr देता है। यौगिक में ब्रोमीन की प्रतिशत ज्ञात कीजिए।
हल
AgBr का आण्विक द्र्रव्यमान = 108 + 80
= 188 g mol–1
188 g AgBr में उपस्थित ब्रोमीन = 80 g
0.12 g AgBr में उपस्थित ब्रोमीन = 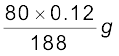
ब्रोमीन का प्रतिशत = 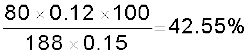
12.10.4 सल्फर
कैरिअस नली में कार्बनिक यौगिक की ज्ञात मात्रा को सधूम नाइट्रिक अम्ल अथवा सोडियम परॉक्साइड के साथ गरम करने पर सल्फ्यूरिक अम्ल में सल्फर अॉक्सीकृत हो जाता है, जिसे बेरियम क्लोराइड के जलीय विलयन का आधिक्य मिलाकर हम बेरियम सल्फेट के रूप में अवक्षेपित कर लेते हैं। अवक्षेप को छानने, धोने और सुखाने के पश्चात् तौल लेते हैं। बेरियम सल्फेट के द्रव्यमान से सल्फर की प्रतिशतता ज्ञात की जा सकती है।
माना कि लिये गए कार्बनिक यौगिक का द्रव्यमान = m g
अतः बेरियम सल्फेट का द्रव्यमान = m1 g
1 मोल BaSO4 = 233 g BaSO4 = 32 g सल्फर
BaSO4 m1g में सल्फर की मात्रा =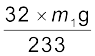
सल्फर का प्रतिशत 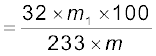
उदाहरण 12.24
सल्फर आकलन में 0.157 g कार्बनिक यौगिक से 0.4813 g बेरियम सल्फेट प्राप्त हुआ। यौगिक में सल्फर का प्रतिशत क्या है?
हल
BaSO4 का आण्विक द्रव्यमान = 137 + 32 + 64
= 233g
233g BaSO4 में उपस्थित सल्फर = 32g
0.4813g BaSO4 में उपस्थित सल्फर
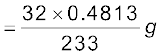
सल्फर का प्रतिशत = 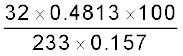
= 42.10%
12.10.5 फ़ॉस्फ़ोरस
कार्बनिक यौगिक की एक ज्ञात मात्रा को सधूम नाइट्रिक अम्ल के साथ गरम करने पर उसमें उपस्थित फ़ॉस्फोरस, फ़ॉस्फोरिक अम्ल में अॉक्सीकृत हो जाता है। इसे अमोनिया तथा
अमोनियम मॉलिब्डेट मिलाकर अमोनियम फॉस्फ़ेटोमॉलिब्डेट, (NH4)3PO4⋅12MoO3 के रूप में हम अवक्षेपित कर लेते हैं, अन्यथा फ़ॉस्फ़ोरिक अम्ल में मेग्नेसिया मिश्रण मिलाकर MgNH4PO4 के रूप में अवक्षेपित किया जा सकता है, जिसके ज्वलन से Mg2P2O7 प्राप्त होता है।
माना कि कार्बनिक यौगिक का द्रव्यमान = m g और अमोनियम फॉस्फ़ोमॉलिब्डेट = m1 g
(NH4)3 PO4⋅12 MoO3 का मोलर द्रव्यमान = 1877 g है।
फॉस्फोरस का प्रतिशत 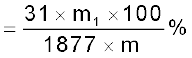
यदि फॉस्फोरस का Mg2 P2O7 के रूप में आकलन किया जाए तो, फॉस्फोरस का प्रतिशत 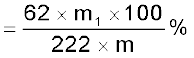
जहाँ Mg2P2O7 का मोलर द्रव्यमान 222 u, लिये गए कार्बनिक पदार्थ का द्रव्यमान m, बने हुए Mg2P2O7 का द्रव्यमान m1 तथा Mg2P2O7 यौगिक में उपस्थित दो प.ηॅास्फोरस परमाणुओं का द्रव्यमान 62 है।
12.10.6 अॉक्सीजन
कार्बनिक यौगिक में अॉक्सीजन की प्रतिशतता की गणना कुल प्रतिशतता (100) में से अन्य तत्त्वों की प्रतिशतताओं के योग को घटाकर की जाती है। अॉक्सीजन का प्रत्यक्ष आकलन निम्नलिखित विधि से भी किया जा सकता है–
कार्बनिक यौगिक की एक निश्चित मात्रा नाइट्रोजन गैस के प्रवाह में गरम करके अपघटित की जाती हैं। अॉक्सीजन सहित उत्पन्न गैसीय मिश्रण को रक्त-तप्त कोक (Coke) पर प्रवाहित करने पर पूरी अॉक्सीजन कार्बन मोनोअॉक्साइड में परिवर्तित हो जाती है। तत्पश्चात् गैसीय मिश्रण को ऊष्ण आयोडीन पेन्टाअॉक्साइड (I2O5) में प्रवाहित करने पर कार्बन मोनोअॉक्साइड कार्बन डाइअॉक्साइड में अॉक्सीकृत हो जाती है और आयोडीन भी उत्पन्न होती है।
समीकरण (क) एवं (ख) को क्रमशः 5 एवं 2 से गुणा करके समीकरण (क) में उत्पन्न CO की मात्रा समीकरण (ख) में प्रयुक्त CO की मात्रा के बराबर करने पर हम पाते हैं कि यौगिक से निकली अॉक्सीजन के प्रत्येक मोल से दो मोल CO2 प्राप्त होगी। अतः 88g कार्बन डाइअॉक्साइड यौगिक से निकली 32g अॉक्सीजन से प्राप्त होगी।
माना कि कार्बनिक यौगिक का द्रव्यमान = m g
उत्पन्न कार्बन डाइअॉक्साइड का द्रव्यमान = m1 g
∴m1 g कार्बन डाइअॉक्साइड 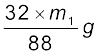 अॉक्सीजन से प्राप्त होगी।
अॉक्सीजन से प्राप्त होगी।
∴ यौगिक में अॉक्सीजन का प्रतिशत 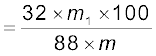
अॉक्सीजन के प्रतिशत का आकलन आयोडीन की मात्रा से भी किया जा सकता है।
आजकल कार्बनिक यौगिक में तत्त्वों का आकलन स्वचालित तकनीक की सहायता से पदार्थो की सूक्ष्म (माइक्रो) मात्र लेकर करते हैं। यौगिकों में उपस्थित कार्बन, हाइड्रोजन तथा नाइट्रोजन तत्त्वों का आकलन CHN तत्त्व विश्लेषक (CHN Elemental Analyzer) से करते हैं। इस उपकरण में पदार्थ की माइक्रो मात्र (1 – 3 mg) की आवश्यकता होती है तथा कुछ समय में इन तत्त्वों का प्रतिशत स्क्रीन पर आ जाती हैं। इन विधियों का विस्तृत विवरण इस पुस्तक के स्तर से ऊपर है।
सारांश
सहसंयोजक आबंधन के कारण बने कार्बनिक यौगिकों की संरचना तथा क्रियाशीलता-संबंधी मूलभूत सिद्धांतों पर इस एकक में हमने विचार किया। कार्बनिक यौगिकों में सहसंयोजी आबंधों की प्रकृति को कक्षक संकरण की अवधारणा से स्पष्ट किया जा सकता है, जिसके अनुसार कार्बन की संकरण-अवस्था sp3, sp2 तथा sp हो सकती है। ये क्रमशः मेथेन, एथीन तथा एथाइन में उपस्थित होती हैं। इस अवधारणा के आधार पर मेथेन की चतुष्फलकीय, एथीन की समतल तथा एथाइन की रैखीय आकृति को स्पष्ट किया जा सकता है। कार्बन का sp3 कक्षक हाइड्रोजन के 1s कक्षक के साथ अतिव्यापन करके कार्बन-हाइड्रोजन (C – H) एकल (सिग्मा ) आबंध बनाता है। इसी तरह दो कार्बन के sp3 कक्षक परस्पर अतिव्यापित होकर कार्बन-कार्बन σ आबंध निर्मित करते हैं। दो निकटवर्ती कार्बन के असंकरित p-कक्षक पार्श्व अतिव्यापन द्वारा पाई (π) आबंध बनाते हैं। कार्बनिक यौगिकों को कई संरचना-सूत्रों द्वारा प्रदर्शित किया जाता है। कार्बनिक यौगिक का त्रिविमीय सूत्र ‘वैज’ एवं ‘डेश’ द्वारा दर्शाया जाता है।कार्बनिक यौगिकों को उनकी संरचना अथवा क्रियात्मक समूहों के आधार पर वर्गीकृत किया जा सकता है। क्रियात्मक समूह एक विशिष्ट तरीके से बंधित एक परमाणु या परमाणुओं का समूह है, जो यौगिकों के भौतिक एवं रासायनिक गुणों का निर्धारण करता है। कार्बनिक यौगिकों का नामांकरण IUPAC द्वारा बनाए गए नियमों के आधार पर किया जाता है। IUPAC नामांकरण में नाम और संरचना के बीच के सहसंबंध से पढ़ने वाले को संरचना बनाने में सहायता मिलती है।
क्रियाधारक अणु की संरचना, सहसंयोजक आबंध के विदलन, आक्रमणकारी अभिकर्मक, इलेक्ट्रॉन विस्थापन प्रभाव तथा अभिक्रिया की परिस्थितियों पर कार्बनिक अभिक्रियाओं की क्रियाविधि आधारित होती है। इन कार्बनिक अभिक्रियाओं में आबंध-विदलन तथा आबंध-निर्माण होता है। सहसंयोजक आबंध का विदलन विषमांश तथा समांश तरीके से हो सकता है। विषमांश विदलन से कार्बधनायन अथवा कार्बऋणायन प्राप्त होता है, जबकि समांश विदलन से मुक्त मूलक उत्पन्न होते हैं। विषमांश-विदलन के माध्यम से संपन्न कार्बनिक अभिक्रियाओं में इलेक्ट्रॉन देनेवाले नाभिकस्नेही तथा इलेक्ट्रॉन ग्रहण करने वाले इलेक्ट्रॉनस्नेही अभिकारक भाग लेते हैं। प्रेरणिक, अनुनाद, इलेक्ट्रोमेरी तथा अतिसंयुग्मन प्रभाव कार्बन-कार्बन अथवा अन्य परमाणु स्थितियों में ध्रुवणता उत्पन्न करने में सहायक हो सकते हैं, जिससे कार्बन परमाणु अथवा अन्य परमाणुओं पर निम्न अथवा उच्च इलेक्ट्रॉन घनत्व वाले स्थान बन जाते हैं। कार्बनिक अभिक्रियाओं के मुख्य प्रकार हैं – प्रतिस्थापन अभिक्रिया, संकलन अभिक्रिया, विलोपन तथा पुनर्विन्यास अभिक्रिया।
किसी कार्बनिक यौगिक की संरचना ज्ञात करने के लिए उसका शोधन और गुणात्मक तथा मात्रात्मक विश्लेषण किया जाता है। शोधन की विशिष्ट विधियाँ, जैसे– ऊर्ध्वपातन, आसवन और विभेदी निष्कर्षण यौगिकों के एक या अधिक भौतिक गुणों में अंतर पर आधारित हैं। यौगिकों के पृथक्करण तथा शोधन के लिए क्रोमेटोग्रैफी एक अत्यधिक उपयोगी तकनीक है। इसे दो वर्गों में वर्गीकृत किया जा सकता हैः अधिशोषण क्रोमेटोग्रैफी तथा वितरण क्रोमेटोग्रैफी। अधिशोषण क्रोमेटोग्रैफी अधिशोषक पर मिश्रण के अवयवों के भिन्न अधिशोषण पर आधारित है। वितरण क्रोमेटोग्रैफी में स्थिर प्रावस्था और गतिक प्रावस्था के मध्य मिश्रण के अववयों का निरंतर वितरण होता है। यौगिक को शुद्ध अवस्था में प्राप्त करने के पश्चात् उसमें उपस्थित तत्त्वों के निर्धारण के लिए उसका गुणात्मक विश्लेषण किया जाता है। नाइट्रोजन, सल्फर, हैलोजेन तथा फ़ॉस्फोरस लैंसे परीक्षण द्वारा जाँचे जाते हैं। कार्बन तथा हाइड्रोजन की पहचान इन्हें क्रमशः कार्बन डाइअॉक्साइड तथा जल में परिवर्तित करके की जाती है। नाइट्रोजन का आकलन ड्यूमा और कैल्डॉल विधियों द्वारा तथा हैलोजेनों को कैरिअस विधि द्वारा किया जाता है। सल्फर तथा फ़ॉस्फोरस को क्रमशः सल्फ्यूरिक तथा प.ηॉस्फोरिक अम्ल में अॉक्सीकृत करके आकलित किया जाता है। अॉक्सीजन की प्रतिशतता कुल प्रतिशतता में से अन्य तत्त्वों की प्रतिशतताओं के योग को घटाकर प्राप्त की जाती है।
अभ्यास
12.1 निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था बताइए–
CH2 = C = O, CH3CH = CH2, (CH3)2CO, CH2 = CH CN, C6H6
12.2 निम्नलिखित अणुओं में σ तथा π आबंध दर्शाइए–
C6H6, C6H12, CH2Cl2, CH2 = C = CH2, CH3 NO2, HCONHCH3
12.3 निम्नलिखित यौगिकों के आबंध-रेखा-सूत्र लिखिए–
आइसोप्रोपिल एेल्कोहॉल, 2, 3– डाइमेथिल ब्यूटेनैल, हेप्टेन-4-ओन
12.4 निम्नलिखित यौगिकों के IUPAC नाम लिखिए–
(क)  (ख)
(ख) 
(ग) 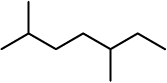 (घ)
(घ) 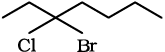
(ङ)  (च) Cl2CHCH2OH
(च) Cl2CHCH2OH
12.5 निम्नलिखित यौगिकों में से कौन सा नाम IUPAC पद्धति के अनुसार सही है?
(क) 2, 2-डाइएथिलपेन्टेन अथवा 2-डाइमेथिलपेन्टेन
(ख) 2, 4, 7-ट्राइमेथिलअॉक्टेन अथवा 2, 5, 7-ट्राइमेथिलअॉक्टेन
(ग) 2-क्लोरो-4-मेथिलपेन्टेन अथवा 4-क्लोरो-2-मेथिलपेन्टेन
(घ) ब्यूट-3-आइन-1-अॉल अथवा ब्यूट-4-अॉल-1-आइन
12.6 निम्नलिखित दो सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना-सूत्र लिखिए–
(क) H – COOH (ख) CH3COCH3 (ग) H – CH = CH2
12.7 निम्नलिखित के संघनित और आबंध रेखा-सूत्र लिखिए तथा उनमें यदि कोई क्रियात्मक समूह हो, तो उसे पहचानिए–
(क) 2, 2, 4 - ट्राइमेथिलपेन्टेन
(ख) 2-हाइड्रॉक्सी-1, 2, 3-प्रोपेनट्राइकार्बाेक्सिलिक अम्ल
(ग) हेक्सेनडाइएेल
12.8 निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए–
(क)  (ख)
(ख) 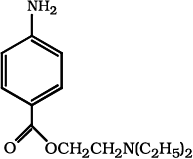
(ग) 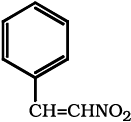
12.9 निम्नलिखित में से कौन अधिक स्थायी है तथा क्यों?
O2NCH2CH2O– और CH3 CH2O–
12.10 π-निकाय से आबंधित होने पर एेल्किल समूह इलेक्ट्रॉनदाता की तरह व्यवहार प्रदर्शित क्यों करते हैं? समझाइए।
12.11 निम्नलिखित यौगिकों की अनुनाद-संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए–
(क) C6H5OH (ख) C6H5NO2
(ग) CH3CH = CHCHO (घ) C6H5 – CHO
(ङ) C6H5 – CH+2 (च) 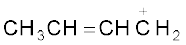
12.12 इलेक्ट्रॉनस्नेही तथा नाभिकस्नेही क्या हैं? उदाहरणसहित समझाइए।
12.13 निम्नलिखित समीकरणों में मोटे अक्षरों में लिखे अभिकर्मकों को नाभिकस्नेही तथा इलेक्ट्रॉनस्नेही में वर्गीकृत कीजिए–
(क) 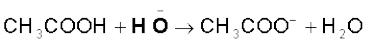
(ख) 
(ग) 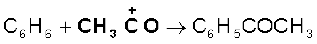
12.14 निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए–
(क) 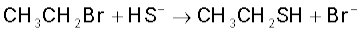
(ख) 
(ग) 
(घ) 
12.15 निम्नलिखित युग्मों में सदस्य-संरचनाओं के मध्य कैसा संबंध है? क्या ये संरचनाएँ संरचनात्मक या ज्यामितीय समावयव अथवा अनुनाद संरचनाएँ हैं?
(क) 
(ख) 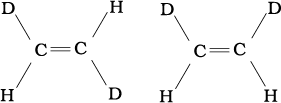
(ग) 
12.16 निम्नलिखित आबंध विदलनों के लिए इलेक्ट्रॉन-विस्थापन को मुड़े तीरों द्वारा दर्शाइए तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिए। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त-मूलक, कार्बधनायन तथा कार्बऋणायन पहचानिए–
(क) 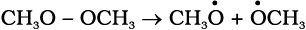
(ख) 
(ग) 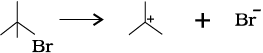
(घ) 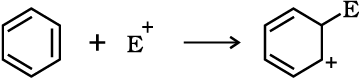
12.17 निम्नलिखित कार्बाेक्सिलिक अम्लों की अम्लता का सही क्रम कौन सा इलेक्ट्रॉन-विस्थापन वर्णित करता है? प्रेरणिक तथा इलेक्ट्रोमेरी प्रभावों की व्याख्या कीजिए–
(क) Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
(ख) CH3CH2COOH > (CH3)2CHCOOH > (CH3)3C.COOH
12.18 प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धांतों का संक्षिप्त विवरण दीजिए–
(क) क्रिस्टलन (ख) आसवन (ग) क्रोमेटोग्रैफी
12.19 एेसे दो यौगिकों, जिनकी विलेयताएँ विलायक s, में भिन्न हैं, को पृथक् करने की विधि की व्याख्या कीजिए।
12.20 आसवन, निम्न दाब पर आसवन तथा भाप आसवन में क्या अंतर है? विवेचना कीजिए।
12.21 लैंसे-परीक्षण का रसायन-सिद्धांत समझाइए।
12.22 किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की (i) ड्यूमा विधि तथा (ii) कैल्डॉल विधि के सिद्धांत की रूप-रेखा प्रस्तुत कीजिए।
12.23 किसी यौगिक में हैलोजेन, सल्फर तथा फ़ॉस्फोरस के आकलन के सिद्धांत की विवेचना कीजिए।
12.24 पेपर क्रोमेटोग्रैफी के सिद्धांत को समझाइए।
12.25 ‘सोडियम संगलन निष्कर्ष’ में हैलोजेन के परीक्षण के लिए सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल क्यों मिलाया जाता है?
12.26 नाइट्रोजन, सल्फर तथा फ़ॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है?
12.27 कैल्सियम सल्फेट तथा कपूर के मिश्रण के अवयवों को पृथक् करने के लिए एक उपयुक्त तकनीक बताइए।
12.28 भाप-आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत क्यों हो
जाता है?
12.29 क्या CCl4 सिल्वर नाइट्रेट के साथ गरम करने पर AgCl का श्वेत अवक्षेप देगा? अपने उत्तर को कारण सहित समझाइए।
12.30 किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइअॉक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है?
12.31 सल्फर के लेड एेसीटेट द्वारा परीक्षण में ‘सोडियम संगलन निष्कर्ष’ को एेसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा। क्यों?
12.32 एक कार्बनिक यौगिक में 69% कार्बन, 4.8% हाइड्रोजन तथा शेष अॉक्सीजन है। इस यौगिक के 0.20 g के पूर्ण दहन के फलस्वरूप उत्पन्न कार्बन डाइअॉक्साइड तथा जल की मात्राओं की गणना कीजिए।
12.33 0.50 g कार्बनिक यौगिक को कैल्डॉल विधि के अनुसार उपचारित करने पर प्राप्त अमोनिया को 0.5 M H2SO4 के 50 mL में अवशोषित किया गया। अवशिष्ट अम्ल के उदासीनीकरण के लिए 0.5 M NaOH के 50 mL की आवश्यकता हुई। यौगिक में नाइट्रोजन प्रतिशतता की गणना कीजिए।
12.34 कैरिअस आकलन में 0.3780 g कार्बनिक क्लोरो यौगिक से 0.5740 g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में क्लोरीन की प्रतिशतता की गणना कीजिए।
12.35 कैरिअस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फरयुक्त कार्बनिक यौगिक से 0.668 g बेरियम सल्फेट प्राप्त हुआ। दिए गए कार्बन यौगिक में सल्फर की प्रतिशतता की गणना कीजिए।
12.36 CH2 = CH – CH2 – CH2 – C ≡ CH, कार्बनिक यौगिक में C2 – C3 आबंध किन संकरित कक्षकों के युग्म से निर्मित होता है?
(क) sp – sp2 (ख) sp – sp3 (ग) sp2 – sp3 (घ) sp3 – sp3
12.37 किसी कार्बनिक यौगिक में लैंसे-परीक्षण द्वारा नाइट्रोजन की जाँच में प्रशियन ब्लू रंग निम्नलिखित में से किसके कारण प्राप्त होता है?
(क) Na4[Fe(CN)6] (ख) Fe4[Fe(CN)6]3
(ग) Fe2[Fe(CN)6] (घ) Fe3[Fe(CN)6]4
12.38 निम्नलिखित कार्बधनायनों में से कौन सा सबसे अधिक स्थायी है?
(क) 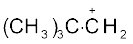 (ख)
(ख) 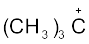
(ग) 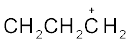 (घ)
(घ) 
12.39 कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वाेत्तम तथा आधुनिकतम तकनीक कौन-सी है?
(क) क्रिस्टलन (ख) आसवन (ग) ऊर्ध्वपातन (घ) क्रोमेटोग्रैफी
12.40 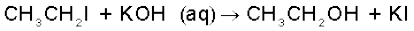 अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए–
अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए–
(क) इलेक्ट्रॉनस्नेही प्रतिस्थापन (ख) नाभिकस्नेही प्रतिस्थापन
(ग) विलोपन (घ) संकलन