Table of Contents
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप :
- नामकरण की आई.यू.पी.ए.सी. पद्धति के अनुसार हाइड्रोकार्बनों का नाम बता सकेंगे;
- एेल्केन, एल्कीन, एल्काइन तथा एेरोमैटिक हाइड्रोकार्बन के समावयवों की पहचान कर सकेंगे तथा उनकी संरचना लिख सकेंगे;
- हाइड्रोकार्बन के विरचन की विभिन्न विधियों के बारे में सीखेंगे;
- भौतिक एवं रासायनिक गुणधर्म के आधार पर एेल्केन, एल्कीन, एल्काइन तथा एेरोमैटिक हाइड्रोकार्बनों में विभेद कर सकेंगे;
- एथेन के विभिन्न संरूपणों (कॉन्फॉर्मेशनों) के आरेख बनाकर उनमें विभेद कर सकेंगे;
- हाइड्रोकार्बन की भूमिका का ऊर्जा के स्रोत के रूप में तथा अन्य औद्योगिक अनुप्रयोगों में महत्त्व बता सकेंगे;
- इलेक्ट्रॉनिक क्रियाविधि के आधार पर असममित एल्कीनों तथा एल्काइनों के संकलन उत्पादों के बनने का अनुमान कर सकेंगे;
- बेन्जीन की संरचना का वर्णन, एेरोमैटिकता एवं इलेक्ट्रॉनस्नेही प्रतिस्थापन-अभिक्रियाओं की क्रियाविधि की व्याख्या कर सकेंगे;
- एकल प्रतिस्थापी बेन्जीनवलय पर प्रतिस्थापियों के निर्देशात्मक प्रभाव की व्याख्या कर सकेंगे; तथा
- कैन्सरजन्यता तथा विषाक्तता के विषय में सीख सकेंगे।
"हाइड्रोकार्बन ऊर्जा के प्रमुख स्रोत है।"
हाइड्रोकार्बन पद स्वतः स्पष्ट है, जिसका अर्थ केवल कार्बन तथा हाइड्रोजन के यौगिक है। हमारे दैनिक जीवन में हाइड्रोकार्बन का महत्त्वपूर्ण योगदान है। आप एलपीजी, सीएनजी आदि संक्षिप्त शब्दों से परिचित होंगे, जो ईंधन के रूप में उपयोग में लाए जाते हैं। एलपीजी द्रवित पेट्रोलियम गैस का, जबकि सीएनजी संघनित प्राकृतिक गैस का संक्षिप्त रूप है। आजकल दूसरा संक्षिप्त शब्द एलएनजी (द्रवित प्राकृतिक गैस) प्रचलन में है। यह भी ईंधन है, जो प्राकृतिक गैस के द्रवीकरण से प्राप्त होता है। पेट्रोलियम, जो भू-पर्पटी के नीचे पाया जाता है, के प्रभावी आसवन (fractional distillation) से पेट्रोल, डीजल तथा कैरोसिन प्राप्त होते हैं। कोल गैस, कोल के भंजक आसवन (destructive distiliation) से प्राप्त होती है। प्राकृतिक गैसें तेल के कुओं की खुदाई के दौरान ऊपरी स्तर में पाई जाती है। संपीडन के पश्चात् प्राप्त गैसों को ‘संपीडित प्राकृतिक गैस’ कहते हैं। एलपीजी का उपयोग घरेलू ईंधन के रूप में होता है, जो सबसे कम प्रदूषण वाली गैस है। कैरोसिन का भी उपयोग घरेलू ईंधन के रूप में किया जाता है, लेकिन इससे कुछ प्रदूषण फैलता है। स्वचालित वाहनों को ईंधन के रूप में पेट्रोल, डीजल तथा सीएनजी की आवश्यकता होती है। पेट्रोल तथा सीएनजी से चलने वाले स्वचालित वाहन कम प्रदूषण फैलाते हैं। ये सभी ईंधन हाइड्रोकार्बन के मिश्रण होते हैं, जो ऊर्जा के स्रोत हैं। हाइड्रोकार्बन का उपयोग पॉलिथीन, पॉलिप्रोपेन, पॉलिस्टाइरीन आदि बहुलकों के निर्माण में किया जाता है। उच्च अणुभार वाले हाइड्रोकार्बनों का उपयोग पेन्ट में विलायक के रूप में और रंजक तथा औषधियों के निर्माण में प्रारंभिक पदार्थ के रूप में भी किया जाता है।
अब आप दैनिक जीवन में हाइड्रोकार्बन के महत्त्वपूर्ण उपयोग को अच्छी तरह समझ गए हैं। इस एकक में हाइड्रोकार्बनों के बारे में और अधिक जानेंगे।
13.1 वर्गीकरण
हाइड्रोकार्बन विभिन्न प्रकार के होते हैं। कार्बन-कार्बन आबंधों की प्रकृति के आधार पर इन्हें मुख्यतः तीन समूहों में वर्गीकृत किया गया है– (1) संतृप्त, (2) असंतृप्त तथा (3) एेरोमैटिक हाइड्रोकार्बन। संतृप्त हाइड्रोकार्बन में कार्बन-कार्बन तथा कार्बन-हाइड्रोजन एकल आबंध होते हैं। यदि विभिन्न कार्बन परमाणु आपस में एकल आबंध से जुड़कर विवृत शृंखला बनाते हैं, तो उन्हें ‘एेल्केन’ कहते हैं, जैसाकि आप एकक-12 में पढ़ चुके हैं। दूसरी ओर यदि कार्बन परमाणु संवृत शृंखला या वलय का निर्माण करते हैं, तो उन्हें ‘साइक्लोएेल्केन’ कहा जाता है। असंतृप्त हाइड्रोकार्बनों में कार्बन-कार्बन बहुआबंध जैसे द्विआबंध, त्रिआबंध या दोनों उपस्थित होते हैं। एेरोमैटिक हाइड्रोकार्बन संवृत यौगिकों का एक विशेष प्रकार है। आप कार्बन की चतुर्संयोजकता तथा हाइड्रोजन की एकल संयोजकता को ध्यान में रखते हुए (विवृत शृंखला या संवृत शृंखला) अनेक अणुओं के मॉडल बना सकते हैं। एेल्केनों के मॉडल बनाने के लिए आबंधों के लिए टूथपिक तथा परमाणुओं के लिए प्लास्टिक की गेंदों का उपयोग हम कर सकते हैं। एल्कीन, एल्काइन तथा एेरोमैटिक हाइड्रोकार्बनों के लिए स्प्रिंग मॉडल बनाए जा सकते हैं।
13.2 एेल्केन
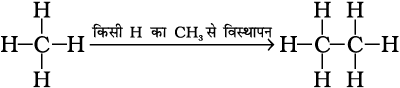
जैसा पहले बताया जा चुका है, एेल्केन कार्बन-कार्बन एकल आबंधयुक्त संतृप्त विवृत शृंखला वाले हाइड्रोकार्बन है। मेथैन (CH4) इस परिवार का प्रथम सदस्य है। मेथैन एक गैस है, जो कोयले की खानों तथा दलदली क्षेत्रों में पाई जाती है। अगर आप मेथैन के एक हाइड्रोजन परमाणु को कार्बन के द्वारा प्रतिस्थापित कर तथा हाइड्रोजन परमाणु की आवश्यक संख्या जोड़कर दूसरे कार्बन की चतुर्संयोजकता को संतुष्ट करते हैं, तो आपको क्या प्राप्त होगा? आपको C2H6 प्राप्त होगा। वह हाइड्रोकार्बन, जिसका अणुसूत्र C2H6 है, एथेन कहलाती है। अतः आप CH4 के एक हाइड्रोजन परमाणु को –CH3 समूह द्वारा प्रतिस्थापित करके C2H6 के रूप में प्राप्त कर सकते हैं।
इस प्रकार हाइड्रोजन को मेथिल (CH3) समूह द्वारा प्रतिस्थापित करके आप अन्य कई एेल्केन बना सकते हैं। इस प्रकार प्राप्त अणु C3H8, C4 H10 इत्यादि होंगे।
ये हाइड्रोकार्बन सामान्य अवस्थाओं में निष्क्रिय होते हैं क्योंकि ये अम्लों और अन्य अभिकर्मकों से अभिक्रिया नहीं करते। अतः प्रारंभ में इन्हें पैराफिन (Parum=कम Affinis=क्रियाशील) कहते थे। क्या आप एेल्केन परिवार या सजातीय श्रेणी (homologous series) के सामान्य सूत्र के बारे में कुछ अनुमान लगा सकते हैं। यदि हम विभिन्न एेल्केनों के सूत्रों का अध्ययन करते हैं तो हमें ज्ञात होता है कि एेल्केन का सामान्य सूत्र CnH2n+2 है। जब n को कोई उपर्युक्त मान दिया जाता है तो यह विशेष सजातीय (homologoue) का प्रतिनिधित्व करता है। क्या आप मेथेन की संरचना का स्मरण कर सकते हैं? संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धांत (VSEPR) के अनुसार (एकक- 4 देखिए) मेथेन की संरचना चतुष्फलीय होती है (चित्र 13.1) जो बहुसमतलीय है जिसमें कार्बन परमाणु केंद्र में तथा चार हाइड्रोजन परमाणु समचतुष्फलक के चारों कोनों पर स्थित हैं। इस प्रकार प्रत्येक H–C का बंध कोण 109.50 होता है।
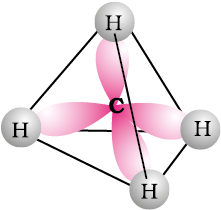
चित्र 13.1 मेथैन (CH4) की चतुष्फलक संरचना
एेल्केनों के चतुष्फलक आपस में जुड़े रहते हैं, जिनमें C-C तथा C-H आबंधों की लंबाइयाँ क्रमशः 154 pm और 112 pm होती हैं (एकक-12 देखिए)। आप पहले अध्ययन कर चुके हैं कि C-C तथा C-Hσ (सिग्मा) आबंध का निर्माण कार्बन परमाणु के संकरित sp3 तथा हाइड्रोजन परमाणुओं के 1s के समाक्षीय अतिव्यापन से होता है।
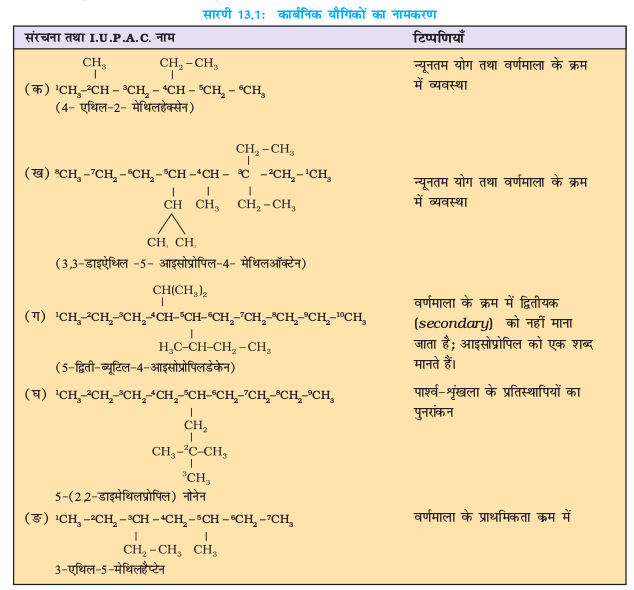
13.2.1 नाम पद्धति तथा समावयवता
एकक-12 में आप विभिन्न कार्बनिक यौगिकों की श्रेणियों की नाम पद्धति की बारे में अध्ययन कर चुके हैं। एेल्केन में नाम पद्धति तथा समावयवता को कुछ और उदाहरणों द्वारा समझा जा सकता है। साधारण नाम कोष्ठक में दिए गए हैं। प्रथम तीन सदस्य मेथैन, एथेन तथा प्रोपेन में केवल एक संरचना पाई जाती है, जबकि उच्च एेल्केनो में एक से अधिक संरचना भी हो सकती है। C4H10 की संरचना लिखने पर चार कार्बन परमाणु आपस में सतत् शृंखला अथवा शाखित शृंखला के द्वारा जुड़े रहते हैं।
I 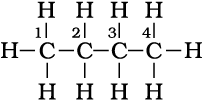
ब्यूटेन (n- ब्यूटेन) (क्वथनांक 237 K) और
II 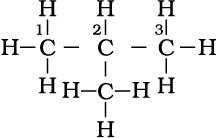
2-मेथिलप्रोपेन (आइसोब्यूटेन)
(क्वथनांक 261K)
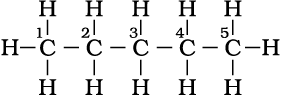
पेन्टेन (n- पेन्टेन)
(क्वथनांक 309 K)
2-मेथिलब्यूटेन (आइसोपेन्टेन)
(क्वथनांक 301K)
2, 2-डाइमेथिलप्रोपेन (नियोपेन्टेन)
(क्वथनांक 282.5K)
संरचना I तथा II का अणु सूत्र समान है, किंतु क्वथनांक तथा अन्य गुणधर्म भिन्न हैं। इसी प्रकार संरचनाओं III, IV तथा V के अणु सूत्र समान हैं, किंतु क्वथनांक तथा गुणधर्म भिन्न हैं। संरचना I तथा II ब्यूटेन के समावयव हैं, जबकि संरचना III, IV तथा V पेन्टेन के समावयव हैं। इनके गुणधर्मों में अंतर इनकी संरचनाओं में अंतर के कारण है। अतः इन्हें ‘संरचनात्मक समावयव’ (structural isomers) कहना उत्तम रहेगा। संरचना I तथा III में सतत् कार्बन परमाणुओं की शृंखला है, जबकि संरचना II, IV तथा V में शाखित कार्बन शृंखला है। अतः एेसे संरचनात्मक समावयवी, जो कार्बन परमाणुओं की
शृंखला में अंतर के कारण होते हैं, को ‘ शृंखला समावयव’ (chain isomers) कहते हैं। अतः आपने देखा कि C4H10 तथा C5H12 में क्रमशः दो तथा तीन शृंखला समावयव होते हैं।
उदाहरण 13.1
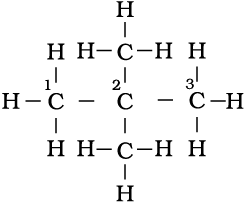
अणुसूत्र C6H14 वाली एेल्केन के विभिन्न शृंखला- समावयवों की संरचना तथा आई.यू.पी.सी नाम लिखिए।
हल
(i) CH3 – CH2 – CH2 – CH2– CH2– CH3
n-हैक्सेन
(i) CH3 – CH – CH2 – CH2– CH3
|
CH3 2-मेथिलपेन्टेन
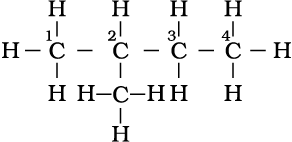
(iii) 
3-मेथिलपेन्टेन
(iv) 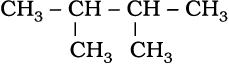
2,3-डाइमेथिलब्यूटेन
(v) 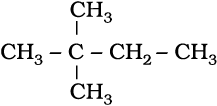
2,2-डाइमेथिलब्यूटेन
कार्बन परमाणु से जुड़े हुए अन्य कार्बन परमाणुओं की संख्या के आधार पर कार्बन परमाणुओं को प्राथमिक (1°), द्वितीयक (2°), तृतीयक (3°) तथा चतुष्क (4°) कार्बन परमाणु कहते हैं। कार्बन परमाणु (जो अन्य कार्बन से नहीं जुड़ा हो, जैसे- मेथैन) में अथवा केवल एक कार्बन परमाणु से जुड़ा हो जैसे- एथेन में उसे ‘प्राथमिक कार्बन’ कहते हैं। अंतिम सिरे वाले परमाणु सदैव प्राथमिक होते हैं। कार्बन परमाणु, जो दो कार्बन परमाणु से जुड़ा हो, उसे ‘द्वितीयक’ कहते हैं। तृतीयक कार्बन तीन कार्बन परमाणुओं से तथा नियो या चतुष्क कार्बन परमाणु चार अन्य कार्बन परमाणुओं से जुड़े होते हैं। क्या आप संरचनाएँ I से V में 1° 2° 3° तथा 4° कार्बन परमाणुओं की पहचान कर सकते हैं? यदि आप उच्चतर एेल्केनों की संरचनाएं बनाते रहेंगे, तो कई प्रकार के समावयव प्राप्त होंगे। C6H14 के पाँच, C7H16 के नौ तथा C10H22 के 75 समावयव संभव हैं।
संरचना II, IV तथा V में आपने देखा है कि –CH3 समूह कार्बन क्रमांक –2 से जुड़ा है। एेल्केन के कार्बन परमाणुओं या अन्य वर्गों के यौगिकों में –CH3,–C2H5,–C3H7 जैसे समूहों को ‘एेल्किल समूह’ कहा जाता है, क्याेंकि उन्हें एेल्केन से हाइड्रोजन परमाणु के विस्थापन द्वारा प्राप्त किया जा सकता है। एेल्किल समूह का सामान्य सूत्र CnH2n+1 (एकक-12) है।
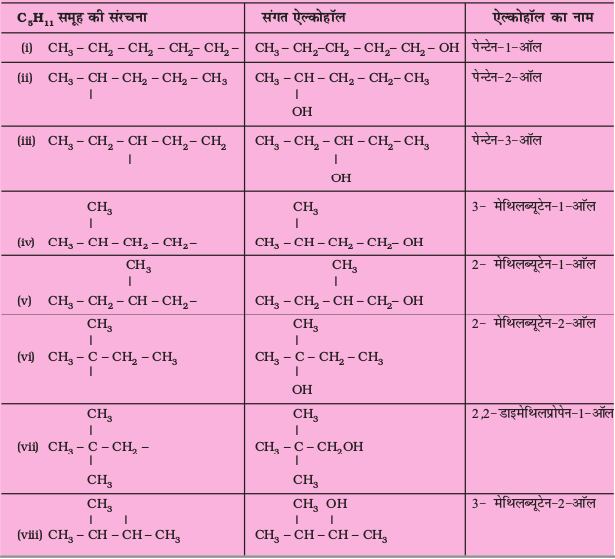
उदाहरण 13.2
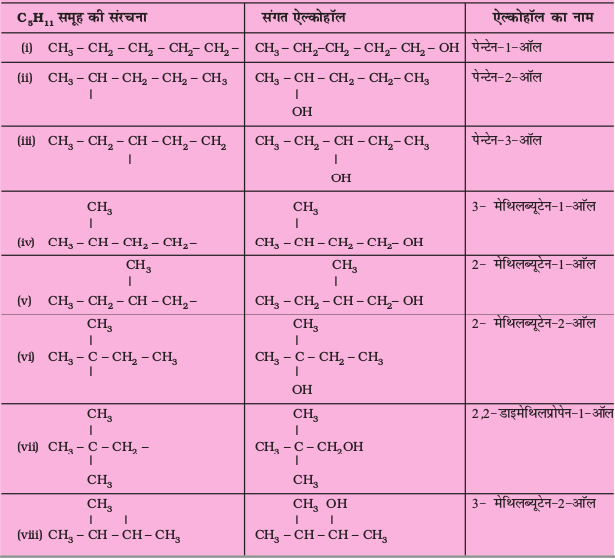
C5H11 अणुसूत्र वाले एेल्किल समूह के विभिन्न समावयवों की संरचनाएँ लिखिए तथा विभिन्न कार्बन शृंखला पर –OH जोड़ने से प्राप्त एेल्कोहॉलों के आई.यू.पी.ए.सी. नाम बताइए।
एकक 12 में पहले से चर्चित नाम पद्धति के सामान्य नियमों का स्मरण करते हुए प्रतिस्थापित एेल्केनों के निम्नलिखित उदाहरणों द्वारा नामकरण की अवधारणा को आप भली-भाँति समझ सकेंगे।
हल
यदि दी गई संरचना का सही IUPAC नाम लिखना महत्त्वपूर्ण है, तो IUPAC नाम से सही संरचना कुछ कार्बनिक यौगिकों का नामकरण-सूत्र लिखना भी उतना ही महत्त्वपूर्ण है। इसके लिए सर्वप्रथम जनक एेल्केन के कार्बन परमाणुओं की दीर्घतम शृंखला को लिखेंगे। तत्पश्चात् उनका अंकन किया जाएगा। जिस कार्बन परमाणु पर प्रतिस्थापी जुड़ा हुआ है तथा अंत में हाइड्रोजन परमाणुओं की यथेष्ट संख्या द्वारा कार्बन परमाणु की संयोजकता को संतुष्ट किया जाएगा।
उदाहरण 13.3
निम्नलिखित यौगिकों के आई.यू.पी.ए.सी. नाम लिखिए-
(i) (CH3)3 CCH2C(CH3)3
(ii) (CH3)2C(C2H5)2
(iii) टेट्रा-तृतीयक (टर्शियरी)-ब्यूटिलमेथेन
हल
(i) 2, 2, 4, 4-टेट्रामेथिलपेन्टेन
(ii) 3, 3-डाइमेथिलपेन्टेन
(iii) 3, 3-डाइ. तृतीयक (टर्शियरी)-ब्यूटिल-2, 2, 4, 4 -टेट्रामेथिलपेन्टेन
उदाहरणार्थ–3-एथिल-2, 2-डाइमेथिलपेन्टेन की संरचना को निम्नलिखित पदों के द्वारा स्पष्ट किया जा सकता है-
(i) पाँच कार्बन परमाणुओं की शृंखला बनाइए–
C-C-C-C-C
(ii) कार्बन परमाणुओं को अंकन दीजिए–
C1–C2–C3–C4–C5
(iii) कार्बन-3 पर एक एथिल-समूह तथा कार्बन-2 पर दो मेथिल-समूह जोड़िए–
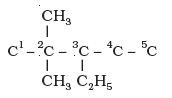
(iv) प्रत्येक कार्बन परमाणु की संयोजकता को हाइड्रोजन परमाणुओं की आवश्यक संख्या से संतुष्ट कीजिए।

इस प्रकार हम सही संरचना पर पहुँच जाते हैं। यदि आप दिए गए नाम को संरचना-सूत्र में लिखना समझ चुके हैं, तो निम्नलिखित प्रश्नों को हल कीजिए–
उदाहरण 13.4
निम्नलिखित यौगिकों के संरचनात्मक सूत्र लिखिए–
(i) 3, 4, 4, 5–टेट्रामेथिलहेप्टेन
(ii) 2,5-डाइमेथिलहेक्सेन
हल
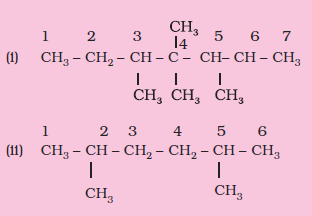
उदाहरण 13.5
निम्नलिखित यौगिकों की संरचनाएँ लिखिए। दिए गए नाम अशुद्ध क्यों हैं? सही आई.यू.पी.ए.सी. नाम लिखिए।
(i) 2-एथिलपेन्टेन
(ii) 5-एथिल-3-मेथिलहेप्टेन
हल
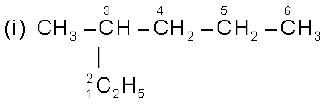
इस यौगिक में दीर्घतम शृंखला पाँच कार्बन की न होकर छः कार्बन की होती है। अतः सही नाम 3-मेथिलहेक्सेन है।
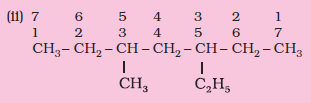
इस यौगिक में अंकन उस छोर से प्रारंभ करेंगे, जहाँ से एेथिल समूह को कम अंक मिले। अतः सही नाम 3-एेथिल- 5-मेथिलहेप्टेन है।
13.2.2 विरचन
एेल्केन के मुख्य स्रोत पेट्रोलियम तथा प्राकृतिक गैस हैं फिर भी एेल्केनों को इन विधियों द्वारा बनाया जा सकता है–
1. असंतृप्त हाइड्रोकार्बनों से–
डाइहाइड्रोजन गैस सूक्ष्म विभाजित उत्प्रेरक (जैसे- प्लैटिनम, पैलेडियम तथा निकेल) की उपस्थिति में एल्कीन के साथ योग कर एेल्केन बनाती है। इस प्रक्रिया को हाइड्रोजनीकरण (Hydrogenation) कहते हैं। ये धातुएं हाइड्रोजन गैस को अपनी सतह पर अधिशोषित करती हैं और हाइड्रोजन-हाइड्रोजन आबंध को सक्रिय करती हैं। प्लैटिनम तथा पैलेडियम, कमरे के ताप पर ही अभिक्रिया को उत्प्रेरित कर देती है, परंतु निकैल उत्प्रेरक के लिए आपेक्षिक रूप से उच्च ताप तथा दाब की आवश्यकता होती है।
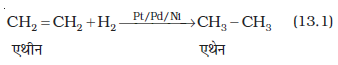
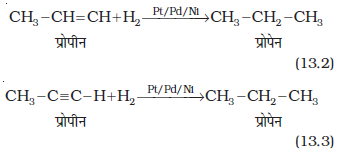
2. एेल्किल हैलाइडों से–
(i) एेल्किल हैलाइडों (फ्लुओराइडों के अलावा) का जिंक तथा तनु हाइड्रोक्लोरिक अम्ल द्वारा अपचयन करने पर एेल्केन प्राप्त होते हैं।
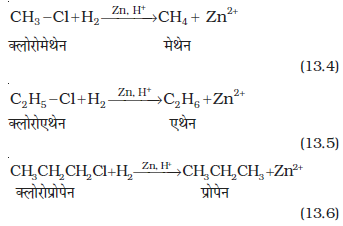
(ii) शुष्क ईथरीय विलयन (नमी से मुक्त) में एेल्किल हैलाइड की सोडियम धातु के साथ अभिक्रिया द्वारा उच्चतर एेल्केन प्राप्त होते हैं। इस अभिक्रिया को वुर्ट्ज अभिक्रिया (wurtz reaction) कहते हैं। यह सम कार्बन परमाणु संख्या वाली उच्चतर एेल्केन बनाने के लिए प्रयुक्त की जाती है।
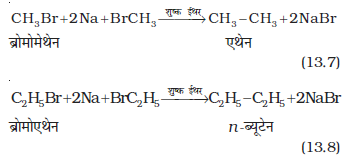
क्या होगा, यदि दो असमान एेल्किल हैलाइड लेते हैं?
3. कार्बोक्सिलिक अम्लों से–
(i) कार्बोक्सिलिक अम्लों के सोडियम लवण को सोडा लाइम (सोडियम हाइड्रॉक्साइड एवं कैल्सियम अॉक्साइड के मिश्रण) के साथ गरम करने पर कार्बोक्सिलिक अम्ल से एक कम कार्बन परमाणु वाले एेल्केन प्राप्त होते हैं। कार्बोक्सिलिक अम्ल से कार्बन डाइअॉक्साइड के इस विलोपन को विकार्बोक्सिलीकरण (decarbo- rytation) कहते हैं।

सोडियम एथेनोएट
उदाहरण 13.6
प्रोपेन के विरचन के लिए किस अम्ल के सोडियम लवण की आवश्यकता होगी। अभिक्रिया का रासायनिक समीकरण भी लिखिए।
हल
ब्यूटेनोइक अम्ल
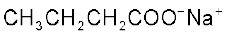
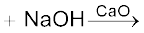
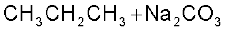
(ii) कोल्बे की विद्युत्-अपघटनीय विधि कार्बोक्सिलिक अम्लों के सोडियम अथवा पोटैशियम लवणों के जलीय विलयन का विद्युत्-अपघटन करने पर एेनोड पर सम कार्बन परमाणु संख्या वाले एेल्केन प्राप्त होते हैं।
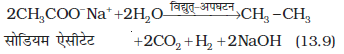
यह अभिक्रिया निम्नलिखित पदों में संपन्न होती है-
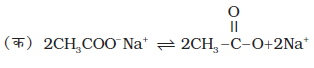
(ख) एनोड पर–
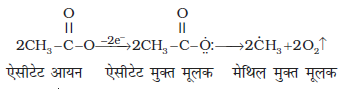
(ग)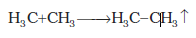
(घ) कैथोड पर–
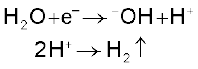
मेथेन इस विधि द्वारा नहीं बनाई जा सकती, क्यों?
13.2.3 गुणधर्म
भौतिक गुणधर्म
एल्केन अणुओं में C–C तथा C–H आबंध के सहसंयोजक गुण तथा कार्बन एवं हाइड्रोजन परमाणुओं की विद्युत् ऋणात्मकता में बहुत कम अंतर के कारण लगभग सभी एेल्केन अध्रुवीय होते हैं। इनके मध्य दुर्बल वान्डरवाल्स बल पाए जाते हैं। दुर्बल बलों के कारण एेल्केन श्रेणी के प्रथम चार सदस्य C1 से C4 तक गैस, C5 से C17 तक द्रव तथा C18 या उससे अधिक कार्बन युक्त एेल्केन 298K पर ठोस होते हैं। ये रंगहीन तथा गंधहीन होते हैं। जल में एेल्केन की विलेयता के लिए आप क्या सोचते हैं? पेट्रोल, हाइड्रोकार्बन का मिश्रण है, जिसका उपयोग स्वचालित वाहनों में ईंधन के रूप में किया जाता है। पेट्रोल तथा उसके निम्न प्रभाजों का उपयोग कपड़ों से ग्रीस के धब्बे हटाने, उनकी निर्जल धुलाई करने आदि के लिए किया जाता है।
इस प्रेक्षण के आधार पर ग्रीसी पदार्थाें की प्रकृति के बारे में आप क्या सोचते हैं? आप सही हैं यदि आप कहते हैं कि ग्रीस (उच्च एेल्केनों का मिश्रण) अध्रुवीय है अतः यह जल विरोधी प्रकृति का होगा तो विलायकों में पदार्थों की विलेयता के संबंध में सामान्यतः यह देखा गया है कि ध्रुवीय पदार्थ, ध्रुवीय विलायकों जबकि अध्रुवीय पदार्थ अध्रुवीय विलायकों में विलेय होते हैं, अर्थात् "समान समान को घोलता है"।
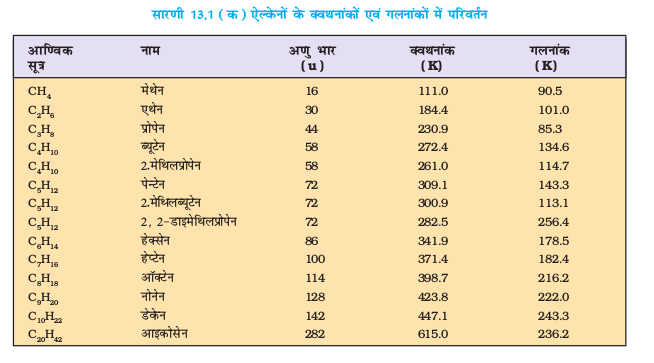
विभिन्न एल्केनों के क्वथनांक सारणी 13.1 (क) में दिए गए हैं, जिसमें यह स्पष्ट है कि आण्विक द्रव्यमान में वृद्धि के साथ- साथ उनके क्वथनांकों में भी नियत वृद्धि होती है। यह इस तथ्य पर आधारित है कि आण्विक आकार अथवा अणु का पृष्ठीय क्षेत्रफल बढ़ने के साथ-साथ उनमें आंतराण्विक वान्डरवाल्स बल बढ़ते हैं।
पेन्टेन के तीन समावयव एेल्केनों (पेन्टेन, 2-मेथिल ब्यूटेन तथा 2, 2- डाइमेथिलप्रोपेन) के क्वथनांकों को देखने से यह पता लगता है कि पेन्टेन में पाँच कार्बन परमाणुओं की एक सतत् शृंखला का उच्च क्वथनांक (309.1K) है, जबकि 2.2- डाइमेथिलप्रोपेन 282.5K पर उबलती है। शाखित शृंखलाओं की संख्या के बढ़ने के साथ-साथ अणु की आकृति लगभग गोल हो जाती है, जिससे गोलाकार अणुओं में कम आपसी संपर्क स्थल तथा दुर्बल अंतराण्विक बल होते हैं। इसलिए इनके क्वथनांक कम होते हैं।
रासायनिक गुणधर्म
जैसा पहले बताया जा चुका है– अम्ल, क्षारक, अॉक्सीकारक (अॉक्सीकरण कर्मक) एवं अपचायक (अपचयन कर्मक) पदार्थों के प्रति एेल्केन सामान्यतः निष्क्रिय होते हैं। विशेष परिस्थितियों में एेल्केन इन अभिक्रियाओं को प्रदर्शित करता है–
1. प्रतिस्थापन अभिक्रियाएं
एल्केन के एक या अधिक हाइड्रोजन परमाणु हैलोजन, नाइट्रोजन तथा सल्फोनिक अम्ल द्वारा प्रतिस्थापित हो जाते हैं। उच्च तापक्रम (573-773 K) या सूर्य के विसरित प्रकाश या पराबैगनी विकिरणों की उपस्थिति में हैलोजेनीकरण होता है। कम अणुभार वाले एेल्केन नाइट्रीकरण तथा सल्फोनीकरण नहीं दर्शाते हैं। वे अभिक्रियाओं, जिनमें एेल्केनों के हाइड्रोजन परमाणु प्रतिस्थापित हो जाते हैं, को प्रतिस्थापन अभिक्रियाएं कहते हैं। उदाहरणस्वरूप मेथैन का क्लोरीनीकरण नीचे दिया गया है–
हैलोजनीकरण या हेलोजनन
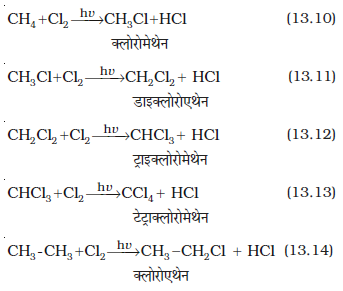
एल्केनों की हैलोजन के साथ अभिक्रिया की गति का क्रम F2>>>Cl2>>Br2>I2 है। एेल्केनों के हाइड्रोजन के विस्थापन की दर 3°>2°>1° है। फ्लुओरीनीकरण प्रचंड व अनियंत्रित होता है जबकि आयोडीनीकरण बहुत धीमे होता है। यह एक उत्क्रमणीय अभिक्रिया है। यह अभिक्रिया अॉक्सीकारक (जैसे HIO3 या HNO3)की उपस्थिति में होती है।
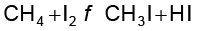 (13.15)
(13.15)
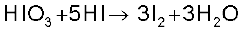 (13.16)
(13.16)
हैलोजनीकरण मुक्त मूलक शृंखला क्रियाविधि द्वारा इन तीन पदों– प्रारंभन (initiation), संचरण (propagation) तथा समापन (termination) के द्वारा संपन्न होता है।
क्रियाविधि
(i) प्रारंभन- यह अभिक्रिया वायु तथा प्रकाश की उपस्थिति में क्लोरीन अणु के समअपघटन (homolysis) से प्रारंभ होती है। Cl–Cl आबंध, C-C तथा C-H आबंध की तुलना में दुर्बल है अतः यह आसानी से टूट जाता है।

(ii) संचरण- क्लोरीन मुक्त-मूलक, मेथेन अणु पर आक्रमण करके C-H आबंध को तोड़कर HCl बनाते हुए मेथिल मुक्त मूलक बनाते हैं, जो अभिक्रिया को अग्र दिशा में ले जाते हैं।
(क) 
मेथिल मुक्त-मूलक क्लोरीन के दूसरे अणु पर आक्रमण करके CH3-Cl तथा एक अन्य क्लोरीन मुक्त-मूलक बनाते हैं, जो क्लोरीन अणु के समांशन के कारण बनते हैं।
(ख)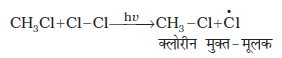
मेथिल तथा क्लोरीन मुक्त-मूलक, जो उपरोक्त पदों क्रमशः (क) तथा (ख) से प्राप्त होते हैं, पुनः व्यवस्थित होकर शृंखला अभिक्रिया का प्रारंभ करते हैं। संचरण पद (क) एवं (ख) सीधे ही मुख्य उत्पाद देते हैं किंतु अन्य कई संचरण पद संभव हैं एेसे दो पद निम्नलिखित हैं जो अधिक हैलोजनयुक्त उत्पादों के निर्माण को समझाते हैं।
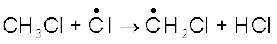
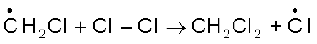
(iii) शृंखला समापन- कुछ समय पश्चात् अभिकर्मक की समाप्ति तथा विभिन्न पार्श्व अभिक्रियाओं के कारण अभिक्रिया समाप्त हो जाती है।
विभिन्न संभावित शृंखला समापन पद निम्नलिखित हैंः
(क) 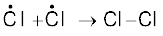
(ख) 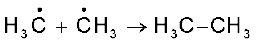
(ग) 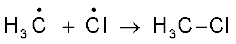
यद्यपि पद (ग) में CH3-Cl एक उत्पाद बनता है, किंतु एेसा होने में मुक्त मूलकों की कमी हो जाती है।
मेथेन के क्लोरीनीकरण के दौरान एथेन का उपोत्पाद (byproduct) के रूप में बनने के कारण को उपरोक्त क्रियाविधि द्वारा समझा जा सकता है।
2. दहन
एेल्केन वायु तथा डाइअॉक्सीजन की उपस्थिति में गरम करने पर पूर्णतः अॉक्सीकृत होकर कार्बन डाइअॉक्साइड और जल बनाते हैं तथा साथ ही अधिक मात्रा में ऊष्मा निकलती है।
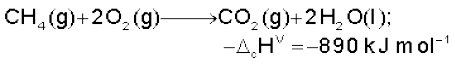 (13.17)
(13.17)
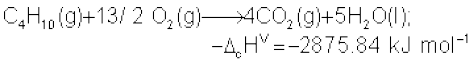 (13.18)
(13.18)
किसी एेल्केन के लिए सामान्य दहन अभिक्रिया निम्नलिखित होती है–
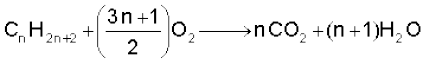 (13.19)
(13.19)
अधिक मात्रा में ऊष्मा निकलने के कारण एेल्केनों को ईंधन के रूप में काम में लेते हैं।
एेल्केनों का अपर्याप्त वायु तथा डाइअॉक्सीजन द्वारा अपूर्ण दहन से कार्बन कज्जल (Black) बनता है, जिसका उपयोग स्याही, मुद्रण स्याही के काले वर्णक (pigments) एवं पूरक (filler) के रूप में होता है।
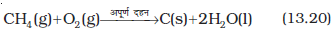
3. नियंत्रित अॉक्सीकरण
उच्च दाब, डाइअॉक्सीजन तथा वायु के सतत् प्रवाह के साथ उपयुक्त उत्प्रेरक की उपस्थिति में एेल्केनों को गरम करने पर कई प्रकार के अॉक्सीकारक उत्पाद बनते हैं।
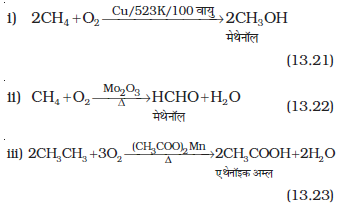
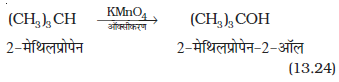
(iv) साधारणतः एेल्केनों का अॉक्सीकरण नहीं होता, किंतु तृतीयक हाइड्रोजन (H) परमाणु वाले एेल्केन पोटैशियम परमैंगनेट से अॉक्सीकृत होकर संगत एेल्कोहॉल देते हैं।
4. समावयवीकरण या समावयवन
n– एेल्केन को निर्जल एेलुमीनियम क्लोराइड तथा हाइड्रोजन क्लोराइड गैस की उपस्थिति में गरम करने पर वे उनके शाखित शृंखला वाले एेल्केनों में समावयवीकृत हो जाते हैं। मुख्य उत्पाद नीचे दिए गए हैं तथा अन्य अल्प उत्पाद के बनने की संभावना भी होती है, जिसे आप सोच सकते हैं। अल्प उत्पादों का वर्णन समान्यत कार्बनिक अभिक्रियाओं में नहीं किया जाता है।
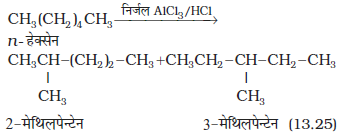
5. एेरोमैटीकरण या एेरोमैटन
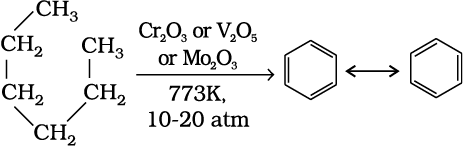
छः या छः से अधिक कार्बन परमाणु वाले n– एेल्केन एेलुमिना आधारित वैनेडियम, मालिब्डेनम तथा क्रोमियम के अॉक्साइड की उपस्थिति में 773K तथा 10 से 20 वायुमंडलीय दाब पर गरम करने से विहाइड्रोजनीकृत होकर बेन्जीन या उसके सजातीय व्युत्पन्न में चक्रीकृत हो जाते हैं। इस अभिक्रिया को एेरोमैटीकरण (Aromatization) या पुनर्संभवन (Reforming) कहते हैं।
 (13.26)
(13.26)
टॉलूईन, बेन्जीन का मेथिल व्युत्पन्न है। टॉलूईन के विरचन के लिए आप कौन सी एेल्केन सुझाएंगे।
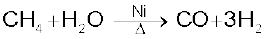
6. भाप के साथ अभिक्रिया
मेथेन भाप के साथ निकैल उत्प्रेरक की उपस्थिति में 1273K पर गरम करने पर कार्बन मोनोअॉक्साइड तथा डाइहाइड्रोजन देती है। यह विधि डाइहॉइड्रोजन के औद्योगिक उत्पादन में अपनाई जाती है।
 (13.27)
(13.27)
7. ताप-अपघटन
उच्चतर एेल्केन उच्च ताप पर गरम करने पर निम्नतर एेल्केनों या एल्कीनों में अपघटित हो जाते हैं। ऊष्मा के अनुप्रयोग से छोटे विखंड बनने की एेसी अपघटनी अभिक्रिया को ताप-अपघटन (pyrolysis) या भंजन (cracking) कहते हैं।
 (13.28)
(13.28)
एल्केनों का भंजन एक मुक्त-मूलक अभिक्रिया मानी जाती है। किरोसिन तेल या पेट्रोल से प्राप्त तेल गैस या पेट्रोल गैस बनाने में भंजन के सिद्धांत का उपयोग होता है। उदाहरणस्वरूप डोडेकेन (जो किरोसिन तेल का घटक है) को 973K पर प्लैटिनम, पैलेडियम अथवा निकैल की उपस्थिति में गरम करने पर हेप्टेन तथा पेन्टीन का मिश्रण प्राप्त होता है।
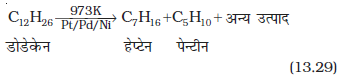
13.2.4 संरूपण
एेल्केनों में कार्बन-कार्बन सिग्मा (σ) आबंध होता है। कार्बन-कार्बन (C–C) आबंध के अंतरनाभिकीय अक्ष के चारों ओर सिग्मा आण्विक कक्षक के इलेक्ट्रॉन का वितरण सममित होता है। इस कारण C–C एकल आबंध के चारों ओर मुक्त घूर्णन होता है। इस घूर्णन के कारण त्रिविम में अणुओं के विभिन्न त्रिविमीय विन्यास होते हैं। फलतः विभिन्न समावयव एक-दूसरे में परिवर्तित हो सकते हैं। एेसे परमाणुओं की त्रिविम व्यवस्थाएँ (जो C–C एकल आबंध के घूर्णन के कारण एक-दूसरे में परिवर्तित हो जाती हैं) संरूपण, संरूपणीय समावयव या घूर्णी (Rotamers) कहलाती हैं। अतः C–C एकल आबंध के घूर्णन के कारण एेल्केन में असंख्य संरूपण संभव है। यद्यपि यह ध्यान रहे कि C–C एकल आबंध का घूर्णन पूर्णतः मुक्त नहीं होता है। यह प्रतिकर्षण अन्योन्य क्रिया के कारण होता है। यह 1 से 20 kJmol–1 तक ऊर्जा द्वारा बाधित है। निकटवर्ती कार्बन परमाणुओं के मध्य इस क्षीण बल को मरोड़ी विकृति (torsional strain) कहते हैं।
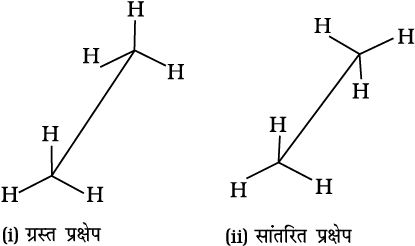
एथेन के संरूपण : एथेन अणु में कार्बन-कार्बन एकल आबंध होता है, जिसमें प्रत्येक कार्बन परमाणु पर तीन हाइड्रोजन परमाणु जुड़े रहते हैं। एथेन के बॉल एवं स्टिक मॉडल को लेकर यदि हम एक कार्बन को स्थिर रखकर दूसरे कार्बन परमाणु को C–C अक्ष पर घूर्णन कराएं, तो एक कार्बन परमाणु के हाइड्रोजन दूसरे कार्बन परमाणु के हाइड्रोजन के संदर्भ में असंख्य त्रिविमीय व्यवस्था प्रदर्शित करते हैं। इन्हें संरूपणीय समावयव (संरूपण) कहते हैं। अतः एेथेन के असंख्य संरूपण होते हैं। हालाँकि इनमें से दो संरूपण चरम होते हैं। एक रूप में दोनों कार्बन के हाइड्रोजन परमाणु एक-दूसरे के अधिक पास हो जाते हैं। उसे ग्रस्त (Eclipsed) रूप कहते हैं। दूसरे रूप में, हाइड्रोजन परमाणु दूसरे कार्बन के हाइड्रोजन परमाणुओं से अधिकतम दूरी पर होते हैं। उन्हें सांतरित (staggered) रूप कहते हैं। इनके अलावा कोई भी मध्यवर्ती संरूपण विषमतलीय (skew) संरूपण कहलाता है। यह ध्यान रहे कि सभी संरूपणों में आबंध कोण तथा आबंध लंबाई समान रहती है। ग्रस्त तथा सांतरित तथा संरूपणों को सॉहार्स तथा न्यूमैन प्रक्षेप (Newmen projection) द्वारा प्रदर्शित किया जाता है।
1. सॉहार्स प्रक्षेप
इस प्रक्षेपण में अणु को आण्विक अक्ष की दिशा में देखा जाता है। कागज पर केंद्रीय C–C आबंध को दिखाने के लिए दाईं या बाईं ओर झुकी हुई एक सीधी रेखा खींची जाती है। इस रेखा को कुछ लंबा बनाया जाता है। आगे वाले कार्बन को नीचे बाईं ओर तथा पीछे वाले कार्बन को ऊपर दाईं ओर से प्रदर्शित करते हैं। प्रत्येक कार्बन से संलग्न तीन हाइड्रोजन परमाणुओं को तीन रेखाएँ खींचकर दिखाया जाता है। ये रेखाएँ एक-दूसरे से 120° का कोण बनाकर झुकी होती हैं। एथेन के ग्रस्त एवं सांतरित सॉहार्स प्रक्षेप चित्र 13.2 में दर्शाए गए हैं।
चित्र 13.2 एथेन के साहार्स प्रक्षेप
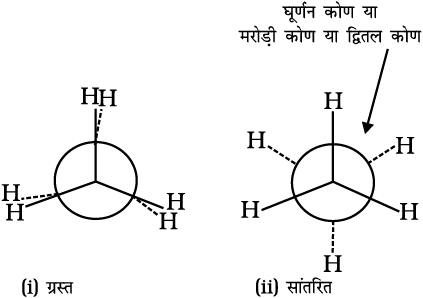
2. न्यूमैन प्रक्षेप
इस प्रक्षेपण में अणु को सामने से देखा जाता है। आँख के पास वाले कार्बन को एक बिंदु द्वारा दिखाया जाता है और उससे जुड़े तीन हाइड्रोजन परमाणुओं को 120° कोण पर खींची तीन
चित्र 13.3 एथेन के न्यूमैन प्रक्षेप
रेखाओं के सिरों पर लिखकर प्रदर्शित किया जाता है। पीछे (आँख से दूर) वाले कार्बन को एक वृत्त द्वारा दर्शाते हैं तथा इसमें आबंधित हाइड्रोजन परमाणुओं को वृत्त की परिधि से परस्पर 120° के कोण पर स्थित तीन छोटी रेखाओं से जुड़े हुए दिखाया जाता है। एथेन के न्यूमैन प्रक्षेपण चित्र 13.3 में दिखाए गए हैं।
संरूपणों का आपेक्षिक स्थायित्व : जैसा पहले बताया जा चुका है, एथेन के सांतरित रूप में कार्बन-हाइड्रोजन आबंध के इलेक्ट्रॉन अभ्र एक-दूसरे से अधिकतम दूरी पर होते हैं। अतः उनमें न्यूनतम प्रतिकषर्ण बल न्यूनतम ऊर्जा तथा अणु का अधिकतम स्थायित्व होता है। दूसरी ओर, जब सांतरित को ग्रस्त रूप में परिवर्तित करते हैं, तब कार्बन-हाइड्रोजन आबंध के इलेक्ट्रॉन अभ्र एक-दूसरे के इतने निकट होते हैं कि उनके इलेक्ट्रॉन अभ्रों के मध्य प्रतिकर्षण बढ़ जाता है। इस बढ़े हुए प्रतिकर्षी बल को दूर करने के लिए अणु में कुछ अधिक ऊर्जा निहित होती है। इसलिए इसका स्थायित्व कम हो जाता है। जैसा पहले बताया जा चुका है, इलेक्ट्रॉन अभ्र के मध्य प्रतिकर्षी अन्योन्य क्रिया, जो संरूपण के स्थायित्व को प्रभावित करती है, को मरोड़ी विकृति कहते हैं। मरोड़ी विकृति का परिणाम
C–C एकल आबंध के घूर्णन कोण पर निर्भर करता है। इस कोण को द्वितल कोण या मरोड़ी कोण भी कहते हैं। एथेन के सभी संरूपणों में मरोड़ी कोण सांतरित रूप में न्यून्तम तथा ग्रस्त रूप में अधिकतम होता है। अतः सांतरित संरूपण, ग्रस्त प्रक्षेप की तुलना में अधिक स्थायी होता है। परिणामतः अणु अधिकतर सांतरित संरूपण में रहते हैं अथवा हम कह सकते हैं कि यह इनका अधिमत संरूपण है। अतः यह निष्कर्ष निकाला जाता है कि एथेन में C–C (आबंध) का घूर्णन पूर्णतः मुक्त नहीं है। दो चरम रूपों के मध्य ऊर्जा का अंतर 12.5 kJ mol–1 है, जो बहुत कम है। सामान्य ताप पर अंतराण्विक संघट्यों (Collisions) के द्वारा एथेन अणु में तापीय तथा गतिज ऊर्जा होती है, जो 12.5 kJ mol–1 के ऊर्जा-अवरोध को पार करने में सक्षम होती है। अतः एथेन में कार्बन-कार्बन एकल आबंध का घूर्णन सभी प्रायोगिक कार्य के लिए लगभग मुक्त है। एथेन के संरूपणों को पृथक् तथा वियोजित करना संभव नहीं है।
13.3 एल्कीन
एल्कीन द्विआबंधयुक्त असंतृप्त हाइड्रोकार्बन होते हैं। एल्कीनों का सामान्य सूत्र क्या होना चाहिए? अगर एल्कीन में दो कार्बन परमाणुओं के मध्य एक द्विआबंध उपस्थित है, तो उनमें एेल्केन से दो हाइड्रोजन परमाणु कम होने चाहिए। इस प्रकार एल्कीनों का सामान्य सूत्र CnH2n होना चाहिए। एल्कीनों के प्रथम सदस्य एथिलीन अथवा एथीन (C2H4) की अभिक्रिया क्लोरीन से कराने पर तैलीय द्रव प्राप्त होता है। अतः एल्कीनों को ओलीफीन (तैलीय यौगिक बनाने वाले) भी कहते हैं।
13.3.1 द्विआबंध की संरचना
एल्कीनों में C = C द्विआबंध है, जिसमें एक प्रबल सिग्मा (σ) आबंध (बंध एंथैल्पी लगभग 397 kJmol–1 है) होता है, जो दो कार्बन परमाणुओं के sp2 संकरित कक्षकों के सम्मुख अतिव्यापन से बनता है। इसमें दो कार्बन परमाणुओं के 2p असंकरित कक्षकों के संपार्श्विक अतिव्यापन करने पर एक दुर्बल पाई (π) बंध, ( बंध एन्थैल्पी 284 kJ mol–1 है ) बनता है।
C–C एकल आबंध लंबाई (1.54 pm) की तुलना में C = C द्विआबंध लंबाई (1.34 pm) छोटी होती है। आपने पूर्व में अध्ययन किया है कि पाई (π) आबंध दो p कक्षकों के दुर्बल अतिव्यापन के कारण दुर्बल होते हैं। अतः पाई (π) आबंध वाले एल्कीनों को दुर्बल बंधित गतिशील इलेक्ट्रॉनों का स्रोत कहा जाता है। अतः एल्कीनों पर उन अभिकर्मकों अथवा यौगिकों, जो इलेक्ट्रॉन की खोज में हों, का आक्रमण आसानी से हो जाता है। एेसे अभिकर्मकों को इलेक्ट्रॉनस्नेही अभिकर्मक कहते हैं। दुर्बल π आबंध की उपस्थिति एल्कीन अणुओं को एेल्केन की तुलना में अस्थायी बनाती है। अतः एल्कीन इलेक्ट्रॉनस्नेही अभिकर्मकों के साथ संयुक्त होकर एकल आबंध-युक्त यौगिक बनाते हैं। C–C द्विआबंध की सामर्थ्य (बंध एंथैल्पी, 681 kJ mol–1) एथेन के कार्बन-कार्बन एकल आबंध (आबंध एंथैल्पी, 348 kJ mol–1) की तुलना में अधिक होती है। एथीन अणु का कक्षक आरेख चित्र- संख्या 13.4 तथा 13.5 में दर्शाया गया है।

चित्र 13.4 एथीन का कक्षीय आरेख केवल 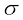 बंधों को चित्रित करते हुए
बंधों को चित्रित करते हुए
13.3.2 नाम-पद्धति
एल्कीनों के आई.यू.पी.ए.सी. नाम पद्धति के लिए द्विआबंध युक्त दीर्घतम कार्बन परमाणुओं की शृंखला में, अनुलग्न ‘एेन’ के स्थान पर अनुलग्न ‘ईन’ (ene) का प्रयोग किया जाता है। स्मरण रहे कि एल्कीन श्रेणी का प्रथम सदस्य हैः CH2
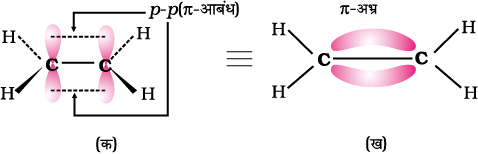
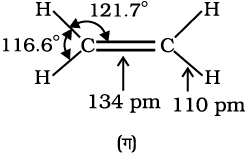
चित्र 13.5 एथीन का कक्षीय आरेख (क) π आबंध बनना (ख) π– अभ्र का बनना तथा (ग) आबंध कोण तथा आबंध लंबाई
(CnH2n में n को 1 द्वारा प्रतिस्थापित करने पर ), जिसे मेथेन कहते हैं। इसकी आयु अल्प होती है। जैसा पहले प्रदर्शित किया गया है, एल्कीन श्रेणी के प्रथम स्थायी सदस्य C2H4 को एथिलीन (सामान्य नाम) या एथीन (आई.यू.पी.ए.सी. नाम) कहते हैं। कुछ एल्कीनों सदस्यों के आई.यू.पी.ए.सी नाम नीचे दिए गए हैं–

उदाहरण 13.7
निम्नलिखित यौगिकों के आई.यू.पी.ए.सी. नाम लिखिए-
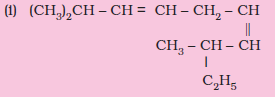
(ii) 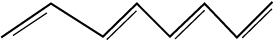
(iii) CH2 = C (CH2CH2CH3)2
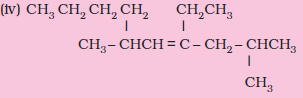
हल
(i) 2, 8-डाइमेथिलडेका-3, 6-डाईन
(ii) 1, 3, 5, 7 – अॉक्टाटेट्राईन
(iii) 2–n–प्रोपिलपेन्ट-1– ईन
(iv) 4–एथिल-2,6-डाइमेथिल-डेक-4-ईन
उदाहरण 13.8 ऊपर दी गईं संरचनाओं (i-iv) में सिग्मा (σ) तथा पाई (π) आबंधों की संख्या का परिकलन कीजिए।
हल
(i) σ बंध : 33, π बंध : 2
(ii) σ बंध : 17, π बंध : 4
(iii) σ बंध : 23, π बंध : 1
(iv) σ बंध : 41, π बंध : 1
13.3.3 समावयता
एल्कीनों द्वारा संरचनात्मक एवं ज्यामितीय समावयवता प्रदर्शित की जाती है।
संरचनात्मक समावयवता- एल्केनों की भाँति एथीन (C2H4) तथा प्रोपीन (C3H6) में केवल एक ही संरचना होती है, किंतु प्रोपीन से उच्चतर एल्कीनों में भिन्न संरचनाएं होती हैं।
C4H8 अणुसूत्र वाली एल्कीन को तीन प्रकार से लिख सकते हैं।

I. ब्यूट-1-ईन
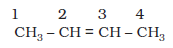
II. ब्यूट-2-ईन
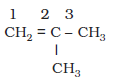
III. 2-मेथिलप्रोप-1-ईन
संरचना I एवं III तथा II एवं III शृंखला समावयवता के उदाहरण हैं, जबकि संरचना I एवं II स्थिति समावयव हैं।
उदाहरण 13.9
C5H10 के संगत एल्कीनों के विभिन्न संरचनात्मक समावयवियों के संरचना-सूत्र एवं आई.यू.पी.ए.सी. नाम लिखिए।
हल
(क) CH2 = CH – CH2 – CH2 – CH3
पेन्ट-1-ईन
(ख) CH3 – CH=CH – CH2 – CH3
पेन्ट-2-ईन
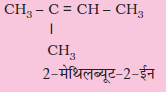

ज्यामितीय समावयवता : द्विआबंधित कार्बन परमाणुओं की बची हुई दो संयोजकताओं को दो परमाणु या समूह जुड़कर संतुष्ट करते हैं। अगर प्रत्येक कार्बन से जुड़े दो परमाणु या समूह भिन्न-भिन्न हैं तो इसे YXC=CXY द्वारा प्रदर्शित करते हैं। एेसी संरचनाओं को दिक् में इस प्रकार प्रदर्शित किया जाता है–
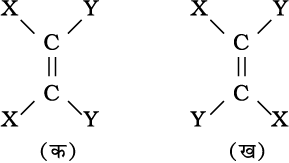
संरचना ‘क’ में एक समान दो परमाणुओं (दोनों X या दोनों Y) द्विआबंधित कार्बन परमाणुओं के एक ही ओर स्थित होते हैं। संरचना ‘ख’ में दोनों X अथवा दोनों Y द्विआबंध कार्बन की दूसरी तरफ या द्विआबंधित कार्बन परमाणु के विपरीत स्थित होते हैं, जो विभिन्न ज्यामिति समावयवता दर्शाते हैं, जिसका दिक् में परमाणु या समूहों की भिन्न स्थितियों के कारण विन्यास भिन्न होता है। अतः ये त्रिविम समावयवी (stereoisomer) हैं। इनकी समान ज्यामिति तब होती है, जब द्विआबंधित कार्बन परमाणुओं या समूहों का घूर्णन हो सकता है, किंतु C=C द्विआबंध में मुक्त घूर्णन नहीं होता। यह प्रतिबंधित होता है। इस तथ्य को समझने के लिए दो सख्त कार्डबोर्ड के टुकड़े लीजिए और दो कीलों की सहायता से उन्हें संलग्न कर दीजिए। एक कार्डबोर्ड को हाथ से पकड़कर दूसरे कार्डबोर्ड को घूर्णित करने का प्रयास कीजिए। क्या वास्तव में आप दूसरे कार्ड-बोर्ड का घूर्णन कर सकते हैं? नहीं, क्योंकि घूर्णन प्रतिबंधित हैं। अतः परमाणुओं अथवा समूहों के द्विआबंधित कार्बन परमाणुओं के मध्य प्रतिबंधित घूर्णन के कारण यौगिकों द्वारा भिन्न ज्यामितियाँ प्रदर्शित की जाती हैं। इस प्रकार के त्रिविम समावयव, जिसमें दो समान परमाणु या समूह एक ही ओर स्थित हों, उन्हें समपक्ष (cis) कहा जाता है, जबकि दूसरे समावयवी, जिसमें दो समान परमाणु या समूह विपरीत ओर स्थित हों, विपक्ष (trans) समावयव कहलाते हैं। इसलिए दिक् में समपक्ष तथा विपक्ष समावयवों की संरचना समान होती है, किंतु विन्यास भिन्न होता है। दिक् में परमाणुओं या समूहों की भिन्न व्यवस्थाओं के कारण ये समावयवी उनके गुणों (जैसे–गलनांक, क्वथनांक द्विध्रुव आघूर्ण, विलेयता आदि) में भिन्नता दर्शाते हैं। ब्यूट-2-ईन की ज्यामितीय समावयवता अथवा समपक्ष-विपक्ष समावयवता को निम्नलिखित संरचना द्वारा प्रदर्शित किया जाता है–
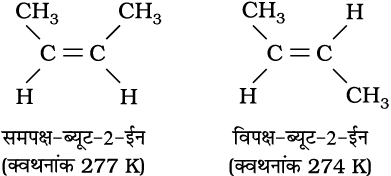
एल्कीन का समपक्ष रूप विपक्ष की तुलना में अधिक ध्रुवीय होता है। उदाहरणस्वरूप–समपक्ष ब्यूट-2-ईन का द्विध्रुव आघूर्ण 0.350 डिबाई है, जबकि विपक्ष ब्यूट-2-ईन का लगभग शून्य होता है। अतः विपक्ष ब्यूट-2-ईन अध्रुवीय है। इन दोनों रूपों की निम्नांकित विभिन्न ज्यामितियों को बनाने से यह पाया गया है कि विपक्ष-ब्यूट-2-ईन के दोनों मेथिल समूह, जो विपरीत दिशाओं में होते हैं, प्रत्येक C-CH3 आबंध के कारण ध्रुवणता को नष्ट करके विपक्ष रूप को इस प्रकार अध्रुवीय बनाते हैं–
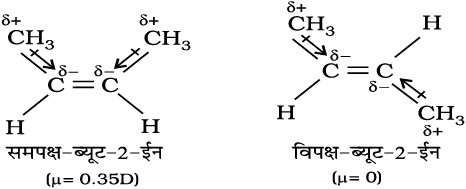
ठोसों में विपक्ष समावयवियों के गलनांक समपक्ष समावयवियों की तुलना में अधिक होते हैं।
ज्यामितीय या समपक्ष (Cis) विपक्ष (Trans) समावयवता, XYC=CXZ तथा XYC=CZW प्रकार की एल्कीनों द्वारा भी प्रदर्शित की जाती है।
उदाहरण 13.10
निम्नलिखित यौगिकों के समपक्ष (cis) तथा विपक्ष (trans) समावयव बनाइए और उनके आई.यू.पी.ए.सी. नाम लिखिए।
हल
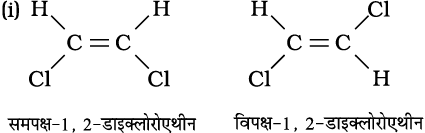
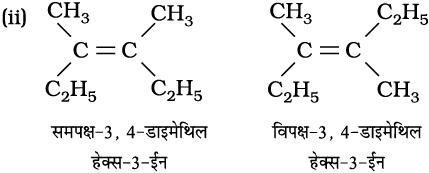
उदाहरण 13.11
निम्नलिखित में से कौन से यौगिक समपक्ष-विपक्ष समावयवता प्रदर्शित करते हैं?
(i) (CH3)2C = CH – C2H5
(ii) CH2 = CBr2
(iii) C6H5CH = CH – CH3
(iv) CH3CH = CCl CH3
हल
यौगिक iii तथा iv
13.3.4 विरचन
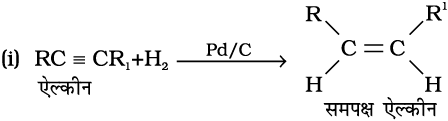
1. एल्काइनों से : एल्काइनों के डाइहाइड्रोजन की परिकलित मात्रा के साथ पैलेडिकृत चारकोल की उपस्थिति में जिसे सल्फर जैसे विषाक्त यौगिकों द्वारा आंशिक निष्क्रिय किया गया हो तो इसके आंशिक अपचयन पर एल्कीन प्राप्त होते हैं। आंशिक रूप से निष्क्रिय पैलेडिकृत चारकोल को लिंडलार अभिकर्मक (Lindlar's catalyst) कहते हैं। इस प्रकार प्राप्त एल्कीनों की समपक्ष ज्यामिती होती है। एल्काइनों के सोडियम तथा द्रव अमोनिया के साथ अपचयन करने पर विपक्ष समावयव वाले एल्कीन बनते हैं।
(13.30)
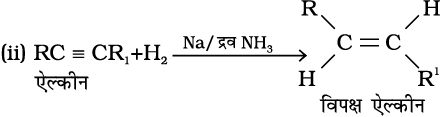
(13.31)
क्या इस प्रकार प्राप्त प्रोपीन ज्यामिती समावयवता प्रदर्शित करेगी? अपने उत्तर की पुष्टि के लिए कारण खोजिए।
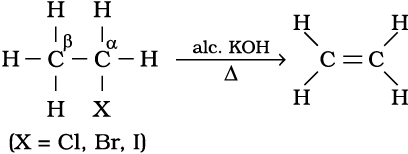
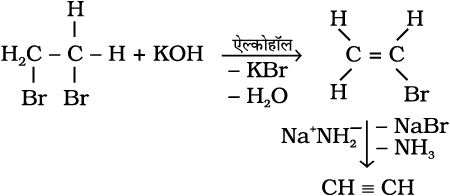
2. एेल्किल हैलाइडों से : एेल्किल हैलाइड (R-X) को एेल्कोहॉली पोटाश (जैसे–एेथेनॉल में विलेय पोटैशियम हाइड्रॉक्साइड) की उपस्थिति में गरम करने पर हैलोजेन अम्ल के अणु के विलोचन पर एल्कीन बनते हैं।
इस अभिक्रिया को विहाइड्रोहैलोजनीकरण (या विहाइड्रोहैलोजनन) कहते हैं, जिसमें हैलोजन अम्ल का विलोपन होता है। यह एक β– विलोपन अभिक्रिया का उदाहरण है। चूँकि β– कार्बन परमाणु (जिस कार्बन से हैलोजन परमाणु जुड़ा हो, उसके अगले कार्बन परमाणु) से हाइड्रोजन का विलोपन होता है।
(13.34)
हैलोजन परमाणु की प्रकृति तथा एेल्किल समूह ही अभिक्रिया की दर निर्धारित करते हैं। एेसा देखा गया है कि हैलोजन परमाणु के लिए दर निम्न इस प्रकार हैं– आयोडीन > ब्रोमीन > क्लोरीन, जबकि एेल्किल समूहों के लिए यह हैं–
3° > 2°>1°.
3. सन्निध डाइहैलाइडों से : डाइहैलाइड, जिनमें दो निकटवर्ती कार्बन परमाणुओं पर दो हैलोजन परमाणु उपस्थित हों, सन्निध डाइहैलाइड कहलाते हैं। सन्निध डाइहैलाइड ज़िंक धातु से अभिक्रिया करके ZnX2 अणु का विलोपन करके एल्कीन देते हैं। इस अभिक्रिया को विहैलोजनीकरण या विहैलोजनन कहते हैं।

(13.35)
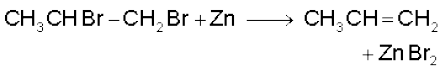
(13.36)
4. एेल्कोहॉलों के अम्लीय निर्जलन से : आपने एकक-12 में विभिन्न सजातीय श्रेणियों की नामकरण पद्धति का अध्ययन किया है। एेल्कोहॉल एेल्केन के हाइड्रॉक्सी व्युत्पन्न होते हैं। इन्हें R–OH से प्रदर्शित करते हैं, जहाँ R=CnH2n+1 है। एेल्कोहॉलों को सांद्र सल्फ्यूरिक अम्ल के साथ गरम करने पर जल के एक अणु का विलोपन होता है। फलतः एेल्कीन बनती हैं। चूँकि अम्ल की उपस्थिति में एेल्कोहॉल अणु से जल का एक अणु विलोपित होता है, अतः इस अभिक्रिया को एेल्कोहॉलों का अम्लीय निर्जलीकरण कहते हैं। यह β– विलोपन अभिक्रिया का उदाहरण है, क्योंकि इसमें –OH समूह, β– कार्बन परमाणु से एक हाइड्रोजन परमाणु हटाता है।
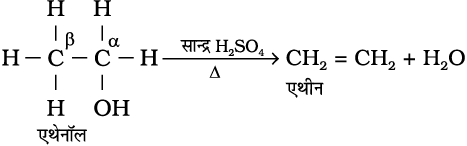
(13.37)
13.3.5 गुणधर्म
भौतिक गुणधर्म
ध्रुवीय प्रकृति में अंतर के अलावा एल्कीन भौतिक गुणधर्मों में एेल्केन से समानता दर्शाती है। प्रथम तीन सदस्य ‘गैस’, अगले चौदह सदस्य ‘द्रव’ तथा उससे अधिक कार्बन संख्या वाली सदस्य ‘ठोस’ होते हैं। एथीन रंगहीन तथा हलकी मधुर सुगंध वाली गैस है। अन्य सभी एल्कीन रंगहीन तथा सुगंधित, जल में अविलेय, परंतु कार्बनिक विलायकों जैसे–बेन्जीन, पेट्रोलियम ईथर में विलेय होती हैं। आकार में वृद्धि होने के साथ-साथ इसके क्वथनांक में क्रमागत वृद्धि होती है, जिसमें प्रत्येक CH2 समूह बढ़ने पर क्वथनांक में 20 से 30 K तक की वृद्धि होती है। एेल्केनों के समान सीधी शृंखला वाले एल्कीनों का क्वथनांक समावयवी शाखित शृंखला वाले एल्कीनों की तुलना में उच्च होता है।
रासायनिक गुणधर्म
एल्कीन क्षीण बंधित π इलेक्ट्रॉनों के स्रोत होते हैं। इसलिए ये योगज अभिक्रियाएं दर्शाते हैं, जिनमें इलेक्ट्रॉनस्नेही C=C द्विबंध पर जुड़कर योगात्मक उत्पाद बनाते हैं। कुछ अभिकर्मकों के साथ क्रिया मुक्त-मूलक क्रियाविधि द्वारा भी होती है। एल्कीन कुछ विशेष परिस्थितियों में मुक्त-मूलक प्रतिस्थापन अभिक्रियाएं प्रदर्शित करती हैं। एल्कीन में अॉक्सीकरण तथा ओजोनी अपघटन अभिक्रियाएं प्रमुख हैं। एल्कीन की विभिन्न अभिक्रियाओं का संक्षिप्त विवरण इस प्रकार है–
1. डाइहाइड्रोजन का संयोजन– एल्कीन सूक्ष्म पिसे हुए निकैल, पैलेडियम अथवा प्लैटिनम की उपस्थिति में डाइहाइड्रोजन गैस के एक अणु के योग से एेल्केन बनाती हैं (13.2.2)।
2. हैलोजन का संयोजन– एल्कीन से संयुक्त होकर हैलोजन जैसे ब्रोमीन या क्लोरीन सन्निध डाइहैलाइड देते हैं, हालाँकि आयोडीन सामान्य परिस्थितियों में योगज अभिक्रिया प्रदर्शित नहीं करती। ब्रोमीन द्रव का लाल-नारंगी रंग असंतृप्त स्थान पर ब्रोमीन के जुड़ने के पश्चात् लुप्त हो जाता है। इस अभिक्रिया का उपयोग असंतृप्तता के परीक्षण के लिए होता है। एल्कीन पर हैलोजन का योग इलेक्ट्रॉनस्नेही (इलेक्ट्रॉनरागी) योगज अभिक्रिया का उदाहरण है, जिसमें चक्रीय हैलोनियम आयन का निर्माण सम्मिलित होता है। इसका अध्ययन आप उच्च कक्षा में करेंगे।
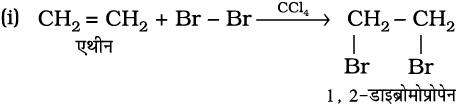
(13.38)
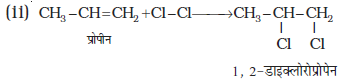
(13.39)
3. हाइड्रोजन हैलाइडों का संयोजन– हाइड्रोजन हैलाइड, HCl, HBr, Hl एल्कीनों से संयुक्त होकर एेल्किल हैलाइड बनाते हैं। हाइड्रोजन हैलाइडों की अभिक्रियाशीलता का क्रम इस प्रकार हैः HI > HBr > HCl। एल्कीनों में हैलोजन के योग के समान हाइड्रोजन हैलाइड का योग भी इलेक्ट्रॉनस्नेही योगज अभिक्रिया का उदाहरण है। इसे हम सममित तथा असममित एल्कीनों की योगज अभिक्रियाओं से स्पष्ट करेंगे।
सममित एल्कीनों में HBr की योगज अभिक्रिया–सममित एल्कीनों में (जब द्विआबंध पर समान समूह जुड़े हुए हों) HBr की योगज अभिक्रियाएं इलेक्ट्रॉनस्नेही योगज क्रियाविधि से संपन्न होती हैं।
 (13.40)
(13.40)

(13.41)
असममित एल्कीनों पर HBr का योगज (मार्कोनीकॉफ नियम)
प्रोपीन पर HBr का संकलन कैसे होगा? इसमें दो संभावित उत्पाद I तथा II हो सकते हैं।
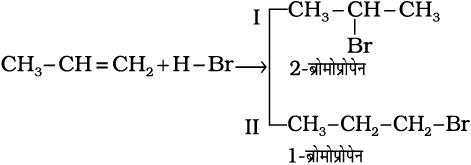
(13.42)
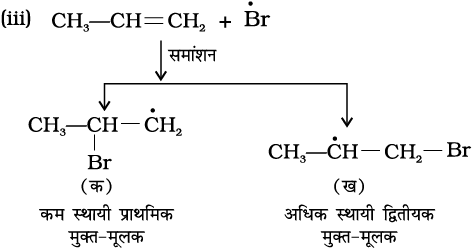
रूसी रसायनविद् मार्कोनीकॉफ ने सन् 1869 में इन अभिक्रियाओं का व्यापक अध्ययन करने के पश्चात् एक नियम प्रतिपादित किया, जिसे मार्कोनीकॉफ का नियम कहते हैं। इस नियम के अनुसार, योज्य (वह अभिकर्मक, जिसका संकलन हो रहा है) का अधिक ऋणात्मक भाग उस कार्बन पर संयुक्त होता है, जिस पर हाइड्रोजन परमाणुओं की संख्या कम हो। अतः इस नियम के अनुसार उत्पाद (I) 2- ब्रोमोप्रोपेन अपेक्षित है। वास्तविक व्यवहार में यह अभिक्रिया का मुख्य उत्पाद है। अतः मार्कोनीकॉफ नियम के व्यापकीकरण को अभिक्रिया की क्रियाविधि से अच्छी तरह समझा जा सकता है।
क्रियाविधि
हाइड्रोजन ब्रोमाइड इलेक्ट्रॉनस्नेही H+ देता है, जो द्विआबंध पर आक्रमण करके नीचे दिए गए कार्बधनायन (Carbocation) बनाता है–
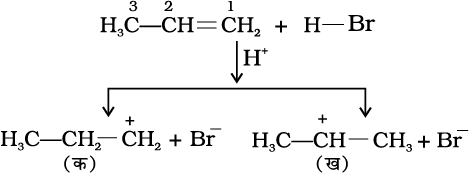
यहाँ ‘क’ कम स्थायी प्राथमिक कार्बधनायन है जबकि ‘ख’ अधिक स्थायी द्वितीयक कार्बधनायन है।
(i) द्वितीयक कार्बधनायन, (ख) प्राथमिक कार्बधनायन
(क) की तुलना में अधिक स्थायी होता है। अतः द्वितीयक कार्ब- धनायन प्रधान रूप से बनेगा, क्योंकि यह शीघ्र निर्मित होता है।
(ii) कार्बधनायन (ख) में Br– के आक्रमण से उत्पाद इस प्रकार बनता है–
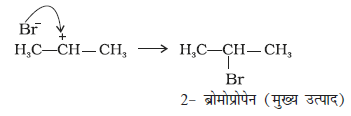
प्रति मार्कोनीकॉफ़ योगज अथवा परॉक्साइड प्रभाव अथवा खराश प्रभाव– परॉक्साइड की उपस्थिति में असममित एल्कीनों (जैसे– प्रोपीन) से HBr का संयोजन प्रति मार्कोनीकॉफ नियम से होता है। एेसा केवल HBr के साथ होता है, HCl एवं HI के साथ नहीं। इस योगज अभिक्रिया का अध्ययन एम.एस. खराश तथा एफ.आर. मेयो द्वारा सन् 1933 में शिकागो विश्वविद्यालय में किया गया। अतः इस अभिक्रिया को परॉक्साइड या खराश प्रभाव (Kharach effect) या योगज अभिक्रिया का प्रति मार्कोनीकॉफ नियम कहते हैं।
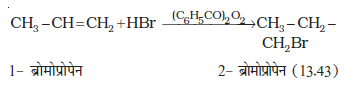
परॉक्साइड प्रभाव, मुक्त-मूलक शृंखला क्रियाविधि द्वारा होता है, जिसकी क्रियाविधि नीचे दी गई है।
(i) 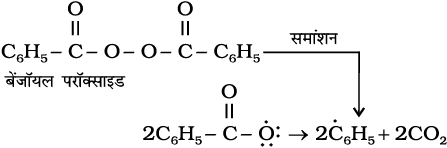
(ii) 
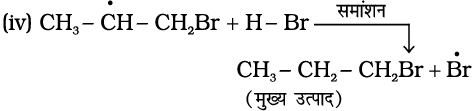
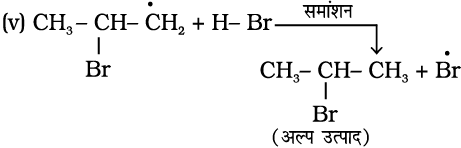
उपरोक्त क्रिया (iii) से प्राप्त द्वितीयक मुक्त-मूलक प्राथमिक मुक्त-मूलक की तुलना में अधिक स्थायी होता है, जिसके कारण 1-ब्रोमोप्रोपेन मुख्य उत्पाद के रूप में प्राप्त होता है। यह ध्यान रखने योग्य बात है कि परॉक्साइड प्रभाव HCl तथा HI के संकलन में प्रदर्शित नहीं होता है। यह इस तथ्य
पर आधारित है कि HCl का आबंध (430.5 kJ mol-1), H-Br के आबंध (363.7 kJ mol-1) की तुलना में प्रबल होता है। जो 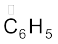 मुक्त-मूलक द्वारा विदलित नहीं हो पाता। यद्यपि HI (296.8 kJ mol-1) का आबंध दुर्बल होता है, परंतु आयोडीन मुक्त-मूलक द्विआबंध पर जुड़ने की बजाय आपस में संयुक्त होकर आयोडीन अणु बनाते हैं।
मुक्त-मूलक द्वारा विदलित नहीं हो पाता। यद्यपि HI (296.8 kJ mol-1) का आबंध दुर्बल होता है, परंतु आयोडीन मुक्त-मूलक द्विआबंध पर जुड़ने की बजाय आपस में संयुक्त होकर आयोडीन अणु बनाते हैं।
उदाहरण 13.12
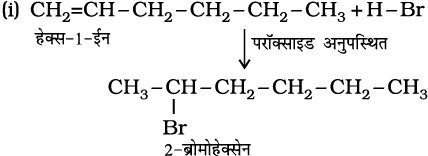
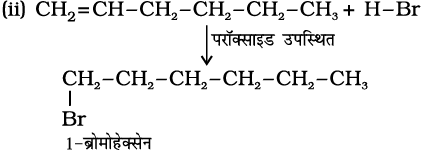
हेक्स-1-ईन की HBr के साथ संकलन अभिक्रिया से प्राप्त उत्पादों के आई.यू.पी.ए.सी. नाम दीजिए।
(i) परॉक्साइड की अनुपस्थिति में (ii) परॉक्साइड की उपस्थिति में।
हल
4. सल्फ्यूरिक अम्ल का संयोजन– एल्कीनों की ठंडे सांद्र सल्फ्यूरिक अम्ल से क्रिया मार्कोनीकॉफ नियम के अनुसार होती है तथा इलेक्ट्रॉनस्नेही योगज अभिक्रिया द्वारा एेल्किल हाइड्रोजन सल्फेट बनते हैं।
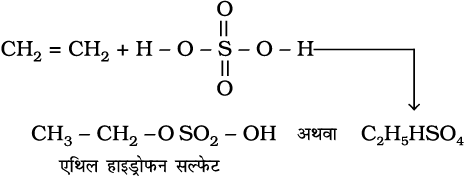 (13.44)
(13.44)
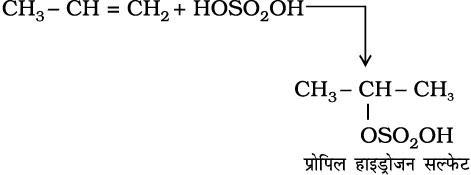 (13.45)
(13.45)
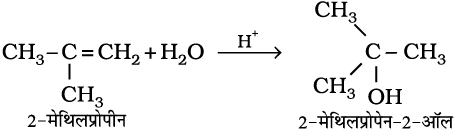
5. जल का संयोजन– एल्कीन, सांद्र सल्फ़्यूरिक अम्ल की कुछ बूँदों की उपस्थिति में जल के साथ मार्कोनीकॉफ नियमानुसार अभिक्रिया करके एेल्कोहॉल बनाते हैं।
(13.46)
6. अॉक्सीकरण– एल्कीन ठंडे, तनु, जलीय पोटैशियम परमैंगनेट, विलयन (बेयर अभिकर्मक) के साथ अभिक्रिया करके संनिध ग्लाइकॉल बनाती हैं। पोटैशियम परमैंगनेट विलयन का विरंजीकरण असंतृप्तता का परीक्षण है।
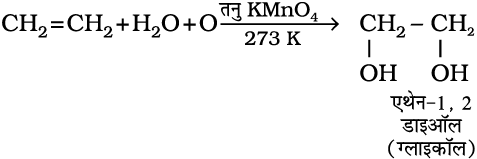
(13.47)
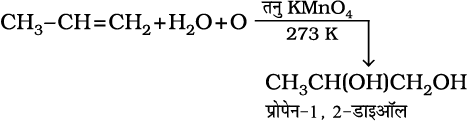
(13.48)
अम्लीय पोटैशियम परमैंगनेट अथवा अम्लीय पोटैशियम डाइक्रोमेट, एल्कीन को कीटोन और अम्ल में अॉक्सीकृत करते हैं। उत्पाद की प्रकृति, एल्कीन की प्रकृति तथा प्रायोगिक परिस्थितियों पर निर्भर करती है।
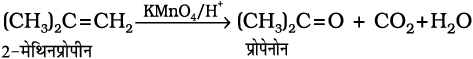
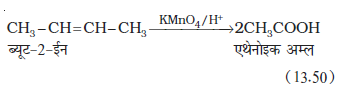
7. ओजोनी अपघटन– ओजोनी अपघटन में एल्कीन O3 का संकलन कर ओजोनाइड बनाते हैं और Zn-H2O के द्वारा ओजोनाइड का विदलन छोटे अणुओं में हो जाता है। यह अभिक्रिया एल्कीन तथा अन्य असंतृप्त यौगिकों में द्विआबंध की स्थिति निश्चित करने के लिए उपयोग में आती है।
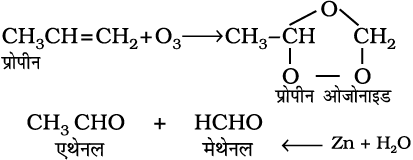
(13.51)
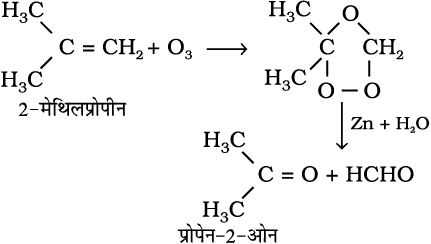
(13.52)
8. बहुलकीकरण– आप पॉलिथीन की थैलियों तथा पॉलिथीन शीट से परिचित होंगे। अधिक संख्या में एथीन अणुओं का उच्च ताप, उच्च दाब तथा उत्प्रेरक की उपस्थिति में संकलन करने से पॉलिथीन प्राप्त होती है। इस प्रकार प्राप्त बृहद् अणु बहुलक कहलाते हैं। इस अभिक्रिया को ‘बहुलकीकरण’ या ‘बहुलकन’ कहते हैं। सरल यौगिक, जिनसे बहुलक प्राप्त होते हैं, एकलक कहलाते हैं।

अन्य एल्कीन भी बहुलकीकरण अभिक्रिया प्रदर्शित करती हैं।
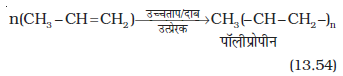
बहुलकों का उपयोग प्लास्टिक के थैले, निष्पीडित बोतल, रेफ्रिजरेटर डिश, खिलौने, पाइप, रेडियो तथा टी.वी. कैबिनेट आदि के निर्माण में किया जाता है। पॉलिप्रोपीन का उपयोग दूध के कैरेट, प्लास्टिक की बाल्टियाँ तथा अन्य संचलित (Moulded) वस्तुओं के उत्पादन के लिए किया जाता है, हालाँकि अब पॉलिथीन तथा पॉलिप्रोपीन का बृहत् उपयोग हमारे लिए एक चिंता का विषय बन गया है।
13.4 एल्काइन
एल्कीन की तरह एल्काइन भी असंतृप्त हाइड्रोकार्बन हैं। इनमें दो कार्बन परमाणुओं के मध्य एक त्रिआबंध होता है। एेल्केन तथा एल्कीन की तुलना में, एल्काइन में हाइड्रोजन परमाणुओं की संख्या कम होती है। इनका सामान्य सूत्र CnH2n-2 है। एल्काइन श्रेणी का प्रथम स्थायी सदस्य एथाइन है, जो एेसीटिलीन नाम से प्रचलित है। एेसीटिलीन का उपयोग आर्क वल्डिंग के लिए अॉक्सीएेसीटिलीन ज्वाला के रूप में होता है, जो अॉक्सीजन गैस तथा एेसीटिलीन को मिश्रित करने से बनती है। एल्काइन कई कार्बनिक यौगिकों के लिए प्रारंभिक पदार्थ है। अतः इस श्रेणी के कार्बनिक यौगिकों का अध्ययन रुचिकर है।
13.4.1 नामपद्धति तथा समावयवता
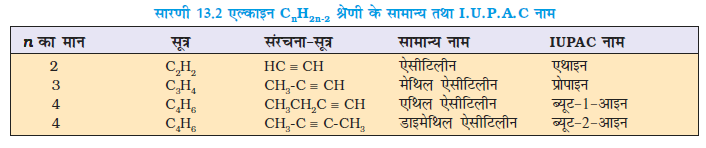
सामान्य पद्धति में एल्काइन एेसीटिलीन के व्युत्पन्न के नाम से जाने जाते हैं। आई.यू.पी.ए.सी. पद्धति में संगत एेल्केन में अनुलग्न ‘एेन’ का ‘आइन’ द्वारा प्रतिस्थापन करके एल्काइन को संगत एेल्केन के व्युत्पन्न नाम से जाना जाता है। त्रिआबंध की स्थिति प्रथम त्रि-आबंधित कार्बन से इंगित की जाती है। एल्काइन श्रेणी के कुछ सदस्यों के सामान्य तथा आई.यू.पी.ए.सी. नाम सारणी 13.2 में दिए गए हैं।
जैसा आपने पहले पढ़ा है, एथाइन तथा प्रोपाइन अणुओं की केवल एक ही संरचना होती है, किंतु ब्यूटाइन में दो संरचनाएँ संभावित हैं– (1) ब्यूट-1-आइन (2) ब्यूट-2-आइन। चूँकि दोनों यौगिक त्रि-आबंध की स्थिति के कारण संरचना में भिन्न है। अतः ये समावयव स्थिति समावयव कहलाते हैं। आप कितने प्रकार से अगले सजात की संरचना को बना सकते हैं? अर्थात् अगला एल्काइन (जिसका अणुसूत्र C5H8 है) के पाँच कार्बन परमाणुओं को सतत् शृंखला तथा पार्श्व शृंखला के रूप में व्यवस्थित करने पर निम्नलिखित संरचनाएँ संभव हैं–

संरचना-सूत्र I एवं II स्थिति समावयव तथा संरचना सूत्र I एवं III अथवा II एवं III शृंखला समावयव के उदाहरण हैं
उदाहरण 13.13
एल्काइन श्रेणी के पाँचवें सदस्य के विभिन्न समावयवों की संरचना एवं आई.यू.पी.ए.सी. नाम लिखिए। विभिन्न समावयवी युग्म किस प्रकार की समावयवता दर्शाते हैं?
हल
एल्काइन श्रेणी के पाँचवे सदस्य का अणुसूत्र C6H10 होता है इसके संभावित समवयव इस प्रकार है–
(क) HC ≡ C – CH2 – CH2 – CH2 – CH3
हेक्स-1-आइन
(ख) CH3 – C ≡ C – CH2 – CH2 – CH3
हेक्स-2-आइन
(ग) CH3 – CH2 – C ≡ C – CH2– CH3
हेक्स-3-आइन
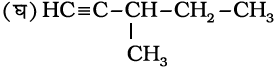
3-मेथिलपेन्ट-1-आइन
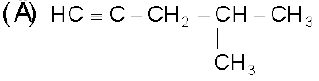
4-मेथिलपेन्ट-1-आइन
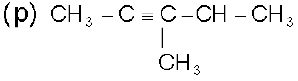
4-मेथिलपेन्ट-2-आइन
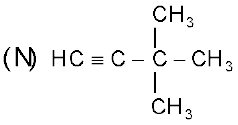
3, 3-डाइमेथिलब्यूट-1-आइन
उपरोक्त समावयव- शृंखला समावयवता एवं स्थिति समावयवता के उदाहरण हैं।
13.4.2 त्रि-आबंध की संरचना
एथाइन, एल्काइन श्रेणी का सरलतम अणु है। एथाइन की संरचना चित्र 13.6 में दर्शायी गई है।
एथाइन के प्रत्येक कार्बन परमाणु के साथ दो sp संकरित कक्षकों के समअक्षीय अतिव्यापन से कार्बन-कार्बन सिग्माआबंध बनता है। प्रत्येक कार्बन परमाणु का शेष sp संकरित कक्षक अंतरनाभिकीय अक्ष के सापेक्ष हाइड्रोजन परमाणु के 1s कक्षक के साथ अतिव्यापन करके, दो C-H सिग्मा आबंध बनाते हैं,
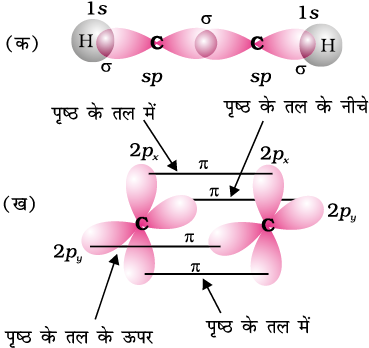
H-C-C आबंध कोण 180° का होता है। प्रत्येक कार्बन परमाणु के पास C-C आबंध तथा तल के लंबवत् असंकरित p-कक्षक होते हैं। एक कार्बन परमाणु का 2p कक्षक दूसरे के समांतर होता है, जो समपार्श्विक अतिव्यापन करके दो कार्बन परमाणुओं के मध्य दो (पाई) बंध बनाते हैं। अतः एथाइन अणु में एक C-C (सिग्मा) आबंध दो C-H सिग्मा आबंध तथा दो C-C (पाई) आबंध होते हैं।
C≡C की आबंध सामर्थ्य बंध एंथैल्पी 823 kJ mol-1 है, जो C=C द्विआबंध बंध एेंथैल्पी 681 kJ mol-1 और C-C एकल आबंध बंध एंथैल्पी 348 kJ mol-1 अधिक होती है। C≡C की त्रिआबंध लंबाई (120pm), C=C द्विआबंध (134 pm) तथा C-C एकल आबंध (154 pm)
तुलना में छोटी होती है। अक्षों पर दो कार्बन परमाणुओं के मध्य इलेक्ट्रॉन अभ्र अंतरानाभिकीय सममित बेलनाकार स्थिति में होते हैं। एथाइन एक रेखीय अणु है।
13.4.3 विरचन
1. कैल्सियम कार्बाइड से–
जल के साथ कैल्सियम कार्बाइड की अभिक्रिया पर औद्योगिक रूप से एथाइन बनाई जाती है। कोक तथा बिना बुझे चूने को गरम करके कैल्सियम कार्बाइड बनाया जाता है। चूना पत्थर से निम्नलिखित अभिक्रिया द्वारा बिना बुझा चूना प्राप्त होता है–

2. सन्निध डाइहैलाइडों से–
सन्निध डाइहैलाइडों की अभिक्रिया एेल्कोहॉली पोटैशियम हाइड्रॉक्साइड से कराने पर इनका विहाइड्रोहैलोजनीकरण होता है। हाइड्रोजन हैलाइड के एक अणु विलोपित करने से एेल्किनाइल हैलाइड प्राप्त होता है, जो सोडामाइड के साथ उपचार कराने पर एल्काइन देते हैं।
13.4.4 गुणधर्म
भौतिक गुणधर्म
एल्काइनों के भौतिक गुण, एल्कीनों तथा एेल्केनों के समान होते हैं। प्रथम तीन सदस्य गैस, अगले आठ सदस्य द्रव तथा शेष उच्चतर सदस्य ठोस होते हैं। समस्त एल्काइन रंगहीन होते हैं। एथाइन की आभिलाक्षणिक गंध होती है। इसके अन्य सदस्य गंधहीन होते हैं। एल्काइन दुर्बल ध्रुवीय, जल से हलके तथा जल में अमिश्रणीय होते हैं, परंतु कार्बनिक विलायकों जैसे–ईथर, कार्बनटेट्राक्लोराइड और बेन्जीन में विलेय होते हैं। इनके गलनांक, क्वथनांक तथा घनत्व अणुभार के साथ बढ़ते हैं।
रासायनिक गुणधर्म
एल्काइन सामान्यतया अम्लीय प्रकृति, योगात्मक तथा बहुलकीकरण अभिक्रियाएँ प्रदर्शित करती है, वे इस प्रकार हैं–
(क) एल्काइन का अम्लीय गुण– सोडियम धातु या सोडामाइड (NaNH2) प्रबल क्षारक होते हैं। ये एथाइन के साथ अभिक्रिया करके डाइहाइड्रोजन मुक्त कर सोडियम एेसीटिलाइड बनाते हैं। इस प्रकार की अभिक्रयाएँ एथीन तथा एथेन प्रदर्शित नहीं करते। यह परीक्षण एथीन तथा एेथेन की तुलना में एथाइन की अम्लीय प्रकृति को इंगित करता है। एेसा क्यों है? क्या इसकी संरचना तथा संकरण के कारण होता है? आप यह अध्ययन कर चुके हैं कि एथाइन में हाइड्रोजन परमाणु sp संकरित कार्बन परमाणु से, एथीन में sp2 संकरित कार्बन परमाणु से तथा एथेन में sp3 संकरित कार्बन परमाणु से जुड़ा रहता है। एथाइन के sp संकरित कक्षक में अधिकतम S गुण (50%) के कारण उसमें उच्च विद्युत्ऋणात्मकता होती है। अतः ये एथाइन में C-H आबंध के साझा इलेक्ट्रॉनों को, एथीन में कार्बन के sp2 संकरित कक्षक तथा एथेन में कार्बन के sp3 संकरित कक्षकों की तुलना में अपनी ओर अधिक आकर्षित करेंगे, जिससे एथेन तथा एथीन की तुलना में एथाइन में हाइड्रोजन परमाणु प्रोटॉन के रूप में आसानी से विलोपित हो जाएँगे। अतः त्रिआबंधित कार्बन परमाणु से जुड़े हाइड्रोजन परमाणु अम्लीय प्रकृति के होते हैं।

यह ध्यान रखने योग्य बात है कि त्रिआबंध से जुड़े हाइड्रोजन परमाणु अम्लीय होते हैं, परंतु एल्काइन के समस्त हाइड्रोजन परमाणु अम्लीय नहीं होते। उपर्युक्त अभिक्रियाएँ एल्कीन तथा एेल्केन प्रदर्शित नहीं करते हैं। यह परीक्षण एल्काइन, एल्कीन तथा एेल्केन में विभेद करने हेतु प्रयुक्त किया जाता है। ब्यूट-1-आइन तथा ब्यूट-2-आइन की उपरोक्त अभिक्रिया कराने पर क्या होगा? एेल्केन, एल्कीन तथा एल्काइन निम्नलिखित क्रम में अम्लीय प्रकृति दर्शाते हैं–
(i) 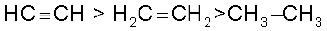
(ii) 
(ख) योगज अभिक्रिया– एल्काइनों में त्रिआबंध होता है। अतः यह डाइहाइड्रोजन, हैलोजन, हाइड्रोजन हैलाइड आदि के दो अणुओं से योग करते हैं। योगज उत्पाद निम्नलिखित पदों में बनता है–
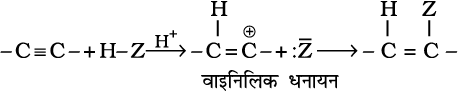
बना हुआ योगज उत्पाद सामान्यतया वाइनिलिक धनायन के स्थायित्व पर निर्भर करता है। असममित एल्काइनों में योगज मार्कोनीकॉफ नियम के अनुसार होता है। एल्काइनों में अधिकतर अभिक्रियाएं इलेक्ट्रॉनस्नेही योगज अभिक्रियाएं हैं, जिनके कुछ उदाहरण दिए जा रहे हैं–
(i) डाइहाइड्रोजन का संयोजन
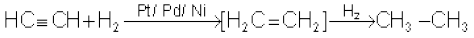
(13.62)
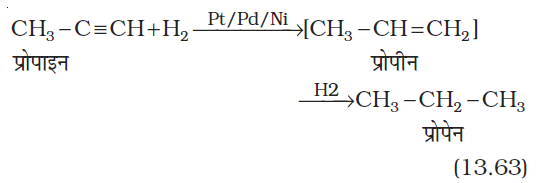
(ii) हैलोजनों का संयोजन
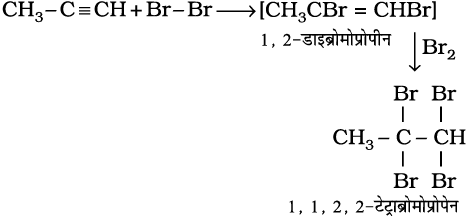
(13.64)
इस संकलन पर ब्रोमीन का लाल-नारंगी रंग विरंजीकृत हो जाता है। अतः इसे असंतृप्तता के परीक्षण के लिए प्रयुक्त किया जाता है।
(iii) हाइड्रोजन हैलाइडो का संयोजन– एल्काइनों में हाइड्रोजन हैलाइड (HCl, HBr, HI) के दो अणु के संकलन से जैम डाइहैलाइड (जिनमें एक ही कार्बन परमाणु पर दो हैलोजन जुड़े हों) बनते हैं।

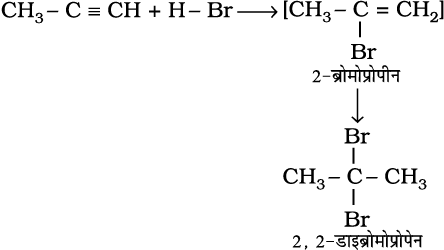
(13.66)
(iv) जल का संयोजन– एेल्केन तथा एल्कीन की भाँति एल्काइन भी जल में अमिश्रणीय होते हैं और जल से अभिक्रिया नहीं करते हैं। एल्काइन 333K पर मर्क्यूरिक सल्फेट तथा तुन सल्फ्यूरिक अम्ल की उपस्थिति में जल के एक अणु के साथ संयुक्त होकर कार्बोनिल यौगिक देते हैं।
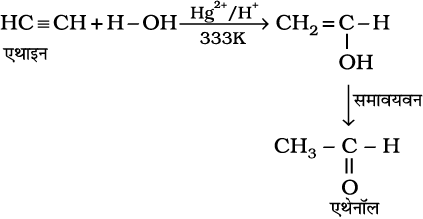
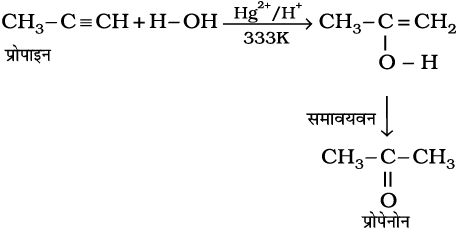
(13.67)
(13.68)
(v) बहुलकीकरण
(क) रैखिक बहुलकीकरण– अनुकूल परिस्थितियों में एथाइन का रैखिक बहुलकीकरण होने से पॉलिएेसीटिलीन अथवा पॉलिएथाइन बनता है, जो उच्चतर अणुभार वाले पॉलिएथाइन इकाइयों 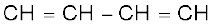 से युक्त होता है। इसे
से युक्त होता है। इसे 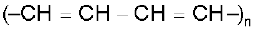 प्रदर्शित किया जा सकता है। विशिष्ट परिस्थितियों में ये बहुलक विद्युत् के सुचालक होते हैं। अतः पॉलिएेसीटिलीन की इस फिल्म का उपयोग बैटरियों में इलेक्ट्रॉड के रूप में किया जाता है। धातु चालकों की अपेक्षा यह फिल्म हलकी, सस्ती तथा सुचालक होती है।
प्रदर्शित किया जा सकता है। विशिष्ट परिस्थितियों में ये बहुलक विद्युत् के सुचालक होते हैं। अतः पॉलिएेसीटिलीन की इस फिल्म का उपयोग बैटरियों में इलेक्ट्रॉड के रूप में किया जाता है। धातु चालकों की अपेक्षा यह फिल्म हलकी, सस्ती तथा सुचालक होती है।
(ख) चक्रीय बहुलकीकरण– एथाइन को लाल तप्त लोह नलिका में 873K पर प्रवाहित कराने पर उसका चक्रीय बहुलकीकरण हो जाता है। एथाइन के तीन अणु बहुलकीकृत होकर बेन्जीन बनाते हैं, जो बेन्जीनव्युत्पन्न, रंजक, औषधि तथा अनेक कार्बनिक यौगिकों के प्रारंभिक अणु है। यह एेलीफैटिक यौगिकों को एेरोमैटिक यौगिकों में परिवर्तित करने के लिए सर्वोत्तम पथ है।
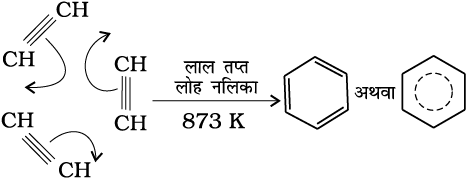 (13.69)
(13.69)
उदाहरण 13.14
आप एथेनोइक अम्ल को बेन्जीन में कैसे परिवर्तित करेंगे?
हल
13.5 एेरोमैटिक हाइड्रोकार्बन
एेरोमैटिक हाइड्रोकार्बन को एेरीन भी कहते हैं, क्योंकि इनके अधिकांश यौगिकों में विशिष्ट गंध (ग्रीक शब्द ‘एेरोमा’, जिसका अर्थ सुगंध होता है।) रहती है। एेसे यौगिकों को ‘एेरौमेटिक यौगिक’ नाम दिया गया है। अधिकतर एेसे यौगिकों में बेन्जीनवलय पाई जाती है। यद्यपि बेन्जीनवलय अतिअसंतृप्त होती है, परंतु अधिकतर अभिक्रियाओं में बेन्जीनवलय अति असंतृप्त बनी रहती है। एेरोमैटिक यौगिकों के कई उदाहरण एेसे भी हैं, जिनमें बेन्जीनवलय नहीं होती है, किंतु उनमें अन्य अतिअसंतृप्त वलय होती है। जिन एेरोमेटिक यौगिकों में बेन्जीनवलय होती है, उन्हें बेन्जेनाइड (Benzenoid) तथा जिसमें बेन्जीनवलय नहीं होती है, उन्हें अबेन्जेनाइड (nonbezenoid) कहते है। एेरीन के कुछ उदाहरण नीचे दिए गए हैं–
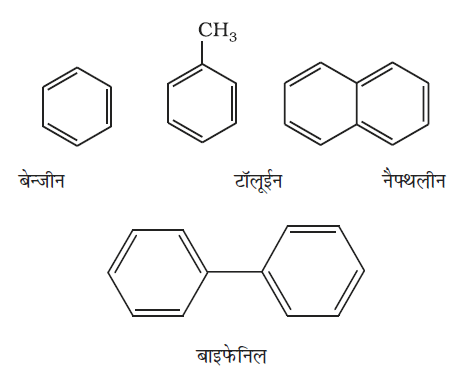
13.5.1 नाम पद्धति तथा समावयवता
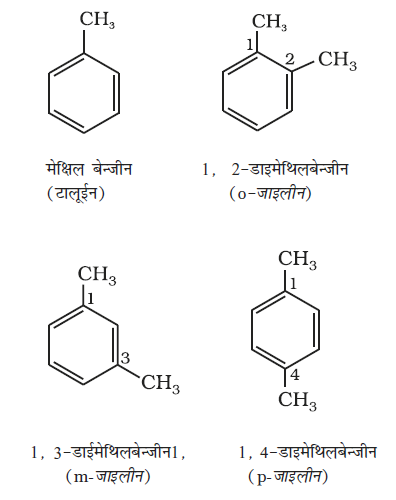
हम एेरामैटिक यौगिकों की नाम पद्धति तथा समावयवता का वर्णन एकक 12 में कर चुके हैं। बेन्जीन के सभी छः हाइड्रोजन परमाणु समतुल्य हैं। अतः ये एक प्रकार का एकल प्रतिस्थापित उत्पाद बनाती हैं। यदि बेन्जीन के दो हाइड्रोजन परमाणु दो समान या भिन्न एक संयोजी परमाणु या समूह द्वारा प्रतिस्थापित हों, तो तीन विभिन्न स्थिति समावयव संभव हैं। ये 1, 2 अथवा 1, 6 आर्थो (o–); 1, 3 अथवा 1, 5 मेटा (m-) तथा 1, 4 पैरा (p-) हैं। द्विप्रतिस्थापित बेन्जीन व्युत्पन्न के कुछ उदाहरण यहाँ दिए जा रहे हैं।
13.5.2 बेन्जीन की संरचना
बेन्जीन को सर्वप्रथम माइकेल फैराडे ने सन् 1825 में प्राप्त किया। बेन्जीन का अणुसूत्र C6H6 है, जो उच्च असंतृप्तता दर्शाता है। यह अणुसूत्र संगत एेल्केन, एल्कीन तथा एल्काइन, से कोई संबंध नहीं बताता है। आप इसकी संभावित संरचना के बारे में क्या सोचते हैं? इसके विशिष्ट गुण तथा असामान्य स्थायित्व के कारण इसकी संरचना निर्धारित करने में कई वर्ष लग गए। बेन्जीन एक स्थायी अणु है और ट्राईओजोनाइड बनाता है, जो तीन द्विआबंध की उपस्थिति को इंगित करता है। बेन्जीन केवल एक प्रकार का एकल प्रतिस्थापित व्युत्पन्न बनाता है, जो बेन्जीन के छः कार्बन तथा छः हाइड्रोजन की समानता को इंगित करती है। इन प्रेक्षणों के आधार पर आगुस्ट् केकुले ने सन् 1865 में बेन्जीन की एक संरचना दी, जिसमें छः कार्बन परमाणु की चक्रीय व्यवस्था है। उसमें एकांतर क्रम में द्विआबंध है तथा प्रत्येक कार्बन से एक हाइड्रोजन परमाणु जुड़ा है।
जर्मन रसायनज्ञ फ्रीड्रिक आगुस्ट् केकुले का जन्म सन् 1829 में जर्मनी के डार्मस्ड्ट नामक नगर में हुआ था। वे सन् 1856 में प्रोफेसर तथा सन् 1875 में रॉयल सोसायटी के फैलो बने। संरचनात्मक कार्बनिक रसायन के क्षेत्र में उन्होंने दो महत्त्वपूर्ण योगदान दिए। प्रथम सन् 1958 में जब उन्होंने यह प्रस्तावित किया कि अनेक कार्बन परमाणु आपस में आबंध बनाकर शृंखलाओं का निर्माण कर सकते हैं। द्वितीय उन्होंने सन् 1875 में बेन्जीन की संरचना को स्पष्ट करने में योगदान दिया, जब उन्होंने प्रस्तावित किया कि कार्बन परमाणुओं की शृंखलाओं के सिरे जुड़कर वलय का निर्माण कर सकते हैं। तत्पश्चात् उन्होंने बेन्जीन की गतिक संरचना प्रस्तावित की, जिस पर बेन्जीन की आधुनिक इलेक्ट्रॉनीय संरचना आधारित है। बाद में उन्होंने बेन्जीन संरचना की खोज को एक रोचक घटना द्वारा समझाया।

फ्रीड्रिक आगुस्ट् केकुले
"मैं पाठ्यपुस्तक लिख रहा था, परंतु कार्य आगे नहीं बढ़ रहा था क्योंकि, मेरे विचार कहीं अन्य थे। तभी मैंने अपनी कुर्सी को अलाव की ओर किया। कुछ समय बाद मुझे झपकी लग गईं। स्वप्न में मेरी आँखों के सामने परमाणु नाच रहे थे। अनेक प्रकार के विन्यासों की संरचनाएं मेरी मस्तिष्क की आँख के सम्मुख घूम रही थी। मैं स्पष्ट रूप से लंबी-लंबी कतारें देख पा रहा था, जो कभी-कभी समीप आ रही थीं, वे सर्प की भाँति घूम रही थीं, कुंडली बना रही थीं। तभी मैं देखा कि एक सर्प ने अपनी ही दुम को अपने मुँह में दबा लिया। इस प्रकार बनी संरचना को मैं स्पष्ट रूप से देख पा रहा था। तभी अचानक मेरी आँखें खुल गई तथा रात्रि का शेष पहर मैंने अपने सपने को समझकर उपयुक्त निष्कर्ष निकालने में व्यतीत किया।
वे आगे कहते हैं कि– सज्जनो! हमें स्वप्न देखने की आदत डालनी चाहिए, तभी हम सत्य से साक्षात्कार कर सकते हैं। परंतु हमें अपने स्वप्नों को, इससे पहले कि हम उन्हें भूल जाएं, अन्य को बता देना चाहिए" (सन् 1890)।
सौ वर्ष के बाद, केकुले की जन्म शताब्दी समारोह के अवसर पर पॉलिबेंजिनायड संरचना युग्म यौगिकों के एक वर्ग को ‘केकुलीन’ नाम दिया गया।
केकुले संरचना 1, 2-डाइब्रोमो बेन्जीन के दो समावयवों की संभावना व्यक्त करती है। एक समावयव में दोनों ब्रोमीन परमाणु द्विआबंधित कार्बन परमाणुओं से जुड़े रहते हैं, जबकि दूसरे समावयव में एकल आबंधित कार्बन परमाणुओं से।
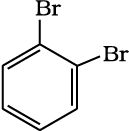
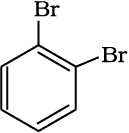
परंतु बेन्जीन केवल एक ही अॉर्थो द्विप्रतिस्थापित उत्पाद बनाती है। इस समस्या का निराकरण केकुले ने बेन्जीन में द्विआबंध के दोलन (Oscillating) प्रकृति पर विचार करके प्रस्तावित किया।
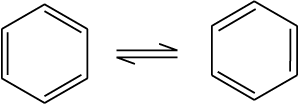
यह सुधार भी बेन्जीन की संरचना के असामान्य स्थायित्व तथा योगात्मक अभिक्रियाओं की तुलना में प्रतिस्थापन अभिक्रियाओं की प्राथमिकता को समझाने में विफल रहा, जिसे बाद में अनुनाद (Resonance) द्वारा समझाया गया।
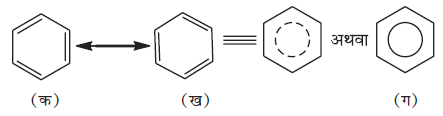
अनुनाद एवं बेन्जीन का स्थायित्व
‘संयोजकता बंध सिद्धांत’ के अनुसार, द्विआबंध के दोलन को अनुनाद के द्वारा समझाया गया है। बेन्जीन विभिन्न अनुनादी संरचनाओं का संकर है। केकुले द्वारा दो मुख्य संरचनाएं (क) एवं (ख) दी गईं, अनुनाद संकर को षट्भुजीय संरचना में वृत्त या बिंदु वृत्त द्वारा (ग) में प्रदर्शित किया गया है। वृत्त, बेन्जीनवलय के छः कार्बन परमाणु पर विस्थानीकृत (Delocalised) छः इलेक्ट्रानों को दर्शाता है।
कक्षीय अतिव्यापन हमें बेन्जीन संरचना के बारे में सही दृश्य देता है। बेन्जीन में सभी छः कार्बन परमाणु sp2 संकरित है। प्रत्येक कार्बन परमाणु के दो sp2 कक्षक निकटवर्ती कार्बन परमाणुओं के sp2 कक्षक से अतिव्यापन करके छः (C-C) σ आबंध बनाते हैं, जो समतलीय षट्भुजीय होते हैं। प्रत्येक कार्बन परमाणु के बचे हुए sp2 कक्षक प्रत्येक हाइड्रोजन परमाणु के s-कक्षक से अतिव्यापन करके छः C-H सिग्मा आबंध बनाते हैं। अब प्रत्येक कार्बन परमाणु पर एक असंकरित p-कक्षक रह जाता है, जो वलय के तल के लंबवत् होता है, जैसा नीचे दर्शाया गया है–
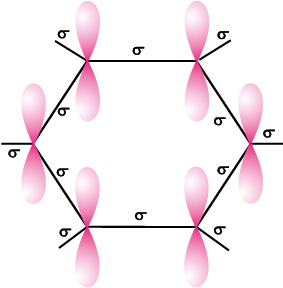
प्रत्येक कार्बन परमाणु पर उपस्थित असंकरित p-कक्षक इतने निकट होते हैं कि वे पार्श्वअतिव्यापन करके आबंध का निर्माण करते हैं। p-कक्षकों के अतिव्यापन से तीन आबंध बनने की क्रमशः दो संभावनाएँ (C1-C2, C3-C4, C5-C6 अथवा C2-C3, C4-C5, C6-C1) हैं, जैसा नीचे दिए गए चित्रों में दर्शाया गया है। संरचना 13.6 (क) तथा (ख) केकुले की विस्थानीकृत आबंधयुक्त संरचना दर्शाता है।
चित्र 13.7 (क) तथा (ख) केकुले की दोनों संरचनाओं के संगत है जिसमें स्थानीकृत π-बंध होते हैं। X-किरण
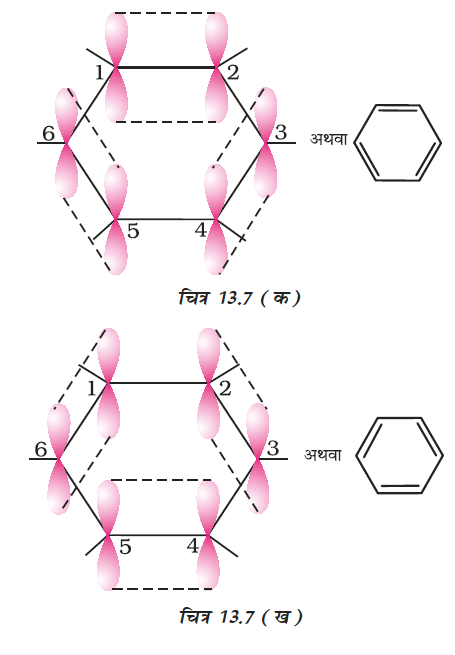

विवर्तन से ज्ञात की गई वलय में कार्बन परमाणुओं के मध्य अन्तर्नाभिकीय दूरी समान पाई गईं प्रत्येक कार्बन परमाणु के p-कक्षक की दोनों तरफ साथ वाले कार्बन परमाणु के p-कक्षक से अतिव्यापन की संभावना समान है [चित्र 13.7 (ग)]। इस इलेक्ट्रॉन अभ्र को चित्र 13.7 (घ) के अनुसार षट्भुजीय वलय के एक ऊपर तथा एक नीचे स्थित माना जा सकता है।
इस प्रकार कार्बन के छः p इलेक्ट्रॉन विस्थानीकृत होकर छः कार्बन नाभिकों के परितः स्वच्छंद रूप से घूम सकेंगे, न कि वे केवल दो कार्बन नाभिकों के मध्य, जैसा चित्र 13.7 (क) एवं (ख) में दर्शाया गया है। विस्थानीकृत इलेक्ट्रॉन अभ्र दो कार्बन परमाणु के मध्य स्थित इलेक्ट्रान अभ्र की बजाय वलय के सभी कार्बन परमाणुओं के नाभिक द्वारा अधिक आकर्षित होगा। अतः विस्थानीकृत इलेक्ट्रॉन की उपस्थिति में बेन्जीन वलय परिकल्पित साइक्लोहैक्साट्राइन की तुलना में अधिक स्थायी है।
X-किरण विर्वतन आँकड़े बेन्जीनके समतलीय अणु को दर्शाते हैं। बेन्जीन की उपरोक्त संरचना (क) तथा (ख) सही होतीं तो दोनों प्रकारों में C-C आबंध लंबाई की अपेक्षा की जाती, जबकि X-किरण आँकड़ों के अध्ययन के आधार पर छः समान C-C आबंध लंबाई (139pm) पाई गई, जो C-C एकल आबंध (154pm) तथा C-C द्विआबंध (134pm) के मध्य हैं। अतः सामान्य परिस्थितियों में बेन्जीन पर शुद्ध द्विआबंध की अनुपस्थिति बेन्जीन पर योगज अभिक्रिया होने से रोकती है। यह बेन्जीन के असाधारण व्यवहार को स्पष्ट करती है।
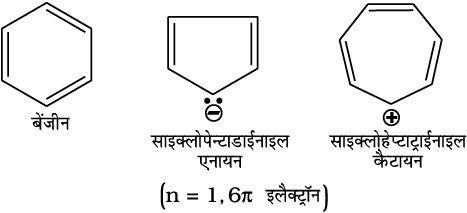
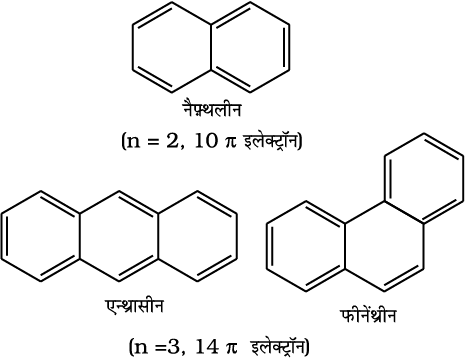
13.5.3 एेरोमैटिकता
बेन्जीन को जनक एेरोमैटिक यैगिक मानते हैं। अब ‘एेरोमैटिक’ नाम सभी वलय तंत्रों, चाहे उसमें बेन्जीन वलय हो या नहीं, में प्रयोग में लाया जाता है। ये निम्नलिखित गुण दर्शाते हैं–
(i) समतलीयता।
(ii) वलय में इलेक्ट्रॉन का संपूर्ण विस्थानीकरण।
(iii) वलय में (4n + 2)π इलेक्ट्रॉन, जहाँ n एक पूर्णांक है (n = 0,1,2,...)। इसे हकल नियम (Hückel Rule) द्वारा भी उल्लेखित करते हैं।
एेरोमैटिक यौगिकों के कुछ उदाहरण इस प्रकार हैं–
13.5.4 बेन्जीन का विरचन
बेन्जीन को व्यापरिक रूप में कोलतार से प्राप्त किया जाता है, यद्यपि इसे निम्नलिखित प्रयोगशाला विधियों द्वारा बना सकते हैं–
(i) एथाइन के चक्रीय बहुलकीकरण से (देखिए अनुभाग 13.4)
(ii) एरोमैटिक अम्लों के विकार्बोक्सिलीकरण से– बेन्जोइक अम्ल के सोडियम लवण को सोडालाइम के साथ गरम करने पर बेन्जीन प्राप्त होती है।

(13.70)
(iii) फीनॉल के अपचयन से– फीनॉल की वाष्प को जस्ता के चूर्ण पर प्रवाहित करने से यह बेन्जीन में अपचयित हो जाती है।
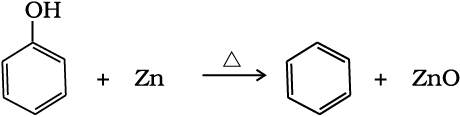 (13.71)
(13.71)
13.5.5 गुणधर्म
भौतिक गुणधर्म
भौतिक गुणधर्म एेरोमैटिक हाइड्रोकार्बन अध्रुवीय अणु हैं। ये सामान्यतः विशिष्ट गंधयुक्त, रंगहीन द्रव या ठोस होते हैं। आप नैफ़्थलीन की गोलियों से चिरपरिचित हैं। इसकी विशिष्ट गंध तथा शलभ प्रतिकर्षी गुणधर्म के कारण इसे शौचालय में तथा कपड़ों को सुरक्षित रखने के लिए उपयोग में लाते हैं। एेरोमैटिक हाइड्रोकार्बन जल में अमिश्रणीय तथा कार्बनिक विलायाकों में विलेय है। ये कज्जली (Sooty) लौ के साथ जलते हैं।
रासायनिक गुणधर्म
रासायनिक गुणधर्म एेरीनो को इलेक्ट्रॉनस्नेही प्रतिस्थापन द्वारा अभिलक्षित किया जाता है, हालाँकि विशेष परिस्थितियों में ये संकलन तथा अॉक्सीकरण अभिक्रिया दर्शाते हैं।
इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएँ
साधारणतया एेरीन नाइट्रोकरण, हैलोजनन, सल्फोनेशन, फ्रीडेल क्राफ्ट एेल्किलन, एेसीटिलन आदि इलेक्ट्रानरागी प्रतिस्थापन अभिक्रिया दर्शाते हैं, जिनमें इलेक्ट्रॉनरागी एक आक्रमणकारी अभिकर्मक E+ है।
(i) नाइट्रोकरण– यदि बेन्जीन वलय को सान्द्र नाइट्रिक अम्ल तथा सल्फ्यूरिक अम्ल (नाइट्रोकरण मिश्रण) के साथ गरम किया जाता है तो बेन्जीन वलय में नाइट्रो समूह प्रविष्ट हो जाता है।
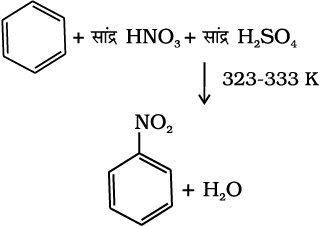
(13.72)
(ii) हैलोजनीकरण या हैलोजनन– लुइस अम्ल (जैसे–FeCl3, FeBr3 तथा AlCl3) की उपस्थिति में एेरीन, हैलोजन से अभिक्रिया कर हैलोएेरीन देते हैं।
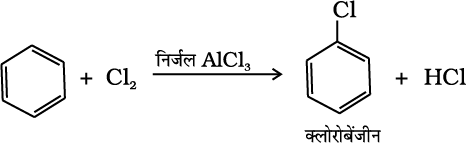
(13.73)
(iii) सल्फोनीकरण– सल्फोनिक अम्ल समूह द्वारा वलय के हाइड्रोजन परमाणु का प्रतिस्थापन सल्फोनीकरण या सल्फोनेशन कहलाता है। यह सांद्र सल्फ्यूरिक अम्ल के साथ गरम करके प्राप्त किया जाता है।
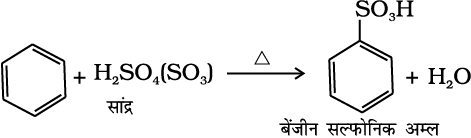 (13.74)
(13.74)
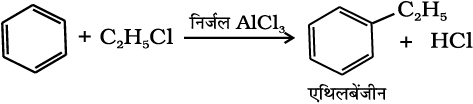
(iv) फ्रीडेल-क्राफ्ट एेल्किलीकरण या एेल्किलन– निर्जल AlCl3 की उपस्थिति में बेन्जीन की एेल्किल हैलाइड से अभिक्रिया कराने पर एेल्किल बेन्जीन प्राप्त होती है।
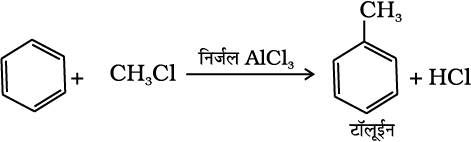
(13.75)
 (13.76)
(13.76)
1-क्लोरोप्रोपेन की बेन्जीन से अभिक्रिया कराने पर n-प्रोपिल बेन्जीन की अपेक्षा आइसोप्रोपिल बेन्जीन क्यों प्राप्त होती हैं?
(v) फ्रीडेल-क्राफ्ट एेसिलीकरण या एेसीटिलन– लुइस अम्ल (AlCl3) की उपस्थिति में बेन्जीन की एेसिल हैलाइड अथवा एेसिड एेनहाइड्राइड के साथ अभिक्रिया करने पर एेसिल बेन्जीन प्राप्त होती है।
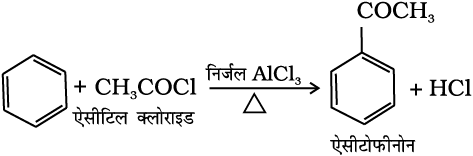
(13.77)
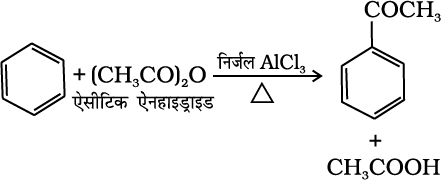
(13.78)
अगर इलेक्ट्रॉनस्नेही अभिकर्मक को आधिक्य में लिया जाए तो पुनः प्रतिस्थापन अभिक्रिया होगी जिसमें इलेक्ट्रानस्नेही द्वारा बेन्जीन के दूसरे हाइड्रोजन उत्तरोतर प्रतिस्थापित होंगे। उदाहरणस्वरूप, बेन्जीन की क्लोरीन की आधिक्य मात्रा के साथ एवं निर्जल AlCl3 की उपस्थिति में अभिक्रिया कराने पर हैक्साक्लोरोबेन्जीन (C6Cl6) प्राप्त की जा सकती है।
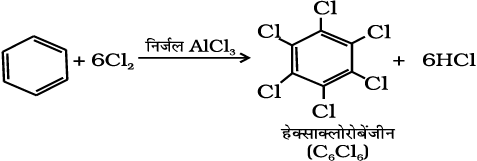
(13.79)
इलेक्ट्रानस्नेही (इलेक्ट्रॉनरागी) प्रतिस्थापन की क्रियाविधि
प्रायोगिक तथ्यों के आधार पर SE (S =प्रतिस्थापन E = इलेक्ट्रॉनस्नेही ) अभिक्रियाएं निम्नलिखित पदों द्वारा सम्पन्न होती हैं।
(क) इलेक्ट्रॉनस्नेही की उत्पत्ति
(ख) कार्बधनायन का बनना
(ग) मध्यवर्ती कार्बधनायन से प्रोटॉन का विलोपन
(क) इलेक्ट्रॉनस्नेही E+ की उत्पत्ति– बेन्जीन के क्लोरीनन, एेल्किलन तथा एेसिलन में निर्जल AlCl3, जो लूइस अम्ल है, आक्रमणकारी अभिकर्मक के साथ संयुक्त होकर क्रमशः Cl⊕, R⊕, RC⊕O (एेसीलियम आयन) देता है।
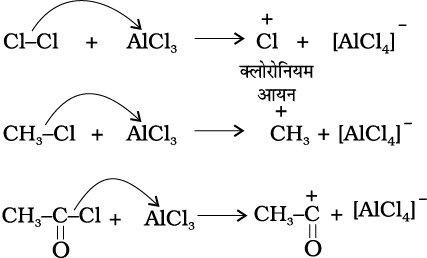
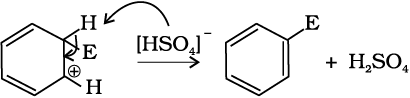
नाइट्रोकरण के संदर्भ में सल्फ्यूरिक अम्ल से नाइट्रिक अम्ल को प्रोटॉन के स्थानांतरण पर इलेक्ट्रॉनस्नेही नाइट्रोनियम आयन 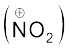 इस प्रकार बनता है–
इस प्रकार बनता है–
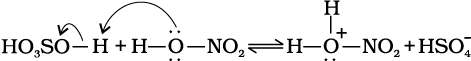
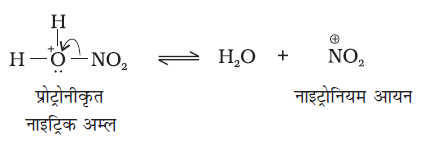
यह रोचक तथ्य है कि नाइट्रोनियम आयन की उत्पत्ति की प्रक्रिया में सल्फ्यूरिक अम्ल, अम्ल की भाँति तथा नाइट्रिक अम्ल, क्षारक की भाँति कार्य करता है। अतः यह साधारण अम्ल-क्षारक साम्य है।
(ख) कार्बधनायन (एेरीनोनियम आयन) का बनना
इलेक्ट्रॉनस्नेही के आक्रमण से σ संकर या एेरीनोनियम आयन बनता है, जिसमें एक कार्बन sp3 संकरित अवस्था में होता है।
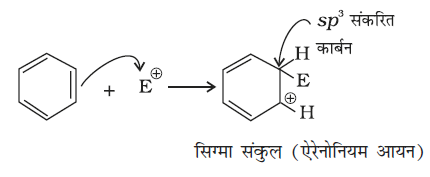
एेरीनोनियम आयन निम्नलिखित प्रकार से अनुनाद द्वारा स्थायित्व प्राप्त करता है–
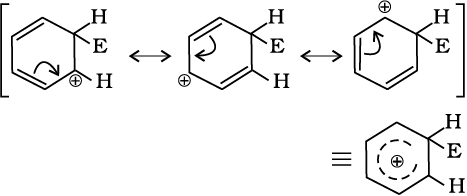
सिग्मा संकुल या एेरीनोनियम आयन के sp3 संकरित कार्बन परमाणु पर इलेक्ट्रॉन का विस्थानीकरण रुक जाता है, जिसके कारण यह एेरोमैटिक गुण खो देता है।
(ग) प्रोटॉन का विलोपन– एेरोमैटिक गुण को पुनः स्थापित करने के लिए σ संकुल sp3 संकरित कार्बन पर AlCl–4 (हैलोजनन, एेल्किलन तथा एेसिलन के संदर्भ में) अथवा HSO–4 (नाइट्रोकरण के संदर्भ में) के आक्रमण द्वारा प्रोटॉन का विलोपन करता है।
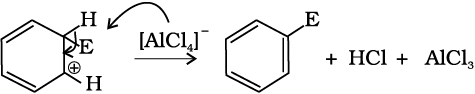
योगज अभिक्रियाएं
प्रबल परिस्थितियों जैसे–उच्च ताप एवं दाब पर निकैल उत्प्रेरक की उपस्थिति में बेन्जीन हाइड्रोजनीकरण यानी हाइड्रोजनन द्वारा साइक्लोहेक्सेन बनाती है।
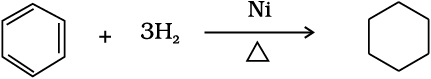 साइक्लोहेक्सेन
साइक्लोहेक्सेन
(13.80)
पराबैंगनी प्रकाश की उपस्थिति में तीन क्लोरीन अणु बेन्जीन वलय पर संयोजित होकर बेन्जीनहैक्साक्लोराइड C6H6Cl6 बनाते हैं, जिसे गैमेक्सीन भी कहते हैं।
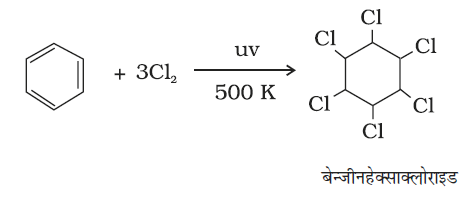
(13.81)
दहन– बेन्जीन को वायु की उपस्थिति में गरम करने पर कज्जली लौ के साथ CO2 एवं H2O बनती है।
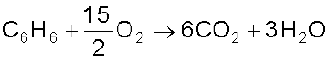 (13.82)
(13.82)
किसी हाइड्रोकार्बन की सामान्य दहन अभिक्रिया को निम्नलिखित रासायनिक अभिक्रिया द्वारा प्रदर्शित किया
जाता है–
CxHy + (x + 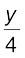 ) O2 → x CO2 +
) O2 → x CO2 + 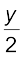 H2O (13.83)
H2O (13.83)
13.5.6 एकल प्रतिस्थापित बेन्जीन में क्रियात्मक समूह का निर्देशात्मक प्रभाव
यदि एकल प्रतिस्थापित बेन्जीन का पुनः प्रतिस्थापन कराया जाए तो तीनों संभावित द्विप्रतिस्थापित उत्पाद समान मात्रा में नहीं बनते हैं। यहाँ दो प्रकार के व्यवहार देखे गए हैं– (i) अॉर्थों एवं पैरा उत्पादन या (ii) मेटा उत्पादन। यह भी देखा गया है कि यह व्यवहार पहले से उपस्थित प्रतिस्थापी की प्रकृति पर निर्भर करता है, न कि आने वाले समूह की प्रकृति पर। इसे प्रतिस्थापियों का निर्देशात्मक प्रभाव कहते हैं। समूहों की विभिन्न निर्देशात्मक प्रकृति का कारण नीचे वर्णित किया गया है–
आर्थो एवं पैरा निर्देशी समूह– वे समूह जो आने वाले समूह को अॉर्थों एवं पैरा स्थिति पर निर्दिष्ट करते हैं, उन्हें आर्थों तथा पैरा निर्देशी समूह कहते हैं। उदाहरणस्वरूप– हम फीनॉलिक समूह के निर्देशात्मक प्रभाव की व्याख्या करते हैं। फीनॉल निम्नलिखित संरचनाओं का अनुनाद संकर है–
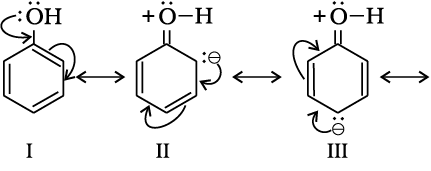
अनुनादी संरचनाओं से स्पष्ट है कि o- एवं p- स्थिति पर इलेक्ट्रॉन घनत्व अधिक है। अतः मुख्यतः इन्हीं स्थितियों पर प्रतिस्थापन होगा। यद्यपि ध्यान रखने योग्य बात यह है कि -OH समूह का -I प्रभाव भी कार्य करता है, जिससे बेन्जीन वलय की o- एवं p- स्थिति पर कुछ इलेक्ट्रॉन घनत्व घटेगा, किंतु अनुनाद के कारण इन स्थितियों पर व्यापक इलेक्ट्रॉन घनत्व बहुत कम घटेगा। अतः -OH समूह बेन्जीन वलय को इलेक्ट्रॉनस्नेही के आक्रमण के लिए सक्रिय कर देते हैं। कुछ अन्य सक्रियकारी समूह के उदाहरण– NH2, -NHR, -NHCOCH3, -OCH3,-CH3,-C2H5, हैं।
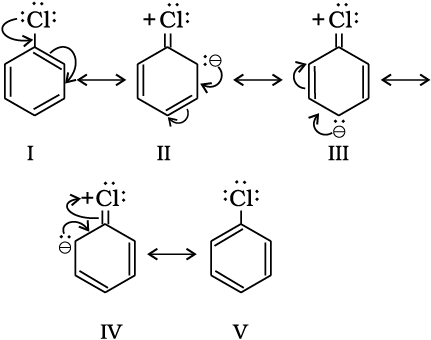
एेरिल हैलाइड में हैलोजन यद्यपि विसक्रियकारी है, परंतु प्रबल -I प्रभाव के कारण ये बेन्जीन वलय पर इलेक्ट्रॉन घनत्व कम कर देते हैं, जिससे पुनः प्रतिस्थापन कठिन हो जाता है। हालाँकि अनुनाद के कारण o- एवं p- स्थिति पर इलेक्ट्रॉन घनत्व m– स्थिति से अधिक है। अतः ये भी o- एवं p-निर्देशी समूह है।
क्लोरोबेन्जीन की अनुनादी संरचनाएँ नीचे दी गई हैं।
मेटा निर्देशी समूह– वे समूह, जो आने वाले समूह को मेटा स्थिति पर निर्दिष्ट करते हैं, उन्हें मेटा निर्देशी समूह कहते हैं। कुछ मेटा निर्देशी समूह के उदाहरण -NO2,-CN,-CHO, -COR,-COOH,-COOR,-SO3H आदि हैं। आइए, नाइट्रोसमूह का उदाहरण लेते हैं। नाइट्रो समूह प्रबल-I प्रभाव के कारण बेन्जीन वलय पर इलेक्ट्रॉन घनत्व कम कर देता है। नाइट्रोबेन्जीन निम्नलिखित संरचनाओं का अनुनाद संकर है–
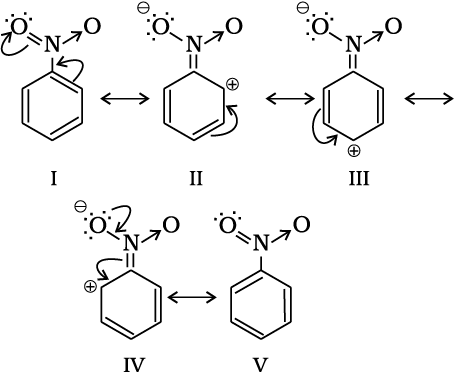
नाइट्रोबेन्जीन में बेन्जीन वलय पर व्यापक इलेक्ट्रॉन घनत्व घट जाता है, जो पुनः प्रतिस्थापन को कठिन बनाता है। अतः इन समूहों को निष्क्रियकारी समूह कहते हैं। मेटा स्थिति की तुलना में o- एवं p- स्थिति पर इलेक्ट्रॉन घनत्व कम होता है। परिणामतः इलेक्ट्रॉनस्नेही तुलनात्मक रूप में इलेक्ट्रॉनधनी स्थिति (मेटा) पर आक्रमण करता है एवं प्रतिस्थापन मेटा स्थिति पर होता है।
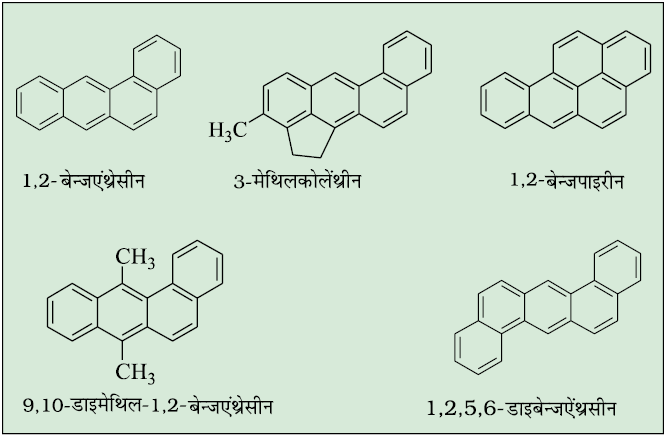
13.6 कैंसरजन्य गुण तथा विषाक्तता
बेन्जीन तथा बहुलकेंद्रकीय हाइड्रोकार्बन, जिनमें दो से अधिक जुड़ी हुई वलय हों, विषाक्त तथा कैंसर जनित (कैंसरजनी) गुण दर्शाते हैं। बहुलकेंद्रकीय हाइड्रोकार्बन, कार्बनिक पदार्थों जैसे–तंबाकू, कोल तथा पेट्रोलियम के अपूर्ण दहन से बनते हैं, जो मानव शरीर में प्रवेश कर विभिन्न जैव रासायनिक अभिक्रियाओं द्वारा डी.एन.ए. को अंततः नष्ट कर कैंसर उत्पन्न करते हैं। कुछ कैंसरजनी हाइड्रोकार्बन नीचे दिए गए हैं–
सारांश
हाइड्रोकार्बन केवल कार्बन तथा हाइड्रोजन के यौगिक होते हैं। हाइड्रोकार्बन मुख्यतः कोल तथा पेट्रोलियम से प्राप्त होते हैं, जो ऊर्जा के मुख्य स्रोत हैं। शैल रसायन (Petrochemicals) अनेक महत्त्वपूर्ण व्यावसायिक उत्पादों के निर्माण के लिए मुख्य प्रारंभिक पदार्थ हैं। घरेलू ईंधन तथा स्वचालित वाहनों के प्रमुख ऊर्जा स्रोत द्रवित पेट्रोलियम गैस, एल.पी.जी. (Liquified petroleum gas) तथा संपीडित प्राकृतिक गैस सी.एन.जी (Compressed natural gas) है, जो पेट्रोलियम से प्राप्त किए जाते हैं। संरचना के आधार पर हाइड्रोकार्बन को विवृत्त शृंखला संतृप्त (एेल्केन), असतृंप्त (एल्कीन तथा एल्काइन), चक्रीय (एेलिसाइक्लिक) तथा एेरोमैटिक वर्गों में वर्गीकृत किया गया है।
एेल्केनों की प्रमुख अभिक्रियाएं, मुक्त-मूलक प्रतिस्थापन, दहन, अॉक्सीकरण तथा एेरोमैटीकरण है। एेल्कीन तथा एेल्काइन संकलन अभिक्रियाएँ प्रदर्शित करते हैं, जो मुख्यतः इलेक्ट्रॉनस्नेही योगज अभिक्रियाएं होती हैं। एेरोमेटिक हाइड्रोकार्बन असंतृप्त
होते हुए भी इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रियाएं प्रदर्शित करते हैं। ये यौगिक विशेष परिस्थितियों में संकलन-अभिक्रियाएं प्रदर्शित करते हैं।
एेल्केन C-C (सिग्मा) आबंध के मुक्त घूर्णन के कारण संरूपणीय समावयवता (Conformational Isomerism) प्रदर्शित करते हैं। एथेन के सांतरित (Staggered) एवं ग्रस्त रूप (Eclipsed) में से सांतरित संरूपण हाइड्रोजन परमाणुओं की अधिकतम दूरी के कारण अधिक स्थायी है। कार्बन-कार्बन द्विआबंध के चारों ओर प्रतिबंधित घूर्णन के कारण एल्कीन ज्यामितीय (सिस-ट्रांस) समावयवता प्रदर्शित करती है।
बेन्जीन तथा बेन्जनाइड यौगिक एेरोमैटिकता प्रदर्शित करते हैं। यौगिकों में एेरोमैटिक होने का गुण, हकल द्वारा प्रतिपादित (4n + 2)π इलेक्ट्रॉन नियम पर आधारित है। बेन्जीनवलय से जुडे समूहों अथवा प्रतिस्थापियों की प्रकृति पुनः इलेक्ट्रानस्नेही प्रतिस्थापन हेतु वलय की सक्रियता एवं निष्क्रियता को तथा प्रवेश करने वाले समूह की स्थिति (Orientation) को प्रभावित करती है। कई बहुकेंद्रकीय हाइड्रोकार्बन (Polynuclear hydrocarbon) में बेन्जीनवलय आपस में जुड़ी रहती है। ये कैंसरजनी प्रकृति दर्शाते हैं।
अभ्यास
13.1 मेथेन के क्लोरीनीकरण के दौरान एेथेन कैसे बनती है? आप इसे कैसे समझाएँगे।
13.2 निम्नलिखित यौगिकों के IUPAC नाम लिखिए–
(क) CH3CH=C(CH3)2
(ख) CH2=CH-C ≡ C-CH3
(ग) 
(घ)  –CH2–CH2–CH=CH2
–CH2–CH2–CH=CH2
(च) 
(छ) 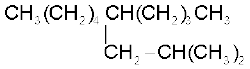
(ज)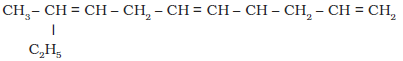
13.3 निम्नलिखित यौगिकों, जिनमें द्विआबंध तथा त्रिआबंध की संख्या दर्शायी गई है, के सभी संभावित स्थिति समावयवों के संरचना-सूत्र एवं IUPAC नाम दीजिए–
(क) C4H8 (एक द्विआबंध)
(ख) C5H8 (एक त्रिआबंध)
13.4 निम्नलिखित यौगिकों के ओजोनी-अपघटन के पश्चात् बनने वाले उत्पादों के नाम लिखिए–
(i) पेन्ट-2-ईन
(ii) 3, 4-डाईमेथिल-हेप्ट-3-ईन
(iii) 2-एथिलब्यूट-1-ईन
(iv) 1-फेनिलब्यूट-1-ईन
13.5 एक एल्कीन 'A' के ओजोनी अपघटन से पेन्टेन-3-ओन तथा एेथेनॉल का मिश्रण प्राप्त होता है। A का IUPAC नाम तथा संरचना दीजिए।
13.6 एक एेल्केन A में तीन C-C, आठ C-H सिग्मा आबंध तथा एक C-C पाई आबंध हैं। A ओजोनी अपघटन से दो अणु एेल्डिहाइड, जिनका मोलर द्रव्यमान 44 है, देता है। A का आई.यू.पी.ए.सी. नाम लिखिए।
13.7 एक एल्कीन, जिसके ओजोनी अपघटन से प्रोपेनॉल तथा पेन्टेन-3-ओन प्राप्त होते हैं, का संरचनात्मक सूत्र क्या है?
13.8 निम्नलिखित हाइड्रोकार्बनों के दहन की रासायनिक अभिक्रिया लिखिए–
(i) ब्यूटेन
(ii) पेन्टीन
(iii) हैक्साइन
(iv) टॉलूइन
13.9 हैक्स-2-ईन की समपक्ष (सिस) तथा विपक्ष (ट्रांस) संरचनाएं बनाइए। इनमें से कौन-से समावयव का क्वथनांक उच्च होता है और क्यों?
13.10 बेन्जीन में तीन द्वि-आबंध होते हैं, फिर भी यह अत्यधिक स्थायी है, क्यों?
13.11 किसी निकाय द्वारा एेरोमैटिकता प्रदर्शित करने के लिए आवश्यक शर्तें क्या हैं?
13.12 इनमें में कौन से निकाय एेरोमैटिक नहीं हैं? कारण स्पष्ट कीजिए–
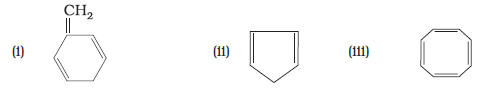
13.13 बेन्जीन को निम्नलिखित में कैसे परिवर्तित करेंगे–
(i) p-नाइट्रोब्रोमोबेन्जीन
(ii) m–नाइट्रोक्लोरोबेन्जीन
(iii) p-नाइट्रोटॉलूईन
(iv) एेसीटोफीनोन
13.14 एेल्केन H3C – CH2 – C – (CH3)2 – CH2 – CH(CH3)2 में 1°,2° तथा 3° कार्बन परमाणुओं की पहचान कीजिए तथा प्रत्येक कार्बन से आबंधित कुल हाइड्रोजन परमाणुओं की संख्या भी बताइए।
13.15 क्वथनांक पर एेल्केन की शृंखला के शाखन का क्या प्रभाव प्रड़ता है?
13.16 प्रोपीन पर HBr के संकलन से 2-ब्रोमोप्रोपेन बनता है, जबकि बेन्जॉयल परॉक्साइड की उपस्थिति में यह अभिक्रिया 1-ब्रोमोप्रोपेन देती है। क्रियाविधि की सहायता से इसका कारण स्पष्ट कीजिए।
13.17 1, 2-डाइमेथिलबेन्जीन(o-जाइलीन) के ओजोनी अपघटन के फलस्वरूप निर्मित उत्पादों को लिखिए। यह परिणाम बेन्जीन की केकुले संरचना की पुष्टि किस प्रकार करता है?
13.18 बेन्जीन, n-हैक्सेन तथा एथाइन को घटते हुए अम्लीय व्यवहार के क्रम में व्यवस्थित कीजिए और इस व्यवहार का कारण बताइए।
13.19 बेन्जीन इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रियाएं सरलतापूर्वक क्यों प्रदर्शित करती हैं, जबकि उसमें नाभिकस्नेही प्रतिस्थापन कठिन होता है?
13.20 आप निम्नलिखित यौगिकों को बेन्जीन में कैसे परिवर्तित करेंगे?
(i) एथाइन
(ii) एथीन
(iii) हैक्सेन
13.21 उन सभी एल्कीनों की संरचनाएं लिखिए, जो हाइड्रोजेनीकरण करने पर 2-मेथिलब्यूटेन देती है।
13.22 निम्नलिखित यौगिकों को उनकी इलेक्ट्रॉनस्नेही (E+) के प्रति घटती आपेक्षिक क्रियाशीलता के क्रम में व्यवस्थित कीजिए–
(क) क्लोरोबेन्जीन, 2,4-डाइनाइट्रोक्लोरोबेन्जीन, p- नाइट्रोक्लोरोबेन्जीन
(ख) टॉलूइन, p-H3C – C6H4 – NO2, p-O2N – C6H4 – NO2
13.23 बेन्जीन, m- डाइनाइट्रोबेन्जीन तथा टॉलूईन में से किसका नाइट्रोकरण आसानी से होता है और क्यों?
13.24 बेन्जीन के एथिलीकरण में निर्जल एेलुमीनियम क्लोराइड के स्थान पर कोई दूसरा लूइस अम्ल सुझाइए।
13.25 क्या कारण है कि वुर्ट्ज़ अभिक्रिया से विषम संख्या कार्बन परमाणु वाले विशुद्ध एेल्केन बनाने के लिए प्रयुक्त नहीं की जाती। एक उदाहरण देकर स्पष्ट कीजिए।
