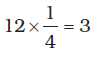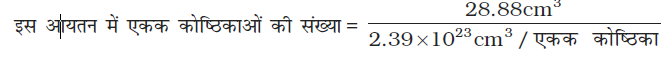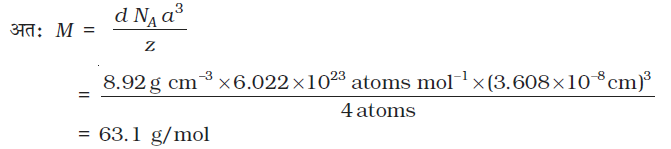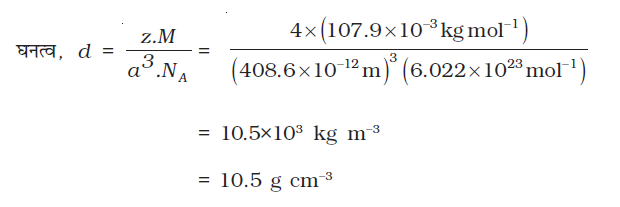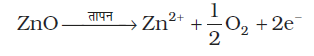Table of Contents
"ठोस पदार्थों जैसे कि उच्च तापीय अतिचालक, जैव सुसंगत प्लास्टिक, सिलिकॉन चिप्स आदि की विपुल बहुतायत विज्ञान के भविष्य के विकास में चहुँमुखी भूमिका के निर्वहन के लिए नियत है।"
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप –
- ठोस अवस्था के सामान्य अभिलक्षणों का वर्णन कर सकेंगे;
- अक्रिस्टलीय और क्रिस्टलीय ठोसों के मध्य विभेद कर सकेंगे;
- क्रिस्टलीय ठोसों को बंधन बलों की प्रकृति के आधार पर वर्गीकृत कर सकेंगे;
- क्रिस्टल जालक और एकक कोष्ठिका को परिभाषित कर सकेंगे;
- कणों के निविड संकुलन की व्याख्या कर सकेंगे;
- विभिन्न प्रकार की रिक्तियों और निविड संकुलित संरचनाओं का वर्णन कर सकेंगे;
- विभिन्न प्रकार की घनीय एकक कोष्ठिकाओं की संकुलन क्षमता का परिकलन कर सकेंगे;
- पदार्थ के घनत्व और उसकी एकक कोष्ठिका के गुणों में सहसंबंध स्थापित कर सकेंगे;
- ठोसों में अपूर्णताओं और उनके गुणों पर अपूर्णताओं के प्रभावों का वर्णन कर सकेंगे;
- ठोसों के विद्युतीय व चुंबकीय गुणों और उनकी संरचना में सहसंबंध स्थापित कर सकेंगे।
हम अपने पूर्व अध्ययन से जानते हैं कि द्रवों और गैसों को उनकी प्रवाह क्षमता के कारण तरल कहा जाता है। इन दोनों अवस्थाओं में तरलता अणुओं की स्वतंत्र गति के कारण होती है। इसके विपरीत, ठोसों के अवययी कणों की स्थितियाँ नियत होती हैं और वे केवल अपनी माध्य स्थितियों के चारों ओर दोलन करते हैं। इससे ठोसों की कठोरता स्पष्ट होती है। ये गुण अवययी कणों की प्रकृति और उनके मध्य परिचालित बंधन बलों पर निर्भर करते हैं। संरचना एवं गुणों के मध्य सहसंबंध वांछनीय गुणों वाले नये ठोस पदार्थों कीे खोज में सहायता करता है। उदाहरणार्थ कार्बन नैनोट्यूब नए पदार्थ हैं, जिनकी क्षमता एेसे पदार्थ देने की है जो स्टील से अधिक मज़बूत हों, एेलुमिनियम से हलके हों और ताँबे से अधिक चालकता वाले हों। इस प्रकार के पदार्थ भविष्य में विज्ञान एवं समाज के विकास के लिए विस्तृत भूमिका निभा सकते हैं। कुछ अन्य पदार्थ जिनसे भविष्य में महत्वपूर्ण भूमिका निभाने की अपेक्षा है वे हैं – उच्च तापीय अतिचालक, चुंबकीय पदार्थ, पैकेज के लिए जैव निम्नीकरणीय बहुलक, शल्यक रोपण में प्रयुक्त जैवसुनम्य (Biocompliant) ठोस। अतः वर्तमान स्थितियों में इस अवस्था का अध्ययन और अधिक महत्वपूर्ण हो जाता है।
इस एकक में हम कणों की विभिन्न सम्भव व्यवस्थाओं से प्राप्त अनेक प्रकार की संरचनाओं का विवेचन करेंगे और छान-बीन करेंगे कि संरचनात्मक इकाइयों के अलग-अलग प्रकार से व्यवस्थित होने से ठोसों के गुण क्यों परिवर्तित हो जाते हैं। हम यह भी जानेंगे कि संरचनात्मक अपूर्णताओं अथवा अपद्रव्यों की अल्प मात्रा में उपस्थिति से ये गुण किस प्रकार से रूपांतरित होते हैं।
1-1 ठोस अवस्था के सामान्य अभिलक्षण
कक्षा XI में आप सीख चुके हैं कि पदार्थ तीन अवस्थाओं– ठोस, द्रव और गैस में पाये जाते हैं। ताप और दाब की दी गई निश्चित परिस्थितियों में, किसी पदार्थ की इनमें से कौन सी अवस्था अधिक स्थायी होगी, दो विरोधी कारकों के सम्मिलित प्रभाव पर निर्भर करती है। यह हैं अंतराआण्विक बलों की अणुओं, परमाणुओं अथवा आयनों को समीप रखने की प्रवृत्ति एवं उष्मीय ऊर्जा जिसकी प्रवृत्ति उनकी गति बढ़ाकर पृथक रखने की होती है। पर्याप्त निम्न तापमान पर उष्मीय ऊर्जा निम्न होती है और अंतराआण्विक बल उन्हें इतना समीप कर देते हैं कि वे एक-दूसरे के साथ चिपक जाते हैं और निश्चित स्थितियाँ अध्यासित कर लेते हैं। यह अब भी अपनी माध्य स्थितियों के चारों ओर दोलन कर सकते हैं और पदार्थ ठोस अवस्था में रहता है। ठोस अवस्था के अभिलक्षणिक गुणधर्म निम्नलिखित हैं–
(i) वे निश्चित द्रव्यमान, आयतन एवं आकार के होते हैं।
(ii) अंतराआण्विक दूरियाँ लघु होती हैं।
(iii) अंतराआण्विक बल प्रबल होते हैं।
(iv) उनके अवयवी कणों (परमाणुओं, अणुओं अथवा आयनों) की स्थितियाँ निश्चित होती हैं और यह कण केवल अपनी माध्य स्थितियों के चारों ओर दोलन कर सकते हैं।
(v) वे असंपीड्य और कठोर होते हैं।
1-2 अक्रिस्टलीय एवं क्रिस्टलीय ठोस
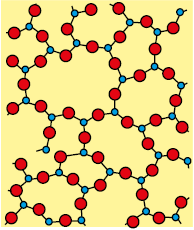
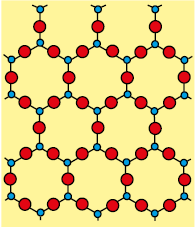
ठोसों को उनके अवयवी कणों की व्यवस्था में उपस्थित क्रम की प्रकृति के आधार पर क्रिस्टलीय और अक्रिस्टलीय में वर्गीकृत किया जा सकता है। क्रिस्टलीय ठोस साधारणतः लघु क्रिस्टलों की अत्यधिक संख्या से बना होता है, उनमें प्रत्येक का निश्चित अभिलक्षणिक ज्यामितीय आकार होता है। क्रिस्टल में अवयवी कणों (परमाणुओं, अणुओं अथवा आयनों) का क्रम सुव्यवस्थित होता है तथा इसकी तीनों विभाओं में पुनरावृत्ति होती है। यदि हम क्रिस्टल के एक भाग में कणों की स्थिति का अवलोकन करें तो हम क्रिस्टल के किसी दूसरे भाग में कणों की स्थिति का सही-सही पूर्वानुमान लगा सकते हैं। चाहे वह अवलोकन किए जा रहे भाग से कितनी भी दूर क्यों न हो अतः क्रिस्टल में दीर्घ परासी व्यवस्था होती है अर्थात् कणों की व्यवस्था का पैटर्न नियमित होता है जिसकी संपूर्ण क्रिस्टल में एक से अंतराल पर पुनरावृत्ति होती है। सोडियम क्लोराइड और क्वाट्ज़ क्रिस्टलीय ठोसों के विशिष्ट उदाहरण हैं। काँच, रबड़ और बहुत से प्लाटिस्कों के द्रव, जब ठंडा करने पर ठोस अवस्था में आते हैं तो क्रिस्टल नहीं बनाते। यह अक्रिस्टलीय ठोस कहलाते हैं। अक्रिस्टलीय ठोस ग्रीक शब्द अमोरफ़ोस से बना है जिसका अर्थ है आकृति नहीं होना। अक्रिस्टलीय ठोस असमाकृति के कणों से बने होते हैं। इन ठोसों में अवयवी कणों (परमाणुओं, अणुओं अथवा आयनों) की व्यवस्था केवल लघु परासी व्यवस्था होती है। एेसी व्यवस्था में नियमित और आवर्ती पुनरावृत पैटर्न केवल अल्प दूरियों तक देखा जाता है। नियमित भाग बिखरे होते हैं और इनके बीच व्यवस्था क्रम अनियमित होते हैं। क्वार्ट्ज़ (क्रिस्टलीय) और क्वार्ट्ज़ काँच (अक्रिस्टलीय) की संरचनाएं क्रमशः चित्र 1.1 (क) और (ख) में दर्शायी गई हैं। यद्यपि दोनों संरचनाएं लगभग समरूप हैं, फिर भी अक्रिस्टलीय क्वार्ट्ज़ कांच में दीर्घ परासी व्यवस्था नहीं है। अक्रिस्टलीय ठोसों की संरचना द्रवों के सदृश होती हैं। अवयवी कणों की व्यवस्था में अंतर के कारण दोनों प्रकार के ठोसों के गुण भिन्न होते हैं।
(ख)
चित्र 1.1– (क) क्वार्ट्ज़ और
(ख) क्वार्ट्ज़ काँच की द्विविमीय संरचना
क्रिस्टलीय ठोसों का गलनांक निश्चित होता है। यह एक विशिष्ट ताप पर पिघल कर द्रव बन जाते हैं। दूसरी ओर अक्रिस्टलीय ठोस ताप के एक निश्चित परास पर नरम होकर पिघलते हैं और बहने लगते हैं तथा गलाकर साँचे में ढाले जा सकते हैं और इनसे विभिन्न आकृतियाँ बनाई जा सकती हैं। अक्रिस्टलीय ठोसों की संरचना द्रवों के सदृश होती है और इन्हें आसानी से अत्यधिक श्यानता वाले द्रव मान लिया जाता है। किसी एक तापमान पर वे क्रिस्टलीय बन सकते हैं। क्रिस्टलीकरण के कारण, प्राचीन सभ्यता की काँच की कुछ वस्तुओं की दृश्यता में दूधियापन पाया गया है। द्रवों के सदृश, अक्रिस्टलीय ठोसों में प्रवाह की प्रवृत्ति होती है, यद्यपि यह बहुत मंद होता है। अतः कभी-कभी इन्हें आभासी ठोस अथवा अतिशीतित द्रव कहा जाता है। अक्रिस्टलीय ठोसों की प्रकृति समदैशिक होती है। इनके याँत्रिक शक्ति, अपवर्तनांक तथा विद्युत चालकता जैसे गुण सभी दिशाओं में समान होते हैं। इसका कारण यह है कि उनमें दीर्घ परासी व्यवस्था नहीं होती और सभी दिशाओं में कणों की व्यवस्था निश्चित नहीं होती अतः सभी दिशाओं में समग्र व्यवस्था एक समान हो जाती है इसलिए किसी भी भौतिक गुण का मान हर दिशा में समान होगा।
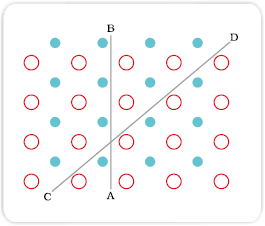
चित्र 1.2– क्रिस्टलों में विषम दैशिकता भिन्न-भिन्न दिशाओं में कणों की भिन्न-भिन्न व्यवस्था से प्राप्त होती है।
क्रिस्टलीय ठोस विषमदैशिक प्रकृति के होते हैं अर्थात् उनके कुछ भौतिक गुण जैसे विद्युतीय प्रतिरोधकता और अपवर्तनांक एक ही क्रिस्टल में भिन्न-भिन्न दिशाओं में मापने पर भिन्न-भिन्न मान प्रदर्शित करते हैं। यह अलग-अलग दिशाओं में कणों की भिन्न व्यवस्था से उत्पन्न होता है। यह चित्र 1.2 से स्पष्ट होता है। इस चित्र में दो भिन्न प्रकार के परमाणुओं की व्यवस्था का दो विमाओं में साधाारण पैटर्न दिखाया गया है। चित्र में दिखाया गया है कि प्रतिरूपण बल जैसा यांत्रिक गुण दो दिशाओं में बिलकुल अलग हो सकता है। CD दिशा में विरूपण से उस पंक्ति में विस्थापन होता है जिसमें दो भिन्न प्रकार के अणु हैं जबकि AB दिशा में एक ही प्रकार के अणुओं का विस्थापन होता है। इन भिन्नताओं को सारणी 1.1 में संक्षेप में दिया गया है।
क्रिस्टलीय और अक्रिस्टलीय ठोसों के अलावा भी कुछ ठोस होते हैं जो देखने से तो अक्रिस्टलीय लगते हैं परंतु इनकी संरचना क्रिस्टली होती है। इन्हें बहुक्रिस्टली ठोस कहते हैं। धातुएँ अक्सर बहुक्रिस्टली अवस्था में होती हैं। इनमें क्रिस्टल इस प्रकार से अभिमुख होते हैं कि धातु का नमूना समदैशिक लगता है यद्यपि अकेला क्रिस्टल विषमदैशिक होता है। अक्रिस्टलीय ठोस उपयोगी पदार्थ होते हैं। काँच, रबर और प्लास्टिक के हमारे दैनिक जीवन में अनेक अनुप्रयोग हैं। अक्रिस्टलीय सिलिकन सूर्य के प्रकाश का विद्युत में रूपांतरण करने के लिए उपलब्ध श्रेष्ठतम प्रकाश-वोल्टीय (photovoltaic) पदार्थ है।
सारणी 1.1– क्रिस्टलीय और अक्रिस्टलीय ठोसों के मध्य विभेद
| गुण | क्रिस्टलीय ठोस | अक्रिस्टलीय ठोस |
आकार गलनांक विदलन गुण गलन एन्थैल्पी दैशिकता प्रकृति अवयवी कणों की व्यवस्था में क्रम | निश्चित अभिलक्षणिक ज्यामितीय आकार निश्चित और अभिलक्षणिक ताप पर पिघलते हैं। तेज धार वाले औज़ार से काटने पर यह दो टुकड़ों में विभक्त हो जाते हैं और नई जनित सतहें सपाट और चिकनी होती हैं। इनकी गलन एन्थैल्पी निश्चित और अभिलक्षणिक होती है। विषमदैशिक प्रकृति के होते हैं। वास्तविक ठोस दीर्घ परासी व्यवस्था | असमाकृति आकार ताप के एक परास में धीरे-धीरे नरम पड़ते हैं तेज धार वाले औज़ार से काटने पर, यह अनियमित सतहों वाले दो टुकड़ों में कट जाते हैं। इनकी गलन एन्थैल्पी निश्चित नहीं होती। समदैशिक प्रकृति के होते हैं। आभासी ठोस अथवा अतिशीतित द्रव केवल लघु परासी व्यवस्था |
पाठ्यनिहित प्रश्न
1.1 ठोस कठोर क्यों होते हैं?
1.2 ठोसों का आयतन निश्चित क्यों होता है?
1.3 निम्नलिखित को अक्रिस्टलीय तथा क्रिस्टलीय ठोसों में वर्गीकृत कीजिए।
पॉलियूरिथेन, नैफ़् थैलीन, बेन्ज़ोइक अम्ल, टेफ्लॉन, पोटैशियम नाइट्रेट, सेलोफेन, पॉलिवाइनिल क्लोराइड, रेशाकाँच, ताँबा।
1.4 एक ठोस के अपवर्तनांक का सभी दिशाओं में समान मान प्रेक्षित होता है। इस ठोस की प्रकृति पर टिप्पणी कीजिए। क्या यह विदलन गुण प्रदर्शित करेगा?
1-3 क्रिस्टलीय ठोसों का वर्गीकरण
खंड 1.2 में हमने अक्रिस्टलीय पदार्थों के बारे में जाना और यह भी जाना कि उनमें लघु परासी व्यवस्था होती है। तथापि, अधिकतर ठोस पदार्थ क्रिस्टलीय प्रकृति के होते हैं। उदाहरण के लिए सभी धात्विक तत्व; जैसे– लोहा, ताँबा और चाँदी; अधात्विक तत्व; जैसे– सल्फर, फ़ॉसफ़ोरस और आयोडीन एवं यौगिक जैसे सोडियम क्लोराइड, ज़िंक सल्फाइड और नैफ़् थैलीन क्रिस्टलीय ठोस हैं।
1.3.1 आण्विक ठोस
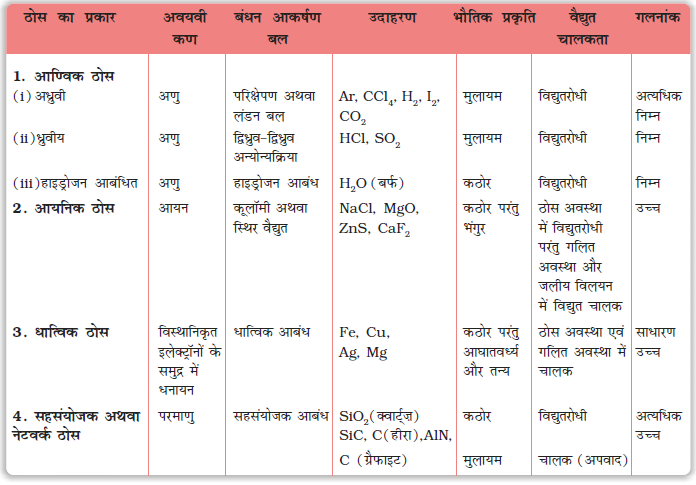
क्रिस्टलीय ठोसों को विभिन्न प्रकार से वर्गीकृत किया जा सकता है। यह विधि उद्देश्य पर निर्भर करती है यहाँ हम क्रिस्टलीय ठोसों को अंतराआण्विक बलों की प्रकृति के आधार पर अथवा आबंधों के आधार पर वर्गीकृत करेंगे जो संरचनात्मक कणों को एक साथ रखते हैं वह हैं – (1) वान्डरवाल्स बल, (2) आयनिक आबंध, (3) सहसंयोजक आबंध, (4) धात्विक आबंध)। इस आधार पर क्रिस्टलीय ठोसों को चार संवर्गों में वर्गीकृत किया जा सकता है। ये हैं, आण्विक, आयनिक, धात्विक और सहसंयोजक ठोस। आइए, अब हम इन संवर्गों के बारे में जानें।
आण्विक ठोसों के अवयवी कण अणु होते हैं। इन्हें निम्नलिखित संवर्गों में और अधिक प्रविभाजित किया गया है –
(i) अध्रुवी आण्विक ठोस
इनके अंतर्गत वे ठोस आते हैं जो या तो परमाणुओं; उदाहरणार्थ, निम्न ताप पर अॉर्गन और हीलियम अथवा अध्रुवी सहसंयोजक बंधों से बने अणुओं, उदाहरणार्थ, निम्न ताप पर H2, Cl2 और I2 द्वारा बने होते हैं। इन ठोसों में परमाणु अथवा अणु दुर्बल परिक्षेपण बलों अथवा लंडन बलों द्वारा बँधे रहते हैं जिनके बारे में आप कक्षा XI में सीख चुके हैं। यह ठोस मुलायम और विद्युत के अचालक होते हैं। यह निम्न गलनांकी होते हैं और सामान्यतः कमरे के ताप और दाब पर द्रव अथवा गैसीय अवस्था में होते हैं।
(ii) ध्रुवीय-आण्विक ठोस
HCl, SO2 आदि पदार्थों के अणु ध्रुवीय सहसंयोजक बंधों से बने होते हैं। एेसे ठोसों में अणु अपेक्षाकृत प्रबल द्विध्रुव-द्विध्रुव अन्योन्यक्रियाओं से एक दूसरे के साथ बँधे रहते हैं। यह ठोस मुलायम और विद्युत के अचालक होते हैं। इनके गलनांक अध्रुवी आण्विक ठोसों से अधिक होते हैं फिर भी इनमें से अधिकतर कमरे के ताप और दाब पर गैस अथवा द्रव हैं। ठोस SO2 और ठोस NH3 एेसे ठोसों के कुछ उदाहरण हैं।
(iii) हाइड्रोजन आबंधित आण्विक ठोस
एेसे ठोसों के अणुओं में H, और F,O अथवा N परमाणुओं के मध्य ध्रुवीय-सहसंयोजक बंध होते हैं। प्रबल हाइड्रोजन आबंधन एेसे ठोसों के अणुओं, जैसे H2O (बर्फ), को बंधित करते हैं। यह विद्युत के अचालक हैं। सामान्यतः यह कमरे के ताप और दाब पर वाष्पशील द्रव अथवा मुलायम ठोस होते हैं।
1.3.2 आयनिक ठोस
आयनिक ठोसों के अवयवी कण आयन होते हैं। एेसे ठोसों का निर्माण धनायनों और ऋणायनों के त्रिविमीय विन्यासों में प्रबल कूलॉमी (स्थिर वैद्युत) बलों से बँधने पर होता है। यह ठोस कठोर और भंगुर प्रकृति के होते हैं। इनके गलनांक और क्वथनांक उच्च होते हैं। चूँकि इसमें आयन गमन के लिए स्वतंत्र नहीं होते, अतः ये ठोस अवस्था में विद्युतरोधी होते हैं। तथापि गलित अवस्था में अथवा जल में घोलने पर, आयन गमन के लिए मुक्त हो जाते हैं और वे विद्युत का संचालन करते हैं।
1.3.3 धात्विक ठोस
धातुएं, मुक्त इलेक्ट्रॉनों के समुद्र से घिरे और उनके द्वारा संलग्नित धनायनों का व्यवस्थित संग्रह हैं। ये इलेक्ट्रॉन गतिशील होते हैं और क्रिस्टल में सर्वत्र समरूप से विस्तारित होते हैं। प्रत्येक धात्विक परमाणु इस गतिशील इलेक्ट्रॉनों के समुद्र में एक अथवा अधिक इलेक्ट्रॉनों का योगदान देता है। ये मुक्त और गतिशील इलेक्ट्रॉन, धातुओं की उच्च वैद्युत और ऊष्मीय चालकता के लिए उत्तरदायी होते हैं। विद्युत क्षेत्र प्रयुक्त करने पर, ये इलेक्ट्रॉन धनायनों के नेटवर्क में सतत प्रवाह करते हैं। इसी प्रकार जब धातु के एक भाग में ऊष्मा संभरित की जाती है तो ऊष्मीय ऊर्जा, मुक्त इलेक्ट्रॉनों द्वारा, सर्वत्र एक समान रूप से विस्तारित हो जाती है। धातुओं की दूसरी महत्वपूर्ण विशेषताएं कुछ स्थितियों में उनकी चमक और रंग हैं। यह भी उनमें उपस्थित मुक्त इलेक्ट्रॉनों के कारण होती हैं। धातुएं अत्यधिक आघातवर्धनीय और तन्य होती हैं।
1.3.4 सहसंयोजक अथवा नेटवर्क ठोस
अधात्विक क्रिस्टलीय ठोसों की विस्तृत अनेकरूपता संपूर्ण क्रिस्टल में निकटवर्ती परमाणुओं के मध्य सहसंयोजक बंधों के बनने के कारण होती हैं। इन्हें विशाल अणु भी कहा जाता है। सहसंयोजक बंध प्रबल और दिशात्मक प्रकृति के होते हैं; इसलिए परमाणु अपनी स्थितियों पर अति प्रबलता से संलग्न रहते हैं। एेसे ठोस अति कठोर और भंगुर होते हैं। इनका गलनांक अत्यन्त उच्च होता है और गलन से पूर्व विघटित भी हो सकते हैं। ये विद्युत का संचालन नहीं करते, अतः ये विद्युतरोधी होते हैं। हीरा (चित्र 1.3, पृष्ठ 6) और सिलिकॉन कार्बाइड एेसे ठोसों के विशिष्ट उदाहरण हैं। ग्रैफाइट भी क्रिस्टलों के इस वर्ग में आता है यद्यपि यह मुलायम और विद्युत चालक है। उसके अपवादात्मक गुण उसकी विशिष्ट संरचना (चित्र 1.4, पृष्ठ 6) के कारण होते हैं। जिसके बारे में आप कक्षा-11 में पढ़ चुके हैं इसमें कार्बन परमाणु विभिन्न परतों में व्यवस्थित होते हैं और प्रत्येक परमाणु उसी परत के तीन निकटवर्ती परमाणुओं से सहसंयोजक बंधन में होता है। प्रत्येक परमाणु का चौथा संयोजकता इलेक्ट्रॉन अलग परतों के मध्य उपस्थित होता है और यह गमन के लिए मुक्त होता है। यही मुक्त इलेक्ट्रॉन ग्रैफाइट को विद्युत का उत्तम चालक बनाते हैं। विभिन्न परतें एक-दूसरे पर सरक सकती हैं। यह ग्रैफाइट को मुलायम ठोस और उत्तम ठोस-चिकनाई बनाते हैं।
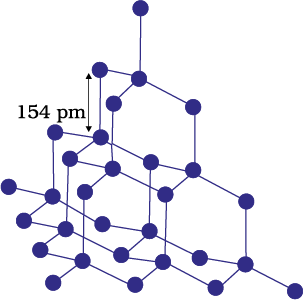
चित्र 1.3– हीरे की नेटवर्क संरचना
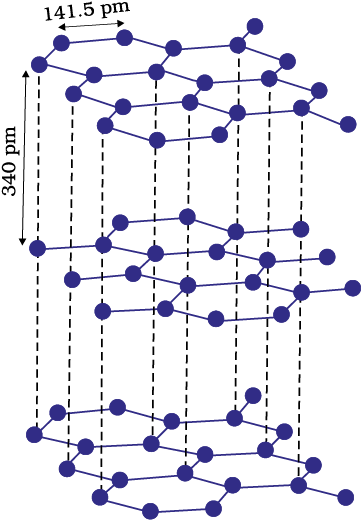
चित्र 1.4– ग्रैफाइट की संरचना
चारों प्रकार के ठोसों के विभिन्न गुणों को सारणी 1.2 में सूचीबद्ध किया गया है।
सारणी 1.2– विभिन्न प्रकार के ठोस
पाठ्यनिहित प्रश्न
1.5 उपस्थित अंतराआण्विक बलों की प्रकृति के आधार निम्नलिखित ठोसों को विभिन्न संवर्गों में वर्गीकृत कीजिए– पोटैशियम सल्फेट, टिन, बेन्ज़ीन, यूरिया, अमोनिया, जल, ज़िंक सल्फाइड, ग्रैफाइट, रूबिडियम, अॉर्गन, सिलिकन कार्बाइड।
1.6 ठोस A, अत्यधिक कठोर तथा ठोस एवं गलित दोनों अवस्थाओं में विद्युतरोधी है और अत्यंत उच्च ताप पर पिघलता है। यह किस प्रकार का ठोस है?
1.7 आयनिक ठोस गलित अवस्था में विद्युत चालक होते हैं परंतु ठोस अवस्था में नहीं, व्याख्या कीजिए।
1.8 किस प्रकार के ठोस विद्युत चालक, आघातवर्ध्य और तन्य होते हैं?
1-4 क्रिस्टल जालक और एकक कोष्ठिका
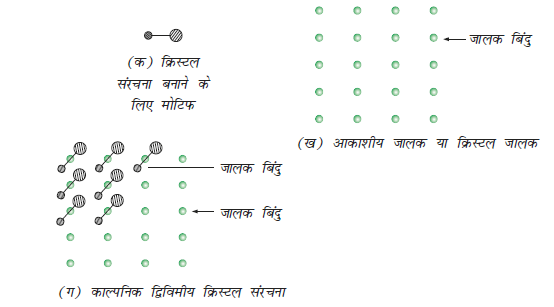
आपने देखा होगा कि जब किसी फर्श को ढ़कने के लिए टाइल बिछाए जाते हैं तो एक पुनरावृत्ति होने वाला पेटर्न बनता है। सारे टाइलों को फर्श पर रखने के बाद यदि हम सभी टाइलों के एक निश्चित स्थान पर बिन्दु लगा दें (उदाहरण के लिए टाइल के मध्य में) तथा टाइल पर ध्यान न देकर केवल बिन्दुओं का अवलोकन करें तों हमें बिंदुओं का एक समुच्चय प्राप्त होता है। यह बिंदुओं का समुच्चय एक ढाँचा है जिसे आकाशीय जालक कहते हैं। यहाँ इसके बिंदुओं पर संरचना-इकाई (यहाँ पर टाइल) रख कर द्विविमीय पैटर्न विकसित किया गया है। संरचना इकाई को बेसिस अथवा मोटिफ कहते हैं। जब आकाशीय जालक के बिंदुओं पर मोटिफ रखते हैं तो पेटर्न बनता है। क्रिस्टल संरचना में मोटिफ एक अणु, परमाणु अथवा आयन होता है। आकाशीय जालक को क्रिस्टल जालक भी कह सकते हैं। यह एेसे बिंदुओं का पैटर्न है जो मोटिफ की स्थिति को प्रदर्शित करते हैं। दूसरे शब्दों में आकाशीय जालक, क्रिस्टल की संरचना के लिए एक काल्पनिक ढाँचा है। जब हम मोटिफ को आकाशीय जालक के बिंदुओं पर रखते हैं तो हमें क्रिस्टल जालक प्राप्त होता है। चित्र 1.5 में एक मोटिफ, एक द्विविमीय जालक और एक काल्पनिक द्विविमीय क्रिस्टल संरचना प्रदर्शित की गई है। जो मोटिफ को द्विविमीय जालक में रख कर प्राप्त होती है।
चित्र 1.5– (क) मोटिफ (ख) आकाशीय जालक (ग) काल्पनिक द्विविमीय क्रिस्टल संरचना
दिक स्थान (स्पेस) में जालक बिंदुओं की व्यवस्था विभिन्न प्रकार के जालक दे सकती है। चित्र 1.6 में दो प्रकार की व्यवस्थाओं से प्राप्त जालक प्रदर्शित किए गए हैं।
चित्र 1.6– दो भिन्न जालकों में बिंदुओं की व्यवस्था।
क्रिस्टलीय ठोसों में आकाशीय जालक बिंदुओं का समूह त्रिविम में होता है। जालक बिंदुओं पर मोटिफ जोड़कर क्रिस्टल संरचना प्राप्त होती है। प्रत्येक पुनरावृत्तित मोटिफ की संरचना एवं त्रिविम विन्यास समान होता है। जैसा कि त्रिविम में किसी भी एक मोटिफ का होता है। सतह को छोड़कर क्रिस्टल में प्रत्येक मोटिफ के आस-पास समान वातावरण होता है।
एक क्रिस्टल जालक के अभिलक्षण निम्नलिखित हैं –
(क) जालक में प्रत्येक बिंदु जालक बिंदु अथवा जालक स्थल कहलाता है।
(ख) क्रिस्टल जालक का प्रत्येक बिंदु एक अवयवी कण को निरूपित करता है जो एक परमाणु, एक अणु (परमाणुओं का समूह) अथवा एक आयन हो सकता है।
(ग) जालक बिंदुओं को सीधी रेखाओं से जोड़ा जाता है जिससे जालक की ज्यामिति व्यक्त की जा सके।
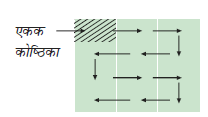
क्रिस्टल को पूर्ण परिभाषित करने के लिए त्रिविम जालक का केवल छोटा सा भाग आवश्यक होता है। इस छोटे-से भाग को एकक कोष्ठिका कहते हैं। कोई एकक कोष्ठिका का चुनाव कई तरह से कर सकता है। सामान्यतः वह कोष्ठिका चुनी जाती है जिसकी लम्ब भुजाएँ छोटी हों तथा जिनके सभी दिशाओं में पुनरावर्तन से सम्पूर्ण क्रिस्टल का निर्माण हो सके। चित्र 1.7 में कोष्ठिका के पुनरावर्तन द्वारा द्विविमीय क्रिस्टल का निर्माण दर्शाया गया है। पुनश्चः कोष्ठिका का आकार एेसा होना चाहिए कि सम्पूर्ण जालक में कोष्ठिकाओं के बीच में रिक्त स्थान न रहे।
चित्र 1.7– चतुर्भुज वर्ग के तीरों की दिशा में गमन से एक काल्पनिक दो द्विविमीय क्रिस्टल का निर्माण
दो विमाओं में ‘a’ तथा ‘b’ लंबाई की भुजाओं वाले समांतर चतुर्भुज को, जिसकी भुजाओं के मध्य γ कोण हो, एकक कोष्ठिका के रूप में चुना जाता है। द्विविमाओं में सम्भावित एकक कोष्ठिाएँ चित्र 1.8 में दर्शाई गई हैं।
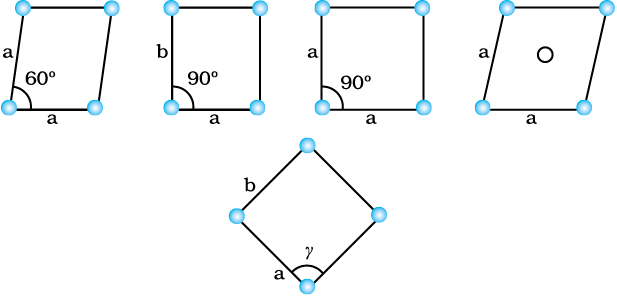
चित्र 1.8– दो विमाओं में सम्भावित एकक कोशिकाएँ
त्रिविम में क्रिस्टल जालक का एक भाग तथा इसकी एकक कोशिका को चित्र 1.9 में प्रदर्शित किया गया है।
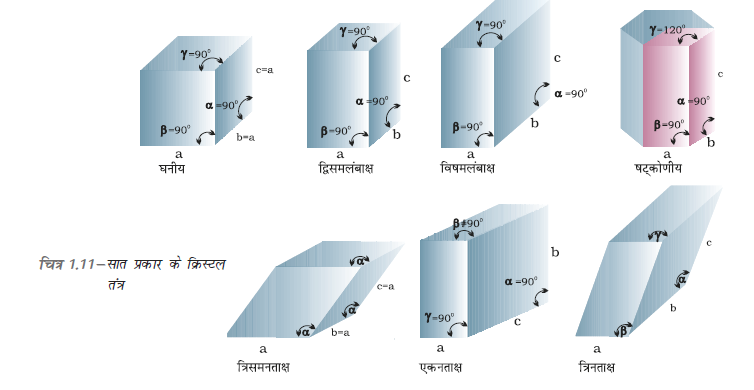
एक त्रिविमीय क्रिस्टल संरचना में एकक कोष्ठिका अभिलक्षणित होती है –
(i) उसके तीनों किनारों की विमाओं a, b और c के द्वारा, जो कि परस्पर लंबवत् हो भी सकते हैं अथवा नहीं भी।
(ii) किनारों (कोरों) के मध्य कोण α (b और c के मध्य), β (a और c के मध्य) और γ (a और b के मध्य) के द्वारा।
इस प्रकार एकक कोष्ठिका छः पैरामीटरों– a, b, c, α , β और γ द्वारा अभिलक्षणित होती है। प्रतिरूपी एकक कोष्ठिका के इन पैरामीटरों को चित्र 1.10 में दिखाया गया है।
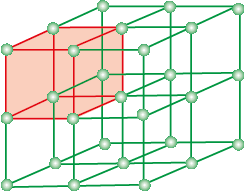
चित्र 1.9– एक क्रिस्टल के त्रिविमीय घनीय आकाशीय जालक का एक भाग और उसकी एकक कोष्ठिका।
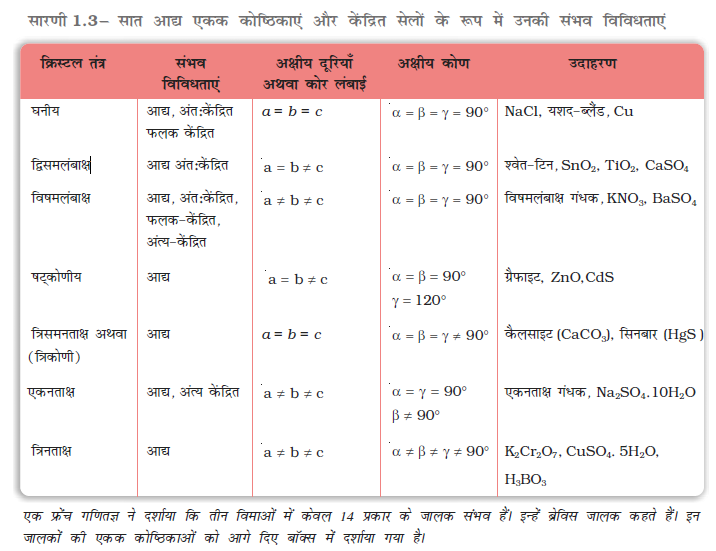
1.4.1 आद्य एवं केंद्रित एकक कोष्ठिका
एकक कोष्ठिका को विस्तृत रूप से दो संवर्गों में बाँटा जा सकता है, आद्य एवं केंद्रित एकक कोष्ठिका।
(क) आद्य एकक कोष्ठिका
जब अवयवी कण एकक कोष्ठिका के केवल कोनों पर उपस्थित हों, तो उसे आद्य एकक कोष्ठिका कहा जाता है।
(ख) केंद्रित एकक कोष्ठिका
जब एकक कोष्ठिका में एक अथवा अधिक अवयवी कण, कोनों के अतिरिक्त अन्य स्थितियों पर भी उपस्थित होते हैं, तो उसे केंद्रित एकक कोष्ठिका कहते हैं। केंद्रित एकक कोष्ठिकाएं तीन प्रकार की होती हैं –
(i) अंतःकेंद्रित एकक कोष्ठिका – एेसी एकक कोष्ठिका में एक अवयवी कण (परमाणु, अणु अथवा आयन) कोनों में उपस्थित कणों के अतिरिक्त उसके अंतः केंद्र में होता है।
(ii) फलक-केंद्रित एकक कोष्ठिका – एेसी एकक कोष्ठिका में कोनों पर उपस्थित अवयवी कणों के अतिरिक्त एक अवयवी कण प्रत्येक फलक के केंद्र पर भी होता है।
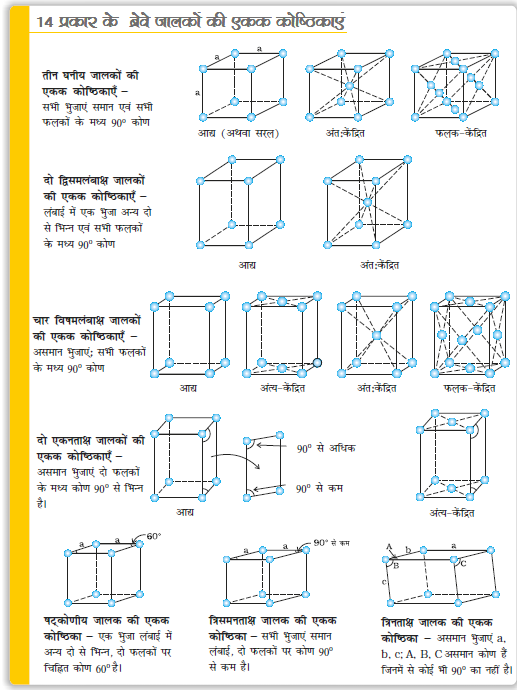
(iii) अंत्य-केंद्रित एकक कोष्ठिका – एेसी एकक कोष्ठिका में कोनों पर उपस्थित अवयवी कणों के अतिरिक्त एक अवयवी कण किन्हीं दो विपरीत फलकों के केंद्र में पाया जाता है। आद्य यानी सरल एकक कोष्ठिकाओं तथा विभिन्न प्रकार के क्रिस्टलों का निरीक्षण करने से यह निष्कर्ष निकलता है कि यह सभी सात संरचनाओं के सदृश हैं। यह मूल नियमित संरचनाएँ सात क्रिस्टल सिस्टम कहलाते हैं। कोई क्रिस्टल किस सिस्टम के अन्तर्गत आता है यह पता लगाने के लिए क्रिस्टल के फलकों के मध्य कोण को मापा जाता है और यह निर्धारित किया जाता है कि इसके आकार का निर्धारण करने के लिए कितने अक्ष आवश्यक हैं। चित्र 1.11 में सातों क्रिस्टल सिस्टम प्रदर्शित किए गए हैं। इनकी आद्य एकक कोष्ठिकाएं तथा उनसे बनने वाली केंद्रित एकक कोष्ठिकाओं के रूप में उनकी संभव विविधताएं सारणी 1.3 में सूचीबद्ध हैं।
1.5 एक एकक कोष्ठिका में अवयवी कणों की संख्या
हम जानते हैं कि कोई भी क्रिस्टल जालक, एकक कोष्ठिकाओं की अत्यधिक संख्या से बना होता है और प्रत्येक जालक बिंदु पर एक अवयवी कण (परमाणु, अणु अथवा आयन) रहता है। अब हम देखेंगे कि प्रत्येक अवयवी कण का कौन सा भाग एक विशिष्ट एकक कोष्ठिका से संबंद्धित है।
हम तीन प्रकार के घनीय एकक कोष्ठिकाओं पर विचार करेंगे और सरलता के लिए परमाणु को अवयवी कण मानेंगे।
1.5.1 आद्य घनीय एकक कोष्ठिका
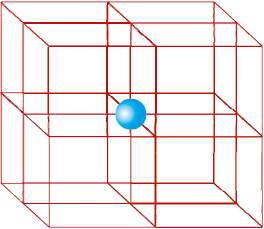
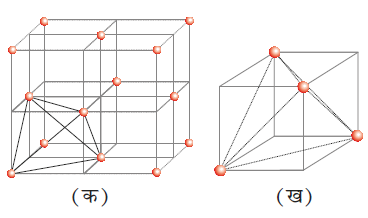
चित्र 1.12–एक सरल एकक कोष्ठिका में प्रत्येक कोने का परमाणु 8 एकक कोष्ठिकाओं के मध्य सहभाजित हैं।
आद्य घनीय एकक कोष्ठिका में परमाणु (अथवा अवयवी कण) केवल कोनों पर होते हैं। कोने का प्रत्येक परमाणु आठ निकटवर्ती एकक कोष्ठिकाओं के मध्य सहभाजित होता है जैसा चित्र 1.12 में दिखाया गया है। चार एकक कोष्ठिकाएं समान परत में और चार एकक कोष्ठिकाएं ऊपरी (अथवा निचली) परत की होती हैं, अतः वास्तव में एक परमाणु (अथवा अणु अथवा आयन) का 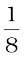 वाँ भाग एक विशिष्ट एकक कोष्ठिका से संबंधित रहता है।
वाँ भाग एक विशिष्ट एकक कोष्ठिका से संबंधित रहता है।
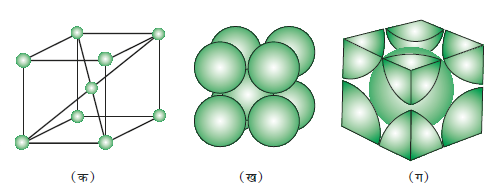
चित्र 1.13 में एक आद्य घनीय एकक कोष्ठिका को तीन भिन्न प्रकारों से चित्रित किया गया है। चित्र 1.13 (क) में प्रत्येक छोटा गोला, उस स्थिति पर उपस्थित कण के केवल केंद्र को निरूपित करता है, उसके वास्तविक आकार को नहीं। एेसी संरचनाओं को विवृत संरचनाएं कहा जाता है। विवृत संरचनाओं में कणों की व्यवस्था को समझना आसान है। चित्र 1.13 (ख) एकक कोष्ठिका के दिक्स्थान-भराव निरूपण को कणों के वास्तविक आकार के साथ चित्रित करता है तथा चित्र 1.13 (ग) एक घनीय एकक कोष्ठिका में उपस्थित विभिन्न परमाणुओं के वास्तविक भागों को दर्शाता है।
चूँकि कुल मिलाकर प्रत्येक घनीय एकक कोष्ठिका में उसके कोनों पर 8 परमाणु हैं, अतः एक एकक कोष्ठिका में परमाणुओं की कुल संख्या 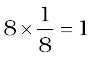 परमाणु होगी।
परमाणु होगी।
चित्र 1.13–एक आद्य घनीय एकक कोष्ठिका
(क) विवृत संरचना,
(ख) दिक्स्थान-भराव संरचना,
(ग) एक एकक कोष्ठिका से संबंधित परमाणुओं के वास्तविक भाग
1.5.2 अंतःकेंद्रित घनीय एकक कोष्ठिका
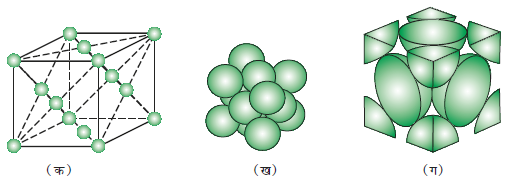
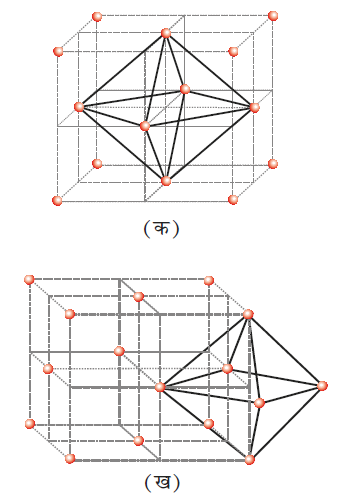
एक अंतःकेंद्रित घनीय (bcc) एकक कोष्ठिका में एक परमाणु उसके प्रत्येक कोने पर और इसके अतिरिक्त एक परमाणु उसके अंतः केंद्र में भी होता है। चित्र 1.14 अंतःकेंद्रित घनीय एकक कोष्ठिका की– (क) विवृत संरचना, (ख) दिकस्थान-भराव मॉडल और (ग) एक एकक कोष्ठिका को वास्तविक रूप से संबंधित परमाणुओं के भागों के साथ दर्शाता है। यहाँ यह देखा जा सकता है कि अंतःकेंद्र का परमाणु पूर्णतया उस एकक कोष्ठिका से संबंधित होता है जिसमें वह उपस्थित होता है। इस प्रकार से एक अंतःकेंद्रित एकक कोष्ठिका में –
चित्र 1.14– एक अंतः केंद्रित घनीय एकक कोष्ठिका
(क) विवृत संरचना, (ख) दिक्स्थान-भराव संरचना,
(ग) एक एकक कोष्ठिका से संबंधित परमाणुओं के वास्तविक भाग
(i) 8 कोने 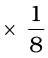 प्रति कोना परमाणु = 8
प्रति कोना परमाणु = 8 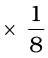 = 1 परमाणु
= 1 परमाणु
(ii) 1 अंतः केंद्र परमाणु = 1 X 1 = 1 परमाणु
 प्रति एकक कोष्ठिका में परमाणुओं की कुल संख्या = 2 परमाणु
प्रति एकक कोष्ठिका में परमाणुओं की कुल संख्या = 2 परमाणु
1.5.3 फलक-केंद्रित घनीय एकक कोष्ठिका
फलक-केंद्रित घनीय (fcc) एकक कोष्ठिका में परमाणु सभी कोनों पर और घन के सभी फलकों के केंद्रों पर पाए जाते हैं। चित्र 1.15 में देखा जा सकता है कि फलक केंद्र पर उपस्थित प्रत्येक परमाणु दो निकटवर्ती एकक कोष्ठिकाओं के मध्य सहभाजित होता है। प्रत्येक फलक के केंद्र पर उपस्थित परमाणु दो सन्निकट कोष्ठिकाओं के मध्य सहभाजित होता है तथा प्रत्येक परमाणु का केवल ½ भाग एक एकक कोष्ठिका में सम्मिलित होता है। चित्र 1.16 में फलक-केंद्रित एकक कोष्ठिका की– (क) विवृत संरचना, (ख) दिक्स्थान-भराव मॉडल और (ग) एक एकक कोष्ठिका को वास्तविक रूप से संबंधित परमाणुओं के भागों के साथ दर्शाया गया है।
चित्र 1.15– एकक कोष्ठिका के फलक केंद्र पर एक परमाणु दो एकक कोष्ठिकाओं के मध्य सहभाजित है।
(i) 8 कोने के परमाणु 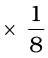 परमाणु प्रति एकक कोष्ठिका = 8
परमाणु प्रति एकक कोष्ठिका = 8 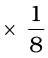 = 1 परमाणु
= 1 परमाणु
(ii) 6 फलक-केंद्रित परमाणु 
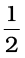 परमाणु प्रति एकक कोष्ठिका = 6
परमाणु प्रति एकक कोष्ठिका = 6 
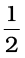 = 3 परमाणु
= 3 परमाणु
 प्रति एकक कोष्ठिका परमाणुओं की कुल संख्या = 1 + 3 = 4 परमाणु
प्रति एकक कोष्ठिका परमाणुओं की कुल संख्या = 1 + 3 = 4 परमाणु
चित्र 1.16– एक फलक-केंद्रित घनीय एकक कोष्ठिका
(क) विवृत संरचना,
(ख) दिक्स्थान-भराव संरचना,
(ग) एक एकक कोष्ठिका से संबंधित अणुओं के वास्तविक भाग।
पाठ्यनिहित प्रश्न
1.9 ‘जालक बिंदु’ से आप क्या समझते हैं?
1.10 एकक कोष्ठिका को अभिलक्षणित करने वाले पैरामीटरों के नाम बताइए।
1.11 निम्नलिखित में विभेद कीजिए।
(i) षट्कोणीय और एकनताक्ष एकक कोष्ठिका
(ii) फलक केंद्रित और अंत्य-केंद्रित एकक कोष्ठिका।
1.12 स्पष्ट कीजिए कि एक घनीय एकक कोष्ठिका के– (i) कोने और (ii) अंतःकेंद्र पर उपस्थित परमाणु का कितना भाग सन्निकट कोष्ठिका से सहभाजित होता है।
1.6 निविड संकु लित संरचनाएं
ठोसों में, अवयवी कण निविड संकुलित होते हैं तथा उनके मध्य न्यूनतम रिक्त स्थान होता है। आइए, हम अवयवी कणों को समरूप कठोर गोले मानते हुए तीन पदों में त्रिविमीय संरचना को निर्मित करें।

चित्र 1.17– एक विमा में गोलों का निविड संकुलन
(क) एक विमा में निविड संकुलन
एकविमीय निविड संकुलित संरचना में गोलों को व्यवस्थित करने की केवल एक विधि है, जिसमें उन्हें एक पंक्ति में एक-दूसरे को स्पर्श करते हुए व्यवस्थित किया जाता है (चित्र 1.17)।
इस व्यवस्था में, प्रत्येक गोला दो निकटवर्ती गोलों के संपर्क में होता है। एक कण के निकटतम गोलों की संख्या को उसकी उपसहसंयोजन संख्या कहा जाता है। इस प्रकार एकविमीय निविड संकुलित व्यवस्था में उपसहसंयोजन संख्या दो हैं।
चित्र 1.18– द्विविम में
(क) वर्ग निविड संकुलन
(ख) गोलों का षट्कोणीय निविड संकुलन
(ख) द्विविमा में निविड संकुलन
द्विविमीय निविड संकुलित संरचना, निविड संकुलित गोलों की पंक्तियों को एक साथ व्यवस्थित करके (रखकर) जनित की जा सकती है। इसे दो भिन्न प्रकार से किया जा सकता है।
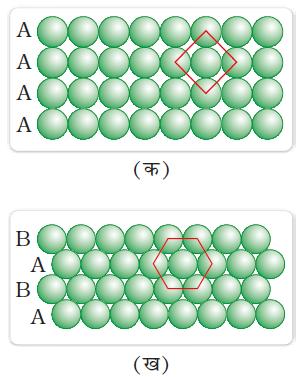
(i) द्वितीय पंक्ति को प्रथम के संपर्क में इस प्रकार रखा जा सकता है कि द्वितीय पंक्ति के गोले प्रथम पंक्ति के गोलों के ठीक ऊपर हों एवं दोनों पंक्तियों के गोले क्षैतिजीय तथा साथ ही ऊर्ध्वाधर रूप से संरेखित हों। यदि प्रथम पंक्ति को हम 'A' प्रकार की पंक्ति कहते हैं तो द्वितीय पंक्ति प्रथम पंक्ति के ठीक समान होने से, वह भी 'A' प्रकार की होगी। इसी प्रकार से अधिक पंक्तियों को रखकर AAA प्रकार की व्यवस्था प्राप्त की जा सकती है जैसा कि चित्र 1.18(क) में दिखाया गया है।
इस व्यवस्था में, प्रत्येक गोला चार निकटवर्ती गोलों के संपर्क में रहता है। इस प्रकार द्विविमीय उपसहसंयोजन संख्या चार है। साथ ही यदि इन सन्निकट चार गोलों के केंद्रों को जोड़ा जाए तो एक वर्ग प्राप्त होता है। अतः इस संकुलन को द्विविम में वर्ग निविड संकुलन कहा जाता है।
(ii) द्वितीय पंक्ति को प्रथम के ऊपर सांतरित रूप से इस प्रकार रखा जा सकता है कि उसके गोले प्रथम पंक्ति के अवनमनों में ठीक आ जाएं। यदि प्रथम पंक्ति के गोलों की व्यवस्था को 'A' प्रकार कहा जाए तो द्वितीय पंक्ति जो कि भिन्न है, उसे 'B' प्रकार कहा जा सकता है। जब तृतीय पंक्ति को द्वितीय के निकट सांतरित रूप से रखा जाता है तो उसके गोले प्रथम तल के गोलों से संरेखित होते हैं। अतः यह तल भी 'A' प्रकार का है। इसी प्रकार से रखे गए चौथी पंक्ति के गोले द्वितीय पंक्ति ('B' प्रकार) से संरेखित होते हैं। अतः यह व्यवस्था ABAB प्रकार की है। इस व्यवस्था में मुक्त स्थान कम होता है और इसमें संकुलन, वर्ग निविड संकुलन से अधिक दक्ष है। प्रत्येक गोला छः निकटवर्ती गोलों के संपर्क में रहता है और द्विविमीय उपसहसंयोजन संख्या छः है। इन छः गोलों के केंद्र सम-षट्कोण के कोनों पर हैं (चित्र 1.18 ख)। इस प्रकार इस संकुलन को द्विविम षट्कोणीय निविड संकुलन कहा जाता है। चित्र 1.18 (ख) में यह देखा जा सकता है कि इस तल में कुछ रिक्तियाँ (रिक्त स्थान) हैं। यह त्रिकोणीय आकृति की हैं। त्रिकोणीय रिक्तियाँ दो प्रकार की हैं। एक पंक्ति में त्रिकोण का शीर्ष ऊर्ध्वमुखी और अगली पंक्ति में अधोमुखी है।
(ग) त्रिविमा में निविड संकुलन
सभी वास्तविक संरचनाएं त्रिविम संरचनाएं होती हैं। यह द्विविमीय परतों को एक-दूसरे के ऊपर रखने से प्राप्त की जा सकती हैं। पिछले खंड में हमने द्विविम में निविड संकुलन की विवेचना की जो कि दो प्रकार की हो सकती है; वर्ग निविड संकुलित और षट्कोणीय निविड संकुलित। आइए, हम देखते हैं कि इनसे कितने प्रकार के त्रिविमीय निविड संकुलन प्राप्त किए जा सकते हैं।
(i) द्विविम वर्ग निविड संकुलित परतों से त्रिविम निविड संकुलन – जब द्वितीय वर्ग निविड संकुलित परत को प्रथम के ऊपर रखा जाता है तब हम उसी नियम का अनुपालन करते हैं जिसका पालन हमने एक पंक्ति को दूसरी के निकट रखने में किया था। द्वितीय परत को प्रथम परत के ऊपर इस प्रकार रखा जाता है कि ऊपरी परत के गोले प्रथम परत के गोलों के ठीक ऊपर रहें। इस व्यवस्था में दोनों परतों के गोले पूर्णतया क्षैतिज तथा साथ ही ऊर्ध्वाधर रूप से सीध में होते हैं जैसा चित्र 1.19 में दिखाया गया है। इसी प्रकार से हम और परतों को एक-दूसरे के ऊपर रख सकते हैं। यदि प्रथम परत के गोलों की व्यवस्था को 'A' प्रकार कहा जाए तो सभी परतों में समान व्यवस्था होती है। इस प्रकार इस जालक में AAA प्रकार का पैटर्न है। इस प्रकार जनित होने वाला जालक सामान्य घनीय जालक और उसकी एकक कोष्ठिका आद्य-घनीय एकक कोष्ठिका है (चित्र 1.19)।
(ii) द्विविम-षट्कोणीय निविड संकुलित परतों से त्रिविम निविड संकुलन – इसमें परतों को एक-दूसरे पर रखकर त्रिविमीय निविड संकुलित संरचना निम्न प्रकार से जनित की जा सकती है।
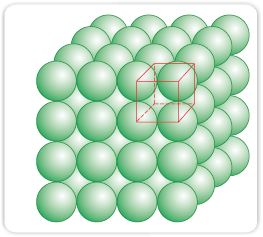
चित्र 1.19– AAA... व्यवस्था से बनने वाला सरल घनीय जालक
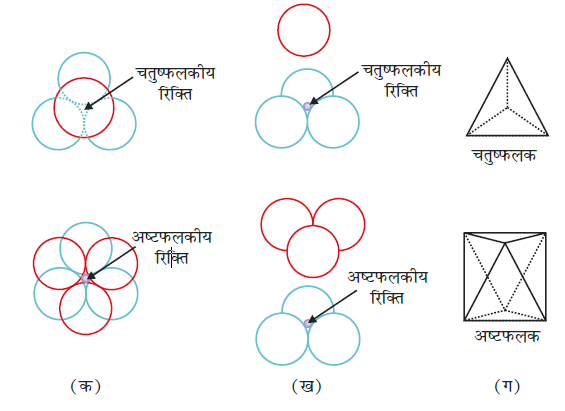
(क) द्वितीय परत को प्रथम के ऊपर रखना - आइए, हम एक द्विविम-षट्कोणीय निविड संकुलित परत 'A' लेते हैं और एक वैसी ही परत उसके ऊपर इस प्रकार रखते हैं कि द्वितीय परत के गोले प्रथम परत के अवनमनों में आ जाते हैं। चूँकि दो परतों के गोले भिन्न प्रकार से संरेखित हैं, अतः द्वितीय परत को हम B परत कहते हैं। यह चित्र 1.20 में देखा जा सकता है कि प्रथम परत की सभी त्रिकोणीय रिक्तियाँ द्वितीय परत के गोलों से आवृत नहीं हैं। इससे अलग-अलग व्यवस्थाओं की उत्पत्ति होती है। जब भी द्वितीय परत का एक गोला प्रथम परत की रिक्ति के ऊपर होता है (अथवा विलोमतः) तब एक चतुष्फलकीय रिक्ति बनती है। इन रिक्तियों को चतुष्फलकीय रिक्तियाँ कहते हैं क्योंकि जब इन चार गोलों के केंद्रों को मिलाया जाता है तब एक चतुष्फलक बनता है। इन्हें चित्र 1.20 में 'T' से अंकित किया गया है। एेसी एक रिक्ति को अलग से चित्र 1.21 में दिखाया गया है।
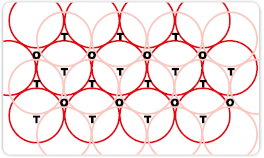
चित्र 1.20 - निविड संकुलित गोलों की दो परतों का एक स्तंभ और उनमें जनित होने वाली रिक्तियाँ।
T = चतुष्फलकीय रिक्ति
O = अष्टफलकीय रिक्ति
चित्र 1.21– चतुष्फलकीय और अष्टफलकीय रिक्तियाँ
(क) ऊपरी दृश्य
(ख) खंडित पार्श्व दृश्य
(ग) रिक्ति का ज्यामितीय आकार
अन्य स्थानों पर, द्वितीय परत की त्रिकोणीय रिक्तियाँ, प्रथम परत की त्रिकोणीय रिक्तियों के ऊपर हैं और इनकी त्रिकोणीय आकृतियाँ अतिव्यापित नहीं होतीं। उनमें से एक में त्रिकोण का शीर्ष ऊर्ध्वमुखी और दूसरे में अधोमुखी होता है। इन रिक्तियों को चित्र 1.20 में 'O' से अंकित किया गया है। एेसी रिक्तियाँ छः गोलों से घिरी होती हैं और इन्हें अष्टफलकीय रिक्तियाँ कहा जाता है। एेसी एक रिक्ति को अलग से चित्र 1.21 में दिखाया गया है। इन दोनों प्रकार की रिक्तियों की संख्या निविड संकुलित गोलों की संख्या पर निर्भर करती है।
माना कि निविड संकुलित गोलों की संख्या N है, तब –
जनित अष्टफलकीय रिक्तियों की संख्या = N
जनित चतुष्फलकीय रिक्तियों की संख्या = 2N
(ख) तृतीय परत को द्वितीय परत पर रखना – जब तृतीय परत को द्वितीय परत पर रखा जाता है, तब दो संभावनाएं होती हैं।
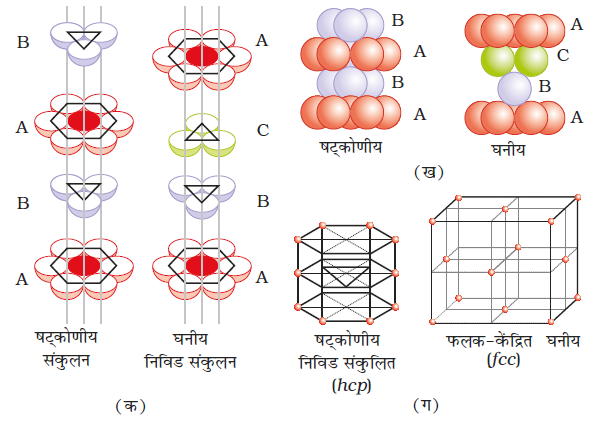
(i) चतुष्फलकीय रिक्तियों का आच्छादन – द्वितीय परत की चतुष्फलकीय रिक्तियों को तृतीय परत के गोलों द्वारा आच्छादित किया जा सकता है। इस स्थिति में तृतीय परत के गोले प्रथम परत के गोलों के साथ पूर्णतः संरेखित होते हैं। इस प्रकार गोलों का पैटर्न एकांतर परतों में पुनरावृत्त होता है। इस पैटर्न को प्रायः ABAB... पैटर्न लिखा जाता है। इस संरचना को षट्कोणीय निविड संकुलित (hcp) संरचना कहते हैं (चित्र 1.22)। इस प्रकार की परमाणुओं की व्यवस्था कई धातुओं जैसे मैग्नीशियम और ज़िंक में पाई जाती है।
चित्र 1.22– (क) षट्कोणीय घनीय निविड संकुलन का खंडित दृश्य गोलों की परतों का संकुलन दर्शाते हुए।
(ख) प्रत्येक स्थिति में चार परतें स्तंभ के रूप में
(ग) संकुलन की ज्यामिति
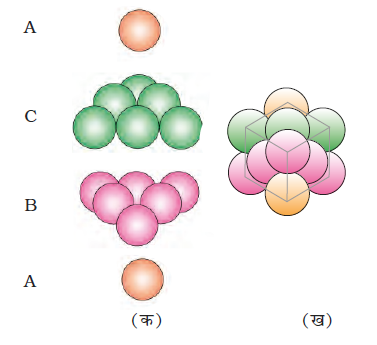
(ii) अष्टफलकीय रिक्तियों का आच्छादन – तीसरी परत दूसरी परत के ऊपर इस प्रकार रख सकते हैं कि उसके गोले अष्टफलकीय रिक्तियों को आच्छादित करते हों। इस प्रकार से रखने पर तीसरी परत के गोले प्रथम अथवा द्वितीय किसी भी परत के साथ संरेखित नहीं होते। इस व्यवस्था को 'C' प्रकार कहा जाता है। केवल चौथी परत रखने पर, उसके गोले प्रथम परत के गोलों के साथ संरेखित होते हैं जैसा चित्र 1.22 और 1.23 में दिखाया गया है।
चित्र 1.23– (क) परतों की ABCABC... व्यवस्था जब अष्टफलकीय रिक्तियाँ आच्छादित होती हैं।
(ख) इस व्यवस्था द्वारा निर्मित होने वाली संरचना का अंश जिसके परिणामस्वरूप घनीय निविड संकुलित(ccp) अथवा फलक-केंद्रित घनीय (fcc) संरचना बनती है।
इस प्रकार के पैटर्न को प्रायः ABCABC... लिखा जाता है। इस संरचना को घनीय निविड संकुलित संरचना (ccp) अथवा फलक केंद्रित घनीय (fcc) संरचना कहा जाता है। धातु, जैसे – ताँबा तथा चाँदी इस संरचना में क्रिस्टलित होते हैं।
ये दोनों प्रकार के निविड संकुलन अति उच्च क्षमता वाले होते हैं और क्रिस्टल का 74% स्थान संपूरित रहता है। इन दोनों में, प्रत्येक गोला बारह गोलों के संपर्क में रहता है। इस प्रकार इन दोनों संरचनाओं में उपसहसंयोजन संख्या 12 है।
1.6.1 यौगिक का सूत्र और संपूरित रिक्तियों की संख्या
हमने इससे पहले के खंड में सीखा कि जब कणों के निविड संकुलन से ccp अथवा hcp संरचना बनती है तो दो प्रकार की रिक्तियाँ जनित होती हैं तथा जालक में उपस्थित अष्टफलकीय रिक्तियों की संख्या निविड संकुलित कणों की संख्या के बराबर होती है, जबकि जनित चतुष्फलकीय रिक्तियों की संख्या इस संख्या की द्विगुनी होती है। आयनी ठोसों में बृहत आयन (साधारणतः ऋणायन) निविड संकुलित संरचना बनाते हैं और लघुतर आयन (साधारणतः धनायन) रिक्तियों में भरते हैं। यदि धनायन पर्याप्त लघु हों तब चतुष्फलकीय रिक्तियाँ और यदि वृहत हों तो अष्टफलकीय रिक्तियाँ अध्यासित होती हैं। सभी चतुष्फलकीय अथवा अष्टफलकीय रिक्तियाँ अध्यासित नहीं होती। किसी दिए गए यौगिक में अष्टफलकीय अथवा चतुष्फलकीय रिक्तियों का अध्यासित होने वाला अंश यौगिक के रासायनिक सूत्र पर निर्भर करता है, जिसे निम्नलिखित उदाहरणों में देखा जा सकता है।
उदाहरण 1.1
एक यौगिक दो तत्वों X और Y से निर्मित है। Y तत्व के परमाणुओं (ऋणायन) से ccp बनता है और X तत्व के परमाणु (धनायन) सभी अष्टफलकीय रिक्तियों में भरे होते हैं। यौगिक का सूत्र क्या है?
हल
ccp जालक, तत्व Y से बनता है, जनित अष्टफलकीय रिक्तियों की संख्या उसमें उपस्थित Y परमाणुओं की संख्या के बराबर होगी। चूँकि सभी अष्टफलकीय रिक्तियाँ तत्व X के परमाणुओं से अध्यासित हैं, उनकी संख्या भी तत्व Y के परमाणुओं की संख्या के बराबर होगी। इस प्रकार तत्व X और Y के परमाणु बराबर संख्या अथवा 1:1 अनुपात में उपस्थित हैं। अतः यौगिक का सूत्र XY है।
उदाहरण 1.2
तत्व B के परमाणुओं से hcp जालक बनता है और तत्व A के परमाणु 2/3 चतुष्फलकीय रिक्तियों को भरते हैं। A और B तत्वों द्वारा बनने वाले यौगिक का सूत्र क्या है?
हल
जालक में बनने वाली चतुष्फलकीय रिक्तियों की संख्या तत्व B के परमाणुओं की संख्या के दोगुने के बराबर होगी। केवल 2/3 रिक्तियाँ ही तत्व A के परमाणुओं से अध्यासित हैं। अतः A और B परमाणुओं की संख्या का अनुपात 2 × (2/3):1 अथवा 4:3 है इसलिए यौगिक का सूत्र A4B3 है।
1.7 संकु लन क्षमता
अवयवी कणों (परमाणुओं, अणुओं अथवा आयनों) के किसी भी प्रकार से संकुलित होने पर, रिक्तियों के रूप में कुछ मुक्त स्थान सर्वदा रहता है। संकुलन क्षमता कुल उपलब्ध स्थान का वह प्रतिशत है जो कणों द्वारा संपूरित होता है। आइए, हम विभिन्न प्रकार की संरचनाओं में संकुलन क्षमता का परिकलन करें।
1.7.1 hcp और ccp संरचनाओं में संकुलन क्षमता
दोनाें प्रकार के निविड संकुलन (hcp और ccp) समान क्षमता वाले हैं। आइए, ccp संरचना में संकुलन क्षमता का परिकलन करें। चित्र 1.24 में, यदि एकक कोष्ठिका के कोर (Edge या किनारा) की लंबाई 'a' हो तथा फलक विकर्ण AC = b हो, तो
चतुष्फलकीय और अष्टफलकीय रिक्तियों का स्थान निर्धारित करना
हम जानते हैं कि निविड संकुलित संरचनाओं में चतुष्फलकीय और अष्टफलकीय, दोनों प्रकार की रिक्तियाँ होती हैं। आइए, हम ccp (अथवा fcc) संरचना लेकर उसमें इन रिक्तियों का स्थान निर्धारित करते हैं।
(क) चतुष्फलकीय रिक्तियों का स्थान निर्धारित करना
आइए, हम ccp अथवा fcc जालक की एकक कोष्ठिका पर विचार करते हैं (चित्र 1 क)। एकक कोष्ठिका को आठ लघु घनों में विभाजित करते हैं।
चित्र 1– (क) ccp संरचना के प्रति एकक कोष्ठिका में 8 चतुष्फलकीय रिक्तियाँ
(ख) एक चतुष्फलकीय रिक्ति ज्यामिती प्रदर्शित करते हुए।
चित्र 2– ccp अथवा fcc जालक में प्रति एकक कोष्ठिका में अष्टफलकीय रिक्तियों की स्थिति का निर्धारण
(क) घन के अंतःकेंद्र पर
(ख) प्रत्येक कोर (edge) के केंद्र पर (केवल एक एेसी रिक्ति को प्रदर्शित किया गया है)
प्रत्येक लघु घन में परमाणु एकांतर कोनों पर हैं (चित्र 1 क)। कुल मिलाकर, प्रत्येक लघु घन में 4 परमाणु हैं। एक-दूसरे से जोड़ने पर यह एक समचतुष्फलक बनाते हैं। इस प्रकार प्रत्येक लघु घन में एक चतुष्फलकीय रिक्ति है और कुल आठ चतुष्फलकीय रिक्तियाँ हैं। ccp संरचना के एक एकक कोष्ठिका के आठों लघु घनों में से प्रत्येक में एक रिक्ति है। हम जानते हैं कि ccp संरचना में प्रति एकक कोष्ठिका में 4 परमाणु होते हैं। इस प्रकार चतुष्फलकीय रिक्तियों की संख्या परमाणुओं की संख्या से दोगुनी होती है।
(ख) अष्टफलकीय रिक्तियों का स्थान निर्धारित करना
अब हम पुनः ccp अथवा fcc जालक की एकक कोष्ठिका पर विचार करते हैं (चित्र 2 क)। घन का अंतःकेंद्र अध्यासित नहीं है लेकिन यह फलक केंद्रों पर स्थित छः परमाणुओं से घिरा है। यदि इन फलक केंद्रों को जोड़ा जाए तो एक अष्टफलक जनित होता है। अतः इस एकक कोष्ठिका में एक अष्टफलकीय रिक्ति घन के अंतः केंद्र पर है।
अंतः केंद्र के अतिरिक्त, 12 किनारों में से प्रत्येक के केंद्र में एक अष्टफलकीय रिक्ति है (चित्र 2 ख)। यह छः परमाणुओं से घिरा रहता है, जिनमें चार उसी एकक कोष्ठिका से (2 कोनों पर और 2 फलक केंद्र पर) और दो निकटवर्ती एकक कोष्ठिकाओं से संबंधित होते हैं। चूँकि घन का प्रत्येक किनारा चार निकटवर्ती एकक कोष्ठिकाओं के मध्य सहभाजित होता है, इसी प्रकार उस पर स्थित अष्टफलकीय रिक्ति भी सहभाजित होती है। प्रत्येक रिक्ति का केवल 1/4 भाग ही एक विशिष्ट एकक कोष्ठिका से संबंधित होता है। इस प्रकार घनीय सुसंकुलित संरचना में घन के अंतः केंद्र पर अष्टफलकीय रिक्ति = 1
12 अष्टफलकीय रिक्तियाँ प्रत्येक किनारे पर स्थित हैं और चार एकक कोष्ठिकाओं के मध्य सहभाजित हैं =
कुल अष्टफलकीय रिक्तियों की संख्या = 4
हम जानते हैं कि ccp संरचना में प्रत्येक एकक कोष्ठिका में 4 परमाणु होते हैं। इस प्रकार अष्टफलकीय रिक्तियों की संख्या इस संख्या के बराबर है।
△ ABC में,
AC2 = b2 = BC2 + AB2
= a2+a2 = 2a2
या b = 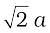
यदि गोले का अर्धव्यास r हो, तो
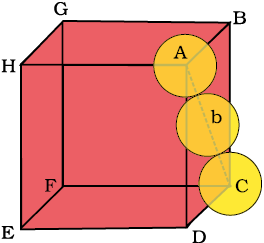
चित्र 1.24– घनीय निविड संकुलित संरचना स्पष्ट करने हेतु दूसरे कोरों में गोलकों को नहीं रखा गया है।
b = 4r = 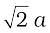
या a = 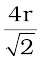 = 2
= 2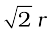
(हम एेसे भी लिख सकते हैं, 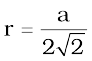 )
)
हम जानते हैं कि ccp संरचना में प्रभावी रूप से, प्रति एकक कोष्ठिका 4 गोले होते हैं। चार गोलों का कुल आयतन 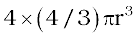 के बराबर होता है और घन का आयतन a3 या
के बराबर होता है और घन का आयतन a3 या 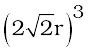 होता है। अतः
होता है। अतः
1.7.2 अंतःकेंद्रित धनीय संरचनाओं में संकुलन क्षमता
चित्र 1.25 से यह स्पष्ट है कि केंद्र पर स्थित परमाणु विकर्ण पर व्यवस्थित अन्य दो परमाणुओं के संपर्क में हैं।
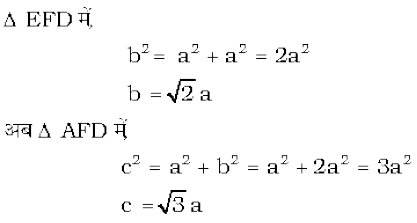
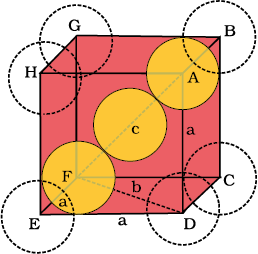
चित्र 1.25– अंत्य-केंद्रित घनीय एकक कोष्ठिका (काय विकर्ण पर उपस्थित गोलों को ठोस परिसीमा द्वारा दर्शाया गया है)।
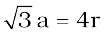
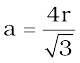
अतः यह भी लिख सकते हैं कि, 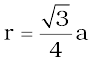
इस प्रकार की संरचना में परमाणु की कुल संख्या 2 है तथा उनका आयतन 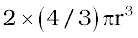 है
है
घन का आयतन a3, 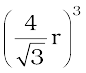 के बराबर होगा अथवा
के बराबर होगा अथवा 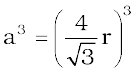 अतः
अतः
1.7.3 सरल घनीय जालक में संकुलन क्षमता
एक सरल घनीय जालक में परमाणु केवल घन के कोनों पर उपस्थित होते हैं। घन के किनारों (कोरों) पर कण एक-दूसरे के सम्पर्क में होते हैं। (चित्र 1.26)।
चित्र 1.26– सरल घनीय एकक कोष्ठिका। घन के कोर की दिशा में गोले एक-दूसरे के संपर्क में हैं।
इसलिए घन के कोर अथवा भुजा की लंबाई 'a' और प्रत्येक कण का अर्धव्यास, r निम्न प्रकार से संबंधित है –
a = 2r
घनीय एकक कोष्ठिका का आयतन = a3 = (2r)3 = 8r3
चूँकि सरल घनीय एकक कोष्ठिका में केवल 1 परमाणु होता है। अतः
अध्यासित दिक्स्थान का आयतन = 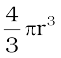
= 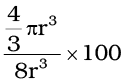
= 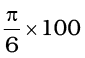
= 52.36% = 52.4 %
इस प्रकार हम निष्कर्ष निकाल सकते हैं कि ccp और hcp संरचनाओं में अधिकतम संकुलन क्षमता है।
1.8 एकक कोष्ठिका विमा संबंधी गणनाएं
एकक कोष्ठिका विमाओं की सहायता से एकक कोष्ठिका के आयतन की गणना करना संभव है। धातु का घनत्व ज्ञात होने पर हम एकक कोष्ठिका के परमाणुओं के द्रव्यमान की गणना कर सकते हैं। एक परमाणु का द्रव्यमान ज्ञात होने पर आवोगाद्रो स्थिरांक का मान प्राप्त करने की परिशुद्ध विधि मिल जाती है। माना कि एक्स-किरण विवर्तन से ज्ञात घनीय क्रिस्टल की एकक कोष्ठिका के कोर की लंबाई a, ठोस पदार्थ का घनत्व d तथा मोलर द्रव्यमान M है। तब घनीय क्रिस्टल में –
एकक कोष्ठिका का आयतन = a3
(यहाँ z एक एकक कोष्ठिका में उपस्थित परमाणुओं की संख्या है तथा m एक परमाणु का द्रव्यमान है।)
एकक कोष्ठिका में उपस्थित एक परमाणु का द्रव्यमान –
m (M मोलर द्रव्यमान है)
याद रहे कि एकक कोष्ठिका एवं पदार्थ का घनत्व बराबर होता है। ठोस पदार्थ का घनत्व अन्य विधियों से भी निकाला जा सकता है। पाँच पैरामीटरों (d, z, M, a, तथा NA) में से यदि कोई भी चार ज्ञात हों, तो पाँचवें को ज्ञात किया जा सकता है।
उदाहरण 1.3
हल
एक तत्व की कोष्ठिका की संरचना अंतःकेंद्रित घन (bcc) है कोष्ठिका के कोर की लंबाई 288 pm है तथा तत्व का घनत्व 7.2 g/cm3 है। ज्ञात कीजिए कि 208 ग्राम तत्व में कितने परमाणु हैं?
एकक कोष्ठिका का आयतन = (288 pm)3 = (288×10−12 m)3
= (288×10−10 cm)3
= 2.39×10−23 cm3
= 12.08×1023 एकक कोष्ठिकाएं
चूँकि प्रत्येक bcc एकक कोष्ठिका में 2 परमाणु होते हैं अतः 208 ग्राम तत्व में
परमाणुओं की संख्या = 2 (परमाणु/एकक कोष्ठिका) × 12.08×1023 एकक कोष्ठिका
= 24.16×1023 परमाणु
उदाहरण 1.4
एक्स-किरण विवर्तन अध्ययन द्वारा पता चला कि ताँबा 3.608×10−8 कोष्ठिका कोर के साथ fcc एकक कोष्ठिका के रूप में क्रिस्टलीकृत होता है। एक दूसरे प्रयोग में ताँबे का घनत्व 8.92 g/cm3 ज्ञात किया गया। ताँबे के परमाण्विक द्रव्यमान ज्ञात कीजिए।
हल
fcc जालक में प्रति एकक कोष्ठिका परमाणुओं की संख्या, z = 4
ताँबे का परमाण्विक द्रव्यमान = 63.1u
उदाहरण 1.5
सिल्वर ccp जालक बनाता है। एक्स-किरण विवर्तन अध्ययन द्वारा पता चला कि इसकी एकक कोष्ठिका के कोर की लंबाई 408.6 pm है। सिल्वर के घनत्व की गणना कीजिए। (परमाण्विक द्रव्यमान = 107.9 u)
हल
चूँकि ccp जालक में प्रति एकक कोष्ठिका में सिल्वर परमाणुओं की संख्या, z = 4
सिल्वर का मोलर द्रव्यमान = 107.9 g mol-1 = 107.9×10−3 kg mol-1
एकक कोष्ठिका के कोर की लंबाई = a = 408.6 pm = 408.6×10-12 m
पाठ्यनिहित प्रश्न
1.13 एक अणु की वर्ग निविड संकुलित परत में द्विविमीय उपसहसंयोजन संख्या क्या है?
1.14 एक यौगिक षट्कोणीय निविड संकुलित संरचना बनाता है। इसके 0.5 मोल में कुल रिक्तियों की संख्या कितनी है? उनमें से कितनी रिक्तियाँ चतुष्फलकीय हैं?
1.15 एक यौगिक, दो तत्वों M और N से बना है। तत्व N, ccp संरचना बनाता है और M के परमाणु चतुष्फलकीय रिक्तियों के 1/3 भाग को अध्यासित करते हैं। यौगिक का सूत्र क्या है?
1.16 निम्नलिखित में से किस जालक में उच्चतम संकुलन क्षमता है?
(i) सरल घनीय, (ii) अंतः केंद्रित घन और (iii) षट्कोणीय निविड संकुलित जालक
1.17 एक तत्व का मोलर द्रव्यमान 2.7×10−2 kg mol−1 है, यह 405 pm लंबाई की भुजा वाली घनीय एकक कोष्ठिका बनाता है। यदि उसका घनत्व 2.7×103 kg m−3 है तो घनीय एकक कोष्ठिका की प्रकृति क्या है?
1.9 ठोसों में अपूर्णताएं
यद्यपि क्रिस्टलीय ठोसों के अवयवी कणों की व्यवस्था में लघु परास के साथ-साथ दीर्घ परास क्रम भी होता है, फिर भी क्रिस्टल परिपूर्ण नहीं होते। साधारणतः ठोस अत्यधिक संख्या में लघु क्रिस्टलों का पुंज होता है। इन लघु क्रिस्टलों में दोष होते हैं। यह तब होता है जब क्रिस्टलीकरण की प्रक्रिया तीव्र अथवा साधारण गति से होती है। जब क्रिस्टलीकरण की प्रक्रिया अत्यंत मंद गति से होती है तब एकल क्रिस्टल बनता है। ये क्रिस्टल भी दोषमुक्त नहीं होते। ये दोष मूलतः अवयवी कणों की व्यवस्था में अनियमितताएं हैं। व्यापक रूप से ये दोष दो प्रकार के होते हैं यानी बिंदु दोष और रेखीय दोष । एक क्रिस्टलीय पदार्थ में एक बिंदु अथवा एक परमाणु के चारों ओर की आदर्श व्यवस्था में अनियमितताएं अथवा विचलन, बिंदु दोष होते हैं, जबकि जालक बिंदुओं की पूर्ण पंक्तियों की आदर्श व्यवस्था में अनियमितताएं अथवा विचलन रेखीय दोष होते हैं। इन अनियमितताओं को क्रिस्टल दोष कहते हैं। हम अपना विवेचन केवल बिंदु दोष तक ही सीमित रखेंगे।
1.9.1 बिंदु दोषों के प्रकार
बिंदु दोषों को तीन प्रकारों में वर्गीकृत किया जा सकता है -
(क) स्टॉइकियोमीट्री दोष (ख) अशुद्धता दोष और (ग) नानस्टॉइकियोमीट्री दोष।
(क) स्टॉइकियोमीट्री दोष
ये वे बिंदु दोष हैं जो ठोस की स्टॉइकियोमीट्री को विक्षुब्ध नहीं करते। इन्हें आंतर अथवा ऊष्मागतिकी दोष भी कहा जाता है। आधारभूत रूप से यह दो प्रकार के होते हैं। रिक्तिका दोष और अंतराकाशी दोष।
(i) रिक्तिका दोष – जब कुछ जालक स्थल रिक्त हों, तब कहा जाता है कि क्रिस्टल में रिक्तिका दोष है (चित्र 1.27)। यह पदार्थ के घनत्व को कम कर देता है। पदार्थ को गरम करने पर भी इस प्रकार का दोष उत्पन्न हो सकता है।
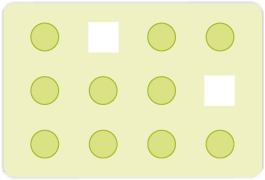
चित्र 1.27– रिक्तिका दोष
(ii) अंतराकाशी दोष – जब कुछ अवयवी कण (परमाणु अथवा अणु) अंतराकाशी स्थल पर पाए जाते हैं, तब कहा जाता है कि क्रिस्टल में अंतराकाशी दोष है (चित्र 1.28) यह दोष पदार्थ के घनत्व को बढ़ाता है। ऊपर समझाए गए रिक्तिका और अंतराकाशी दोष अनआयनिक (non-ionic) ठोसों में दिखाई पड़ते हैं। आयनिक ठोसों में सदैव विद्युत उदासीनता बनी रहनी चाहिए। यह इन दोषों को सरल रिक्तिका अथवा अंतराकाशी दोषों की बजाय, फ्रेंकेल और शॉट्की दोषों की तरह दिखाते हैं।
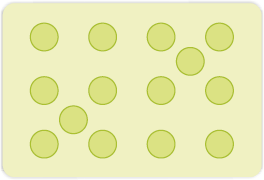
चित्र 1.28– अंतराकाशी दोष
(iii) फ्रेंकेल दोष – यह दोष आयनिक ठोसों द्वारा दिखाया जाता है। लघुतर आयन (साधारणतः धनायन) अपने वास्तविक स्थान से विस्थापित होकर अन्तराकाश स्थान में चला जाता है (चित्र 1.29)। यह वास्तविक स्थान पर रिक्तिका दोष और नए स्थान पर अंतराकाशी दोष उत्पन्न करता है। फ्रेंकेल दोष को विस्थापन दोष भी कहते हैं। यह ठोस के घनत्व को परिवर्तित नहीं करता। फ्रेंकेल दोष उन आयनिक पदार्थ द्वारा दिखाया जाता है जिनमें आयनों के आकार में अधिक अंतर होता है, उदाहरण के लिए ZnS, AgCl, AgBr और AgI में यह दोष Zn2+ और Ag+ आयन के लघु आकार के कारण होता है।

चित्र 1.29– फ्रेंकेल दोष
(iv) शॉट्की दोष – यह आधारभूत रूप से आयनिक ठोसों का रिक्तिका दोष है। विद्युत उदासीनता को बनाए रखने के लिए लुप्त होने वाले धनायनों और ऋणायनों की संख्या बराबर होती है (चित्र 1.30)।

चित्र 1.30– शॉट्की दोष
सरल रिक्तिका दोष की भाँति, शॉट्की दोष भी पदार्थ के घनत्व को घटाता है। आयनिक ठोसों में एेसे दोषों की संख्या निश्चित रूप से महत्वपूर्ण है। उदाहरण के लिए NaCl में कमरे के ताप पर लगभग 106 शॉट्की युगल प्रति cm3 होते हैं। एक cm3 में करीब 1022 आयन होते हैं। इस प्रकार प्रति 1016 आयनों में एक शॉट्की दोष होता है। शॉट्की दोष उन आयनिक पदार्थों द्वारा दिखाया जाता है जिनमें धनायन और ऋणायन लगभग समान आकार के होते हैं। उदाहरण के लिए NaCl, KCl, CsCl और AgBr. यह ध्यान देने योग्य है कि AgBr फ्रेंकेल तथा शॉट्की दोनों ही दोष दिखाता है।
(ख) अशुद्धता दोष
यदि अल्प मात्रा में SrCl2 युक्त गलित NaCl को क्रिस्टलीकृत किया जाए, तो Na+ के कुछ स्थान Sr2+ द्वारा घेर लिए जाते हैं (चित्र 1.31)। प्रत्येक Sr2+ दो Na+ आयनों को प्रतिस्थापित करता है। यह एक आयन का स्थान ग्रहण करता है और दूसरा स्थान रिक्त रहता है। इस प्रकार उत्पन्न धनायन रिक्तिकाओं की संख्या Sr2+ आयनों की संख्या के बराबर होती है। दूसरा इसी प्रकार का उदाहरण CdCl2 तथा AgCl का ठोस विलयन है।
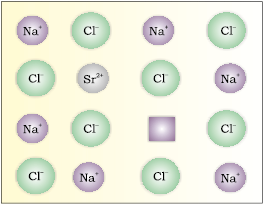
चित्र 1.31– NaCl में Na+ के Sr2+ द्वारा प्रतिस्थापन से धनायन रिक्तिका उत्पन्न होना
(ग) नानस्टॉइकियोमीट्री दोष
अब तक वर्णित दोष क्रिस्टलीय पदार्थ की स्टॉइकियोमीट्री को विक्षुब्ध नहीं करते फिर भी अत्यधिक संख्या में नानस्टॉइकियोमीट्री अकार्बनिक ठोस ज्ञात हैं, जिनमें क्रिस्टल संरचनाओं में दोष के कारण अवयवी तत्व नानस्टॉइकियोमीट्री अनुपात में पाए जाते हैं। ये दोष दो प्रकार के होते हैं– (i)धातु आधिक्य दोष एवं (ii) धातु न्यूनता दोष
(i) धातु आधिक्य दोष
- ऋणायनिक रिक्तिका के कारण धातु आधिक्य दोष - क्षारकीय हैलाइड, जैसे NaCl और KCl, इस प्रकार का दोष दर्शाते हैं। जब NaCl के क्रिस्टल को सोडियम वाष्प के वातावरण में गरम किया जाता है, तो सोडियम परमाणु क्रिस्टल की सतह पर जम जाते हैं। Cl- आयन क्रिस्टल की सतह में विसरित हो जाते हैं और Na परमाणुओं के साथ जुड़कर NaCl देते हैं। एेसा Na+ आयन बनाने के लिए Na परमाणु से एक इलेक्ट्रॉन के निकल जाने से होता है। निर्मुक्त इलेक्ट्रॉन विसरित होकर क्रिस्टल के ऋणायनिक स्थान को अध्यासित करते हैं (चित्र 1.32)। परिणामस्वरूप अब क्रिस्टल में सोडियम का आधिक्य होता है। अयुग्मित इलेक्ट्रॉनों द्वारा भरी ऋणायनिक रिक्तिकाओं को F-केंद्र कहते हैं (रंग केंद्र के लिए जर्मन शब्द फारबेनज़ेनटर से)। ये NaCl के क्रिस्टलों को पीला रंग प्रदान करते हैं। यह रंग, इन इलेक्ट्रॉनों द्वारा क्रिस्टल पर पड़ने वाले प्रकाश से ऊर्जा अवशोषित करके उत्तेजित होने के परिणामस्वरूप दिखता है। इसी प्रकार लीथियम का आधिक्य LiCl क्रिस्टल को गुलाबी बनाता है और पोटैशियम का आधिक्य KCl क्रिस्टल को बैंगनी (अथवा लाइलैक) बनाता है।
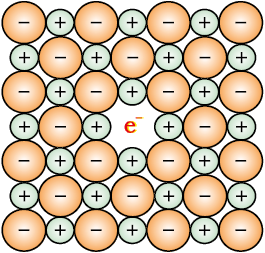
चित्र 1.32– क्रिस्टल में एक F- केंद्र
- अतिरिक्त धनायनों की अंतराकाशी स्थलों पर उपस्थिति से धातु आधिक्य दोष – कमरे के ताप पर ज़ि्ांक अॉक्साइड सफ़ेद रंग का होता है। गरम करने पर इसमें से अॉक्सीजन निकलती है तथा यह पीले रंग का हो जाता है।
अब क्रिस्टल में ज़ि्ांक का आधिक्य होता है तथा इसका सूत्र Zn1+xO बन जाता है। आधिक्य में उपस्थित Zn2+ आयन अंतराकाशी स्थलों में, और इलेक्ट्रॉन निकटवर्ती अंतराकाशी स्थलों में चले जाते हैं।
(ii) धातु न्यूनता दोष – कई एेसे भी ठोस हैं जिन्हें स्टॉइकियोमीट्री संघटन में बनाना कठिन होता है एवं इनमें स्टॉइकियोमीट्री अनुपात की तुलना में धातु की मात्रा कम होती है। इस प्रकार का एक विशिष्ट उदाहरण FeO है यह अधिकतर Fe0.95O संघटन में पाया जाता है। यह वास्तव में Fe0.93O से Fe0.96O की परास में हो सकता है। FeO के क्रिस्टल में से कुछ Fe2+ धनायन लुप्त हो जाते हैं और धनावेश की क्षतिपूर्ति Fe3+ आयनों की आवश्यक संख्या से हो जाती है।
1.10 विद्युतीय गुण
ठोस विद्युत चालकता में अद्भुत विविधता दर्शाते हैं जिनके परिमाणों का परास 10–20 से लेकर 107 ohm-1 m-1 तक लगभग 27 कोटियों में फैला होता है। चालकता के आधार पर ठोसों को तीन वर्गों में वर्गीकृत किया जा सकता है।
(i) चालक
वे ठोस जिनकी चालकता का परास 104 से 107 ohm-1 m-1 के मध्य हो चालक कहलाते हैं। धातुओं की चालकता की कोटि 107ohm-1 m-1 होती है और ये उत्तम चालक होते हैं।
(ii) विद्युतरोधी
ये वे ठोस हैं जिनकी चालकता बहुत कम, 10-20 से 10-10 ohm-1 m-1 के परास के मध्य होती है।
(iii) अर्धचालक
ये वे ठोस होते हैं जिनकी चालकता 10-6 से 104 ohm-1m-1 तक के मध्यवर्ती परास में होती है।
1.10.1 धातुओं में विद्युत चालन
चालकों में विद्युत का चालन इलेक्ट्रॉनों अथवा आयनों के गमन द्वारा होता है। धात्विक चालक पहले संवर्ग में (इलेक्ट्रॅानों द्वारा चालन) और विद्युतअघट्य पिछले संवर्ग (आयनों द्वारा चालन) में आते हैं।
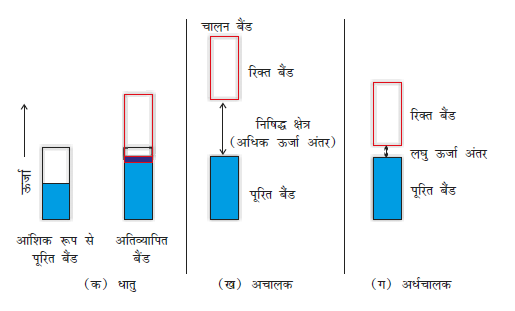
धातु ठोस एवं गलित दोनों अवस्थाओं में विद्युत का चालन करती हैं। धातुओं की चालकता प्रति परमाणु संयोजी इलेक्ट्रॉनों की संख्या पर निर्भर करती है। धातु परमाणुओं के परमाण्विक कक्षकों से आण्विक कक्षक बनते हैं जिनकी ऊर्जा इतनी पास-पास होती है कि वे बैंड बना लेते हैं। यदि यह बैंड आंशिक रूप से भरा हो अथवा यह एक उच्च ऊर्जा वाले रिक्त चालकता बैंड के साथ अतिव्यापन करता हो तो विद्युत क्षेत्र में इलेक्ट्रॉन आसानी से प्रवाहित हो सकते हैं जिससे धातु चालकता दर्शाती है (चित्र 1.33 क)।
यदि पूरित संयोजक बैंड एवं आगामी उच्च रिक्त बैंड (चालकता बैंड) के मध्य अंतराल अधिक होता है तो इलेक्ट्रॉन उसमें नहीं लाँघ सकते और एेसे पदार्थों की चालकता बहुत कम होती है तथा यह एक विद्युतरोधी के समान व्यवहार करते हैं (चित्र 1.33 ख)।
1.10.2 अर्धचालकों में विद्युत चालन
अर्धचालकों में संयोजक बैंड एवं चालक बैंड के मध्य अंतराल कम होता है (चित्र 1.33 ग)। अतः कुछ इलेक्ट्रॉन चालक बैंड में लाँघ सकते हैं और अल्प चालकता दिखा सकते हैं। ताप बढ़ने के साथ अर्धचालकों में विद्युत् चालकता बढ़ती है, क्योंकि अधिक संख्या में इलेक्ट्रॉन चालक बैंड में जा सकते हैं। सिलिकन एवं जमैनियम जैसे पदार्थ इस प्रकार का व्यवहार प्रदर्शित करते हैं तथा इन्हें नैज-अर्धचालक (Intrinsic-semiconductors) कहते हैं।
चित्र 1.33– (क) धातुओं,
(ख) चालकता रोधियों एवं
(ग) अर्धचालकों में विभेद, प्रत्येक श्रेणी में रंगरहित (अनशेडेड) क्षेत्र चालकता बैंड को दर्शाता है।
इन नैज-अर्धचालकों की चालकता व्यवहारिक उपयोग के लिए बहुत ही कम होती है। उचित अशुद्धि को उपयुक्त मात्रा में मिलाने से इनकी चालकता बढ़ जाती है। इस विधि को अपमिश्रण कहते हैं। अपमिश्रण उस अशुद्धि द्वारा किया जा सकता है जो नैज-अर्धचालक सिलिकन अथवा जमैनियम की तुलना में इलेक्ट्रॉन धनी या इलेक्ट्रॉन न्यून हो। एेसी अशुद्धियों से उनमें इलेक्ट्रॉनीय दोष उत्पन्न हो जाता है।
(क) इलेक्ट्रॉन-धनी अशुद्धियाँ
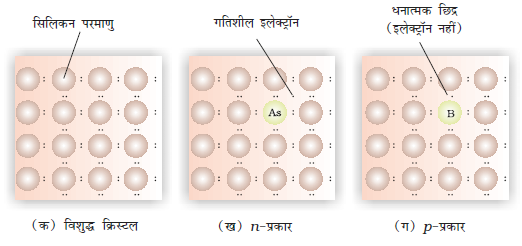
सिलिकन और जमैनियम आवर्तसारणी के चौदहवें वर्ग से संबंधित हैं और प्रत्येक में चार संयोजक इलेक्ट्रॉन हैं। क्रिस्टलों में इनका प्रत्येक परमाणु अपने निकटस्थ परमाणुओं के साथ चार सहसंयोजक बंध बनाता है (चित्र 1.34 क)। जब पंद्रहवें वर्ग के तत्व जैसे P अथवा As, जिनमें पाँच संयोजक इलेक्ट्रॉन होते हैं, को अपमिश्रित किया जाता है, तो यह सिलिकन अथवा जमैनियम के क्रिस्टल में कुछ जालक स्थलों में आ जाते हैं (चित्र 1.34 ख)। पाँच में से चार इलेक्ट्रॉनों का उपयोग चार सन्निकट सिलिकन परमाणुओं के साथ चार सहसंयोजक बंध बनाने में होता है। पाँचवाँ अतिरिक्त इलेक्ट्रॉन विस्थानित हो जाता है। यह विस्थानित इलेक्ट्रॉन अपमिश्रित सिलिकन (अथवा जमैनियम) की चालकता में वृद्धि करते हैं। यहाँ चालकता में वृद्धि ऋणावेशित इलेक्ट्रॉन के कारण होती है, अतः इलेक्ट्रॉन-धनी अशुद्धि से अपमिश्रित सिलिकन को n-प्रकार का अर्धचालक कहा जाता है।
(ख) इलेक्ट्रॉन-न्यून अशुद्धियाँ
सिलिकन अथवा जरमेनियम को वर्ग 13 के तत्वों जैसे B, Al अथवा Ga के साथ भी अपमिश्रित किया जा सकता है जिनमें केवल तीन संयोजक इलेक्ट्रॉन होते हैं। वह स्थान जहाँ चौथा इलेक्ट्रॉन नहीं होता, इलेक्ट्रॉन रिक्ति या इलेक्ट्रॉन छिद्र कहलाता है (चित्र 1.34 ग)। निकटवर्ती परमाणु से इलेक्ट्रॉन आकर इलेक्ट्रॉन छिद्र को भर सकता है, परंतु एेसा करने पर वह अपने मूल स्थान पर इलेक्ट्रॉन छिद्र छोड़ जाता है। यदि एेसा हो तो यह प्रतीत होगा जैसे कि इलेक्ट्रॉन छिद्र, जिस इलेक्ट्रॉन द्वारा यह भरा गया है उसके विपरीत दिशा में चल रहा है। विद्युत क्षेत्र के प्रभाव में इलेक्ट्रॉन, इलेक्ट्रॉन छिद्रों में से धनावेशित प्लेट की ओर चलेंगे, परंतु एेसा प्रतीत होगा; जैसे इलेक्ट्रॉन छिद्र धनावेशित हैं और ऋणावेशित प्लेट की ओर चल रहे हैं। इस प्रकार के अर्धचालकों को p- प्रकार के अर्धचालक कहते हैं।
चित्र 1.34– वर्ग 13 और 15 के तत्वों को अपमिश्रित करके n-और p- प्रकार के अर्धचालकों की सृष्टि
n- प्रकार और p- प्रकार के अर्धचालकों के अनुप्रयोग
n- प्रकार और p- प्रकार के अर्धचालकों के विभिन्न संयोजनों को इलेक्ट्रॉनिक अवयव बनाने में उपयोग किया जाता है। डायोड n- प्रकार और p- प्रकार के अर्धचालकों का एक संयोजन है और परिशोधक के रूप में उपयोग किया जाता है। ट्रांज़िस्टर एक प्रकार के अर्धचालक की परत को अन्य प्रकार के अर्धचालक की दो परतों के मध्य अंतदबिन (सैंडविच) करके बनाए जाते हैं। npn और pnp प्रकार के ट्रांज़िस्टरों को रेडियो अथवा श्राव्य संकेतों के पहचान और प्रवर्धन में उपयोग किया जाता है। सौर सेल एक दक्ष फोटो-डायोड है जिसका उपयोग प्रकाश-ऊर्जा को विद्युत-ऊर्जा में बदलने के लिए किया जाता है।
जमैनियम तथा सिलिकन वर्ग 14 के तत्व हैं अतः इनकी अभिलाक्षणिक संयोजकता चार है तथा चार बंध बनते हैं, जैसे हीरे में। वर्ग 13 एवं 15 अथवा वर्ग 12 तथा 16 के तत्वों के सम्मिश्रण से अनेक प्रकार के ठोस पदार्थ बनाए गए हैं जिनकी औसत संयोजकता Ge या Si के समान चार है। इनमें से वर्ग 13 –15 के विशिष्ट यौगिक InSb, AlP तथा GaAs हैं। गैलियम आर्सेनाइड (GaAs) अर्द्धचालक त्वरित प्रतिसंवेदी होते हैं; इन्होंने अर्द्धचालक युक्तियों के निर्माण में क्रांतिकारी हलचल ला दी है। ZnS, CdS, CdSe तथा HgTe, वर्ग 12 –16 के यौगिकों के उदाहरण हैं। इन यौगिकों में बंध पूर्णतया सहसंयोजक नहीं होते तथा इनके आयनिक गुण इनमें उपस्थित दोनों तत्वों की विद्युत ऋणात्मकता पर निर्भर करते हैं।
यह जानना बहुत रोचक होगा कि संक्रमण धातु अॉक्साइडों के वैद्युतीय गुणों में बहुत अधिक अंतर होता है। TiO, CrO2 तथा ReO3 धातु के समान व्यवहार करते हैं। चालकता में तथा दिखने में ReO3 कॉपर धातु की तरह प्रतीत होता है। कुछ अन्य अॉक्साइड जैसे VO, VO2 VO3 तथा TiO3 के धात्विक एवं रोधी गुण ताप पर निर्भर होते हैं।
1.11 चुंबकीय गुण
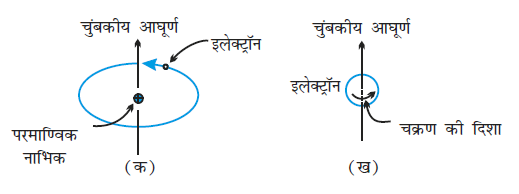
सभी पदार्थों के साथ कुछ चुंबकीय गुण संबंधित होते हैं। इन गुणों की उत्पति इलेक्ट्रॉनों के कारण होती है। एक परमाणु में प्रत्येक इलेक्ट्रॉन एक सूक्ष्म चुंबक की तरह व्यवहार करता है। उसका चुंबकीय आघूर्ण दो प्रकार की गतियों से उत्पन्न होता है (i) उसकी नाभिक के चारों ओर कक्षक गति और (ii) उसका अपने अक्ष पर चारों ओर चक्रण (चित्र 1.35)।
चित्र 1.35– (क) इलेक्ट्रॉन की कक्षीय गति,
(ख) इलेक्ट्रॉन की चक्रण गति के साथ संयुक्त चुंबकीय आघूर्ण का निदर्शन
इलेक्ट्रॉन एक आवेशित कण होने के कारण एवं इस प्रकार की गतियों के कारण एक छोटे विद्युत परिपथ के रूप में समझा जा सकता है जिसमें चुंबकीय आघूर्ण पाया जाता है। इस प्रकार प्रत्येक इलेक्ट्रॉन के साथ स्थायी चक्रण और कक्षक चुंबकीय आघूर्ण संयुक्त रहता है। इस चुंबकीय आघूर्ण का परिमाण बहुत कम होता है इसे मापे जाने वाली इकाई को बोर मैग्नेटॉन, µB कहा जाता है। यह 9.27 × 10–24 A m2 के बराबर होता है।
पदार्थों को उनके चुंबकीय गुणों के आधार पर पाँच संवर्गों में वर्गीकृत किया जा सकता है – (i) अनुचुंबकीय (ii) प्रतिचुंबकीय (iii) लोहचुंबकीय (iv) प्रतिलोहचुंबकीय (v) फेरीचुंबकीय
(i) अनुचुंबकत्व
अनुचुंबकीय पदार्थ चुंबकीय क्षेत्र की ओर दुर्बल रूप से आकर्षित होते हैं। ये चुंबकीय क्षेत्र की दिशा में ही चुंबकित हो जाते हैं। ये चुंबकीय क्षेत्र की अनुपस्थिति में अपना चुंबकत्व खो देते हैं। अनुचुंबकत्व का कारण एक अथवा अधिक अयुगलित इलेक्ट्रॉनों की उपस्थिति है, जो कि चुंबकीय क्षेत्र की ओर आकर्षित होते हैं। O2, Cu2+, Fe3+, Cr3+ एेसे पदार्थों के कुछ उदाहरण हैं।
(ii) प्रतिचुंबकत्व
प्रतिचुंबकीय पदार्थ चुंबकीय क्षेत्र से दुर्बल रूप से प्रतिकर्षित होते हैं। H2O, NaCl और C6H6 एेसे पदार्थों के कुछ उदाहरण हैं। ये चुंबकीय क्षेत्र की विपरीत दिशा में दुर्बल रूप से चुंबकित होते हैं। प्रतिचुंबकत्व उन पदार्थों द्वारा दर्शाया जाता है जिनमें सभी इलेक्ट्रॉन युगलित होते हैं और इनमें अयुगलित इलेक्ट्रॉन नहीं हैं। इलेक्ट्रॉनों का युगलित होना उनके चुंबकीय आघूर्ण को आपस में निरस्त कर देता है और वे चुंबकीय गुण नहीं दर्शाते।
(iii) लोहचुंबकत्व
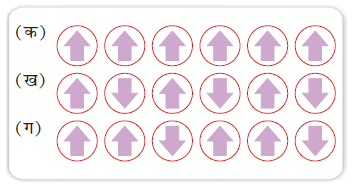
कुछ पदार्थ, जैसे– लोहा, कोबाल्ट, निकैल, गैडोलिनियम और CrO2 बहुत प्रबलता से चुंबकीय क्षेत्र की ओर आकर्षित होते हैं। एेसे पदार्थों को लोहचुंबकीय पदार्थ कहा जाता है। प्रबल आकर्षणों के अतिरिक्त ये स्थायी रूप से चुंबकित किए जा सकते हैं। ठोस अवस्था में, लोहचुंबकीय पदार्थों के धातु आयन छोटे खंडों में एक साथ समूहित हो जाते हैं इन्हें डोमेन कहा जाता है। इस प्रकार प्रत्येक डोमेन एक छोटे चुंबक की तरह व्यवहार करता है। लोहचुंबकीय पदार्थ के अचुंबकीय टुकड़े में डोमेन अनियमित रूप से अभिविन्यासित होते हैं और उनका चुंबकीय आघूर्ण निरस्त हो जाता है। पदार्थ को चुंबकीय क्षेत्र में रखने पर सभी डोमेन चुंबकीय क्षेत्र की दिशा में अभिविन्यासित हो जाते हैं (चित्र 1.36 क) और प्रबल चुंबकीय प्रभाव उत्पन्न होता है। चुंबकीय क्षेत्र को हटा लेने पर भी डोमेनों का क्रम बना रहता है और लौहचुंबकीय पदार्थ स्थायी चुंबक बन जाते हैं।
चित्र 1.36– चुंबकीय आघूर्ण का व्यवस्थित संरेखण (क) लोहचुंबकीय, (ख) प्रतिलोहचुंबकीय और (ग) फेरीचुंबकीय
(iv) प्रतिलोहचुंबकत्व
प्रतिलोहचुंबकत्व प्रदर्शित करने वाले पदार्थ जैसे MnO में डोमेन संरचना लोहचुंबकीय पदार्थ के सदृश होती है, परंतु उनके डोमेन एक दूसरे के विपरीत अभिविन्यासित होते हैं तथा एक दूसरे के चुंबकीय आघूर्ण को निरस्त कर देते हैं (चित्र 1.36 ख)।
(v) फेरीचुंबकत्व
जब पदार्थ में डोमेनो के चुंबकीय आघूर्णों का संरेखण समानांतर एवं प्रतिसमानांतर दिशाओं में असमान होता है तब पदार्थ में फेरीचुंबकत्व देखा जाता है (चित्र 1.36 ग)। ये लौहचुंबकत्व की तुलना में चुंबकीय क्षेत्र द्वारा दुर्बल रूप से आकर्षित होते हैं। Fe3O4,(मैग्नेटाइट) और फेराइट जैसे MgFe2O4, ZnFe2O4 एेसे पदार्थों के उदाहरण हैं। ये पदार्थ भी गरम करने पर फेरीचुंबकत्व खो देते हैं और अनुचुंबकीय बन जाते हैं।
पाठ्यनिहित प्रश्न
1.18 जब एक ठोस को गरम किया जाता है तो किस प्रकार का दोष उत्पन्न हो सकता है? इससे कौन से भौतिक गुण प्रभावित होते हैं और किस प्रकार?
1.19 निम्नलिखित किस प्रकार का स्टॉइकियोमीट्री दोष दर्शाते हैं?
(i) ZnS (ii) AgBr
1.20 समझाइए कि एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएं किस प्रकार प्रविष्ट होती हैं।
1.21 जिन आयनिक ठोसों में धातु आधिक्य दोष के कारण ऋणायनिक रिक्तिका होती हैं, वे रंगीन होते हैं। इसे उपयुक्त उदाहरण की सहायता से समझाइए।
1.22 वर्ग 14 के तत्व को n- प्रकार के अर्धचालक में उपयुक्त अशुद्धि द्वारा अपमिश्रित करके रूपांतरित करना है। यह अशुद्धि किस वर्ग से संबंधित होनी चाहिए?
1.23 किस प्रकार के पदार्थों से अच्छे स्थायी चुंबक बनाए जा सकते हैं, लोहचुंबकीय अथवा फेरीचुंबकीय? अपने उत्तर का औचित्य बताइए।
सारांश
ठोसों का द्रव्यमान, आयतन और आकार निश्चित होता है। यह उनके कणों की नियत स्थिति, उनके मध्य लघु दूरी और उनके बीच प्रबल अन्योन्यक्रियाओं के कारण होता है। अक्रिस्टलीय ठोसों के अवयवी कणों की व्यवस्था केवल लघु परासी होती है जिसके परिणामस्वरूप ये अतिशीतित द्रवों के समान व्यवहार करते हैं। गलनांक सुस्पष्ट नहीं होता और समदैशिक प्रकृति के होते हैं। क्रिस्टलीय ठोसों के अवयवी कणों की व्यवस्था दीर्घ परासी होती है। इनका गलनांक सुस्पष्ट होता है, विषमदैशिक प्रकृति के होते हैं और उनके कणों की विशिष्ट आकृतियाँ होती हैं। क्रिस्टलीय ठोसों के गुण उनके अवयवी कणों के मध्य अन्योन्यक्रिया की प्रकृति पर निर्भर करते हैं। इस आधार पर इन्हें आण्विक, आयनिक, धात्विक और सहसंयोजक ठोस नामक चार संवर्गों में विभाजित किया जा सकता है। ये गुणों में व्यापक रूप से भिन्न होते हैं।
क्रिस्टलीय ठोसों में अवयवी कण नियमित क्रम में व्यवस्थित होते हैं जो पूरे क्रिस्टल में विस्तारित होता है। यह व्यवस्था प्रायः बिंदुओं के त्रिविमीय क्रम-विन्यास द्वारा चित्रित की जाती है, जिसे क्रिस्टल जालक कहा जाता है। प्रत्येक जालक बिंदु दिक्स्थान में एक कण की स्थिति बताता है। कुल मिलाकर विभिन्न प्रकार के चौदह जालक संभव हैं जिन्हें ब्रेवे जालक कहा जाता है। जालक का लघु अभिलक्षणिक भाग जिसे एकक कोष्ठिका कहा जाता है, की पुनरावृत्ति से प्रत्येक जालक जनित किया जा सकता है। किसी एकक कोष्ठिका की विशेषताएं उसकी कोर-लंबाई और इन कोरों के मध्य तीन कोणों द्वारा बताई जा सकती हैं। एकक कोष्ठिकाएं आद्य, जिनमें कण केवल कोनों पर स्थित हैं, अथवा केंद्रित हो सकती हैं। केंद्रित एकक कोष्ठिकाओं में अतिरिक्त कण उनके अंतःकेंद्र (अंतःकेंद्रित), प्रत्येक फलक के केंद्र पर (फलक-केंद्रित) अथवा दो विपरीत फलकों के केंद्रों पर (अंत्य-केंद्रित) होते हैं। सात प्रकार की आद्य एकक कोष्ठिकाएं होती हैं। केंद्रित एकक कोष्ठिकाओं को मिलाकर कुल चौदह प्रकार की एकक कोष्ठिकाएं होती हैं जिनके परिणामस्वरूप चौदह ब्रेवे जालक बनते हैं।
कणों के निविड संकुलन के परिणामस्वरूप दो उच्च क्षमता के जालक, षट्कोणीय निविड संकुलित (hcp) और घनीय निविड संकुलित (ccp) प्राप्त होते हैं। घनीय निविड संकुलित (ccp) को फलक-केंद्रित घनीय (fcc) जालक भी कहा जाता है। इन दोनों संकुलनों में 74% स्थान संपूरित होता है। शेष स्थान दो प्रकार की रिक्तिकाओं के रूप में उपस्थित होता है – अष्टफलकीय रिक्ति और चतुष्फलकीय रिक्ति। अन्य प्रकार के संकुलन निविड संकुलन नहीं हैं उनमें कणों की संकुलन दक्षता कम होती है। जबकि अंतःकेंद्रित घन जालक (bcc) में 68% स्थान और सरल घनीय जालक में केवल 52.4% स्थान ही संपूरित रहता है।
ठोसों की संरचनाएं परिपूर्ण नहीं होतीं। उनमें विभिन्न प्रकार की अपूर्णताएं अथवा दोष होते हैं। बिंदु दोष और रेखीय दोष सामान्य प्रकार के दोष हैं। बिंदु दोष तीन प्रकार के हैं – स्टॉइकियोमीट्री दोष, अशुद्धि दोष और नानस्टॉइकियोमीट्री दोष। रिक्तिका दोष और अंतराकाशी दोष दो आधारभूत प्रकार के स्टॉइकियोमीट्री बिंदु दोष हैं। आयनिक ठोसों में यह दोष शॉट्की और फ्रेंकेल दोष के रूप में उपस्थित होते हैं। अशुद्धि दोष क्रिस्टल में अशुद्धि की उपस्थिति से उत्पन्न होते हैं। आयनिक ठोसों में जब आयन-अशुद्धि की संयोजकता मूल यौगिक के वैसे ही आयन से भिन्न होती है तब कुछ रिक्तियाँ उत्पन्न हो जाती हैं। नानस्टॉइकियोमीट्री दोष, धातु-आधिक्य और धातु-न्यून प्रकार के होते हैं। कभी-कभी अशुद्धियों की परिकलित मात्राओं का अचालकों में डोपन करने से उनके विद्युतीय गुणों में परिवर्तन आ जाता है। इलेक्ट्रॉनिकी उद्योगों में एेसे पदार्थों का व्यापक रूप से उपयोग किया जाता है। ठोस कई प्रकार के चुंबकीय गुण प्रदर्शित करते हैं जैसे अनुचुंबकत्व, प्रतिचुंबकत्व, लोहचुंबकत्व, प्रतिलोहचुंबकत्व और फेरीचुंबकत्व। इन गुणों को श्रव्य, दृश्य-श्रव्य और अन्य अभिलेखीय यंत्रों में उपयोग किया जाता है। इन सभी गुणों को उनके इलेक्ट्रॉनिक विन्यास और संरचनाओं से सहसंबंधित किया जा सकता है।
अभ्यास
1.1 ‘अक्रिस्टलीय’ पद को परिभाषित कीजिए। अक्रिस्टलीय ठोसों के कुछ उदाहरण दीजिए।
1.2 काँच, क्वार्ट्ज़ जैसे ठोस से किस प्रकार भिन्न है? किन परिस्थितियों में क्वार्ट्ज़ को काँच में रूपांतरित किया जा सकता है?
1.3 निम्नलिखित ठोसों का वर्गीकरण आयनिक, धात्विक, आण्विक, सहसंयोजक या अक्रिस्टलीय में कीजिए।
(i) टेट्राफ़ॉस्फोरस डेकॉक्साइड (P4O10)
(ii) अमोनियम फॉस्फेट, (NH4)3 PO4
(iii) SiC
(iv) I2
(v) P4
(vi) प्लास्टिक
(vii) ग्रैफाइट
(viii) पीतल
(ix) Rb
(x) LiBr
(xi) Si
1.4 (i) उपसहसंयोजन संख्या का क्या अर्थ है?
(ii) निम्नलिखित परमाणुओं की उपसहसंयोजन संख्या क्या होती है?
(क) एक घनीय निविड संकुलित संरचना
(ख) एक अंतःकेंद्रित घनीय संरचना
1.5 यदि आपको किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएं ज्ञात हैं तो क्या आप उसके परमाण्विक द्रव्यमान की गणना कर सकते हैं? स्पष्ट कीजिए।
1.6 ‘किसी क्रिस्टल की स्थिरता उसके गलनांक के परिमाण द्वारा प्रकट होती है’, टिप्पणी कीजिए। किसी आँकड़ा पुस्तक से जल, एथिल एेल्कोहॉल, डाइएथिल ईथर तथा मैथेन के गलनांक एकत्र करें। इन अणुओं के मध्य अंतराआण्विक बलों के बारे में आप क्या कह सकते हैं?
1.7 निम्नलिखित युग्मों के पदों में कैसे विभेद करोगे?
(i) षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
(ii) क्रिस्टल जालक एवं एकक कोष्ठिका
(iii) चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति
1.8 निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिंदु होते हैं?
(i) फलक-केंद्रित घनीय, (ii) फलक-केंद्रित चतुष्कोणीय, (iii) अंतःकेंद्रित
1.9 समझाइए–
(i) धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद का आधार।
(ii) आयनिक ठोस कठोर एवं भंगुर होते हैं।
1.10 निम्नलिखित के लिए धातु के क्रिस्टल में संकुलन क्षमता की गणना कीजिए।
(i) सरल घनीय, (ii) अंतःकेंद्रित घनीय, (iii) फलक-केंद्रित घनीय।
(यह मानते हुए कि परमाणु एक-दूसरे के संपर्क में हैं।)
1.11 चाँदी का क्रिस्टलीकरण fcc जालक में होता है। यदि इसकी कोष्ठिका के कोरों की लंबाई 4.07 × 10–8 cm तथा घनत्व 10.5 g cm--3 हो तो चाँदी का परमाण्विक द्रव्यमान ज्ञात कीजिए।
1.12 एक घनीय ठोस दो तत्वों P एवं Q से बना है। घन के कोनों पर Q परमाणु एवं अंतः केंद्र पर P परमाणु स्थित हैं। इस यौगिक का सूत्र क्या है? P एवं Q की उपसहसंयोजन संख्या क्या है?
1.13 नायोबियम का क्रिस्टलीकरण अंतःकेंद्रित घनीय संरचना में होता है। यदि इसका घनत्व 8.55 g cm--3 हो तो इसके परमाण्विक द्रव्यमान 93 u का प्रयोग करके परमाणु त्रिज्या की गणना कीजिए।
1.14 यदि अष्टफलकीय रिक्ति की त्रिज्या r हो तथा निविड संकुलन में परमाणुओं की त्रिज्या R हो तो r एवं R में संबंध स्थापित कीजिए।
1.15 कॉपर fcc जालक रूप में क्रिस्टलीकृत होता है जिसके कोर की लंबाई 3.61×10-8 cm है। यह दर्शाइए कि गणना किए गए घनत्व के मान तथा मापे गए घनत्व 8.92 g cm-3 में समानता है।
1.16 विश्लेषण द्वारा ज्ञात हुआ कि निकैल अॉक्साइड का सूत्र Ni0.98O1.00 है। निकैल आयनों का कितना अंश Ni2+ और Ni3+ के रूप में विद्यमान है?
1.17 अर्धचालक क्या होते हैं? दो मुख्य अर्धचालकों का वर्णन कीजिए एवं उनकी चालकता-क्रियाविधि में विभेद कीजिए।
1.18 नानस्टॉइकियोमीट्री क्यूप्रस अॉक्साइड, Cu2O, प्रयोगशाला में बनाया जा सकता है। इसमें कॉपर तथा अॉक्सीजन का अनुपात 2:1 से कुछ कम है। क्या आप इस तथ्य की व्याख्या कर सकते हैं कि यह पदार्थ p- प्रकार का अर्धचालक है?
1.19 फेरिक अॉक्साइड, आक्साइड आयन के षट्कोणीय निविड संकुलन में क्रिस्टलीकृत होता है जिसकी तीन अष्टफलकीय रिक्तियों में से दो पर फेरिक आयन होते हैं। फेरिक अॉक्साइड का सूत्र ज्ञात कीजिए।
1.20 निम्नलिखित को p- प्रकार या n- प्रकार के अर्धचालकों में वर्गीकृत कीजिए –
(i) In से डोपित Ge (ii) B से डोपित Si
1.21 सोना (परमाणु त्रिज्या = 0.144 nm) फलक-केंद्रित एकक कोष्ठिका में क्रिस्टलीकृत होता है। इसकी कोष्ठिका के कोर की लंबाई ज्ञात कीजिए।
1.22 बैंड सिद्धांत के आधार पर (i) चालक एवं रोधी (ii) चालक एवं अर्धचालक में क्या अंतर होता है?
1.23 उचित उदाहरणों द्वारा निम्नलिखित पदों को परिभाषित कीजिए –
(i) शॉट्की दोष, (ii) फ्रेंकेल दोष, (iii) अंतराकाशी, (iv) F-केंद्र।
1.24 एेलुमिनियम घनीय निविड संकुलित संरचना में क्रिस्टलीकृत होता है। इसका धात्विक अर्धव्यास 125 pm है।
(i) एकक कोष्ठिका के कोर की लंबाई ज्ञात कीजिए।
(ii) 1.0 cm3 एेलुमिनियम में कितनी एकक कोष्ठिकाएं होंगी?
1.25 यदि NaCl को SrCl2 के 10-3 मोल % से डोपित किया जाए तो धनायनों की रिक्तियों का सांद्रण क्या होगा?
1.26 निम्नलिखित को उचित उदाहरणों से समझाइए –
(i) लोहचुंबकत्व
(ii) अनुचुंबकत्व
(iii) फेरीचुंबकत्व
(iv) प्रतिलोहचुंबकत्व
(v) 12–16 और 13–15 वर्गों के यौगिक
कुछ पाठ्यनिहित प्रश्नों के उत्तर
1.13 4
1.14 कुल रिक्तिओं की संख्या = 9.033 ×1023
चतुष्फलकीय रिक्तिओं की संख्या = 6.022 × 1023
1.15 M2N3
1.17 ccp