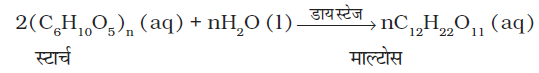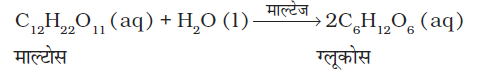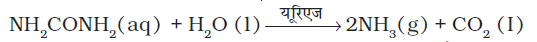Table of Contents
एकक 5
पृष्ठ रसायन
"कुछ अत्यधिक महत्वपूर्ण रसायनों का औद्योगिक उत्पादन ठोस उत्प्रेरकों की सतह पर होने वाली अभिक्रियाओं द्वारा किया जाता है।"
इस एकक के अध्ययन के पश्चात् आप-
- अंतरापृष्ठीय परिघटना एवं इसके महत्व का वर्णन कर सकेंगे;
- अधिशोषण को परिभाषित कर सकेंगे एवं इसे भौतिक एवं रासायनिक अधिशोषण में वर्गीकृत कर सकेंगे;
- अधिशोषण की क्रियाविधि की व्याख्या कर सकेंगे;
- गैसों एवं विलयनों के ठोसों पर अधिशोषण को नियंत्रित करने वाले कारकों की व्याख्या कर सकेंगे;
- फ्रॉयंडलिक (Freundlich) अधिशोषण समतापी वक्रों के आधार पर अधिशोषण परिणामों की व्याख्या कर सकेंगे;
- उद्योगों में उत्प्रेरक की भूमिका का महत्व समझ सकेंगे;
- कोलॉइडी अवस्था की प्रकृति का वर्णन कर सकेंगे;
- कोलॉइडों का विरचन, गुणों एवं शुद्धीकरण का वर्णन कर सकेंगे;
- इमल्शनों (पायस) का वर्गीकरण एवं उनका विरचन तथा गुणों का वर्णन कर सकेंगे;
- जेल निर्माण की परिघटना का वर्णन कर सकेंगे;
- कोलॉइडों के उपयोगों को सूचीबद्ध कर सकेंगे।
पृष्ठ रसायन सतह या अंतरापृष्ठ पर होने वाली परिघटनाओं से संबंधित क्षेत्र है। अंतरापृष्ठ या सतह को स्थूल प्रावस्थाओं से अलग दर्शाने के लिए एक हाइफन (-) या स्लैश (/) का उपयोग किया जाता है। उदाहरणार्थ, एक ठोस एवं गैस के बीच अंतरापृष्ठ को, ठोस - गैस या ठोस / गैस द्वारा दर्शाया जाता है। पूर्ण मिश्रणीयता के कारण गैसों के मध्य कोई अंतरापृष्ठ नहीं होता। पृष्ठ रसायन में हम जिन स्थूल प्रावस्थाओं के संपर्क में आते हैं वे शुद्ध यौगिक या विलयन हो सकते हैं। अंतरापृष्ठ की मोटाई बहुधा कुछ अणुओं तक सीमित रहती है, परंतु इसका क्षेत्रफल स्थूल प्रावस्थाओं के कणों के आकार पर निर्भर करता है। बहुत-सी ध्यान देने योग्य महत्वपूर्ण परिघटनाएं जैसे, संक्षारण, इलेक्ट्रोड प्रक्रम, विषमांगी उत्प्रेरण, विलीनीकरण एवं क्रिस्टलीकरण, अंतरापृष्ठ पर परिलक्षित होती हैं। पृष्ठ रसायन का विषय उद्योग, विश्लेषण कार्य एवं दैनिक जीवन की परिस्थितियों में कई अनुप्रयोग पाता है।
पृष्ठ अध्ययनों को सतर्कतापूर्वक निष्पादित करने हेतु पृष्ठ का वस्तुतः स्वच्छ होना अतिआवश्यक है। 10-8 से 10-9 पास्कल कोटि के अति उच्च निर्वात में आजकल धातुओं के अत्यधिक स्वच्छ पृष्ठ प्राप्त करना संभव है। एेसे स्वच्छ सतह वाले ठोस पदार्थों को निर्वात में ही भंडारित करना चाहिए अन्यथा उनका पृष्ठ, वायु के प्रमुख अवयवों अर्थात् डाइनाइट्रोजन एवं डाइअॉक्सीजन के अणुओं से आच्छादित हो जाएगा।
इस एकक में आप कोलॉइड, इमल्शन तथा जेल सहित पृष्ठ रसायन की कुछ महत्वपूर्ण विशिष्टताओं, जैसे- अधिशोषण, उत्प्रेरण और कोलॉइडों के बारे में पढ़ेंगे।
5.1 अधिशोषण
एेसे अनेक उदाहरण हैं जो यह प्रदर्शित करते हैं कि किसी ठोस के पृष्ठ की प्रवृत्ति, संपर्क में आने वाली प्रावस्था के अणुओं को आकर्षित कर धारित करने की होती है। यह अणु केवल पृष्ठ पर ही रहते हैं एवं स्थूल में गहराई पर नहीं जाते। अणुक स्पीशीज़ का किसी ठोस या द्रव के स्थूल की अपेक्षा पृष्ठ पर संचित होना अधिशोषण कहलाता है। अणुक स्पीशीज़ या पदार्थ जो कि पृष्ठ पर सांद्रित या संचित होता है अधिशोष्य कहलाता है एवं पदार्थ जिसके पृष्ठ पर अधिशोषण होता है, अधिशोषक कहलाता है।
अधिशोषण निश्चित रूप से पृष्ठीय परिघटना है। विशेष रूप से बारीक चूर्ण अवस्था में ठोस, जो अधिक पृष्ठ क्षेत्रफल के होते हैं, जैसे चारकोल, सिलिका जेल, एेलुमिना जेल, मिट्टी, कोलॉइड सूक्ष्म विभाजित धातुएं इत्यादि अच्छे अवशोषक का कार्य करते हैं।
क्रियाविधियों में अधिशोषण
(i) यदि चूर्णित चारकोल वाले बंद पात्र में O2, H2, CO, Cl2, NH3 या SO2 जैसी गैसें ली जाएं, तो एेसा देखा जाता है कि पात्र में गैस का दाब घट जाता है। गैस के अणु चारकोल की सतह पर सांद्रित हो जाते हैं अर्थात् गैसें सतह पर अधिशोषित हो जाती हैं।
(ii) एक कार्बनिक रंजक जैसे मेथिलीन ब्लू के विलयन में जब जांतव चारकोल मिलाकर विलयन को अच्छी प्रकार हिलाया जाता है, तो निस्यंद (छनित्र) रंगहीन हो जाता है क्योंकि रंजक के अणु चारकोल की सतह पर एकत्रित हो जाते हैं अर्थात् अधिशोषित हो जाते हैं।
(iii) अपरिष्कृत शर्करा के जलीय विलयन को जब जांतव चारकोल की परतों पर से प्रवाहित किया जाता है तो यह रंगहीन हो जाता है; क्योंकि रंगीन पदार्थ चारकोल द्वारा अधिशोषित कर लिए जाते हैं।
(iv) सिलिका जेल की उपस्थिति में वायु शुष्क हो जाती है, क्योंकि जल के अणु जेल की सतह पर अधिशोषित हो जाते हैं।
उपरोक्त उदाहरणों से यह स्पष्ट है कि ठोस पृष्ठ गैस या द्रव के अणुओं को अधिशोषण के कारण बाँधे रखती हैं। किसी अधिशोषित पदार्थ को उस पृष्ठ से हटाना जिस पर वह अधिशोषित है, विशोषण कहलाता है।
5.1.1 अधिशोषण एवं अवशोषण में विभेद
अधिशोषण में पदार्थ केवल पृष्ठ पर सांद्रित होता है एवं अधिशोषक की सतह से स्थूल में प्रवेश नहीं करता, जबकि अवशोषण में पदार्थ, ठोस के संपूर्ण स्थूल में समानरूप से वितरित हो जाता है। उदाहरण के लिए जब एक चाक को स्याही में डुबोया जाता है तो चाक की सतह रंजक अणुओं के अधिशोषण के कारण स्याही का रंग धारण कर लेती है। केवल स्याही का विलायक अवशोषण के कारण चाक में अंदर तक चला जाता है। चाक को तोड़ने पर यह अंदर से सफेद निकलती है। जल वाष्प का उदाहरण लेकर अधिशोषण एवं अवशोषण में विभेद किया जा सकता है। जल वाष्प शुष्क कैल्सियम क्लोराइड के द्वारा अवशोषित होती है जबकि सिलिका जेल द्वारा अधिशोषित होती है। दूसरे शब्दों में, अधिशोषण में अधिशोष्य की सांद्रता केवल अधिशोषक के पृष्ठ पर बढ़ती है जबकि अवशोषण में सांद्रता ठोस के संपूर्ण स्थूल में एक समान रहती है।
अधिशोषण एवं अवशोषण साथ-साथ भी हो सकते हैं। दोनों प्रक्रमों को समझाने के लिए शोषण शब्द (पद) का प्रयोग किया जाता है।
5.1.2 अधिशोषण की क्रियाविधि
अधिशोषण की उत्पत्ति इस तथ्य से होती है कि अधिशोषक के पृष्ठीय कण वैसे वातावरण में नहीं होते जिसमें स्थूल के अंदर के कण होते हैं। अधिशोषक के अंदर के कणों पर लगने वाले सभी बल आपस में संतुलित होते हैं परंतु पृष्ठीय कण सभी दिशाओं में अपनी प्रकार के परमाणुओं या अणुओं से घिरे नहीं होते, अतः उन पर असंतुलित या अधिशेष आकर्षण बल होते हैं। अधिशोषक के ये बल ही अधिशोष्य कणों को आकर्षित करने के लिए उत्तरदायी होते हैं। एक दिए गए ताप एवं दाब पर अधिशोषण की सीमा अधिशोषक के प्रति इकाई द्रव्यमान का क्षेत्रफल बढ़ने के साथ बढ़ती है।
दूसरा महत्वपूर्ण कारक जो अधिशोषण की विशेषता चित्रित करता है, वह है अधिशोषण ऊष्मा। अधिशोषण होने पर पृष्ठ के अवशिष्ट बलों में सदैव कमी आती है अर्थात् पृष्ठ ऊर्जा में कमी आती है जो कि ऊष्मा के रूप में प्रकट होती है। अतः अधिशोषण सदा एक ऊष्माक्षेपी प्रक्रम होता है। दूसरे शब्दों में, अधिशोषण का ∆H हमेशा ऋणात्मक होता है। जब एक गैस अधिशोषित होती है, तो इसके अणुओं का संचलन (movement) सीमित हो जाता है। इससे अधिशोषण के पश्चात् गैस की एेन्ट्रॉपी घट जाती है। अर्थात् ∆S ऋणात्मक होता है। इस प्रकार अधिशोषण होने पर निकाय की एन्थैल्पी एवं एन्ट्रॉपी घटती हैं। किसी प्रक्रम के स्वतः प्रवर्तित होने के लिए, ऊष्मागतिकीय आवश्यकता यह है कि स्थिर ताप एवं दाब पर ∆G ऋणात्मक होना चाहिए अर्थात् गिब्ज़ ऊर्जा में कमी होनी चाहिए। समीकरण ∆G = ∆H - T∆S के आधार पर ∆G तभी ऋणात्मक हो सकता है जब ∆H का मान पर्याप्त ऋणात्मक हो, क्योंकि -T∆S का मान धनात्मक है। अतः अधिशोषण प्रक्रम में, जो कि स्वतः प्रवर्तित होता है, इन दोनों गुणकों का संयोजन ∆G को ऋणात्मक बनाता है। जैसे-जैसे अधिशोषण बढ़ता है ∆H कम ऋणात्मक होता जाता है एवं अंत में ∆H, T∆S के तुल्य हो जाता है एवं ∆G का मान शून्य हो जाता है। इस अवस्था पर साम्य स्थापित हो जाता है।
5.1.3 अधिशोषण के प्रकार
ठोसों पर गैसों के अधिशोषण दो प्रकार के होते हैं। यदि किसी ठोस के पृष्ठ पर गैस का संचयन दुर्बल वान्डरवालस बलों के कारण होता है तो अधिशोषण को भौतिक अधिशोषण (Physical adsorption or Physiorption) कहते हैं। जब गैस के अणु या परमाणु ठोस पृष्ठ पर रासायनिक बंधों से जुड़ते हैं तो अधिशोषण, रासायनिक अधिशोषण या रसोवशोषण (Chemical Adsorption or Chemisorption) कहलाता है। रासायनिक बंध प्रकृति में सहसंयोजक या आयनिक हो सकते हैं। रसोवशोषण में उच्च सक्रियण ऊर्जा सम्मिलित होती है, अतः इसे सामान्यतया सक्रियत अधिशोषण संदर्भित किया जाता है। कभी-कभी ये दोनों प्रक्रम साथ-साथ होते हैं एवं अधिशोषण का प्रकार निश्चित करना आसान नहीं होता। निम्न ताप पर होने वाला भौतिक अधिशोषण ताप बढ़ाने पर रसोवशोषण में बदल जाता है। उदाहरण के लिए, डाइहाइड्रोजन पहले निकैल की सतह पर वान्डरवालस बलों के द्वारा अधिशोषित होती है। तत्पश्चात् हाइड्रोजन के अणु, परमाणुओं में वियोजित होते हैं, जो कि रसोवशोषण द्वारा निकैल की सतह पर बंधे रहते हैं। दोनों प्रकार के अधिशोषणों के कुछ प्रमुख अभिलक्षण नीचे वर्णित किए गए हैं।
भौतिक अधिशोषण के अभिलक्षण
(i) विशिष्टता की कमी - एक अधिशोषक की दी गई सतह किसी विशिष्ट गैस के लिए कोई प्राथमिकता नहीं दर्शाती क्योंकि वान्डरवाल्स बल व्यापक होते हैं।
(ii) अधिशोष्य की प्रकृति - किसी ठोस द्वारा अधिशोषित गैस की मात्रा गैस की प्रकृति पर निर्भर करती है। सामान्यतया, सरलतापूर्वक द्रवणीय गैसें (यानि उच्च क्रांतिक तापों वाली) आसानी से अधिशोषित हो जाती हैं, क्योंकि वान्डरवाल्स बल क्रांतिक तापों के निकट अधिक प्रबल होते हैं। इसीलिए 1g सक्रियत चारकोल, मेथेन (क्रांतिक ताप 190 K) की अपेक्षा अधिक सल्फर डाइअॉक्साइड (क्रांतिक ताप 630K) को अधिशोषित करता है जो कि 4.5 mL डाइहाइड्रोजन (क्रांतिक ताप 33K) से भी अधिक है।
(iii) उत्क्रमणीय प्रकृति - गैस का ठोस पर अधिशोषण सामान्यतया उत्क्रमणीय होता है।
अतः ठोस + गैस l गैस/ठोस + ऊर्जा
दाब बढ़ाने पर अधिक गैस अधिशोषित होती है क्योंकि इससे गैस का आयतन कम होता है (ले-शातैलिए का सिद्धांत) और दाब घटाकर गैस को निकाला जा सकता है। अधिशोषण प्रक्रम ऊष्माक्षेपी होने के कारण, भौतिक अधिशोषण निम्न ताप पर सहजता से होता है और ताप बढ़ने पर घटता है (ले-शातैलिए का सिद्धांत)।
(iv) अधिशोषक का पृष्ठीय क्षेत्रफल- अधिशोषण का परिमाण अधिशोषक के पृष्ठीय क्षेत्रफल के बढ़ने के साथ बढ़ता है। अतः महीन चूर्णित धातुएं एवं सरंध्र पदार्थ जिनका पृष्ठीय क्षेत्रफल अधिक होता है, अच्छे अधिशोषक होते हैं।
(v) अधिशोषण की एन्थैल्पी- निसंदेह, भौतिक अधिशोषण एक ऊष्माक्षेपी प्रक्रम है परंतु अधिशोषण की एन्थैल्पी, अत्यधिक कम (20 - 40 kJ mol-1) होती है। एेसा इसीलिए होता है क्योंकि गैसीय अणुओं एवं ठोस सतह के मध्य आकर्षण केवल दुर्बल वान्डरवाल्स बलों के कारण होता है।
रसोवशोषण के अभिलक्षण
(i) उच्च विशिष्टता- रसोवशोषण अतिविशिष्ट होता है एवं यह केवल तभी होता है जब अधिशोषक एवं अधिशोष्य के मध्य रासायनिक बंध बनने की कोई संभावना हो। उदाहरणार्थ, अॉक्सीजन धातुओं पर अॉक्साइड बनने के कारण अधिशोषित होती है एवं हाइड्रोजन का संक्रमण धातुओं द्वारा अवशोषण हाइड्राइड बनने के कारण होता है।
(ii) अनुत्क्रमणीयता- रसोवशोषण में यौगिक बनने के कारण इसकी प्रकृति अनुत्क्रमणीय होती है। रसोवशोषण भी एक ऊष्माक्षेपी प्रक्रम है परंतु उच्च सक्रियण ऊर्जा के कारण निम्न तापों पर यह बहुत धीमा होता है। अधिकांश रासायनिक परिवर्तनों के समान अधिशोषण ताप बढ़ने पर प्रायः बढ़ता है। निम्नताप पर गैस का भौतिक अधिशोषण, उच्च ताप पर रसोवशोषण में बदल सकता है। साधारणतया उच्च दाब भी रसोवशोषण के लिए सहायक होता है।
(iii) पृष्ठीय क्षेत्रफल- भौतिक अधिशोषण के समान, रसोवशोषण भी अधिशोषक का पृष्ठीय क्षेत्रफल बढ़ने पर बढ़ता है।
(iv) अधिशोषण की एन्थैल्पी- रसोवशोषण की एन्थैल्पी उच्च (80-240 kJ mol-1) होती है क्योंकि इसमें रासायनिक बंध का निर्माण होता है।
सारणी 5.1- भौतिक अधिशोषण एवं रासायनिक अधिशोषण की तुलना
| भौतिक अधिशोषण | रासायनिक अधिशोषण (रसोवशोषण) |
|---|---|
| 1. यह वान्डरवाल्स बलों के कारण उत्पन्न होता है। 2. यह प्रकृति में विशिष्ट नहीं है। 3. यह प्रकृति में उत्क्रमणीय है। 4. यह गैस की प्रकृति पर निर्भर करता है। अधिक आसानी से द्रवणीय गैसें सहजता से अधिशोषित होती हैं। 5.इसमें अधिशोषण की एन्थैल्पी कम (20-40 kj mol-1) होती है। 6. अधिशोषण के लिए निम्न ताप सहायक होता है। यह ताप बढ़ने पर घटता है। 7. इसमें सुप्रेक्ष्य सक्रियण ऊर्जा की आवश्यकता नहीं होती। 8. यह पृष्ठीय क्षेत्रफल पर निर्भर करता है। यह पृष्ठीय क्षेत्रफल के बढ़ने पर बढ़ता है। 9. उच्च दाब पर अधिशोषक के पृष्ठ पर यह बहुअणुक परतों के रूप में परिणामित होता है। | 1. यह रासायनिक बंध बनने के कारण होता है। 2. यह प्रकृति में अतिविशिष्ट होता है। 3. यह अनुत्क्रमणीय है। 4. यह भी गैस की प्रकृति पर निर्भर करता है। वे गैसें जो अधिशोषक से क्रिया करती हैं, रसोशोषण दर्शाती है। 5. इसमें अधिशोषण की एन्थैल्पी (30 - 240 kJmol-1) उच्च होती है। 6. अधिशोषण के लिए उच्च ताप सहायक होता है। यह ताप बढ़ने पर बढ़ता है। 7. कभी-कभी उच्च सक्रियण ऊर्जा की आवश्यकता होती है। 8. यह भी पृष्ठीय क्षेत्रफल पर निर्भर करता है। यह भी पृष्ठीय क्षेत्रफल के बढ़ने पर बढ़ता है। 9. यह एकल अणुक परत के रूप में फलित होता है। |
5.1.4 अधिशोषण समतापी
अधिशोषक द्वारा अधिशोषित गैस की मात्रा में स्थिर ताप पर दाब के साथ परिवर्तन एक वक्र के माध्यम से व्यक्त किया जा सकता है, जिसे अधिशोषण समतापी कहते हैं।
फ्रॉयन्डलिक समतापीवक्र- फ्रॉयन्डलिक ने 1909 में ठोस अधिशोषक के इकाई द्रव्यमान द्वारा एक निश्चित ताप पर अधिशोषित गैस की मात्रा एवं दाब के मध्य एक प्रयोगाश्रित संबंध दिया। संबंध को निम्न समीकरण द्वारा व्यक्त किया जा सकता है -
 = k.p1/n (n > 1) (5.1)
= k.p1/n (n > 1) (5.1)
जहाँ x अधिशोषक के m द्रव्यमान द्वारा p दाब पर अधिशोषित गैस का द्रव्यमान है। k एवं n स्थिरांक हैं जो कि किसी निश्चित ताप पर अधिशोषक एवं गैस की प्रकृति पर निर्भर करते हैं। संबंध को सामान्यतया एक वक्र के रूप में निरूपित किया जाता है जिसमें अधिशोषक के प्रति ग्राम द्वारा अधिशोषित गैस का द्रव्यमान दाब के विपरीत आलेखित किया जाता है (चित्र 5.1)। ये वक्र इंगित करते हैं कि एक निश्चित दाब पर, ताप बढ़ाने से भौतिक अधिशोषण घटता है। ये वक्र उच्च दाब पर हमेशा संतृप्ता की ओर बढ़ते प्रतीत होते हैं।
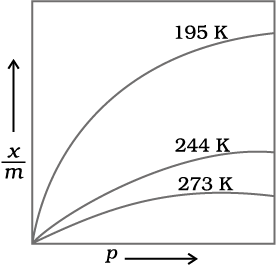
चित्र 5.1-अधिशोषण समतापी वक्र
समीकरण 5.1 का लघुगणक लेने पर-
फ्रॉयन्डलिक समतापी वक्र की वैधता, आलेख में log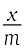 को y-अक्ष (कोटि) एवं log p को x-अक्ष (भुज) पर लेकर प्रमाणित की जा सकती है। यदि यह एक सीधी रेखा आती है तो फ्रॉयन्डलिक समतापी वक्र प्रमाणित है, अन्यथा नहीं (चित्र 5.2)। सीधी रेखा के ढाल
को y-अक्ष (कोटि) एवं log p को x-अक्ष (भुज) पर लेकर प्रमाणित की जा सकती है। यदि यह एक सीधी रेखा आती है तो फ्रॉयन्डलिक समतापी वक्र प्रमाणित है, अन्यथा नहीं (चित्र 5.2)। सीधी रेखा के ढाल 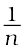 का मान देता है। y-अक्ष पर अंतःखंड log k का मान देता है।
का मान देता है। y-अक्ष पर अंतःखंड log k का मान देता है।
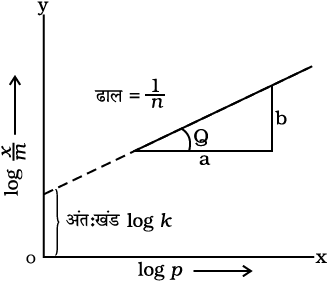
चित्र 5.2-फ्रॉयन्डलिक समतापी वक्र
फ्रॉयन्डलिक समतापी अधिशोषण के व्यवहार की सन्निकट व्याख्या करता है। गुणक 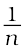 का मान 0 एवं 1 के मध्य हो सकता है (अनुमानित सीमा 0.1 से 0.5)। अतः समीकरण 5.2 दाब के सीमित विस्तार तक ही लागू होती है।
का मान 0 एवं 1 के मध्य हो सकता है (अनुमानित सीमा 0.1 से 0.5)। अतः समीकरण 5.2 दाब के सीमित विस्तार तक ही लागू होती है।
क्योंकि 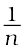 = 0,
= 0, = स्थिरांक, अतः अधिशोषण दाब से स्वतंत्र है।
= स्थिरांक, अतः अधिशोषण दाब से स्वतंत्र है।
जब 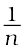 = 1,
= 1, = k p अर्थात
= k p अर्थात  ∝ p, अतः अधिशोषण में परिवर्तन दाब के अनुक्रमानुपाती है। दोनों ही प्रतिबंधों का प्रायोगिक परिणामों से समर्थन होता है। प्रायोगिक समतापी सदैव उच्च दाब पर संतृप्ता की ओर अभिगमन करते प्रतीत होते हैं। इसे फ्रॉयन्डलिक समतापी से नहीं समझाया जा सकता। इस प्रकार यह उच्च दाब पर असफल हो जाता है।
∝ p, अतः अधिशोषण में परिवर्तन दाब के अनुक्रमानुपाती है। दोनों ही प्रतिबंधों का प्रायोगिक परिणामों से समर्थन होता है। प्रायोगिक समतापी सदैव उच्च दाब पर संतृप्ता की ओर अभिगमन करते प्रतीत होते हैं। इसे फ्रॉयन्डलिक समतापी से नहीं समझाया जा सकता। इस प्रकार यह उच्च दाब पर असफल हो जाता है।
5.1.5 विलयन प्रावस्था से अधिशोषण
ठोस, विलयनों से भी घुले हुए पदार्थों का अधिशोषण कर सकते हैं। जब एेसीटिक अम्ल के जलीय विलयन को चारकोल के साथ हिलाया जाता है तो अम्ल का एक अंश चारकोल के द्वारा अधिशोषित हो जाता है एवं विलयन में अम्ल की सांद्रता घट जाती है। इसी प्रकार से लिटमस का विलयन चारकोल के साथ हिलाने पर रंगहीन हो जाता है। जब Mg(OH)2 को मैग्नेसॉन अभिकर्मक की उपस्थिति में अवक्षेपित किया जाता है तो यह नीला रंग ग्रहण कर लेता है। यह रंग मैग्नेसॉन के अधिशोषण के कारण होता है। विलयन प्रावस्था से अधिशोषण में निम्नलिखित प्रेक्षण प्राप्त किए गए हैं।
(i) अधिशोषण की सीमा ताप के बढ़ने पर घटती है।
(ii) अधिशोषण की सीमा, अधिशोषक का पृष्ठीय क्षेत्रफल बढ़ने पर बढ़ती है।
(iii) अधिशोषण की सीमा, विलयन में विलेय की सांद्रता पर निर्भर करती है।
(iv) अधिशोषण की सीमा अधिशोषण एवं अधिशोष्य की प्रकृति पर निर्भर करती है।
विलयनों से अधिशोषण की परिशुद्ध क्रियाविधि ज्ञात नहीं है। फ्रॉयन्डलिक समीकरण विलयनों से अधिशोषण के व्यवहार का इस अंतर के साथ सन्निकट वर्णन करती है कि दाब के स्थान पर विलयन की सांद्रता पर विचार किया जाता है। अर्थात्,
 = kC1/n (5.3)
= kC1/n (5.3)
(यहाँ C साम्यसांद्रता है, अर्थात् अधिशोषण पूर्ण होने पर सांद्रता)
उपरोक्त समीकरण का लघुगणक लेने पर हम पाते हैं,
log = logk +
= logk +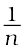 logC (5.4)
logC (5.4)
log को logC के विपरीत आलेखित करने पर एक सीधी रेखा प्राप्त होती है जो कि फ्रॉयन्डलिक समतापी के सत्यापन को दर्शाती है। इसको प्रायोगिक तौर पर एेसीटिक अम्ल की विभिन्न सांद्रताओं के विलयन लेकर परखा जा सकता है। विलयनों के समान आयतन, चारकोल की समान मात्राओं में अलग-अलग फ्लास्कों में मिलाये जाते हैं। अधिशोषण के पश्चात् प्रत्येक फ्लास्क में एेसीटिक अम्ल की अंतिम सांद्रता ज्ञात की जाती है। प्रारंभिक एवं अंतिम सांद्रताओं में अंतर, 'x' का मान देता है। उपरोक्त समीकरण का उपयोग करते हुए फ्रॉयन्डलिक समतापी की सत्यता स्थापित की जा सकती है।
को logC के विपरीत आलेखित करने पर एक सीधी रेखा प्राप्त होती है जो कि फ्रॉयन्डलिक समतापी के सत्यापन को दर्शाती है। इसको प्रायोगिक तौर पर एेसीटिक अम्ल की विभिन्न सांद्रताओं के विलयन लेकर परखा जा सकता है। विलयनों के समान आयतन, चारकोल की समान मात्राओं में अलग-अलग फ्लास्कों में मिलाये जाते हैं। अधिशोषण के पश्चात् प्रत्येक फ्लास्क में एेसीटिक अम्ल की अंतिम सांद्रता ज्ञात की जाती है। प्रारंभिक एवं अंतिम सांद्रताओं में अंतर, 'x' का मान देता है। उपरोक्त समीकरण का उपयोग करते हुए फ्रॉयन्डलिक समतापी की सत्यता स्थापित की जा सकती है।
5.1.6 अधिशोषण के अनुप्रयोग
अधिशोषण की परिघटना के अनेक अनुप्रयोग हैं। कुछ महत्वपूर्ण अनुप्रयोग यहाँ सूचीबद्ध किए गए हैं-
(i) उच्च निर्वात उत्पन्न करने में
अत्यधिक उच्च निर्वात उत्पन्न करने के लिए, निर्वात पंप द्वारा निर्वातित पात्र से लेशमात्र वायु, चारकोल पर अधिशोषित करके निकाली जा सकती है।
(ii) गैस मास्क
गैस मास्क (एक युक्ति, जिसमें साक्रियित चारकोल या अधिशोषकों का मिश्रण होता है) का उपयोग कोयले की खानों में साँस लेते समय, विषैली गैसों को अधिशोषित करने के लिए किया जाता है।
(iii) आद्रता पर नियंत्रण
सिलिका जेल एवं एेलुमिनियम जेल का उपयोग नमी को दूर करने एवं आद्रता को नियंत्रित करने के लिए किया जाता है।
(iv) विलयनों से रंगीन पदार्थों को हटाना
जांतव चारकोल विलयनों की रंगीन अशुद्धियों को अधिशोषित कर रंग हटा देता है।
(v) विषमांगी उत्प्रेरण
उत्प्रेरक की ठोस सतह पर अभिक्रियकों का अधिशोषण अभिक्रिया की दर बढ़ा देता है। औद्योगिक महत्व की एेसी कई गैसीय अभिक्रियाएं हैं, जिनमें ठोस उत्प्रेरकों का होना आवश्यक है। अमोनिया के उत्पादन में लोहे का उत्प्रेरक की तरह उपयोग, H2SO4 का संपर्क प्रक्रम से उत्पादन, एवं तेलों के हाइड्रोजनीकरण में सूक्ष्मविभाजित निकैल का उपयोग, विषमांगी उत्प्रेरण के उत्कृष्ट उदाहरण हैं।
(vi) अक्रिय गैसों का पृथक्करण
गैसों के चारकोल द्वारा अधिशोषण की मात्रा में भिन्नता होने के कारण मिश्रण में से अक्रिय गैसों को नारियल चारकोल पर, विभिन्न तापों पर अधिशोषित करके पृथक किया जा सकता है।
(vii) व्याधियों के उपचार में
अनेक औषध कीटाणुओं को अधिशोषण द्वारा मारने में प्रयुक्त होते हैं।
(viii) झाग प्लवन प्रक्रम
चीड़ के तेल एवं झाग कारक का उपयोग करके एक निम्न श्रेणी के सल्फाइड अयस्क को सिलिका जेल एवं अन्य मृदा पदार्थों से पृथक कर सांद्रित किया जा सकता है। (एकक 1 देखें)
(ix) अधिशोषण सूचक
कुछ अवक्षेपों की सतहें, जैसे- सिल्वर हैलाइड, इओसिन, फ्लुओरेसाइन आदि जैसे कुछ रंजकों को अवशोषित कर सकती हैं एवं इस प्रकार अंतिम बिंदु पर अभिलक्षणिक रंग प्रदान करती हैं।
(x) वर्णलेखिकीय विश्लेषण
अधिशोषण की परिघटना पर आधारित वर्णलेखिकीय विश्लेषण के विश्लेषिक एवं औद्योगिक क्षेत्रों में अनेक उपयोग हैं।
पाठ्यनिहित प्रश्न
5.1 रसोवशोषण के दो अभिलक्षण दीजिए।
5.2 ताप बढ़ने पर भौतिक अधिशोषण क्यों घटता है?
5.3 अपने क्रिस्टलीय रूपों की तुलना में चूर्णित पदार्थ अधिक प्रभावी अधिशोषक क्यों होते हैं?
5.2 उत्प्रेरण
पोटैशियम क्लोरेट को तीव्र गर्म करने पर यह डाइअॉक्सीजन देते हुए धीरे-धीरे विघटित हो जाता है। विघटन 653 से 873 ताप परास पर होता है।
2KClO3 → 2KCl + 3O2
तथापि, जब उक्त अभिक्रिया में थोड़ा-सा मैंगनीज डाइअॉक्साइड मिला दिया जाता है तो विघटन उल्लेखनीय निम्न ताप परास, अर्थात् 473-633K, पर हो जाता है एवं अभिक्रिया दर भी पर्याप्त रूप से बढ़ जाती है। मिलाए गए मैंगनीज डाइअॉक्साइड का द्रव्यमान एवं संघटन अपरिवर्तित रहता है। इसी प्रकार से बाहरी पदार्थों की उपस्थिति मात्र से कई रासायनिक अभिक्रियाओं की दरें परिवर्तित की जा सकती हैं। विभिन्न बाहरी पदार्थों के विभिन्न रासायनिक अभिक्रियाओं पर प्रभाव का व्यवस्थित अध्ययन सर्वप्रथम 1835 में बर्जीलियस ने किया। उसने एेसे पदार्थों के लिए उत्प्रेरक पद का सुझाव दिया।
वे पदार्थ जो रासायनिक अभिक्रिया के पश्चात् रासायनिक एवं मात्रात्मक रूप से अपरिवर्तित रहते हुए, रासायनिक अभिक्रिया की दर में वृद्धि कर देते हैं, उत्प्रेरक कहलाते हैं एवं इस परिघटना को उत्प्रेरण कहते हैं। आप खंड 4.5 में उत्प्रेरकों एवं इनकी कार्यप्रणाली के बारे में पढ़ चुके हैं।
वर्धक एवं विषकारक
वर्धक वे पदार्थ होते हैं जो उत्प्रेरक की सक्रियता बढ़ा देते हैं जबकि विष, उत्प्रेरक की सक्रियता घटा देते हैं। उदाहरण के लिए अमोनिया के हाबर प्रक्रम द्वारा उत्पादन में, मॉलिब्डेनम लोहे के लिए वर्धक का कार्य करता है, जो कि उत्प्रेरक की तरह प्रयुक्त होता है।
N2 + 3H2(g)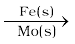 2NH3(g)
2NH3(g)
5.2.1 समांगी एवं विषमांगी उत्प्रेरण
उत्प्रेरण मुख्यतः दो समूहों में विभाजित किया जा सकता है-
(क) समांगी उत्प्रेरण
जब अभिक्रियक एवं उत्प्रेरक समान प्रावस्था (अर्थात् द्रव या गैस) में हों तो प्रक्रम समांगी उत्प्रेरण कहलाता है। समांगी उत्प्रेरण के कुछ उदाहरण निम्नलिखित हैं-
(i) सीसा कक्ष विधि (लेड चेंबर प्रक्रम) में नाइट्रोजन के अॉक्साइडों की उत्प्रेरक की तरह उपस्थिति में, सल्फर डाइअॉक्साइड का डाइअॉक्सीजन के साथ अभिक्रिया द्वारा सल्फर डाइअॉक्साइड में अॉक्सीकरण-
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
अभिक्रियक, सल्फर डाइअॉक्साइड तथा अॉक्सीजन एवं उत्प्रेरक नाइट्रिक अॉक्साइड सभी समान प्रावस्था में हैं।
(ii) हाइड्रोक्लोरिक अम्ल द्वारा प्रदत्त H+ आयनों से मेथिल एेसीटेट का जल अपघटन उत्प्रेरित होता है।
CH3COOCH3(l) + H2O(l) 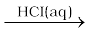 CH3COOH(aq) + CH3OH(aq)
CH3COOH(aq) + CH3OH(aq)
अभिक्रियक एवं उत्प्रेरक दोनों ही समान प्रावस्था में हैं।
(iii) शर्करा का जल अपघटन, सल्यूरिक अम्ल द्वारा प्रदत्त H+ आयनों से उत्प्रेरित होता है।
अभिक्रियक एवं उत्प्रेरक दोनों समान प्रावस्था में हैं।
(ख) विषमांगी उत्प्रेरण
उत्प्रेरकी प्रक्रम जिसमें अभिक्रियक एवं उत्प्रेरक भिन्न प्रावस्थाओं में होते हैं, विषमांगी उत्प्रेरण कहलाता है। विषमांगी उत्प्रेरण के कुछ उदाहरण निम्नलिखित हैं-
(i) Pt की उपस्थिति में सल्फर डाइअॉक्साइड का सल्फर ट्राइअॉक्साइड में अॉक्सीकरण-
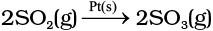
अभिक्रियक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस अवस्था में हैं।
(ii) हाबर प्रक्रम में सूक्ष्म विभाजित लोहे की उपस्थिति में अमोनिया बनने में डाइनाइट्रोजन एवं डाइहाइड्रोजन के मध्य संयोजन-
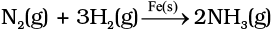
अभिक्रियक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस प्रावस्था में हैं।
(iii) ओस्टवाल्ड प्रक्रम में, प्लेटिनम गेज की उपस्थिति में, अमोनिया का नाइट्रिक अॉक्साइड में अॉक्सीकरण-

अभिक्रियक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस प्रावस्था में हैं।
(iv) सूक्ष्म विभाजित निकैल उत्प्रेरक की उपस्थिति में वनस्पति तेलों का हाइड्रोजनन-
वनस्पति तेल  वनस्पति घी (s)
वनस्पति घी (s)
अभिक्रियकों में से एक द्रव प्रावस्था में है जबकि दूसरा गैसीय प्रावस्था में है और उत्प्रेरक ठोस प्रावस्था में है।
5.2.2 विषमांगी उत्प्रेरण का अधिशोषण सिद्धांत
यह सिद्धांत विषमांगी उत्प्रेरण की क्रियाविधि को स्पष्ट करता है। प्राचीन सिद्धांत जो कि उत्प्रेरण का अधिशोषण सिद्धांत कहलाता था, के अनुसार गैसीय प्रावस्था या विलयन में अभिक्रियक, ठोस उत्प्रेरक के पृष्ठ पर अधिशोषित हो जाते हैं। पृष्ठ पर अभिक्रियकों की सांद्रता में वृद्धि अभिक्रिया की दर को बढ़ा देती है। अधिशोषण एक ऊष्माक्षेपी अभिक्रिया है अतः अधिशोषण की ऊष्मा, अभिक्रिया की दर बढ़ाने में प्रयुक्त हो जाती है।
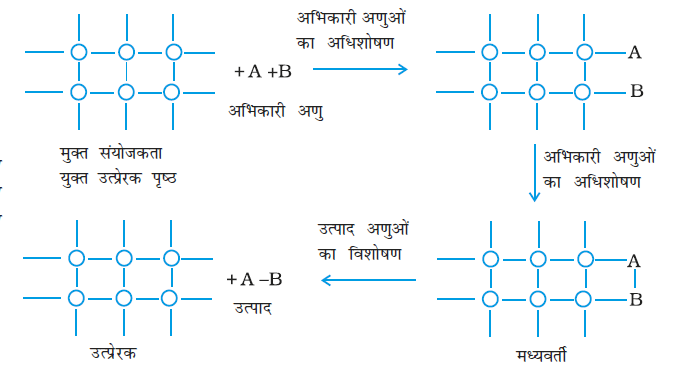
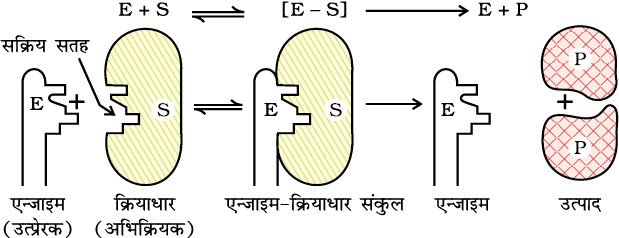
उत्प्रेरण क्रिया को मध्यवर्ती यौगिक के बनने के पदों में वर्णित किया जा सकता है, जिसका सिद्धांत आप पूर्व में ही खंड 4.5.1 में पढ़ चुके हैं। आधुनिक अधिशोषण सिद्धांत मध्यवर्ती यौगिक निर्माण सिद्धांत एवं प्राचीन अधिशोषण सिद्धांत का संयोजन है। उत्प्रेरण क्रिया उत्प्रेरक की सतह पर केंद्रित होती है। क्रियाविधि में पाँच पद सम्मिलित होते हैं-
(i) उत्प्रेरक की सतह पर अभिक्रियकों का विसरण
(ii) उत्प्रेरक की सतह पर अभिक्रियक अणुओं का अधिशोषण,
(iii) एक मध्यवर्ती निर्माण द्वारा उत्प्रेरक की सतह पर रासायनिक अभिक्रिया का होना (चित्र 5.3)।
(iv) उत्प्रेरक सतह से अभिक्रिया उत्पादों का विशोषण होने के बाद सतह का दोबारा अधिक अभिक्रिया होने के लिए उपलब्ध कराना।
(v) अभिक्रिया उत्पादों का उत्प्रेरक की सतह से दूर विसरण।
चित्र 5.3- अभिकारी अणुओं का अधिशोषण, मध्यवर्ती का बनना एवं उत्पादों का विशोषण।
उत्प्रेरक की सतह पर मुक्त संयोजकताएं होती हैं, जैसा स्थूल के आंतरिक भाग में नहीं है। यह संयोजकताएं रासायनिक आकर्षण बलों के लिए स्थान उपलब्ध करवाती हैं। जब कोई गैस एक एेसी सतह के संपर्क में आती है तो इसके अणु शिथिल रासायनिक संयोजन के कारण वहाँ बँध जाते हैं। यदि अलग प्रकार के अणु पास-पास अधिशोषित हो जाएं तो एक दूसरे से अभिक्रिया कर सकते हैं जिससे नए अणु बन जाते हैं। इस प्रकार बने अणु सतह को नए अभिक्रियक अणुओं के लिए छोड़ते हुए वाष्पीकृत हो जाते हैं।
यह सिद्धांत समझाता है कि अभिक्रिया के अंत में उत्प्रेरक का द्रव्यमान एवं रासायनिक संघटन क्यों अपरिवर्तित रहता है तथा यह कम मात्रा में भी कैसे प्रभावी होता है। तथापि, यह उत्प्रेरक वर्धक एवं उत्प्रेरक विष की क्रिया को स्पष्ट नहीं करता।
ठोस उत्प्रेरकों की महत्वपूर्ण विशेषताएं
(क) सक्रियता- बहुत सीमा तक का उत्प्रेरक की सक्रियता रसोवशोषण की प्रबलता पर निर्भर करती है। सक्रिय होने के लिए अभिक्रियक, उत्प्रेरक पर पर्याप्त प्रबलता से अधिशोषित होने चाहिए। तथापि वे इतनी प्रबलता से अधिशोषित नहीं होने चाहिए कि वे गतिहीन हो जाएं एवं अन्य अभिक्रियकों के लिए उत्प्रेरक की सतह पर कोई स्थान रिक्त न रहे। हाइड्रोजनन अभिक्रियाओं के लिए यह पाया गया है कि उत्प्रेरकी सक्रियता आवर्तसारणी में वर्ग 5 से वर्ग 11 के तत्वों तक बढ़ती है, जिनमें वर्ग 7 से 9 के तत्व अधिकतम सक्रियता दर्शाते हैं (कक्षा 11, एकक 3)।
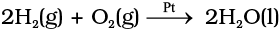
(ख) वरणात्मकता (चयनात्मकता)- किसी उत्प्रेरक की वरणात्मकता उसकी किसी अभिक्रिया को दिशा देकर एक विशेष उत्पाद बनाने की क्षमता है, जब उन्हीं रासायनिक अवस्थाओं में अनेक उत्पाद बनना संभव हो। विभिन्न उत्प्रेरकों की वरणात्मकता भिन्न होती है। उदाहरणार्थ H2 एवं CO से प्रारंभ करके एवं भिन्न उत्प्रेरकों के प्रयोग से हम भिन्न-भिन्न उत्पाद प्राप्त कर सकते हैं।
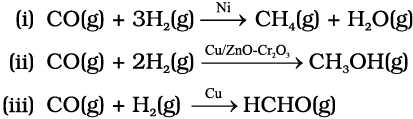
अतः यह निष्कर्ष निकाला जा सकता है कि, उत्प्रेरक के कार्य की प्रकृति अत्यधिक विशिष्ट होती है। इसलिए एक पदार्थ जो एक अभिक्रिया में उत्प्रेरक का कार्य करता है अन्य अभिक्रियाओं को उत्प्रेरित करने में असमर्थ हो सकता है।
5.2.3 ज़िओलाइटों का आकार वरणात्मक उत्प्रेरण
वह उत्प्रेरकी अभिक्रिया जो उत्प्रेरक की रंध्र संरचना एवं अभिक्रियक एवं उत्पाद अणुओं के साइज (आकार) पर निर्भर करती है, आकार वरणात्मक उत्प्रेरण कहलाती है। मधु-छत्ते जैसी संरचना के कारण ज़िओलाइट अच्छे आकार-वरणात्मक उत्प्रेरक हैं। यह सिलिकेटस के त्रिविमीय नेटवर्क वाले सूक्ष्मरंध्री एेलुमिनो सिलीकेट होते हैं, जिनमें कुछ सिलिकन परमाणु एेलुमिनियम के परमाणुओं द्वारा प्रतिस्थापित होकर Al-O-Si ढाँचा बनाते हैं। ज़िओलाइटों में होने वाली अभिक्रियाएं अभिक्रियक तथा उत्पाद अणुओं के आकार एवं आकृति के साथ-साथ ज़िओलाइटों के सरंध्रों एवं कोटरों (Cavities) पर निर्भर करती हैं। ज़िओलाइट प्रकृति में पाए जाते हैं तथा उत्प्रेरक वरणात्मकता के लिए संश्लेषित भी किए जाते हैं।
ज़िओलाइट पेट्रोरसायन उद्योग में हाइड्रोकार्बनों के भंजन एवं समावयवन में उत्प्रेरक के रूप में व्यापक रूप से प्रयुक्त किए जा रहे हैं। ZSM-5 पेट्रोलियम उद्योग में प्रयुक्त होने वाला एक महत्वपूर्ण ज़िओलाइट उत्प्रेरक है। यह एेल्कोहॉल का निर्जलीकरण करके हाइड्रोकार्बनों का मिश्रण बनता है और उन्हें सीधे ही गैसोलीन (पेट्रोल) में परिवर्तित कर देता है।
5.2.4 एन्जाइम उत्प्रेरण
एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक हैं जो कि जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। वास्तविक रूप में ये उच्च अणु द्रव्यमान वाले प्रोटीन अणु हैं जो जल में कोलॉइडी विलयन बनाते हैं। ये बहुत प्रभावी उत्प्रेरक होते हैं जो अनेक, विशेष रूप से प्राकृतिक प्रक्रमों से संबंधित अभिक्रियाओं को उत्प्रेरित करते हैं। जंतुओं एवं पौधों में जीवन प्रक्रम के अनुरक्षण के लिए होने वाली अनेक शारीरिक अभिक्रियाएं, एन्जाइमों द्वारा उत्प्रेरित होती हैं। अतः एन्जाइमों के लिए जैवरासायनिक उत्प्रेरक शब्द का प्रयोग होता है एवं उत्प्रेरण की परिघटना जैवरासायनिक उत्प्रेरण कहलाती है।
कई एन्जाइम जीवित कोशिकाओं से परिशुद्ध क्रिस्टलीय अवस्था में प्राप्त किए गए हैं परंतु प्रयोगशाला में पहला एन्जाइम 1969 में संश्लेषित किया गया था। एन्जाइम उत्प्रेरित अभिक्रियाओं के कुछ उदाहरण निम्नलिखित हैं-
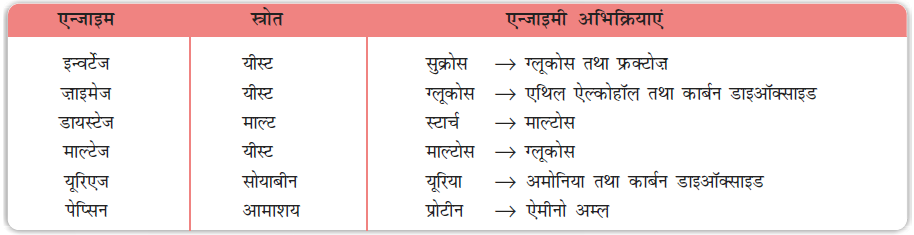
(i) इक्षु-शर्करा (सूक्रोस) का प्रतिलोमन- इन्वर्टेज एन्जाइम इक्षु-शर्करा (सूक्रोस) को ग्लूकोस एवं फ्रक्टोज़ में परिवर्तित कर देता है।
(ii) ग्लूकोस का एेथिल एेल्कोहॉल में परिवर्तन- ज़ाइमेज एन्जाइम ग्लूकोस को एथिल एेल्कोहॉल एवं कार्बन डाइअॉक्साइड में परिवर्तित कर देता है।
(iii) स्टार्च का माल्टोस में परिवर्तन- डायस्टेज एन्जाइम स्टार्च को माल्टोस में परिवर्तित कर देता है।
(iv) माल्टोस का ग्लूकोस में परिवर्तन- माल्टेज एन्जाइम माल्टोस को ग्लूकोस में परिवर्तित कर देता है।
(v) यूरिया का अमोनिया एवं कार्बन डाइऑक्साइड में अपघटन- यूरिएज एन्जाइम इस अपघटन को उत्प्रेरित करता है।
(vi) आमाशय में पेप्सिन एन्जाइम प्रोटीनों को पेप्टाइडों में परिवर्तित करता है जबकि आँत में अग्नाशय ट्रिप्सिन प्रोटीनों को जल अपघटन द्वारा एमीनो अम्लों में परिवर्तित करता है।
(vii) दुग्ध का दही में परिवर्तन- यह एक एन्जाइमिक अभिक्रिया है जो कि दही में उपस्थित लेक्टोबैसिलस एन्जाइम द्वारा होती है।
सारणी 5.2 में कुछ प्रमुख एन्जाइमी अभिक्रियाओं का सारांश दिया गया है।
सारणी 5.2- कुछ एन्जाइमी अभिक्रियाएं
एन्जाइम उत्प्रेरण के अभिलक्षण-
एन्जाइम उत्प्रेरण दक्षता एवं उच्च कोटि की विशिष्टता में अनूठा है। एन्जाइम उत्प्रेरण के द्वारा निम्न अभिलक्षण दर्शाए जाते हैंः
(i) सर्वोत्तम दक्षता - एन्जाइम का एक अणु अभिक्रियक के दस लाख अणुओं को प्रति मिनट परिवर्तित कर सकता है।
(ii) उच्च विशिष्ट प्रकृति- प्रत्येक एन्जाइम की विशिष्टता किसी एक अभिक्रिया के लिए होती है अर्थात् एक उत्प्रेरक एक से अधिक अभिक्रियाओं को उत्प्रेरित नहीं कर सकता। उदाहरणार्थ एन्जाइम यूरिएज, केवल यूरिया के जल अपघटन को उत्प्रेरित करता है। यह किसी अन्य एमाइड के जल अपघटन को उत्प्रेरित नहीं करता।
(iv) इष्टतम pH पर सर्वाधिक सक्रिय- एन्जाइम उत्प्रेरित अभिक्रिया की दर एक निश्चित pH पर जिसे इष्टतम pH कहते हैं, अधिकतम होती है इसका मान 5-7 के मध्य होता है।
(v) सक्रियक एवं सहएन्जाइमों की उपस्थिति में वर्धमान सक्रियता - एन्जाइम की सक्रियता कुछ पदार्थों की उपस्थिति में, जिन्हें सहएन्जाइम कहते हैं, बढ़ जाती है। यह देखा गया है कि जब थोड़ा सा अप्रोटीन (जैसे विटामीन), एन्जाइम के साथ उपस्थित होता है तो, एन्जाइमी की उत्प्रेरकी महत्वपूर्ण रूप से बढ़ जाती है। सक्रियक साधारणतया धात्विक आयन जैसे Na+ Mn2+ Co2+, Cu2++ आदि होते हैं। ये धात्विक आयन एन्जाइम अणुओं से दुर्बल रुप से आबंधित होने पर उत्प्रेरकी सक्रियता बढ़ा देते हैं। एमिलेज सोडियम क्लोराइड की उपस्थिति में अर्थात् Na+ आयनों की उपस्थिति उत्प्रेरकीय रुप में बहुत सक्रिय होता है।
(vi) संदमक एवं विष का प्रभाव- सामान्य उत्प्रेरकों के समान एन्जाइम भी कुछ पदार्थों की उपस्थिति में संदमित एवं विषाक्त हो जाते हैं। संदमक अथवा विष, एन्जाइम की सतह पर उपस्थित सक्रिय क्रियात्मक समूहों से अन्योन्यक्रिया करके एन्जाइमों की उत्प्रेरकी सक्रियता को प्रायः कम या पूरी तरह समाप्त कर देते हैं। शरीर में कई औषधों का प्रयोग उनके एन्जाइम को संदमित करने के गुण से संबंधित होता है। शरीर में कई औषधों की क्रिया एन्जाइम संदमक से संबंधित होती है।
एन्जाइम उत्प्रेरण की क्रियाविधि-
एन्जाइम के कोलॉइडी कणों की सतहों पर बहुत सारे कोटर होते हैं। ये कोटर अभिलक्षणिक आकृति के होते हैं एवं इनमें सक्रिय समूह जैसे- -NH2, -COOH, -SH, -OH, आदि होते हैं। वास्तव में यह सतह पर उपस्थित सक्रिय केंद्र होते हैं। अभिक्रियक के अणु जिनकी परिपूरक आकृति होती है, इन कोटरों में एक ताले में चाबी के समान फिट हो जाते हैं। सक्रिय समूहों की उपस्थिति के कारण एक सक्रियत संकुल बनता है जो विघटित होकर उत्पाद देता है।
इस प्रकार, एन्जाइम उत्प्रेरित अभिक्रियाओं का दो पदों में सम्पन्न होना माना जा सकता है।
पद 1 - सक्रियत संकुल बनाने के लिए एन्जाइम का सबस्ट्रेट से आबंधन
E + S → ES
पद 2 - उत्पाद बनाने के लिए सक्रियत संकुल का विघटन
ES → E + P
5.2.5 उद्योगों में उत्प्रेरण
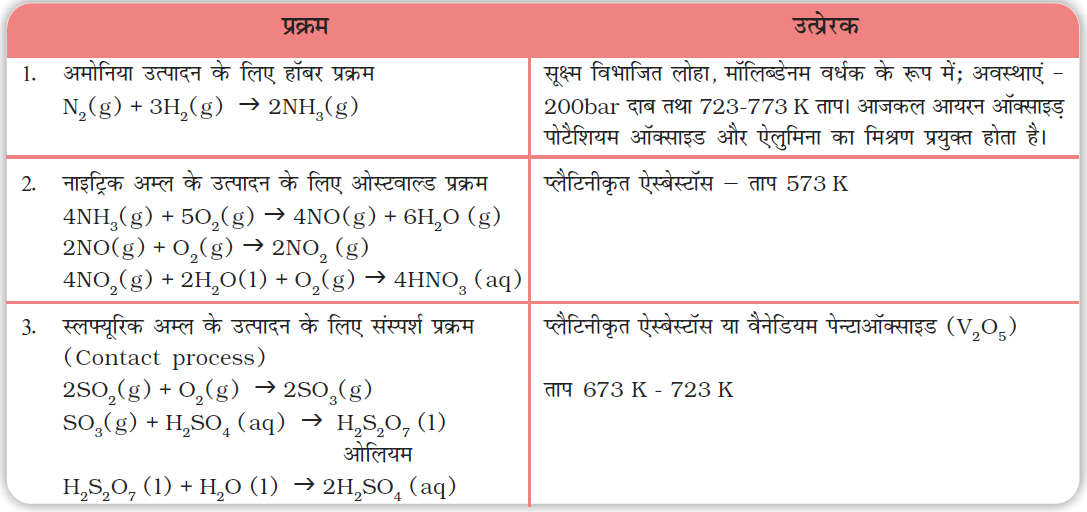
उद्योगों में उत्प्रेरण की उपयोगिता का बोध कराने के लिए सारणी 5.3 में कुछ महत्वपूर्ण तकनीकी उत्प्रेरक प्रक्रम दिए गए हैं।
सारणी 5.3- कुछ औद्योगिक उत्प्रेरकी प्रक्रम
पाठ्यनिहित प्रश्न
5.4 हॉबर प्रक्रम में हाइड्रोजन को NiO उत्प्रेक की उपस्थिति में मेथेन के साथ भाप की अभिक्रिया द्वारा प्राप्त किया जाता है। प्रक्रम को भाप-पुनःसंभावन कहते हैं। अमोनिया प्राप्त करने के लिए हॉबर प्रक्रम में CO को हटाना क्यों आवश्यक है?
5.5 एस्टर का जलअपघटन प्रारंभ में धीमा एवं कुछ समय पश्चात तीव्र क्यों हो जाता है?
5.6 उत्प्रेरण के प्रक्रम में विशोषण की क्या भूमिका है?
5.3 कोलॉइड
हम एकक-2 में सीख चुके हैं कि विलयन समांगी निकाय होते हैं। हम यह भी जानते हैं कि रेत को जल में हिलाने पर यह निलंबन देती है जो कि समय के साथ धीरे-धीरे नीचे बैठ जाता है। निलंबन एवं विलयन की पराकाष्ठाओं के बीच हम निकायों का एक वृहद् समूह पाते हैं जिसे कोलॉइडी परिक्षेपण या सामान्यतया कोलॉइड कहते हैं।
कोलॉइड एक विषमांगी तंत्र होता है जिसमें एक पदार्थ बहुत बारीक कणों के रूप में (परिक्षिप्त प्रावस्था) एक दूसरे पदार्थ में परिक्षेपित रहता है जिसे परिक्षेपित माध्यम कहते हैं।
विलयन एवं कोलॉइड में अनिवार्य अंतर कण के माप में होता है। विलयन में अवयव कण, आयन या छोटे अणु होते हैं जबकि कोलॉइड में परिक्षिप्त प्रावस्था एक वृहदणु (जैसे प्रोटीन या संष्लेषित बहुलक) या कई परमाणुओं, आयनों या अणुओं का संकलन होता है। कोलॉइड कण सामान्य अणुओं से बड़े परंतु निलंबन में रहने योग्य छोटे होते हैं। उनके व्यास की सीमा 1 और 1000 nm (10-9 से 10-6 m) के बीच होती है।
कम माप के कारण कोलॉइडी कणों का प्रतिग्राम पृष्ठ क्षेत्रफल बहुत अधिक होता है। 1 cm भुजा वाले एक घन पर विचार कीजिए। इसका कुल पृष्ठ क्षेत्रफल 6 cm2 होगा। यदि इसे 1012 बराबर घनों में बाँटा जाये तो इन घनों का माप बड़े कोलॉइडी कण के माप के बराबर होगा तथा इनका कुल पृष्ठ क्षेत्रफल 60,000 cm2 या 6 m2 होगा। इस विशाल पृष्ठ क्षेत्रफल के कारण कोलॉइड के कुछ विशेष गुण होते हैं, जिनकी चर्चा हम इस एकक में आगे करेंगे।
5.4 कोलॉइडों का वर्गीकरण
कोलॉइडों को निम्न मापदंडों के आधार पर वर्गीकृत किया गया है-
(i) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था।
(ii) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया की प्रकृति।
(iii) परिक्षिप्त प्रावस्था के कणों का प्रकार।
5.4.1 परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर वर्गीकरण
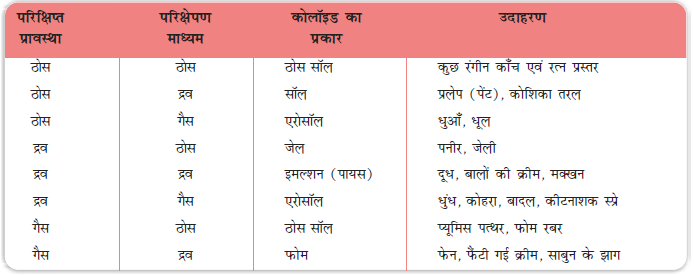
इस आधार पर कि परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम ठोस, द्रव अथवा गैस हैं, आठ प्रकार के कोलॉइडी तंत्र संभव हैं। एक गैस का दूसरी गैस के साथ मिश्रण समांगी होता है, अतः यह कोलॉइडी तंत्र नहीं होता। विभिन्न प्रकार के कोलॉइडों के उदाहरण उनके विशिष्ट नामों सहित सारणी 5.4 में दिए गए हैं।
अनेक परिचित व्यावसायिक उत्पाद एवं प्राकृतिक वस्तुएं कोलॉइड हैं उदाहरण के लिए, फेटी हुई क्रीम झाग है जिसमें गैस, द्रव में परिक्षिप्त है। हवाई जहाजों के आपात्कालीन अवतारण (Landing) के समय उपयोग किए जाने वाले अग्निशामक फोम भी कोलॉइडी तंत्र होते हैं। अधिकांश जैविक तरल, जलीय सॉल (जल में परिक्षिप्त ठोस) होते हैं। एक प्रारूपी कोशिका में उपस्थित प्रोटीन एवं न्यूक्लीक अम्ल कोलॉइड के आकार के कण होते हैं जो आयनों एवं लघुअणुओं के जलीय विलयन में परिक्षिप्त होते हैं।
सारणी 5.4- कोलॉइडी तंत्रों के प्रकार
5.4.2 परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया की प्रकृति के आधार पर वर्गीकरण
सारणी 5.4 में दिए गए विभिन्न प्रकार के कोलॉइडों में से सबसे अधिक प्रचलित सॉल (द्रवों में ठोस), जेल (ठोसों में द्रव) तथा इमल्शन (द्रव में द्रव) हैं। किंतु, इस अध्याय में हम केवल सॉल एवं इमल्शनों के बारे में अध्ययन करेंगे। आगे यह भी कहा जा सकता है कि यदि परिक्षेपण माध्यम जल हो तो सॉल को जलविलय (एक्वासॉल) या हाइड्रोसॉल एवं यदि परिक्षेपण माध्यम एेल्कोहॉल हो तो उसे एेल्कोसॉल कहते हैं।
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया के आधार पर कोलॉइडी सॉल को दो वर्गों में विभाजित किया जा सकता है, यानि द्रवरागी (विलायक को आकर्षित करने वाले) एवं द्रवविरागी (विलायक को प्रतिकर्षित करने वाले)। यदि परिक्षेपण माध्यम जल हो तो जलरागी एवं जलविरागी नामों का प्रयोग किया जाता है।
(i) द्रवरागी कोलॉइड
द्रवरागी शब्द का अर्थ है द्रव को स्नेह करने वाला। गोंद, जिलेटिन स्टार्च, रबर आदि जैसे पदार्थों को उचित द्रव (परिक्षेपण माध्यम) में मिलाने पर सीधे ही प्राप्त होने वाले कोलॉइडी सॉल द्रवरागी कोलॉइड कहलाते हैं। सॉल की एक महत्वपूर्ण विशेषता यह होती है कि यदि परिक्षेपण माध्यम को परिक्षिप्त प्रावस्था से अलग कर दिया जाये (मान लीजिए वाष्पीकरण द्वारा) तो सॉल को केवल परिक्षेपण माध्यम के साथ मिश्रित करके पुनः प्राप्त किया जा सकता है। एेसे सॉल उत्क्रमणीय सॉल भी कहलाते हैं। इसके अतिरिक्त, ये सॉल पर्याप्त स्थायी होते हैं एवं इन्हें आसानी से स्कंदित नहीं किया जा सकता जिसकी विवेचना आगे की जाएगी।
(ii) द्रवविरागी कोलॉइड
द्रवविरागी शब्द का अर्थ है द्रव से घृणा करने वाला। धातुएं एवं उनके सल्फाइड आदि जैसे पदार्थ, केवल परिक्षेपण माध्यम में मिश्रित करने से कोलॉइडी सॉल नहीं बनाते। इनके कोलॉइडी सॉल केवल विशेष विधियों (जिनकी चर्चा हम आगे करेंगे) द्वारा ही बनाए जा सकते हैं। एेसे सॉल द्रवविरागी सॉल कहलाते हैं। एेसे सॉल को वैद्युत अपघट्य की थोड़ी सी मात्रा मिलाकर, गर्म करके या हिलाकर आसानी से अवक्षेपित (या स्कंदित) किया जा सकता है इसीलिए ये स्थायी नहीं होते। इसके अतिरिक्त एक बार अवक्षेपित होने के बाद ये केवल परिक्षेपण माध्यम के मिलाने मात्र से पुनः कोलॉइडी सॉल नहीं देते। अतः इनको अनुत्क्रमणीय सॉल भी कहते हैं। द्रवविरागी सॉल के परीक्षण के लिए स्थायी कारकों की आवश्यकता होती है।
5.4.3 परिक्षिप्त प्रावस्था के कणों के प्रकार पर आधारित वर्गीकरण- बहुआण्विक, बृहदाण्विक तथा सहचारी कोलॉइड
परिक्षिप्त प्रावस्था के कणों के प्रकार के आधार पर कोलॉइडों को बहुआणविक, बृहदाण्विक तथा सहचारी कोलॉइडों में वर्गीकृत किया जाता है।
(i) बहुआण्विक कोलॉइड- विलीन करने पर किसी पदार्थ के बहुत से परमाणु या लघु अणु एकत्रित होकर पुंज जैसी एेसी स्पीशीज बनाते हैं जिनका आकार (साइज) कोलॉइडी सीमा (व्यास <1nm) में होता है। इस प्रकार प्राप्त स्पीशीज़ बहुआण्विक कोलॉइड कहलाती है। उदाहरण के लिए एक गोल्ड सॉल में अनेक परमाणु युक्त भिन्न-भिन्न आकारों के कण हो सकते हैं। सल्फर सॉल में एक हज़ार या उससे भी अधिक S8 सल्फर अणु वाले कण उपस्थित रहते हैं।
(ii) वृहदाण्विक कोलॉइड- वृहदाणु (एकक 15) उचित विलायकों में एेसे विलयन बनाते हैं जिनमें वृहदाणुओं का आकार कोलॉइडी सीमा में होता है एेसे निकाय वृहदाण्विक कोलॉइड कहलाते हैं। ये कोलॉइड बहुत स्थायी होते हैं और अनेक अर्थों में यथार्थ विलयनों के समान होते हैं। प्राकृतिक रूप से पाए जाने वाले वृहदाण्विक कोलॉइडों के उदाहरण हैं- स्टार्च, सेलुलोज प्रोटीन और एन्जाइम एवं मानव निर्मित वृहदाणु हैं- पॉलीथीन, नायलोन, पॉली स्टायरीन, संश्लेषित रबर आदि।
(iii) सहचारी कोलॉइड (मिसेल)- कुछ पदार्थ एेसे हैं जो कम सांद्रताओं पर सामान्य प्रबल वैद्युतअपघट्य के समान व्यवहार करते हैं परन्तु उच्च सांद्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार पुंजित कण मिसेल कहलाते हैं। ये सहचारी कोलॉइड भी कहलाते हैं। मिसेल केवल एक निश्चित ताप से अधिक ताप पर बनते हैं जिसे क्राफ्ट ताप कहते हैं, एवं सांद्रता एक निश्चित सांद्रता से अधिक होती है, जिसे क्रांतिक मिसेल सांद्रता (Cmc) कहते हैं। तनु करने पर ये कोलॉइड पुनः अलग-अलग आयनों में टूट जाते हैं। पृष्ठ सक्रिय अभिकर्मक जैसे साबुन एवं संश्लेषित परिमार्जक इसी वर्ग में आते हैं। साबुनों के लिए cmc का मान 10-4 से 10-3 mol L-1 होता है। इन कोलॉइडों में द्रवविरागी एवं द्रवरागी दोनों ही भाग होते हैं। मिसेल में 100 या उससे अधिक अणु हो सकते है।
मिसेल निर्माण की क्रियाविधि
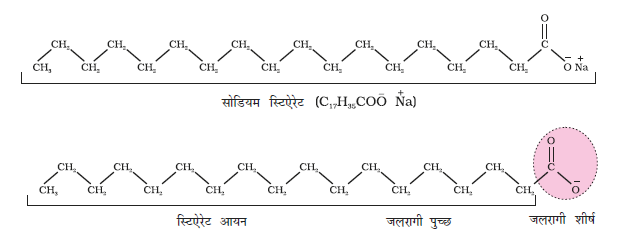
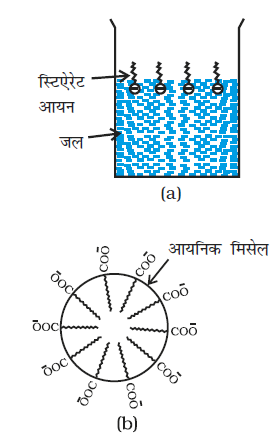
आइए, हम साबुन के विलयन का उदाहरण लेते हैं। पानी में घुलनशील साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं जिन्हें RCOO- M+ द्वारा व्यक्त किया जा सकता है। उदाहरणार्थ, सोडियम स्टिएेरेट (जो कि अनेक बट्टी वाले साबुनों का प्रमुख घटक है।) जल में विलीन करने पर RCOO- एवं Na+ आयनों में विघटित हो जाता है। किंतु RCOO- आयन के दो भाग होते हैं- एक लंबी हाइड्रोकार्बन शृंखला (जिसे ‘अध्रुवीय पुच्छ’ भी कहते हैं), जो जलविरागी (जल प्रतिकर्षी) होती है तथा ध्रुवीय समूह COO- (जिसे ‘ध्रुवीय आयनिक शीर्ष’ भी कहते हैं।) जो जलरागी (जल को स्नेह करने वाला) होता है।
RCOO- आयन पृष्ठ पर इस प्रकार उपस्थित रहते हैं कि उनका COO- समूह जल में तथा हाइड्रोकार्बन शृंखला R, पृष्ठ से दूर रहती है। परंतु क्रांतिक मिसेल सांद्रता पर ऋणायन विलयन के स्थूल में खिंच आते हैं एवं गोलीय आकार में इस प्रकार एकत्रित हो जाते हैं कि इनकी हाइड्रोकार्बन शृंखलाएं गोले के केंद्र की ओर इंगित होती है तथा COO- भाग गोले के पृष्ठ पर रहता है। इस प्रकार बना पुंज आयनिक मिसेल कहलाता है। इन मिसेलों में इस प्रकार के 100 तक आयन हो सकते हैं।
चित्र 5.5- स्टीएेरेट आयन के जलरागी एवं जलविरागी भाग
इसी प्रकार अपमार्जकों जैसे सोडियम लॉरिल सल्फेट, CH3(CH2)11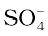 Na+ में लंबी हाइड्रोकार्बन शृंखला सहित -
Na+ में लंबी हाइड्रोकार्बन शृंखला सहित - 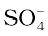 ध्रुवीय समूह है, अतः मिसेल बनने की क्रियाविधि साबुनों के समान ही है।
ध्रुवीय समूह है, अतः मिसेल बनने की क्रियाविधि साबुनों के समान ही है।
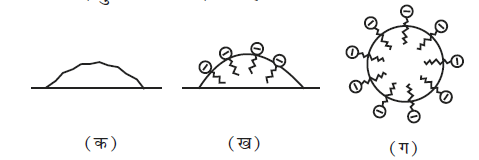
चित्र 5.6- (क) साबुन की निम्न सांद्रता पर, जल के पृष्ठ पर स्टिएेरेट आयनों की व्यवस्था (ख) साबुन की क्रांतिक मिसेल सांद्रता पर जल के आंतरिक स्थूल में स्टिएेरेट आयनों की व्यवस्था (आयनिक मिसेल)
साबुनों की शोधन-क्रिया- यह पहले बताया जा चुका है कि मिसेल में एक जल विरोधी हाइड्रोकार्बन का केंद्रीय क्रोड होता है। साबुन की शोधन-क्रिया इस यथार्थ के कारण है कि साबुन के अणु तेल की बूँदों के चारों ओर इस प्रकार से मिसेल बनाते हैं कि स्टिएेरेट आयन का जलविरागी भाग बूूँदों के अंदर होता है एवं जलरागी भाग चिकनाई की बूँदों के बाहर (चित्र 5.7) काँटों की तरह निकला रहता है। चूँकि ध्रुवीय समूह जल से अन्योन्यक्रिया कर सकते हैं, अतः स्टिएेरेट आयनों से घिरी हुई तेल की बूँदें जल में खिंच जाती हैं एवं गंदी सतह से हट जाती है। इस प्रकार साबुन तेलों तथा वसाओं का पायसीकरण (Emulsification) करके धुलाई में सहायता करता है। छोटी गोलियों के चारों ओर का ऋण आवेशित आवरण उन्हें एक साथ आकर पुंज बनाने से रोकता है।
चित्र 5.7- (क) कपड़े पर ग्रीस (ख) ग्रीस बूंदों के चारों ओर व्यवस्थित स्टिएेरेट आयन
(ग) स्टिएेरेट आयनों द्वारा घिरी ग्रीस की बूंदे (बनी हुई मिसेल)।
5.4.4 कोलॉइड बनाना
कोलॉइड बनाने की कुछ महत्वपूर्ण विधियाँ निम्नलिखित हैं-
(क) रासायनिक विधियाँ- कोलॉइडी परिक्षेपण द्विक अपघटन, अॉक्सीकरण, अपचयन अथवा जल अपघटन जैसी रासायनिक अभिक्रियाओं द्वारा, जिनमें अणु निर्मित होते हैं, बनाए जा सकते हैं। ये अणु पुंजित होकर सॉल का निर्माण करते हैं।
(ख) विद्युतीय विघटन या ब्रेडिग आर्क विधि- इस प्रक्रम में परिक्षेपण एवं संघनन दोनों ही सम्मिलित हैं। गोल्ड, सिल्वर, प्लेटिनम इत्यादि धातुओं के कोलॉइडी सॉल इस विधि द्वारा बनाये जा सकते हैं। इस विधि में परिक्षेपण माध्यम में डूबे धातु के इलैक्ट्रोडों के बीच एक विद्युत आर्क उत्पन्न किया जाता है (चित्र 5.8)। इससे उत्पन्न अत्यधिक ऊष्मा धातु को वाष्पित कर देती है जो फिर संघनित होकर कोलॉइडी आकार के कण बनाती है।
चित्र 5.8- ब्रेडिग आर्क विधि
5.4.5 कोलॉइडी विलयनों का शुद्धिकरण
कोलॉइडी विलयन बनाते समय उनमें वैद्युतअपघट्य की अतिरिक्त मात्रा एवं कुछ अन्य विलेय अशुद्धियाँ होती हैं। विद्युत अपघट्य की आंशिक मात्रा में उपस्थिति, कोलॉइडी विलयन के स्थायित्व के लिए आवश्यक है, लेकिन इसकी अधिक मात्रा कोलॉइड को स्कंदित कर देती है, अतः यह आवश्यक है कि इन विलेय अशुद्धिओं की सांद्रता को आपेक्षित सीमा तक कम कर दिया जाए। अशुद्धियों को आवश्यक सीमा तक कम करने के लिए प्रयुक्त प्रक्रम को कोलॉइडी विलियनों का शुद्धिकरण कहते हैं। कोलॉइडी विलयनों का शुद्धिकरण निम्नलिखित विधियों द्वारा किया जाता है।
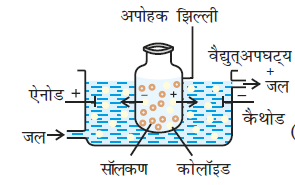
(i) अपोहन (Dialysis)
यह एक उपयुक्त झिल्ली द्वारा अपोहन करके कोलॉइडी विलयन में से घुले हुए पदार्थों को निकालने का प्रक्रम है। चूँकि वास्तविक विलयन के कण (आयन या छोटे अणु) जांतव झिल्ली (ब्लैडर), पार्चमेन्ट पत्र या सेलोफेन शीट में से निकल सकते हैं परंतु कोलॉइडी कण नहीं, अतः झिल्ली को अपोहन में प्रयुक्त किया जा सकता है। इस उद्देश्य के लिए प्रयुक्त उपकरण अपोहक कहलाता है। कोलॉइडी विलयन से भरा एक उपयुक्त झिल्ली का बैग एक पात्र में लटकाया जाता है जिसमें से होकर जल निरंतर बहता रहता है (चित्र 5.9)। अणु एवं आयन झिल्ली में से विसरित होकर बाहरी जल में आ जाते हैं एवं शुद्ध कोलॉइडी विलयन शेष रह जाता है।
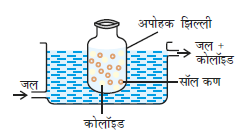
चित्र 5.9- अपोहन
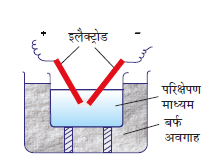
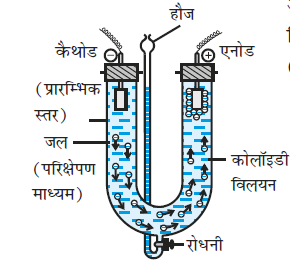
(ii) वैद्युत् अपोहन
साधारणतया अपोहन का प्रक्रम बहुत मन्द होता है। यदि अशुद्ध कोलॉइडी विलयन में विलेय पदार्थ केवल वैद्युत अपघट्य हो तो इसे विद्युत-क्षेत्र लगाकर तेज किया जा सकता है। तब इस प्रक्रम को वैद्युत् अपोहन नाम दिया जाता है। कोलॉइडी विलयन को एक उपयुक्त झिल्ली के बैग में रखा जाता है तथा शुद्ध जल को बाहर लिया जाता है। चित्र 5.10 में दर्शाये अनुसार कक्ष में इलैक्ट्रोड लगाये जाते हैं। कोलॉइडी विलयन में उपस्थित आयन विपरीत आवेश वाले इलेक्ट्रोडों की ओर झिल्ली से बाहर गमन कर जाते हैं।
चित्र 5.10- वैद्युत्अपोहन
(iii) अतिसूक्ष्म निस्यंदन
अतिसूक्ष्म निस्यंदन वह प्रक्रम है जिसमें विशेष रूप से निर्मित निस्यंदक (फिल्टर) द्वारा, जो कि कोलॉइडी कणों के अलावा अन्य सभी पदार्थों के लिए पारगम्य होता है, कोलॉइडी विलयन में उपस्थित विलायकों एवं घुलनशील विलेयों को पृथक किया जाता है। कोलॉइडी कण सामान्य निस्यंदक पत्र में से गुज़र सकते हैं क्योंकि इनके रंध्र बहुत बड़े होते हैं, किंतु कोलॉइडी कणों को निकलने से रोकने के लिए निस्यंदक को कोलोडियन में संसेचित कर इसके रंध्रों का आकार छोटा किया जा सकता है। सामान्य कोलोडियन एेल्कोहॉल एवं ईथर के मिश्रण में नाइट्रोसेलुलोस का 4% विलयन होता है। एक अतिसूक्ष्म निस्यंदक पत्र को एक कोलोडियन विलयन में भिगोकर, फर्मेल्डिहाइड में कठोर बनाकर एवं अंत में सुखाकर बनाया जा सकता है। इस प्रकार के अतिसूक्ष्म निस्यंदक पत्र का प्रयोग कर कोलॉइडी कणों को अन्य पदार्थों से पृथक किया जा सकता है। अतिसूक्ष्म निस्यंदन एक धीमा प्रक्रम है। प्रक्रम की गति बढ़ाने के लिए दाब या चूषण का प्रयोग किया जाता है। शुद्ध कोलॉइडी विलयन प्राप्त करने के लिए निस्यंदक पत्र पर शेष बचे कोलॉइडी कणों को ताज़े परिक्षेपण माध्यम (विलायक) के साथ हिलाया जाता है।
5.4.6 कोलॉइडी विलयनों के गुण
कोलॉइडी विलयनों द्वारा दर्शाये जाने वाले विभिन्न गुण नीचे वर्णित किए गए हैं -
(i) अणुसंख्यक गुण
कोलॉइडी कण बड़े पुंज होने के कारण एक कोलॉइडी विलयन में, वास्तविक विलयन की तुलना में कणों की संख्या कम होती है। अतः समान सांद्रताओं पर अणुसंख्यक गुणों (परासरण दाब, वाष्पदाब में अवनमन, द्रवणांक में अवनमन एवं क्वथनांक में उन्नयन) के मान उसी सांद्रता के वास्तविक विलयनों द्वारा दर्शाये गये मानों से कम कोटि के होते हैं।
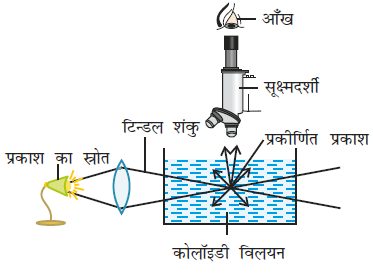
(ii) टिन्डल प्रभाव
यदि अंधेरे में रखा एक समांगी विलयन, प्रकाश की दिशा से देखा जाए, तो यह स्वच्छ दिखाई देता है एवं यदि इसे प्रकाश किरण पुंज की दिशा के लंबवत दिशा से देखा जाए तो यह पूर्णतया अदीप्त दिखाई देता है। कोलॉइडी विलयन को भी इसी प्रकार से पारगमन प्रकाश द्वारा देखने पर पर्याप्त स्वच्छ या पारदर्शी (जिसके आरपार देखा जा सके) दिखाई देते हैं परंतु उन्हें प्रकाश के पथ की दिशा से समकोण दिशा में देखने पर वे मंद से प्रबल दूधियापन दर्शाते हैं। अर्थात् प्रकाश किरण पुंज का पारगमन पथ नीले प्रकाश से प्रदीप्त हो जाता है। यह प्रभाव सर्वप्रथम फैराडे ने प्रेक्षित किया एवं बाद में टिन्डल ने इसका विस्तृत रूप में अध्ययन किया, अतः इसे टिन्डल प्रभाव कहा जाता है। प्रकाश का चमकीला कोन, टिन्डल शंकु कहलाता है (चित्र 5.11)। टिन्डल प्रभाव वास्तव में इस कारण से होता है कि कोलॉइडी कण, प्रकाश को दिक्-स्थान में सभी दिशाओं में प्रकीर्णित करते हैं। प्रकाश का यह प्रर्कीणन कोलॉइडी परिक्षेपण में किरण के पथ को प्रदीप्त करता है।
चित्र 5.11- टिन्डल प्रभाव
टिन्डल प्रभाव सिनेमा हॉल में पिक्चर के प्रोजेक्शन के समय हाल में उपस्थित धूल एवं धुएं के कणों द्वारा प्रकाश के प्रकीर्णन द्वारा देखा जा सकता है। टिन्डल प्रभाव तभी देखा जा सकता है जब निम्नलिखित दो शर्तें पूरी होती हैं-
(i) परिक्षिप्त कणों का व्यास प्रयुक्त प्रकाश की तरंगदैर्घ्य से बहुत कम नहीं होना चाहिए।
(ii) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के अपवर्तनांक परिमाप में बहुत अंतर होना चाहिए।
टिन्डल प्रभाव का उपयोग कोलॉइडी एवं वास्तविक विलयन में विभेद करने में किया जाता है। जिगमोन्डी ने 1903 में एक उपकरण, जिसे अतिसूक्ष्मदर्शी कहा जाता है, को बनाने में टिन्डल प्रभाव का उपयोग किया। एक काँच के पात्र में उपस्थित कोलॉइडी विलयन पर तीव्र प्रकाश किरण पुंज संकेंद्रित (Focus) किया जाता है। फिर इस संकेंद्रित प्रकाश के किरण पुंज को लंबवत दिशा में अतिसूक्ष्मदर्शी द्वारा देखा जाता है। पृथक-पृथक कोलॉइडी कण अंधेरी पृष्ठभूमि में चमकदार तारों के समान प्रतीत होते हैं। अतिसूक्ष्मदर्शी वास्तविक कोलॉइडी कणों को प्रदर्शित नहीं करता, बल्कि उनके द्वारा प्रकीर्णित प्रकाश का अवलोकन कराता है। अतः अतिसूक्ष्मदर्शी कोलॉइडी कणों के आकार एवं आकृति के बारे में कोई सूचना नहीं देता।
(iii) रंग-
कोलॉइडी विलयन का रंग परिक्षिप्त कणों के द्वारा प्रकीर्णित प्रकाश के तरंगदैर्घ्य पर निर्भर करता है। इसके अतिरिक्त, प्रकाश का तरंगदैर्घ्य कणों के आकार एवं प्रकृति पर निर्भर करता है। कोलॉइडी विलियनों का रंग प्रेक्षक द्वारा प्रकाश को ग्रहण करने के तरीके पर भी निर्भर करता है। उदाहरण के लिए दूध एवं पानी का मिश्रण परावर्तित प्रकाश में देखने पर नीला एवं संचरित प्रकाश में देखने पर लाल दिखाई देता है सूक्ष्मतम कणों वाले गोल्ड सॉल का रंग लाल होता है, जैसे-जैसे कणों का आकार बढ़ता जाता है यह बैंगनी, फिर नीला और अंत में स्वर्णिम हो जाता है।
(iv) ब्राउनी गति-
जब कोलॉइडी विलयनों को शक्तिशाली अतिसूक्ष्मदर्शी में देखा जाता है तो कोलॉइडी कण पूरे प्रेक्षित क्षेत्र में लगातार टेढ़ी-मेढ़ी गति की अवस्था में दिखाई देते हैं। यह गति सर्वप्रथम ब्रिटिश वनस्पति वैज्ञानिक रॉबर्ट ब्राउन ने प्रेक्षित की, इसीलिए इसे ब्राउनी गति कहते हैं (चित्र 5.12) । यह गति कोलॉइड की प्रकृति से स्वतंत्र होती है परन्तु कणों के आकार एवं विलयन की श्यानता (विस्कॉसिटी) पर निर्भर करती है। जितना छोटा आकार होगा एवं श्यानता जितनी कम होगी, गति उतनी ही तीव्र होगी।
चित्र 5.12- ब्राउनी गति
ब्राउनी गति को परिक्षेपण माध्यम के अणुओं द्वारा कोलॉइडी कणों से असमान टक्कर के द्वारा समझाया गया है। ब्राउनी गति बिलोडन प्रभाव डालती है जो कणों को स्थिर नहीं होने देता तथा इस प्रकार कोलॉइडी सॉल के स्थायित्व के लिए उत्तरदायी होता है।
(v) कोलॉइडी कणों पर आवेश-
कोलॉइडी कणों पर हमेशा विद्युत आवेश रहता है। विलयन के सभी कोलॉइडी कणों पर आवेश की प्रकृति समान होती है जो कि धनात्मक या ऋणात्मक हो सकती है। कुछ सामान्य सॉल की सूची उनके कणों पर आवेश की प्रकृति के साथ नीचे दी गई है-
कोलॉइडी कणों पर बराबर एवं एक जैसे आवेशों की उपस्थिति कोलॉइडी विलयनों को स्थायित्व देने के लिए मुख्य रुप से उत्तरदायी होती है क्योंकि समान आवेशों के मध्य प्रतिकर्षण बल उन्हें पास-पास आकर सहमिलन या पुंजित होने से रोकते हैं।
सॉल कणों पर आवेश एक या अधिक कारणों से होता है यथा धातुओं के वैद्युतपरिक्षेपण के समय सॉल कणों के द्वारा इलैक्ट्रॉन प्रग्रहण (Capture), विलयन से आयनों का अधिमान्य अधिशोषण एवं/या विद्युतीय दोहरी परत बनने के कारण आयनों का अधिमान्य अधिशोषण के कारण साल कणों पर आवेश उत्पन्न होने का विवरण नीचे दिया गया है।
सॉल कण धनात्मक या ऋणात्मक आयनों के अधिमान्य अधिशोषण द्वारा धनात्मक या ऋणात्मक आवेश ग्रहण कर लेते हैं। परिक्षेपण माध्यम में दो या अधिक आयन उपस्थित होने पर कोलॉइडी कणों द्वारा उस आयन का अधिमान्य अधिशोषण होता है जो कोलॉइड में भी उपस्थित होता है। इसे निम्नलिखित उदाहरण द्वारा समझा जा सकता है।
(क) जब सिल्वर नाइट्रेट के अत्यधिक तनु विलयन को पोटैशियम आयोडाइड के अत्यधिक तनु विलयन में मिलाया जाता है, तब अवक्षेपित सिल्वर आयोडाइड परिक्षेपण माध्यम में से आयोडाइड आयनों को अधिशोषित करके ऋण-आवेशित कोलॉइडी सॉल देता है। किंतु जब KI विलयन को AgNO3 विलयन में मिलाया जाता है तो परिक्षेपण माध्यम से Ag+ आयनों के अधिशोषण के कारण धन-आवेशित सॉल बनता है।
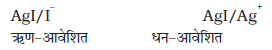
(ख) यदि गर्म जल के आधिक्य में FeCl3 मिलाया जाये तो Fe3+ आयनों के अधिशोषण से धन आवेशित जलयोजित फेरिक अॉक्साइड का सॉल बनता है। किंतु यदि फेरिक क्लोराइड को NaOH विलयन में मिलाया जाये तो OH- आयनों के अधिशोषण के साथ एक ऋण-आवेशित सॉल प्राप्त होता है।
उपरोक्त अधिमान्य अधिशोषण द्वारा पृष्ठ पर धन या ऋण आवेश ग्रहण कर लेने के पश्चात् कोलॉइडी कणों की सतह माध्यम में से प्रतिआयनों को आकर्षित करती है जिससे आयनों की दूसरी परत बनती है जैसा कि नीचे दर्शाया गया है।
कोलॉइडी कणों के चारों ओर विपरीत आवेशों की दो परतों का संयोजन हेल्महोल्त्स विद्युतीय दोहरी परत कहलाता है। आधुनिक विचारों के अनुसार आयनों की प्रथम परत दृढ़तापूर्वक बँधी रहती है, जिसे स्थिर परत कहते हैं, जबकि दूसरी परत गतिशील होती है जिसे विसरित परत कहते हैं। चित्र 5.13 में दोहरी परत का बनना दर्शाया गया है। आवेशों का पृथक्करण विभव का आधार होता है, अतः स्थिर एवं विसरित भागों पर विपरीत चिह्न के आवेशों के कारण दोनोें परतों के मध्य विभवान्तर उत्पन्न हो जाता है। वैसे ही जैसे कि संघरित्र में विभवान्तर उत्पन्न होता है। विपरीत आवेशों वाली स्थिर एवं विसरित परतों के मध्य यह विभवान्तर वैद्युत गतिक विभव या जीटा विभव कहलाता है।
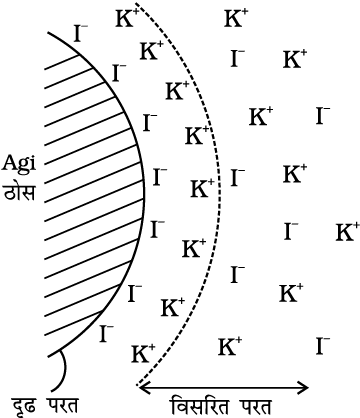
चित्र 5.13 (क)- वैद्युत कण संचलन
यदि दो अघुलनशील कणों (अवक्षेप) पर दोहरी परत न हो तो वह एक दूसरे के बहुत पास आ सकते हैं और तब आकर्षी वान्डरवाल्स बल उन्हें खींच कर एक साथ ले आते हैं। जब कणों पर दोहरी परत होती है, जैसा चित्र 5.13(क) में दर्शाया गया है तो समग्र प्रभाव यह होता है कि कण एक दूसरे से बहुत दूर तक विकर्षित हो जाते हैं। विकर्षण उन्हें पास-पास नहीं आने देता। वह परिक्षप्त रहते हैं और कोलॉइड स्थायित्व प्राप्त कर लेता है।
चित्र 5.13 (ख)- वैद्युत कण संचलन
(vi) वैद्युत कण संचलन (Eletrophoresis) -
कोलॉइडी कणों पर आवेश की उपस्थिति वैद्युत कण संचलन प्रयोग से संपुष्ट होती है। जब एक कोलॉइडी विलयन में डूबे हुये दो प्लैटिनम इलैक्ट्रोडों पर विद्युत विभव लगाया जाता है तो कोलॉइडी कण एक अथवा दूसरे इलैक्ट्रोड की ओर गमन करते हैं। विद्युत विभव के प्रभाव में कोलॉइडी कणों का संचलन वैद्युत कण संचलन कहलाता है। धनात्मक आवेशित कण कैथोड की ओर जबकि ऋणात्मक आवेशित कण एेनोड की ओर गति करते हैं। यह निम्नलिखित प्रायोगिक व्यवस्था से प्रदर्शित किया जा सकता है (चित्र 5.13(ख)।
जब किसी उपयुक्त प्रकार से वैद्युत कण संचलन अर्थात् कणों की गति रोकी जाती है तो यह देखा जाता है कि परिक्षेपण माध्यम विद्युत क्षेत्र में गति करना प्रारंभ कर देता है। यह परिघटना वैद्युत परासरण कहलाती है।
(vii) स्कंदन या अवक्षेपण
द्रवविरागी सॉल का स्थायित्व कोलॉइडी कणों पर आवेश के कारण होता है। यदि किसी प्रकार आवेश हटा दिया जाये तो कण एक-दूसरे के समीप आकर पुंजित (या स्कंदित) हो जायेंगे एवं गुरूत्व बल के कारण नीचे बैठ जाएंगे। कोलॉइडी कणों के नीचे बैठ जाने का प्रक्रम सॉल का स्कंदन या अवक्षेपण कहलाता है। द्रवस्नेही सॉल का स्कंदन निम्नलिखित विधियों से किया जा सकता है-
(क) वैद्युत कण संचलन द्वारा- कोलॉइडी कण विपरीत आवेशित इलैक्ट्रोड की ओर गति करते हैं एवं इलैक्ट्रोड पर आवेश विसर्जित करके अवक्षेपित हो जाते हैं।
(ख) दो विपरीत आवेशित सॉल को मिश्रित करके- जब दो विपरीत आवेशित सॉल लगभग समान अनुपात में मिश्रित किए जाते हैं, तो वे एक-दूसरे के आवेश को उदासीन करके आंशिक या पूर्णतया अवक्षेपित हो जाते हैं। जलयोजित फेरिक अॉक्साइड (धन-आवेशित सॉल) एवं आर्सेनियस सल्फाइड (ऋण-आवेशित सॉल) को मिश्रित करने पर ये अवक्षेपित हो जाते हैं। इस प्रकार का स्कंदन पारस्परिक स्कंदन कहलाता है।
(ग) क्वथन द्वारा- जब एक सॉल को उबाला जाता है तो परिक्षेपण माध्यम के अणुओं के साथ संघट्ट (Collision) बढ़ने से अधिशोषित परत विक्षुब्ध हो जाती है। इससे कणों पर उपस्थित आवेश कम हो जाता है और अंततः इसके कारण वे अवक्षेप के रूप में नीचे बैठे जाते हैं।
(घ) वैद्युतअपघट्य मिलाकर- जब एक वैद्युतअपघट्य प्रचुर मात्रा में मिलाया जाता है तो कोलॉइडी कण अवक्षेपित हो जाते हैं। इसका कारण यह है कि कोलॉइडी कण अपने से विपरीत आवेश वाले आयनों से अन्योन्यक्रिया करते हैं। इससे उदासीनीकरण होता है जिससे स्कंदन हो जाता है। कणों पर आवेश के उदासीनीकरण के लिए उत्तरदायी आयन स्कंदक आयन कहलाते हैं। एक ऋण आयन धनात्मक आवेशित सॉल का स्कंदन करता है और इसके विलोमतः भी होता है। यह देखा गया है कि साधारणतः ऊर्णी कर्मक आयन की संयोजकता जितनी अधिक होती है उतनी ही अधिक उसकी अवक्षेपण की क्षमता होती है। इसे हार्डी-शुल्से नियम कहते हैं। ऋण सॉल के स्कंदन में ऊर्णन क्षमता का क्रम Al3+>Ba2+>Na+ होता है।
इसी प्रकार धन सॉल के स्कंदन में ऊर्णन क्षमता का क्रम-
[Fe(CN)6]4- > PO43- > SO42- > Cl- होता है।
किसी विद्युत अपघट्य की मिली मोल प्रति लीटर में न्यूनतम सांद्रता जो किसी सॉल को दो घंटों में स्कंदित करने के लिए आवश्यक हो, स्कंदन मान कहलाती है। जितनी कम मात्रा की आवश्यकता होगी उतनी ही अधिक उस आयन की स्कंदन शक्ति होगी।
द्रवरागी सॉल का स्कंदन
द्रवरागी सॉल के स्थायित्व के लिए दो कारक उत्तरदायी होते हैं। ये दो कारक हैं, कोलॉइडी कणों पर आवेश एवं उनका विलायकयोजन। जब ये दोनों कारक हटा दिए जाते हैं, तो द्रवरागी सॉल को स्कंदित किया जा सकता है। यह (i) वैद्युतअपघट्य मिलाकर एवं (ii) उपयुक्त विलायक मिलाकर किया जा सकता है।
जब द्रवरागी सॉल में एल्कोहॉल एवं एेसीटोन जैसे विलायक मिलाए जाते हैं तो परिक्षिप्त प्रावस्था का निर्जलीकरण हो जाता है। इस परिस्थिति में वैद्युतअपघट्य की कम मात्रा से भी स्कंदन हो सकता है।
कोलॉइडों का रक्षण
द्रवरागी सॉल, द्रवविरागी सॉल की तुलना में अधिक स्थायी होते हैं। इसका कारण यह है कि द्रवरागी कोलॉइड व्यापक रूप से विलायकयोजित होते हैं अर्थात् कोलॉइड कण जिस द्रव में परिक्षिप्त होते हैं, उससे आच्छादित हो जाते हैं।
द्रवरागी कोलॉइडों में द्रवविरागी कोलॉइडों के रक्षण का अद्वितीय गुण होता है। जब द्रवरागी सॉल को द्रवविरागी सॉल में मिलाया जाता है तो द्रवरागी कण, द्रवविरागी कणों के चारों ओर एक परत बना लेते हैं एवं इस प्रकार वे उसकी वैद्युत अपघट्य से रक्षा करते हैं। इस उद्देश्य के लिए प्रयुक्त द्रवरागी कोलॉइड रक्षी कोलॉइड कहलाते हैं।
5.5 इमल्शन (पायस)
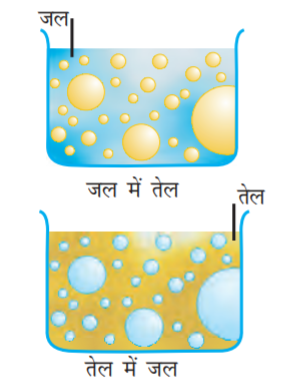
ये द्रव, द्रव कोलॉइडी निकाय हैं अर्थात् उनमें सूक्ष्म विभाजित द्रव की बूँदों का दूसरे द्रव में परिक्षेपण होता है। जब दो अमिश्रणीय या आंशिक मिश्रणीय द्रवों के मिश्रण को हिलाया जाता है, तो एक द्रव में दूसरे द्रव का अपरिष्कृत परिक्षेपण प्राप्त होता है जिसे इमल्शन (पायस) कहते हैं। सामान्यतया दो द्रवों में से एक जल होता है। इमल्शन दो प्रकार के होते हैं।
(i) तेल का जल में परिक्षेपण (o/w प्रकार) एवं
(ii) जल का तेल में परिक्षेपण (w/o प्रकार)
चित्र 5.14- इमल्शनों के प्रकार
प्रथम निकाय में जल परिक्षेपण माध्यम की तरह कार्य करता है। इस प्रकार के इमल्शन के उदाहरण हैं- दूध एवं वेनीशिंग क्रीम। दूध में, द्रव वसा जल में परिक्षिप्त होती है। दूसरे निकाय में, तेल परिक्षेपण माध्यम का कार्य करता है। इस प्रकार के सामान्य उदाहरण हैं- मक्खन एवं क्रीम।
तेल एवं जल के इमल्शन अस्थायी होते हैं और कभी-कभी रख देने पर दो परतों में अलग हो जाते हैं। इमल्शन के स्थायित्व के लिए सामान्यतया एक तीसरा घटक जिसे पायसीकर्मक कहते हैं, मिलाया जाता है। पायसीकर्मक, माध्यम एवं निलंबित कणों के मध्य एक अंतरापृष्ठीय फिल्म बनाता है। तेल/जल (o/w) इमल्शन के लिए प्रमुख पायसीकर्मक, प्रोटीन, गोंद, प्राकृतिक एवं संश्लेषित साबुन आदि हैं एवं जल/तेल (w/o) के लिए वसीय अम्लों के भारी धातुओं के लवण, लंबी शृंखला के एल्कोहॉल, काजल (Lamp Black) आदि हैं।
इमल्शन को परिक्षेपण माध्यम की किसी भी मात्रा से तनु किया जा सकता है। दूसरी ओर जब परिक्षिप्त द्रव को मिश्रित किया जाता है तो यह एक पृथक परत बना लेता है। इमल्शन में बिंदुक (droplets) बहुधा ऋणात्मक आवेशित होते हैं तथा वैद्युतअपघट्य के द्वारा अवक्षेपित किए जा सकते हैं। ये ब्राउनी गति तथा टिन्डल प्रभाव भी दर्शाते हैं। इमल्शनों को गर्म, ठंडा या अपकेंद्रण करके अवयवी द्रवों में तोड़ा जा सकता है।
5.6 हमारे चारों ओर कोलॉइड
दैनिक जीवन में हमारे संपर्क में आने वाले अधिकतर पदार्थ कोलॉइड होते हैं। हमारा भोजन, पहनने वाले वस्त्र, हमारे इस्तेमाल में आने वाला लकड़ी का फर्नीचर, हमारा घर, पढ़ने वाले समाचार पत्र मुख्यतः कोलॉइड से निर्मित होते हैं।
कुछ रोचक एवं उल्लेखनीय कोलॉइडों के उदाहरण निम्नलिखित हैं-
(i) आकाश का नीला रंग- हवा में जल के साथ निलंबित धूल के कण हमारी आँखों तक पहुँचने वाले प्रकाश को प्रकीर्णित करते हैं एवं हमें आकाश नीला दिखाई देता है।
(ii) कोहरा, धुंध एवं बरसात- जब हवा की बहुत बड़ी मात्रा जिसमें धूल के कण होते हैं, अपने ओसांक से नीेचे ठंडी हो जाती है तो हवा की नमी इन कणों पर संघनित हो जाती है और बिंदुक (droplets) बना लेती है। ये बिंदुक कोलॉइडी प्रकृति के होने के कारण हवा में धुंध या कोहरे के रूप में तैरते रहते हैं। बादल हवा में निलंबित जल के बिंदुकों से बने एेरोसॉल होते हैं। ऊपरी वायुमंडल में संघनन के कारण जल के कोलॉइडी बिंदुक और बड़े होते जाते हैं जब तक कि वे बरसात के रूप में नीेचे न आ जाएँ। कभी-कभी दो विपरीत आवेशित बादलों के मिलने से भी बरसात होती है।
विद्युतीकृत धूल को फेंककर या बादलों के विपरीत आवेश वाले सॉल को वायुयान की सहायता से स्प्रे करके कृत्रिम बरसात करवाना भी संभव है।
(iii) खाद्य सामग्री- दूध, मक्खन, हलवा, आईसक्रीम, फलों का रस आदि ये सभी किसी न किसी रूप में कोलॉइड होते हैं।
(iv) रुधिर- रुधिर एेल्बूमिनॉइड पदार्थ का कोलॉइडी विलयन है। फिटकरी एवं फेरिक क्लोराइड के विलयन का रक्तस्राव को रोकने का कार्य रुधिर के स्कंदन से बनने वाला थक्के के कारण होता है जो खून को बहने से रोकता है।
(v) मृदाएं- ऊर्वरा मृदाएं कोलॉइडी प्रकृति की होती हैं जिनमें ह्यूमस, रक्षक कोलॉइड की तरह कार्य करता है। कोलॉइड प्रकृति के कारण मृदाएं नमी एवं पोषक पदार्थों को अधिशोषित करती हैं।
(vi) डेल्टा बनना- नदी का जल मृदा का कोलॉइडी विलयन बन जाता है। समुद्र के जल में बहुत सारे वैद्युतअपघट्य होते हैं। जब नदी का जल समुद्र के जल से मिलता है तो समुद्र के जल में उपस्थित विद्युतअपघट्य मिट्टी के कोलॉइडी विलयन को स्कंदित कर देता है जिससे यह जम जाती है तथा डेल्टा बन जाता है।
कोलॉइडों के अनुप्रयोग
कोलॉइड उद्योगों में व्यापक रूप से प्रयुक्त होते हैं। कुछ उदाहरण निम्नलिखित हैं-
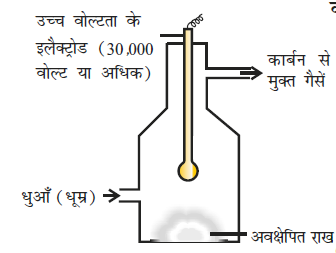
चित्र 5.15- कॉट्रेल धूम्र अवक्षेपक
(i) धूम्र का विद्युतीय अवक्षेपण- धूम्र, कार्बन, आर्सेनिक यौगिकों, धूल आदि ठोस कणों का वायु में कोलॉइडी विलयन है। चिमनी के बाहर आने से पहले धुएँ को इसके कणों के आवेश से विपरीत आवेश वाले इलैक्ट्रोडों के कक्ष में से गुजारा जाता है। कण इन प्लेटों के संपर्क में आने पर अपना आवेश खो देते हैं एवं अवक्षेपित हो जाते हैं। इस प्रकार कण कक्ष के फर्श पर बैठ जाते हैं। इस अवक्षेपक को कॅाट्रेल अवक्षेपक कहा जाता है (चित्र 5.15)।
(ii) पेयजल का शुद्धिकरण- प्राकृतिक स्रोतों से प्राप्त जल में प्रायः अशुद्धियाँ निलंबित होती हैं। एेसे जल से निलंबित अशुद्धियों को स्कंदित करने के लिए फिटकरी मिलाई जाती है जिससे जल पीने योग्य बन जाता है।
(iii) औषध- अधिकांश औषध कोलॉइडी प्रकृति की होती हैं। उदाहरणार्थ, आँख का लोशन आर्जिरॉल एक सिल्वर सॉल है। कोलॉइडी एन्टिमनी का उपयोग कालाजार के इलाज में होता है। कोलॉइडी गोल्ड का उपयोग अंतःपेशी इंजेक्शन में किया जाता है। दूधिया मैग्नीशिया जो कि एक इमल्शन है, का उपयोग पेट की गड़बड़ी दूर करने में किया जाता है। कोलॉइडी औषध अधिक प्रभावशाली होती हैं क्योंकि बड़े पृष्ठ क्षेत्र के कारण ये आसानी से स्वांगीकृत हो जाती हैं।
(iv) चर्मशोधन- पशुओं की खाल कोलॉइडी प्रकृति की होती है। जब खाल पर धनात्मक आवेशित कण होते हैं और इसे टेनिन में भिगोया जाता है, जिस पर ऋणात्मक आवेश वाले कोलॉइडी कण होते हैं, तो पारस्परिक स्कंदन होता है। इससे चर्म कठोर हो जाता है। इस प्रक्रम को चर्मशोधन कहते हैं। टेनिन के स्थान पर क्रोमियम लवणों का उपयोग भी किया जाता है।
(v) साबुन एवं अपमार्जकों की शोधन क्रिया- इसका वर्णन पहले ही खंड 5.4.3 में किया जा चुका है।
(vi) फोटोग्राफी प्लेटें एवं फिल्में- जिलेटिन में प्रकाश संवेदी सिल्वर ब्रोमाइड के इमल्शन का ग्लास प्लेटों या सेलुलॉइड फिल्मों पर विलेपन कर फोटोग्राफी की प्लेटें या फिल्म बनायी जाती हैं।
(vii) रबर उद्योग- लेटेक्स रबर के ऋणात्मक आवेशित कणों का कोलॉइडी विलयन है। रबर को लेटेक्स के स्कंदन से प्राप्त किया जाता है।
(viii) औद्योगिक उत्पाद- पेंट, स्याही, संश्लेषित प्लास्टिक, रबर, ग्रैफाइट, चिकनाई (स्नेहक) (Lubricant), सीमेंट आदि सभी कोलॉइडी विलयन हैं।
पाठ्यनिहित प्रश्न
सारांश
अधिशोषण वह परिघटना है जिसमें किसी ठोस अथवा द्रव का पृष्ठ किसी पदार्थ के अणुओं को आकर्षित कर धारण कर लेता है, जिसके परिणामस्वरूप पृष्ठ पर पदार्थ का सांद्रण स्थूल की तुलना में बढ़ जाता है। अधिशोषित पदार्थ को अधिशोष्य एवं जिस पदार्थ पर अधिशोषण होता है उसे अधिशोषक कहते हैं। भौतिक अधिशोषण में अधिशोष्य अधिशोषक से दुर्बल वान्डरवाल बलों द्वारा एवं रासायनिक अधिशोषण में प्रबल रासायनिक बंधों द्वारा बंधा रहता है। लगभग सभी ठोस गैसों को अधिशोषित करते हैं। किसी ठोस पर किसी गैस के अधिशोषण की सीमा गैस की प्रकृति, ठोस की प्रकृति, ठोस का पृष्ठ क्षेत्र, गैस का दाब एवं ताप पर निर्भर करती है। स्थिर ताप पर अधिशोषण का परिमाण (x/m) एवं गैस के दाब में संबंध को अधिशोषण समतापी कहते हैं।
उत्प्रेरक वह पदार्थ है जो अभिक्रिया में स्वयं बिना उपयोग हुए अभिक्रिया की गति को परिवर्तित कर देता है। उत्प्रेरक के उपयोग की परिघटना को उत्प्रेरण कहते हैं। समांगी उत्प्रेरण में उत्प्रेरक और अभिक्रियक एक ही प्रावस्था में और विषमांगी उत्प्रेरण में भिन्न प्रावस्था में रहते हैं।
कोलॉइडी विलयन वास्तविक विलयन एवं निलंबन के मध्य की स्थिति है। कोलॉइडी कणों का आकार
1 से 1000 nm तक होता है। एक कोलॉइडी निकाय में दो प्रावस्थाएं होती हैं- परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम। कोलॉइडी निकायों को तीन प्रकार से वर्गीकृत किया जा सकता है जो कि निर्भर करते हैं- (i) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं पर; (ii) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के बीच अन्योन्यक्रिया की प्रकृति पर और (iii) परिक्षिप्त प्रावस्था के कणों की प्रकृति पर। कोलॉइडी निकाय रोचक प्रकाशिक यांत्रिक एवं विद्युतीय गुण दर्शाते हैं। एक सॉल के कोलॉइडी कणों को उपयुक्त वैद्युतअपघट्य मिलाकर अविलेय अवक्षेप में बदलना स्कंदन कहलाता है। इमल्शन वे कोलॉइडी निकाय हैं जिनमें परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम दोनों द्रव अवस्था में होते हैं। ये (i) जल में तेल एवं (ii) तेल में जल प्रकार के हो सकते हैं। इमल्शन बनाने का प्रक्रम पायसीकरण कहलाता है। किसी इमल्शन को स्थायी करने के लिए इसमें पायसीकारक मिलाया जाता है। साबुन एवं अपमार्जक अधिकांशतः उपयोग किए जाने वाले पायसीकारक हैं। कोलॉइड दैनिक जीवन एवं उद्योगों में कई प्रकार से उपयोग में लाए जाते हैं।
अभ्यास
5.1 अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिए। प्रत्येक का एक उदाहरण दीजिए।
5.2 भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अंतर है?
5.3 कारण बताइए कि सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
5.4 किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौन से हैं?
5.5 अधिशोषण समतापी वक्र क्या है? फ्रॉयन्डलिक अधिशोषण समतापी वक्र का वर्णन कीजिए।
5.6 अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जाता है?
5.7 विषमांगी उत्प्रेरण में अधिशोषण की क्या भूमिका है?
5.8 अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
5.9 कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है?
5.10 ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
5.11 द्रवरागी एवं द्रवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। द्रवविरोधी सॉल आसानी से स्कंदित क्यों हो जाते हैं?
5.12 बहुअणुक एवं वृहदाणुक कोलॉइड में क्या अंतर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं?
5.13 एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रिया विधि को संक्षेप में लिखिए।
5.14 कोलॉइडों को निम्न आधार पर कैसे वर्गीकृत किया गया है?
(क) घटकों की भौतिक अवस्था (ख) परिक्षिप्त प्रावस्था की प्रकृति
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया।
5.15 निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे?
(i) जब प्रकाश किरण पुंज कोलॉइडी सॉल में से गमन करता है।
(ii) जलयोजित फेरिक अॉक्साइड सॉल में NaCl वैद्युतअपघट्य मिलाया जाता है।
(iii) कोलॉइडी सॉल में से विद्युतधारा प्रवाहित की जाती है।
5.16 इमल्शन क्या हैं? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दीजिए।
5.17 पायसीकर्मक पायस को स्थायित्व कैसे देते हैं? दो पायसीकर्मकों के नाम लिखिए।
5.18 ‘‘साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है,’’ इस पर टिप्पणी कीजिए।
5.19 विषमांगी उत्प्रेरण के चार उदाहरण दीजिए।
5.20 उत्प्रेरक की सक्रियता एवं वरणक्षमता का क्या अर्थ है?
5.21 ज़िओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
5.22 आकृति वरणात्मक उत्प्रेरण क्या है?
5.23 निम्न पदों (शब्दों) को समझाइए
(i) वैद्युत कण संचलन, (ii) स्कंदन, (iii) अपोहन, (iv) टिन्डल प्रभाव,
5.24 इमल्शनों (पायस) के चार उपयोग लिखिये।
5.25 मिसेल क्या हैं? मिसेल निकाय का एक उदाहरण दीजिए।
5.26 निम्न पदों को उचित उदाहरण सहित समझाइए।
(i) एल्कोसॉल, (ii) एरोसॉल, (iii) हाइड्रोसॉल,
5.27 "कोलॉइड एक पदार्थ नहीं पदार्थ की एक अवस्था है" इस कथन, पर टिप्पणी कीजिए।