Table of Contents
एकक 6
तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
इस एकक के अध्ययन के पश्चात् आप -
• भारतीय पारंपरिक धातुकर्मीय प्रक्रमों के योगदान के महत्व को समझ सकेंगे;
• खनिजों, अयस्कों, सांद्रण, सज्जीकरण, निस्तापन, भर्जन, शोधन आदि पदों की व्याख्या कर सकेंगे;
• निष्कर्षण विधियों में प्रयुक्त अॉक्सीकरण व अपचयन के सिद्धांतों को समझ सकेंगे।
• Al, Cu, Zn, तथा Fe के निष्कर्षण में गिब्ज़ ऊर्जा तथा एन्ट्रॉपी जैसी ऊष्मागतिकी की धारणाओं को लागू कर सकेंगे;
• व्याख्या कर सकेंगे कि कुछ अॉक्साइडों जैसे Cu2O का अपचयन Fe2O3 की तुलना में अधिक आसानी से क्यों होता है?
• व्याख्या कर सकेंगे कि क्यों CO कुछ निश्चित तापों पर अच्छा अपचायक है जबकि कोक कुछ अन्य स्थितियों में ज़्यादा अच्छा है?
• व्याख्या कर सकेंगे कि अपचयन कार्यों के लिए कुछ विशिष्ट अपचायक ही काम में क्यों लिए जाते हैं
सभ्यता का इतिहास पुरातन काल में धातुओं के उपयोग की कहानी से अनेक प्रकार से संबंधित हैं। प्रारंभिक मानव सभ्यताओं के विभिन्न युगों को उस युग में प्रयुक्त होने वाली धातुओं के नाम से जाना जाता है। धातुओं के निष्कर्षण की दक्षता ने अनेकों धातुएँ दीं जिनसे मानव समाज में अनेकों परिवर्तन हुए। इसने हथियार, औज़ार, आभूषण, बर्तन इत्यादि दिए जिससे सांस्कृतिक जीवन का संवर्धन हुआ। सोना, तांबा, चाँदी, सीसा, टिन, लोहा और पारा वह सात धातुएँ हैं, जिन्हें कभी-कभी प्राचीन धातुएँ भी कहा जाता है। यद्यपि, औद्योगिक क्राँति के बाद आधुनिक धातु विज्ञान की चरघातांकी वृद्धि हुई, परंतु यह ध्यान देने योग्य और रोचक है कि धातु विज्ञान की अनेकों अवधारणाओं की जड़ें औद्योगिक क्राँति के पहले की पुरातन पद्धतियों में हैं। सात हज़ार वर्षों से भी अधिक समय से भारत में धातु-कर्म में दक्षता की उच्च परंपरा रही है।
पुरातत्वीय खुदाई और साहित्य भारतीय धातु विज्ञान के इतिहास के दो प्रमुख स्रोत हैं। भारतीय उपमहाद्वीप में धातु की उपस्थित का प्रथम प्रमाण बलूचिस्तान के मेहरगढ़ से प्राप्त होता है जहाँ के ताँबें के मोती लगभग 6000 BCE पुराने माने गए हैं। यद्यपि यह समझा जाता है कि यह प्राकृत ताँबा है जिसे अयस्क से प्राप्त नहीं किया गया है। राजस्थान में खेतरी की पुरातन खदानों से लिए गए ताँबे के अयस्क के नमूनों तथा हरियाणा के मिताहल एवं राजस्थान, गुजरात, मध्यप्रदेश के आठ स्थलों में पाए गए हडप्पा के प्रतिनिधिक नमूनों से काटे गये धातु के नमूनों के स्पेक्ट्रोस्कोपी द्वारा अध्ययनों से सिद्ध होता है कि भारत में ताँबे के धातु-कर्म की क्रिया का ज्ञान भारतीय उपमहाद्वीप में कैल्कोलिथी सभ्यता के समय से था और भारतीय कैल्कोलिथी ताँबे की वस्तुएँ संभवतः देश में ही बनती थीं। वस्तुएँ बनाने के लिए धातु का निष्कर्षण आरावली पहाड़ियों की खदानों से प्राप्त कैल्कोपाइराइट अयस्क से किया जाता था। भारत के पुरातात्वीय सर्वेक्षण ने पिछली शताब्दी में ताम्र-पत्रों के अभिलेखों और शिलालेखों से पुरातात्विक जानकारी संकलित करके प्रकाशित की है। राजकीय अभिलेख ताम्र-पत्रों (Copper plates) पर खोदे जाते थे। सबसे पुराने अभिलेख में मौर्यों द्वारा अकाल के समय में दी गई सहायता का रिकॉर्ड है। इस पर अशोक के समय से पहले के भारत के बहुत कम अभिलेखों में से एक ब्राह्मी अभिलेख है।
हडप्पा के लोग सोना, चाँदी और इनकी मिश्र धातु इलेक्ट्रम का भी उपयोग करते थे। चीनी मिट्टी और काँसे के पात्रों में रखे विभिन्न प्रकार के आभूषण जैसे कि लटकन, चूड़ियाँ, माला, अंगूठियाँ इत्यादि प्राप्त हुए हैं। सिंधु घाटी सभ्यता के स्थलों जैसे मोहनजोदाड़ो (3000 BCE) से बहुत पुराने सोने और चाँदी के आभूषण प्राप्त हुए हैं। यह राष्ट्रीय संग्रहालय, नयी-दिल्ली में प्रदर्शित किए गए हैं। भारत की विशिष्टता है कि यहाँ कर्नाटक के मस्की क्षेत्र में विश्व की सबसे गहरी सोने की पुरातन खदानें हैं जो कार्बन कालनिर्धारण के अनुसार एक सहस्त्राब्दि BCE की हैं।
ऋगवेद के श्लोकों से भारत में जलोद स्वर्ण के निक्षेपणों (deposits) का अप्रत्यक्ष संकेत मिलता है। पुरातन काल में सिंधु नदी स्वर्ण का महत्वपूर्ण स्रोत थी। यह रोचक है कि आधुनिक समय में भी सिंधु नदी में जलोद स्वर्ण की उपलब्धता ज्ञात हुई है। यह सूचना है कि मानसरोवर और थोक्यालुंग क्षेत्र में अब भी बड़ी स्वर्ण खदानें हैं। पाली भाषा में लिखी पुस्तक अंगुत्तरा निकाय में जलोद स्वर्ण धूलि अथवा कण प्राप्त करने की प्रक्रिया का वर्णन किया गया है। यद्यपि वेदों में सोने के शुद्धिकरण के प्रमाण प्राप्त होते हैं तथापि यह कौटिल्य का अर्थशास्त्र है, जिसकी रचना तीसरी या चौथी सदी BCE में मौर्यकाल में की गई थी, जिसमें खान और खनिजों के एक बड़े अध्याय में तत्कालीन प्रचलित रासायनिक व्यापार के अनेकों आंकड़े हैं जिनमें सोना, चाँदी, ताँबा, सीसा, टिन और लोहे के अयस्क सम्मिलित हैं। कौटिल्य ने रसविधा नामक सोने के विलयन का वर्णन किया है जो प्राकृतिक रूप में पाया जाता है। कालीदास ने भी एेसे विलयनों का उल्लेख किया है। यह आश्चर्यजनक है कि लोग एेसे विलयनों को पहचानते कैसे थे।
प्राकृत स्वर्ण के रंग उसमें उपस्थित अशुद्धियों की प्रकृति और मात्रा पर निर्भर करते हैं और अलग-अलग होते हैं। हो सकता है कि प्राकृत सोने के अलग-अलग रंग सोने के शुद्धिकरण के विकास के लिए प्ररेक-बल रहे हों।
गंगा की घाटी के मध्य भाग और विन्ध्य पहाड़ियों पर हाल में की गई खुदाई से ज्ञात होता है कि वहाँ सम्भवतः बहुत पहले 1800 BCE में लोहे का उत्पादन किया जाता था। उत्तर प्रदेश के पुरातत्व विभाग द्वारा हाल ही में की गई खुदाई में, लोहा प्राप्त करने की भट्टी, शिल्प, धमनी (ट्वीयर) और धातुमल की परतें प्राप्त हुई हैं। रेडियो कार्बन काल निर्धारण के अनुसार यह 1800 से 1000 BCE के काल की हैं। खुदाई के परिणाम संकेत देते हैं कि पूर्वी विन्ध्य में लोहे के प्रगलन और लोहे से शिल्प बनाने की अच्छी जानकारी थी और गंगा के मैदानी भाग के केंद्रीय भाग में इसका उपयोग कम से कम दूसरी सहस्त्राब्दी BCE के प्रारम्भ से ही किया जाता था। लोहे के शिल्प के प्रकार और मात्रा तथा उच्च तकनीक से प्रतीत होता है कि लोहा उद्योग इससे भी पहले प्रारम्भ हो गया होगा। देश के अन्य भागों से भी लोहा बहुत पहले से उपयोग किए जाने के प्रमाण मिलते हैं तथा सिद्ध होता है कि भारत वास्तव में लोहे के उद्योग के विकास का स्वाधीन केन्द्र था।
लोहे का प्रगलन और उपयोग दक्षिण भारत के महापाषाणी (मेगालिथिक) सभ्यता में विशेषकर स्थापित था। एेसा प्रतीत होता है कि भारत में पिटवां लोहे का फोर्जन एक सहस्त्राब्दी CE में चरमोत्कर्ष पर था। ग्रीक विवरण के अनुसार भारत में स्टील का उत्पादन क्रूसिबल प्रक्रम द्वारा किया जाता था। इस प्रक्रम में लोहा, चारकोल तथा काँच का मिश्रण एक क्रूसिबल में तब तक गरम किया जाता था जब तक लोहा पिघलकर कार्बन अवशोषित कर लेता था। भारत उन्नत किस्म का स्टील उत्पादित करने वाला प्रमुख प्रवर्तक था। भारतीय स्टील को ‘वाँडर मैटीरियल अॉफ़ द ओरियंट’ यानी ‘पूर्व की अद्भुत वस्तु’ कहा जाता था। एक रोमन इतिहासकार, क्युनट्स कॉर्टियस ने लिखा है कि तक्षशिला में पोरस ने (326 BCE) सिकन्दर को जो उपहार दिए थे उनमें से एक ढ़ाई किलो वूट्ज़ स्टील था। मूलतः वूट्ज़ स्टील में लोहे के साथ अधिक अनुपात में कार्बन (1.0-1.9%) मिला होता है। कर्नाटक और आंध्र प्रदेश की भाषा में स्टील को उक्कू कहा जाता है। वूट्ज़ इसी से बना अंग्रेज़ी शब्द है। साहित्यिक अभिलेखों के अनुसार भारतीय वूट्ज़ स्टील को भारतीय महाद्वीप से यूरोप, चीन और अरब देशों में निर्यात किया जाता था। इसे मध्यपूर्व में उच्च कोटि का माना गया जहाँ इसे डैमास्करस स्टील कहा जाता था। माइकेल फैराडे ने लोहे में उच्च धातुओं सहित कई धातुएँ मिला कर इसे बनाने का प्रयत्न किया परंतु सफलता नहीं मिली।
जब लोहे को ठोस अवस्था में चारकोल मिला कर अपचित किया जाता है तो सरंध्र लोहा प्राप्त होता है। इस पदार्थ से कोई भी उपयोगी वस्तु उष्ण फोर्जन द्वारा रंध्रता हटा कर ही बनाई जा सकती है। फोर्जन से प्राप्त लोहे को पिटवां लोहा कहते हैं। पुरातन भारत में उत्पादित एेसे लोहे का एक उदाहरण विश्वविख्यात लौह स्तम्भ है। यह दिल्ली में वर्तमान स्थिति में पाँचवी शताब्दी में स्थापित किया गया था। इस पर अंकित संस्कृत लेख से पता चलता है कि यह गुप्त काल में यहाँ पर कहीं और से लाया गया था। स्तम्भ के पिटवाँ लोहे में लोहे के अतिरिक्त अन्य उपस्थित संघटकों का औसत (भार %) है - 0.15% C, 0.05% Si, 0.05% Mn, 0.25% P, 0.005% Ni, 0.03% Cu तथा 0.02% N। इसकी सबसे महत्वपूर्ण बात यह है कि यह लगभग 1,600 वर्षों से वातावरण को झेल रहा है परन्तु इसमें अभी तक क्षरण का कोई चिह्न नहीं है।
मेघालय की खासी पहाड़ियों से प्राप्त लोहे के धातु-मल में उपस्थित चारकोल के रेडियो कार्बन तिथि निर्धारण से पता चलता है कि धातु मल की परत 353 BCE से 128 CE के बीच की है उत्तर-पूर्व भारत में किए गए अध्ययनों से संकेत मिलता है कि खासी पहाड़ियों का क्षेत्र लौह प्रगलन और उत्पादन का सबसे पुराना क्षेत्र है। लौह अयस्क के पूर्व में किए गए उत्खनन और उत्पादन के अवशेष खासी पहाड़ियों के परिदृष्य में अब भी देखने को मिलते हैं। ब्रिटिश प्रकृति-वैज्ञानिक जिन्होंने उन्नीसवीं सदी में मेघालय का भ्रमण किया था, खासी-पहाड़ियों के ऊपरी भाग में हो रहे लोहे के उद्योग का वर्णन किया है।
राजस्थान में जावर की खदानों से छठी या पाँचवी BCE से ज़िक उत्पादन होने के पुरातात्विक प्रमाण हैं। भारत वह पहला देश था जहाँ ज़िक के आसवन में दक्षता प्राप्त थी। ज़िक का क्वथनांक कम होने के कारण यह अयस्क के प्रगलन के साथ ही वाष्पीकृत हो जाता है। शुद्ध ज़िक को अधोमुखी आसवन की जटिल तकनीक द्वारा प्राप्त किया जा सकता था जिसमें वाष्प को निचले पात्र में संघनित किया जाता था। यही तकनीक पारे के लिए भी प्रयुक्त की जाती थी। इसका वर्णन चौदहवीं शताब्दी के संस्कृत साहित्य में मिलता है।
भारतीयों को पारे के विषय में ज्ञान प्राप्त था वह इसका उपयोग औषधीय उद्देश्य के लिए करते थे। खनन और धातुकर्मिकी का विकास ब्रिटिश उपनिवेश के युग में कम होता गया। उन्नीसवीं शताब्दी तक किसी समय फल-फूल रही राजस्थान की खदानों का अधिकतर परित्याग हो चुका था और खदानें लगभग विलुप्त हो गईं। जब 1947 में भारत स्वतंत्र हुआ तो विज्ञान का यूरोपीय साहित्य धीरे-धीरे देश में प्रवेश कर चुका था। इस प्रकार से स्वतंत्रता के पश्चात भारत सरकार ने देश निर्माण का कार्य विज्ञान और तकनीकी के विभिन्न संस्थान स्थापित करके प्रारम्भ किया। आगे के अध्यायों में हम तत्वों को प्राप्त करने की आधुनिक विधियों के बारे में जानेंगे।
6-1 धाातुओं की उपलब्धता
भूपर्पटी में कुछ तत्व; जैसे- कार्बन, सल्फर, सोना तथा उत्कृष्ट गैसें मुक्त अवस्था में पाई जाती हैं जबकि अन्य तत्व संयुक्त अवस्था में मिलते हैं। भूपर्पटी में तत्वों की बाहुल्यता भिन्न-भिन्न होती है। धातुओं में एेलुमिनियम की बाहुल्यता अधिकतम है। यह भूपर्पटी में सर्वाधिक पाया जाने वाला तीसरा तत्व है (लगभग 8.3% भार में)। यह अभ्रक तथा मृत्तिका सहित अनेक आग्नेय खनिजों का प्रमुख घटक है। बहुत से रत्न प्रस्तर, Al2O3 के अशुद्ध रूप हैं उदाहरणार्थ रूबी और नीलम में क्रमशः Cr तथा Co की अशुद्धि होती है। भूपर्पटी में सबसे अधिक पाई जाने वाली दूसरी धातु लोहा (आयरन) है। यह विभिन्न प्रकार के यौगिक बनाता है एवं इनके विभिन्न उपयोग इसे एक बहुत महत्वपूर्ण तत्व बनाते हैं। यह जैविक तंत्रों में भी आवश्यक तत्वों में से एक है। किसी धातु विशेष को प्राप्त करने के लिए हम एेसे खनिजों के बारे में सोचते हैं जो भूपर्पटी में प्राकृतिक रूप से पाए जाने वाले रासायनिक पदार्थों के खनन द्वारा प्राप्त किए जा सकते हैं। बहुत से खनिजों में से, जिनमें धातु पाई जाती है, केवल कुछ ही धातु प्राप्त करने के स्रोत के रूप में प्रयुक्त होते हैं। एेसे खनिजों को अयस्क कहते हैं।
एेलुमिनियम आयरन, कॉपर तथा ज़िंक के मुख्य अयस्क सारणी 6.1 में दिए गए हैं।
सारणी 6.1 कुछ महत्वपूर्ण धातुओं के मुख्य अयस्क
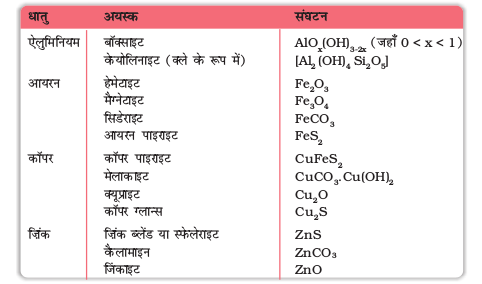
एक विशेष तत्व विविध यौगिकों के रूप में मिल सकता है। तत्व का इसके यौगिक से पृथक्करण का प्रक्रम इस प्रकार का होना चाहिए कि यह रासायनिक रूप से संभव हो तथा आर्थिक रूप से लाभदायक हो।
एेलुमिनियम के निष्कर्षण के लिए, बॉक्साइट का चयन किया जाता है। लोहे के लिए, प्रायः आयरन अॉक्साइड अयस्क लिए जाते हैं, जो कि प्रचुरता से उपलब्ध हों तथा प्रदूषित गैसें न बनाते हों (जैसे कि आयरन पाइरॉइट द्वारा SO2 बनती है)। कॉपर तथा ज़िंक के लिए, सारणी 6.1 में से अयस्कों की उपलब्धता तथा दूसरे संगत कारकों के आधार पर कोई भी अयस्क उपयोग में लिया जा सकता है।
अयस्कों से धातु पृथक्करण में प्रयुक्त होने वाली संपूर्ण वैज्ञानिक व प्रौद्योगिक प्रक्रिया धातुकर्म कहलाती है। किसी तत्व के संयुक्त अवस्था से निष्कर्षण तथा पृथ्क्करण में रसायन के कई सिद्धांत निहित होते हैं। फिर भी धातुओं के सभी निष्कर्षण प्रक्रमों के कुछ सामान्य सिद्धांत समान हैं।
- अयस्क का सांद्रण
- सांद्रित अयस्क से तत्व का पृथक्करण तथा
- धातु का शुद्धीकरण
6-2 अयस्कों का सांद्रण
अवांछित पदार्थों; जैसे- रेत, क्ले आदि का अयस्कों से निष्कासन का प्रक्रम अयस्क सांद्रण, प्रसाधन अथवा सज्जीकरण कहलाता है। सांद्रण की क्रिया करने से पहले अयस्कों को श्रेणीकृत किया जाता है और उचित आकार में तोड़ा जाता हैं। इसमें कई पद सम्मिलित होते हैं और इन पदों का चयन उपस्थित धातु के यौगिक एवं अपअयस्क (गैंग) के भौतिक गुणों में अंतर पर निर्भर करता है। धातु का प्रकार, उपलब्ध सुविधाओं तथा पर्यावरणीय कारकों का भी ध्यान रखा जाता है। कुछ महत्वपूर्ण प्रक्रियाएं आगे वर्णित की गई हैं।
6.2.1 द्रवीय धावन
यह विधि अयस्क तथा गैंग कणों के आपेक्षिक घनत्वों के अंतर पर निर्भर करती है। अतः यह गुरुत्वीय पृथक्करण का एक प्रकार है। इसी प्रकार के एक प्रक्रम में चूर्णित अयस्क को ऊपर की ओर बहती हुई जल की तेज़ धारा से धोया जाता है जिसके कारण हलके गैंग के कण जल के साथ बहकर निकल जाते हैं तथा भारी अयस्क के कण शेष रह जाते हैं।
6.2.2 चुंबकीय पृथक्करण
यह विधि अयस्क के घटकों में चुंबकीय गुणों की भिन्नता पर आधारित है। यदि अयस्क या गैंग में से कोई भी एक चुंबकीय क्षेत्र की ओर आकर्षित हो सकता है तब इस प्रकार से पृथक्करण किया जाता है उदाहरण के लिए लौह अयस्क चुंबक की ओर आकर्षित होते हैं अतः इनमें से चुंबक की ओर आकर्षित न होने वाली अशुद्धियों को चुंबकीय प्रथक्करण द्वारा अलग किया जा सकता है। चूर्णित अयस्क को एक घूमते हुए पट्टे पर डाला जाता है जो चुंबकीय रोलर पर लगा होता है। चुंबकीय पदार्थ पट्टे की ओर आकर्षित रहते हैं और इसके पास गिरते हैं (चित्र 6.1)।
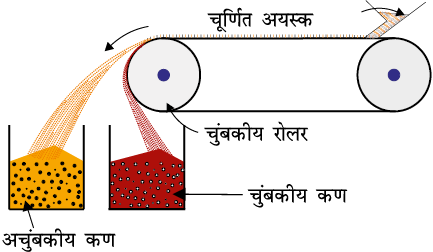
चित्र 6.1- चुंबकीय पृथक्करण (आरेखीय)
6.2.3 फेन प्लवन विधि
यह विधि सल्फाइड अयस्कों को गैंग से मुक्त करने के लिए प्रयुक्त होती है। इस विधि में चूर्णित अयस्क का पानी के साथ निलंबन बना लिया जाता है। इसमें संग्राही तथा फेन- स्थायीकारी मिला देते हैं। संग्राही (जैसे चीड़ का तेल, वसा अम्ल, जैंथेट इत्यादि) अयस्क कणों की अक्लेदनीयता (non-wettability) को बढ़ा देते हैं तथा फेन-स्थायीकारी (जैसे क्रिसॉल, एेनीलिन) फेन को स्थायित्व प्रदान करते हैं। 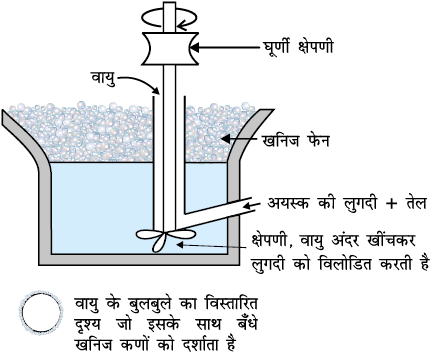
चित्र 6.2- फेन प्लवन विधि (आरेखीय)
कभी-कभी तेल तथा जल के अनुपात को संयोजित करके अथवा अवनमकों का उपयोग करके दो सल्फाइड अयस्कों को पृथक करना संभव होता है। उदाहरणस्वरूप, किसी अयस्क में उपस्थित ज़िंक सल्फाइड तथा लेड सल्फाइड को पृथक करने के लिए सोडियम साइनाइड (NaCN) का उपयोग किया जाता है, जो अवनमक का कार्य करता है। यह चयनित रूप से ZnS को फेन में आने से रोकता है परंतु PbS को फेन में आने देता है।
कपड़े धोने वाली महिला का नवाचार
यदि वैज्ञानिक दृष्टिकोण हो तथा प्रेक्षणों के प्रति सजगता हो तो कोई भी चमत्कार कर सकता है। एक कपड़े धोने वाली महिला का भी खोजी मस्तिष्क था। उसने एक खनिक के कपड़े धोते हुए यह पाया कि रेत तथा अन्य एेसी ही गंदगी, धोने के टब के पेंदे में गिर जाती है परंतु विशेष बात यह थी कि कॉपरयुक्त यौगिक जो खदानों से कपड़ों में पहुँचते थे, साबुन के झागों में जकड़कर ऊपरी सतह पर आ जाते थे। उसके ग्राहकों में एक रसायनज्ञ श्रीमती केरी एेवरसन थीं। कपड़े धोने वाली महिला ने अपना अनुभव श्रीमती एेवरसन को बताया। श्रीमती एेवरसन ने सोचा कि यह विचार कॉपर यौगिकों को चट्टानी तथा जमीनी पदार्थों से पृथक करने में व्यापक स्तर पर प्रयुक्त किया जा सकता है। इस प्रकार एक आविष्कार का प्रादुर्भाव हुआ। उस समय तक केवल वही अयस्क कॉपर के निष्कर्षण के लिए उपयोग किए जाते थे जिनमें धातु की मात्रा अधिक होती थी। झाग प्लवन विधि के आविष्कार ने निम्न श्रेणी के अयस्कों से भी कॉपर निष्कर्षण को लाभदायक बना दिया। कॉपर (ताँबा) का विश्व में उत्पादन बढ़ा और धातु सस्ती हो गई।
6.2.4 निक्षालन
यदि अयस्क किसी उपयुक्त विलायक में विलेय हो तोे प्रायः निक्षालन का उपयोग करते हैं। निम्नलिखित उदाहरण इस क्रियाविधि को स्पष्ट करते हैं।
(क) बॉक्साइट से एेलुमिना का निक्षालन
एेलुमिनियम के मुख्य अयस्क बॉक्साइट में अधिकांशतः SiO2, आयरन अॉक्साइड तथा टाइटेनियम अॉक्साइड (TiO2) की अशुद्धियाँ होती हैं। 473-523 K ताप तथा 35-36 bar दाब पर सांद्रण के लिए चूर्णित अयस्क को सांद्र सोडियम हाइड्रॉक्साइड विलयन के साथ गरम किया जाता है। इस प्रकार Al2O3 सोडियम एेलुमिनेट के रूप में निष्कर्षित हो जाता है एवं SiO2, की अशुद्धि भी सोडियम सिलीकेट के रूप में घुल जाती है तथा अन्य अशुद्धियाँ शेष रह जाती हैं।Al2O3(s) + 2NaOH(aq) + 3H2O(l) → 2Na[Al(OH) 4](aq) (6.1)
2Na[Al(OH)4](aq) + CO2(g) → Al2O3.xH2O(s) + 2NaHCO3 (aq) (6.2)
सोडियम सिलिकेट विलयन में शेष रह जाता है तथा जलयोजित एेलुमिना को छानकर, सुखाकर तथा गरम करके पुनः शुद्ध Al2O3 प्राप्त कर लिया जाता है। Al2O3.x H2O(s)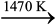 Al2O3(s) + x H2O(g) (6.3)
Al2O3(s) + x H2O(g) (6.3)
(ख) अन्य उदाहरण
चाँदी तथा सोने के धातुकर्म में धातुओं का निक्षालन वायु की (O2 के लिए) उपस्थिति में सोडियम साइनाइड अथवा पोटैशियम साइनाइड के तनु विलयन द्वारा किया जाता है जिसमें से धातु बाद में प्रतिस्थापन अभिक्रिया द्वारा प्राप्त कर ली जाती है। 4M(s) + 8CN-(aq)+ 2H2O(aq) + O2(g) → 4[M(CN)2]-(aq) + 4OH-(aq)(M= Ag अथवा Au) (6.4)
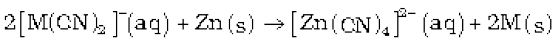 (6.5)
(6.5)
पाठ्यनिहित प्रश्न
6.1 सारणी 6.1 में दर्शाए गए अयस्काें में से कौन से चुंबकीय पृथक्करण विधि द्वारा सांद्रित किए जा सकते हैं?
6.2 एेलुमिनियम के निष्कर्षण में निक्षालन का क्या महत्व है?
6-3 सांद्रित अयस्कों से अशोधित धातुओं का निष्कर्षण
धातु निष्कर्षण के लिए सांद्रित अयस्कों को एेसे प्रारूपों में परिवर्तित करना आवश्यक होता है जो कि अपचयन के लिए उपयुक्त हों। सामान्यतः सल्फाइड अयस्कों को अपचयन से पहले अॉक्साइड में परिवर्तित करते हैं। अॉक्साइड आसानी से अपचित होते हैं अतः सांद्रित अयस्क से धातुओं का पृथक्करण दो मुख्य पदों में होता है।
(क) अॉक्साइड में परिवर्तन तथा
(ख) अॉक्साइड का धातु में अपचयन
(क) अॉक्साइड में परिवर्तन
(i) निस्तापन- निस्तापन में गरम करने की आवश्यकता होती है जिससे वाष्पशील पदार्थ निष्कासित हो जाते हैं तथा धातु अॉक्साइड शेष रह जाता है।
Fe2O3.x H2O(s)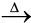 Fe2O3 (s) + x H2O(g) (6.6)
Fe2O3 (s) + x H2O(g) (6.6)
ZnCO3 (s)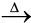 ZnO(s) + CO2(g) (6.7)
ZnO(s) + CO2(g) (6.7)
CaCO3.MgCO3(s)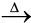 CaO(s) + MgO(s ) + 2CO2(g) (6.8)
CaO(s) + MgO(s ) + 2CO2(g) (6.8)
(ii) भर्जन- भर्जन में अयस्क (ore) को वायु की नियमित आपूर्ति के साथ धातु के गलनांक से नीचे के तापमान पर एक भट्टी में गरम किया जाता है। सल्फाइड अयस्क के भर्जन की कुछ अभिक्रियाएँ इस प्रकार हैं -
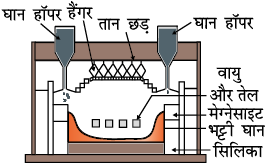
चित्र 6.3- आधुनिक परावर्तनी भट्टी का अनुभाग
2ZnS + 3O2 → 2ZnO + 2SO2 (6.9)
2PbS + 3O2 → 2PbO + 2SO2 (6.10)
2Cu2S + 3O2 → 2Cu2O + 2SO2 (6.11)
कॉपर के सल्फाइड अयस्कों को परावर्तनी भट्टी (चित्र 6.3) में गरम करते हैं। यदि अयस्क में लोहा हो तो गरम करने से पहले इसमें सिलिका मिलाते हैं। आयरन अॉक्साइड आयरन सिलिकेट बनाकर धातु मल* के रूप में, तथा ताँबा कॉपर मेट के रूप में प्राप्त होता है जिसमें Cu2S तथा FeS होता है।
FeO + SiO2 → FeSiO3 (6.12)
धातुमलउत्पन्न हुई SO2, गैस H2SO4 के उत्पादन के लिए प्रयुक्त की जाती है।
(ख) अॉक्साइड का धातु में अपचयन
धातु अॉक्साइड के अपचयन में प्रायः इसे किसी अपचायक जैसे C या CO अथवा अन्य धातु के साथ गरम किया जाता है। अपचायक (जैसे कार्बन) धातु अॉक्साइड की अॉक्सीजन के साथ संयोग करते हैं।MxOy + y C → x M + y CO (6.13)
कुछ धातु अॉक्साइड आसानी से अपचित होते हैं। जबकि दूसरों को अपचित करना कठिन होता है। (अपचयन का अर्थ धातु आयन द्वारा इलेक्ट्रॉन प्राप्ति होता है)। किसी भी स्थिति में, इन्हें गरम करने की आवश्यकता होती है। उष्मागतिकी की कुछ मूल धारणाएं हमें धातुकर्मीय परिवर्तनों के सिद्धांत को समझने में सहायता करती हैं। गिब्ज़ ऊर्जा सबसे अधिक सार्थक पद है। तापीय अपचयन में आवश्यक तापक्रम परिवर्तन को समझने, तथा इस प्रागुक्ति के लिए, कि कौन सा तत्व दिए गए धातु अॉक्साइड (MxOy) के अपचयन के लिए अपचायी कर्मक के रूप में उपयुक्त होगा, गिब्ज़ ऊर्जा से समझा जाता है। तापीय अपचयन की संमाव्यता का मानक यह है कि दिए गए ताप पर गिब्ज़ ऊर्जा का मान ऋणात्मक हो।
6-4 धातुकर्मिकी के उष्मागतिकी सिद्धांत
किसी प्रक्रम के लिए किसी विशिष्ट तापक्रम पर गिब्ज़ ऊर्जा में परिवर्तन, ∆G, को निम्नलिखित समीकरण द्वारा बताया जाता है।
∆G = ∆H - T∆S (6.14)
जहाँ किसी प्रक्रम के लिए ∆H एन्थैल्पीका ज़िंक अॉक्साइड से निष्कर् में परिवर्तन तथा ∆S एन्ट्रॉपी में परिवर्तन है।
* धातु कर्मिकी में ‘फ्लक्स’ (गालक) मिलाते हैं जो ‘गैंग’ (अपअयस्क) के साथ मिलकर ‘धातुमल’ बनता है। अयस्कों से गैंग की अपेक्षा धातुमल अधिक आसानी से पृथक हो सकता है। इस प्रकार गैंग (अपअयस्क) का पृथक्करण आसान हो जाता है।

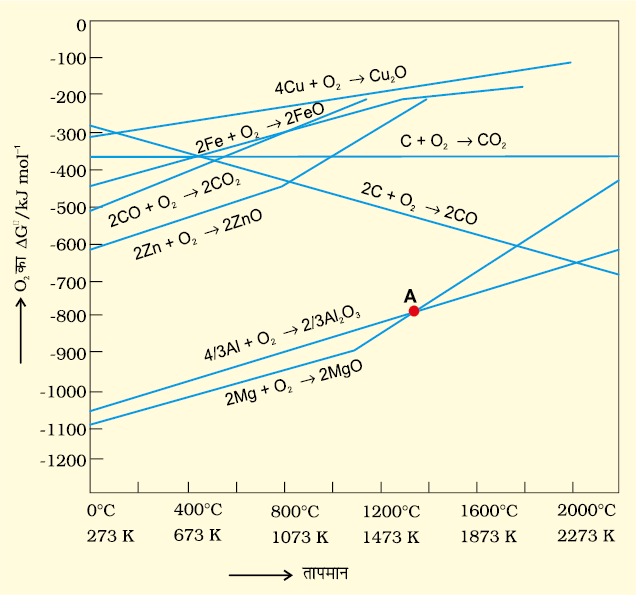
चित्र 6.4- कुछ अॉक्साइडों के विरचन में गिब्ज़ ऊर्जा ∆GV तथा T के मध्य वक्र (आरखीय एलिंघम आलेख)
एलिंघम आरेख
(क) सामान्यतः एलिंघम आरेख तत्वोें के अॉक्साइडों के विरचन के लिए ∆f GV तथा T के मध्य वक्र होता है। यानी निम्नलिखित अभिक्रिया के लिए -
2x M(s) + O2(g) → 2MxO(s)
इस अभिक्रिया में अॉक्साइड बनने में गैसों के उपभोग के कारण आण्विक यादृच्छिकता कम हो रही है। अतः ∆S का मान ऋणात्मक हो जाता है जो समीकरण 6.14 में T∆S पद का चिह्न धनात्मक कर देता है। इसके कारण ताप में वृद्धि होने के उपरांत भी ∆fG उच्च मान की ओर बढ़ता है। परिणामतः MxO(s) के विरचन की अधिकांश उपरोक्त अभिक्रियाओं के वक्रों का ढाल धनात्मक होता है।
(ख) प्रावस्था परिवर्तन (ठोस → द्रव या द्रव → गैस) की स्थिति के अतिरिक्त प्रत्येक स्थिति में वक्र एक सीधी रेखा होता है। ढाल की धनात्मक दिशा में वृद्धि उस ताप को निदर्शित करती है जिस पर एेसा परिवर्तन होता है। उदाहरणार्थ - Zn, ZnO वक्र में अचानक परिवर्तन गलनांक को निदर्शित करता है (चित्र 6.4)।
(ग) ताप बढ़ाने पर वक्र में एक एेसा बिंदु आता है जब वक्र 
(घ) इसी प्रकार के आरेख सल्फाइडों तथा हैलाइडों के लिए भी बनाये जाते हैं। उनसे यह स्पष्ट हो जाता है, कि
Mx S का अपचयन कठिन क्यों होता है।
एलिंघम आरेख की सीमाएं
1. ग्राफ केवल यह प्रदर्शित करता है कि कोई अभिक्रिया संभव है या नहीं अर्थात् केवल अपचायक केसाथ अपचयन की प्रवृत्ति प्रदर्शित होती है। एेसा इसलिए है क्योंकि यह केवल ऊष्मागतिकी की धारणा पर आधारित है। यह अपचयन प्रक्रमों की बलगतिकी के बारे में कुछ नहीं बताता। यह अपचयन कितनी तीव्रता से होगा? जैसे प्रश्नों का उत्तर नहीं दे सकता। यद्यपि यह व्याख्या करता है कि जब सभी स्पीशीज़ ठोस अवस्था में होती हैं तब अभिक्रिया मंद और अयस्कों के पिघल जाने पर आसानी से कैसे होती है। यहाँ यह ध्यान देना रोचक है कि किसी अभिक्रिया के लिए ∆H (एन्थैल्पी में परिवर्तन) तथा ∆S(एन्ट्रॉपी में परिवर्तन) के मान ताप में परिवर्तन होने पर भी लगभग स्थिर रहते हैं। अतः समीकरण 6.14 में केवल T ही प्रमुख चर बन जाता है तथापि ∆S यौगिक की भौतिक अवस्था पर अधिक निर्भर करता है। चूँकि एन्ट्रॉपी निकाय में अव्यवस्था या अस्तव्यस्तता पर निर्भर करती है, अतः यह यौगिक के पिघलने (ठोस → द्रव) या वाष्पित (द्रव → गैस) होने पर बढ़ेगी; क्योंकि ठोस से द्रव या द्रव से गैस प्रावस्था में परिवर्तन पर आण्विक अस्तव्यस्तता बढ़ती है।
2. ∆G की व्याख्या K (∆Gθ = - RT lnK) पर आधारित है। अतः यह माना गया है कि अभिक्रियक और उत्पाद साम्यावस्था में हैं।
MxO + A l x M + AO यह सदैव सत्य नहीं होता क्योंकि अभिक्रियक/उत्पाद ठोस भी हो सकते हैं। औद्योगिक अभिक्रियाओं में अभिक्रियक और उत्पाद बहुत कम समय के लिए साम्यावस्था में रहते हैं।
MxO(s) → x M (s या l) + 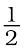 O2 (g) ∆rGθ(MxO,M) (6.15)
O2 (g) ∆rGθ(MxO,M) (6.15)
C(s) + 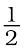 O2(g) → CO(g) [∆G(C, CO)] (6.16)
O2(g) → CO(g) [∆G(C, CO)] (6.16)
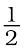 C(s) +
C(s) + 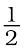 O2(g) →
O2(g) → 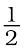 CO2(g) [
CO2(g) [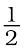 ∆G(C, CO2)] (6.17)
∆G(C, CO2)] (6.17)
MxO(s) + C(s) → xM(s अथवा l) + CO(g) (6.18)
समीकरण 6.15 और 6.17 के युग्मन से हमें प्राप्त होता है -
MxO(s) + 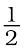 C(s) → xM(s अथवा l) +
C(s) → xM(s अथवा l) + 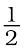 CO2(g) (6.19)
CO2(g) (6.19)
CO(g) + 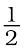 O2(g) → CO2(g) [∆G(CO, CO2)] (6.20)
O2(g) → CO2(g) [∆G(CO, CO2)] (6.20)
MxO(s) + CO(g) → xM(s अथवा l) + CO2(g) (6.21)
अभिक्रियाएं 6.18 तथा 6.21 धातु अॉक्साइड, MxO के वास्तविक अपचयन को दर्शाती हैं जिसे हम निष्पादित करना चाहते हैं। सामान्यतः इन अभिक्रियाओं के ∆rGθ मान, संगत अॉक्साइडों के ∆fGθ मान से प्राप्त कर सकते हैं। जैसा कि हम देख चुके हैं, तापन (अर्थात् बढ़ता T) ∆rGθ के ऋणात्मक मान के लिए सहायक होता है, अतः इस प्रकार का तापमान चुना जाता है जिस पर दो संयुक्त रेडॉक्स प्रक्रमों के ∆rGθ के मानों का योग ऋणात्मक हो। ∆rGθ तथा T के मध्य वक्रों में (एलिंघम आरेख चित्र 6.4) यह दोनों वक्रों के प्रतिच्छेदन बिंदु द्वारा प्रदर्शित होता है (यानी MxO का वक्र तथा अपचायक पदार्थ के अॉक्सीकरण का वक्र)। इस बिंदु के बाद संयुक्त प्रक्रमों के ∆rGθ का मान अधिक ऋणात्मक हो जाता है और MxO का अपचयन संभव हो जाता है। उस बिंदु के बाद दोनों ∆rGθ मानों में अंतर यह निर्धारित करता है कि ऊपरी रेखा के अॉक्साइड का अपचयन नीचे की रेखा द्वारा प्रदर्शित तत्व द्वारा संभव है या नहीं। यदि अंतर अधिक है तो अपचयन आसानी से होगा।उदाहरण 6.1
इस प्रक्रम में निहित अभिक्रियाओं के दो समीकरण हैं -
हल
(क) 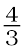 Al + O2 →
Al + O2 → 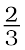 Al2O3 तथा (ख) 2Mg +O2→ 2MgO
Al2O3 तथा (ख) 2Mg +O2→ 2MgO
Al2O3 तथा MgO वक्रों के प्रतिच्छेदन बिंदु (चित्र 6.4 में 'A' द्वारा चिह्नित) पर निम्नलिखित अभिक्रिया के लिए ∆rGθ शून्य हो जाता है-
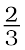 Al2 O3 +2Mg → 2MgO +
Al2 O3 +2Mg → 2MgO +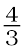 Al
Al
उस बिंदु से पहले मैग्नीशियम एेलुमिना को अपचित कर सकता है।
हल
Al2O3 तथा MgO वक्रों के प्रतिच्छेदन बिंदु से पहले के तापों पर मैग्नीशियम एेलुमिना को अपचित कर सकता है परंतु प्रक्रम अलाभकर होगा।
6.4.1 अनुप्रयोग
(क) आयरन का इसके अॉक्साइड से निष्कर्षण
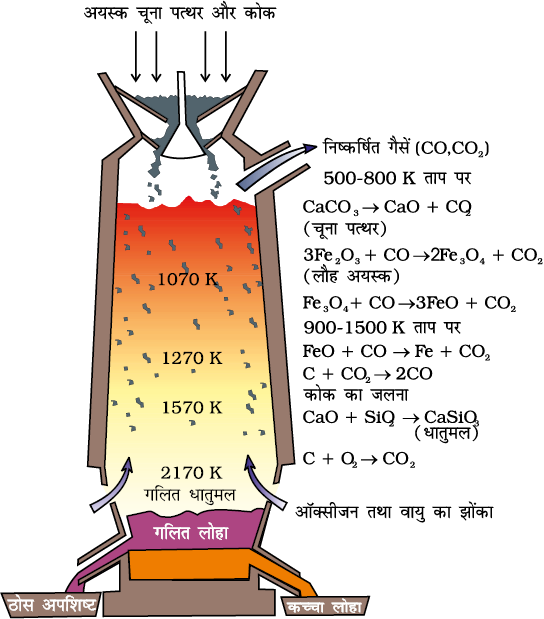
चित्र 6.5- वात्या भट्टी
500 - 800K पर (वात्या भट्टी में निम्न ताप परिसर में) -
Fe2O3 पहले Fe3O4 में अपचित होता है तथा बाद में FeO में।
3 Fe2O3 + CO → 2 Fe3O4 + CO2 (6.22)
Fe3O4 + 4 CO → 3Fe + 4 CO2 (6.23)
Fe2O3 + CO → 2FeO + CO2 (6.24)
चूना पत्थर भी CaO में अपघटित हो जाता है। सिलिकेट, अयस्क से अशुद्धियों को धातुमल के रूप में निकाल लेता है। धातुमल गलित अवस्था में लोहे से अलग हो जाता है।
900 - 1500K पर (वात्या भट्टी में उच्च ताप परिसर में) -
C + CO2 → 2 CO (6.25)
FeO + CO → Fe + CO2 (6.26)
ऊष्मागतिकी हमें यह समझने में सहायता करती है कि कोक, अॉक्साइड को क्यों अपचित करता है तथा इस भट्टी का चयन क्यों किया जाता है। इस प्रक्रम में एक महत्वपूर्ण चरण अपचयन है जिसकी अभिक्रिया निम्नलिखित समीकरण 6.27 में दी गई है।
FeO(s) + C(s) → Fe(s/l) + CO (g) (6.27)
इसे दो सामान्य अभिक्रियाओं के युग्म के रूप में देखा जा सकता है। इनमें से एक में FeO का अपचयन हो रहा है तथा दूसरे में C, CO में अॉक्सीकृत हो रहा है - FeO(s) → Fe(s) + 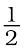 O2(g) [∆rGθ(FeO, Fe)] (6.28)
O2(g) [∆rGθ(FeO, Fe)] (6.28)
C(s) + 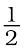 O2 (g) → CO (g) [∆rGθ (C, CO)] (6.29)
O2 (g) → CO (g) [∆rGθ (C, CO)] (6.29)
∆rGθ (C, CO) + ∆rGθ (FeO, Fe) = ∆rGθ (6.30)
स्वाभाविक है कि परिणामी अभिक्रिया तभी संपन्न होगी जब समीकरण 6.30 में दायाँ पक्ष ऋणात्मक होगा। चित्र 6.6 में ∆rG0 तथा T के मध्य जो वक्र Fe → FeO परिवर्तन को निरूपित करता है, वह ऊपर की ओर जाता है तथा जो C→CO (C, CO रेखा) परिवर्तन को निरूपित करता है, वह नीचे की ओर जाता है। यह एक दूसरे को लगभग 1073 K पर काटते हैं। लगभग 1073 K से अधिक ताप पर C, CO रेखा Fe, FeO रेखा के नीचे आ जाती है [∆rGθ (C, CO) < ∆rGθ(Fe, FeO)], अतः इस परिसर में कोक, FeO को अपचित करेगा और स्वयं CO में अॉक्सीकृत होगा। आइए इसे चित्र 6.6 की सहायता से समझने का प्रयत्न करते हैं (∆rGθ के सन्निकट मान दिए हैं) लगभग 1673 K (1400OC) पर अभिक्रिया 2FeO → Fe+O2 के लिए ∆rGθ का मान 341 kJ mol-1 है तथा 2C + O → 2 CO2 परिवर्तन के लिए ∆rGθ का मान -447 KJ mol-1 है। यदि हम समग्र अभिक्रिया (6.27) के लिए ∆rGθ का मान ज्ञात करें तो यह -53 kJ mol-1 होगा। अतः अभिक्रिया (6.27) संभव होगी। इसी प्रकार से Fe3O4 एवं Fe2O3 के CO द्वारा अपेक्षाकृत कम ताप पर अपचयन को CO तथा CO2 के वक्रों के प्रतिच्छेदन बिंदुओं के नीचे होने के आधार पर समझा जा सकता है।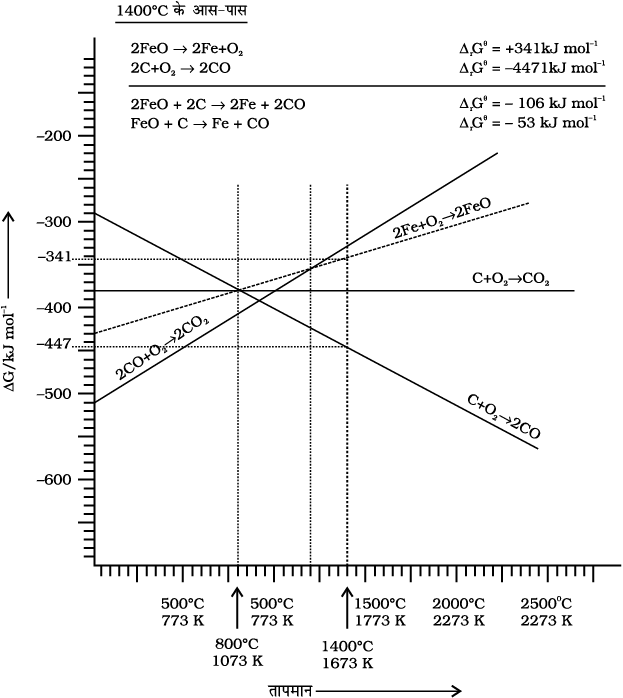
चित्र 6.6- आयरन तथा कार्बन के अॉक्साइड के विरचन के लिए (एलिंघम आलेख) गिब्ज़ ऊर्जा बनाम T वक्र (आरेखीय)
वात्या भट्टी से प्राप्त लोहे में लगभग 4% कार्बन तथा अन्य अशुद्धियाँ, जैसे S, P, Si Mn, सूक्ष्म मात्रा में उपस्थित रहती हैं। यह कच्चे लोहे (पिग लोहा) के नाम से जाना जाता है तथा विभिन्न आकृतियों में ढाला जा सकता है। ढलवाँ लोहा, कच्चे लोहे से भिन्न होता है तथा इसे कच्चे लोहे, रद्दी लोहे एवं कोक को एक साथ गरम हवा के झोंकों द्वारा पिघलाकर बनाया जाता है। इसमें थोड़ा कम कार्बन (लगभग 3%) होता है तथा यह अति कठोर और भंगुर होता है।
Fe2O3 + 3 C → 2 Fe + 3 CO (6.31)
चूने के पत्थर को गालक के रूप में मिलाया जाता है जिससे सल्फर, सिलिकन तथा फ़ॉस्फ़ोरस अॉक्सीकृत होकर धातुमल में चले जाते हैं। धातु को निकाल लिया जाता है और रोलरों पर से गुज़ार कर धातुमल से मुक्त कर लिया जाता है।
(ख) क्यूप्रस अॉक्साइड (कॉपर (I) अॉक्साइड) से ताँबे (कॉपर) का निष्कर्षण अॉक्साइडों के विरचन के लिए ∆rG0 तथा T के मध्य आलेख में [चित्र (6.4)] Cu2O की रेखा लगभग शिखर पर है अतः कॉपर के अॉक्साइड अयस्कों को कोक के साथ गरम करके सीधे धातु में अपचयित करना अत्यधिक आसान होता है। विशेषकर 500-600 K के बाद (C, CO) तथा (C, CO2) दोनों ही रेखाएं आलेख में स्थिति में बहुत नीचे हैं तथापि बहुत से अयस्क सल्फाइड होते हैं तथा कुछ में लोहा भी हो सकता है। सल्फाइड अयस्काें का भर्जन/गलन करने पर अॉक्साइड प्राप्त होते हैं।2Cu2S + 3O2 → 2Cu2O + 2SO2 (6.32)
अॉक्साइड को कोक के द्वारा आसानी से धात्विक कॉपर में अपचित किया जा सकता है।Cu2O + C → 2 Cu + CO (6.33)
वास्तविक प्रक्रम में, अयस्क को सिलिका मिलाने के बाद परावर्तनी भट्टी में गरम किया जाता है। भट्टी में आयरन अॉक्साइड, आयरन सिलिकेट के रूप में धातुमल बनाता है तथा कॉपर, कॉपर मेट के रूप में प्राप्त होता है। इसमें Cu2S तथा FeS होते हैं।FeO + SiO2 → FeSiO3 (6.34)
धातुमल
इसके बाद कॉपर मेट को सिलिका परत चढ़े परिवर्तित्र (परिवर्तक)में भर दिया जाता है। कुछ सिलिका भी मिलाते हैं तथा बचे हुए FeS, FeO तथा Cu2S/Cu2O को धात्विक कॉपर में परिवर्तित करने के लिए गरम वायु के झोंके प्रवाहित करते हैं। निम्नलिखित अभिक्रियाएं संपन्न होती हैं -2FeS + 3O2 → 2FeO + 2SO2 (6.35)
FeO + SiO2 → FeSiO3 (6.36)
2Cu2S + 3O2 → 2Cu2O + 2SO2 (6.37)
2Cu2O + Cu2S → 6Cu + SO2 (6.38)
प्राप्त ठोस कॉपर (ताँबा), SO2 के निकलने के कारण फफोलेदार दिखाई देता है, इसलिए यह फफोलेदार ताँबा (ब्लिस्टर्ड कॉपर) कहलाता है।
(ग) ज़िंक अॉक्साइड से ज़िंक का निष्कर्षणज़िंक अॉक्साइड का अपचयन कोक द्वारा किया जाता है। इसमें कॉपर की स्थिति की अपेक्षा ताप अधिक रखा जाता है। तापन के लिए अॉक्साइड की कोक तथा मृदा के साथ छोटी-छोटी ईंटें बनाई जाती हैं।
ZnO + C Zn + CO (6.39)
Zn + CO (6.39)
पाठ्यनिहित प्रश्न
6-5 धाातुकर्म का वैद्युतरसायन सिद्धांत
हमने देखा कि किस प्रकार ऊष्मागतिकी के सिद्धांत उत्तापधातुकर्मिकी में प्रयुक्त होते हैं। धातु आयनों के विलयन में अथवा गलित अवस्था में अपचयन में समान सिद्धांत प्रभावी होते हैं। धातु के गलित लवण का अपचयन वैद्युतअपघटन द्वारा अथवा कोई अपचायक धातु मिलाकर किया जाता है। धातु लवण का पिघली हुई अवस्था में अपचयन विद्युत् अपघटन द्वारा किया जाता है। ये विधियाँ वैद्युतरसायन सिद्धांत पर आधारित हैं, जिन्हेें निम्नलिखित समीकरण के द्वारा समझा जा सकता है-
∆Gθ = - nEθF (6.40)
यहाँ n इलेक्ट्रॉनों की संख्या तथा Eθ निकाय के रेडॉक्स युग्म का इलेक्ट्रोड विभव है। अधिक क्रियाशील धातुओं के लिए इलेक्ट्रोड विभव का मान अधिक ऋणात्मक होता है इसलिए उनका अपचयन कठिन होता है। यदि समीकरण 6.40 में दो Eθ मानों में अंतर धनात्मक Eθ के, एवं परिणामतः ऋणात्मक ∆Gθ के संगत हो, तो कम क्रियाशील धातु विलयन से बाहर तथा अधिक क्रियाशील धातु विलयन में चली जाती है। उदाहरणार्थ -
Cu2+ (aq) + Fe(s) → Cu(s) + Fe2+ (aq) (6.41)
सामान्य वैद्युतअपघटन में Mn+ आयन ऋणात्मक इलेक्ट्रोड (कैथोड) पर विर्सजित होते हैं और वहाँ निक्षेपित हो जाते हैं। उत्पादित धातु की क्रियाशीलता को ध्यान में रखते हुए सावधानियाँ रखी जाती हैं एवं उपयुक्त पदार्थो के इलेक्ट्रोड का उपयोग किया जाता है। कभी-कभी गलित पदार्थ को अधिक सुचालक बनाने के लिए गालक मिला दिया जाता है।
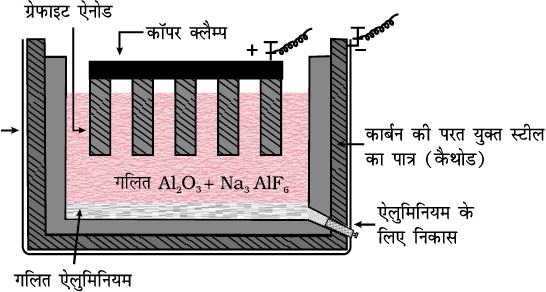
एेलुमिनियमइसके धातुकर्म में, शुद्ध Al2O3 में Na3AlF6 या CaF2 मिलाया जाता है, जिससे मिश्रण का गलनांक कम हो जाता है और इसमें चालकता आ जाती है। गलित आधात्री (मैट्रिक्स) का वैद्युतअपघटन किया जाता है। कार्बन की परत युक्त स्टील का पात्र कैथोड का कार्य करता है तथा ग्रैफाइट के एेनोड उपयोग में लेते हैं।
संपूर्ण अभिक्रिया को इस प्रकार लिखा जा सकता है -2Al2O3 + 3C → 4Al + 3CO2 (6.42)
वैद्युतअपघटन की यह विधि हॉल-हेरॉल्ट प्रक्रम के नाम से सुप्रसिद्ध है। गलित द्रव्य का वैद्युतअपघटन एक वैद्युतअपघटनी सेल में, कार्बन इलेक्ट्रॉड का प्रयोग करके किया जाता है। एेनोड पर उत्सर्जित अॉक्सीजन एेनोड के कार्बन से अभिक्रिया करके CO एवं CO2 बनाती है। इस प्रकार एेलुमिनियम के प्रत्येक किलोग्राम के उत्पादन के लिए कार्बन एेनोड का लगभग 0.5 किलोग्राम कार्बन जल जाता है। वैद्युतअपघटनी अभिक्रियाएं इस प्रकार हैं -कैथोड - Al3+ (गलित) + 3e- → Al(l) (6.43)
एेनोड - C(s) + O2- (गलित) → CO(g) + 2e- (6.44)
C(s) + 2O2- (गलित) → CO2 (g) + 4e- (6.45)
Cu2+(aq) + H2(g) → Cu(s) + 2H+ (aq) (6.46)
उदाहरण 6.4
एक स्थान पर, निम्न कोटि के कॉपर अयस्कों के साथ ज़िंक तथा आयरन की रद्दी धातु भी उपलब्ध हैं। निक्षालित कॉपर अयस्क के अपचयन के लिए दोनों में से कौन-सी रद्दी धातु अधिक अनुकूल है तथा क्यों?
हल
वैद्युतरासायनिक श्रेणी में ज़िंक आयरन से ऊपर होता है (ज़िंक अधिक क्रियाशील धातु है)। यदि रद्दी ज़िंक का उपयोग किया जाए तो अपचयन तेज़ी से होगा। परंतु ज़िंक आयरन से ज़्यादा कीमती धातु है, इसलिए रद्दी आयरन का उपयोग उपयुक्त एवं लाभकारी होगा।
6-6 ऑक्सीकरण अपचयन
अपचयन के अतिरिक्त, कुछ निष्कर्षण विशेषतः अधातुओं के लिए, अॉक्सीकरण पर आधारित हैं। अॉक्सीकरण पर आधारित एक अत्यंत सामान्य उदाहरण है- लवण-जल से क्लोरीन का निष्कर्षण (क्लोरीन समुद्री जल में सामान्य लवण के रूप में बहुतायत में उपलब्ध है)।2Cl-(aq) + 2H2O(l) → 2OH-(aq) + H2(g) + Cl2(g) (6.47)
इस अभिक्रिया के लिए ∆Gθ का मान, + 422kJ है। जब इसे ∆Gθ = - nEθF का उपयोग करते हुए Eθ में परिवर्तित करते हैं तब हम Eθ = 2.2 V प्राप्त करते हैं। स्वाभाविक रूप से इसके लिए 2.2 V से अधिक बाह्य विद्युत वाहक बल (emf) की आवश्यकता होगी। लेकिन वैद्युतअपघटन में कुछ अन्य बाधक अभिक्रियाओं पर नियंत्रण के लिए अतिरिक्त विभव की आवश्यकता होती है, (एकक-3, खंड 3.51), अतः Cl2 वैद्युतअपघटन से प्राप्त होती है जिसमें H2 तथा जलीय NaOH सहउत्पाद होते हैं। गलित NaCl का भी वैद्युतअपघटन किया जाता है, परंतु इस स्थिति में Na धातु प्राप्त होती है तथा NaOH नहीं बनता।4Au(s) + 8CN-(aq) + 2H2O(aq) + O2(g) → 4[Au(CN)2]-(aq) + 4OH-(aq) (6.48)
2[Au(CN)2]-(aq) + Zn(s) → 2Au(s) + [Zn(CN)4]2- (aq) (6.49)
6-7 शोधान
किसी भी विधि द्वारा निष्कर्षण से प्राप्त धातुओं में सामान्य रूप से कुछ अशुद्धियाँ मिली रहती हैं। उच्च शुद्धता की धातु प्राप्त करने के लिए अनेक विधियाँ प्रयोग में लाई जाती हैं। ये विधियाँ धातु एवं उसमें उपस्थित अशुद्धियों के गुणों में अंतर पर निर्भर करती हैं जिनमें से कुछ नीचे दी गई हैं-
(क) आसवन (घ) मंडल परिष्करण
(ख) द्रावगलन परिष्करण (च) वाष्प प्रावस्था परिष्करण
(ग) वैद्युतअपघटन (छ) वर्णलेखिकी (क्रोमैटोग्रैफी) विधि
यहाँ इनका वर्णन संक्षेप में किया गया है।
(क) आसवनयह विधि कम क्वथनांक वाली धातुओं जैसे ज़िंक तथा पारद के लिए बहुत उपयोगी हैं। अशुद्ध धातु को वाष्पीकृत करके शुद्ध धातु को आसुत के रूप में प्राप्त कर लिया जाता है।
इस विधि में कम गलनांक वाली धातु जैसे टिन को पिघलाकर ढालू सतह पर बहने दिया जाता है, जिससे अधिक गलनांक वाली अशुद्धियाँ अलग हो जाती हैं।
(ग) वैद्युतअपघटनी शोधन इस विधि में अशुद्ध धातु को एेनोड बनाते हैं। उसी धातु की शुद्ध धातु-पट्टी को कैथोड की तरह प्रयुक्त करते हैं। इन्हें एक उपयुक्त वैद्युतअपघटनी विश्लेषित्र में रखते हैं जिसमें उसी धातु का लवण घुला रहता है। अधिक क्षारकीय धातु विलयन में रहती है तथा कम क्षारकीय धातुएं एेनोड पंक में चली जाती हैं। इस प्रक्रम की व्याख्या, वैद्युत विभव की धारणा, अधिविभव तथा गिब्ज़ ऊर्जा के द्वारा (उपयोग) भी की जाती है, जिसको आपने पहले खंडों में देखा है। ये अभिक्रियाएं इस प्रकार हैं - एेनोड - M → Mn+ + n e-कैथोड - Mn+ + n e- → M (6.50)
ताँबे का शोधन वैद्युतअपघटनी विधि के द्वारा किया जाता है। अशुद्ध कॉपर एेनोड के रूप में तथा शुद्ध कॉपर पत्री कैथोड के रूप में लेते हैं। कॉपर सल्फेट का अम्लीय विलयन वैद्युतअपघटनी होता है तथा वैद्युतअपघटन के वास्तविक परिणामस्वरूप, शुद्ध कॉपर एेनोड से कैथोड की तरफ़ स्थानांतरित हो जाता है। एेनोड - Cu → Cu2+ + 2 e-कैथोड - Cu2+ + 2e- → Cu (6.51)
फफोलेदार कॉपर की अशुद्धियाँ एेनोड पंक के रूप में जमा होती हैं जिसमें एन्टीमनी सिलीनियम टेल्यूरियम, चाँदी, सोना तथा प्लैटिनम मुख्य होती हैं। इन तत्वों की पुनः प्राप्ति से शोधन की लागत की क्षतिपूर्ति हो सकती है। ज़िंक का शोधन भी इसी प्रकार से किया जा सकता है।
(घ) मंडल परिष्करण
यह विधि इस सिद्धांत पर आधारित है कि अशुद्धियों की विलेयता धातु की ठोस अवस्था की अपेक्षा गलित अवस्था में अधिक होती है। अशुद्ध धातु की छड़ के एक किनारे पर एक गतिशील तापक लगा रहता है (चित्र 6.8) जो छड़ को हर ओर से घेरे रहता है। तापक जैसे-जैसे आगे की ओर बढ़ता है, गलित मंडल भी आगे बढ़ता जाता है और शुद्ध धातु गलित में से क्रिस्टलित हो जाती है तथा अशुद्धियाँ संलग्न गलित मंडल में चली जाती हैं।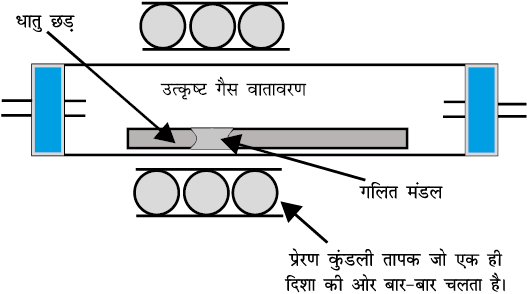
चित्र 6.8- मंडल परिष्करण प्रक्रम
इस क्रिया को कई बार दोहराया जाता है तथा तापक को एक ही दिशा में बार-बार चलाते हैं। अशुद्धियाँ छड़ के एक किनारे पर एकत्रित हो जाती हैं। इसे काटकर अलग कर लिया जाता है। यह विधि मुख्य रूप से अतिउच्च शुद्धता वाले अर्धचालकों तथा अन्य अतिशुद्ध धातुओं; जैसे - जर्मेनियम, सिलिकॉन, बोरॉन, गैलियम तथा इंडियम को प्राप्त करने के लिए बहुत उपयोगी है-
(च) वाष्प प्रावस्था परिष्करण
इस विधि में, धातु को वाष्पशील यौगिक में परिवर्तित किया जाता है तथा वाष्पित यौगिक को एकत्र कर लेते हैं। इसके बाद इसे विघटित करके शुद्ध धातु प्राप्त कर लेते हैं। इसके लिए दो आवश्यकताएं होती हैं-(i) उपलब्ध अभिकर्मक के साथ धातु वाष्पशील यौगिक बनाती हो तथा
(ii) वाष्पशील पदार्थ आसानी से विघटित हो सकता हो, जिससे धातु आसानी से पुनः प्राप्त की जा सके।
निम्नलिखित उदाहरण से यह तकनीक स्पष्ट हो जाती है-
निकैल शोधन का मॉन्ड प्रक्रम - इस प्रक्रम में निकैल को कार्बन मोनोक्साइड के प्रवाह में गरम करने से वाष्पशील निकैल टेट्राकार्बोनिल संकुल बन जाता है -
Ni + 4CO  [Ni(CO)4] (6.52)
[Ni(CO)4] (6.52)
इस संकुल को और अधिक ताप पर गरम करते हैं, जिससे यह विघटित होकर शुद्ध धातु दे देता है।
[Ni(CO)4]  Ni + 4CO (6.53)
Ni + 4CO (6.53)
जर्काेनियम या टाइटेनियम शोधन के लिए वॉन-आरकैल विधि - यह विधि Zr तथा Ti जैसी कुछ धातुओं से अशुद्धियों की तरह उपस्थित संपूर्ण अॉक्सीजन तथा नाइट्रोजन को हटाने में बहुत उपयोगी है। परिष्कृत धातु को निर्वातित पात्र में आयोडीन के साथ गरम करते हैं। धातु आयोडाइड अधिक सहसंयोजी होने के कारण वाष्पीकृत हो जाता है।
Zr + 2I2 → ZrI4 (6.54)
धातु आयोडाइड को विद्युतधारा द्वारा 1800 K ताप पर गरम किए गए टंगस्टन तंतु पर विघटित किया जाता है। इस प्रकार से शुद्ध धातु तंतु पर जमा हो जाती है।
ZrI4 → Zr + 2I2 (6.55)
(छ) वर्णलेखिकी (क्रोमैटोग्रैफी) विधियाँआप कक्षा XI (एकक-12) में पदार्थों के शोधन की क्रोमैटोग्राफी तकनीक के विषय में जान चुके हैं।
स्तम्भ वर्ण लेखिकी (कॉलम क्रोमैटोग्राफी) सूक्ष्म मात्रा में पाए जाने वाले तत्वों के शुद्धिकरण और शुद्ध किए जाने वाले तत्व तथा अशुद्धियों के रासायनिक गुणों में अधिक भिन्नता न होने की स्थिति में, शुद्धिकरण के लिए अत्यधिक उपयोगी होती है।
6-8 ऐलुमिनियम, कॉपर, जि़क, तथा लोहे के उपयोग
एेलुमिनियम पन्नी का उपयोग खाद्य पदार्थों के लिए आवरण-पत्र (रैपर) के रूप में होता है। धातु की सूक्ष्म धूलि का उपयोग प्रलेपों (पेंट) व प्रलाक्षों (रोगन) में किया जाता है। अत्यधिक क्रियाशील होने के कारण एेलुमिनियम का उपयोग क्रोमियम तथा मैंगनीज के अॉक्साइडों से, उनके निष्कर्षण में किया जाता है। एेलुमिनियम के तारों का उपयोग विद्युत चालकों के रूप में किया जाता है। एेलुमिनियम युक्त मिश्रातु हल्की होने के कारण बहुत उपयोगी होती हैं।
ताँबे का उपयोग विद्युत उद्योग में तार बनाने तथा जल और भाप के लिए पाइप बनाने में होता है। इसका उपयोग कई प्रकार की मिश्रधातुओं में भी किया जाता है, जो धातु से अधिक कठोर होती हैं। जैसे पीतल (ज़िंक के साथ), काँसा (टिन के साथ) तथा मुद्रा मिश्रधातु (निकैल के साथ)। ज़िंक का उपयोग जस्तेदार लोहा बनाने में किया जाता है। व्यापक मात्रा में इसका उपयोग बैटरियों में, कई मिश्रधातु घटकों में, जैसे - पीतल (Cu, 60%; Zn, 40%) तथा जर्मन सिल्वर (Cu, 25-30%; Zn, 25-30%; Ni, 40-50%) में होता है। यशद रज का उपयोग रंजक सामग्री, प्रलेप आदि के उत्पादन में अपचायक के रूप में किया जाता है। ढलवाँ लोहा, जो कि लोहे का सबसे महत्वपूर्ण प्रकार है, इसका उपयोग स्टोवों, रेलवे स्लीपरों, गटर पाइपों तथा खिलौने आदि को ढालने में होता है। इसका उपयोग पिटवाँ लोहे तथा इस्पात को बनाने में किया जाता है। पिटवाँ लोहे का उपयोग लंगरों, तारों, बोल्टों, चेनों तथा कृषि उपयोगी उपकरणों के बनाने में किया जाता है। स्टील (इस्पात) के अनेक उपयोग हैं। जब इसमें दूसरी धातुएं मिलाई जाती हैं तो मिश्रातु इस्पात प्राप्त होता है। निकैल इस्पात का उपयोग रस्से बनाने, स्वचालित वाहनों तथा हवाई जहाज़ों के हिस्से, लोलक, मापक फ़ीतों, कटाई के औज़ारों तथा संदलन मशीनों के बनाने में और स्टेनलेस स्टील का उपयोग साइकिलों, स्वचालित वाहनों, बरतनों तथा पेनों इत्यादि में किया जाता है।सारांश
यद्यपि वर्तमान धातुकर्मिकी की औद्योगिकी क्राँति के बाद चरघातांकी वृद्धि हुई फिर भी वर्तमान अवधारणाओं में से बहुत-सी एेसी हैं जिनका आधार औद्योगिकी क्राँति के पहले-पहले से है। भारत में 7000 वर्षों से भी अधिक समय से पारंपरिक धातुकर्मीय कौशल रहा है। पुरातन धातुविदों ने महत्वपूर्ण योगदान दिए हैं जिनको विश्व के इतिहास में उचित स्थान मिलना चाहिए। ज़िंक और अधिक कार्बन वाले स्टील तैयार करने में तो पुरातन भारत का महत्वपूर्ण योगदान है जिसने वर्तमान धातुकर्मीय प्रगति के लिए आधार तैयार किया जिसके कारण धातुकर्म का अध्ययन आरंभ हुआ और औद्योगिक क्राँति आई। धातुओं की आवश्यकता विभिन्न प्रकार के कार्यों के लिए होती है, अतः हमें उन खनिजों में से इनके निष्कर्षण की आवश्यकता होती है जिनमें यह पाई जाती है तथा जिनसे इनका निष्कर्षण वाणिज्यिक रूप से व्यावहारिक होता है। इन खनिजों को अयस्कों के नाम से जाना जाता है। धात्विक अयस्कों में कई प्रकार की अशुद्धियाँ पाई जाती हैं। इन अशुद्धियों का निष्कासन एक सीमा तक सांद्रण चरणों (पदों) द्वारा प्राप्त किया जाता है। सांद्रित अयस्क से धातु प्राप्त करने के लिए रासायनिक क्रिया की जाती है। सामान्यतः धात्विक यौगिक (जैसे अॉक्साइड, सल्फाइड) धातु में अपचित किए जाते हैं। कार्बन CO या कुछ धातुएं भी अपचायक की तरह प्रयुक्त की जाती हैं। इन अपचयन की प्रक्रियाओं में ऊष्मागतिकी तथा वैद्युतरासायनिक अवधारणाओं पर उचित विचार किया जाता है। धात्विक अॉक्साइड अपचायक से क्रिया करते हैं जिससे अॉक्साइड धातु में अपचित हो जाता है तथा अपचायक अॉक्सीकृत हो जाता है। दोनों अभिक्रियाओं में गिब्ज़ ऊर्जा में वास्तविक परिवर्तन ऋणात्मक होता है जो ताप ब\ढ़ाने पर और अधिक ऋणात्मक हो जाता है। ठोस से द्रव या द्रव से गैस में भौतिक अवस्था परिवर्तन तथा गैसीय अवस्थाओं की उत्पत्ति, संपूर्ण तंत्र की गिब्ज़ ऊर्जा में कमी लाने में सहायक होती है। यह अवधारणा इस प्रकार की अॉक्सीकरण/अपचयन अभिक्रियाओं के लिए विभिन्न तापों पर, ∆Gθ तथा T के मध्य वक्र (एलिंघम आरेख) द्वारा दर्शाई जा सकती है। विद्युत विभव की अवधारणा धातु (जैसे A1, Ag, Au) के निष्कर्षण में उपयोगी है। जहाँ दो रेडॉक्स युग्मों के इलैक्ट्रोड विभवों का योग धनात्मक होता है। इसलिए गिब्ज़ ऊर्जा परिवर्तन ऋणात्मक हो जाता है। सामान्य विधियों द्वारा प्राप्त धातुओं में अभी भी अल्प अशुद्धियाँ विद्यमान होती हैं। शुद्ध धातु प्राप्त करने के लिए शोधन की आवश्यकता होती है। शोधन की प्रक्रिया धातु तथा अशुद्धियों के गुणों में अंतर पर निर्भर करती है। सामान्यतः एेलुमिनियम का निष्कर्षण बॉक्साइट अयस्क को NaOH के साथ निक्षालित करके किया जाता है। इस प्रकार बना सोडियम एेलुमिनेट पृथक् कर लिया जाता है, जो उदासीनीकरण करने पर पुनः जलीय अॉक्साइड बनाता है जिसका क्रायोलाइट को गालक (Flux) की तरह प्रयोग में लाकर वैद्युतअपघटन किया जाता है। लोहे का निष्कर्षण, इसके अॉक्साइड अयस्कों को वात्या भट्टी में अपचित करके किया जाता है। ताँबे का निष्कर्षण परावर्तनी भट्टी में प्रगलन तथा गरम करके किया जाता है। ज़िंक का ज़िंक अॉक्साइड से निष्कर्षण कोक का उपयोग करके किया जाता है। धातुओं के शोधन के लिए अनेक विधियों का उपयोग किया जाता है। सामान्यतः धातुएं व्यापक रूप से उपयोग में लाई जाती हैं तथा विभिन्न प्रकार के उद्योगों के विकास में इनका महत्वपूर्ण योगदान है। कुछ धातुओं की उपस्थिति तथा निष्कर्षण का संक्षिप्त विवरण निम्नलिखित सारणी में दिया गया है।
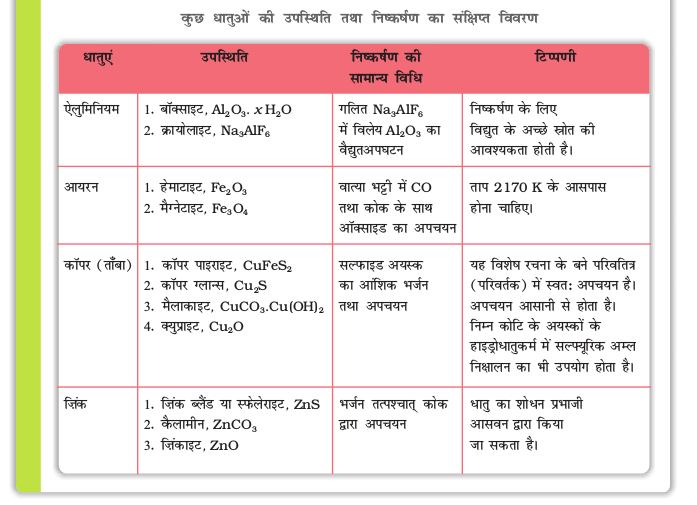
अभ्यास
6.1 कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जाता है, परंतु ज़िंक का नहीं। व्याख्या कीजिए।6.2 फेन प्लवन विधि में अवनमक की क्या भूमिका है?
6.3 अपचयन द्वारा अॉक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन क्यों है?
6.4 व्याख्या कीजिए - (1) मंडल परिष्करण (2) स्तंभ वर्णलेखिकी
6.5 673 K ताप पर C तथा CO में से कौन सा अच्छा अपचायक है?
6.6 कॉपर के वैद्युतअपघटन शोधन में एेनोड पंक में उपस्थित सामान्य तत्वों के नाम दीजिए। वे वहाँ कैसे उपस्थित होते हैं?
6.7 आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली अभिक्रियाओं को लिखिए।
6.8 ज़िंक ब्लेंड से ज़िंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
6.9 कॉपर के धातुकर्म में सिलिका की भूमिका समझाइए।
6.10 यदि तत्व सूक्ष्म मात्रा में प्राप्त हुआ हो तो शोधन की कौन-सी तकनीक अधिक उपयोगी होगी?
6.11 यदि किसी तत्व में उपस्थित अशुद्धियों के गुण तत्व से मिलते-जुलते हों तो आप शोधन के लिए किस विधि का सुझाव देंगे।
6.12 निकैल-शोधन की विधि समझाइए।
6.13 सिलिका युक्त बॉक्साइट अयस्क में से सिलिका को एेलुमिना से कैसे अलग करते हैं? यदि कोई समीकरण हो तो दीजिए।
6.14 उदाहरण देते हुए भर्जन व निस्तापन में अंतर बताइए।
6.15 ढलवाँ लोहा कच्चे लोहे से किस प्रकार भिन्न होता है?
6.16 अयस्कों तथा खनिजों में अंतर स्पष्ट कीजिए।
6.17 कॉपर मेट को सिलिका की परत चढ़े हुए परिवर्तक में क्यों रखा जाता है?
6.18 एेलुमिनियम के धातुकर्म में क्रायोलाइट की क्या भूमिका है?
6.19 निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया को कैसे किया जाता है?
6.20 CO का उपयोग करते हुए अपचयन द्वारा ज़िंक अॉक्साइड से ज़िंक का निष्कर्षण क्यों नहीं किया जाता?
6.21 Cr2O3 के विरचन के लिए ∆fGθ का मान - 540 kJmol-1 है तथा Al2O3 के लिए -827 kJ mol-1 है क्या Cr2O3 का अपचयन Al से संभव है?
6.22 C व CO में से ZnO के लिए कौन-सा अपचायक अच्छा है?
6.23 किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। आप इस कथन से कहाँ तक सहमत हैं? अपने मत के समर्थन में दो उदाहरण दीजिए।
6.24 उस विधि का नाम लिखिए जिसमें क्लोरीन सहउत्पाद के रूप में प्राप्त होती है। क्या होगा यदि NaCl के जलीय विलयन का वैद्युतअपघटन किया जाए?
6.25 एेलुमिनियम के वैद्युत-धातुकर्म में ग्रैफाइट छड़ की क्या भूमिका है?
6.26 निम्नलिखित विधियों द्वारा धातुओं के शोधन के सिद्धांतों की रूपरेखा दीजिए।
(i) मंडल परिष्करण (ii) वैद्युतअपघटन परिष्करण (iii) वाष्प प्रावस्था परिष्करण 6.27 उन परिस्थितियों का अनुमान लगाइए जिनमें Al, MgO को अपचयित कर सकता है। (संकेत - पाठ्यनिहित प्रश्न 6.4 देखिए)पाठ्यनिहित प्रश्नों के उत्तर
6.1 उन अयस्कों को जिनमें एक घटक चुंबकीय (या तो अशुद्धता या वास्तविक अयस्क) होता है, इस प्रकार से सांद्रित किया जा सकता है। जैसे लोह युक्त अयस्क (हेमेटाइट, मैग्नेटाइट, सिडेराइट तथा आयरन पाइराइट)
6.2 निक्षालन का महत्व बाक्साइट अयस्क से SiO2, Fe2O3 आदि अशुद्धियों के निष्कासन में सहायक होने के कारण है।
6.3 उष्मागतिकी रूप से सुसंगत कुछ अभिक्रियाओं के लिए भी निश्चित मात्रा में सक्रियण उर्जा की आवश्यकता होती है। अतः तापन आवश्यक है।
6.4 हाँ, 1350ºC से कम ताप पर Mg, Al2O3 को अपचित कर सकता है तथा 1350ºC से अधिक ताप पर Al, MgO का अपचयन कर सकता है। यह अनुमान ∆GV तथा T के मध्य आलेख से लगाया जा सकता है (चित्र 6.4)।
