Table of Contents
एकक 7
p-ब्लॉक के तत्व
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप —
• 15, 16, 17 और 18 वर्ग के तत्वों के रसायन में सामान्य प्रवृत्तियों के महत्व को समझ सकेंगे;
• डाइनाइट्रोजन और फ़ॉस्फ़ोरस तथा उनके कुछ महत्वपूर्ण यौगिकों के संश्लेषण, गुणों और उपयोगों के बारे में सीख सकेंगे;
• डाइ अॉक्सीजन और ओज़ोन के संश्लेषण, गुण और उपयोग तथा कुछ सामान्य अॉक्साइडों के रसायन का वर्णन कर सकेंगे;
• सल्फर के अपररूपों, इसके महत्वपूर्ण यौगिकों के रसायन तथा इसके अॉक्सोअम्लों की संरचना के बारे में जान सकेंगें;
• क्लोरीन और हाइड्रोक्लोरिक अम्ल के संश्लेषण, गुणों तथा उपयोगों का वर्णन कर सकेंगे;
• अंतराहैलोजनों के रसायन तथा हैलोजनों के अॉक्सोअम्लों की संरचना के बारे में जान सकेंगे;
• उत्कृष्ट गैसों के उपयोग बता सकेंगे;
• दैनिक जीवन में इन तत्वों और इनके यौगिकों के महत्व को समझ सकेंगे।
"रसायन में विविधता p-ब्लॉक तत्वों की स्पष्ट पहचान है जो उनकी अपने एवं s-, d- व f- ब्लॉक तत्वों के साथ अभिक्रिया करने की प्रवृत्ति से स्पष्ट है।"
कक्षा XI में आप जान चुके हैं कि p ब्लाक के तत्व आवर्त सारणी के वर्ग 13 से 18 में रखे गए हैं। इनके संयोजकता कोश का इलेक्ट्रॉनिक विन्यास ns2np1-6 (हीलियम, He, के अतिरिक्त, विन्यास 1s2) है, p- ब्लॉक के तत्वों के गुण अन्य तत्वों की ही भाँति परमाणवीय आकारों, आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा विद्युतऋणात्मकता से बहुत अधिक प्रभावित होते हैं। द्वितीय आवर्त में d- कक्षकों की अनुपस्थिति तथा भारी तत्वों में d या d और f- कक्षकों (तृतीय आवर्त एवं उसके पश्चातवर्ती) की उपस्थिति का तत्वों के गुणों पर सार्थक प्रभाव होता है। इसके अतिरिक्त तीनों प्रकार के तत्वों- धातु, उपधातु तथा अधातु की उपस्थिति इनके रसायन को विविधता प्रदान करती है।
आवर्त सारणी के p- ब्लॉक के वर्ग 13 व 14 के तत्वों के रसायन का कक्षा XI में अध्ययन करने के पश्चात् इस एकक में आप इसके बाद के वर्गों के तत्वों के रसायन के बारे में पढ़ेंगे।
7-1 वर्ग 15 के तत्व
वर्ग 15 में तत्व, नाइट्रोजन, फ़ॉस्फ़ोरस, आर्सेनिक एेन्टिमनी बिस्मथ एवं मास्कोवियम सम्मिलित हैं। जैसे-जैसे हम वर्ग में नीचे की ओर बढ़ते हैं, अधात्विक गुण, उपधात्विक गुणों से होते हुए धात्विक गुणों में परिवर्तित हो जाते हैं। नाइट्रोजन तथा फ़ॉस्फ़ोरस अधातुएं, आर्सेनिक तथा एेन्टिमनी उपधातुएं तथा बिस्मथ एक मास्कोवियम धातुएँ हैं।
7.1.1 उपलब्धता
वायुमंडल में आण्विक नाइट्रोजन का आयतन 78% है। भूपर्पटी के खनिजों में यह सोडियम नाइट्रेट (चिली साल्टपीटर या चिली शोरा) तथा पोटैशियम नाइट्रेट (इंडियन साल्टपीटर) के रूप में पाया जाता है। जीवों और वनस्पतियों में यह प्रोटीन के रूप में पाया जाता है। फ़ॉस्फ़ोरस एेपेटाइट वर्ग के खनिजों Ca9(PO4)6. CaX2 (X = F, Cl अथवा OH), (उदाहरण- फ्लुओरोएेपेटाइट Ca9(PO4)6. CaF2) में मिलता है, जो कि फॉस्फेट चट्टानों के मुख्य घटक होते हैं। फॉस्फोरस प्राणियों एवं पादप पदार्थों का आवश्यक अवयव होता है। यह अस्थियों तथा अन्य जीवित कोशिकाओं में उपस्थित होता है। फ़ॉस्फ़ोप्रोटीन दूध तथा अंडों में उपस्थित होते हैं। आर्सेनिक, एेन्टिमनी तथा बिस्मथ मुख्यत: सल्फाइड खनिजों के रूप में पाए जाते हैं। मास्कोवियम संश्लेषित तत्व है। मास्कोवियम का संकेत Mc, परमाणु संख्या 115, परमाण्विक द्रव्यमान 289 gmol-1 तथा इलेक्ट्रॉनिक विन्यास [Rn] 5f14 6d10 7s2 7p3 है। इसकी अल्प अर्घायु तथा अल्प मात्रा में उपलब्धता के कारण इसका रसायन ज्ञात नहीं है।
यहाँ मास्कोवियम को छोड़कर इस वर्ग के अन्य तत्वों के महत्वपूर्ण परमाण्विक तथा भौतिक गुण उनके इलेक्ट्रॉनिक विन्यास के साथ सारणी 7.1 में दिए गए हैं तथा उनके कुछ परमाण्विक, भौतिक और रासायनिक गुणों की प्रवृत्तियों की चर्चा नीचे की गई है।
सारणी 7.1- वर्ग 15 के तत्वों के परमाण्विक तथा भौतिक गुण
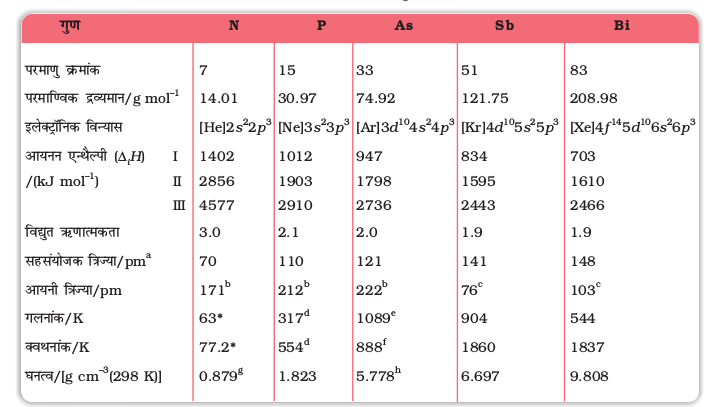
a EIII एकल बंध (E= तत्व); b E3-; c E3+; d श्वेत फ़ॉस्फ़ोरस e धूसर 38.6 atm पर; α- रूप f उर्ध्वपातन ताप g 63 K पर h धूसर α- रूप * आण्विक N2
7.1.2 इलेक्ट्रॉनिक विन्यास
इन तत्वों का संयोजकता कोश इलेक्ट्रॉनिक विन्यास, ns2np3 होता है। इन तत्वों के s कक्षक पूर्णतया भरे होते हैं तथा p कक्षक अर्धभरित होते हैं, जो इनके इलेक्ट्रॉनिक विन्यास को अतिरिक्त स्थायित्व प्रदान करते हैं।
7.1.3 परमाणु एवं आयनी त्रिज्या
वर्ग में नीचे की ओर बढ़ने पर सहसंयोजक तथा आयनी (किसी एक विशेष अवस्था में) त्रिज्याओं के आकार में वृद्धि होती है। N से P तक सहसंयोजक त्रिज्या में विचारणीय वृद्धि होती है। हालाँकि, As से Bi तक सहसंयोजक त्रिज्या में बहुत कम वृद्धि प्रेक्षित की जाती है। यह भारी सदस्यों में पूर्ण भरे d और / या f कक्षकों की उपस्थिति के कारण है।
7.1.4 आयनन एन्थैल्पी
7.1.5 विद्युत्ऋणात्मकता
सामान्यत: वर्ग में नीचे की ओर जाने पर परमाण्विक आकार में वृद्धि के साथ विद्युत्ऋणात्मकता का मान घटता है हालाँकि भारी तत्वों में यह अंतर बहुत अधिक नहीं है।
7.1.6 भौतिक गुण
7.1.7 रासायनिक गुण
अॉक्सीकरण अवस्थाएं तथा इनकी क्रियाशीलता में पाई जाने वाली प्रवृत्तियाँ
इन तत्वों की सामान्य अॉक्सीकरण अवस्थाएं -3, +3 तथा +5 हैं। आकार तथा धातु लक्षणों में वृद्धि के कारण वर्ग में नीचे की ओर जाने पर -3 अॉक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति घटती है। वास्तव में वर्ग का अंतिम सदस्य, बिस्मथ -3 अॉक्सीकरण अवस्था में शायद ही कोई यौगिक बनाता हो। वर्ग में नीचे की ओर जाने पर +5 अॉक्सीकरण अवस्था का स्थायित्व घटता है। बिस्मथ (V) का एकमात्र अभिलक्षणिक यौगिक BiF5 है। वर्ग में नीचे की ओर +5 अॉक्सीकरण अवस्था के स्थायित्व में कमी तथा +3 अॉक्सीकरण अवस्था (अक्रिय युगल प्रभाव के कारण) के स्थायित्व में वृद्धि होती है। +5 अॉक्सीकरण अवस्था के अलावा अॉक्सीजन के साथ अभिक्रिया करने पर नाइट्रोजन +1, +2, +4 अॉक्सीकरण अवस्थाएं भी प्रदर्शित करती है। यद्यपि यह +5 अॉक्सीकरण अवस्था में हैलोजन के साथ यौगिक नहीं बनाती क्योंकि इसमें d- कक्षक उपलब्ध नहीं है, जिससे यह अन्य तत्वों से इलेक्ट्रॉन लेकर पाँच बंधबना सके। फ़ॉस्फ़ोरस भी कुछ अॉक्सो अम्लों में, +1 तथा +4 अॉक्सीकरण अवस्थाएं प्रदर्शित करता है।
नाइट्रोजन की +1 से +4 तक सभी अॉक्सीकरण अवस्थाओं की प्रवृत्ति अम्ल विलयन में असमानुपातन की होती है। उदाहरण के लिए-
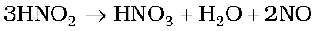
इसी प्रकार फ़ॉस्फ़ोरस की लगभग सभी मध्यवर्ती अॉक्सीकरण अवस्थाएं क्षार व अम्ल दोनों में +5 और -3 अॉक्सीकरण अवस्थाओं में असमानुपातित हो जाती हैं हालाँकि आर्सेनिक एेन्टिमनी और बिस्मथ की +3 अॉक्सीकरण अवस्था असमानुपातन के संदर्भ में बहुत अधिक स्थायी हो जाती है।
नाइट्रोजन की अधिकतम सहसंयोजकता 4 ही हो सकती है; क्योंकि केवल 4 कक्षक (एक s तथा तीन p) ही बंधन के लिए उपलब्ध हैं। भारी तत्वों में बाहरी कोश में रिक्त d कक्षक होते हैं, जो बंधन (सहसंयोजी) के लिए उपयोग किए जा सकते हैं, अत: उनकी सहसंयोजकता बढ़ा देते हैं जैसे PF6- में।
नाइट्रोजन का असामान्य गुण (व्यवहार)
नाइट्रोजन छोटे आकार, उच्च विद्युत्ऋणात्मकता, उच्च आयनन एन्थैल्पी एवं d कक्षकों की अनुपलब्धता के कारण वर्ग के अन्य सदस्यों से भिन्न होती हैं। नाइट्रोजन की स्वयं के साथ व छोटे आकार तथा उच्च विद्युत्ऋणात्मकता वाले तत्वों (जैसे C,O) के साथ, pπ−pπ बहुआबंध बनाने की विशिष्ट प्रवृत्ति होती है। इस वर्ग के भारी तत्व pπ−pπ बंध नहीं बनाते क्योंकि उनके परमाणु कक्षक इतने बड़े और विसरित होते हैं कि वे प्रभावी अतिव्यापन नहीं कर सकते। इस प्रकार नाइट्रोजन दो परमाणुओं के बीच एक त्रिबंध (एक σ तथा दो π) के साथ एक द्विपारमाणुक अणु रूप में पाया जाता है, परिणामस्वरूप इसकी बंध एन्थैल्पी (941.4 kJ mol-1) बहुत उच्च है। इसके विपरीत फ़ॉस्फ़ोरस, आर्सेनिक तथा एेन्टिमनी P-P, As-As तथा Sb-Sb जैसे एकल बंध बनाते हैं, जबकि बिस्मथ तात्विक अवस्था में धात्विक बंध बनाता है एक N-N बंध, एक P-P बंध की अपेक्षा दुर्बल होता है क्योंकि इसमें अबंधी इलेक्ट्रॉनों के उच्च अंतराइलेक्ट्रॉनिक प्रतिकर्षण के कारण बंध लंबाई कम होती है। परिणामत: नाइट्रोजन में शृंखलन प्रवृत्ति दुर्बल होती है। इसके संयोजकता कोश में d कक्षकों की अनुपस्थिति दूसरा कारक है जो इसके रसायन को प्रभावित करता है। इसकी सहसंयोजकता केवल 4 तक ही सीमित रहने के अलावा नाइट्रोजन dπ-pπ बंध नहीं बना सकता जैसा कि भारी तत्व करते हैं, उदाहरणार्थ R3P=O तथा R3P=CH2 (R = एेल्किल समूह)। फ़ॉस्फ़ोरस तथा आर्सेनिक संक्रमण तत्वों के साथ भी dπ-dπ बंध बना सकते हैं, जब उनके P(C2H5)3 तथा As(C6H5)3 जैसे यौगिक लिगेन्डों के रूप में कार्य करते हैं।
(i) हाइड्रोजन के प्रति क्रियाशीलता
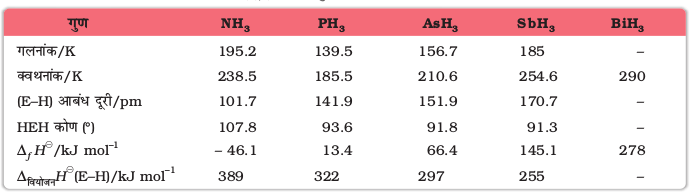
वर्ग 15 के सभी तत्व EH3 प्रकार के हाइड्राइड बनाते हैं, जहाँ E = N, P, As, Sb या Bi हो सकता है। इनके हाइड्राइडों के कुछ गुण सारणी 7.2 में दर्शाए गए हैं। हाइड्राइड उनके गुणों में नियमित क्रमिक परिवर्तन दर्शाते हैं। हाइड्राइडो का स्थायित्व NH3 से BiH3 तक घटता है जो कि उनकी बंध वियोजन एन्थैल्पी से प्रेक्षित किया जा सकता है। परिणामस्वरूप, हाइड्राइडों का अपचायी गुण बढ़ता है। अमोनिया केवल एक मृदु अपचायक है, जबकि BiH3 प्रबलतम अपचायक है। क्षारकता भी इसी क्रम में घटती है-
NH3 > PH3 > AsH3 > SbH3 > BiH3
नाइट्रोजन की उच्च विद्युत ऋणात्मकता तथा छोटे आकार के कारण अमोनिया ठोस एवं द्रव अवस्था में हाइड्रोजन आबंध बनाती है। यही कारण है कि इसके गलनांक और क्वथनांक PH3 से अधिक होते हैं।
सारणी 7.2- वर्ग 15 के तत्वों के हाइड्राइडों के गुण
(ii) अॉक्सीजन के प्रति क्रियाशीलता
(iii) हैलोजन के प्रति क्रियाशीलता
इन तत्वों की अभिक्रियाओं में हैलाइडो की दो श्रेणियाँ- EX3 तथा EX5 बनती हैं। नाइट्रोजन के संयोजकता कोश में d कक्षकों की अनुपस्थिति के कारण यह पेंटाहैलाइड नहीं बनाता। पेन्टाहैलाइड ट्राईहैलाइडों की अपेक्षा अधिक सहसंयोजी होते हैं। नाइट्रोजन के अलावा इन सभी तत्वों के ट्राइहैलाइड स्थायी होते हैं। इस तथ्य का कारण है कि पेन्टाहैलाइड में +5 अॉक्सीकरण अवस्था प्रदर्शित होती है जबकि ट्राईहैलाइडों में +3, चूँकि तत्वों की ध्रुवण क्षमता +3 अॉक्सीकण अवस्था की तुलना में +5 अॉक्सीकरण अवस्था में अधिक होती है अत: पेन्टाहैलाइडों में सहसंयोजन गुण अधिाक होता है। नाइट्रोजन के लिए केवल NF3 ही स्थायी है। BiF3 के अतिरिक्त सभी ट्राईहैलाइड मुख्य रूप से सहसंयोजी प्रकृति के होते हैं।
(iv) धातुओं के प्रति क्रियाशीलता
यह सभी तत्व धातुओं के साथ अभिक्रिया करके द्विअंगी यौगिक बनाते हैं जिनमें यह -3 अॉक्सीकरण अवस्था दर्शाते हैं। जैसे Ca3 N2 (कैल्शियम नाइट्राइड) Ca3P2 (कैल्शियम फॉस्फाइड) Na3 As (सोडियम आर्सेनाइड) Zn3 Sb2 (जिंक एन्टीमोनाइड) तथा Mg3 Bi2 (मैग्नीशियम बिस्मथाइड)।
उदाहरण 7.1
यद्यपि नाइट्रोजन +5 अॉक्सीकरण अवस्था दर्शाता है, लेकिन यह पेन्टाहैलाइड नहीं बनाता। कारण दीजिए।
हल
नाइट्रोजन में n=2 है, जिसमें केवल s तथा p कक्षक हैं। इसमें सहसंयोजकता का चार से आगे प्रसार करने के लिए d कक्षक नहीं हैं। इसीलिए यह पेन्टाहैलाइड नहीं बनाता।
उदाहरण 7.2
PH3 का क्वथनांक NH3 की अपेक्षा कम होता है। क्यों?
हल
NH3 की भाँति PH3 अणु द्रव अवस्था में हाइड्रोजन बंध की सहायता से बंधित नहीं होते, इसी कारण PH3 का क्वथनांक NH3 से कम होता है।
पाठ्यनिहित प्रश्न
7.1 P, As, Sb तथा Bi के ट्राईहैलाइडों से पेन्टाहैलाइड अधिक सहसंयोजी क्यों होते हैं?
7.2 वर्ग 15 के तत्वों के हाइड्राइडों में BiH3 सबसे प्रबल अपचायक क्यों है।
7-2 डाइनाइट्रोजन
विरचन
डाइनाइट्रोजन का व्यावसायिक उत्पादन वायु के द्रवीकरण तथा प्रभाजी आसवन से किया जाता है। पहले द्रव नाइट्रोजन (क्वथनांक 77.2k) आसवित होती है एवं अॉक्सीजन (क्वथनांक 90k) शेष रह जाती है।
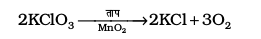
प्रयोगशाला में डाइनाइट्रोजन बनाने के लिए अमोनियम क्लोराइड के जलीय विलयन कीे सोडियम नाइट्राइट के साथ अभिक्रिया कराई जाती है-
NH4Cl(aq) + NaNO2(aq) → N2(g) + 2H2O(l) + NaCl (aq)
इस अभिक्रिया में थोड़ी मात्रा में NO तथा HNO3 भी बनते हैं; इन अशुद्धियों को गैस को पौटैशियम डाइक्रोमेट युक्त सल्फ्यूरिक अम्ल के जलीय विलयन में से प्रवाहित कर दूर किया जा सकता है। इसे अमोनियम डाइक्रोमेट के तापीय अपघटन से भी प्राप्त किया जा सकता है।
(NH4)2Cr2O7  N2 + 4H2O + Cr2O3
N2 + 4H2O + Cr2O3
अति शुद्ध अवस्था में नाइट्रोजन सोडियम या बेरियम एजाइड के तापीय अपघटन से भी प्राप्त की जा सकती है।
Ba(N3)2 → Ba + 3N2
गुण
डाइनाइट्रोजन एक रंगहीन, गंधहीन, स्वादहीन तथा अविषैली गैस है। नाइट्रोजन परमाणु के दो स्थायी समस्थानिक 14N तथा 15N हैं। इसकी जल में विलेयता बहुत कम है (23.2 cm3 प्रति लीटर जल, 273k ताप तथा 1 बार दाब पर) तथा हिमांक और क्वथनांक भी कम हैं (सारणी 7.1)।
N≡N बंध की उच्च बंध एन्थैल्पी के कारण डाइनाइट्रोजन कमरे के ताप पर काफी अक्रिय है। यद्यपि, ताप में वृद्धि के साथ क्रियाशीलता तेज़ी से बढ़ती है। उच्च ताप पर यह कुछ धातुओं के साथ सीधे संयुक्त होकर मुख्य रूप से आयनिक नाइट्राइडों तथा अधातुओं के साथ सहसंयोजक नाइट्राइडों को बनाती है। कुछ विशिष्ट अभिक्रियाएं हैं-
6Li + N2  2Li3N
2Li3N
3Mg + N2  Mg3N2
Mg3N2
यह उत्प्रेरक की उपस्थिति में लगभग 773 K ताप पर यह हाइड्रोजन के साथ संयोजित होकर अमोनिया बनाती है (हाबर प्रक्रम)।
N2(g) + 3H2(g)  2NH3(g); ∆fHθ = -46.1 kJmol-1
2NH3(g); ∆fHθ = -46.1 kJmol-1
डाइनाइट्रोजन, केवल अत्यधिक उच्च ताप (लगभग 2000 K) पर डाइअॉक्सीजन के साथ संयोग कर नाइट्रिक अॉक्साइड, NO बनाती है।
N2(g) + O2(g)  2NO(g)
2NO(g)
उपयोग
डाइनाइट्रोजन का मुख्य उपयोग अमोनिया तथा नाइट्रोजन युक्त अन्य औद्योगिक रसायनों (उदाहरण- कैल्सियम सायनेमाइड) के निर्माण में है। जहाँ अक्रिय वातावरण की आवश्यकता होती है; वहाँ भी इसका उपयोग होता है। (जैसे- लोहा और स्टील उद्योग, अभिक्रियाशील रसायनों के लिए अक्रिय तनुकारी) द्रव नाइट्रोजन का उपयोग जैविक पदार्थों एवं खाद्य सामग्री के लिए प्रशीतक के रूप में और क्रायोसर्जरी में होता है।
उदाहरण 7.3
सोडियम एेज़ाइड के तापीय अपघटन की अभिक्रिया लिखिए।
हल
सोडियम एेज़ाइड तापीय अपघटन से डाइनाइट्रोजन गैस देता है।
2NAaN3 →2NA +3N2
पाठ्यनिहित प्रश्न
7.3 N2 कमरे के ताप पर कम क्रियाशील क्यों है?
7.3 अमोनिया
छोटे स्तर पर अमोनिया, अमोनियम लवणों से प्राप्त होती है, जो कॉस्टिक सोडा या कैल्सियम हाइड्रॉक्साइड से क्रिया करने पर विघटित हो जाते हैं।
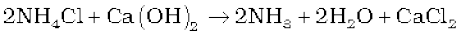
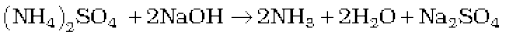
व्यापक स्तर पर अमोनिया हाबर प्रक्रम द्वारा बनाई जाती है।
N2(g) + 3H2(g) 2NH3(g); ∆f Hθ = - 46.1 kJ mol-1
ले-शतैलिए सिद्धांत के अनुसार उच्च दाब अमोनिया निर्मित करने के लिए अनुकूल होता है। अमोनिया के उत्पादन के लिए अनुकूलतम परिस्थितियाँ 200 × 105 Pa (लगभग 200 वायुमंडलीय दाब, ~700 K ताप तथा थोड़ी मात्रा में K2O तथा Al2O3 युक्त आयरन अॉक्साइड जैसे उत्प्रेरक का उपयोग है, ताकि साम्य अवस्था प्राप्त करने की दर बढ़ाई जा सके। अमोनिया के उत्पादन के लिए प्रवाह-चित्र 7.1 में दर्शाया गया है।

चित्र 7.1-अमोनिया उत्पादन के लिए प्रवाह-चित्र
गुण
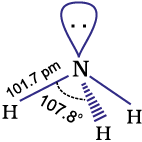
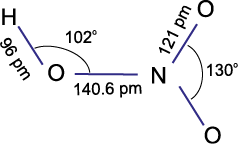
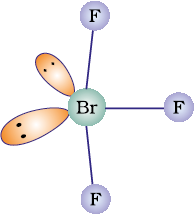
अमोनिया एक तीखी गंधवाली, रंगहीन गैस है। इसका हिमांक तथा क्वथनांक क्रमश:198.4 K तथा 239.7 K है। जल की भाँति ही द्रव और ठोस अवस्थाओं में यह हाइड्रोजन बंधों द्वारा बंधित होती है जिसके कारण इसके गलनांक व क्वथनांक के मान इसके अणु द्रव्यमान के आधार पर अपेक्षित मानों की अपेक्षा अधिक होते हैं। अमोनिया का अणु त्रिकोणीय पिरैमिडी है जिसके शीर्ष परनाइट्रोजन परमाणु है। दर्शाए गए चित्र के अनुसार इसमें तीन आबंध युगल तथा एक एकाकी युगल है।
अमोनिया गैस जल में अत्यधिक विलेय है। OH- आयन बनने के कारण इसका जलीय विलयन दुर्बलत: क्षारीय है।
NH3(g) + H2O(l)  NH+4 (aq) + OH- (aq)
NH+4 (aq) + OH- (aq)
यह अम्लों के साथ अमोनियम लवण बनाती है उदाहरणार्थ NH4Cl, (NH4)2SO4 इत्यादि। एक दुर्बल क्षार के रूप में यह कई धातुओं के लवणों के विलयनों से उनके हाइड्राक्साइडों (कुछ धातुओं के जलीय अॉक्साइडों) को अवक्षेपित करती है। जैसे—
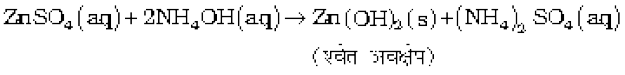
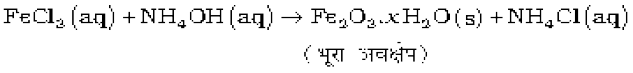
अमोनिया अणु के नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युगल की उपस्थिति इसे लूइस क्षारक बनाती है। यह इलेक्ट्रॉन एकाकी युगल दान करके धातु आयनों के साथ बंध बनाता है। एेसे संकुल यौगिकों के बनने का Cu2+ तथा Ag+ जैसे धातु आयनों को पहचानने में अनुप्रयोग है-
Cu2+ (aq) + 4 NH3(aq) [Cu(NH3)4]2+(aq)
(नीला) (गहरा नीला)
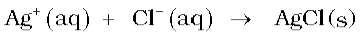
(रंगहीन) (श्वेत अवक्षेप)
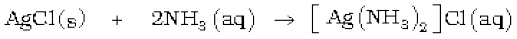
(श्वेत अवक्षेप) (रंगहीन)
उपयोग
अमोनिया कई नाइट्रोजनी उर्वरकों के उत्पादन (अमोनियम नाइट्रेट, यूरिया, अमोनियम फ़ॉस्प़ेηट तथा अमोनियम सल्फेट) तथा कुछ अकार्बनिक यौगिकों के उत्पादन में उपयोग किया जाता है। जिनमें से नाइट्रिक अम्ल एक प्रमुख है। द्रव अमोनिया प्रशीतक के रूप में भी उपयोग में आती है।
उदाहरण 7.4
NH3 लूइस क्षारक की तरह व्यवहार क्यों करती है?
हल
अमोनिया में नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युगल प्रदान करने के लिए उपलब्ध है इसलिए यह लूइस क्षारक की तरह व्यवहार करती है।
पाठ्यनिहित प्रश्न
7.4 अमोनिया की लब्धि को बढ़ाने के लिए आवश्यक स्थितियों का वर्णन कीजिए।
7.5 Cu2+ विलयन के साथ अमोनिया कैसे क्रिया करती है?
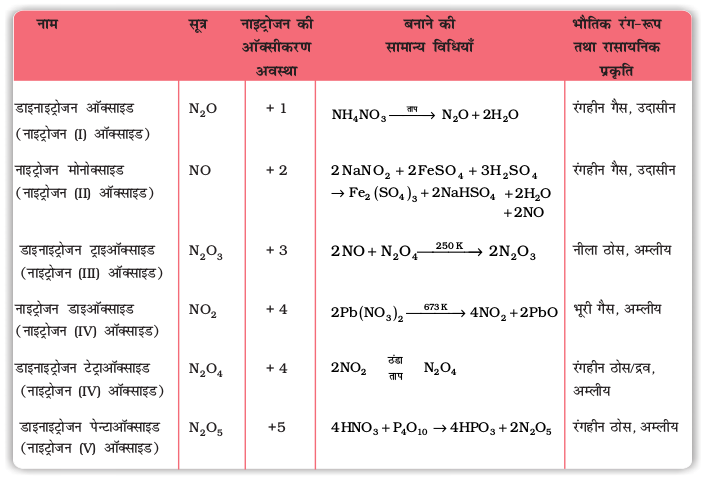
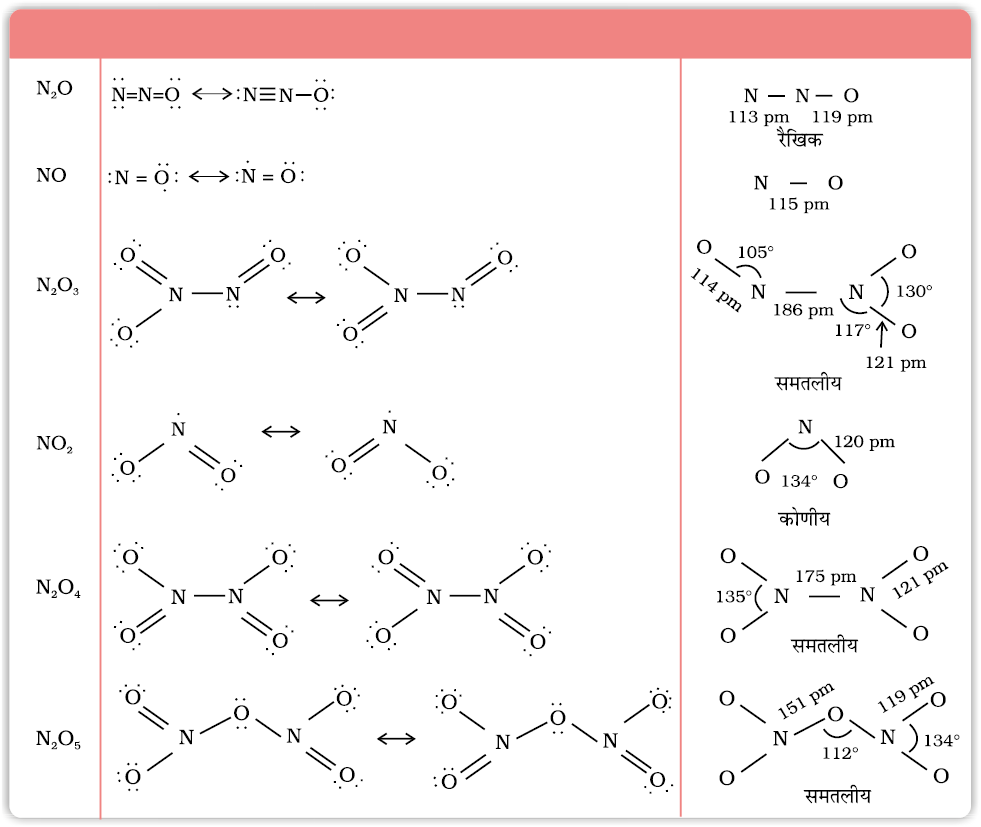
7-4 नाइट्रोजन के ऑक्साइड
सारणी 7.3- नाइट्रोजन के अॉक्साइड
7-5 नाइट्रिक अम्ल
विरचन
प्रयोगशाला में, नाइट्रिक अम्ल, काँच के रिटॉर्ट (भभका) में सांद्र H2SO4 तथा NaNO2 अथवा KNO3 को गर्म करके प्राप्त किया जाता है।
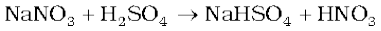
व्यापक स्तर पर यह मुख्यत: ओस्टवाल्ड प्रक्रम द्वारा बनाया जाता है।
यह विधि अमोनिया (NH3) के वायुमंडलीय अॉक्सीजन द्वारा उत्प्रेरकीय अॉक्सीकरण पर आधारित है।
सारणी 7.4- नाइट्रोजन के अॉक्साइडों की संरचना
उदाहरण 7.5
NO2 द्वितयीकृत क्यों होती है?
हल
NO2 में संयोजकता इलेक्ट्रॉन विषम संख्या में होते हैं। यह एक प्रारूपी विषम इलेक्ट्रॉन अणु की तरह व्यवहार करती है। द्वितयन होने पर यह स्थायी N2O4 अणु में परिवर्तित हो जाती है; जिसमें इलेक्ट्रॉनों की संख्या सम है।

इस प्रकार निर्मित नाइट्रिक अॉक्साइड अॉक्सीजन के साथ संयोग कर NO2 देती है।
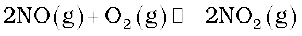
निर्मित नाइट्रोजन डाइअॉक्साइड पानी में घुलकर HNO3 देती है।
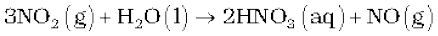
निर्मित NO पुन: चक्रित की जाती है तथा जलीय HNO3 को आसवन द्वारा लगभग 68% द्रव्यमान तक सांद्रित किया जा सकता है। सांद्र H2SO4 द्वारा निर्जलीकरण से इसे 98% तक सांद्रित किया जा सकता है।
यह एक रंगहीन द्रव है (हिमांक 231.4 K तथा क्वथनांक 355.6 K)। प्रयोगशाला कोटि के नाइट्रिक अम्ल में HNO3 68% द्रव्यमान होता है तथा इसका विशिष्ट घनत्व 1.504 होता है। गैसीय अवस्था में, HNO3 की संरचना समतलीय है जैसा कि चित्र में दिखाया गया है।
जलीय विलयन में नाइट्रिक अम्ल प्रबल अम्ल की तरह व्यवहार करता है तथा हाइड्रोनियम और नाइट्रेट आयन देता है।
HNO3(aq) + H2O(l) → H3O+(aq) + NO3- (aq)
सांद्र नाइट्रिक अम्ल प्रबल अॉक्सीकारक है तथा सोना एवं प्लेटिनम जैसी उत्कृष्ट धातुओं को छोड़कर अधिकतर धातुओं के साथ अभिक्रिया करता है। अॉक्सीकरण के उत्पाद अम्ल की सांद्रता, ताप तथा अॉक्सीकृत होने वाले पदार्थ की प्रकृति पर निर्भर करते हैं।
3Cu + 8 HNO3 (तनु) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 (सांद्र) → Cu(NO3)2 + 2NO2 + 2 H2O
जिंक तनु नाइट्रिक अम्ल के साथ क्रिया करने पर N2O तथा सांद्र अम्ल के साथ NO2 देता है।
4Zn + 10HNO3 (तनु) → 4 Zn(NO3)2 + 5H2O + N2O
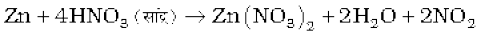
कुछ धातुएं (जैसे Cr, Al) सांद्र नाइट्रिक अम्ल में विलेय नहीं होती। क्योंकि धातु की सतह पर अॉक्साइड की पतली अक्रिय परत बन जाती है। सांद्र अधातुओं एवं उनके यौगिकों को भी आक्सीकृत करता है। आयोडीन आयोडिक अम्ल में, कार्बन कार्बन डाइआक्साइड में, सल्फर सल्फ्यूरिक अम्ल में तथा फ़ॉस्फ़ोरस फ़ॉस्फ़ोरिक अम्ल में आक्सीकृत होता है।
I2 + 10HNO3 → 2HIO3 + 10 NO2 + 4H2O
C + 4HNO3 → CO2 + 2H2O + 4NO2
S8 + 48HNO3 → 8H2SO4 + 48NO2 + 12H2O
P4 + 20HNO3 → 4H3PO4 + 20 NO2 + 4H2O
भूरी-वलय परीक्षण
नाइट्रेटों के लिए सुपरिचित भूरा वलय परीक्षण Fe2+ आयनों की नाइट्रेटों को नाइट्रिक अॉक्साइड में अपचित करने की क्षमता पर निर्भर करता है, जो Fe2+ से अभिक्रिया कर भूरे रंग का संकुल बनाता है। यह परीक्षण सामान्यतया नाइट्रेट आयन युक्त जलीय विलयन में तनु फेरस सल्फेट विलयन मिलाने के पश्चात सावधानीपूर्वक परखनली की दीवार के सहारे सांद्र सल्फ्यूरिक अम्ल मिलाकर किया जाता है। विलयन तथा सल्फ्यूरिक अम्ल अंतरापृष्ठ पर एक भूरी वलय का बनना विलयन में नाइट्रेट आयन की उपस्थिति का संकेत करता है।
NO3- + 3Fe2+ + 4H+ → NO + 3Fe3+ + H2O
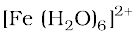 + NO → [Fe(H2O)5(NO)]2+ + H2O
+ NO → [Fe(H2O)5(NO)]2+ + H2O
(भूरा)
उपयोग
नाइट्रिक अम्ल का प्रमुख उपयोग उर्वरकों के लिए अमोनियम नाइट्रेट बनाने तथा विस्फोटक एवं पायरों तकनीक में प्रयुक्त होने वाले अन्य नाइट्रेटों के उत्पादन में है। यह नाइट्रोग्लिसरीन, ट्राइनाइट्रोटालुइन तथा अन्य कार्बनिक नाइट्रो यौगिकों के विरचन में भी प्रयुक्त होता है। इसके अन्य प्रमुख उपयोग स्टेनलैस स्टील के अम्लोपचार, धातुओं के निक्षारण और रॉकेट ईंधनों में अॉक्सीकारक के रूप में हैं।
7-6 फ़ॉस्फ़ोरस के अपररूप
श्वेत फ़ॉस्फ़ोरस
एक पारभासी श्वेतमोमी ठोस है। यह विषैला, जल में अविलेय परंतु कार्बन डाइसल्फाइड में विलेय होता है तथा अँधेरे में दीप्त होता है (रसोसंदीप्ति)।
अक्रिय वायुमंडल में यह उबलते हुए NaOH विलयन में घुलकर PH3 देता है।
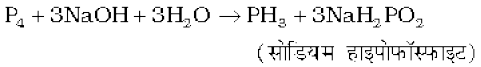
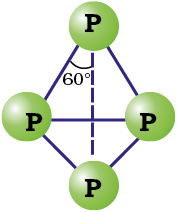
P4 अणुओं में कोणीय तनाव के कारण, जिनमें कोण केवल 60º का है, श्वेत फ़ॉस्फ़ोरस कम स्थायी है तथा सामान्य परिस्थितियों में दूसरी ठोस प्रावस्थाओं से अधिक क्रियाशील होता है। यह वायु में तेजी से आग पकड़कर P4O10 के सघन श्वेत धूम देता है
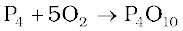
यह विविक्त चतुष्फलकीय P4 अणुओं से बना होता है जैसा चित्र 7.2 में दिखाया गया है।
लाल फ़ॉस्फ़ोरस
श्वेत फ़ॉस्फ़ोेरस को जब अक्रिय वातावरण में 573K ताप पर कई दिनों तक गर्म करने पर प्राप्त होता है। जब लाल फ़ॉस्फ़ोेरस को उच्च दाब पर गर्म किया जाता है तो काले फ़ॉस्फ़ोेरस के प्रावस्थाओं की श्रेणियाँ प्राप्त होती हैं। लाल फ़ॉस्फ़ोेरस लोहे-जैसी धूसर चमक वाला होता है। यह गन्धहीन, अविषैला तथा जल एवं कार्बन डाइसल्फाइड में अविलेय है। रासायनिक रूप से लाल फ़ॉस्फ़ोेरस, श्वेत फ़ॉस्फ़ोेरस की तुलना में बहुत कम क्रियाशील होता है। यह अँधेरे में दीप्त नहीं होता। यह बहुलकी होता है जिसमें P4 चतुष्फलक शृंखला के रूप में एक-दूसरे से जुड़े रहते हैं जैसा चित्र 7.3 में दिखाया गया है।
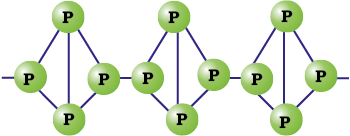
चित्र 7.3- लाल फ़ॉस्फ़ोरस
काला फ़ॉस्फ़ोरस
काले फ़ॉस्फ़ोेरस के दो रूप होते हैं, α-काला फ़ॉस्फ़ोेरस तथा β-काला फ़ॉस्फ़ोेरस। लाल फ़ॉस्फ़ोेरस को 803 K पर, बन्द नलिका में गर्म करने पर α-काला फ़ॉस्फ़ोेरस फ़ॉस्फ़ोेरस बनता है। इसे वायु में उर्ध्वपातित किया जा सकता है तथा इसके क्रिस्टल अपारदर्शी, एकनताक्ष या त्रिसमनताक्ष होते हैं। यह वायु में आक्सीकृत नहीं होता। β−काला फ़ॉस्फ़ोेरस श्वेत फ़ॉस्फ़ोेरस को 473 K ताप तथा उच्च दाब पर गर्म करके बनाया जाता है। यह वायु में 673 K तक नहीं जलता।
7.7 फ़ॉस्फ़ीन
विरचन
फ़ास्फ़ीन, कैल्सियम फ़ास्फ़ाइड की जल या तनु HCl से अभिक्रिया द्वारा बनाई जाती है।
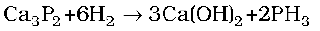
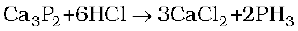
प्रयोगशाला में, यह श्वेत फ़ॉस्फ़ोरस को CO2 का अक्रिय वातावरण में सांद्र कॉस्टिक सोडा विलयन के साथ गर्म करके बनाई जाती है।
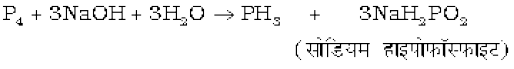
शुद्ध अवस्था में यह अज्वलनशील होती है लेकिन P2H4 या P4 के वाष्पों की उपस्थिति के कारण यह ज्वलनशील हो जाती है। अशुद्धियों से शुद्ध करने के लिए, इसे HI में अवशोषित किया जाता है। जिससे फास्फोनियम आयोडाइड (PH4I) बन जाए जो KOH से अभिक्रिया कराने पर फॉस्फीन दे देता है।
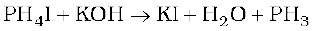
गुण
यह एक रंगहीन, सड़ी मछली के समान गंध वाली अत्यंत विषैली गैस है। यह HNO3, Cl2 तथा Br2 जैसे आक्सीकारकों के वाष्पों की अतिसूक्ष्म मात्रा के संपर्क में आने पर विस्फोटित होती है।
यह जल में आंशिक रूप से विलेय है। PH3 का जलीय विलयन प्रकाश की उपस्थिति में विघटित होकर लाल फ़ॉस्फ़ोेरस तथा H2 देता है। कॉपर सल्फेट या मरक्यूरिक क्लोराइड विलयन द्वारा अवशोषित करने पर संगत फॉस्फाइड प्राप्त होते हैं।
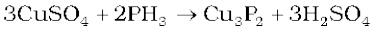

फ़ॉस्फ़ोेरस अमोनिया की तरह दुर्बल क्षारकीय है तथा अम्लों के साथ फॉस्फोनियम यौगिक देती है, उदाहरणार्थ-
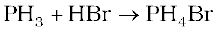
उपयोग
फ़स्फ़न का स्वत: स्फूर्त दहन का तकनीकी रूप से उपयोग होम्ज सिग्नलों में किया जाता है। कैल्सियम कार्बाइड तथा कैल्सियम फ़ास्फ़ाइड के पात्रों को छेदित करके समुद्र में फेंक दिया जाता है जिससे गैसें उत्पन्न होती हैं, जलती हैं और संकेत के रूप में कार्य करती हैं। यह धूमपट में भी प्रयुक्त होती हैं।
उदाहरण 7.6
किस तरह से यह सिद्ध कर सकते हैं कि PH3 की प्रकृति क्षारकीय है?
PH3 HI जैसे अम्लों से क्रिया करता है जिससे PH4I बनता है जो यह दर्शाता है कि इसकी प्रकृति क्षारकीय है।
PH3 + HI → PH4I
फ़ॉस्फ़ोेरस परमाणु पर एकाकी युगल की उपस्थिति के कारण PH3 उपरोक्त अभिक्रिया में लूइस छारक की तरह कार्य कर रही है।
पाठ्यनिहित प्रश्न
7.7 (a) PH3 से PH4+ का आबंध कोण अधिक है। क्यों?
(b) जब PH3 अम्ल से अभिक्रिया करता है तो क्या बनता है?
7.8 क्या होता है जब श्वेत फ़ॉस्फ़ोेरस को CO2 के अक्रिय वातावरण में सांद्र कॉस्टिक सोडा विलयन के साथ गर्म करते हैं?
7-8 फ़ॉस्फ़ोरस के हैलाइड
फ़ॉस्फ़ोेरस दो प्रकार के हैलाइड बनाता है-
PX3 (X= F, Cl, Br, I) तथा PX5 (X=F, Cl, Br)।
7.8.1 फ़ॉस्फ़ोेरस ट्राईक्लोराइड
विरचन
यह श्वेत फ़ॉस्फ़ोेरस पर शुष्क क्लोरीन प्रवाहित करने से प्राप्त होता है
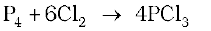
यह थायोनिल क्लोराइड की अभिक्रिया श्वेत फ़ॉस्फ़ोेरस के साथ करने से भी प्राप्त किया जाता है।
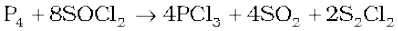
गुण
यह रंगहीन तैलीय द्रव है तथा नमी की उपस्थिति में जल अपघटित हो जाता है।
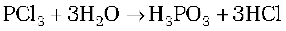
यह CH3COOH, C2H5OH जैसे -OH समूह युक्त कार्बनिक यौगिकों से क्रिया करता है
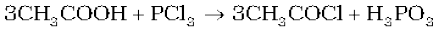
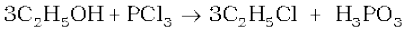

इसकी आकृति पिरैमिडी है जैसा यहाँ चित्र में दिखाया है जिसमें फ़ॉस्फ़ोेरस SP3 संकरित है।
7.8.2 फ़ॉस्फ़ोेरस फ़ॉस्फ़ोेरस पेन्टाक्लोराइड
विरचन
फ़ॉस्फ़ोेरस पेन्टाक्लोराइड श्वेत फॉस्फोरस की शुष्क क्लोरीन के आधिक्य में अभिक्रिया से बनता है।
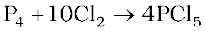
इसे फ़ॉस्फ़ोेरस पर SO2Cl2 की क्रिया द्वारा भी बनाया जा सकता है।

गुण
PCl5 एक हलका पीत-श्वेत पाउडर है तथा नम वायु में यह जल अपघटित होकर POCl3 देता है और अंतत: फॉस्फोरिक अम्ल में परिवर्तित हो जाता है।
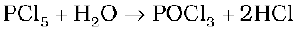
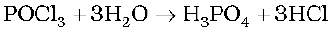
गर्म करने पर यह उर्ध्वपातित होता है परन्तु अधिक गर्म करने से वियोजित हो जाता है।
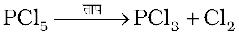
यह -OH समूह युक्त कार्बनिक यौगिकों के साथ अभिक्रिया करके उन्हें क्लोरो व्युत्पन्नों में परिवर्तित कर देता है।
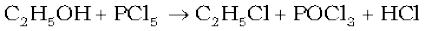

सूक्ष्म विभाजित धातुएं PCl5 के साथ गरम करने पर संगत क्लोराइड बनाती हैं।
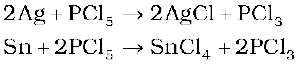
इसका उपयोग कुछ कार्बनिक यौगिकों के संश्लेषण में किया जाता है उदाहरणार्थ- C2H5Cl, CH3COCl
द्रव तथा गैसीय प्रावस्थाओं में इसकी संरचना त्रिसमनताक्ष द्विपिरैमिडी होती है जैसा यहाँ दर्शाया गया है।
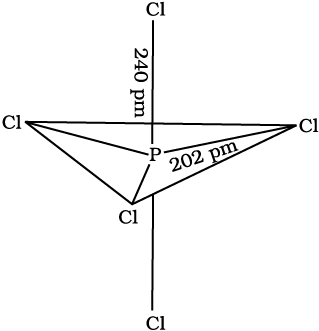
तीनों निरक्षीय (equatorial) P-Cl आबंध समतुल्य हैं।
जबकि दो अक्षीय आबंध (axial) निरक्षीय बंधों से बड़े हैं। इसका मुख्य कारण यह है कि निरक्षीय आबंध युगलों की तुलना में अक्षीय (axial) आबंध युगलों पर अधिक प्रतिकर्षण होता है।
उदाहरण 7.7
PCl3 नमी में धूम क्यों देता है?
हल
नमी की उपस्थिति में PCl3 जल-अपघटित होकर HCl के धूम देता है।
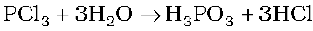
उदाहरण 7.8
क्या PCl5 के पाँचों आबंध समतुल्य हैं? अपने उत्तर की पुष्टि कीजिए।
हल
PCl3 की त्रिकोणीय द्विपिरैमिडी संरचना है। इनके तीनों निरक्षीय (equatorial) P-Cl आबंध समान हैं। परंतु दो अक्षीय आबंध भिन्न हैं तथा निरक्षीय आबंधों से बड़े हैं।
पाठ्यनिहित प्रश्न
7.9 क्या होता है जब PCl5 को गर्म करते हैं?
7.10 PCl5 की जल से अभिक्रिया का संतुलित समीकरण लिखिए।
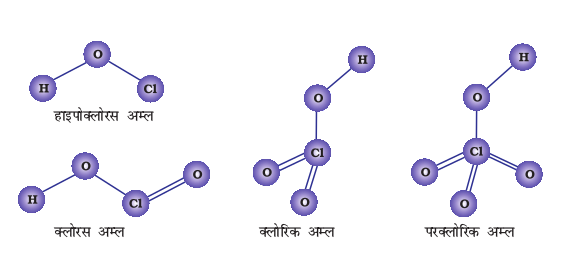
7-9 फ़ॉस्फ़ोरस के ऑक्सोअम्ल
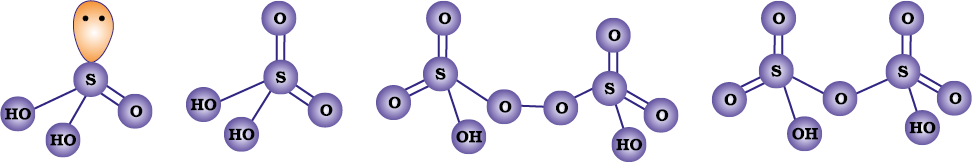
फ़ॉस्फ़ोरस अनेक अॉक्सो अम्ल बनाता है। फ़ॉस्फ़ोरस के महत्वपूर्ण अॉक्सोअम्ल सूत्र, बनाने की विधि तथा उनकी संरचनाओं में उपस्थित कुछ अभिलक्षणिक आबंधों को सारणी 7.5 में दिया गया है। अॉक्सोअम्लों के संघटन H2O अणु अथवा O-परमाणु के ग्रहण करने या त्यागने की दृष्टि से परस्पर संबंधित होते हैं। कुछ महत्वपूर्ण अॉक्सोअम्लों की संरचनाएं चित्र 7.4 में दी गई हैं -
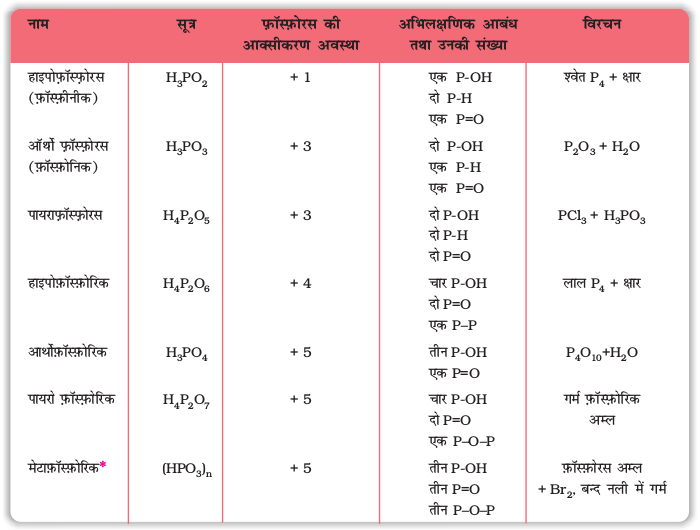
* केवल बहुलकी रूप में अस्तित्व (HPO3)3 के अभिलक्षणिक आबंध सारणी में दिए गए हैं।
अॉक्सोअम्लों में फ़ॉस्फ़ोरस अन्य परमाणुओं द्वारा चतुष्फलकीय रूप से घिरा रहता है। सभी अम्लों में कम-से-कम एक P=O आबंध तथा एक P-OH आबंध होता है। उन आक्सोअम्लों में, जिनमें फ़ॉस्फ़ोरसकी निम्न आक्सीकरण अवस्था (+5 से कम) होती है, P = O तथा P-OH आबंधों के अतिरिक्त या तोP-P (जैसे H2P2O6 में) या P-H (जैसे H3PO2 में) आबंध होते हैं, परंतु दोनों नहीं। फ़ॉस्फ़ोरस की +3अॉक्सीकरण अवस्था वाले इन अम्लों की प्रवृत्ति, उच्च या निम्न अॉक्सीकरण अवस्थाओं में असमानुपातित होने वाली होती है। उदाहरण के लिए आर्थोफ़ॉस्फ़ोरस अम्ल (या फ़ॉस्फ़ोरसअम्ल) गर्म करने पर असमानुपातित होकर आर्थोफ़ॉस्फ़ोरसरिक अम्ल (या फ़ॉस्फ़ोरिकअम्ल) तथा फ़ॉस्फ़ीनदेता है।
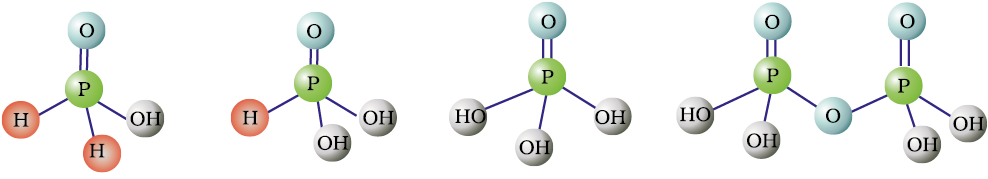
H3PO2 H3PO3 H3PO4 H4P2O7
हाइपोफास्फोरस अम्ल आर्थोफॉस्फोरस अम्ल आर्थोफॉस्फोरिक अम्ल पायरोफॉस्फोरिक अम्ल
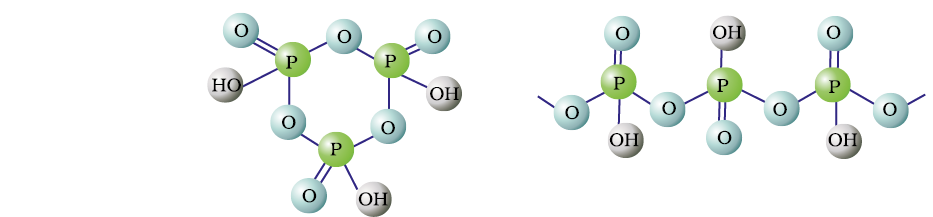
(HPO3)3 (HPO3)3
साइक्लोट्राइमेटाफ़ॉस्फ़रिक अम्ल पॉलीमेटाफॉस्फोरिक अम्ल
चित्र 7.4- फ़ॉस्फ़ोरस के कुछ प्रमुख आक्सोअम्लों की संरचनाएँ
वह अम्ल जिनमें P-H आबंध होते हैं, प्रबल अपचायक गुण वाले होते हैं। इसीलिए हाइपो फ़ॉस्फ़ोरस अम्ल में दो P-H आबंध होने के कारण यह एक अच्छा अपचायक है तथा ये उदाहरण के लिए AgNO3 को धात्विक चाँदी में अपचित कर देता है।
4 AgNO3 + 2H2O + H3PO2 → 4Ag + 4HNO3 + H3PO4
ये P-H आबंध आयनीकृत होकर H+ नहीं देते तथा क्षारकता में कोई भूमिका नहीं निभाते। केवल वे ही हाइड्रोजन परमाणु आयनन योग्य होते हैं। जो और क्षारकता उत्पन्न करते हैं। P-OH आबंध में आकॅसीजन के साथ जुड़े रहते हैं। इसलिए H3PO3 तथा H3PO4 क्रमश: द्विक्षारकीय और त्रिक्षारकीय हैं; क्याेंकि H3PO3 की संरचना में दो P-OH आबंध तथा H3PO4 तीन आबंध होते हैं।
उदाहरण 7.9
आप H3PO2 की संरचना के आधार पर इसका अपचायक व्यवहार कैसे स्पष्ट कर सकते हैं?
हल
H3PO2 में, दो H परमाणु P परमाणु से सीधे आबंधित होते हैं जो इस अम्ल को अपचायक गुण देते हैं।
पाठ्यनिहित प्रश्न
7.11 H3PO4 की क्षारकता क्या है?
7.12 क्या होता है जब H3PO3 को गरम करते हैं?
7-10 वर्ग 16 के तत्व
आवर्त सारणी के वर्ग 16 के सदस्य हैं - अॉक्सीजन, सल्फर, सिलीनियम, टेल्यूरियम, पोलोनियम तथा लिवरमोरियम निहित हैं। यह कभी-कभी केल्कोजौन समूह की तरह जाना जाता है। यह नाम, ब्रास के लिए ग्रीक भाषा के शब्द से व्युत्पन्न हुआ है तथा सल्फर एवं इसके समवंशियों का कॉपर के साथ संगुणन होने की ओर इंगित करता है। अधिकांश कॉपर खनिजों में या तो अॉक्सीजन अथवा सल्फर और बहुधा वर्ग के अन्य सदस्य पाए जाते हैं।
7.10.1 उपलब्धता
पृथ्वी पर सभी तत्वों में से अॉक्सीजन सबसे अधिक प्रचुरता में पाई जाती है। भूपर्पटी के द्रव्यमान का लगभग 46.6% अॉक्सीजन के द्वारा निर्मित है। शुष्क वायु में आयतन के अनुसार 20.946% अॉक्सीजन होती है।
हालाँकि भूपर्पटी में सल्फर की उपलब्धता केवल 0.03 से 0.1% है, संयुक्त अवस्था में सल्फर मुख्यतया सल्फेटों के रूप में जिप्सम CaSO4.2H2O, एपसम लवण MgSO4.7H2O, बेराइट BaSO4 तथा सल्फाइडों के रूप में गेलेना PbS, यशद ब्लैंड ZnS, कॉपर पाइरॉइट CuFeS2 में पाई जाती है। सल्फर की सूक्ष्म मात्रा ज्वालामुखी में हाइड्रोजन सल्फाइड के रूप में पाई जाती है। कार्बनिक पदार्थों; जैसे— अंडे, प्रोटीन, लहसुन, प्याज़, सरसों, बाल तथा ऊन में सल्फर होती है।
सिलीनियम तथा टेल्यूरियम सल्फाइड अयस्कों में धातु सेलेनाइडों तथा टेलुराइडों के रूप में पाए जाते हैं। पोलोनियम प्रकृति में थोरियम तथा यूरेनियम खनिजों के विघटन उत्पाद के रूप में पाया जाता है। लिवरमोरियम एक संश्लेषित रेडियोसक्रिय तत्व है। इसका संकेत Lv, परमाणु संख्या 116, परमाण्विक द्रव्यमान 292 gmol-1 तथा इलेक्ट्रॉनिक विन्यास [Rn] 5f14 6d10 7s2 7p4 है। Lv को केवल अल्प मात्रा में ही बनाया जा सका है तथा इसकी अर्धायु भी अति अल्प है (सेकेंड का भी छोटा अंश)। इस कारण से इसके गुणों का अध्ययन नहीं हो सका है।
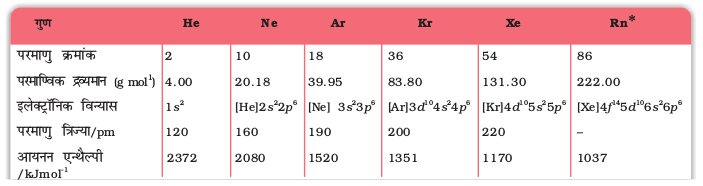
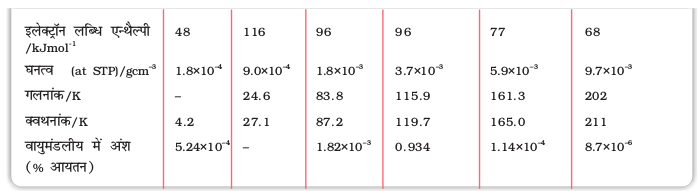
यहाँ लिवरमोरियम को छोड़कर वर्ग 16 के अन्य तत्वों के महत्वपूर्ण परमाण्विक एवं भौतिक गुण तथा इलेक्ट्रॉनिक विन्यास सारणी 7.6 में दिए गए हैं। कुछ परमाण्विक भौतिक तथा रासायनिक गुणों और उनकी प्रवृत्तियों की विवेचना नीचे की गई है।
सारणी 7.6- वर्ग 16 के तत्वों के कुछ भौतिक गुण
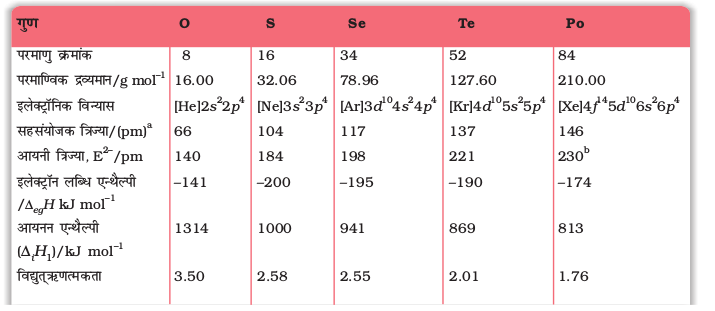

a एकल बंध b लगभग मान c गलनांक पर d विषमलंबाक्ष गंधक e षट्कोणीय धूसर f एकनताक्ष रूप,673 K.
* अॉक्सीजन, आकॅसीजन फ्लुओराइडों, OF2 तथा O2F2 में क्रमश: +2 तथा +1 अॉक्सीकरण अवस्था दर्शाती है।
7.10.2 इलेक्ट्रॉनिक विन्यास
वर्ग 16 के तत्वों के बाह्य कोशों में छ: इलेक्ट्रॉन होते हैं तथा सामान्य इलेक्ट्रॉनिक विन्यास ns2np4 होता है।
7.10.3 परमाणु तथा आयनी त्रिज्या
वर्ग में ऊपर से नीचे की ओर बढ़ने पर कोशों की संख्या में वृद्धि के कारण आयनी तथा परमाणु त्रिज्याओं के मानों में वृद्धि होती है। तथापि अॉक्सीजन परमाणु का आकार अपवाद स्वरूप छोटा होता है।
7.10.4 आयनन एन्थैल्पी
वर्ग में नीचे की ओर बढ़ने पर आयनन एन्थैल्पी में कमी होती है। इसका कारण आकार में वृद्धि है। तथापि इस वर्ग के तत्वों की आयनन एन्थैल्पी का मान वर्ग 15 के संगत आवतों के तत्वों से निम्न होता है। इसका कारण यह है कि वर्ग 15 के तत्वों में अतिरिक्त स्थायित्व प्राप्त अर्धभरित इलेक्ट्रॉनिक विन्यास के p-कक्षक उपस्थित होते हैं।
7.10.5 इलेक्ट्रॉन लब्धि एन्थैल्पी
अॉक्सीजन परमाणु की सुसंबद्ध प्रकृति के कारण इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी सल्फर की अपेक्षा कम ऋणात्मक होती है। तथापि सल्फर से पोलिनियम तक पुन: इसके मान कम ऋणात्मक होते जाते हैं।
7.10.6 विद्युत्ऋणात्मकता
फ्लुओरीन के बाद, अॉक्सीजन की विद्युत्ऋणात्मकता का मान, सब तत्वों से उच्चतम होता है। वर्ग में परमाणु क्रमांक में वृद्धि के साथ विद्युत्ऋणात्मकता में कमी होती जाती है। इससे यह प्रदर्शित होता है कि अॉक्सीजन से पोलोनियम तक धात्विक लक्षणों में वृद्धि होती है।
उदाहरण 7.10
वर्ग 15 के संगत आवर्तों के तत्वों की तुलना में वर्ग 16 के तत्वों की प्रथम आयनन एन्थैल्पी का मान सामान्यतया कम होता है, क्यों?
हल
वर्ग 15 के तत्वों में अतिरिक्त स्थायित्व प्राप्त अर्धभरित इलेक्ट्रॉनिक विन्यास के p-कक्षक होते हैं। अत: वर्ग 16 के तत्वों की तुलना में इनमें से इलेक्ट्रॉन को निकालने में बहुत अधिक मात्रा में ऊर्जा की आवश्यकता होती है।
7.10.7 भौतिक गुण
वर्ग 16 के तत्वों के कुछ भौतिक गुण सारणी 7.6 में दिए गए हैं। अॉक्सीजन तथा सल्फर अधातु, सिलीनियम तथा टेल्यूरियम उपधातु हैं जबकि पोलोनियम एक धातु है। पोलोनियम रेडियोधर्मी होता है तथा अल्प आयु है (अर्धायु 13.8 दिन)। सभी तत्व अपररूपता प्रदर्शित करते हैं। वर्ग में नीचे की ओर बढ़ने पर परमाणु क्रमांक में वृद्धि के साथ गलनांक तथा क्वथनांक में वृद्धि होती है। अॉक्सीजन तथा सल्फर के गलनांक और क्वथनांक के मध्य बहुत ज़्यादा अंतर को उनकी परमाणुकता के आधार पर समझाया जा सकता है। अॉक्सीजन द्विपरमाणुक अणु (O2) के रूप में विद्यमान होता है जबकि सल्फर बहुपरमाणुक अणु (S8) के रूप में विद्यमान होता है।
7.10.8 रासायनिक गुण
अॉक्सीकरण अवस्थाएं तथा रासायनिक क्रियाशीलता में प्रवृत्तियाँ
वर्ग 16 के तत्व अनेक अॉक्सीकरण अवस्थाएं (सारणी 7.6) प्रदर्शित करते हैं। -2 अॉक्सीकरण अवस्था का स्थायित्व वर्ग में नीचे की ओर घटता है। पोलिनियम कतिपय ही -2 अॉक्सीकरण अवस्था प्रदर्शित करता है। अॉक्सीजन की विद्युत्ऋणात्मकता बहुत उच्च होने के कारण OF2 के उदाहरण को छोड़ कर जिसमें इसकी अॉक्सीकरण अवस्था +2 है। यह केवल -2 ऋणात्मक अॉक्सीकरण अवस्था दर्शाता है। वर्ग के अन्य तत्व +2, +4,+6 अॉक्सीकरण अवस्थाएं दर्शाते हैं, लेकिन +4 तथा +6 अधिक सामान्य हैं। सल्फर सिलीनियम तथा टेल्यूरियम सामान्यतया अॉक्सीजन के साथ यौगिकों में +4 अॉक्सीकरण अवस्था तथा फ्लुओरीन के साथ यौगिकों में +6 अॉक्सीकरण अवस्था दर्शाते हैं। वर्ग में नीचे की ओर बढ़ने पर +6 अॉक्सीकरण अवस्था का स्थायित्व घटता है और +4 अॉक्सीकरण अवस्था का स्थायित्व बढ़ता है (अक्रिय युग्म प्रभाव)। +4 तथा +6 अॉक्सीकरण अवस्थाओं में आबंधन प्राथमिक रूप से सहसंयोजक होता है।
अॉक्सीजन का असामान्य व्यवहार
द्वितीय आवर्त में उपस्थित p-ब्लाक के अन्य सदस्यों की भाँति अॉक्सीजन का असामान्य व्यवहार इसके छोटे आकार तथा उच्च विद्युत्ऋणात्मकता के कारण होता है छोटे आकार तथा उच्च विद्युत्ऋणात्मकता के प्रभावों का एक विशिष्ट उदाहरण जल में प्रबल हाइड्रोजन बंध की उपस्थिति है जो कि H2S में नहीं पाया जाता है।
अॉक्सीजन में d कक्षकों की अनुपस्थिति के कारण इसकी सहसंयोजकता 4 तक सीमित होती है और व्यवहार में 2 से अधिक दुर्लभ है। दूसरी ओर वर्ग के अन्य तत्वों में संयोजकता कोश का विस्तार हो सकता है और सहसंयोजकता 4 से अधिक होती है।
(i) हाइड्रोजन के प्रति क्रियाशीलता
वर्ग 16 के सभी तत्व H2E (E = O, S, Se, Te, Po) प्रकार के हाइड्राइड बनाते हैं। हाइड्राइडों के कुछ गुण सारणी 7.7 में दिए गए हैं। इनका अम्लीय गुण H2O से H2Te तक बढ़ता है। अम्लीय गुण में वृद्धि को वर्ग में नीचे की ओर जाने पर के लिए बंध (H-E) वियोजन एन्थैल्पी में कमी द्वारा समझा जा सकता है। बंध (H-E) वियोजन एन्थैल्पी में वर्ग में नीचे की ओर जाने पर कमी होने के कारण हाइड्राइडों के तापीय स्थायित्व में भी H2O से लेकर H2Po तक कमी होती है। जल के अतिरिक्त सभी हाइड्राइड अपचायक गुण वाले होते हैं तथा यह गुण H2S से लेकर H2Te तक बढ़ता है।
सारणी 7.7- वर्ग 16 के तत्वों के हाइड्राइडों के गुण

aजलीय विलयन, 298 K
(ii) अॉक्सीजन के प्रति क्रियाशीलता
ये सभी तत्व EO2 तथा EO3 प्रकार के अॉक्साइड बनाते हैं जहाँ E = S, Se, Te तथा Po। ओजोन (O3) तथा सल्फर डाइअॉक्साइड (SO2) गैसें हैं जबकि सिलीनियम डाइअॉक्साइड (SeO2) एक ठोस है। डाइअॉक्साइड का अपचायक गुण SO2 से TeO2 तक कम होता जाता है। SO2 एक अपचायक है जबकि TeO2 एक अॉक्सीकारक है। EO2 प्रकार के अॉक्साइडों के अतिरिक्त सल्फर, सिलीनियम तथा टेल्यूरियम EO3 प्रकार के अॉक्साइड (SO3, SeO3, TeO3) भी बनाते हैं। दोनों प्रकार के अॉक्साइड अम्लीय प्रकृति के होते हैं।
(iii) हैलोजन के प्रति क्रियाशीलता
वर्ग 16 के तत्व EX6, EX4 तथा EX2 प्रकार के अनेक हैलाइड बनाते हैं, जहाँ E इस वर्ग की धातु है तथा X एक हैलोजन है, हैलाइडों का स्थायित्व के घटने का क्रम है F>Cl>Br>I। हेक्साहैलाइडों में केवल हेक्साफ्लुओराइड ही स्थायी हैलाइड होते हैं। सभी हेक्साफ्लुओराइड गैसीय प्रकृति के हैं। इनकी संरचना अष्टफलकीय होती है। सल्फर हेक्साफ्लुओराइड, SF6, त्रिविमीय कारणों से असाधारण रूप से स्थायी होता है।
टेट्राफ्लुओराइडों में से SF4 एक गैस, SeF4 द्रव तथा TeF4 एक ठोस है। ये हेक्साफ्लुओराइड sp3d संकरित होते हैं, अत: इनकी संरचना त्रिकोणीय द्विपिरैमिडी होती है जिसमें एक निरक्षीय (equatorial) स्थिति पर एक एकाकी इलेक्ट्रॉन युगल होता है। यह ज्यामिति सी-सॉ (see-saw) ज्यामिति भी कहलाती है।
अॉक्सीजन को छोड़कर सभी तत्व डाइक्लोराइड तथा डाइब्रोमाइड बनाते हैं। यह डाइहेलाइड sp3 संकरण द्वारा बनते हैं तथा चतुष्फलकीय संरचना के होते हैं। सुपरिचित मोनोलाइड द्वितयी (dimer) प्रकृति के हैं जैसे S2F2, S2Cl2, S2Br2, Se2Cl2 तथा Se2Br2 । यह द्वितयी हेलाइड निम्न प्रकार से असमानुपातित होते हैं-
2Se2Cl2 → SeCl4+Se
उदाहरण 7.11
H2S, H2Te की अपेक्षा कम अम्लीय क्यों है?
हल
वर्ग में नीचे की ओर बढ़ने पर बंध (E-H) वियोजन एन्थैल्पी में कमी आने के कारण अम्लीय गुणों में वृद्धि होती है।
पाठ्यनिहित प्रश्न
7.13 सल्फर के महत्वपूर्ण स्रोतों को सूचिबद्ध कीजिए।
7.14 वर्ग 16 के तत्वों के हाइड्राइडों के तापीय स्थायित्व के क्रम को लिखिए।
7.15 H2O एक द्रव तथा H2S गैस क्यों है?
7-11 डाइऑक्सीजन
(iii) हाइड्रोजन पारॉक्साइड आसानी से उत्प्रेरक जैसे सूक्ष्म विभाजित धातुएं तथा मैंगनीज डाइअॉक्साइड द्वारा वियोजित होकर जल तथा डाइअॉक्सीजन देती हैं-
2H2O2(aq) → 2H2O(1) + O2(g)
व्यापक स्तर पर इसे जल या वायु से भी बनाया जा सकता है। जल के वैद्युत अपघटन में हाइड्रोजन कैथोड पर तथा अॉक्सीजन एेनोड पर मुक्त होती है।
औद्योगिक रूप से, डाइअॉक्सीजन वायु से प्राप्त की जाती है। पहले कार्बन डाइअॉक्साइड तथा जल वाष्प को हटाते हैं, तत्पश्चात् बची गैसों को द्रवित करते हैं तथा आंशिक आसवन द्वारा डाइनाइट्रोजन तथा डाइअॉक्सीजन प्राप्त होती हैं।
गुण
डाइअॉक्सीजन एक रंगहीन, गंधहीन गैस है। 293 K ताप पर इसकी 100cm3 जल में विलेयता 3.08cm3 की सीमा तक होती है, जो कि समुद्री तथा जलीय जीवन के लिए पर्याप्त है। यह 90 K पर द्रवीकृत तथा 55 K पर जम जाती है। अॉक्सीजन परमाणु के तीन स्थायी समस्थानिक हैं— 16O, 17O तथा 18 O। इलेक्ट्रॉनों की सम संख्या के होने पर भी आण्विक अॉक्सीजन का अनुचुंबकीय होना विलक्षण है (देखें कक्षा XI रसायन पुस्तक एकक-4)।
डाइअॉक्सीजन, केवल कुछ धातुओं (जैसे Au, Pt) तथा कुछ उत्कृष्ट गैसों को छोड़कर लगभग सभी धातुओं और अधातुओं के साथ सीधी क्रिया करती है। इसका अन्य तत्वों के साथ संयोग प्राय: प्रबल उष्माक्षेपी होता है जो अभिक्रिया जारी रखने में सहायक होता है। हालाँकि अभिक्रिया को प्रारंभ कराने के लिए उच्च बाह्य ताप की आवश्यकता होती है क्योंकि अॉक्सीजन-अॉक्सीजन द्विबंध की आबंध वियोजन एन्थैल्पी उच्च (493.4 kJ mol-1) होती है।
डाइअॉक्सीजन की धातुओं, अधातुओं तथा दूसरे यौगिकों के साथ कुछ अभिक्रियाएं नीचे दी गई हैं-
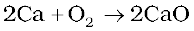
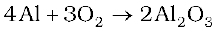
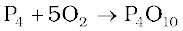
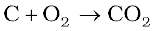
2ZnS + 3O2 → 2ZnO + 2SO2
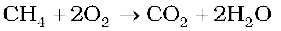
कुछ यौगिकों का उत्प्रेरकी आक्सीकरण होता है।
जैसे- 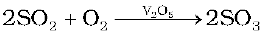

उपयोग
सामान्य श्वसन तथा दहन प्रक्रिया में इसकी महत्ता के अतिरिक्त अॉक्सीजन का उपयोग अॉक्सीएेसीटिलीन वेलि्ंडग में; अनेक धातुओं के उत्पादन में, विशेषकर स्टील के लिए होती है। अधिकतर अस्पतालों अत्यधिक ऊँचाई पर उड़ानों तथा पर्वतारोहरण में अॉक्सीजन के सिलिंडर उपयोग किए जाते हैं। द्रव अॉक्सीजन में हाइड्रैज़ीन जैसे ईंधनों का दहन राकेटों को ऊपर उठाने के लिए विस्मयकारी दबाव प्रदान करता है।
पाठ्यनिहित प्रश्न
7.16 निम्नलिखित में से कौन सा तत्व अॉक्सीजन के साथ सीधे अभिक्रिया नहीं करता?
Zn, Ti, Pt, Fe
7.17 निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए।
(i) C2H4 + O2 → (ii) 4Al + 3 O2 →
7-12 सामान्य ऑक्साइड
अॉक्सीजन का किसी अन्य तत्व के साथ द्विअंगी यौगिक अॉक्साइड कहलाता है। जैसा कि पहले बताया जा चुका है, अॉक्सीजन आवर्त सारणी के अधिकतर तत्वों से अभिक्रिया करके अॉक्साइड बनाती है। एेसे बहुत से उदाहरण हैं जहाँ एक तत्व, दो या अधिक अॉक्साइड बनाता है। अॉक्साइडों की प्रकृति तथा गुणों में अत्यधिक भिन्नता है। अॉक्साइड सामान्य (जैसे MgO, Al2O3) तथा संयुक्त ( Pb3O4, Fe3O4) हो सकते हैं। सामान्य अॉक्साइडों को उनके अम्लीय, क्षारकीय तथा उभयधर्मी गुणों से वर्गीकृत किया जा सकता है। अॉक्साइड जो जल के साथ संयोग कर अम्ल देता है, अम्लीय अॉक्साइड कहलाता है (जैसे, SO2, Cl2O7, CO2, N2O5 ) उदाहरणार्थ SO2 जल के साथ संयोग कर H2SO3 अम्ल देता है।
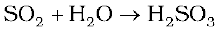
सामान्य नियम के अनुसार केवल अधातु अॉक्साइड अम्लीय होते हैं परंतु कुछ धातुओं के अॉक्साइड जिनमें धातु की अॉक्सीकरण अवस्था उच्च होती है, अम्लीय होते हैं (जैसे- Mn2O7, CrO3, V2O5)।
अॉक्साइड जो जल में क्षारक देते हैं, क्षारकीय अॉक्साइड कहलाते हैं (जैसे Na2O, CaO, BaO )उदाहरणार्थ CaO जल के साथ संयोग कर Ca(OH)2 क्षार देता है।
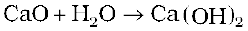
सामान्यतया धात्विक अॉक्साइड क्षारकीय होते हैं। कुछ धात्विक अॉक्साइड द्वैत व्यवहार प्रदर्शित करते हैं। वे अम्लीय तथा क्षारकीय दोनों प्रकार के अॉक्साइडों के गुण प्रदर्शित करते हैं। इन अॉक्साइडों को उभयधर्मी आक्साइड कहते हैं। वे अम्लों तथा क्षारकों, दोनों के साथ अभिक्रिया करते हैं।
उदाहरणार्थ- Al2O3 अम्लों व क्षारकों दोनों के साथ क्रिया करता है।
कुछ एेसे अॉक्साइड हैं जो न तो अम्लीय होते हैं न ही क्षारकीय। ये अॉक्साइड उदासीन अॉक्साइड कहलाते हैं। CO, NO तथा N2O उदासीन अॉक्साइडों के उदाहरण हैं।
7-13 ओज़ोन
ओज़ोन अॉक्सीजन का अपररूप है, यह इतनी क्रियाशील होती है कि समुद्र तल की ऊँचाई पर यह लंबे समय तक वातावरण में नहीं रहती। लगभग 20 km ऊँचाई पर यह सूर्य के प्रकाश की उपस्थिति में वायुमंडलीय अॉक्सीजन से बनती है।
यह ओज़ोन परत भू-पृष्ठ को पराबैंगनी विकिरणों (UV) की अधिक मात्रा से बचाती है।
विरचन
अॉक्सीजन की एक मंद शुष्क धारा निरव वैद्युत विसर्जन से गुज़रे जाने पर ओज़ोन में परिवर्तित (10%) हो जाती है।
3O2 → 2O3 ∆Hθ(298 K) = +142 kJ mol-1
चूँकि अॉक्सीजन से ओज़ोन का विरचन एक उष्माशोषी प्रक्रम है, अत: इसके विरचन में निरव वैद्युत विसर्जन का उपयोग आवश्यक है ताकि इसका विघटन न हो।
यदि ओज़ोन की 10% से अधिक सांद्रता की आवश्यकता हो तो ओज़ोनित्रों की बैटरी का उपयोग किया जा सकता है तथा शुद्ध ओज़ोन (385 K क्वथनांक) को एक द्रव अॉक्सीजन से घिरे पात्र में संघनित किया जा सकता है।
गुण
शुद्ध ओज़ोन एक हल्की पीत-नीली गैस, गहरा नीला द्रव तथा बैंगनी-काला ठोस होती है। ओज़ोन की अभिलक्षणिक गंध होती है और थोड़ी मात्रा में यह हानिकारक नहीं होती। परंतु यदि सांद्रता 100 भाग प्रति मिलियन (100 ppm) से अधिक बढ़ जाए तो श्वास लेने में असुविधा होती है जिससे सिरदर्द व मितली उत्पन्न होती है।
ओज़ोन उष्मागतिकीय रूप से अॉक्सीजन की तुलना में अस्थायी है; क्योंकि इसके अॉक्सीजन में विघटन से उष्मा मुक्त (∆H ऋणात्मक) होती है और एन्ट्रॉपी (∆S धनात्मक) में वृद्धि होती है। दोनों प्रभाव एक-दूसरे को प्रबलित करते हैं जो इसके अॉक्सीजन में परिवर्तन के लिए गिब्ज़ ऊर्जा (∆G) परिवर्तन का अधिक ऋणात्मक मान देते हैं। इसलिए यह वास्तव में आश्चर्यजनक नहीं है कि ओज़ोन की उच्च सांद्रता भयंकर विस्फोटक हो सकती है।
यह बहुत आसानी से नवजात अॉक्सीजन मुक्त करने के कारण (O3 → O2+O) प्रबल अॉक्सीकारक होती है। उदाहरण के लिए यह लेड सल्फाइड को लेड सल्फेट में और आयोडाइड आयनों की आयोडीन में अॉक्सीकृत करती है।
PbS(s) + 4O3(g) → PbSO4(s) + 4O2(g)
2I-(aq) + H2O(l) + O3(g) → 2OH-(aq) + I2(s) + O2(g)
जब ओज़ोन, बोरेट बफ़र (उभय प्रतिरोधी) (pH 9.2) से उभय प्रतिरोधित पोटैशियम आयोडाइड विलयन के आधिक्य से अभिक्रिया करती है तो आयोडीन मुक्त होती है जिसका मानक सोडियम थायोसल्फेट विलयन के साथ अनुमापन किया जा सकता है। यह O3 गैस के आकलन की मात्रात्मक विधि है।
प्रयोग दर्शाते हैं कि नाइट्रोजन के अॉक्साइड (विशेष रूप से नाइट्रोजन मोनोक्साइड) ओज़ोन के साथ अत्यधिक तीव्रता से संयुक्त होते हैं। अत: यह सम्भव है कि सुपरसोनिक जेट विमानों के निकास तंत्र से उत्सर्जित नाइट्रोजन अॉक्साइड ऊपरी वायुमंडल में ओज़ोन परत की सांद्रता में मंद गति से क्षरण कर रही हो।

इस ओज़ोन परत को दूसरा खतरा संभवतया फ्रेअॉनों के उपयोग से है जिनका उपयोग एेरोसोल स्प्रे तथा प्रशीतकों के रूप में किया जाता है।
ओज़ोन अणु में दो अॉक्सीजन-अॉक्सीजन आबंध लंबाइयाँ समान हैं। (128 pm) और जैसा कि अपेक्षित है अणु कोणीय है जिसमें बंधक कोण लगभग 117º है। यह निम्नलिखित दो प्रमुख रूपों का अनुनादी संकर है-
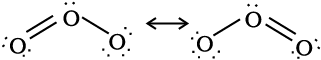
उपयोग
यह एक (जर्मनाशी) कीटाणु विसंक्रासी तथा जल को रोगाणुरहित (निर्जर्म) करने में उपयोग किया जाता है। इसका तेलों, हाथीदाँत, आटे तथा स्टार्च आदि को विरंजित करने में भी उपयोग किया जाता है। पोटैशियम परमैंगनेट के उत्पादन में यह एक अॉक्सीकारक के रूप में कार्य करती है।
पाठ्यनिहित प्रश्न
7.18 O3, एक प्रबल अॉक्सीकारक की तरह क्यों क्रिया करती है?
7.19 O3 का मात्रात्मक आकलन कैसे किया जाता है?
7-14 सल्फ़र के अपररूप
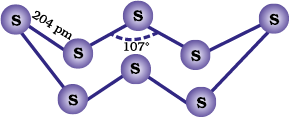
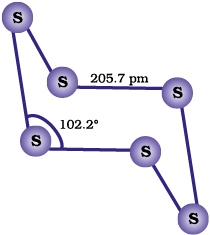
सल्फर के अनेक अपररूप हैं जिसमें पीली विषमलंबाक्ष (α−सल्फर) तथा एकनताक्ष (β−सल्फर) रूप अति महत्वपूर्ण हैं। कक्षताप पर विषमलंबाक्ष सल्फर स्थायी अपररूप है जो 369 K ताप पर गर्म करने से एकनताक्ष (monoclinic) सल्फर में रूपांतरित हो जाती है।
(क)
चित्र 7.5 (क) विषमलंबाक्ष सल्फर में S8 वलय
विषमलंबाक्ष सल्फर (α-सल्फर)
यह अपररूप पीले रंग का होता है जिसका गलनांक 385.8 K तथा विशिष्ट घनत्व 2.06 होता है। विषमलंबाक्ष सल्फर के क्रिस्टल गंधक शलाका के CS2 में विलयन को वाष्पीकृत करके बनाए जाते हैं यह जल में अविलेय है परंतु कुछ मात्रा में बेन्ज़ीन, एल्कोहॉल तथा ईथर में विलेय है। यह CS2 में पूर्णतया विलेय है।
एकनताक्ष सल्फर (β-सल्फर)
इसका गलनांक 393 K है तथा विशिष्ट घनत्व 1.98 है यह CS2 में विलेय है। सल्फर के इस अपररूप को बनाने के लिए विषमलंबाक्ष गंधक को एक तश्तरी में पिघलाकर तथा पपड़ी बनने तक ठंडा करते हैं। इस पपड़ी में दो छिद्र करते हैं। जिनमें से बचा हुआ द्रव निकाल लिया जाता है। पपड़ी को हटाने पर, रंगहीन, सुई के आकार के β-सल्फर के क्रिस्टल बनते हैं।
(ख)
चित्र 7.5 (ख) साइक्लो S6 रूप संरचनाएँ
यह 369 K के ऊपर ताप पर स्थायी है तथा इसके नीचे ताप पर α-सल्फर में रूपांतरित हो जाती है। इसके विपरीत α-सल्फर 369 K से नीचे ताप पर स्थायी है तथा इसके ऊपर ताप पर β-सल्फर में रूपांतरित हो जाती है। 369 Κ पर दोनों रूप स्थायी हैं। यह ताप, संक्रमण ताप कहलाता है। विषमलंबाक्ष तथा एकनताक्ष दोनों ही सल्फर अपररुपों में S8 अणु होते हैं। यह S8 अणु विभिन्न प्रकार सेसंकुलित होकर विभिन्न क्रिस्टलीय संरचनाएँ बनाते हैं। दोनों अपररूपों में S8 वलय प्रकुंचित होती हैं तथा किरीटाकार (crown shaped) होती है। आण्विक विमाएं चित्र 7.5 (क) में प्रदर्शित की गई हैं।
पिछले दो दशकों में सल्फर के अनेक रूपांतरण संश्लेषित किए गए हैं जिनमें 6-20 सल्फर परमाणु युक्त वलय होती हैं। साइक्लो S6 वलय में कुर्सी रूप धारण करती है जिसकी विमाएँ चित्र 7.5 (ख) मेंदर्शायी गई हैं।
उदाहरण 7.12
सल्फर का कौन सा रूप अनुचुंबकीय व्यवहार प्रदर्शित करता है?
हल
वाष्प अवस्था में सल्फर आंशिक रूप में S2 अणु के रूप में पाया जाता है, जिसमें O2 की तरह प्रतिआबंधन आर्बिटल π∗ में अयुग्मित इलेक्ट्रॉन होने के कारण अनुचुंबकत्व का गुण प्रदर्शित होता है।
7-15 सल्फ़र डाइऑक्साइड
विरचन
सल्फर डाइअॉक्साइड सल्फर को वायु या अॉक्सीजन में जलाने पर तब बनती है साथ ही सूक्ष्म रूप में (6-8%) सल्फर ट्राइअॉक्साइड भी बनती है
S(s) + O2(g) → SO2 (g)
प्रयोगशाला में, यह किसी सल्फाइट की सांद्र सल्फ्यूरिक अम्ल के साथ अभिक्रिया करके आसानी से बन जाती है।
SO32-(aq) + 2H+ (aq) → H2O(l) + SO2 (g)
इसका औद्योगिक उत्पादन सल्फाइड अयस्कों के भर्जन से सहउत्पाद के रूप में होता है।
गैस को शुष्क करने के पश्चात् दाब द्वारा द्रवीकृत किया जाता है तथा स्टील के सिलिंडरों में संग्रह कर लिया जाता है।
गुण
सल्फर डाइअॉक्साइड तीखी गंध वाली रंगहीन गैस है तथा जल में अत्यधिक विलेय है। यह कक्ष ताप व दो वायुमंडलीय दाब पर द्रवित होती है तथा 263 K पर उबलती है।
सल्फर डाइअॉक्साइड को जल में प्रवाहित करने पर सल्फ्यूरस अम्ल का विलयन प्राप्त होता है।
यह सोडियम हाइड्रॉक्साइड विलयन के साथ आसानी से अभिक्रिया कर सोडियम सल्फाइट बनाती है जो कि सल्फर डाइअॉक्साइड की और अधिक मात्रा के साथ अभिक्रिया कर सोडियम हाइड्रोजन सल्फाइट बनाता है।
2NaOH + SO2 → Na2SO3 + H2O
Na2SO3 + H2O + SO2 → 2NaHSO3
जल तथा क्षार के साथ अभिक्रिया में सल्फर डाइअॉक्साइड का व्यवहार कार्बन डाइ अॉक्साइड से बहुत मिलता-जुलता है।
सल्फर डाइअॉक्साइड चारकोल की उपस्थिति में क्लोरीन के साथ जो कि उत्प्रेरक की तरह कार्य करता है। अभिक्रिया करने पर सल्फ्यूरिक क्लोराइड SO2Cl देता है। यह अॉक्सीजन द्वारा वेनेडियम(v) अॉक्साइड उत्प्रेरक की उपस्थिति में आक्सीकृत होकर सल्फर ट्राइअॉक्साइड बनाता है।
SO2(g) + CI2 (g) → SO2CI2(l)
नम सल्फर डाइअॉक्साइड अपचायक की तरह व्यवहार करती है। उदाहरणार्थ यह आयरन
(III) आयन को आयरन (II) आयन में परिवर्तित करती है तथा अम्लीय पोटैशियम परमैंगनेट (VII)विलयन को रंगहीन कर देती है। बाद की अभिक्रिया गैस के परीक्षण के लिए सुविधाजनक है।
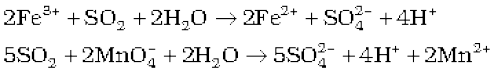
SO2 का अणु कोणीय है यह दो विहित रूपों का अनुनाद संकर है
उपयोग
सल्फर डाइअॉक्साइड का उपयोग होता है- (i) शर्करा एवं पेट्रोलियम के शोधन में (ii) ऊन तथा रेशम के विरंजन में (iii) प्रतिक्लोर, विसंक्रामक तथा परिरक्षक के रूप में। सल्फर डाइअॉक्साइड से सल्फ्यूरिक अम्ल, सोडियम हाइड्रोजनसल्फाइट तथा कैल्सियम हाइड्रोजन सल्फाइट (औद्योगिक रसायन) का उत्पादन होता है। द्रव SO2 अनेक कार्बनिक तथा अकार्बनिक रसायनों के लिए विलायक के रूप में प्रयुक्त होती है।
पाठ्यनिहित प्रश्न
7.20 तब क्या होता है जब सल्फर डाइअॉक्साइड को Fe(III) लवण के जलीय विलयन में से प्रवाहित करते हैं?
7.21 दो S-O आबंधों की प्रकृति पर टिप्पणी कीजिए जो SO2 अणु बनाते हैं क्या SO2 अणु के ये दोनों S-O आबंध समतुल्य हैं।
7.22 SO2 की उपस्थिति का पता कैसे लगाया जाता है?
7-16 सल्फ़र के ऑक्सोअम्ल
(x = 2 से 5), H2SO4, H2S2O7, H2SO5, H2S2O8.
कुछ अॉक्सोअम्ल अस्थायी होते हैं तथा इनका पृथक्करण नहीं किया जा सकता। इनका अस्तित्व जलीय विलयन में अथवा लवणों के रूप में होता है।
सल्फर के कुछ महत्वपूर्ण अॉक्सोअम्लों की संरचनाएँ चित्र 7.6 में दर्शायी गई हैं।
सल्फ्यूरस अम्ल सल्फ्यूरिक अम्ल परअॉक्सोडाइसल्फ्यूरिक अम्ल पाइरोसल्फ्यूरिक अम्ल (ओलियम)
(H2SO3) (H2SO4) (H2S2O8) (H2S2O7)
चित्र 7.6- सल्फर के कुछ महत्वपूर्ण अॉक्सोअम्लों की संरचनाएँ
7.17 सल्फ्यूरिक अम्ल
उत्पादन
पूरे विश्व में, सल्फ्यूरिक अम्ल अतिमहत्वपूर्ण औद्योगिक रसायनों में से एक है। सल्फ्यूरिक अम्ल का उत्पादन संस्पर्श प्रक्रम द्वारा तीन चरणों में संपन्न होता है।
(i) सल्फर अथवा सल्फाइड अयस्कों को वायु में जलाकर सल्फर डाइअॉक्साइड का उत्पादन करना।
(ii) उत्प्रेरक (V2O5) की उपस्थिति में अॉक्सीजन के साथ अभिक्रिया कराकर SO2 का SO3 में परिवर्तन करना।
(iii) SO3 को सल्फ्यूरिक अम्ल में अवशोषित करके ओलियम (H2S2O7) प्राप्त करना।
सल्फ्यूरिक अम्ल के उत्पादन का प्रवाह चित्र, चित्र 7.7 में दिया गया है।
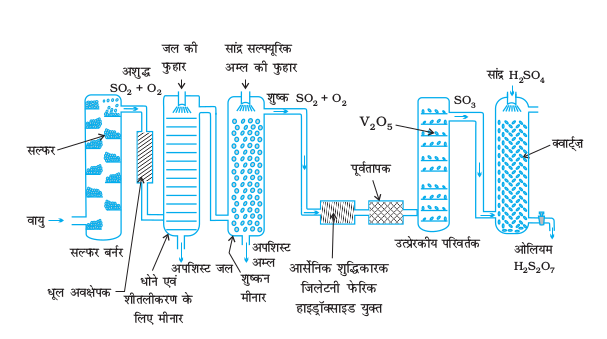

प्राप्त सल्फर डाइअॉक्साइड को धूल के कणों एवं आर्सेनिक यौगिकों जैसी अन्य अशुद्धियों से मुक्त कर शुद्ध कर लिया जाता है।
सल्फ्यूरिक अम्ल के उत्पादन में अॉक्सीजन द्वारा SO2 गैस का V2O5 उत्प्रेरक की उपस्थिति में SO3प्राप्त करने के लिए उत्प्रेरकी अॉक्सीकरण मूल पद है।
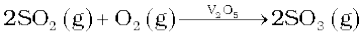
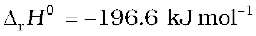
यह अभिक्रिया उष्माक्षेपी तथा उत्क्रमणीय है एवं अग्र अभिक्रिया में आयतन में कमी आती है। अत: कमताप और उच्च दाब उच्च लब्धि (yield) के लिए उपयुक्त स्थितियाँ हैं। परंतु तापक्रम बहुत कम नहीं होना चाहिए अन्यथा अभिक्रिया की गति धीमी हो जाएगी। सल्फ्यूरिक अम्ल के उत्पादन में प्रयुक्त सयंत्र का संचालन 2 bar दाब तथा 720 K ताप पर किया जाता है। उत्प्रेरकी परिवर्तित्र से प्राप्त SO3गैस, सांद्र सल्फ्यूरिक अम्ल में अवशोषित होकर ओलियम, H2S2O7 बना देती है। जल द्वारा ओलियम का तनुकरण करके वांछित सांद्रता वाला सल्फ्यूरिक अम्ल प्राप्त कर लिया जाता है। प्रक्रम के सतत संचालन तथा लागत में भी कमी लाने के लिए उद्योग में उपरोक्त दोनों प्रक्रियाएं साथ-साथ संपन्न की जाती हैं।
SO3 + H2SO4 → H2S2O7
(ओलियम)
H2S2O7 + H2O → 2H2SO4
संपर्क विधि द्वारा प्राप्त सल्फ्यूरिक अम्ल की शुद्धता सामान्यत: 96 - 98% होती है।
गुण
सल्फ्यूरिक अम्ल एक रंगहीन, गाढ़ा तैलीय द्रव है जिसका 298 K ताप पर विशिष्ट घनत्व 1.84 g cm-3 है। 283 K ताप पर अम्ल जम जाता है तथा 611 K ताप पर उबलने लगता है। यह जल में अत्यधिक ऊष्मा निर्गमन के साथ घुलता है, अत: सांद्र सल्फ्यूरिक अम्ल का तनुकरण करने में बहुत सावधानी रखनी चाहिए। सांद्र सल्फ्यूरिक अम्ल को जल में कम मात्रा में, धीमे-धीमे डालना चाहिए तथा उसको लगातार हिलातेे रहना चाहिए।
जलीय विलयन में सल्फ्यूरिक अम्ल का आयनन दो चरणों में होता है-
H2SO4 (aq) + H2O(l) → H3O+ (aq) + HSO4- (aq); K1 = बहुत अधिक
(Ka1 > 10)
HSO4- (aq) + H2O (l) → H3 O+ (aq) + SO42- (aq); K2 = 1.2 × 10-2
Ka1का अधिक मान यह दर्शाता है कि H2SO4 अधिकतर H+ तथा HSO4- में वियोजित है।
वियोजन स्थिरांक (Ka) का अधिक मान अम्ल की अधिक प्रबलता दर्शाता है।
अम्ल लवणों की दो श्रेणियाँ देता है, सामान्य सल्फेट (जैसे सोडियम सल्फेट तथा कॉपर सल्फेट) एवं अम्लीय सल्फेट (जैसे सोडियम हाइड्रोजनसल्फेट)।
निम्न वाष्पशीलता के कारण सल्फ्यूरिक अम्ल का उपयोग अधिक वाष्पशील अम्लों के उनके संगत लवणों से उत्पादित करने के लिए किया जाता है।
2 MX + H2SO4 → 2HX + M2SO4
(M = धातु) (X = F, Cl, NO3)
सांद्र सल्फ्यूरिक अम्ल एक प्रबल निर्जलन कर्मक है। अनेक नम गैसों को सल्फ्यूरिक अम्ल में से प्रवाहित करके शुष्क किया जाता है, यदि ये गैसें सल्फ्यूरिक अम्ल से अभिक्रिया न करती हों। सल्फ्यूरिक अम्ल कार्बनिक पदार्थों से जल निष्कासित करता है जैसा इसकी कार्बाेहाइड्रेट पर आदग्धन क्रिया से स्पष्ट है।
C12H22O11 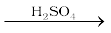 12 C + 11 H2O
12 C + 11 H2O
गरम सांद्र सल्फ्यूरिक अम्ल एक मध्यम प्रबलता का अॉक्सीकारक है। इस संदर्भ में इसका स्थान फॉस्फोरिक अम्ल तथा नाइट्रिक अम्ल के बीच आता है। धातुएं तथा अधातुएं दोनों ही सांद्र सल्फ्यूरिक अम्ल द्वारा अॉक्सीकृत हो जाती हैं तथा इस प्रक्रिया में सल्फ्यूरिक अम्ल SO2 में अपचित हो जाता है।
Cu + 2 H2 SO4 (सांद्र) → Cu SO4 + SO2 + 2 H2O
S + 2 H2 SO4 (सांद्र) → 3 SO2 + 2 H2O
C + 2 H2 SO4 (सांद्र) → CO2 + 2 SO2 + 2 H2O
उपयोग
सल्फ्यूरिक अम्ल एक अत्यधिक महत्वपूर्ण औद्योगिक रसायन है। किसी राष्ट्र की औद्योगिक सामर्थ्य उस राष्ट्र में सल्फ्यूरिक अम्ल के उत्पादन और उपयोग में आने वाली मात्रा के आधार पर आँकी जा सकती है। सल्फ्यूरिक अम्ल की आवश्यकता, हज़ारों यौगिकों के उत्पादन तथा बहुत से औद्योगिक प्रक्रमों में होती है। इस अम्ल की अधिकांश मात्रा का उपयोग उर्वरकों के उत्पादन में किया जाता है (उदाहरण- अमोनियम सल्फेट, सुपरफॉस्फेट)।
सल्फ्यूरिक अम्ल के अन्य उपयोग हैं-
(क) पेट्रोलियम के शोधन में;
(ख) वर्णकों, प्रलेपों तथा रंजकों के मध्यवर्तियों के उत्पादन में;
(ग) अपमार्जक उद्योग में;
(घ) धातुकर्मीय प्रक्रमों में (उदाहरण इनेमलन वैद्युतलेपन एवं यशदलेपन के पहले धातुओं के शोधन में);
(च) संचायक बैटरियों में; (छ) और नाइट्रोसेलुलोज उत्पादों के उत्पादन में तथा
(ज) प्रयोगशाला अभिकर्मक की तरह।
उदाहरण 7.13
तब क्या होता है जब-
(i) कैल्सियम फ्लुओराइड में सांद्र H2SO4 मिलाया जाता है?
(ii) SO3 को पानी में प्रवाहित किया जाता है?
हल
(i) यह हाइड्रोजन फ्लुओराइड बनाता है।
CaF2 + H2SO4 → CaSO4 + 2HF
(ii) SO3 घुल जाती है तथा H2SO4 प्राप्त होता है।
SO3 + H2O → H2SO4
पाठ्यनिहित प्रश्न
7.23 उन तीन क्षेत्रों का उल्लेख कीजिए जिनमें H2SO4 महत्वपूर्ण भूमिका निभाता है।
7.24 संस्पर्श प्रक्रम द्वारा H2SO4 की मात्रा में वृद्धि करने के लिए आवश्यक परिस्थितियों को लिखिए।
7.25 जल में H2SO4 के लिए Ka2 << Ka1 क्यों है?
7.18 वर्ग 17 के तत्व
फ्लुओरीन, क्लोरीन, ब्रोमीन, आयोडीन, एेस्टैटीन एवं टेनेसाइन वर्ग 17 के सदस्य हैं। ये तत्व संयुक्त रूप से हैलोजन कहलाते हैं [ग्रीक भाषा में हेलो का अर्थ है लवण तथा जेनेस का अर्थ है उत्पन्न करना अर्थात लवण पैदा करने वाले] हैलोजन अति क्रियाशील अधातु तत्व हैं। वर्ग 1 व 2 की तरह वर्ग 17 के तत्व भी आपस में बहुत अधिक समानता दर्शाते हैं। इतनी समानता आवर्त सारणी के अन्य वर्गों के तत्वों में नहीं पाई जाती। इनके रासायनिक तथा भौतिक गुणों में भी नियमित परिवर्तन होता है। एेस्टैटीन एवं टेनेसाइन रेडियोधर्मी तत्व हैं।
7.18.1 उपलब्धता
फ्लुओरीन और क्लोरीन बहुलता से उपलब्ध है जबकि ब्रोमीन तथा आयोडीन कम मात्रा में। फ्लुओरीन मुख्यतया अविलेय फ्लुओराइडों (फ्लुओरस्पार CaF2, क्रायोलाइट Na3AlF6 तथा फ्लुओरएपेटाइट3Ca3(PO4)2· CaF2) और थोड़ी मात्रा में नदी जल, पादपों, जीवों की हड्डियों तथा दाँतों में उपस्थित होती है।
समुद्री पानी में सोडियम पोटैशियम मैग्नीशियम तथा कैल्शियम के क्लोराइड, ब्रोमाइड तथा आयोडाइड उपस्थित होते हैं लेकिन मुख्यतया यह सोडियम क्लोराइड विलयन (द्रव्यमान द्वारा 2.5%) है। शुष्क हुए समुद्री निक्षेपों में सोडियम क्लोराइड तथा कारनेलाइट KCl · MgCl2 · 6H2O जैसे यौगिक उपस्थित होते हैं। कुछ समुद्री जीवों के तंत्र में आयोडीन होती है; बहुत से समुद्री पादपों में0.5% आयोडीन तथा चिली साल्टपीटर में 0.2% तक सोडियम आयोडेट पाया जाता है।
यहाँ टेनेसाइन को छोड़कर वर्ग 17 के अन्य तत्वों के प्रमुख परमाण्विक तथा भौतिक गुण एवं इलेक्ट्रॉनिक विन्यास सारणी 7.8 में दिए गए हैं।
टेनेसाइन एक संश्लेषित रेडियोसक्रिय तत्व है। इसका संकेत जेए परमाणु संख्या 117, परमाण्विक द्रव्यमान 294 gmol-1 तथा इलेक्ट्रॉनिक विन्यास [Rn] 5f14 6d10 7s2 7p5 है। इसका केवल अल्प मात्रा में निर्माण तथा अल्प अर्धायु (एक मिली सेकेंड) के कारण इसका रसायन ज्ञात नहीं है।
सारणी 7.8- हैलोजनों के परमाण्विक एवं भौतिक गुण
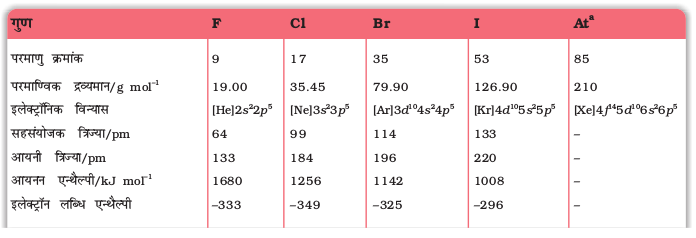
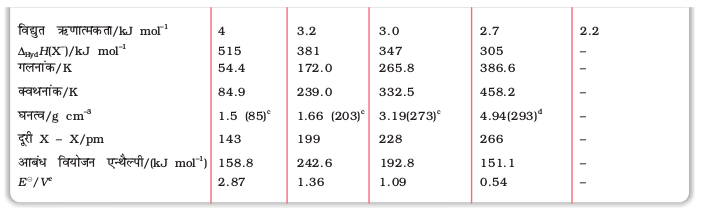
a रेडियोधर्मी b पॉलिंग स्केल c द्रव के लिए कोष्ठ में दिया गया ताप K दर्शाता है d ठोस e अर्धसेल अभिक्रिया X2(Ag) + 2e- → 2X - (aq)
कुछ परमाण्विक भौतिक तथा रासायनिक गुणों की प्रवृत्ति नीचे की गई है-
7.18.2 इलेक्ट्रॉनिक विन्यास
इन सभी तत्वों के बाह्यतम कोश में सात इलेक्ट्रॉन (ns2 np5) होते हैं। जो कि उससे अगली उत्कृष्ट गैससे एक इलेक्ट्रॉन कम होता है।
7.18.3 परमाणु तथा आयनी त्रिज्या
अधिकतम प्रभावी नाभिकीय आवेश के कारण हैलोजनों की आयनी त्रिज्या अपने यथाक्रम आवर्ती मेंसबसे छोटी होती है। फ्लुओरीन की परमाणु त्रिज्या दूसरे आवर्त के अन्य तत्वों के समान बहुत छोटी होती है। क्वान्टम कोशों की संख्या में फ्लुओरीन से आयोडीन तक वृद्धि होने के कारण परमाणु तथा आयनी त्रिज्या में वृद्धि होती है।
7.18.4 आयनन एन्थैल्पी
7.18.5 इलेक्ट्रॉन लब्धि एन्थैल्पी
उदाहरण 7.14
आवर्त सारणी में यथा क्रम आवर्त में हैलोजन की अधिकतम ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी क्यों होती है?
हल
हैलोजन अपने यथाक्रम आवर्त में बहुत छोटे आकार के होते हैं। अत: इन पर उच्च प्रभावी नाभिकीय आवेश होता है; फलत: ये आसानी से एक इलेक्ट्रॉन ग्रहण कर उत्कृष्ट गैसों का इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं।
7.18.7 भौतिक गुण
उदाहरण 7.15
यद्यपि फ्लुओरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी क्लोरीन की तुलना में कम ऋणात्मक है लेकिन फ्लुओरीन, क्लोरीन की अपेक्षा प्रबल अॉक्सीकारक है, क्यों?
हल
यह इस कारण है क्योंकि-
(i) F - F आबंध की वियोजन एन्थैल्पी कम है (सारणी 7.8)।
(ii) F- की जलयोजन एन्थैल्पी उच्च है (सारणी 7.8)।
7.18.8 रासायनिक गुण
अॉक्सीकरण अवस्थाएं तथा रासायनिक क्रियाशीलता की प्रवृत्ति—
सभी हैलोजन - 1 अॉक्सीकरण अवस्था प्रदर्शित करती हैं तथापि क्लोरीन, ब्रोमीन तथा आयोडीन +1, +3, +5 तथा +7 अॉक्सीकरण अवस्थाएं भी प्रदर्शित करती हैं। जैसा कि नीचे स्पष्ट किया गया है।
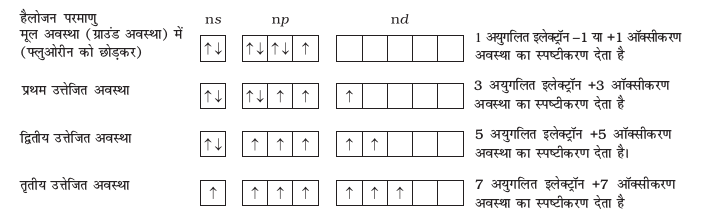
क्लोरीन, ब्रोमीन तथा आयोडीन की उच्च अॉक्सीकरण अवस्थाएं मुख्यतया तब प्राप्त होती हैं जब हैलोजन छोटे तथा उच्च विद्युत ऋणात्मकता वाले फ्लुओरीन तथा अॉक्सीजन परमाणुओं के साथ संयोग करते हैं, जैसे- अंतराहैलोजनों, अॉक्साइडों तथा अॉक्सोअम्लों में +4 व +6 अॉक्सीकरण अवस्थाएं क्लोरीन तथा ब्रोमीन के अॉक्साइडों तथा अॉक्सोअम्लों में पाई जाती हैं। फ्लुओरीन के परमाणु के संयोजकता कोश में कोई d कक्षक नहीं होता। अत: यह अपने अष्टक का प्रसार नहीं कर सकता। सबसे अधिक विद्युत ऋणात्मकता होने के कारण यह केवल -1 अॉक्सीकरण अवस्था प्रदर्शित करताहै।
F2+2X- → 2F-+X2 (X=Cl, Br या I)
Cl2+2X- → 2Cl-+X2 (X=Br या I)
Br2+2I- → 2Br-+I2
वर्ग में नीचे की ओर जाने पर हैलोजनों के जलीय विलयन में घटती हुई अॉक्सीकारक प्रवृत्ति की पुष्टि उनके मानक इलैक्ट्रोड विभावों से होती है। सारणी 7.8 जो कि नीचे दर्शाए गए प्राचलों पर निर्भर करते हैं-
हैलोजनों की तुलनात्मक अॉक्सीकारक सामर्थ्य को उनकी जल के साथ अभिक्रिया से और अधिक समझा जा सकता है। फ्लुओरीन जल को अॉक्सीजन में अॉक्सीकृत कर देती है। जबकि क्लोरीन तथा ब्रोमीन जल के साथ अभिक्रिया कर संगत हाइड्रोहैलिक और हाइपोहैलस अम्ल बनाती हैं। आयोडीन की जल के साथ अभिक्रिया अस्वत: प्रवर्तित है।
वास्तव में, I- अम्लीय माध्यम में अॉक्सीजन द्वारा अॉक्सीकृत किया जा सकता है, जो कि फ्लुओरीन द्वारा प्रदर्शित अभिक्रिया का ठीक विपरीत है।
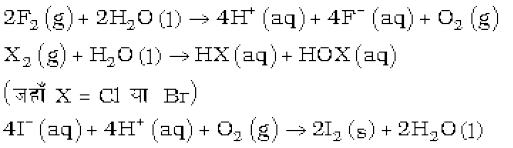
फ्लुओरीन का असामान्य व्यवहार
p-ब्लाक में द्वितीय आवर्त में उपस्थित अन्य तत्वों की भाँति फ्लुओरीन भी कई गुणों में असामान्य है। उदाहरण के लिए आयनन एन्थैल्पी, विद्युत ऋणात्मकता तथा विद्युत विभव, यह सभी फ्लुओरीन के लिए, अन्य हैलोजनों की प्रवृत्तियों के आधार पर अपेक्षित मानों से उच्च होते हैं। इसके अतिरिक्त आयनी तथा सहसंयोजी त्रिज्या, गलनांक, क्वथनांक, आबंध वियोजन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी अपेक्षित मानों से भी बहुत कम होते हैं। फ्लुओरीन का असामान्य व्यवहार इसके छोटे आकार, उच्च विद्युत ऋणात्मकता, निम्न F - F बंध वियोजन एन्थैल्पी तथा संयोजकता कोश में कक्षकों की अनुपलब्धता के कारण होता है।
फ्लुओरीन की अधिकांश अभिक्रियाएं उष्माक्षेपी होती हैं (इसका मुख्य कारण है दूसरे तत्वों के साथ इसके छोटे तथा प्रबल आबंधों को बनना)। यह केवल एक अॉक्सोअम्ल बनाती है जबकि दूसरे हैलोजन कई अॉक्सोअम्ल बनाते हैं। हाइड्रोजन फ्लुओराइड प्रबल हाइड्रोजन आबंधों के कारण एक द्रव है (क्वथनांक 293 K)। हाइड्रोजन बंध का कारण फ्लुओरीन का छोटा आकार तथा अधिक विद्युत्ऋणात्मकता है दूसरे हाइड्रोजन हैलाइड जिनका आकार बड़ा है तथा विद्युत्ऋणात्मकता कम है, गैसें हैं।
(i) हाइड्रोजन के प्रति अभिक्रियाशीलता
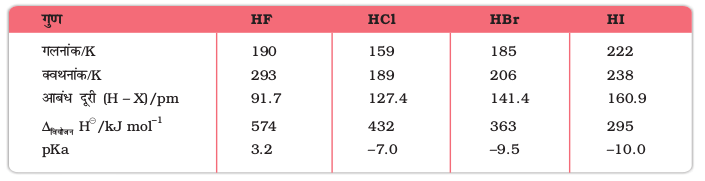
ये सभी हाइड्रोजन के साथ अभिक्रिया कर हाइड्रोजन हैलाइड बनाती हैं। परंतु फ्लुओरीन से आयोडीन तक हाइड्रोजन के प्रति बंधुता में कमी आती है। हाइड्रोजन हैलाइड जल में विलेय होकर हाइड्रोहैलिक अम्ल बनाते हैं। हाइड्रोजन हैलाइडों के कुछ गुणों को सारणी 7.9 में दिया गया है। इन अम्लों की अम्लीय सामर्थ्य निम्न क्रम में है- HF < HCl < HBr < HI। इन हैलाइडों का स्थायित्व वर्ग में नीचे की ओर बढ़ने पर घटता है। इसका कारण आबंध (H - X) वियोजन एन्थैल्पी में कमी का क्रम, H - F > H - Cl > H - Br > H - I, होना है।
सारणी 7.9- हाइड्रोजन हैलाइडों के गुण
(ii) अॉक्सीजन के प्रति अभिक्रियाशीलता
हैलोजन अॉक्सीजन से संयोग कर बहुत से अॉक्साइड बनाते हैं परंतु इनमें से अधिकांश अस्थायी होते हैं। फ्लुओरीन दो अॉक्साइड, OF2 तथा O2F2 बनाती है परंतु केवल OF2 ही 298 K ताप पर स्थायी होता है। ये अॉक्साइड आवश्यक रूप से अॉक्सीजन फ्लोराइड हैं क्योंकि फ्लुओरीन की विद्युत ऋणात्मकता अॉक्सीजन से अधिक है। ये दोनों प्रबल फ्लुओरीनन कारक है। O2F2, प्लूटोनियम को PuF6 में अॉक्सीकृत कर देता है। इस प्रकार इस अभिक्रिया का उपयोग भुक्तशेष नाभिकीय ईंधन से प्लूटोनियम को PuF6 के रूप में हटाने हेतु किया जाता है।
क्लोरीन, ब्रोमीन तथा आयोडीन भी अॉक्साइड बनाती हैं जिनमें इन हैलोजनों की अॉक्सीकरण संख्या +1 से +7 तक होती है। गतिज तथा उष्मागतिक कारकों के संयोग के कारण सामान्यतया हैलोजनों द्वारा निर्मित अॉक्साइडों के स्थायित्व का घटता क्रम 1 > Cl > Br होता है। आयोडीन के अॉक्साइडों के अधिक स्थायित्व का कारण अॉक्सीजन एवं आयोडीन के मध्य बंध की अधिक ध्रुवणता है। d-कक्षकों की उपलब्धता के कारण क्लोरीन अॉक्सीजन के साथ बहुआबंध बनाती है। इससे स्थायित्व की वृद्धि होती है। ब्रोमीन में दोनों गुणों का अभाव होता है, अत: इसके अॉक्साइड सबसे कम स्थायी होते हैं। हैलोजनों के उच्चतर अॉक्साइडों की प्रवृत्ति निम्नतर अॉक्साइड्स की अपेक्षा अधिक स्थायी होने की होती है।
ब्रोमीन के अॉक्साइड, Br2O, BrO2, BrO3 सबसे कम स्थायी होते हैं (मध्य पंक्ति अनियमितता) तथा इनका अस्तित्व केवल कम ताप पर होता है। ये बहुत प्रबल अॉक्सीकारक होते हैं।
आयोडीन के अॉक्साइड, I2O4, I2O5, I2O7 अविलेय ठोस है तथा गरम करने पर विघटित हो जाते हैं। I2O5 बहुत अच्छा अॉक्सीकारक है तथा इसका उपयोग कार्बन मोनोक्साइड के आकलन में होता है।
(iii) धातुओं के प्रति अभिक्रियाशीलता
हैलोजन धातु के साथ अभिक्रिया करके धातु हैलाइड बनाते हैं। उदाहरणार्थ, ब्रोमीन मैग्नीशियम के साथ अभिक्रिया करके मैग्नीशियम ब्रोमाइड देता है
Mg(s) + Br2 (l) → Mg Br2 (s)
हैलाइड के आयनिक गुण इस क्रम में कम होते हैं- MF > MCl > MBr > MI
जहाँ M, एकसंयोजी धातु है।
यदि धातु एक से अधिक अॉक्सीकरण अवस्थाएं प्रदर्शित करती हैं तो उच्च अॉक्सीकरण अवस्था वाले हैलाइड, निम्न अॉक्सीकरण अवस्था वाले हैलाइडों से अधिक सहसंयोजक होंगे। उदाहरण के लिए SnCl2, PbCl2, SbCl3 तथा UF4 की अपेक्षा क्रमश: SnCl4, PbCl4, SbCl5 तथा UF6 अधिक सहसंयोजक होते हैं।
(iv) हैलोजन की अभिक्रियाशीलता अन्य हैलोजनों के प्रति
हैलोजन अन्य हैलोजनों के साथ संयोग कर बहुत से यौगिक बनाते हैं, जो अंतरा हैलोजेन कहलाते हैं जिनके प्रकार हैं- XX, XX3, XX5 तथा XX7जहाँ X- बड़े आकार का हैलोजन तथा X छोटे आकार का हैलोजन है।
उदाहरण 7.16
फ्लुओरीन केवल -1 अॉक्सीकरण अवस्था प्रदर्शित करता है जबकि अन्य हैलोजन +1, +3, +5 तथा+7 अॉक्सीकरण अवस्थाएं भी प्रदर्शित करते हैं। व्याख्या कीजिए।
हल
फ्लुओरीन सबसे अधिक विद्युत ऋणात्मक तत्व है तथा कोई धनात्मक अॉक्सीकरण अवस्था प्रदर्शित नहीं कर सकती। दूसरे हैलोजनों में d कक्षक होते हैं तथा वह अपने अष्टक का विस्तार करके +1, +3, +5 तथा +7 अॉक्सीकरण अवस्थाएं प्रदर्शित कर सकते हैं।
पाठ्यनिहित प्रश्न
7.26 आबंध वियोजन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा जलयोजन एन्थैल्पी जैसे प्राचलों को महत्व देते हुए F2 तथा Cl2 की अॉक्सीकारक क्षमता की तुलना कीजिए।
7.27 दो उदाहरणों द्वारा फ्लुओरीन के असामान्य व्यवहार को दर्शाइए।
7.28 समुद्र कुछ हैलोजन का मुख्य स्रोत है। टिप्पणी कीजिए।
7-19 क्लोरीन
शैले ने 1774 में HCl पर MnO2 की अभिक्रिया द्वारा क्लोरीन को खोजा था। 1810 में डेवी ने इसकी तात्विक प्रकृति को स्थापित किया तथा इसके रंग के आधार पर इसे क्लोरीन नाम दिया। (ग्रीक, Chloros - हरित-पीला)
विरचन
इसे निम्नलिखित में से किसी भी विधि द्वारा बनाया जा सकता है—
(i) सांद्र हाइड्रोक्लोरिक अम्ल को मैंगनीज डाइअॉक्साइड के साथ गर्म करके

परंतु, HCl के स्थान पर नमक तथा सांद्र H2SO4 का मिश्रण उपयोग में लिया जाता है।
(ii) पोटैशियम परमैंगनेट की HCl से अभिक्रिया करने पर
क्लोरीन का उत्पादन
(i) डेकॉन विधि - इनमें 723 K पर हाइड्रोजन क्लोराइड गैस का CuCl2 (उत्प्रेरक) की उपस्थिति में वायुमंडलीय अॉक्सीजन द्वारा अॉक्सीकरण करते हैं।

(ii) वैद्युतअपघटन प्रक्रम - क्लोरीन लवण जल (सांद्र NaCl विलयन) के वैद्युतअपघटन द्वारा प्राप्त की जाती है) क्लोरीन एेनोड पर प्राप्त होती है। यह बहुत से रासायनिक उद्योगों में सहउत्पाद के रूप में भी प्राप्त होती है।
गुण
यह तीखी गंध वाली, दमघोंटू हरित-पीली गैस है। यह वायु से 2.5 गुना भारी है। यह हरित-पीले द्रव के रूप में आसानी से द्रवित की जा सकती है जो कि 239 K पर उबलती है। यह जल में विलेय है।
क्लोरीन बहुत सी धातुओं तथा अधातुओं के साथ क्रिया कर क्लोराइड बनाती है।
2Al + 3Cl2→2AlCl3
2Na + Cl2→2NaCl
2 Fe+3Cl2→2FeCl3
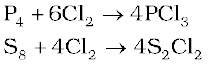
इसकी हाइड्रोजन के प्रति अत्यधिक बंधुता होती है। यह हाइड्रोजन युक्त यौगिकों के साथ अभिक्रिया कर HCl बनाती है।
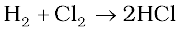
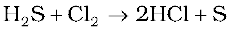
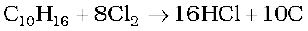
ठंडे तथा तनुक्षारकों के साथ, क्लोरीन क्लोराइड और हाइपोक्लोराइट का मिश्रण देती है। परंतु गरम तथा सांद्र क्षारकों के साथ, क्लोराइड तथा क्लोरेट बनते हैं।
2NaOH + Cl2→NaCl + NaOCl + H2O
(ठंडा तथा तनु)
6 NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
(गरम तथा सांद्र)
शुष्क बुझे हुए चूने के साथ यह विरंजक चूर्ण (ब्लीचिंग पाउडर) देती है।
गर्म तथा सांद्र विरंजक चूर्ण का संघटन Ca(OCl)2 · CaCl2 · Ca(OH)2 · 2H2O है।
क्लोरीन हाइड्रोकार्बनों के साथ अभिक्रिया करती है तथा संतृप्त हाइड्रोकार्बनों के साथ प्रतिस्थापन उत्पाद और असंतृप्त हाइड्रोकार्बनों के साथ योगज उत्पाद देती है। उदाहरणार्थ—
CH4 + Cl2  CH3 Cl + HCl
CH3 Cl + HCl
मेथेन मेथिल क्लोराइड
C2H4 + Cl2 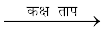 C2H4 Cl2
C2H4 Cl2
एथीन 1, 2- डाइक्लोरोएथेन
HCl तथा HOCl के निर्माण के कारण क्लोरीन जल का पीला रंग उड़ जाता है। इस प्रकार प्राप्त हाइपोक्लोरस अम्ल (HOCl) नवजात अॉक्सीजन देता है जो कि क्लोरीन के विरंजक तथा अॉक्सीकारक गुणों के लिए उत्तरदायी है।
(i) क्लोरीन फेरस को फेरिक तथा सल्फाइट को सल्फेट में आक्सीकृत करती है, यह सल्फर डाइअॉक्साइड को सल्फर ट्राइअॉक्साइड में तथा आयोडीन को आयोडेट में आक्सीकृत करती है जो जल की उपस्थिति में क्रमश: सल्फ्यूरिक अम्ल तथा आयोडिक अम्ल देते हैं।
2 Fe SO4 + H2 SO4 + Cl2  Fe2 (SO4)3 + 2HCl
Fe2 (SO4)3 + 2HCl
Na2 SO3 + Cl2 + H2O  Na2 SO4 + 2 HCl
Na2 SO4 + 2 HCl
SO2 + 2H2O + Cl2  H2 SO4 + 2 HCl
H2 SO4 + 2 HCl
I2 + 6 H2O + 5 Cl2  2 HIO3 + 10 HCl
2 HIO3 + 10 HCl
(ii) क्लोरीन एक प्रबल विरंजक है, विरंजन क्रिया अॉक्सीकरण के कारण होती है। यह नमी की उपस्थिति में वानस्पतिक अथवा कार्बनिक पदार्थों को विरंजित करती है। क्लोरीन का विरंजक प्रभाव स्थायी होता है।
Cl2 + H2O  2HCl + O
2HCl + O
रंगीन पदार्थ + O → रंगहीन पदार्थ
उपयोग
इसका उपयोग (i) काष्ठ लुगदी (कागज़ तथा रेअॉन के उत्पादन में आवश्यक होती है।), कपास तथा वस्त्रों के विरंजन में (ii) सोने तथा प्लैटिनम के निष्कर्षण में (iii) रंजकों, औषधों तथा कार्बनिक पदार्थों जैसे CCl4, CHCl3, DDT, प्रशीतकों इत्यादि के उत्पादन में (iv) पीने के जल को निर्जम (जीवाणुरहित) करने में (v) विषैली गैसों, जैसे फ़ॉसज़ीन (COCl2) अश्रु गैस (CCl3NO2), मस्टर्ड गैस(ClCH2CH2SCH2CH2Cl) के बनाने में होता है।
उदाहरण 7.17
Cl2 की गर्म तथा सांद्र NaOH के साथ अभिक्रिया की संतुलित रासायनिक समीकरण लिखिए। क्या यह अभिक्रिया असमानुपातन अभिक्रिया है? औचित्य बतलाइए।
हल
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
हाँ, क्लोरीन शून्य अॉक्सीकरण अवस्था से -1 तथा +5 अॉक्सीकरण अवस्थाओं में परिवर्तित होती है।
पाठ्यनिहित प्रश्न
7.29 Cl2 की विरंजक क्रिया का कारण बताइए।
7.30 उन दो विषैली गैसों के नाम बताइए जो क्लोरीन गैस से बनाई जाती हैं।
7-20 हाइड्रोजन क्लोराइड
यह अम्ल 1648 में ग्लैबर ने साधारण लवण (नमक) को सांद्र सल्फ्यूरिक अम्ल के साथ गर्म कर प्राप्त किया। 1810 में डेवी ने प्रदर्शित किया कि यह हाइड्रोजन तथा क्लोरीन का यौगिक है।
विरचन
प्रयोगशाला में यह सोडियम क्लोराइड को सांद्र सल्फ्यूरिक अम्ल के साथ गरम करके बनाया जाता है।
NaCl + H2SO4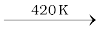 NaHSO4 + HCl NaHSO4 + NaCl
NaHSO4 + HCl NaHSO4 + NaCl 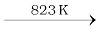 Na2SO4 + HCl
Na2SO4 + HCl HCl गैस को सांद्र सल्फ्यूरिक अम्ल में प्रवाहित करके शुष्क किया जा सकता है।
गुण
यह रंगहीन व तीक्ष्ण गंध वाली गैस है। यह आसानी से रंगहीन द्रव में द्रवित हो जाती है (क्वथनांक 189 K) तथा श्वेत क्रिस्टलीय ठोस के रूप में जम जाती है (हिमांक 159 K)। यह पानी में अत्यधिक विलेय है तथा निम्न प्रकार से आयनित होती है-
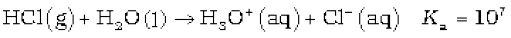
इसका जलीय विलयन को हाइड्रोक्लोरिक अम्ल कहते हैं। वियोजन स्थिरांक का उच्च मान प्रदर्शित करता है कि यह जल में एक प्रबल अम्ल है। यह आमोनिया से अभिक्रिया करती है तथा NH4Cl के श्वेत धूम देती है।
NH3 + HCl → NH4Cl
सांद्र HCl के तीन भाग तथा सांद्र HNO3 के एक भाग को मिलाने पर एक्वारेजिया बनता है। जो कि सोने तथा प्लैटिनम जैसी अक्रिय धातुओं (जैसे सोना, प्लैटिनम) को घोलने के लिए काम में लाया जाता है।
हाइड्रोक्लोरिक अम्ल दुर्बल अम्लों के लवणों जैसे कार्बोनेट, हाइड्रोजन कार्बोनेट, सल्फाइट इत्यादि को विघटित कर देता है।
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
Na2SO3 + 2HCl → 2NaCl + H2O + SO2
उपयोग
इसके उपयोग हैं-
(i) क्लोरीन, अमोनियम क्लोराइड तथा ग्लूकोस (अन्न स्टार्च से) के उत्पादन में,
(ii) अस्थियों से सारेस निकालने और अस्थि कोयले के शुद्धिकरण में, तथा
(iii) औषध में तथा प्रयोगशाला अभिकर्मक के रूप में।
उदाहरण 7.18
हल
HCl सूक्ष्म चूर्णित लोहे से अभिक्रिया करने पर फेरस क्लोराइड बनता है, न कि फेरिक क्लोराइड, क्यों?
इसकी आयरन से अभिक्रिया में H2 बनती है। हाइड्रोजन का मुक्त होना फेरिक क्लोराइड के बनने को रोकता है।
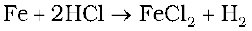
7.21 हैलोजनों के ऑक्सोअम्ल
उच्च विद्युत ऋणात्मकता तथा छोटे आकार के कारण फ्लूओरीन एक मात्र अॉक्सोअम्ल HOF बनाती है जो फ्लूओरिक (1) अम्ल या हाइपोफ्लूओरस अम्ल कहता है। अन्य हैलोजन अनेक अॉक्सोअम्ल बनाते हैं। जिनमें से अधिकांश शुद्ध रूप में पृथक नहीं किए जा सकते। अॉक्सोअम्ल केवल जलीय विलयन में अथवा लवण के रूप में स्थायी है।
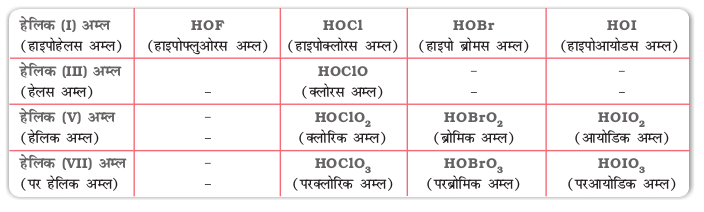
हैलोजनों के अॉक्सोअम्ल सारणी 7.10 में दिए गए हैं तथा उनकी संरचनाएं चित्र 7.8 में दी गई हैं।
सारणी 7.10- हैलोजनों के अॉक्सोअम्ल
![12m]()
![9i]()
चित्र 7.8- क्लोरीन के अॉक्सोअम्लों की संरचनाएं
सारणी 7.10- हैलोजनों के अॉक्सोअम्ल
7.22 अंतराहैलोजन यौगिक
जब दो भिन्न हैलोजन एक दूसरे से अभिक्रिया करते हैं तब अंतराहैलोजन यौगिक बनते हैं। इन्हें सामान्य संघटनों XX′ , XX3′, XX5′ तथा XX7′ से प्रदर्शित किया जा सकता है। जहाँ X बड़े आकार वाला हैलोजन है तथा X′ छोटे आकार वाला, एवं X, X ′ की तुलना में अधिक विद्युत धनात्मक है। जैसे-जैसे X और X′ की त्रिज्याओं का अनुपात बढ़ता है, प्रति अणु परमाणुओं की संख्या भी बढ़ती है। अत: आयोडीन (VII) फ्लोराइड में परमाणुआें की संख्या अधिकतम होनी चाहिए। क्योंकि I और F के बीच त्रिज्याओं का अनुपात अधिकतम है। इसीलिए इसका सूत्र 1F7 होता है जिसमें परमाणुओं की संख्या अधिकतम है।
विरचन
अंतराहैलोजन यौगिक सीधे संयोग द्वारा या किसी हैलोजन की एक निम्नतर अंतराहैलोजन यौगिक पर अभिक्रिया द्वारा बनाए जा सकते हैं। निर्मित उत्पाद कुछ विशिष्ट परिस्थितियों पर निर्भर करते हैं। जैसे-
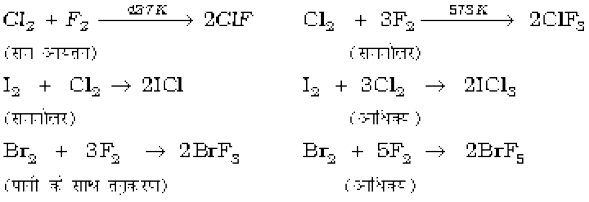
गुण
अंतराहैलोजन यौगिकों के कुछ गुण सारणी 7.11 में दिए गए हैं।
ये सभी सहसंयोजक अणु होते हैं और प्रतिचुंबकीय प्रकृति के होते हैं। CIF के अतिरिक्त जो कि 298Kपर एक गैस है, ये सभी वाष्पशील ठोस या द्रव हैं। इनके भौतिक गुण अवयवी हैलोजनों के मध्यवर्ती होते हैं। केवल यह अंतर होता है कि इनके गलनांक व क्वथनांक अपेक्षित मानों से थोड़े उच्च होते हैं।
इनकी रासायनिक अभिक्रियाओं की तुलना पृथक अवयवी हैलोजनों से की जा सकती है। सामान्यतया अंतरा हैलोजन यौगिक हैलोजनों की अपेक्षा अधिक क्रियाशील होते हैं (फ्लुओरीन के अतिरिक्त)। एेसा अंतरा हैलोजनों के X-X' आबंधों का हैलोजनों के X-X आबंधों की तुलना में दुर्बल होने के कारण होता है (F-F आबंध को छोड़कर)। ये सभी जल अपघटित होकर छोटे हैलोजन के संगत हैलाइड आयन, और बड़े हैलोजन के संगत हाइपोहैलाइट (जब XX') हैलाइट (जब XX'3), हैलेट (जब XX'5) तथा परहैलेट (जब XX'7) आयन देते हैं।
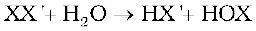
इनकी आण्विक संरचनाएं बहुत रोचक होती हैं जो कि VSEPR सिद्धांत के आधार पर समझाई जासकती हैं (उदाहरण 7.19)। XX3 यौगिकों की संरचना बंकित T-आकार की, XX5 यौगिकों की संरचना वर्गाकार पिरैमिडी तथा XF7 की संरचना पंचकोणीय द्विपिरैमिडी होती है (सारणी 7.11)।
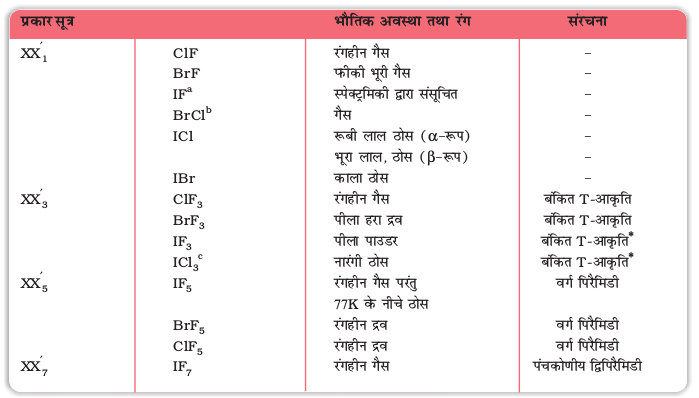
a बहुत अस्थायी b शुद्ध ठोस कमरे के ताप पर ज्ञात c Cl-सेतु द्वितय बनाता है (I2Cl6) * अनिश्चित
उदाहरण 7.19
VSEPR सिद्धांत के आधार पर BrF3 की आकृति की व्याख्या कीजिए।
हल
केंद्रीय परमाणु Br के संयोजकता कोश में सात इलेक्ट्रॉन हैं। इनमें से तीन इलेक्ट्रॉन तीन फ्लुओरीन परमाणुआें के साथ इलेक्ट्रॉन युगल आबंध बना लेते हैं तथा चार इलेक्ट्रॉन शेष रह जाते हैं। इस प्रकार अब तीन आबंध युगल तथा दो एकाकी युगल VSEPR सिद्धांत के अनुसार सभी इलेक्ट्रॉन युगलत्रिसमनताक्ष द्विपिरैमिडी के शीर्षों पर स्थित रहते हैं। दो एकाकी इलेक्ट्रॉन युगल निरक्षीय स्थान परस्थित होंगे जिससे कि एकाकी युगल-एकाकी युगल तथा आबंध युगल एकाकी युगल के बीच प्रतिकर्षण न्यूनतम रहें। उल्लेखनीय है कि ये प्रतिकर्षण, आबंध युगल-आबंध युगल प्रतिकर्षण से अधिक होते हैं। इसके अतिरिक्त अक्षीय फ्लुओरीन परमाणु, एकाकी युगल-एकाकी युगल के बीच प्रतिकर्षण को कम करने के लिए निरक्षीय फ्लुओरीन परमाणु की तरफ़ झुक जाते हैं जिससे एकाकी युगल-एकाकी युगल प्रतिकर्षण न्यूनतम रहे। इस प्रकार BrF3 की आकृति थोड़ी बंकित 'T' आकृति की हो जाती है।
उपयोग
यह यौगिक अजलीय विलायकों की तरह उपयोग में लाए जा सकते हैं। अंतराहैलोजन यौगिक बहुत उपयोगी है। फ्लुओरीनीकरण कारक होते हैं। ClF3 तथा BrI3 का उपयोग यूरेनियम 235U के संवर्धन हेतु UF6 के उत्पादन में किया जाता है।
U(s) + 3ClF3(l) → UF6(g) + 3ClF(g)
पाठ्यनिहित प्रश्न
7.31 I2 से ICl अधिक क्रियाशील क्यों है?
7.23 वर्ग 18 के तत्व
वर्ग 18 के तत्व हैं— हीलियम, निअॉन, अॉर्गन, क्रिप्टॉन, जीनॉन, रेडॉन तथा ओगानेसन। ये सभी गैसें हैं तथा रासायनिक रूप से अक्रिय हैं ये बहुत कम यौगिक बनाती हैं इसी कारण इन्हें उत्कृष्ट गैसें कहते हैं।
7.23.1 उपलब्धता
रेडॉन तथा ओगानेसन के अतिरिक्त अन्य सभी उत्कृष्ट गैसें वायुमंडल में पाई जाती हैं। आयतन के अनुसार, इनकी शुष्क वायु में बाहुल्यता लगभग 1 प्रतिशत है जिसमें अॉर्गन प्रमुख अवयव है। हीलियम तथा कभी-कभी निअॉन रेडियोधर्मी उत्पत्ति के खनिजों में पाए जाते हैं। जैसे पिचब्लैन्ड, मोनेज़ाइट, क्लीवाइट। हीलियम का मुख्य औद्योगिक स्रोत प्राकृतिक गैस है। जीनॉन तथा रेडॉन इस वर्ग के दुर्लभतम तत्व हैं। रेडियम (226Ra) के विघटन उत्पाद की तरह रेडॉन प्राप्त होता है- 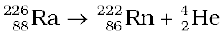
ओगानेसन का संश्लेषण 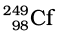 तथा
तथा 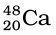 आयन के संघट्ट के द्वारा किया गया है।
आयन के संघट्ट के द्वारा किया गया है।
ओगानेसन का संकेत Og, परमाणु संख्या 118, परमाण्विक द्रव्यमान 294 gmol-1 तथा इलेक्ट्रानिक विन्यास [Rn] 5f14 6d10 7s2 7p6 है। Og की केवल अल्पमात्रा ही बन पाई है इसकी अर्धायु केवल 7 मिलीसेकेंड है। इसलिए इसके रसायन का मुख्यत: पूर्वानुमान ही लगाया गया है।
सारणी 7.12- वर्ग 18 के तत्वों के परमाण्विक एवं भौतिक गुण
7.23.2 इलेक्ट्रॉनिक विन्यास
यहाँ वर्ग के परमाण्विक, भौतिक तथा रासायनिक गुणों की प्रवृत्तियों की व्याख्या की गई है।
हीलियम के अतिरिक्त सभी उत्कृष्ट गैसों का सामान्य इलेक्ट्रॉनिक विन्यास ns2np6 होता है जो कि हीलियम के लिए 1s2 है (सारणी 7.14) उत्कृष्ट गैसों के बहुत से गुण जिनमें अक्रिय प्रकृति शामिल है, उनकी संवृत कोश संरचना के कारण होती है।
7.23.3 आयनन एन्थैल्पी
स्थायी इलेक्ट्रॉनिक विन्यास के कारण इनकी गैसों में आयनन एन्थैल्पी बहुत अधिक होती है। जबकि परमाण्विक आकार में वृद्धि के साथ वर्ग में नीचे की ओर बढ़ने पर यह कम होती जाती है।
7.23.4 परमाणु त्रिज्या
परमाणु क्रमांक में वृद्धि के साथ-साथ वर्ग में नीचे की ओर परमाणु त्रिज्या में वृद्धि होती है।
7.23.5 इलेक्ट्रॉन लब्धि एन्थैल्पी
उत्कृष्ट गैसों का स्थायी इलेक्ट्रॉनिक विन्यास होने के कारण इनकी प्रवृत्ति इलेक्ट्रॉन ग्रहण करने की नहीं होती, अत: इनकी इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अधिक धनात्मक होता है।
7.23.6 भौतिक गुण
सभी उत्कृष्ट गैसें एक परमाण्विक हैं। यह रंगहीन, गंधहीन तथा स्वादहीन होती हैं। जल में अल्प विलेय हैं। इनके गलनांक तथा क्वथनांक अत्यधिक निम्न होते हैं, क्योंकि इन तत्वों में एक मात्र अंतरापरमाणुक अन्योन्यक्रिया दुर्बल परिक्षेपण बलों के कारण होती है। ज्ञात पदार्थों में हीलियम का क्वथनांक (4.2 K) निम्नतम होता है। हीलियम में प्रयोगशाला में प्रयुक्त होने वाले साधारण पदार्थों, जैसे कि रबर, काँच तथा प्लास्टिक में से विसरित होने का असामान्य गुण पाया जाता है।
उदाहरण 7.21
उत्कृष्ट गैसों के क्वथनांक बहुत कम क्यों होते हैं?
हल
उत्कृष्ट गैसें एक परमाण्विक होने के कारण इनमें दुर्बल परिक्षेपण बलों के अतिरिक्त अन्य किसी प्रकार के अंतरापरमाणुक बल कार्यरत नहीं होते, इसलिए ये अति निम्न तापों पर द्रवित होती हैं अत: इनके क्वथनांक निम्न होते हैं।
7.23.7 रासायनिक गुण
सामान्यतया उत्कृष्ट गैसें सबसे कम क्रियाशील होती हैं। इनकी रासायनिक अभिक्रिया के प्रति अक्रियता के निम्न कारण दिए जाते हैं।
(i) उत्कृष्ट गैसों के संयोजकता कोश का पूर्णभरित इलेक्ट्रॉनिक विन्यास ns2np6 होता है [हीलियम में (152)]।
(ii) इनकी आयनन एन्थैल्पी अधिक होती है तथा इलेक्ट्रान लब्धि एन्थैल्पी अधिक धनात्मक होती है।
इनकी खोज के समय से ही इनकी सक्रियता बार-बार परखी जाती रही, परंतु इनके यौगिक बनाने के सभी प्रयास काफी समय तक असफल रहे। मार्च 1962 में नील बर्टलेट ने, जो कि उस समय ब्रिटिश कोलंबिया विश्वविद्यालय में थे, एक उत्कृष्ट गैस की क्रियाशीलता प्रेक्षित की। उन्होंने पहले एक लाल रंग का यौगिक निर्मित किया जिसे O2+PtF6- सूत्र से दर्शाया जा सकता है। उन्होंने अनुभव किया कि अॉक्सीजन की प्रथम आयनन एन्थैल्पी (1175 kJ mol-1) जिनॉन (1170 kJmol-1) के लगभग बराबर है। उन्होंने Xe के इसी प्रकार के यौगिक बनाने का प्रयास किया और Xe तथा PtF6 को मिलाकर लाल रंग के एक दूसरे यौगिक Xe+PtF6- के विरचन में सफलता प्राप्त की।
इस खोज के पश्चात् जीनॉन के बहुत से यौगिक, प्रमुख रूप से अधिक विद्युत्ऋणात्मकता वाले फ्लुओेरीन एवं अॉक्सीजन तत्वों के साथ, संश्लेषित किए गए हैं।
क्रिप्टॉन के बहुत कम यौगिक ज्ञात हैं। केवल क्रिप्टॉन डाइफ्लुओराइड (KrF2) का विस्तृत अध्ययन किया गया है। रेडॉन के यौगिकों का पृथक्करण नहीं हो पाया है परंतु इनकी पहचान रेडियो अनुज्ञापक (रेडियो ट्रेसर) तकनीक द्वारा की गई है। Ar, Ne तथा He का कोई भी वास्तविक यौगिक ज्ञात नहीं है।
(क) जीनॉन-फ्लुओरीन यौगिक
अनुकूल प्रायोगिक परिस्थितियों में तत्वों से प्रत्यक्ष क्रिया द्वारा जीनॉन तीन प्रकार के द्विअंगी फ्लुओराइड, XeF2, XeF4 तथा XeF6 बनाती है।
Xe (g) + F2 (g)  XeF2(s)
XeF2(s)
(जीनॉन आधिक्य में)
Xe (g) + 2F2 (g) 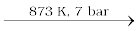 XeF4(s)
XeF4(s)
(1:5 अनुपात)
Xe (g) + 3F2 (g)  XeF6(s)
XeF6(s)
(1:20 अनुपात)
XeF6 को XeF4 तथा O2F2 की 143K ताप पर अन्यन्यक्रिया से भी बनाया जाता है।
XeF2, XeF4 तथा XeF6 रंगहीन, क्रिस्टलीय ठोस पदार्थ हैं जो कि 298 K ताप पर आसानी से उर्ध्वपातित हो जाते हैं। यह प्रबल फ्लुओरीनीकरण कर्मक हैं। लेश मात्र जल से भी इनका जलअपघटन आसानी से हो जाता है। उदाहरणार्थ XeF2 के जल अपघटन से Xe, HF तथा O2 प्राप्त होते हैं।
2XeF2 (s) + 2H2O(l) → 2Xe (g) + 4 HF(aq) + O2(g)
जीनॉन के तीनों फ्लुओराइडों की संरचनाओं की व्युत्पत्ति VSEPR सिद्धांत के आधार पर की जा सकती है। इन संरचनाओं को चित्र 7.9 में दर्शाया गया है XeF2 तथा XeF4 की संरचनाएं क्रमश: रैखिक तथा वर्ग समतलीय हैं XeF6 में सात इलेक्ट्रॉन युगल हैं (6 आबंध युगल तथा एक एकाकी युगल है) अत: इसकी संरचना विकृत अष्टफलकीय है जैसा कि गैसीय प्रावस्था में प्रायोगिक आधार पर पाया गया है।
जीनॅान फ्लुओराइड, फ्लुओराइड आयन ग्राही से अभिक्रिया कर धनायन स्पीशीज तथा फ्लुओराइड आयन दाता से अभिक्रिया करके फ्लुओरोऋणायन बनाते हैं।
XeF2 + PF5 → [XeF]+ [PF6]-
XeF4 + SbF5 → [XeF3]+ [SbF6]-
XeF6 + MF → M+ [XeF7]- (M = Na, K, Rb or Cs)
(ख) जीनॉन-अॉक्सीजन यौगिक
XeF4 तथाXeF6 के जल अपघटन फलस्वरूप XeO3 प्राप्त होता है।
6XeF4 + 12 H2O → 4Xe + 2Xe03 + 24 HF + 3 O2
XeF6 + 3 H2O → XeO3 + 6 HF
XeF6 के आंशिक जल अपघटन से अॉक्सीफ्लुओराइड XeOF4 तथा XeO2F2 प्राप्त होते हैं।
XeF6 + H2O → XeOF4 + 2 HF
XeF6 + 2 H2O → XeO2F2 + 4HF
XeO3 एक रंगहीन विस्फोटक ठोस पदार्थ है। इसकी संरचना पिरैमिडी है (चित्र 7.9)। XeOF4 एक रंगहीन वाष्पशील द्रव है जिसकी संरचना वर्ग समतलीय होती है (चित्र 7.9)।
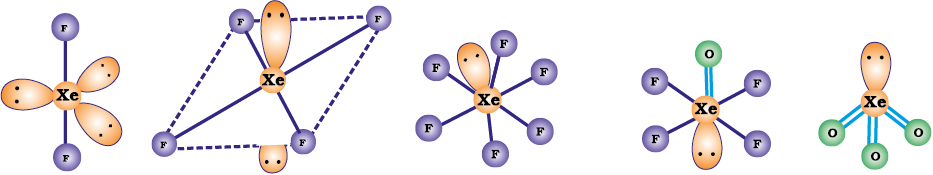
चित्र 7.9- (क) XeF2, (ख) XeF4, (ग) XeF6, (घ) XeOF4 तथा (च) XeO3 की संरचनाएं
उदाहरण 7.22
क्या XeF6 का जल अपघटन एक रेडॉक्स अभिक्रिया है?
हल
नहीं, जल अपघटन के उत्पाद XeOF4 तथा XeO2F2 हैं जिनमें सभी तत्वों की अॉक्सीकरण अवस्थाएं अभिक्रिया से पहले की अवस्था के समान हैं।
उपयोग
हीलियम अज्वलनशील तथा हल्की गैस है। अत: इसका उपयोग मौसम प्रेक्षण के लिए गुब्बारों में भरने के लिए किया जाता है। इसका उपयोग गैस शीतित नाभिकीय रिएक्टरों में भी किया जाता है। द्रव हीलियम (क्वथनांक 4.2 K) को निम्न ताप पर संचालित प्रयोगों के लिए निम्नतापीकारक के रूप मेंउपयोग किया जाता है। इसके अतिरिक्त द्रव हीलियम का उपयोग अतिचालक चुंबक को उत्पन्न तथा कायम रखने के लिए किया जाता है जो कि आधाुनिक NMR स्पेक्ट्रोमीटर तथा आधुनिक चिकित्सीय निदान में प्रयुक्त होने वाले चुंबकीय अनुनाद प्रतिबिंब (MRI) तंत्र के मुख्य अवयव हैं। आधुनिक गोताखोरी के उपकरणों में यह अॉक्सीजन के तनुकारी के रूप में उपयोग में आती है; क्योंकि रक्त में इसकी विलेयता बहुत कम है।
निअॉन का उपयोग विसर्जन ट्यूब तथा प्रदीप्त बल्बों में विज्ञापन प्रदर्शन हेतु किया जाता है। निअॉन बल्बों का उपयोग वनस्पति उद्यान तथा ग्रीनहाउस में किया जाता है।
अॉर्गन का उपयोग उच्चताप धातु कर्मीय प्रक्रमों में अक्रिय वातावरण उत्पन्न करने के लिए किया जाता है। (धातुओं तथा उपधातुओं के आर्क वेलि्ंडग में इसका उपयोग विद्युत बल्ब को भरने के काम आता है। प्रयोगशाला में इसका उपयोग वायु सुग्राही पदार्थाें के प्रबन्धन में भी किया जाता है।
जीनॉन तथा क्रिप्टॉन के कोई विशेष उपयोग नहीं हैं। इनका उपयोग विशेष अवसरों के लिए बनाए गए बल्बों में किया जाता है।
पाठ्यनिहित प्रश्न
7.32 हीलियम को गोताखोरी के उपकरणों में उपयोग क्यों किया जाता है?
7.33 निम्नलिखित समीकरण को संतुलित कीजिए- XeF6 + H2O → XeO2F2 + HF
7.34 रेडॉन के रसायन का अध्ययन करना कठिन क्यों था?
सारांश
आवर्त सारणी के वर्ग 13 से 18 वाले तत्व p-ब्लॉक की रचना करते हैं। जिनके संयोजकता कोश का इलेक्ट्रॉनिक विन्यास ns2np1-6 है। 13 व 14 वर्गों का अध्ययन कक्षा XI में किया गया। इस इकाई में शेष p-ब्लॉक वर्गाें का विवेचन किया गया है।
वर्ग 15 में पाँच तत्व, N, P, As Sb तथा Bi आते हैं। जिनका सामान्य इलेक्ट्रॉनिक विन्यास ns2np3 है। नाइट्रोजन इस वर्ग के अन्य तत्वों से, छोटे आकार, स्वयं तथा उच्च विद्युतऋणात्मकता वाले परमाणु जैसे O या C के साथ pπ - pπ बहुआबंधों के निर्माण तथा अपने संयोजकता कोश का विस्तार करने के लिए कक्षकों की अनुपलब्धता के कारण इस वर्ग के अन्य तत्वों से भिन्न है। वर्ग 15 के तत्व गुणों में क्रमिक परिवर्तिता दर्शाते हैं। ये अॉक्सीजन, हाइड्रोजन तथा हैलोजनों के साथ अभिक्रया करते हैं। ये दो महत्वपूर्ण अॉक्सीकरण अवस्थाएं + 3 तथा + 5 प्रदर्शित करते हैं। लेकिन +3 अॉक्सीकरण अवस्था, अक्रिय युगल प्रभाव के कारण भारी तत्वों में महत्वपूर्ण हो जाती है।
डाइनाइट्रोजन प्रयोगशाला तथा औद्योगिक दोनों स्तर पर बनाई जा सकती है। यह विभिन्न अॉक्सीकरण अवस्थाओं में आक्साइड निर्मित करती है जैसे, N2O, NO, N2O3, NO2, N2O4 तथा N2O5। इन अॉक्साइडों की अनुनादी संरचनाएं होती हैं तथा इनमें बहुआबंध होते हैं। व्यापक स्तर पर, आमोनिया हॉबर प्रक्रम द्वारा बनाई जाती है। HNO3 एक महत्वपूर्ण औद्योगिक रसायन है। यह प्रबल एकक्षारकी अम्ल है तथा शक्तिशाली अॉक्सीकारक है। HNO3 भिन्न-भिन्न परिस्थितियों (अवस्था) में धातुओं तथा अधातुओं से क्रिया कर NO अथवा NO2 बनाता है।
तत्व अवस्था में फ़ॉस्फ़ोरस P4 के रूप में पाया जाता है यह कई अपररूपों में पाया जाता है। यह हाइड्राइड, PH3 का बनाता है जो एक बहुत विषैली गैस है। यह दो प्रकार के हैलाइडों PX3 तथा PX5 बनाता है। PCl3, श्वेत फ़ॉस्फ़ोरस की शुष्क क्लोरीन के साथ अभिक्रिया द्वारा बनाया जाता है जबकि PCl5 फ़ॉस्फ़ोरस की SO2Cl2 के साथ अभिक्रिया द्वारा बनाया जाता है।फ़ॉस्फ़ोरस बहुत से अॉक्सोअम्ल बनाता है। इनकी क्षारकता में अंतर P-OH समूह की संख्या पर निर्भर करता है। अॉक्सोअम्ल जिनमें P-H आबंध होते हैं, अच्छे अपचायक होते हैं।
वर्ग 16 के तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास ns2np4 है। उच्चतम अॉक्सीकरण अवस्था यह +6 प्रदर्शित करते हैं। वर्ग 16 के तत्वों के भौतिक तथा रासायनिक गुणों में क्रमिक परिवर्तन प्रेक्षित होता है। प्रयोगशाला में, डाईअॉक्सीजन KClO3 को MnO2 की उपस्थिति में गरम करके बनाई जाती है। यह धातुओं के साथ अनेक अॉक्साइड निर्मित करती है। ओजोन (O3) अॉक्सीजन का अपररूप है, जो एक प्रबल अॉक्सीकारक है। सल्फर कई अपररूप बनाता है, इनमें से सल्फर के α- तथा β- रूप बहुत महत्वपूर्ण हैं। सल्फर, अॉक्सीजन के साथ संयोग कर SO2 तथा SO3 जैसे अॉक्साइड बनाता है। SO2 सल्फर तथा अॉक्सीजन के सीधे संयोग द्वारा बनाई जाती है। SO2 का उपयोग, H2SO4 के उत्पादन में किया जाता है। सल्फर अनेक अॉक्सोअम्ल बनाता है, जिनमें सबसे महत्वपूर्ण H2SO4 है। इसके संस्पर्श प्रक्रम द्वारा बनाया जाता है। यह निर्जलन तथा अॉक्सीकरण कर्मक है। इसका उपयोग बहुत से यौगिकों के उत्पादन में किया जाता है।
आवर्त सारणी के वर्ग 17 में F, Cl, Br, I तथा At हैं। यह तत्व अत्यधिक क्रियाशील होते हैं और इसके कारण यह केवल संयुक्त अवस्था में पाए जाते हैं। इन तत्वों की सामान्य अॉक्सीकरण अवस्था -1होती है। यद्यपि उच्चतम अॉक्सीकरण अवस्था +7 भी हो सकती है। यह भौतिक तथा रासायनिक गुणों में क्रमिक परिवर्तन प्रदर्शित करते हैं। यह आक्साइडों हाइड्रोजन हैलाइडों अंतराहैलोजन यौगिकों तथा अॉक्सोअम्लों का निर्माण करते हैं। क्लोरीन, HCl की KMnO4 के साथ अभिक्रिया द्वारा आसानी से प्राप्त की जाती है। HCl, NaCl को सांद्र H2SO4 के साथ गर्म करके प्राप्त की जाती है। हैलोजन परस्पर संयोग से X X1n (n = 1, 3, 5, 7) अंतराहैलोजनों का निर्माण करते है। जहाँ X1, X से हल्का होता है। हैलोजनों के कई अॉक्सोअम्ल ज्ञात हैं। इन अॉक्सोअम्लों की संरचनाओं में हैलोजन केंद्रीय परमाणु है। जो सभी स्थितियों में एक - OH आबंध के साथ X-OH के रूप में आबंधित होते हैं। कुछ स्थितियों में X = O आबंध भी पाए जाते हैं।
आवर्त सारणी के वर्ग 18 में उत्कृष्ट गैसें आती हैं। हीलियम को छोड़कर जिसका विन्यास है 1s2, इनके संयोजकता कोश का इलेक्ट्रॉनिक विन्यास ns2 np6 होता है। रेडॉन को छोड़कर सभी गैसें वायुमंडल में पाई जाती हैं। रेडॉन, रेडियम 226Ra के विघटन उत्पाद के रूप में प्राप्त होती है।
बाह्य कोश का अष्टक पूर्ण भरित होने के कारण इनकी यौगिक बनाने की प्रवृत्ति कम होती है। केवल कुछ परिस्थितियों में जिनॉन के, फ्लुओरीन तथा अॉक्सीजन के साथ यौगिक भली-भाँति अभिलक्षणित हैं। इन गैसों के कई उपयोग हैं। अॉर्गन का उपयोग अक्रिय वातावरण देने में, हीलियम का उपयोग मौसम विज्ञान संबंधी जानकारी प्राप्त करने के लिए प्रयुक्त गुब्बारों को भरने में तथा निअॉन का उपयोग विसर्जन नली और प्रतिदीप्ति बल्बों में किया जाता है।
अभ्यास
7.2 नाइट्रोजन की क्रियाशीलता फॉस्फोरस से भिन्न क्यों है?
7.3 वर्ग 15 के तत्वों की रासायनिक क्रियाशीलता की प्रवृत्ति की विवेचना कीजिए।
7.4 NH3 हाइड्रोजन बंध बनाती है। परंतु PH3 नहीं बनाती क्यों?
7.5 प्रयोगशाला में नाइट्रोजन कैसे बनाते हैं? संपन्न होने वाली अभिक्रिया के रासायनिक समीकरणों को लिखिए।
7.6 अमोनिया का औद्योगिक उत्पादन कैसे किया जाता है?
7.7 उदाहरण देकर समझाइए कि कॉपर धातु HNO3 के साथ अभिक्रिया करके किस प्रकार भिन्न उत्पाद दे सकती है?
7.8 NO2 तथा N2O5 के अनुनादी संरचनाओं को लिखिए।
7.9 HNH कोण का मान, HPH, HAsH तथा HSbH कोणों की अपेक्षा अधिक क्यों है?
(संकेत - NH3 में sp3 संकरण के आधार तथा हाइड्रोजन और वर्ग के दूसरे तत्वों के बीच केवल s-p आबंधन के द्वारा व्याख्या की जा सकती है।)
7.10 R3P = O है पाया जाता है जबकि R3N = O नहीं क्यों (R= एेल्किल समूह)?
7.11 समझाइए कि क्यों NH3 क्षारकीय है जबकि BiH3 केवल दुर्बल क्षारक है।
7.12 नाइट्रोजन द्विपरमाणुक अणु के रूप में पाया जाता है तथा फॉस्फोरस P4 के रूप में। क्यों?
7.13 श्वेत फॉस्फोरस तथा लाल फ़ॉस्फ़ोरस के गुणों की मुख्य भिन्नताओं को लिखिए।
7.14 फॉस्फोरस की तुलना में नाइट्रोजन शृंखलन गुणों को कम प्रदर्शित करता है, क्यों?
7.15 H3PO3 की असमानुपातन अभिक्रिया दीजिए।
7.16 क्या PCl5 अॉक्सीकारक और अपचायक दोनों कार्य कर सकता है? तर्क दीजिए।
7.17 O, S, Se, Te तथा Po को इलेक्ट्रॉनिक विन्यास, अॉक्सीकरण अवस्था तथा हाइड्राइड निर्माण के संदर्भ में आवर्त सारणी के एक ही वर्ग में रखने का तर्क दीजिए।
7.18 क्यों डाइअॉक्सीजन एक गैस है जबकि सल्फर एक ठोस है?
7.19 यदि O → O- तथा O → O2- के इलेक्ट्रॉन लब्धि एन्थैल्पी मान पता हो, जो क्रमश: 141 तथा 702kJ mol-1 है, आप कैसे स्पष्ट कर सकते हैं कि O2- स्पीशीज वाले अॉक्साइड अधिक बनते हैं न कि O- वाले?
(संकेत - यौगिकों के बनने में जालक ऊर्जा कारक को ध्यान में रखिए)
7.20 कौन से एरोसोल्स ओजोन हैं?
7.21 संस्पर्श प्रक्रम द्वारा H2SO4 के उत्पादन का वर्णन कीजिए।
7.22 SO2 किस प्रकार से एक वायु प्रदूषक है?
7.23 हैलोजन प्रबल अॉक्सीकारक क्यों होते हैं?
7.24 स्पष्ट कीजिए कि फ्लुओरीन केवल एक ही अॉक्सोअम्ल, HOF क्यों बनाता है।
7.25 व्याख्या कीजिए कि क्यों लगभग एक समान विद्युत्ऋणात्मकता होने के पश्चात् भी नाइट्रोजन हाइड्रोजन आबंध निर्मित करता है, जबकि क्लोरीन नहीं।
7.26 ClO2 के दो उपयोग लिखिए।
7.27 हैलोजन रंगीन क्यों होते हैं?
7.28 जल के साथ F2 तथा Cl2 की अभिक्रियाएं लिखिए।
7.29 आप HCl से Cl2 तथा Cl2 से HCl को कैसे प्राप्त करेंगे? केवल अभिक्रियाएं लिखिए।
7.30 एन-बार्टलेट Xe तथा PtF6 के बीच अभिक्रिया कराने के लिए कैसे प्रेरित हुए?
7.31 निम्नलिखित में फ़ॉस्फ़ोरस की अॉक्सीकरण अवस्थाएं क्या हैं?
(i) H3PO3 (ii) PCl3 (iii) Ca3P2 (iv) Na3PO4 (v) POF3 ?
7.32 निम्नलिखित के लिए संतुलित समीकरण दीजिए।
(i) जब NaCl को MnO2 की उपस्थिति में सांद्र सल्फ्यूरिक अम्ल के साथ गरम किया जाता है।
(ii) जब क्लोरीन गैस को NaI के जलीय विलयन में से प्रवाहित किया जाता है।
7.33 जीनॉन फ्लुओराइड, XeF2, XeF4, तथा XeF6 कैसे बनाए जाते हैं?
7.34 किस उदासीन अणु के साथ ClO-, समइलेक्ट्रानी है? क्या एक अणु लुइस क्षारक है?
7.35 निम्नलिखित प्रत्येक समुच्चय को सामने लिखे गुणों के अनुसार सही क्रम में व्यवस्थित कीजिए-
(क) F2, Cl2, Br2, I2 - आबंध वियोजन एन्थैल्पी बढ़ते क्रम में
(ख) HF, HCl, HBr, HI - अम्ल सामर्थ्य बढ़ते क्रम में
(ग) NH3, PH3, AsH3, SbH3, BiH3 - क्षारक सामर्थ्य बढ़ते क्रम में
7.36 निम्नलिखित में से कौन सा एक अस्तित्व में नहीं है?
(a) XeOF4 (b) NeF2 (c) XeF2 (d) XeF6
7.37 उस उत्कृष्ट गैस स्पीशीज का सूत्र देकर संरचना की व्याख्या कीजिए जो कि इनके साथ समसंरचनीय है-
(a) ICl4- (b) IBr2- (c) BrO3-
7.38 उष्कृष्ट गैसों के परमाण्विक आकार तुलनात्मक रूप से बड़े क्यों होते हैं?
7.39 निअॉन तथा अॉर्गन गैसों के उपयोग सूचीबद्ध कीजिए।
कुछ पाठ्यनिहित प्रश्नों के उत्तर
7.1 केंद्रीय परमाणु की जितनी उच्च धनात्मक अॉक्सीकरण अवस्था होती है। उतनी ही अधिक इसकी ध्रुवण क्षमता भी होती है जिसके कारण केंद्रीय परमाणु और अन्य परमाणु के बीच बने आबंध में सहसंयोजक लक्षण बढ़ते जाते हैं।
7.2 क्योंकि BiH3 वर्ग 15 के हाइड्राइडों में सबसे कम स्थायी होता है।
7.3 क्योंकि प्रबल pπ - pπ अतिव्यापन के कारण त्रिबंध N≡N बनता है।
7.6 N2O5 की संरचना से पुष्टि होती है कि N2 की सहसंयोजकता 4 है।
7.7(a) ये दोनों ही sp3 संकरित हैं। PH4+ में चारों कक्षक आबंधित होते हैं जबकि PH में P पर एक एकाकी इलेक्ट्रॉन युगल है जो कि एकाकी युगल - आबंध युगल प्रतिकर्षण के लिए उत्तरदायी है जिससे आबंध कोण 109º28' से कम होता है।
7.10 PCl5 + H2O → POCl3 + 2HCl
7.11 H3PO4 अणु में तीन P-OH समूह उपस्थित है अत: इसकी क्षारकता 3 है।
7.15 अॉक्सीजन O2 के छोटे आकार और उच्च विद्युत्ऋणात्मकता के कारण जल के अणु हाइड्रोजन आबंध से अधिक संगुणित होते हैं। इसके परिणामस्वरूप यह द्रव अवस्था में रहता है।
7.21 अनुनाद संरचनाओं के कारण दोनों S-O आबंध सहसंयोजी हैं तथा समान सामर्थ्य वाले हैं।
7.25 मुख्यतया H3O+ और HSO-4 में प्रथम आयनन के कारण H2SO4 जल में एक प्रबल अम्ल है। HSO-4 का H3O+ तथा SO4 2- में आयनन नगण्य है अत:  ।
।
7.31 सामान्यत: अंतराहैलोजन यौगिक हैलोजन की अपेक्षा अधिक क्रियाशील होते हैं। इसका कारण X-X1 आबंध की अपेक्षा X-X1 आबंध का दुर्बल होना है। अत: ICI, I2 से अधिक क्रियाशील है।
7.34 रेडॉन रेडियोसक्रिय है तथा इसकी अर्धायु कम होती है जिससे रेडॉन के रसायन का अध्ययन कठिन हो जाता है।