Table of Contents
एकक
10
हैलोएेल्केन तथा हैलोएेरीन
हैलोजनयुक्त यौगिक पर्यावरण में लंबे समय तक बने रहते हैं क्योंकि यह मृदा के जीवाणुओं द्वारा भंजन के प्रति प्रतिरोधी होते हैं।
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप -
• IUPAC प्रणाली की नामपद्धति से हैलोएेल्केनों तथा हैलोएेरीनों की दी गई संरचना का नामकरण कर सकेंगे;
• हैलोएेल्केनों तथा हैलोएेरीनों के विरचन में प्रयुक्त होने वाली अभिक्रियाओं का वर्णन कर सकेंगे तथा इनके द्वारा दी जाने वाली विभिन्न अभिक्रियाओं को समझ सकेंगे;
• विभिन्न प्रकार की अभिक्रियाओं तथा हैलोएेल्केनों एवं हैलोएेरीनों की संरचनाओं को सहसंबंधित कर सकेंगे;
• अभिक्रिया की क्रियाविधि को समझने में त्रिविमरसायन का उपयोग कर सकेंगे;
• कार्बधात्विक यौगिकों के अनुप्रयोगों का महत्व समझ सकेंगे;
• पॉलिहैलोजन यौगिकों के पर्यावरण पर प्रभावों को अतिदीप्त कर सकेंगे।
एेलिफैटिक अथवा एेरोमैटिक हाइड्रोकार्बन के हाइड्रोजन परमाणु (अथवा परमाणुओं) का हैलोजन परमाणु (अथवा परमाणुओं) द्वारा प्रतिस्थापन होने से क्रमशः एेल्किल हैलाइड (हैलोएेल्केन) तथा एेरिल हैलाइड (हैलोएेरीन) बनते हैं। हैलोएेल्केनों में हैलोजन परमाणु एेल्किल समूह के sp3 संकरित कार्बन परमाणु (परमाणुओं) से जुड़ा रहता है जबकि हैलोएेरीनों में हैलोजन परमाणु एेरिल समूह के sp2 संकरित कार्बन परमाणु (परमाणुओं) से जुड़ा रहता है। बहुत से हैलोजनयुक्त कार्बनिक यौगिक प्रकृति में मिलते हैं तथा इनमें से कुछ चिकित्सकीय रूप से उपयोगी होते हैं। इस वर्ग के यौगिकों के उपयोगों का विस्तार उद्योगों में तथा दैनिक जीवन में बहुत बड़ा है। इनका उपयोग अपेक्षाकृत अध्रुवीय यौगिकों के लिए विलायक के रूप में तथा अनेक प्रकार के कार्बनिक यौगिकों के संश्लेषण के लिए प्रारंभिक पदार्थ के रूप में होता है। सूक्ष्मजीवियों द्वारा उत्पादित क्लोरैम्फेनिकॉल, जो कि क्लोरीनयुक्त प्रतिजैविक (एेन्टिबायोटिक) है, आंत्रज्वर (टाइफाइड) के इलाज में अत्यधिक प्रभावी होती है। हमारे शरीर में आयोडीनयुक्त हार्मोन, थाइरॉक्सिन उत्पन्न होता है जिसकी कमी से गलगंड (घेंघा) नामक रोग हो जाता है। संश्लेषित हैलोजन यौगिक जैसे, क्लोरोक्वीन का उपयोग मलेरिया के उपचार में होता है। हैलोथेन का उपयोग शल्य चिकित्सा में निश्चेतक के रूप में होता है। कुछ पूर्णतः फ्लुओरीनीकृत यौगिकों को शल्य चिकित्सा में प्रभावी रक्त प्रतिस्थापी के रूप में देखा जा रहा है।
इस एकक में आप कार्बहैलोजन यौैगिकों के विरचन की प्रमुख विधियों, भौतिक एवं रासायनिक गुणों तथा उपयोगों का अध्ययन करेंगे।
१०.१ वर्गीकरण
10.1.1 हैलोजन परमाणुओं की संख्या के आधार पर
हैलोएेल्केनों तथा हैलोएेरीनों को निम्न प्रकार से वर्गीकृत किया जा सकता है–
संरचना में उपस्थित एक, दो अथवा अधिक हैलोजन परमाणुओं की संख्या के आधार पर इन्हें मोनो, डाइ अथवा पॉलिहैलोजन (ट्राइ-टेट्रा-आदि) में वर्गीकृत किया जा सकता है। उदाहरणार्थ–

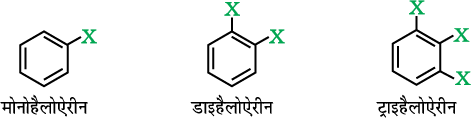
मोनो हैलोयौगिकों को, उस कार्बन परमाणु के संकरण के आधार पर पुनः वर्गीकृत किया जा सकता हैे जिससे हैलोजन परमाणु आबंधित होता है। जैसा कि नीचे वर्णित किया गया है। इस वर्ग में सम्मिलित हैं—
10.1.2 sp3 C–X आबंध युक्त यौगिक (X = F, Cl, Br, I)
(क) एेल्किल हैलाइड अथवा हैलोएेल्केन (R–X)
एेल्किल हैलाइडों में हैलोजन परमाणु एेल्किल समूह (R) से आबंधित रहता है। ये एक सजातीय श्रेणी बनाते हैं जिसे CnH2n+1X से प्रदर्शित करते हैं। इन्हें उस कार्बन परमाणु की प्रकृति के आधार पर पुनः प्राथमिक, द्वितीयक अथवा तृतीयक में वर्गीकृत किया गया है। जिससे हैलोजन परमाणु आबंधित होता है। यदि एेल्किल हैलाइड में हैलोजन प्राथमिक कार्बन से जुड़ा हो तो उसे प्राथमिक एेल्किल हैलाइड अथवा 1° एेल्किल हैलाइड कहते हैं। इसी प्रकार से यदि हैलोजन द्वितीयक या तृतीयक कार्बन परमाणु से जुड़ा हो तो उसे क्रमशः द्वितीयक (अथवा 2°) और तृतीयक (अथवा 3°) एेल्किल हैलाइड कहते हैं।
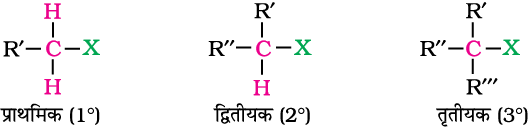
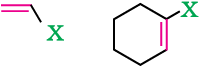
(ख) एेलिलिक हैलाइड
यह वे यौगिक होते हैं जिनमें हैलोजन परमाणु कार्बन–कार्बन द्विक आबंध (C=C) के समीपवर्ती sp3 संकरित कार्बन परमाणु से आबंधित रहता है अर्थात् एक एेलिलिक कार्बन से आबंεंधत होता है।

(ग) बेन्जिलिक हैलाइड
इस प्रकार के यौगिकों में हैलोजन परमाणु एेरोमैटिक वलय से जुड़े sp3 संकरित कार्बन परमाणु से आबंधित रहता है।

इस वर्ग में शामिल हैं–
10.1.3 sp2 C–X आबंधयुक्त यौगिक
(क) वाइनिलिक हैलाइड
इस प्रकार के यौगिकों में हैलोजन परमाणु कार्बन-कार्बन द्विक् आबंध (C = C) के sp2 संकरित कार्बन परमाणु से सीधे जुड़ा रहता है।
(ख) एेरिल हैलाइड
इस प्रकार के यौगिकों में हैलोजन परमाणु एक एेरोमैटिक वलय के sp2 संकरित कार्बन परमाणु से सीधे जुड़ा रहता है।
१०.२ नामपद्धति
हैलोजन यौगिकों का वर्गीकरण सीखने के पश्चात् आइए अब हम सीखेें कि इन्हें नाम कैसे दिया जाता है। एेल्किल हैलाइडों के सामान्य नाम को व्युत्पित करने के लिए एेल्किल समूह का नाम लिखने के पश्चात हैलाइड का नाम लिखा जाता है। नामकरण की IUPAC पद्धति में एेल्किल हैलाइड का नामकरण हैलोप्रतिस्थापी हाइड्रोकार्बन के रूप में किया जाता हैं। एक हैलोजन वाले बेन्जीन के व्युत्पन्नों के सामान्य और IUPAC नाम एक ही होते हैं। डाइहैलोजन व्युत्पन्नों के लिए सामान्य प्रणाली में o-, m-,तथा p- पूर्वलग्न का उपयोग करते हैं जबकि जैसा आप कक्षा XI के एकक-12 में जान चुके हैं, IUPAC पद्धति में इसके लिए 1,2; 1,3 तथा 1,4 संख्याओं का उपयोग करते हैं।

समान हैलोजन परमाणुयुक्त डाइहैलोएेल्केनों को एेल्किलिडीन या एेल्किलीन डाइहैलाइड कहते हैं। यदि समान हैलोजन परमाणुयुक्त डाइहैलो यौगिक में दोनों हैलोजन परमाणु शृंखला के एक ही कार्बन परमाणु पर उपस्थित हों तो इसे जेम डाइहैलाइड या जैमिनल डाइहैलाइड कहते हैं। यदि हैलोजन परमाणु शृंखला के दो निकटवर्ती कार्बन परमाणुओं पर उपस्थित हों तो उन्हें विसिनल हैलाइड कहा जाता है। सामान्य नामकरणपद्धति में जेम-डाइहैलाइड को एेल्किलिडीन हैलाइड तथा विस–डाइहैलाइड को एेल्किलीन डाइहैलाइड के रूप में नामित करते हैं। IUPAC पद्धति में इन्हें डाइहैलोएेल्केन के रूप में नामित करते हैं।

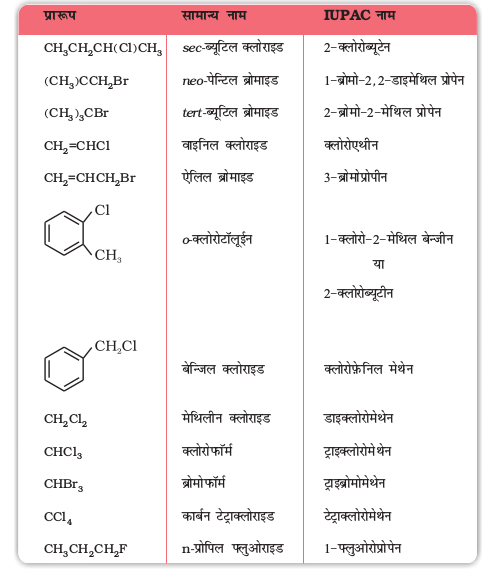
कुछ प्रमुख हैलो यौगिकों के उदाहरण सारणी 10.1 में दिए गए हैं।
सारणी 10.1– कुछ हैलाइडों के सामान्य एवं IUPAC नाम
उदाहरण 10.1
C5H11Br अणुसूत्र वाले आठ संरचनात्मक समावयवियाें की संरचनाएं बनाइए।
I U P A C पद्धति के अनुसार सभी समावयवियों के नाम दीजिए तथा उन्हें प्राथमिक, द्वितीयक एवं तृतीयक ब्रोमाइडों के रूप में वर्गीकृत कीजिए।
हल

उदाहरण 10.2

हल
(i) 4-ब्रोमोपेन्ट-2-ईन (ii) 3-ब्रोमो-2-मेथिलब्यूट-1-ईन
(iii) 4-ब्रोमो-3-मेथिलपेन्ट-2-ईन (iv) 1-ब्रोमो-2-मेथिलब्यूट-2-ईन
(v) 1-ब्रोमोब्यूट-2-ईन (vi) 3-ब्रोमो-2-मेथिल प्रोपीन
पाठ्यनिहित प्रश्न
10.1 निम्नलिखित यौगिकों की संरचनाएं लिखिए—
(i) 2-क्लोरो-3-मेथिलपेन्टेन
(ii) 1-क्लोरो-4-एथिलसाइक्लोहेक्सेन
(iii) 4-तृतीयक-ब्यूटिल-3-आयडोहेप्टेन
(iv) 1,4-डाइब्रोमोब्यूट-2-ईन
(v) 1-ब्रोमो-4-द्वितीयक-ब्यूटिल-2-मेथिलबेन्ज़ीन
१०.३ C-X आबंध की प्रकृति
हैलोजन परमाणु, कार्बन परमाणु की तुलना में अधिक विद्युतऋणात्मक होता है अतः एेल्किल हैलाइड का कार्बनहैलोजन आबंध ध्रुवित हो जाता है। इससे कार्बन परमाणु पर आंशिक धनावेश तथा हैलोजन परमाणु पर आंशिक ऋणावेश आ जाता है।

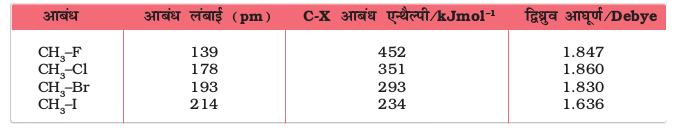
आवर्त सारणी में वर्ग में ऊपर से नीचे की ओर जाने पर हैलोजन परमाणु का आकार बढ़ता जाता है, अतः फ्लुओरीन परमाणु सबसे छोटे आकार का तथा आयोडीन परमाणु सबसे बड़े आकार का होता है। परिणामतः कार्बन-हैलोजन आबंध की लंबाई C—F से C—I तक बढ़ती जाती है। सारणी 10.2 में कुछ विशिष्ट आबंध लंबाइयाँ, आबंध एन्थैल्पी तथा द्विध्रुव आघूर्ण दिए गए हैं।
१०.४ एेल्किल हैलाइडों के विरचन की विधियाँ
10.4.1 एेल्कोहॉलों से
एेल्किल हैलाइड, एेल्कोहॉल से सर्वोत्तम प्रकार से बनाए जा सकते हैं जो आसानी से प्राप्त की जा सकती हैं। सांद्र हैलोजन अम्लों, फ़ास्फ़ोरस हैलाइड अथवा थायोनिल क्लोराइड के साथ अभिक्रिया से एेल्कोहॉल का हाइड्रॉक्सिल समूह हैलोजन द्वारा प्रतिस्थापित हो जाता है। इनमें से थायोनिल क्लोराइड को प्राथमिकता दी जाती है क्योंकि इस अभिक्रिया में एेल्किल हैलाइडों के साथ दो गैसें SO2 तथा HCl बनती हैं। दोनों गैसीय उत्पाद आसानी से निकल सकने वाली गैसें हैं अतः अभिक्रिया में शुद्ध एेल्किल हैलाइड प्राप्त होता है। प्राथमिक एवं द्वितीयक एेल्कोहॉल की HCl से अभिक्रिया में ZnCl2 उत्प्रेरक की आवश्यकता होती है। तृतीयक एेल्कोहॉल की अभिक्रिया कमरे के ताप पर केवल सांद्र HCl के साथ हिलाने पर संपन्न हो जाती है। एेल्किल ब्रोमाइड के विरचन के लिए इसे HBr (48%) के साथ लगातार उबाला जाता है। 95 प्रतिशत अॉर्थोफ़ास्फ़ोरिक अम्ल में एेल्कोहॉल को सोडियम अथवा पोटैशियम आयोडाइड के साथ गरम करके R–I की अच्छी लब्धि प्राप्त की जा सकती है। हैलोअम्लों से एेल्किल हैलाइड की अभिक्रियाशीलता का क्रम 3° > 2° > 1° होता है। फ़ास्फ़ोरस ट्राइब्रोमाइड तथा ट्राइआयोडाइड को सामान्यतः लाल फ़ास्फ़ोरस की क्रमशः ब्रोमीन तथा आयोडीन के साथ अभिक्रिया द्वारा स्वस्थाने यानी अभिक्रिया मिश्रण में ही उत्पन्न किया जाता है।

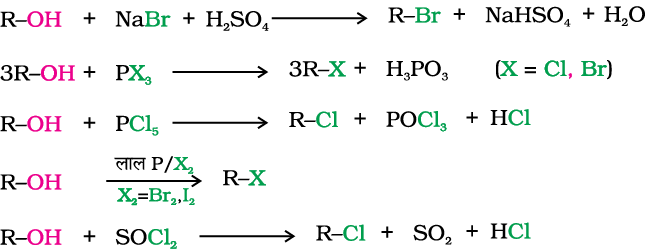
एेल्किल क्लोराइड का विरचन एेल्कोहॉल में शुष्क हाइड्रोजन क्लोराइड गैस को प्रवाहित करके अथवा सांद्र जलीय हैलोजन अम्लों के साथ एेल्कोहॉल के मिश्रण को गरम करके किया जा सकता है। एेरिल हैलाइड के विरचन के लिए उपरोक्त विधियाँ उपयुक्त नहीं हैं; क्योंकि फ़ीनॉल में कार्बन-अॉक्सीजन आबंध में आंशिक द्विआबंध के गुण होने के कारण यह एकल आबंध से अधिक मज़बूत होता है अतः इसे एकल आबंध की तुलना में तोड़ना कठिन होता है। (एकक 11, कक्षा XI)।
10.4.2 हाइड्रोकार्बनों से
(i) एेल्केनों से मुक्त मूलक हैलोजनन द्वारा
एेल्केनों के मुक्त मूलक क्लोरीनन अथवा ब्रोमीनन में समावयवी मोनो तथा पॉलिहैलोएेल्केनों का जटिल मिश्रण प्राप्त होता है, जिसे शुद्ध यौगिकों में पृथक् करना कठिन होता है। परिणामतः किसी भी एक यौगिक की लब्धि कम होती है (एकक 13, कक्षा XI)।
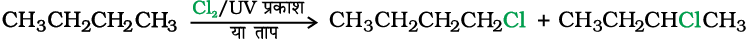
(ii) एेल्कीनों से
(क) हाइड्रोजन हैलाइड के संयोजन या योगज द्वारा— हाइड्रोजन क्लोराइड, हाइड्रोजन ब्रोमाइड अथवा हाइड्रोजन आयोडाइड से अभिक्रिया करने पर एेल्कीन संगत एेल्किल हैलाइड में परिवर्तित हो जाती हैं।

प्रोपीन दो प्रकार के उत्पाद देती है परंतु मार्काेनीकॉफ के नियमानुसार एक उत्पाद प्रमुख होता है। (एकक 13, कक्षा XI)
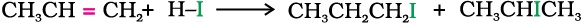
अल्प मुख्य
(ख) हैलोजन के संयोजन द्वारा—
CCl4 में घुली ब्रोमीन को एेल्कीन में डालने से ब्रोमीन का लाल रंग विलुप्त हो जाता है। यह किसी अणु में द्विआबंध की पहचान करने की एक महत्वपूर्ण प्रयोगशाला विधि है। इस संयोजन के परिणामस्वरूप संनिधि डाइब्रोमाइड (Vic-dibromide) का संश्लेषण होता है जो कि रंगहीन होता है। (एकक 13, कक्षा XI)।

10.4.3 हैलोजन विनिमय द्वारा
एेल्किल आयोडाइडों का विरचन प्रायः एेल्किल क्लोराइडों/ब्रोमाइडों की शुष्क एेसीटोन में NaI के साथ अभिक्रिया से होता है। इस अभिक्रिया को फिंकेल्स्टाइन अभिक्रिया कहते हैं।

इस प्रकार प्राप्त NaCl तथा NaBr शुष्क एेसीटोन में अवक्षेपित हो जाते हैं तथा यह ले-शातैलिए के नियमानुसार अग्र अभिक्रिया को सुगम बना देता है।
धात्विक फ्लुओराइड जैसे AgF, Hg2F2, CoF2 अथवा SbF3 की उपस्थिति में एेल्किल क्लोराइड/ब्रोमाइड को गरम करके उपलब्ध करना, एेल्किल फ्लुओराइडों के संश्लेषण का सर्वोत्तम तरीका है। इस अभिक्रिया को स्वाट्ρस अभिक्रिया कहते हैं।

उदाहरण 10.3
हल
दिए गए अणु में चार विभिन्न प्रकार के हाइड्रोजन परमाणु हैं। इन हाइड्रोजन परमाणुओं के प्रतिस्थापन से निम्नलिखित चार मोनोक्लोरो व्युत्पन्न प्राप्त होंगे–
(CH3)2CHCH2CH2Cl, (CH3)2CHCH(Cl) CH3,
(CH3)2C(Cl)CH2CH3, CH3CH(CH2Cl)CH2CH3
१०.५ हैलोएरीनों का विरचन
(i) हाइड्रोकार्बनों से इलेक्ट्रॉनरागी प्रतिस्थापन द्वारा
एेरिल क्लोराइडों तथा ब्रोमाइडों का विरचन, आयरन या आयरन (III) क्लोराइड अथवा किसी अन्य लूईस अम्ल उत्प्रेरक की उपस्थिति में एेरीनों के क्लोरीन अथवा ब्रोमीन द्वारा इलेक्ट्रॉनरागी प्रतिस्थापन द्वारा आसानी से किया जा सकता है।
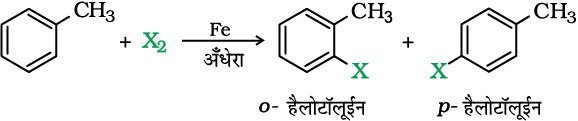
अॉर्थो तथा पैरा समावयवों को, उनके गलनांकों में अत्यधिक अंतर होने के कारण सुगमतापूर्वक पृथक् किया जा सकता है। आयोडीन के साथ अभिक्रिया उत्क्रमणीय होती है तथा इस अभिक्रिया में उत्पन्न HI को अॉक्सीकृत करने के लिए अॉक्सीकरण कर्मक (HNO3, HIO3) की आवश्यकता होती है। फ्लुओरीन की अत्यधिक क्रियाशीलता के कारण इस विधि द्वारा फ्लुओरीन युक्त यौगिकों का विरचन नहीं किया जाता।
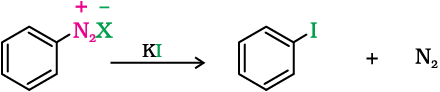
(ii) एेमीनों से सैन्डमायर-अभिक्रिया द्वारा
जब ठंडे जलीय खनिज अम्ल में घुली अथवा निलंबित किसी प्राथमिक एेमीन को सोडियम नाइट्राइट के साथ अभिकृत किया जाता है तो डाइएेज़ोनियम लवण बनते हैं (एकक-13, कक्षा 12)। ताज़ा बने डाइएेज़ोनियम लवण तथा क्यूप्रस क्लोराइड अथवा क्यूप्रस ब्रोमाइड के विलयन को मिलाने पर डाइज़ोनियम समूह – Cl अथवा - Br के द्वारा प्रतिस्थापित हो जाता है।


आयोडीन द्वारा डाइएेज़ोनियम समूह के प्रतिस्थापन के लिए क्यूप्रस हैलाइड की उपस्थिति आवश्यक नहीं होती तथा इसे सामान्यतः डाइएेज़ोनियम लवण तथा पोटैशियम आयोडाइड के विलयन को एक साथ हिलाकर किया जाता है।
उदाहरण 10.4 निम्नलिखित अभिक्रियाओं के उत्पाद लिखिए–

हल

पाठ्यनिहित प्रश्न
10.2 ऐल्कोहॉल तथा Kl की अभिक्रिया में सल्फ्रयूरिक अम्ल का उपयोग क्यों नहीं करते?
10.3 प्रोपेन के विभिन्न डाइहैलोजन व्युत्पन्नाें की संरचना लिखिए।
10.4 C5H12 अणुसूत्र वाले समावयवी ऐल्केनो में से उसको पहचानिए जो प्रकाशरासायनिक क्लोरीनन पर देता है -
(I) केवल एक मोनोक्लोराइड
(II) तीन समावयवी मोनोक्लोराइड
(III) चार समावयवी मोनोक्लोराइड।
10.5 निम्नलिखित प्रत्येक अभिक्रिया के मुख्य मोनोहैलो उत्पाद की सरंचना बनाइए।
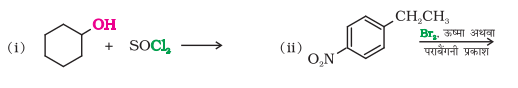
१०.६ भौतिक गुण
शुद्ध अवस्था में एेल्किल हैलाइड रंगहीन यौगिक होते हैं परंतु ब्रोमाइड तथा आयोडाइड, प्रकाश के संपर्क में आने पर रंगीन हो जाते हैं। अनेक वाष्पशील हैलोजन युक्त यौगिक सुगंधमय होते हैं।
गलनांक एवं क्वथनांक
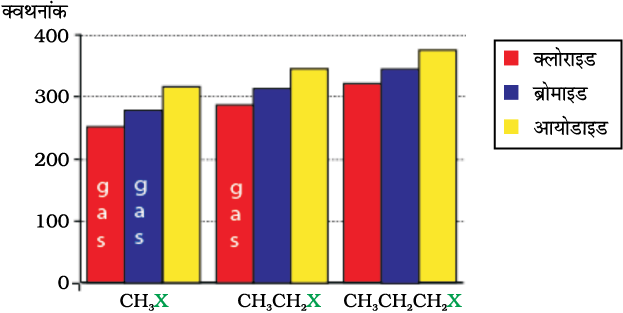
चित्र 10-1 कुछ ऐल्किल हैलाइडों के क्वथनांकों की तुलना
मेथिल क्लोराइड, मेथिल ब्रोमाइड,एथिल क्लोराइड तथा कुछ क्लोरोफ्लुओरोमेथेन कमरे के ताप पर गैस के रूप में होते हैं जबकि उच्च सदस्य द्रव अथवा ठोस होते हैं। जैसा कि हम जानते हैं, कार्बनिक हैलोजन यौगिकों के अणु सामान्यतः ध्रुवीय होते हैं। उच्च ध्रुवता एवं जनक हाइड्रोकार्बन की तुलना में उच्च आण्विक द्रव्यमान होने के कारण हैलोजन व्युत्पन्नों में प्रबल अंतराआण्विक आकर्षण बल (द्विध्रुव-द्विध्रुव तथा वान्डरवाल्स) होते हैं। यही कारण है कि क्लोराइडों, ब्रोमाइडों तथा आयोडाइडों के क्वथनांक समतुल्य द्रव्यमान वाले हाइड्रोकार्बनों के क्वथनांकों की अपेक्षा महत्वपूर्ण रूप से अधिक होते हैं।
अणुओं का आकार बड़ा होने पर तथा अधिक संख्या में इलेक्ट्रॉन उपस्थित होने पर आकर्षण बल और अधिक प्रबल हो जाते हैं। चित्र 10.1 में विभिन्न हैलाइडों के क्वथनांकों में परिवर्तन का प्रारूप दिया गया है। समान एेल्किल समूह के लिए एेल्किल हैलाइडों के क्वथनांकों के घटने का क्रम – RI > RBr > RCl > R–F है। एेसा हैलोजन परमाणु के आकार तथा द्रव्यमान में वृद्धि होने से वान्डरवाल्स बलों के परिमाण में वृद्धि होने के कारण होता है।
समावयवी हैलोएेल्केनों में शृंखलन बढ़ने के साथ क्वथनांक कम होते जाते हैं। (एकक 13, कक्षा XI)। उदाहरणार्थ, निम्नलिखित तीन समावयवियों में से 2-ब्रोमो-2-मेथिलप्रोपेन का क्वथनांक न्यूनतम होता है।

समावयवी डाइहैलोबेन्जीन के क्वथनांक लगभग समान होते हैं परंतु पैरा-समावयवी आर्थो-तथा मेटा-समावयवियों की अपेक्षा उच्च गलनांकी होते हैं। एेसा पैरा समावयवियों की सममिति के कारण होता है, जिसके कारण यह आर्थो तथा मेटा समावयवियों की तुलना में क्रिस्टल जालक में अधिक समायोजित होते हैं।

घनत्व
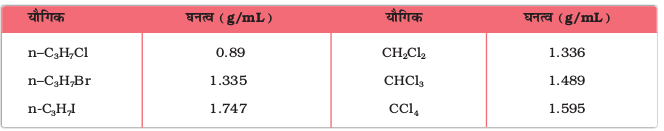
हाइड्रोकार्बनों के ब्रोमो, आयडो तथा पॉलिक्लोरो व्युत्पन्न जल की तुलना में भारी होते हैं। कार्बन परमाणुओं की संख्या, हैलोजन परमाणुओं की संख्या तथा हैलोजन परमाणु का द्रव्यमान बढ़ने से घनत्व बढ़ता जाता है (सारणी 10.3)।
विलेयता
हैलोएेल्केन जल में बहुत अल्प विलेय होते हैं। हैलोएेल्केन को जल में घोलने के लिए ऊर्जा की आवश्यकता होती है जिससे कि हैलोएेल्केन के अणुओं के मध्य उपस्थित आकर्षण को तथा जल के अणुओं के मध्य हाइड्रोजन आबंध को तोड़ा जा सके। हैलोएेल्केन तथा जल में अणुओं के मध्य नए आकर्षण बलों के बनने से कम ऊर्जा निर्गमित होती है, क्योंकि ये आकर्षण बल जल में उपस्थित मूल हाइड्रोजन आबंधों जितने प्रबल नहीं होते। परिणामस्वरूप, हैलोएेल्केन की जल में विलेयता बहुत कम होती है। हालाँकि, हैलोएेल्केनों की प्रवृत्ति कार्बनिक विलायकों में घुलने की होती है क्योंकि हैलोएेल्केन तथा विलायक अणु के मध्य बने नए अंतराआण्विक आकर्षण बलों की सामर्थ्य लगभग उतनी ही है जितनी की टूटने वाले अलग-अलग हैलोएेल्केन तथा विलायक अणुओं के मध्य होती है।
पाठ्यनिहित प्रश्न
10.6 निम्नलिखित यौगिकों को क्वथनांकों के बढ़ते हुए क्रम में व्यवस्थित कीजिए।
(i) ब्रोमोमेथेन, ब्रोमोफॉर्म, क्लोरोमेथेन, डाइब्रोमोमेथेन
(ii) 1-क्लोरोप्रोपेन, आइसोप्रोपिल क्लोराइड, 1-क्लोरोब्यूटेन
१०.७ रासायनिक अभिक्रियाएँ
10.7.1 हैलोएेल्केनों की अभिक्रियाएँ
हैलोएेल्केनों की अभिक्रियाओं को निम्न संवर्गों में बाँटा गया है–
1. नाभिकरागी प्रतिस्थापन 2. निराकरण अभिक्रियाएँ 3. धातुओं के साथ अभिक्रिया
आप कक्षा XI में जान चुके हैं कि नाभिकरागी इलेक्ट्रॉन धनी स्पीशीज़ होती हैं, अतः वे क्रियाधार के उस भाग पर आक्रमण करती हैं, जहाँ इलेक्ट्रॉनों की अल्पता होती है। वह अभिक्रिया जिसमें एक नाभिकरागी, पहले से उपस्थित नाभिकरागी को प्रतिस्थापित करता है, नाभिकरागी प्रतिस्थापन अभिक्रिया कहलाती है। इन अभिक्रियाओं में हैलोएेल्केन क्रियाधार होते हैं।
1. नाभिकरागी प्रतिस्थापन अभिक्रियाएँ– इस प्रकार की अभिक्रिया में नाभिकरागी उस हैलोएेल्केन (क्रियाधार) से अभिक्रिया करता है जिसमें हैलोजन परमाणु से आबंधित कार्बन परमाणु पर आंशिक धनावेश होता है, प्रतिस्थापन अभिक्रिया होती है तथा हैलाइड आयन निकल जाता है जिसे अवशिष्ट समूह कहते हैं। चूँकि प्रतिस्थापन अभिक्रिया नाभिकरागी के द्वारा प्रारंभ होती हैं अतः इसे नाभिकरागी प्रतिस्थापन अभिक्रिया कहते हैं।

यह एेल्किल हैलाइड की कार्बनिक अभिक्रियाओं का एक प्रमुख उपयोगी संवर्ग है जिसमें हैलोजन परमाणु sp3 संकरित कार्बन परमाणु से आबंधित होता है। हैलोएेल्केनों की कुछ सामान्य नाभिकरागियों द्वारा अभिक्रिया के उपरांत बने उत्पादों को सारणी 10.4 में दिया गया है।
सारणी 10-4 क- ऐल्किल हैलाइडों का नाभिकरागी प्रतिस्थापन
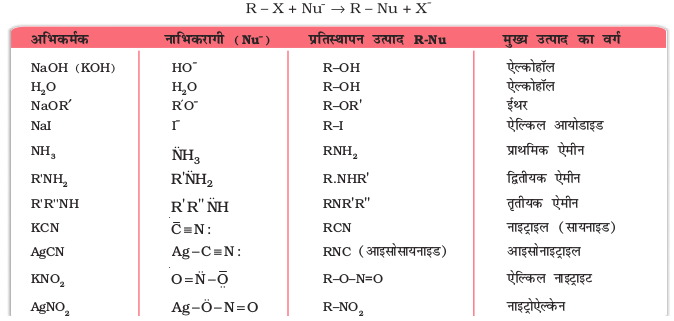

सायनाइड तथा नाइट्राइट जैसे समूहों में दो नाभिकरागी केंद्र होते हैं तथा इन्हें उभदंती नाभिकरागी कहा जाता है। वास्तव में सायनाइड समूह दो अंशदायी संरचनाओं का संकर होता है। अतः यह दो भिन्न प्रकार से नाभिकरागी के रूप में कार्य कर सकता है। 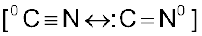 अर्थात् कार्बन परमाणु से जुड़ने के परिणामस्वरूप एेल्किल सायनाइड तथा नाइट्रोजन परमाणु से जुड़ने के परिणामस्वरूप आइसोसायनाइड बनाता है। इसी प्रकार से नाइट्राइट आयन भी उभदंती नाभिकरागी के दो भिन्न संयोजन केंद्रों वाला
अर्थात् कार्बन परमाणु से जुड़ने के परिणामस्वरूप एेल्किल सायनाइड तथा नाइट्रोजन परमाणु से जुड़ने के परिणामस्वरूप आइसोसायनाइड बनाता है। इसी प्रकार से नाइट्राइट आयन भी उभदंती नाभिकरागी के दो भिन्न संयोजन केंद्रों वाला 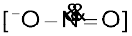 है। अॉक्सीजन के द्वारा जुड़ने के परिणामस्वरूप एेल्किल नाइट्राइट तथा नाइट्रोजन के द्वारा जुड़ने के परिणामस्वरूप यह नाइट्रोएेल्केन बनता है।
है। अॉक्सीजन के द्वारा जुड़ने के परिणामस्वरूप एेल्किल नाइट्राइट तथा नाइट्रोजन के द्वारा जुड़ने के परिणामस्वरूप यह नाइट्रोएेल्केन बनता है।
उदाहरण 10.5
हैलोएेल्केन की KCN से अभिक्रिया करके मुख्य उत्पाद के रूप में एेल्किल सायनाइड बनाते हैं, जबकिAgCN से अभिक्रिया करने पर आइसोसायनाइड प्रमुख उत्पाद के रूप में प्राप्त होता है। समझाइए।
हल
KCN प्रमुखतः आयनिक होता है तथा विलयन में सायनाइड आयन देता है। यद्यपि कार्बन तथा नाइट्रोजन दोनों ही परमाणु इलेक्ट्रॉन युगल प्रदान करने की स्थिति में होते हैं परंतु आक्रमण मुख्यतः कार्बन परमाणु के द्वारा होता है न कि नाइट्रोजन परमाणु के द्वारा; क्योंकि C–C आबंध C–N आबंध की तुलना में अधिक स्थायी होता है। तथापि, AgCN मुख्यतः सहसंयोजक प्रकृति का होता है तथा इसका नाइट्रोजन परमाणु इलेक्ट्रॉन युगल प्रदान करने के लिए सक्षम होता है, इसलिए आइसोसायनाइड मुख्य उत्पाद के रूप में बनता है।
क्रियाविधि–अभिक्रिया दो भिन्न क्रियाविधियों द्वारा संपन्न होती है जिनका वर्णन नीचे किया गया है–
(क) द्विअणुक नाभिकरागी (नाभिकस्नेही) प्रतिस्थापन अभिक्रिया (SN2)
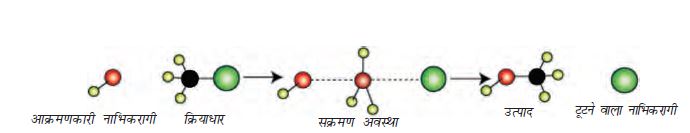
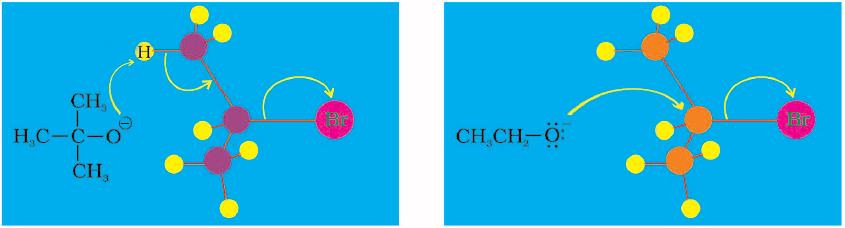
CH3Cl तथा हाइड्रॉक्साइड आयन की अभिक्रिया, जिसमें मेथेनॉल तथा क्लोराइड आयन बनता है, द्वितीय कोटि बलगतिकी का अनुसरण करती है। अर्थात्, अभिक्रिया का वेग दोनों अभिक्रियकों की सांद्रता पर निर्भर करता है। इस अभिक्रिया को आरेखीय रूप में चित्र 10.2 (पृष्ठ 316) द्वारा प्रदर्शित किया जा सकता है।
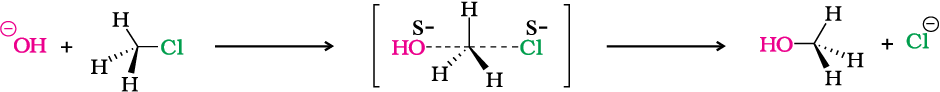
चित्र 10.2– लाल गेंद आक्रमणकारी हाइड्रॉक्साइड आयन को तथा हरी गेंद निकलने वाले हैलाइड आयन को प्रदर्शित करती है।
सन् 1937 में एडवर्ड डेवी ह्यूहेस एवं सर क्रिस्टोफर इन्गोल्ड ने SN2 अभिक्रियाओं की क्रियाविधि दी।
ह्यूहेस ने इन्गोल्ड के निर्देशन में कार्य करके लंदन विश्वविद्यालय से डी.एस.सी. की उपाधि प्राप्त की।
यह द्विअणुक नाभिकरागी प्रतिस्थापन (SN2) को प्रदर्शित करता है। आक्रमणकारी नाभिकरागी की एेल्किल हैलाइड से अन्योन्यक्रिया होने पर कार्बन-हैलाइड आबंध टूटता है तथा साथ ही कार्बन एवं आक्रमणकारी नाभिकरागी के बीच में एक नया आबंध बनता है। यहाँ पर C तथा O के मध्य C-O बंध बनता है। ये दोनों प्रक्रियाएँ एक साथ एक ही पद में संपन्न होती हैं तथा कोई मध्यवर्ती नहीं बनता। जैसे-जैसे अभिक्रिया प्रगति करती है तथा आने वाले नाभिकरागी एवं कार्बन परमाणु के मध्य आबंध बनना प्रारंभ हो जाता है; कार्बन परमाणु एवं अवशिष्ट समूह के मध्य आबंध दुर्बल होने लगता है। जैसे ही एेसा होता है, क्रियाधार के कार्बन-हाइड्रोजन बंध, आक्रमणकारी नाभिकरागी से दूर होने लगते हैं। संक्रमण स्थिति में तीनों C-H बंध एक ही तल में हो जाते हैं तथा आक्रमणकारी एवं टूटने वाला नाभिकरागी कार्बन से अंशतः जुड़े रहते हैं। जैसे ही आक्रमणकारी नाभिकरागी कार्बन के समीप पहुँचता है, C-H बंध पहले की दिशा में तब तक अग्रसर होते रहते हैं जब तक टूटने वाला समूह कार्बन से टूटकर अलग नहीं हो जाता परिणामस्वरूप आक्रमण के लिए उपलब्ध कार्बन परमाणु का विन्यास प्रतीप हो जाता है, ठीक उसी प्रकार जिस प्रकार कि तेज हवाओं में छाता अंदर की ओर से बाहर उलट जाता है, इसके साथ ही अवशिष्ट समूह निकल जाता है। इस प्रक्रिया को विन्यास का प्रतीपन कहते हैं। संक्रमण अवस्था में कार्बन परमाणु एक ही समय पर आने वाले नाभिकरागी तथा निकलने वाले अवशिष्ट समूह दोनों के साथ जुड़ा रहता है। अतः संक्रमण अवस्था में कार्बन परमाणु एक साथ पाँच परमाणुओं से आबंधित रहता है। इस प्रकार की संरचना अस्थायी होती है तथा इसे यौगिक के रूप में अभिक्रिया मिश्रण से पृथक नहीं किया जा सकता।
विन्यास
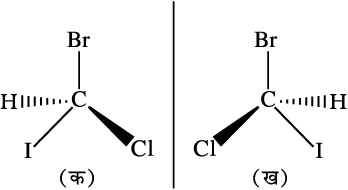
त्रिविम में कार्बन से जुड़े क्रियात्मक समूहों की व्यवस्था विन्यास कहलाती है। नीचे दी गई संरचना (क) तथा (ख) को सावधानी पूर्वक देखिए।
यह एक यौगिक की दो संरचनाएँ हैं। इनमें कार्बन से जुड़े क्रियात्मक समूहों की त्रिविम व्यवस्था भिन्न है।संरचना (ख) संरचना (क) की दर्पण प्रतिबिम्ब है। हम कह सकते हैं कि संरचना (ख) में कार्बन का विन्यास संरचना (क) में कार्बन के विन्यास का दर्पण प्रतिबिम्ब है।
दर्पण
चूँकि इस अभिक्रिया में नाभिकरागी अवशिष्ट समूह युक्त कार्बन परमाणु के निकट आता है, अतः इस कार्बन परमाणु पर अथवा उसके निकट उपस्थित स्थूल समूह प्रभावशाली अवरोध (निरोधक प्रभाव) उत्पन्न करता है। सामान्य एेल्किल हैलाइडों में मेथिल हैलाइड सबसे अधिक शीघ्रता से SN2 अभिक्रिया देता है क्योंकि इसमें केवल तीन छोटे हाइड्रोजन परमाणु होते हैं। तृतीयक एेल्किल हैलाइड सबसे कम क्रियाशील होते हैं क्योंकि स्थूल समूह आगमनकारी नाभिकरागी के लिए अवरोध उत्पन्न करते हैं (चित्र 10.3)। अतः अभिक्रियाशीलता का क्रम निम्नलिखित होता है–
प्राथमिक हैलाइड > द्वितीयक हैलाइड > तृतीयक हैलाइड

चित्र 10.3 SN2 अभिक्रिया में त्रिविम प्रभाव, SN2 अभिक्रिया के तुलनात्मक वेग कोष्ठक में दिए हैं।
(ख) एकाण्विक नाभिकरागी प्रतिस्थापन (SN1)
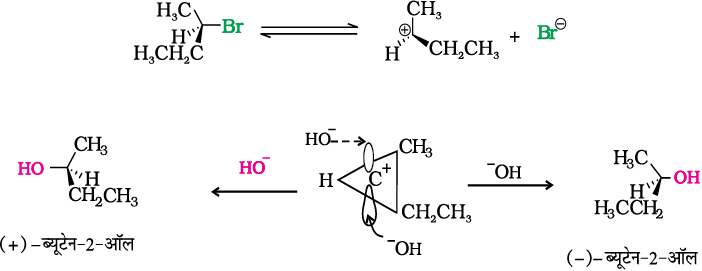
SN1 अभिक्रियाएं सामान्यतः ध्रुवीय प्रोटिक विलायकों (जैसे जल, एेल्कोहॉल, एेसीटिक अम्ल आदि) में संपन्न होती हैं। तृतीयक-ब्यूटिल ब्रोमाइड तथा हाइड्रॉक्साइड आयन के मध्य अभिक्रिया तृतीयक-ब्यूटिल एेल्कोहॉल देती है एवं प्रथम कोटि की बलगतिकी का अनुसरण करती है। अर्थात् अभिक्रिया का वेग केवल एक अभिक्रियक की सांद्रता पर निर्भर करता है, जो कि तृतीयक-ब्यूटिल ब्रोमाइड है।

यह दो चरणों में संपन्न होती है। प्रथम चरण में ध्रुवीय C-Br आबंध का धीमा विदलन एक कार्बोकैटायन तथा एक ब्रोमाइड आयन बनता है। द्वितीय चरण में इस प्रकार निर्मित कार्बोकैटायन पर नाभिकरागी के द्वारा आक्रमण होता है तथा प्रतिस्थापन अभिक्रिया पूर्ण होती है।

चरण-1 सबसे धीमा तथा उत्क्रमणीय होता है इसमें C–Br आबंध का विदलन होता है जिसके लिए ऊर्जा प्रोटिक विलायकों के प्रोटॉन द्वारा हैलाइड आयन के विलायक योजन से प्राप्त होती है। चूँकि अभिक्रिया की दर सबसे धीमे चरण पर निर्भर करती है, अतः अभिक्रिया का वेग केवल एेल्किल हैलाइड की सांद्रता पर निर्भर करता है, न कि हाइड्रॉक्साइड आयन की सांद्रता पर। इसके अतिरिक्त कार्बोकैटायन का स्थायित्व जितना अधिक होगा, एेल्किल हैलाइड से इसका विरचन उतना ही सरल होगा तथा अभिक्रिया का वेग उतना ही अधिक होगा। एेल्किल हैलाइडों में 3° एेल्किल हैलाइड, तीव्रता से SN1 अभिक्रिया देते हैं क्योंकि 3° कार्बोकैटायन का स्थायित्व सर्वाधिक होता है। हम SN1 तथा SN2 अभिक्रिया के लिए एेल्किल हैलाइड की क्रियाशीलता के क्रम को संक्षेप में निम्न प्रकार से दे सकते हैं–
विलियम निकॉल (1768-1851) ने समतल ध्रुवित प्रकाश उत्पन्न करने वाला पहला प्रिज़्म बनाया।
इन्हीं कारणों से एेलिलिक तथा बेन्ज़िलिक हैलाइड SN1 अभिक्रिया के प्रति अधिक क्रियाशीलता प्रदर्शित करते हैं। इस प्रकार निर्मित कार्बोकैटायन अनुनाद के द्वारा स्थायित्व प्राप्त कर लेता है जैसा कि नीचे दर्शाया गया है–
उदाहरण 10.6
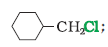
निम्नलिखित हैलोजन यौगिकों के युगलों में कौन सा यौगिक SN2अभिक्रिया तीव्रता से देगा?
हल
यह प्राथमिक हैलाइड है अतः SN2 अभिक्रिया तीव्रता से देता है। बड़े आकार के कारण आयोडीन बेहतर अवशिष्ट समूह है अतः आने वाले
नाभिकरागी की उपस्थिति में द्रुत वेग से निकल जाएगा।
उदाहरण 10.7
SN1 o SN2 अभिक्रिया में निम्नलिखित यौगिकों की अभिक्रियाशीलता का क्रम अनुमानित कीजिए।
(i) ब्रोमोब्यूटेन के चार समावयवी
(ii) C6H5CH2Br, C6H5CH(C6H5)Br, C6H5CH(CH3)Br, C6H5C(CH3)C6H5Br
हल
(i) CH3CH2CH2CH2Br < (CH3)2CHCH2Br < CH3CH2CH(Br)CH3 < (CH3)3CBr (SN1)
समूह के इलेक्ट्रॉन दाता प्रेरणिक प्रभाव के अधिक होने के कारण दो प्राथमिक ब्रोमाइडों में से (CH3)2CHCH2Br से निर्मित मध्यवर्ती कार्बोकैटायनCH3CH2CH2CH2Br से बने कार्बोकैटायन की अपेक्षा अधिक स्थायी होगा। अतःSN1 अभिक्रिया में CH3CH2CH2CH2Br की अपेक्षाCH3)2CHCH2Br अधिक क्रियाशील होता है।CH3CH2CH(Br)CH3 एक द्वितीयक ब्रोमाइड है। जबकि (CH3)3CBrब्ठततृतीयक ब्रोमाइड है, अतःSN1 अभिक्रिया के लिए अभिक्रियाशीलता का क्रम उपरोक्त होता है।SN2 अभिक्रिया में उपर्युक्त अभिक्रियाशीलता का क्रम विपरीत हो जाता है, क्योंकि इलेक्ट्रॉन रागी कार्बन पर त्रिविम बाधा इसी क्रम में बढ़ती है।
(ii) C6H5C(CH3)(C6H5)Br > C6H5CH(C6H5)Br > C6H5CH(CH3)Br > C6H5CH2Br(SN1) C6H5C(CH3)(C6H5)Br < C6H5CH(C6H5)Br < C6H5CH(CH3)Br < C6H5CH2Br (SN2) दोनों द्वितीयक ब्रोमाइडों में से, C6H5CH (C6H5)Br से प्राप्त कार्बोकैटायन माध्यमिक, C6H5CH (CH3)Brसे प्राप्त होने वाले माध्यमिक की अपेक्षा अधिक स्थायी होता है, क्योंकि यह दो प़फ़ेनिल समूहों द्वारा अनुनाद के कारण स्थायित्व प्राप्त कर लेता है। इसलिए, पहला ब्रोमाइड दूसरे की अपेक्षा SN1 अभिक्रियाओं में अधिक क्रियाशील होता है। प़्ाफ़ेनिल समूह मेथिल समूह से अधिक स्थूल होता है, इसलिए SN2 अभिक्रियाओं में C6H5CH (C6H5)Br, C6H5CH (CH3)Br की अपेक्षा कम क्रियाशील होता है।
दोनों क्रियाविधियों में दिए हुए एेल्किल समूह के लिए, हैलाइड R-X की क्रियाशीलता का क्रम इस प्रकार होता है– R–I > R– Br > R–Cl > R–F.
(ग) नाभिकरागी प्रतिस्थापन अभिक्रियाओं के त्रिविम रासायनिक पहलू
जैकब्स हैन्ड्रिक्स वान्ट हॉफ (1852-1911) ने 1901 में विलयनों पर अपने कार्य के लिए रसायन का प्रथम नोबेल पुरस्कार प्राप्त किया।
नाभिकरागी प्रतिस्थापन अभिक्रियाओं के त्रिविम रासायनिक पहलू को समझने के लिए हमें कुछ मूलभूत त्रिविम-रासायनिक सिद्धांतों तथा प्रतीकों (ध्रुवण घूर्णकता, काइरलता, धारण, प्रतिलोमन तथा रेसिमीकरण आदि) को सीखना होगा।
(i) ध्रुवण घूर्णकता–
कुछ यौगिकों के विलयन में से समतल ध्रुवित प्रकाश गुज़ारे जाने पर (जो कि सामान्य प्रकाश को निकॉल प्रिज़्म से गुज़ारने पर प्राप्त होता है) यह इस प्रकाश के तल को घूर्णित कर देते हैं। इस प्रकार के यौगिकों को ध्रुवण घूर्णक यौगिक कहते हैं। उस कोण को जिस पर ध्रुवित प्रकाश का तल घूर्णित हो जाता है, ध्रुवणमापी नामक उपकरण के द्वारा मापा जा सकता है। यदि यौगिक समतल ध्रुवित प्रकाश के तल को दाईं ओर घुमा देता है अर्थात् घड़ी की सुई की दिशा में घुमा देता है तो उसे दक्षिण ध्रुवण घूर्णक (ग्रीक में दाहिनी ओर घूर्णन) अथवा d रूप कहते हैं तथा इसे घूर्णन कोण से पूर्व धनात्मक (+) चिह्न द्वारा प्रदर्शित करते हैं। यदि प्रकाश का तल बाईं ओर घूर्णित होता है, अर्थात् घड़ी की सूई के विपरीत दिशा में, तो यौगिक को वाम ध्रुवण धूर्णक अथवा l रूप कहते हैं तथा घूर्णन कोण से पूर्व ऋणात्मक (–) चिह्न लगाते हैं। इस प्रकार के (+) तथा (–) समावयवियों को ध्रुवण समावयवी कहते हैं तथा इस परिघटना को ध्रुवण समावयवता कहते हैं।
(ii) आण्विक असममितता, काइरलता एवं प्रतिबिंब रूप–
लुइस पाश्चर (1848) के इस प्रेक्षण ने आधुनिक त्रिविम रसायन की आधारशिला रखी कि कुछ यौगिकों के क्रिस्टल, दर्पण प्रतिबिंब रूपों में पाए जाते हैं। उन्होंने प्रदर्शित किया कि दोनों प्रकार के क्रिस्टलों के समान सांद्रता वाले जलीय विलयन, समान परिमाण, किंतु विपरीत दिशा में ध्रुवण घूर्णन प्रदर्शित करते हैं। उनको विश्वास था कि दोनों प्रकार के क्रिस्टलों के ध्रूवण घूर्णन में अंतर इनके अणुओं में परमाणुओं की तीनों विमाओं में भिन्न व्यवस्था (विन्यास) से संबंधित होता है। डच वैज्ञानिक जे. वान्ट हॉफ तथा फ्रांसिसी वैज्ञानिक ले बेल ने उसी वर्ष (1874), में स्वतंत्र रूप से कार्य करते हुए तर्क दिया कि केंद्रीय कार्बन परमाणु के चारों ओर, समूहों (संयोजकताओं) की त्रिविम व्यवस्था चतुष्फलकीय होती है और यदि कार्बन परमाणु से जुड़े सभी प्रतिस्थापी भिन्न हों तो अणु का दर्पण प्रतिबिंब अणु पर अध्यारोपित नहीं होता। एेसे कार्बन परमाणु को असममित कार्बन परमाणु अथवा त्रिविमकेंद्र कहते हैं। परिणामी अणु की सममितता भंग हो जाती है तथा इसे असममित अणु कहते हैं। अणु की असममितता तथा दर्पण प्रतिबिंब का अणु पर अध्यारोपित न होना इस प्रकार के कार्बनिक यौगिकों में ध्रुवण घूर्णन के लिए उत्तरदायी होती है।
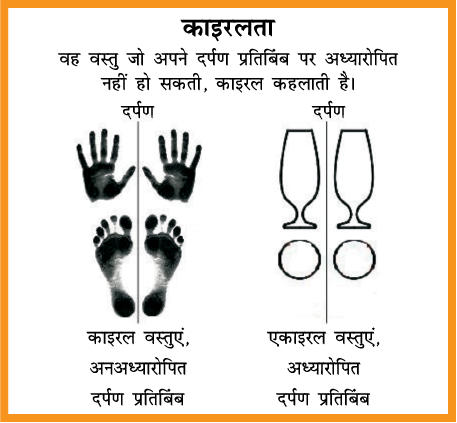
चित्र 10.4– कुछ काइरल एवं अकाइरल वस्तुओं के उदाहरण
सममितता तथा असममितता हमारे दैनिक जीवन में काम आने वाली वस्तुओं में भी देखने को मिलती है। गोले, घन, शंकु, ग्लोब आदि सभी के दर्पण प्रतिबिंब उनके समान होते हैं तथा ये दर्पण प्रतिबिंब पर अध्यारोपित किए जा सकते हैं। तथापि बहुत सी वस्तुएं अपने दर्पण प्रतिबिंब पर अध्यारोपित नहीं होतीं। उदाहरणार्थ, आपका बायाँ तथा दायाँ हाथ समान दिखाई देता है; लेकिन यदि आप अपने बाएं हाथ को दाहिने हाथ पर उसी समतल में ले जाते हुए रखें तो दोनों एक दूसरे को ठीक-ठीक नहीं ढकते। वे वस्तुएं जो अपने दर्पण प्रतिबिंब पर अध्यारोपित नहीं होतीं (दोनों हाथों के समान) काइरल कहलाती हैं तथा इस गुण को काइरलता कहते हैं काइरल अणु ध्रुवण घूर्णक होते हैं तथा वे वस्तुएं जो कि अपने दर्पण प्रतिबिंब पर अध्यारोपित हो जाती हैं, उन्हें एकाइरल कहते हैं।
उपरोक्त आण्विक काइरलता के इस परीक्षण को कार्बनिक अणुओं तथा उनके दर्पण प्रतिबिंब के मॉडल बनाकर अथवा त्रिविमीय संरचना का आरेख बनाकर एवं उसे कल्पना में प्रतिबिंब पर अध्यारोपित करके किया जा सकता है। इसके अतिरिक्त अन्य कई सहायक हैं जो हमें काइरल अणु की पहचान करने में मदद करते हैं। इनमें से एक सहायक असममित कार्बन परमाणु की उपस्थिति है। आइए, हम दो साधारण अणुओं, प्रोपेन-2-अॉल (चित्र 10.5) एवं ब्यूटेन-2-अॉल (चित्र 10.6) तथा उनके दर्पण प्रतिबिंब रूपों पर विचार करें।
जैसा कि आप स्पष्टतः देख सकते हैं कि प्रोपेन-2-अॉल में असममित कार्बन परमाणु नहीं है, क्योंकि चतुष्फलकीय कार्बन परमाणु से जुड़े चारों समूह असमान नहीं हैं, हम दर्पण प्रतिबिंब (ख) को 180॰ पर घुमाते हैं तथा प्राप्त संरचना (ग) को संरचना (क) पर अध्यारोपित करने का प्रयत्न करते हैं। यह संरचनाएँ पूर्णतः अध्यारोपित हो जाती हैं। अतः प्रोपेन-2-अॉल एक एकाइरल अणु है।
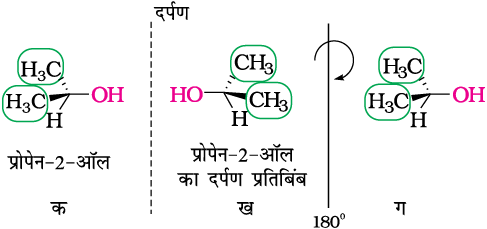
चित्र 10.5– ‘क’ के प्रतिबिंब रूप ‘ख’ को 180॰ घुमाने पर ‘ग’ प्राप्त होता है ‘ग’ को ‘क’ पर अध्यारोपित कर सकते हैं।
ब्यूटेन-2-अॉल में चतुष्फलकीय कार्बन परमाणु से जुड़े चारों समूह भिन्न हैं। अतः अपेक्षा अनुसार यह काइरल है। काइरल अणु के सामान्य उदाहरण जैसे कि; 2-कलोरोब्यूटेन, 2,3-डाइहाइड्रॉक्सी प्रोपेनैल (OHC-CHOH-CH2OH); ब्रोमोक्लोरोआयडोमेथेन (BrClHI); 2-ब्रोमोप्रोपेनॉइक अम्ल (H3C-CHBr-COOH) आदि हैं।
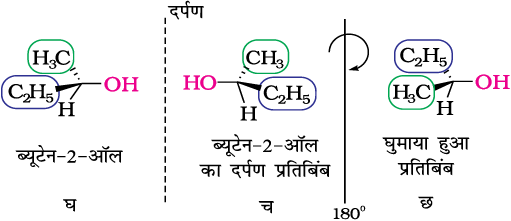
चित्र 10.6– ‘घ’ के प्रतिबिंब रूप ‘च’ को 180° घुमाने पर ‘छ’ प्राप्त होता है ‘छ’ को ‘घ’ पर अध्यारोपित नहीं कर सकते।
जिन त्रिविम समावयवियों का संबंध परस्पर अध्यारोपित न हो सकने वाले दर्पण प्रतिबिंबों की तरह होता है, उन्हें प्रतिबिंब रूप (एनेनटियोमर) कहते हैं (चित्र 10.7)। चित्र 10.6 में ‘घ’ एवं ‘च’ प्रतिबिंब रूप हैं।
चित्र 10.7– एक काइरल अणु एवं उसका दर्पण प्रतिबिंब
प्रतिबिंब रूपों के भौतिक गुण जैसे गलनांक, क्वथनांक, अपवर्तनांक आदि समान होते हैं। इनमें अंतर केवल समतल ध्रुवित प्रकाश को घूर्णित करने में होता है। यदि एक प्रतिबिंब रूप दक्षिण ध्रुवण घूर्णक हो तो दूसरा वाम ध्रुवण घूर्णक होगा।
ध्रुवण घूर्णन के चिह्न का अणु के निरपेक्ष (वास्तविक) विन्यास से कोई संबंध नहीं होता।
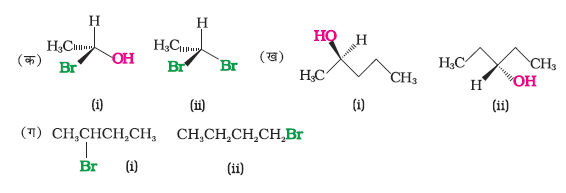
उदाहरण 10.8
निम्नलिखित यौगिकों के युगलों में से काइरल व एकाइरल यौगिकों को पहचानिए। (वेज तथा डेश निरूपण कक्षा 11 चित्र 12-1 के अनुसार)
हल
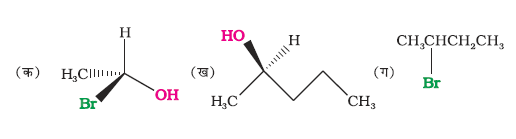
दो प्रतिबिंब रूपों के समान अनुपात में मिश्रण का ध्रुवण घूर्णन शून्य होगा, क्योंकि एक समावयवी के द्वारा उत्पन्न घूर्णन को दूसरा समावयवी निरस्त कर देगा। इस प्रकार के मिश्रण को रेसिमिक मिश्रण अथवा रेसिमिक अंशातरण कहते हैं। एक रेसिमिक मिश्रण को उसके नाम से पूर्व dl अथवा (±) पूर्वलग्न लगाकर प्रदर्शित करते हैं। उदाहरणार्थ, (±) ब्यूटेन-2-अॉल। प्रतिबिंब रूप के रेसिमिक मिश्रण में परिवर्तित होने के प्रक्रम को, रेसिमीकरण कहते हैं।
(iii) धारण (Retention)—
रासायनिक अभिक्रिया अथवा रूपांतरण के समय एक असममित केंद्र के आबंधों के त्रिविम विन्यास की अखंडता बने रहने को विन्यास का धारण कहते हैं। सामान्यतः किसी अभिक्रिया के दौरान यदि त्रिविम केंद्र से आबंधित कोई बंध नहीं टूटता तो उत्पाद में त्रिविम केंद्र के चारों ओर समूहों का वही सामान्य विन्यास होगा जैसा कि अभिक्रियक में था। एेसी अभिक्रिया विन्यास के धारण के साथ संपन्न होती है। उदाहरण के लिए उस अभिक्रिया पर विचार करें जिसमें (-)-2-मेथिलब्यूटेन-1-अॉल को सांद्र हाइड्रोक्लोरिक अम्ल की उपस्थिति में गरम किया जाता है।

यह ध्यान देना महत्वपूर्ण है कि अभिक्रियक एवं उत्पाद में असममित केंद्र समान हैं। किंतु उत्पाद में ध्रुवण घूर्णक का चिन्ह बदल गया है, क्योंकि दो भिन्न यौगिकों का विन्यास असममित केंद्र पर एक समान होने पर भी ध्रुवण घूर्णन भिन्न हो सकता है। एक दक्षिण ध्रुवण घूर्णक (+चिह्न) जबकि दूसरा बाम ध्रुवण घूर्णक (-चिह्न) हो सकता है।
(iv) प्रतिलोमन, धारण तथा रेसिमीकरण– जब असममित कार्बन से जुड़ा कोई बंध टूटता है तो असममित कार्बन परमाणु पर किसी अभिक्रिया के तीन प्रकार के परिणाम होते हैं। निम्नलिखित अभिक्रिया में Y के द्वारा X समूह के प्रतिस्थापन पर विचार कीजिए—
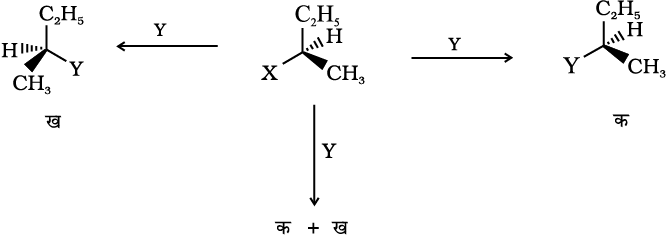
यदि केवल यौगिक ‘क’ प्राप्त होता है तो इसे विन्यास का धारण कहते हैं। नोट करें कि (क) में विन्यास सुरक्षित रहता है।
यदि केवल यौगिक ‘ख’ प्राप्त होता है तो इसे विन्यास का प्रतिलोमन कहते हैं। (ख) में विन्यास का प्रतिलोमन हो गया है।
यदि दोनों यौगिकों ‘क’ तथा ‘ख’ का मिश्रण 50 : 50 अनुपात में प्राप्त होता है तो इस प्रक्रिया को रेसिमीकरण कहते हैं तथा उत्पाद ध्रुवण घूर्णक नहीं होगा, क्योंकि एक समावयवी समतल ध्रुवित प्रकाश को दूसरे से विपरीत दिशा में घूर्णित करेगा।
आइए अब हम SN1 व SN2 क्रियाविधियों का ध्रुवण घूर्णक एेल्किल हैलाइड लेकर पुनरवलोकन करें।
ध्रुवण घूर्णक एेल्किल हैलाइडों में SN2 क्रियाविधि द्वारा प्राप्त उत्पाद का विन्यास अभिक्रियक की तुलना में प्रतिलोम होगा। एेसा इसलिए होगा क्योंकि नाभिकरागी, जिस दिशा में हैलोजन परमाणु जुड़ा है उसके विपरीत दिशा में जुड़ता है।
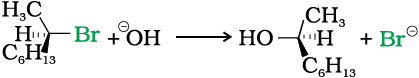
जब (-)-2-ब्रोमोअॉक्टेन की अभिक्रिया सोडियम हाइड्रॉक्साइड से कराते हैं तो
(+)-अॉक्टेन-2-अॉल बनता है जिसमें –OH समूह ब्रोमाइड के विपरीत स्थिति पर स्थान ग्रहण करता है।
किसी अणु में α तथा β कार्बन का स्थान
कार्बन जिससे हैलोजन परमाणु सीधा जुड़ा रहता है, उसे α कार्बन कहते हैं। इससे जुड़े अगले कार्बन को β-कार्बन तथा β-कार्बन से जुड़े कार्बन को α-कार्बन कहते हैं।
अतः ध्रुवण घूर्णक हैलाइडों में SN2 अभिक्रिया विन्यास के प्रतिलोमन के साथ संपन्न होती है। ध्रुवण घूर्णक एेल्किल हैलाइडों के लिए SN1 अभिक्रिया रेसिमीकरण के साथ संपन्न होती है। क्या आप सोच सकते हैं कि एेसा क्यों होता है? वास्तव में धीमे चरण में बना कार्बोकैटायन sp2 संकरित होने के कारण समतलीय हो जाता है (एकाइरल)। नाभिकरागी समतल कार्बोकैटायन पर समतल के ऊपर अथवा नीचे दोनों दिशाओं से आक्रमण कर सकता है। फलस्वरूप उत्पाद में एेसा मिश्रण प्राप्त होता है जिसमें एक उत्पाद में विन्यास संरक्षित रहता है। (-OH उसी स्थिति पर जुड़ता है जहाँ हैलाइड आयन था) तथा दूसरे में विन्यास (-OH, हैलाइड आयन के विपरीत दिशा में जुड़ता है) विपरीत होता है। इसे ध्रुवण घूर्णक-2-ब्रोमोब्यूटेन के जल अपघटन द्वारा प्रदर्शित किया जा सकता है जिससे (±)-ब्यूटेन-2-अॉल का विरचन होता है।
2. विलोपन अभिक्रिया
किसी अणु में α तथा β कार्बन का स्थान
कार्बन जिससे हैलोजन परमाणु सीधा जुड़ा रहता है, उसे α कार्बन कहते हैं। इससे जुड़े अगले कार्बन को β-कार्बन तथा β-कार्बन से जुड़े कार्बन को α-कार्बन कहते हैं।
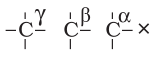
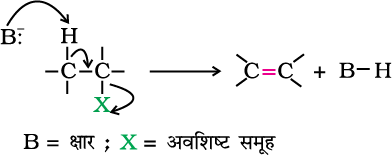

विलोपन बनाम प्रतिस्थापन
एक रासायनिक अभिक्रिया प्रतिस्पर्धा का परिणाम होती हैं जिसमें सबसे तेज़ धावक दौड़ जीतता है। अणुओं का एक समूह अधिकांशतः वह करने का प्रयास करता है जो कि उसके लिए सरल होता है। जब β− हाइड्रोजन परमाणु युक्त एक एेल्किल हैलाइड किसी क्षार अथवा नाभिकरागी के साथ अभिक्रिया करता है तो दो प्रतिस्पर्धात्मक पथ उपलब्ध होते हैं– प्रतिस्थापन (SN1 तथा SN2) तथा विलोपन। किस पथ का चयन होगा, यह एेल्किल हैलाइड की प्रकृति, क्षार, नाभिकरागी का आकार एवं सामर्थ्य तथा अभिक्रिया की परिस्थितियों पर निर्भर करता है। अतः एक बड़ा नाभिकरागी क्षार के समान व्यवहार को प्राथमिकता देता है तथा चतुष्फलकीय कार्बन परमाणु के निकट जाने के स्थान पर एक प्रोटॉन का आहरण करता है (त्रिविम कारण)। इसी प्रकार से प्राथमिक एेल्किल हैलाइड SN2 अभिक्रिया को प्राथमिकता देगा, द्वितीयक एेल्किल हैलाइड की प्राथमिकता SN2 की होगी अथवा विलोपन की; यह क्षार अथवा नाभिकरागी की सामर्थ्य पर निर्भर करता है तथा तृतीयक एेल्किल हैलाइड SN1 को प्राथमिकता देगा अथवा विलोपन को यह कार्बोकैटायन के स्थायित्व अथवा एेल्कीन के अधिक प्रतिस्थापन पर निर्भर करेगा।
3. धातुओं से अभिक्रिया
अधिकांश कार्बनिक क्लोराइड, ब्रोमाइड तथा आयोडाइड कुछ धातुओं के साथ अभिक्रिया करके कार्बन-धातु आबंधयुक्त यौगिक देते हैं। इस प्रकार के यौगिकों को कार्बधात्विक यौगिक कहते हैं। एेल्किल मैग्नीशियम हैलाइड RMgX कार्ब-धात्विक यौगिकों का एक मुख्य वर्ग है। जिनकी खोज विक्टर ग्रीन्यार ने 1900 में की थी। इन्हें ग्रीन्यार अभिक्रियक कहा जाता है। ये अभिक्रियक हैलोएेल्केन की शुष्क ईथर की उपस्थिति में मैग्नीशियम धातु से अभिक्रिया द्वारा प्राप्त किए जाते हैं।

विक्टर ग्रीन्यार की रसायनज्ञ के रूप में शैक्षणिक शुरुआत विचित्र थी। उन्होंने गणित में डिग्री प्राप्त की; किंतु वे अंततोगत्वा रसायन शास्त्र की ओर अग्रसर हुए। यह भौतिक रसायन का गणित कार्य क्षेत्र नहीं था; अपितु कार्बनिक रसायन का था। मेथिलन के लिए एक उत्कृष्ट उत्प्रेरक की खोज करते हुए उन्होंने देखा कि डाइएथिल ईथर में जिंक, इस कार्य के लिए प्रयोग में लिया जाता है। उन्होंने जानना चाहा कि क्या इसके स्थान पर मैग्नीशियम/ईथर संयोग भी सफल हो सकता है? ग्रीन्यार अभिक्रियक सर्वप्रथम 1900 में प्रस्तुत किए गए। ग्रिन्यार ने इस कार्य का उपयोग 1901 में अपनी पीएच.डी. उपाधि के लिए किया। 1910 में ग्रीन्यार नेंसी विश्वविद्यालय में प्रोफ़ेसर पद पर नियुक्त हुए। वर्ष 1912 में उन्होंने पॉल साबात्ये (Paul Sabitier) के साथ संयुक्त रूप से रसायन शास्त्र का नोबेल पुरस्कार प्राप्त किया। पॉल साबात्ये ने निकैल उत्प्रेरित हाइड्रोजनन पर कार्य किया था।

ग्रीन्यार अभिक्रियक में कार्बन मैग्नीशियम बंध सहसंयोजक आबंध होता है परंतु विद्युतधनी मैग्नीशियम के इलेक्ट्रॉन आकर्षित करने के कारण यह आबंध अत्यधिक ध्रुवीय होता है। मैग्नीशियम तथा हैलोजन आबंध आवश्यक रूप से आयनिक होता है।

ग्रीन्यार अभिकर्मक अत्यधिक क्रियाशील होते हैं तथा किसी भी स्रोत से प्राप्त प्रोटॉन से अभिक्रिया कर हाइड्रोकार्बन देते हैं। यहाँ तक कि जल एेल्कोहॉल तथा एेमीन भी इन्हें संगत हाइड्रोकार्बन में परिवर्तित करने के लिए पर्याप्त अम्लीय होते हैं।

अतः ग्रीन्यार अभिक्रियक के साथ अभिक्रिया के समय लेशमात्र नमी को भी निकालना आवश्यक है। इसलिए अभिक्रिया को शुष्क ईथर में किया जाता है। वहीं दूसरी ओर, एेल्किल हैलाइड को हाइड्रोकार्बन में परिवर्तित करने के लिए इसे एक विधि माना जा सकता है।
वुर्ट्ज़ अभिक्रिया
एेल्किल हैलाइड शुष्क ईथर में सोडियम के साथ अभिक्रिया करके हाइड्रोकार्बन बनाते हैं। जिसमें मूल हैलाइड में उपस्थित कार्बन परमाणुओं से दुगुने कार्बन परमाणु होते हैं। इस अभिक्रिया को वुट्ρज़ अभिक्रिया कहते हैं (कक्षा XI, एकक 13)।
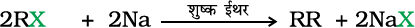
10.7.2 हैलोएरीनों की अभिक्रियाएं
1. नाभिकरागी प्रतिस्थापन
एेरिल हैलाइड नाभिकरागी प्रतिस्थापन अभिक्रियाओं के प्रति निम्नलिखित कारणों से कम क्रियाशील होते हैं।
(i) अनुनाद प्रभाव–
हैलोएेरीन में हैलोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युगल वलय के π इलेक्ट्रॉनों के साथ संयुग्मन में होते हैं तथा निम्नलिखित अनुनादी संरचनाएं संभव हैं।
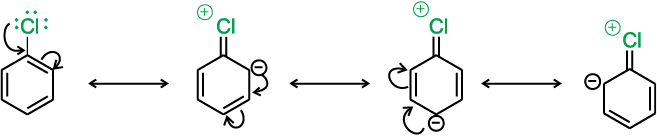
अनुनाद के कारण C–Cl आबंध में आंशिक द्विबंध के गुण आ जाते हैं। जिसके परिणामस्वरूप हैलोएेल्केन की तुलना में हैलोएेरीन में आबंध विदलन अपेक्षाकृत कठिन होता है। अतः ये नाभिकरागी प्रतिस्थापन अभिक्रियाओं के प्रति कम क्रियाशील होती हैं।
(ii) C-X आबंध में कार्बन परमाणु के संकरण में अंतर–
हैलोएेल्केन में हैलोजन से जुड़ा कार्बन परमाणु sp3 संकरित होता है जबकि हैलोएेरीन में हैलोजन परमाणु से जुड़ा कार्बन परमाणु sp2 संकरित होता है।

अधिक s गुणयुक्त sp2 संकरित कार्बन अधिक विद्युतऋणात्मक होता है तथा हैलोएेल्केन में कम s गुण युक्त sp3 संकरित कार्बन परमाणु की तुलना में
C-X आबंध के इलेक्ट्रॉन युगल को अपेक्षाकृत अधिक सुदृढ़ता से थाम सकता है। अतः हैलोएेल्केन में C–Cl आबंध की लम्बाई 177pm है जबकि हैलोएेरीन में
169 pm है। चूँकि लंबे बंध की तुलना में छोटे बंध को तोड़ना कठिन होता है, अतः नाभिकरागी प्रतिस्थापन अभिक्रिया में हैलोएेल्केनों की तुलना में हैलोएेरीन कम क्रियाशील होते हैं।
(iii) फेनिल धनायन का अस्थायित्व–
स्वआयनन के फलस्वरूप हैलोएेरीनों से बना फेनिल धनायन अनुनाद के द्वारा स्थायी नहीं हो पाएगा। अतः SN1 क्रियाविधि की संभावना समाप्त हो जाती है।
(iv) संभावित प्रतिकर्षण के कारण इलेक्ट्रॉनधनी नाभिकरागी के इलेक्ट्रॉनधनी एेरीन की ओर जाने की संभावना कम होती है।
हाइड्रॉक्सिल समूह के द्वारा प्रतिस्थापन
623K ताप तथा 300 वायुमंडलीय दाब पर जलीय सोडियम हाइड्रॉक्साइड के साथ गरम करने पर क्लोरोबेन्जीन को फीनॉल में परिवर्तित कर सकते हैं।
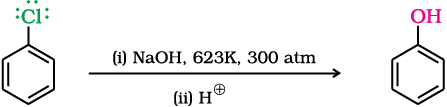
आर्थो-तथा पैरा-स्थिति पर इलेक्ट्रॉन-अपनयक समूह (–NO2) उपस्थित होने पर हैलोएेरीन की क्रियाशीलता बढ़ जाती है।

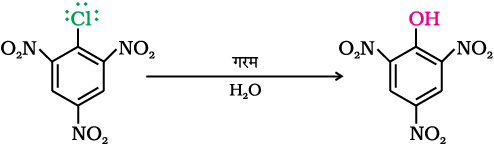
जब –NO2 समूह आर्थो-तथा पैरा-स्थितियों पर जुड़ा होता है, तब यह प्रभाव अधिक प्रबल होता है। तथापि, इलेक्ट्रॉन अपनयक समूह के मैटा-स्थिति पर जुड़े होने की स्थिति में हैलोएरीनों की अभिक्रियाशीलता पर कोई प्रभाव प्रेक्षित नहीं होता है। अभिक्रिया की क्रियाविधि को निम्न प्रकार से आरेखित किया जा सकता है।

////////////////////////
क्या आप विचार कर सकते हैं कि SN2 समूह ऑर्थो- तथा पैरा-स्थिति पर ही प्रभाव क्यों दर्शाता है, मेटा-स्थिति पर क्यों नहीं?
जैसा कि दर्शाया गया है, कि ऑर्थो- तथा पैरा-स्थिति पर नाइट्रो समूह की उपस्थिति से बेन्जीन वलय पर इलेक्ट्रॉन घनत्व कम हो जाता है। फलतः हैलोऐरीन पर नाभिकरागी का आक्रमण सरल हो जाता है। इस प्रकार बना कार्बऐनायन अनुनाद के द्वारा स्थायित्व प्राप्त कर लेता है। हैलोजन प्रतिस्थापी के स्थान से ऑर्थो- एवं पैरा-स्थितियों पर स्थित कार्बनों पर उत्पन्न ऋणावेश SN2 के द्वारा स्थायित्व प्राप्त कर लेता है जबकि उ-नाइट्रोक्लोरोबेन्जीन में एक भी संरचना इस प्रकार की नहीं होती जिसमें SN2 समूह की उपस्थिति वाले कार्बन परमाणु पर ऋणावेश हो। अतः मेटा- स्थिति पर उपस्थित नाइट्रो समूह ऋणावेश को स्थायित्व प्रदान नहीं करता तथा मेटा- स्थिति पर उपस्थित SN2 समूह का अभिक्रियाशीलता पर कोई प्रभाव प्रेक्षित नहीं होता।
2. इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएं
हैलोएेरीन, बेन्जीन की तरह सामान्य इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएं जैसे- हैलोजनन, नाइट्रोकरण, सल्फोनेशन तथा फ्रीडेल-क्राफ्ट आदि अभिक्रियाएं देती हैं। हैलोजन परमाणु के आंशिक निष्क्रियक होते हुए भी इसका o– तथा p– निर्देशकारी प्रभाव होता है। अतः अगला प्रतिस्थापन हैलोजन के स्थान से अॉर्थो और पैरा स्थितियों पर होता है। हैलोजन के अॉर्थो एवं पैरा निर्देशक प्रभाव को अनुनाद संरचनाओं की ओर ध्यान देकर आसानी से समझ सकते हैं।

अनुनाद के कारण, मेटा- स्थिति की तुलना में आर्थो- तथा पैरा- स्थितियों पर इलेक्ट्रॉन घनत्व अधिक बढ़ जाता है। –I प्रभाव के कारण हैलोजन परमाणु की प्रकृति बेन्जीन वलय के इलेक्ट्रॉन आकर्षित करने की होती है, इसलिए बेन्जीन की तुलना में वलय कुछ मात्रा में निष्क्रिय हो जाती है। अतः हैलोएेरीन में इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएं मंद होती हैं तथा बेन्जीन की तुलना में अधिक उग्र परिस्थितियों की आवश्यकता होती है।
(i) हैलोजनन

(ii) नाइट्रोकरण
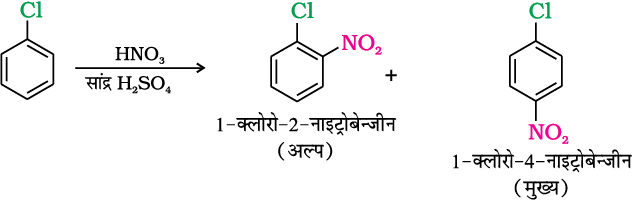
(iii) सल्फोनेशन

(iv) फ्रीडेल क्राफ्ट अभिक्रिया


उदाहरण 10.9
क्लोरीन यद्यपि इलेक्ट्रॉन अपनयक समूह है फिर भी यह एेरोमैटिक इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में अॉर्थाे- तथा पैरा- निर्देशक है, क्यों?
हल
प्रेरण प्रभाव के कारण क्लोरीन इलेक्ट्रॉन आकर्षित करती है तथा अनुनाद के कारण इलेक्ट्रॉन निर्गमित करती है। प्रेरण प्रभाव के कारण क्लोरीन इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में बने मध्यवर्ती कार्बोकैटायन को अस्थायित्व प्रदान करती है।

पाठ्यनिहित प्रश्न
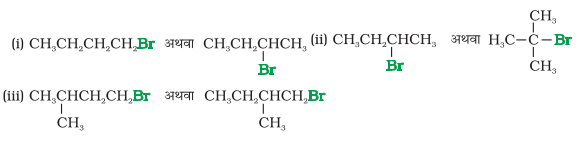
10.7 निम्नलिखित युगलों में से आप कौन से ऐल्किल हैलाइड द्वारा sN2 क्रियाविधि से अधिक तीव्रता से अभिक्रिया करने की अपेक्षा करते हैं? अपने उत्तर को समझाइए।
10.8 हैलोजन यौगिकों के निम्नलिखित युगलों में से कौन सा यौगिक तीव्रता से sN1 अभिक्रिया करेगा?
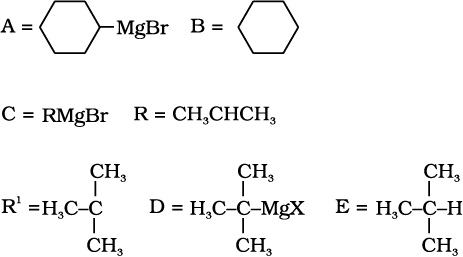
10.9 निम्नलिखित में A, B, C, D, E, R तथा R 1 को पचानिए-
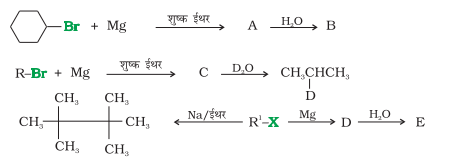
3. धातुओं के साथ अभिक्रिया
वुर्ट्ज-फिटिग अभिक्रिया– एेल्किल हैलाइड तथा एेरिल हैलाइड का मिश्रण, सोडियम के साथ शुष्क ईथर की उपस्थिति में गरम करने पर एेल्किलएेरीन देता है तथा इसे वुर्ट्ज-फिटिग अभिक्रिया कहते हैं।

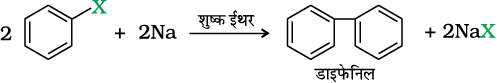
फिटिग अभिक्रिया–एेरिल हैलाइड भी शुष्क ईथर में सोडियम के साथ अभिक्रिया द्वारा सजातीय यौगिक देते हैं, जिसमें दो एेरिल समूह परस्पर जुड़े रहते हैं। इसे फिटिग अभिक्रिया कहते हैं।
१०.८ पॉलिहैलोजन यौगिक
10.8.1 डाइक्लोरोमेथेन (मेथिलीन क्लोराइड)
डाइक्लोरोमेथेन का अत्यधिक उपयोग विलायक के रूप में, पेंट अपयनक में, एेरोसॉल में प्रणोदक के रूप में तथा औषध निर्माण की प्रक्रिया में विलायक के रूप में होता है। यह धातु की सफ़ाई एवं फिनिशिंग विलायक के रूप में प्रयुक्त होता है। मेथिलीन क्लोराइड मनुष्यों के केंद्रीय तंत्रिका तंत्र को हानि पहुँचाता है। वायु में मेथिलीन क्लोराइड की थोड़ी सी मात्रा के सम्पर्क में आने के प्रभाव से श्रवण एवं दृश्य क्षमता में आंशिक क्षीणता आती है। मेथिलीन क्लोराइड की वायु में अधिक मात्रा के प्रभाव से चक्कर आना, मितली, हाथ-पैरों की अंगुलियों में सनसनी एवं जड़ता आदि लक्षण उत्पन्न हो जाते हैं। मनुष्यों में मेथिलीन क्लोराइड के त्वचा के सीधे संपर्क में आने पर तीव्र जलन तथा हल्का लालपन आ जाता है। आँखों से सीधा संपर्क कोर्निया जला सकता है।
10.8.2 ट्राइक्लोरोमेथेन (क्लोरोफार्म)
रासायनिक रूप में क्लोरोफार्म का उपयोग वसा, एेल्केलॉइड, आयोडीन तथा अन्य पदार्थों के लिए विलायक के रूप में होता है। वर्तमान में क्लोरोफार्म का प्रमुख उपयोग फ्रेअॉन प्रशीतक R-22 बनाने में होता है। पहले इसका उपयोग शल्य चिकित्सा में निश्चेतक के रूप में होता था; परंतु अब इसका स्थान ईथर जैसे कम विषैले एवं अधिक सुरक्षित निश्चेतकों ने ले लिया है। निश्चेतक के रूप में इसके उपयोग को देखते हुए यह अपेक्षित है कि क्लोरोफॉर्म को सूँघने से केंद्रीय तंत्रिका तंत्र अवनमित हो जाता है। वायु के प्रति दस लाख भाग में 900 भाग क्लोरोफॉर्म (900 भाग प्रति दस लाख) में बहुत कम समय तक सांस लेने से चक्कर, थकान एवं सिरदर्द हो सकता है, क्लोरोफॉर्म के दीर्घकालिक संपर्क (exposure) से यकृत का (जहाँ क्लोरोफार्म फ़ॉस्जीन में उपापचयित होती है) एवं वृक्क का क्षय हो सकता है तथा कुछ व्यक्तियों की त्वचा क्लोरोफार्म में डूबी रहने पर उसमें घाव हो जाते हैं। क्लोरोफॉर्म प्रकाश की उपस्थिति में वायु द्वारा धीरे-धीरे अॉक्सीकृत होकर अत्यधिक विषैली गैस, कार्बोनिल क्लोराइड बनाती है जिसे फ़ॉस्जीन भी कहते हैं। इसलिए भंडारण के लिए इसे पूर्णतः भरी हुई इसे रंगीन बोतलों में रखा जाता है ताकि उनमें वायु न रहे।

10.8.3 ट्राइआयोडोमेथेन (आयडोफार्म)
इसका उपयोग प्रारंभ में पूतिरोधी (एेंटिसेप्टिक) के रूप में किया जाता था परंतु आयडोफॉर्म का यह पूतिरोधी गुण आयडोफार्म के कारण स्वयं नहीं, बल्कि मुक्त हुई आयोडीन के कारण होता है। इसकी अरुचिकर गंध के कारण अब इसके स्थान पर आयोडीन युक्त अन्य दवाओं का उपयोग किया जाता है।
10.8.4 टेट्राक्लोरोमेथेन (कार्बन टेट्राक्लोराइड)
इसका अत्यधिक मात्रा में उत्पादन प्रशीतक बनाने तथा एेरोसॉल कैन के लिए प्रणोदक के उत्पादन में उपयोग करने के लिए किया जाता है इसे क्लोरोफ्लुओरो कार्बन तथा अन्य रसायनों के उत्पादन में भी फ़ीडस्टॉक की तरह एवं औषध उत्पादन में तथा सामान्य विलायक की भाँति प्रयुक्त किया जाता है। 1960 के मध्य तक यह उद्योगों में ग्रीस को साफ़ करने वाले द्रव तथा घरों में दाग-धब्बे हटाने वाले द्रव एवं अग्नि शामक के रूप में बहुतायत से प्रयुक्त होता था। इस प्रकार के कुछ प्रमाण हैं कि कार्बन टेट्राक्लोराइड से उद्भासन (exposure) द्वारा मनुष्यों को यकृत का कैंसर हो जाता है। इसके कुछ प्रमुख प्रभाव हैं चक्कर आना, सिर का हल्कापन, मितली तथा उल्टी आना आदि, जिससे तंत्रिका कोशिकाओं में स्थायी क्षति हो सकती है। गंभीर स्थिति में यह प्रभाव शीघ्रता से मूर्च्छा, गहरी नींद, बेहोशी अथवा मृत्यु ला सकता है। CCl4 के उद्भासन से हृदयगति अनियमित हो सकती है अथवा रुक जाती है। आँखों के संपर्क में आने पर इस रसायन से जलन उत्पन्न होती है। कार्बनटेट्राक्लोराइड वायु में निर्मुक्त होने पर ऊपरी वायुमंडल में पहुँच जाती है और ओज़ोन परत को विरल बना देती है। ओज़ोन परत के विरलीकरण से मनुष्यों का पराबैंगनी किरणों से उद्भासन बढ़ जाता है। जिससे त्वचा का कैंसर, आँखों की बीमारियाँ तथा विकार एवं प्रतिरक्षा प्रणाली में विदारण होना संभव है।
10.8.5 फ्रेअॉन
मेथेन व एथेन के क्लोरोफ्लुओरो व्युत्पन्न संयुक्त रूप से फ्रेअॉन कहलाते हैं। यह अत्यधिक स्थायी, निष्क्रिय तथा निरावेषी (नॉन-टॉक्सिक) असंक्षारक (नॉन-कोरोसिव) तथा आसानी से द्रवित हो सकने वाली गैसें हैं। फ्रेअॉन 12 (CF2Cl2) उद्योगों मे सर्वाधिक प्रयुक्त होने वाले सामान्य फ्रेअॉनों में से एक है। इसका उत्पादन स्वार्ट्स अभिक्रिया द्वारा टेट्राक्लोरोमेथेन से किया जाता है। यह एेरोसॉल प्रणोदक, प्रशीतक तथा वायु शीतलन में उपयोग करने के लिए उत्पादित किए जाते हैं। 1974 तक विश्व में फ्रेअॉन का वार्षिक उत्पादन 20 करोड़ पाउंड तक था। अधिकांश फ्रेअॉन यहाँ तक कि प्रशीतन में काम आने वाले भी, वायुमंडल से होते हुए क्षोभमंडल में विसरित हो जाते हैं। क्षोभमंडल में फ्रेअॉन, मूलक शृंखला अभिक्रिया प्रारंभ कर देते हैं तथा प्राकृतिक ओज़ोन संतुलन को अनियंत्रित कर देते हैं (एकक 14 कक्षा XI)।
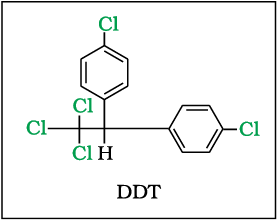
10.8.6 p-p'-डाइ- क्लोरोडाइफेनिल- ट्राइक्लोरो एथेन (DDT)
प्रथम क्लोरीनीकृत, कार्बनिक कीटनाशी DDT मूलतः 1873 में बनाया गया था, लेकिन इसके कीटनाशी प्रभाव की खोज 1939 में स्विट्ज़रलैंड के गिगी औषधालय के पॉल मूलर ने की। इस खोज के लिए पॉल मूलर को 1948 में चिकित्सा एवं शरीर क्रिया विज्ञान के लिए नोबेल पुरस्कार प्राप्त हुआ। द्वितीय विश्व युद्ध के उपरांत इसका उपयोग विश्वस्तर पर तेजी के साथ बढ़ा, क्योंकि यह मुख्यतः मलेरिया फैलाने वाले मच्छरों तथा टाइफस वाहक जुओं को समाप्त करने में प्रभावकारी होती है। 1940 के अंत में DDT के अत्यधिक उपयोग के कारण उत्पन्न होने वाली समस्याएं उभरने लगीं। कीटाें की अनेक प्रजातियों ने DDT के प्रति प्रतिरोधात्मकता विकसित कर ली तथा यह मछलियों के लिए अति विषैली सिद्ध हुई। DDT के अत्यधिक रासायनिक स्थायित्व तथा इसकी वसा में विलेयता ने समस्या को और जटिल बना दिया। DDT का शीघ्रता से उपापचयन नहीं होता अपितु यह वसीय ऊतकों में एकत्र तथा संग्रहित हो जाती है। यदि अंतर्ग्रहण लगातार स्थायी गति से होता रहे तो जंतुओं में DDT की मात्रा समय के साथ बढ़ती जाती है। संयुक्त राज्य में 1973 में DDT पर प्रतिबंध लगा दिया था परंतु विश्व में अनेक स्थानों पर इसका उपयोग आज भी हो रहा है।
सारांश
एेल्किल/एेरिल हैलाइडों को उनकी संरचना में उपस्थित एक, दो अथवा अधिक हैलोजन परमाणुओं के आधार पर क्रमशः मोनो, डाइ अथवा पॉलिहैलोजन (ट्राइ-, टेट्रा- आदि) यौगिकों में वर्गीकृत किया जा सकता है चूँकि हैलोजन परमाणु कार्बन परमाणु से अधिक विद्युतऋणात्मक होता है, अतः कार्बन-हैलोजन आबंध ध्रुवित हो जाता है। कार्बन पर आंशिक धनावेश तथा हैलोजन परमाणु पर आंशिक ऋणावेश आ जाता है।
एेल्किल हैलाइडों को एेल्केन के मुक्त मूलक हैलोजनन द्वारा; एेल्कीनों पर हैलोजन अम्लों के योगज द्वारा; एेल्कोहॉल के –OH समूह को फ़ास्फ़ोरस हैलाइड या थायोनिल क्लोराइड अथवा हैलोजन अम्लों के उपयोग से हैलोजन द्वारा प्रतिस्थापित करके बनाया जाता है। एरिल हैलाइडों को एेरीनो कीइलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया द्वारा बनाया जाता है। फ्लुओराइडों एवं आयोडाइडों को बनाने की श्रेष्ठ विधि हैलोजन विनिमय विधि है।
प्रबल, द्विध्रुव-द्विध्रुव तथा वान्डरवाल्स आकर्षण बलों के कारण कार्बनहैलोजन यौगिकों के क्वथनांक संगत होइड्रोकार्बनों की तुलना में अधिक होते हैं। ये जल में अल्प विलेय परंतु कार्बनिक विलायकों में पूर्ण विलेय होते हैं।
एेल्किल हैलाइडों के कार्बन-हैलोजन आबंध की ध्रुवता इनके नाभिकरागी प्रतिस्थापन, विलोपन तथा धातुओं से अभिक्रिया द्वारा कार्बधात्विक यौगिकों के निर्माण के लिए उत्तरदायी है। रासायनिक बलगतिकी गुणों के आधार पर नाभिकरागी प्रतिस्थापन अभिक्रियाओं को SN1 व SN2 अभिक्रियाओं में वर्गीकृत किया गया है। SN1 व SN2 अभिक्रिया की क्रियाविधि को समझने के लिए काइरलता की महत्वपूर्ण भूमिका है। काइरल एेल्किल हैलाइड की SN2 अभिक्रिया को विन्यास में प्रतीपन के द्वारा तथाSN1 अभिक्रिया को रेसिमीकरण के द्वारा अभिलक्षणित किया जा सकता है।
अधिकांश पॉलिहैलोजन यौगिक जैसे डाइक्लोरोमेथेन, क्लोराफार्म, आयडोफार्म, कार्बनटेट्राक्लोराइड, फ्रेअॉन तथा DDT के अनेक औद्योगिक अनुप्रयोग हैं। तथापि इनमें से कई यौगिक शीघ्रता से अपघटित नहीं किए जा सकते यहाँ तक कि ये ओज़ेान परत का विरलीकरण करते हैं और वायुमंडलीय संकट सिद्ध हो रहे हैं।
अभ्यास
10.1 निम्नलिखित हैलाइडों के नाम आईयूपीएसी (IUPAC) पद्धति से लिखिए तथा उनका वर्गीकरण, एेल्किल एेलिलिक, बेन्ज़िलिक (प्राथमिक, द्वितीयक एवं तृतीयक) वाइनिल अथवा एेरिल हैलाइड के रूप में कीजिए–
(i) (CH3)2CHCH(Cl)CH3 (ii)CH3CH2CH(CH3)CH(C2H5)Cl
(iii) CH3CH2C(CH3)2CH2I (iv) (CH3)3CCH2CH(Br) C6H5
(v) CH3CH(CH3)CH(Br)CH3 (vi) CH3C(C2H5)2CH2Br
(vii) CH3C(Cl)(C2H5)CH2CH3 (viii)CH3CH=C(Cl)CH2CH(CH3)2
(ix) CH3CH=CHC(Br)(CH3)2 (x) p-ClC6H4CH2CH(CH3)2
(xi) m-ClCH2C6H4CH2C(CH3)3 (xii) o-Br-C6H4CH(CH3)CH2CH3
10.2 निम्नलिखित यौगिकों के IUPAC नाम दीजिए–
(i) CH3CH(Cl)CH(Br)CH3 (ii) CHF2CBrCIF
(iii) 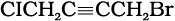 (iv) (CCl3)3CCI
(iv) (CCl3)3CCI
(v) CH3C(p-ClC6H4)2CH(Br)CH3 (vi)(CH3)3CCH=CClC6H4I-p
10.3 निम्नलिखित कार्बनिक हैलोजन यौगिकों की संरचना दीजिए–
(i) 2-क्लोरो-3-मेथिलपेन्टेन (ii) p-ब्रोमोक्लोरो बेन्जीन
(iii) 1-क्लोरो-4-एथिलसाइक्लोहेक्सेन (iv) 2-(2-क्लोरोफेनिल)-1-आयडोअॉक्टेन
(v) 2–ब्रोमोब्यूटेन (vi) 4-तृतीयक-ब्यूटिल-3-आयडोहेप्टेन
(vii) 1-ब्रोमो-4-द्वितीयक-ब्यूटिल-2-मेथिल बेन्जीन (viii) 1,4-डाइब्रोमोब्यूट-2-ईन
10.4 निम्नलिखित में से किसका द्विध्रुव आघूर्ण सर्वाधिक होगा?
(i) CH2Cl2 (ii) CHCl3 (iii) CCl4
10.5 एक हाइड्रोकार्बन C5H10 अंधेरे में क्लोरीन के साथ अभिक्रिया नहीं करता परन्तु सूर्य के तीव्र प्रकाश में केवल एक मोनोक्लोरो यौगिक C5H9Cl देता है। हाइड्रोकार्बन की संरचना क्या है?
10.6 C4H9Br सूत्र वाले यौगिक के सभी समावयवी लिखिए।
10.7 निम्नलिखित से 1-आयडोब्यूटेन प्राप्त करने की समीकरण दीजिए।
(i) 1-ब्यूटेनॉल (ii) 1-क्लोरोब्यूटेन (iii) ब्यूट-1-इन
10.8 उभदंती नाभिकरागी क्या होते हैं? एक उदाहरण की सहायता से समझाइए।
10.9 निम्नलिखित प्रत्येक युगलों में से कौन सा यौगिक OH– के साथ SN2अभिक्रिया में अधिक तीव्रता से अभिक्रिया करेगा?
(i) CH3Br अथवा CH3I (ii) (CH3)3CCl अथवा CH3Cl
10.10 निम्नलिखित हैलाइडों के एथेनॉल में सोडियम हाइड्रॉसाइड द्वारा विहाइड्रोहैलोजनन के फलस्वरुप बनने वाली सभी एेल्कीनो की संरचना लिखिए। इसमें से मुख्य एेल्कीन कौन सी होगी?
(i) 1-ब्रोमो-1-मेथिलसाइक्लोहेक्सेन
(ii) 2-क्लोरो-2-मेथिलब्यूटेन
(iii) 2,2,3-ट्राइमेथिल-3-ब्रोमोपेन्टेन
10.11 निम्नलिखित परिवर्तन आप कैसे करेंगे?
(i) एथेनॉल से ब्यूट-1-आइन (ii) एथीन से ब्रोमोएथेन (iii) प्रोपीन से 1-नाइट्रोप्रोपीन
(iv) टॉलूईन से बेन्जिल एेल्कोहॉल (v) प्रोपीन से प्रोपाइन (vi)एथेनॉल से एथिल फ्लुओरोइड
(vii) ब्रोमोमेथेन से प्रोपेनोन (viii) ब्यूट-1-ईन से ब्यूट-2-ईन
(ix) 1-क्लोरोब्यूटेन से n-अॉक्टेन (x) बेन्जीन से बाइफ़ेनिल
10.12 समझाइए क्यों—
(i) क्लोरोबेन्जीन का द्विध्रुव आघूर्ण साइक्लोहेक्सिल क्लोराइड की तुलना में कम होता है?
(ii) एेल्किल हैलाइड ध्रुवीय होते हुए भी जल में अमिश्रणीय हैं?
(iii) ग्रीन्यार अभिकर्मक का विरचन निर्जलीय अवस्थाओं में करना चाहिए?
10.13 फ्रेओन-12, DDT, कार्बनटेट्राक्लोराइड तथा आयडोफार्म के उपयोग दीजिए।
10.14 निम्नलिखित प्रत्येक अभिक्रिया में बनने वाले मुख्य कार्बनिक उत्पाद की संरचना लिखिए–
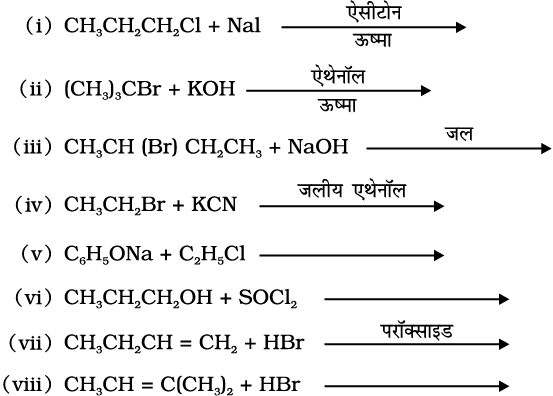
10.15 निम्नलिखित अभिक्रिया की क्रियाविधि लिखिए–
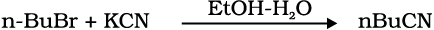
10.16 SN2 प्रतिस्थापन के प्रति अभिक्रियाशीलता के आधार पर इन यौगिकों के समूहों को क्रमबद्ध कीजिए।
(i) 2-ब्रोमो-2-मेथिलब्यूटेन, 1- ब्रोमोपेन्टेन, 2- ब्रोमोपेन्टेन
(ii) 1-ब्रोमो-3-मेथिलब्यूटेन, 2-ब्रोमो-2-मेथिलब्यूटेन, 2-ब्रोमो-3-मेथिलब्यूटेन
(iii) 1-ब्रोमोब्यूटेन, 1-ब्रोमो-2,2-डाइमेथिलप्रोपेन, 1-ब्रोमो-2-मेथिलब्यूटेन, 1-ब्रोमो-3-मेथिलब्यूटेन
10.17 C6H5CH2Cl तथा C6H5CHClC6H5 में से कौन सा यौगिक जलीय KOH से शीघ्रता से जलअपघटित होगा?
10.18 o-तथा-m- समावयवियों की तुलना में p-डाक्लोरोबेन्जीन का गलनांक उच्च होता है, विवेचना कीजिए।
10.19 निम्नलिखित परिवर्तन कैसे संपन्न किए जा सकते हैं?
(1) प्रोपीन से प्रोपेन-1-अॉल
(2) एथेनॉल से ब्यूट-1-आइन
(3) 1-ब्रोमोप्रोपेन से 2-ब्रोमोप्रोपेन
(4) टॉलूईन से बेन्ज़िल एेल्कोहॉल
(5) बेन्जीन से 4-ब्रोमोनाइट्रोबेन्जीन
(6) बेन्ज़िल एेल्कोहॉल से 2-फेनिल एथेनॉइक अम्ल
(7) एथेनॉल से प्रोपेन नाइट्राइल
(8) एेनिलीन से क्लोरोबेन्जीन
(9) 2-क्लोरोब्यूटेन से 3, 4-डाइमेथिलहेक्सेन
(10) 2-मेथिल-1-प्रोपीन से 2-क्लोरो-2-मेथिलप्रोपेन
(11) एथिल क्लोराइड से प्रोपेनॉइक अम्ल
(12) ब्यूट-1-ईन से n-ब्यूटिल आयोडाइड
(13) 2-क्लोरोप्रोपेन से 1- प्रोपेनॉल
(14) आइसोप्रोपिल एेल्कोहॉल से आयडोफार्म
(15) क्लोरोबेन्जीन से p-नाइट्रोफ़ीनॉल
(16) 2-ब्रोमोप्रोपेन से 1-ब्रोमोप्रोपेन
(17) क्लोरोएथेन से ब्यूटेन
(18) बेन्जीन से डाइफ़ेनिल
(19) तृतीयक-ब्यूटिल ब्रोमाइड से आइसो-ब्यूटिल ब्रोमाइड
(20) एेनिलीन से फ़ेनिलआइसोसायनाइड
10.20 एेल्किल क्लोराइड की जलीय KOH से अभिक्रिया द्वारा एेल्कोहॉल बनती है लेकिन एेल्कोहॉलिकKOH की उपस्थिति में एेल्कीन मुख्य उत्पाद के रूप में प्राप्त होती है। समझाइए।
10.21 प्राथमिक एेल्किल हैलाइड C4H9Br (क), एेल्कोहॉलिक KOH में अभिक्रिया द्वारा यौगिक (ख) देता है। यौगिक ‘ख’ HBr के साथ अभिक्रिया से यौगिक ‘ग’ देता है जो कि यौगिक ‘क’ का समावयवी है। जब यौगिक ‘क’ की अभिक्रिया सोडियम धातु से होती है तो यौगिक ‘घ’ C8H18 बनता है, जो कि ब्यूटिल ब्रोमाइड की सोडियम से अभिक्रिया द्वारा बने उत्पाद से भिन्न है। यौगिक ‘क’ का संरचना सूत्र दीजिए तथा सभी अभिक्रियाओं की समीकरण दीजिए।
10.22 तब क्या होता है जब–
(i) n-ब्यूटिल क्लोराइड को एेल्कोहॉलिक KOH के साथ अभिकृत किया जाता है?
(ii) शुष्क ईथर की उपस्थिति में ब्रोमोबेन्जीन की अभिक्रिया मैग्नीशियम से होती है?
(iii) क्लोरोबेन्जीन का जलअपघटन किया जाता है?
(iv) एथिल क्लोराइड की अभिक्रिया जलीय KOH से होती है?
(v) शुष्क ईथर की उपस्थिति में मेथिल ब्रोमाइड की अभिक्रिया सोडियम से होती है?
(vi) मेथिल क्लोराइड की अभिक्रिया KCN से होती है?
कुछ पाठ्यनिहित प्रश्नों केउत्तर
10.1
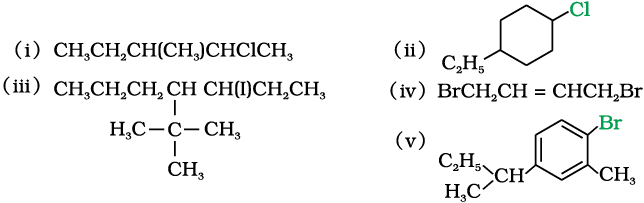
10.2 (i) एेल्कोहॉल के एेल्किल आयोडाइड में परिवर्तन के लिए KI के साथ H2SO4 का प्रयोग नहीं किया जा सकता; क्योंकि यह KI को संगतHI अम्ल में परिवर्तित कर देता है, तत्पश्चात् इसे I2 में आक्सीकृत कर देता है।
10.3
(I)ClCH2CH2CH2Cl
(II) ClCH2CHClCH3
(iii)Cl2CH2CH2CH3
(iv) CH3CCl2CH3
10.4
(i) चूँकि सभी हाइड्रोजन परमाणु समतुल्य हैं, अतः किसी भी हाइड्रोजन परमाणु के प्रतिस्थापन पर समान उत्पाद बनेगा।
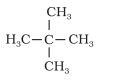
(ii) समतुल्य हाइड्रोजनों को a,b,c से निर्देशित किया गया है। समतुल्य हाइड्रोजनों के प्रतिस्थापन पर समान उत्पाद बनेंगें।
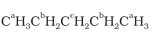
(iii) इसी प्रकार समतुल्य हाइड्रोजनों को a, b, c तथा d से निर्देशित किया गया है अतः चार समावयवी उत्पाद संभव हैं।
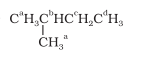
10.5
10.6 (i) क्लोरोमेथेन < ब्रोमोमेथेन < डाइब्रोमोमेथेन < ब्रोमोफार्म
अणुभार बढ़ने पर क्वथनांक बढ़ता जाता है।
(ii) आइसोप्रोपिल क्लोराइड < 1-क्लोरोप्रोपेन < 1-क्लोरोब्यूटेन
शाखित होने के कारण आइसोप्रोपिल क्लोराइड का गलनांक 1-क्लोरोप्रोपेन से कम होगा।
10.7
(i) 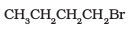
प्राथमिक हैलाइड होने के कारण कोई त्रिविम बाधा नहीं होगी।
(ii)
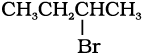
द्वितीयक हैलाइड, तृतीयक हैलाइड की तुलना में अधिक तीव्रता से अभिक्रिया करता है।
(iii)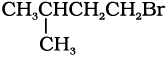
मेथिल समूह हैलाइड समूह के निकट होने के कारण त्रिविम बाधा अधिक होगी तथा अभिक्रिया का वेग कम होगा।
10.8
(i)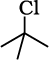
तृतीयक कार्बोकैटायन का स्थायित्व अधिक होने के कारण तृतीयक हैलाइड की अभिक्रियाशीलता द्वितीयक हैलाइड से अधिक होगी।
(ii)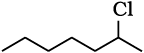
प्राथमिक कार्बोकैटायन की तुलना में द्वितीयक कार्बोकैटायन का स्थायित्व अधिक होने के कारण।
10.9