Table of Contents
एकक
12
एेल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप -
• एेल्डिहाइडों, कीटोनों एवं कार्बोक्सिलिक अम्लों के साधारण व IUPAC नाम लिख सकेंगे।
• कार्बोनिल व कार्बोक्सिलिक समूह युक्त यौगिकों की संरचना लिख सकेंगे।
• उपरोक्त वर्गों के यौगिकों के विरचन की महत्वपूर्ण विधियों एवं अभिक्रियाओं का वर्णन कर सकेंगे।
• एेल्डिहाइडों, कीटोनों एवं कार्बोक्सिलिक अम्लों के भौतिक गुणधर्मों, रासायनिक अभिक्रियाशीलता और संरचनाओं के मध्य परस्पर संबंध स्थपित कर सकेंगे।
• एेल्डिहाइडों व कीटोनों की कुछ चयनित अभिक्रियाओं की क्रियाविधि को समझा सकेंगे।
• कार्बोक्सिलिक अम्लों की अम्लता को प्रभावित करने वाले कारकों तथा उनकी अभिक्रियाओं को समझ सकेंगे।
• एेल्डिहाइडों, कीटोनों एवं कार्बोक्सिलिक अम्लों के उपयोगों का वर्णन कर सकेंगे।
कार्बनिक रसायन में कार्बोनिल यौगिकों का अत्यधिक महत्व है। यह वस्त्रों, सुगन्धों, प्लास्टिकों तथा औषधों के संघटक होते हैं।
पिछले एकक में आपने एेसे कार्बनिक यौगिकों का अध्ययन किया है, जिनमें प्रकार्यात्मक समूह में कार्बन तथा अॉक्सीजन परमाणु के मध्य एकल आबंध पाया जाता है। इस एकक में आप एेसे कार्बनिक यौगिकों के बारे में अध्ययन करेंगे जिनमें प्रकार्यात्मक समूह में कार्बन तथा अॉक्सीजन के मध्य द्विआबंध (>C=O) होता है जिसे कार्बोनिल समूह कहते हैं। यह कार्बनिक रसायन का एक महत्वपूर्ण प्रकार्यात्मक समूह है।
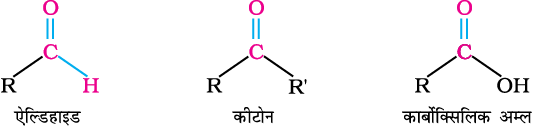
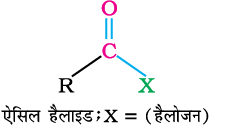
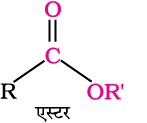
एेल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल पौधों और जीवों में विस्तृत रूप से पाए जाते हैं। ये जीवों की जैव रासायनिक प्रक्रिया में महत्वपूर्ण योगदान देते हैं। ये प्रकृति में सुगंध व स्वाद प्रदान करते हैं। उदाहरणार्थ, वेनेलिन (बेनीला सेम से प्राप्त) सौलिसिल एेल्डिहाइड (मेडोस्वीट से प्राप्त) तथा सिनेमैल्डिहाइड (दाल चीनी से प्राप्त) रुचिकर सुगंध देते हैं।
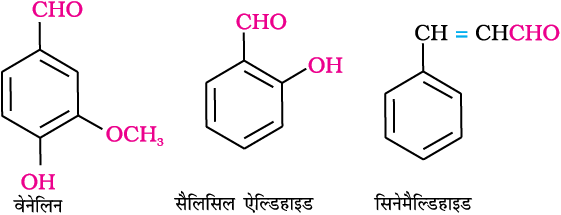
ये अनेक खाद्य उत्पादों व औषधों में सुगंध प्रदान करने के लिए प्रयुक्त होते हैं। इस वर्ग के कुछ यौगिकों का उत्पादन विलायक (एेसीटोन) और आसंजी (चिपकने वाले) पदार्थ, पेंट, रेज़िन, सुगंध, प्लास्टिक, वस्त्र आदि बनाने के लिए किया जाता है।
१२.१ कार्बोनिल यौगिकों का नामकरण एवं संरचना
12.1.1 नामपद्धति
(I) एेल्डिहाइड एवं कीटोन
एेल्डिहाइड एवं कीटोन सरलतम और अत्यंत महत्वपूर्ण कार्बोनिल यौगिक हैं।
एेल्डिहाइडों एवं कीटोनों के नामकरण की दो पद्धतियाँ हैं–
(क) सामान्य नाम–
एेल्डिहाइड एवं कीटोन प्रायः IUPAC नामपद्धति की अपेक्षा अपने सामान्य नामों से जाने जाते हैं। एेल्डिहाइड के सामान्य नाम संगत कार्बोक्सिलिक अम्लों (खंड 12.6.1) के अंग्रेज़ी में लिखे सामान्य नामों के अंत में स्थित अनुलग्न इक के स्थान पर एेल्डिहाइड अनुलग्न लगाकर प्राप्त करते हैं। साथ ही कार्बोक्सिलिक अम्ल या एेल्डिहाइड के नाम में वास्तविक स्रोत का नाम लेटिन या ग्रीक में प्रतिबिंबित होता है। कार्बन शृंखला में प्रतिस्थापियों की स्थिति को ग्रीक अक्षरों α, β, γ, δ, आदि से प्रदर्शित करते हैं। α उस कार्बन परमाणु को कहते हैं जो सीधे एेल्डिहाइड समूह के कार्बन परमाणु से संलग्न होता है। तत्पश्चात् β कार्बन तथा अन्य इसी क्रम में आगे चलते हैं। उदाहरणार्थ–

कीटोनों के सामान्य नाम व्युत्पन्न करने के लिए कार्बोनिल समूह से जुड़े दो एेल्किल या एेरिल समूहों का नामकरण किया जाता है। प्रतिस्थापियों की स्थिति को ग्रीक अक्षरों α α′, β β′ आदि द्वारा प्रदर्शित करते हैं। α α′ कार्बन परमाणु वे होते हैं जो सीधे कार्बोनिल समूह (> C = O) से संलग्न होते हैं। कुछ कीटोनों के एेतिहासिक सामान्य नाम होते हैं जैसे सरलतम डाइमेथिल कीटोन को एेसीटोन कहते हैं। एेल्किल फ़ेनिल कीटोन का नाम लिखने के लिए एेसिल समूह के नाम को फ़ीनॉन शब्द के साथ पूर्वलग्न की तरह जोड़कर लिखा जाता है; उदाहरणार्थ–
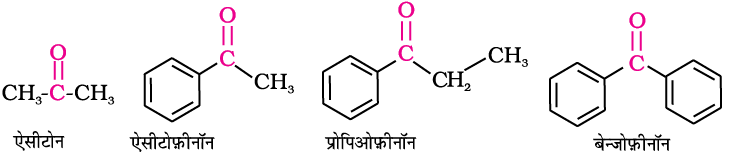
(ख) आईयूपीएसी (IUPAC) नाम—
खुली शृंखला वाले एलिफैटिक एेल्डिहाइडों एवं कीटोनों के IUPAC नाम प्राप्त करने के लिए संगत एेल्केन के अंग्रेज़ी में लिखे नाम के अंत में स्थित इ (–e) के स्थान पर क्रमशः अल (– al) एवं ओन (– one) अनुलग्न लगाते हैं। एेल्डिहाइडों में कार्बन की सबसे लंबी शृंखला का अंकन उस सिरे से शुरू किया जाता है जहाँ एेल्डिहाइड समूह स्थित होता है जबकि कीटोनों में उस सिरे से अंकन करते हैं, जो कार्बोनिल समूह के निकट होता है। प्रतिस्थापियों को पूर्वलग्न के रूप में अंग्रेज़ी वर्णमाला के क्रमानुसार, कार्बन शृंखला में अंकों द्वारा स्थिति प्रदर्शित करते हुए लिखते हैं। चक्रीय कीटोनों पर भी यही नियम लागू होता है, जिनमें कार्बोनिल के कार्बन परमाणु की स्थिति की संख्या एक (1) होती है। जब एेल्डिहाइड समूह वलय से संयुक्त होता है तो साइक्लोएेल्केन (चक्रीय एेल्केन) का नाम लिखने के पश्चात् अनुलग्न कार्बैल्डिहाइड (Carbaldehyde) जोड़ देते हैं। वलय के कार्बन परमाणुओं का संख्यांकन उस कार्बन परमाणु से आरंभ करते हैं, जिससे एेल्डिहाइड समूह संयुक्त होता है। सरलतम एेरोमेटिक एेल्डिहाइड, जिसमें एेल्डिहाइड समूह बेन्जीन वलय पर स्थित होता है, का नाम बेन्ज़ीनकार्बैल्डिहाइड है। यद्यपि, IUPAC पद्धति द्वारा सामान्य नाम बेन्जैल्डिहाइड भी स्वीकृत है। अन्य प्रतिस्थापित एेरोमैटिक एेल्डिहाइडों के नाम बेन्जैल्डिहाइड के व्युत्पन्न के रूप में दिए जाते हैं।
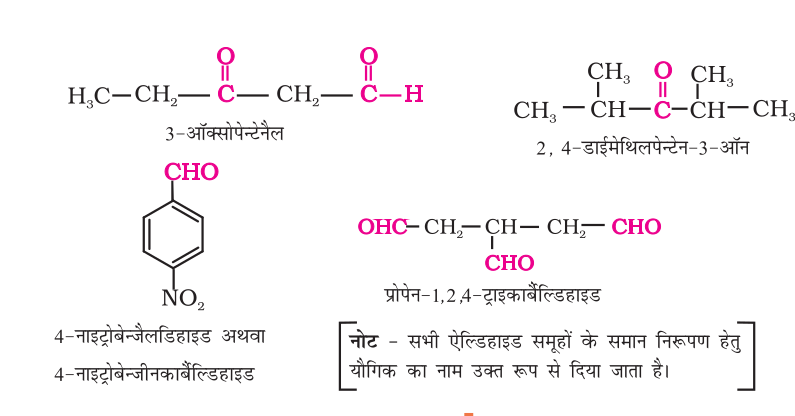
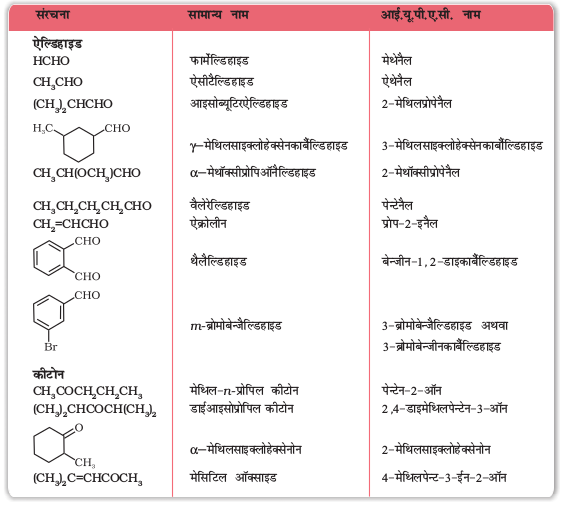
सारणी 12-1 ऐल्डिहाइडों व कीटोनों के सामान्य और IUPAC नाम
12.1.2 कार्बोनिल समूह की संरचना
कार्बोनिल समूह में कार्बन परमाणु sp2 संकरित अवस्था में होता है तथा तीन सिग्मा (σ) आबंध निर्मित करता है। कार्बन का चौथा संयोजकता इलेक्ट्रॉन कार्बन के असंकरित p-कक्षक में होता है तथा अॉक्सीजन के p-कक्षक के साथ अतिव्यापन करके एक π आबंध बनाता है। इसके अतिरिक्त अॉक्सीजन परमाणु पर दो अनाबंधी इलेक्ट्रॉन युगल उपस्थित होते हैं। इस प्रकार कार्बोनिल समूह का कार्बन तथा इससे आबंधित तीन परमाणु एक ही तल में होते हैं एवं π इलेक्ट्रॉन अभ्र इस तल के ऊपर एवं नीचे होता है। बंधक कोण लगभग 120° का होता है जैसा कि समतलीय त्रिकोणीय संरचना में अपेक्षित है (चित्र 12.1)।
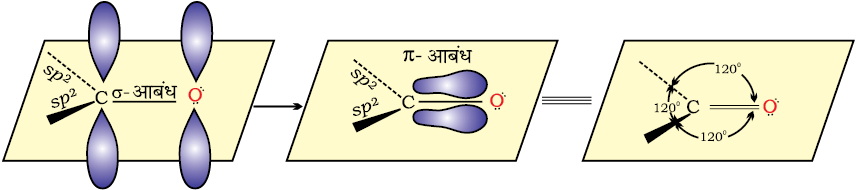
चित्र 12.1— कार्बोनिल समूह निर्माण का कक्षीय आरेख
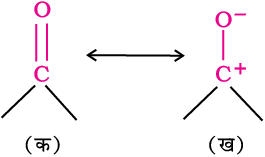
कार्बन की अपेक्षा अॉक्सीजन की विद्युतऋणात्मकता उच्च होने के कारण कार्बन-अॉक्सीजन द्विक् आबंध ध्रुवित हो जाता है। अतः कार्बोनिल समूह का कार्बन एक इलेक्ट्रॉनरागी (लूइस अम्ल) केंद्र और कार्बोनिल अॉक्सीजन एक नाभिकरागी (लूइस क्षारक) केंद्र होता है। कार्बोनिल यौगिकों में पर्याप्त द्विध्रुव आघूर्ण होता है और ये ईथर से अधिक ध्रुवीय होते हैं। कार्बोनिल समूह की उच्च ध्रुवता, अनुनाद के आधार पर समझाई जा सकती है, जिसमें एक उदासीन संरचना (क) एवं एक द्विध्रुव संरचना (ख) है जैसा कि चित्र में प्रदर्शित किया गया है।
पाठ्यनिहित प्रश्न
12.1 निम्न यौगिकों की संरचना लिखिए-
(I) α-मेथॉक्सीप्रोपिऑनऐल्डिहाइड
(II) 3-हाइड्रॉक्सीब्यूटेनैल
(III) 2-हाइड्रॉक्सीसाइक्लोपेन्टेन कार्बैल्डिहाइड
(IV) 4-ऑक्सोपेन्टेनैल
(V) डाइ-द्वितीयकब्यूटिल कीटोन
(VI) 4-क्लोरोऐसीटोफीनॉन
१२.२ एेल्डिहाइडों एवं कीटोनों का विरचन
एेल्डिहाइडों एवं कीटोनों के विरचन की कुछ महत्वपूर्ण विधियाँ इस प्रकार हैं–
12.2.1 एेल्डिहाइडों एवं कीटोनों का विरचन
1. एेल्कोहॉलों के अॉक्सीकरण से
सामान्यतः एेल्डिहाइड एवं कीटोन क्रमशः प्राथमिक व द्वितीयक एेल्कोहॉलों के अॉक्सीकरण से बनाए जाते हैं (एकक 11, कक्षा XII)।
2. एेल्कोहॉलों के विहाइड्रोजनन से
यह विधि वाष्पशील एेल्कोहॉलों के लिए उचित होती है तथा यह एक औद्योगिक अनुप्रयोग की विधि है। इस विधि में एेल्कोहॉल के वाष्प को तप्त भारी-धातु उत्प्रेरक (सिल्वर अथवा कॉपर) के ऊपर से प्रवाहित करते हैं, जिसके फलस्वरूप प्राथमिक व द्वितीयक एेल्कोहॉल क्रमशः एेल्डिहाइड व कीटोन देते हैं (एकक 11 कक्षा XII)।
3. हाइड्रोकार्बन से
(i) एेल्कीनों के ओज़ोनी अपघटन से- जैसा कि हम जानते हैं एेल्कीनों के ओज़ोनी अपघटन के पश्चात् प्राप्त उत्पाद की ज़िंक धूल व जल के साथ अभिक्रिया के द्वारा एेल्डिहाइड या कीटोन अथवा दोनों का मिश्रण प्राप्त होता है, जो एेल्कीन में उपस्थित प्रतिस्थापन के प्रकार पर निर्भर करता है। (एकक 13, कक्षा XI)
(ii) एेल्काइनों के जलयोजन से- H2SO4 एवं HgSO4 की उपस्थिति में एथाइन में जलयोजन द्वारा एेसीटैल्डिहाइड प्राप्त होता है। अन्य सभी एेल्काइनें इस अभिक्रिया द्वारा कीटोन प्रदान करती हैं (एकक 13, कक्षा XI)।
12.2.2 एेल्डिहाइडों का विरचन
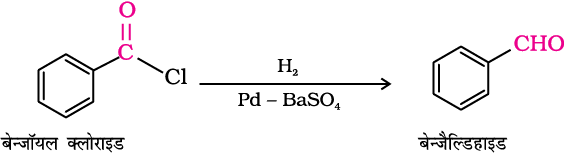
1. एेसिल क्लोराइड से (अम्ल क्लोराइड)
एेसिल क्लोराइड (अम्ल क्लोराइड) के बेरियम सल्फेट पर अवलंबित पैलेडियम उत्प्रेरक पर हाइड्रोजनन से एेल्डिहाइड प्राप्त होते हैं। इस अभिक्रिया को रोज़ेनमुंड अपचयन (Rosenmund Reduction) कहते हैं।
2. नाइट्राइल एवं एस्टर से
हाइड्रोक्लोरिक अम्ल की उपस्थिति में नाइट्राइल स्टैनस क्लोराइड द्वारा संगत इमीन में अपचित हो जाते हैं। जो जलअपघटन करने पर संगत एेल्डिहाइड देते हैं।

यह अभिक्रिया स्टीफैन अभिक्रिया (Stephen Reaction) कहलाती है।
वैकल्पिक अभिक्रिया में नाइट्राइल को डाइआइसोब्यूटिलएेलुमिनियम हाइड्राइड(DIBAL-H) द्वारा चयनित अपचयन से इमीन में बदल लेते हैं एवं तत्पश्चात् इसके जलअपघटन से एेल्डिहाइड प्राप्त हो जाता है।
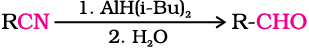
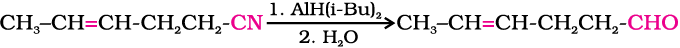
इसी प्रकार से एस्टर भी DIBAL–H द्वारा एेल्डिहाइड में अपचित हो जाते हैं।
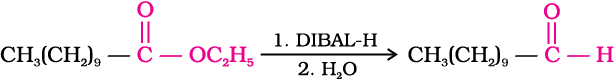
3. हाइड्रोकार्बन से
एेरोमैटिक एेल्डिहाइड (बेन्जैल्डिहाइड व इसके व्युत्पन्न) एेरोमैटिक हाइड्रोकार्बन द्वारा निम्न प्रकार से बनाए जाते हैं–
(i) मेथिल बेन्जीन के अॉक्सीकरण द्वारा–
प्रबल अॉक्सीकरण कर्मक टॉलूईन व इसके व्युत्पन्नों को बेन्ज़ोइक अम्ल में अॉक्सीकृत कर देते हैं। इस अॉक्सीकरण को उपयुक्त अभिकर्मकों द्वारा एेल्डिहाइड चरण में ही रोकना संभव है। यह मेथिल समूह को एक मध्यवर्ती में परिवर्तित कर देते हैं जिसे पुनः अॉक्सीकृत करना कठिन होता है। इसके लिए निम्न विधियों का उपयोग किया जाता है–
(क) क्रोमिल क्लोराइड के उपयोग से—
क्रोमिल क्लोराइड (CrO2Cl2) मेथिल समूह को एक क्रोमियम संकुल में अॉक्सीकृत कर देता है जो जल अपघटन द्वारा संगत बेन्जैल्डिहाइड बनाता है।
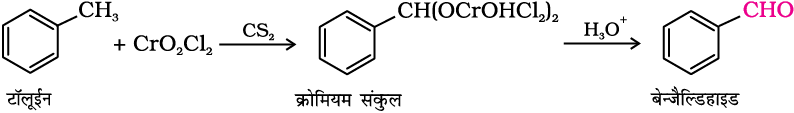
यह अभिक्रिया ईटार्ड अभिक्रिया (Etard Reaction) कहलाती है।
(ख) क्रोमिक अॉक्साइड के उपयोग से (CrO3)—
टॉलूईन या प्रतिस्थापित टॉलूईन को एेसीटिक एनहाइड्राइड में क्रोमिक अॉक्साइड के साथ अभिकृत कराने पर बेन्जिलिडीन डाइएेसीटेट प्राप्त होता है। बेन्जिलिडीन डाइएेसीटेट जलीय अम्ल के साथ जल अपघटित होकर संगत बेन्जैल्डिहाइड बनाता है।
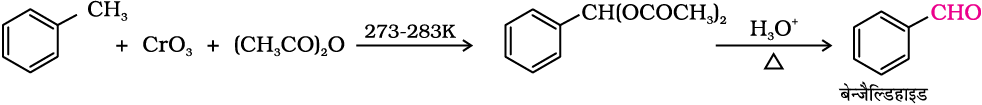
(ii) पार्श्व शृंखला के क्लोरीनन के पश्चात् जल अपघटन—
टॉलूईन पार्श्व शृंखला क्लोरीनन द्वारा बेन्जल क्लोराइड देती है, जो जल अपघटन द्वारा बेन्जैल्डिहाइड बनाता है। यह बेन्जैल्डिहाइड के औद्योगिक उत्पादन की विधि है।
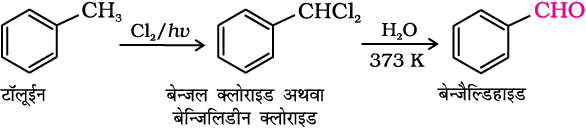
(iii) गाटरमान-कॉख अभिक्रिया से—
जब बेन्जीन या इसके व्युत्पन्न निर्जल एेलुमिनियम क्लोराइड या क्यूप्रस क्लोराइड की उपस्थिति में कार्बन मोनोअॉक्साइड और हाइड्रोजन क्लोराइड के साथ क्रिया करते हैं, तो बेन्जैल्डिहाइड या प्रतिस्थापित बेन्जैल्डिहाइड प्राप्त होते हैं।

12.2.3 कीटोनों का विरचन
यह अभिक्रिया गाटरमान-कॉख अभिक्रिया (Gatterman-Koch Reaction) कहलाती हैं।
1. एेसिल क्लोराइड से
ग्रीन्यार अभिकर्मक तथा कैडमियम क्लोराइड की अभिक्रिया से प्राप्त डाइएेल्किलकैडमियम की एेसिल क्लोराइड से अभिक्रिया कराने पर कीटोन प्राप्त होते हैं।
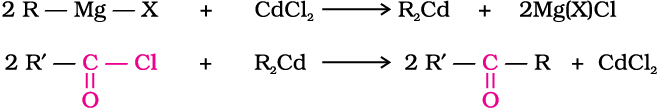
2. नाइट्राइल से -
नाइट्राइल व ग्रीन्यार अभिकर्मक की क्रिया से प्राप्त उत्पाद का जल अपघटन कराने से कीटोन प्राप्त होते हैं।
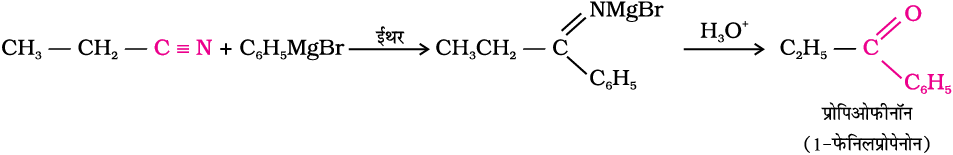
3. बेन्जीन या प्रतिस्थापित बेन्जीन से-
निर्जल एेलुमिनियम क्लोराइड की उपस्थिति में बेन्जीन या प्रतिस्थापित बेन्जीन, अम्ल क्लोराइड के साथ अभिक्रिया कर संगत कीटोन देते हैं। यह अभिक्रिया फ्रीडेल-क्राफ्ट्स एेसीटिलन अभिक्रिया (Friedal-Craft's Acylation reaction) कहलाती हैं।

उदाहरण 12.1
निम्नलिखित रूपांतरणों को करने के लिए अभिकिर्मकों के नाम बताइए–
(i) हेक्सेन-1-अॉल से हेक्सेनैल (iv) एेथेन नाइट्राइल से एेथेनैल
(ii) साइक्लोहेक्सेनॉल से साइक्लोहेक्सेनोन (v) एेलिल एेल्कोहॉल से प्रोपिनैल
(iii) p-फ्लुओरोटॉलुईन से p-फ्लुओरोबेन्जैल्डिहाइड (vi) ब्यूट-2-ईन से एेथेनैल
हल
(i) C5H5NH + CrO3Cl – (PCC) (v) पीसीसी
(ii) एन्हाइड्रस CrO3 (vi) O3/H2O-ज़िंक धूल
(iii) CrO3 (CH3 CO)2 की उपस्थिति में / 1. CrO2Cl2 2. HOH
(iv) डाईआइसोब्युटिलएेलुमिनियमहाइड्राइड (DIBAL-H)
पाठ्यनिहित प्रश्न
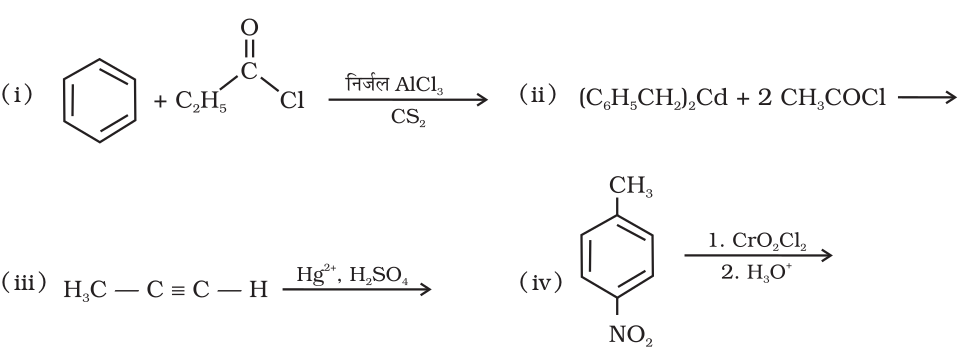
12.2 निम्न अभिक्रियाओं के उत्पादों की संरचना लिखिए–
१२.३ भौतिक गुणधर्म
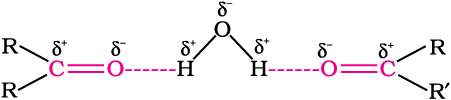
परंतु जैसे-जैसे एेल्किल शृंखला की लंबाई बढ़ती है, इनकी घुलनशीलता तेज़ी से घटती जाती है। सभी एेल्डिहाइड व कीटोन सभी कार्बनिक विलायकों जैसे— बेन्जीन, ईथर, मेथेनॉल, क्लोरोफॉर्म इत्यादि में सुगमतापूर्वक घुलनशील होते हैं। निम्नतर एेल्डिहाइड में तीक्ष्ण गंध होती हैं। जैसे-जैसे अणुओं का आकार बढ़ता जाता है गंध कम तीक्ष्ण होती जाती है तथा सुगंध बढ़ती जाती है। वास्तव में प्रकृति में पाए जाने वाले अनेक एेल्डिहाइडों व कीटोनों का उपयोग सुगंध व सुरुचि कर्मकों के सम्मिश्रण में किया जाता है।
उदाहरण 12.2
निम्नलिखित यौगिकों को क्वथनांकों के बढ़ते क्रम में व्यवस्थित कीजिएकृ
CH3CH2CH2CHO, CH3CH2CH2CH2OH, H5C2-O-C2H5, CH3CH2CH2CH3
हल
यौगिकों के आण्विक द्रव्यमान 72 से 74 के परास में हैं। क्योंकि केवल ब्यूटेन-1-ऑल ही अत्यधिक अंतराआण्विक हाइड्रोजन आबंधन के कारण संगुणित द्रव है, इसलिए इसका क्वथनांक सबसे अधिक होगा। ब्यूटेनैल, एथॉक्सीएथेन से अधिक ध्रुवीय है अतः ब्यूटेनैल में अंतराआण्विक द्विध्रुव आकर्षण प्रबल होता है। n-पेन्टेन में केवल दुर्बल वांडरवाल्स बल होते हैं, अतः दिए गए यौगिकों के क्वथनांक बढ़ते क्रम में इस प्रकार होंगे-
CH3CH2CH2CH3 < H5C2-O-C2H5 < CH3CH2CH2CHO < CH3CH2CH2CH2OH
पाठ्यनिहित प्रश्न
12.3 निम्नलिखित यौगिकों को उनके क्वथनांकों के बढ़ते क्रम में व्यवस्थित कीजिए।
CH3CHO, CH3CH2OH, CH3OCH3, CH3CH2CH3
१२.४ रासायनिक अभिक्रियाएँ
एेल्डिहाइड एवं कीटोन, दोनों में कार्बोनिल क्रियात्मक समूह विद्यमान हैं अतः ये एक समान रासायनिक अभिक्रियाएँ प्रदर्शित करते हैं।
1. नाभिकरागी योगज अभिक्रिया
एेल्कीनों में जैसी इलेक्ट्रॉनरागी योगज अभिक्रियाएँ देखी जाती हैं (देखें एकक 13, कक्षा XI), उसके विपरीत एेल्डिहाइड व कीटोन नाभिकरागी योगज अभिक्रियाएँ प्रदर्शित करते हैं।
(i) नाभिकरागी योगज अभिक्रियाओं की क्रियाविधि—

चित्र 12.2– कार्बोनिल कार्बन पर नाभिकरागी आक्रमण
(ii) अभिक्रियाशीलता—
उदाहरण 12.3
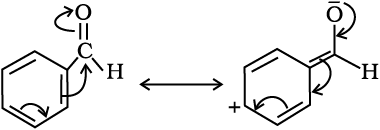
नाभिकरागी योगज अभिक्रिया में बेन्जैल्डिहाइड प्रोपेनैल से कम अभिक्रियाशील होगा अथवा अधिक, आप क्या अपेक्षा करेंगे? अपने उत्तर की व्याख्या कीजिए।
हल
बेन्जैल्डिहाइड में कार्बोनिल समूह का कार्बन परमाणु प्रोपेनैल के कार्बोनिल समूह के कार्बन की तुलना में कम इलेक्ट्रॉनरागी होता है। बेन्जैल्डिहाइड में अनुनाद के कारण कार्बोनिल समूह की ध्रुवता कम हो जाती है, जैसा कि चित्र में दिखाया गया है अतः यह प्रोपेनल से कम अभिक्रियाशील होता है।
(iii) नाभिकरागी योगज और नाभिकरागी योगज-विलोपन अभिक्रियाओं के कुछ महत्वपूर्ण उदाहरण–
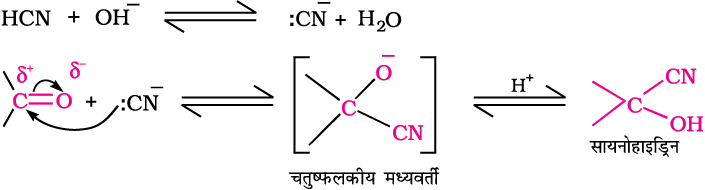
(क) हाइड्रोजन सायनाइड (HCN) का संयोजन
एेल्डिहाइड व कीटोन हाइड्रोजन सायनाइड से (HCN) अभिकृत होकर संगत सायनोहाइड्रिन देते हैं। शुद्ध HCN के साथ यह अभिक्रिया बहुत धीमी होती है; अतः यह क्षार द्वारा उत्प्रेरित की जाती है और जनित सायनाइड आयन प्रबल नाभिकस्नेही (CN–) कार्बोनिल यौगिकों पर संयोजित होकर संगत सायनोहाइड्रिन देते हैं।
सायनोहाइड्रिन उपयोगी संश्लेषित मध्यवर्ती होते हैं।
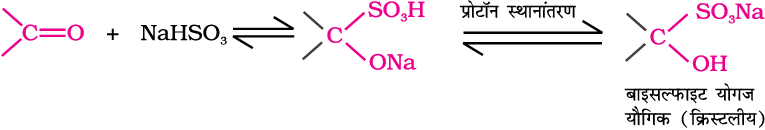
(ख) सोडियम बाइसल्फाइड का संयोजन—
एेल्डिहाइड एवं कीटोन सोडियम हाइड्रोजन सल्फाइट के साथ संयुक्त होकर योगज उत्पाद देते हैं।
त्रिविमीय प्रभाव के कारण साम्यावस्था की स्थिति अधिकांश एेल्डिहाइडों के लिए दाईं ओर तथा अधिकतर कीटोनों के लिए बाईं ओर होती है। हाइड्रोजन सल्फाइट योगज उत्पाद जल में अविलेय होता है, जो तनु खनिज अम्लों अथवा क्षार के साथ अभिक्रिया कर पुनः मूल कार्बोनिल यौगिकों में परिवर्तित किया जा सकता है। इसलिए यह एेल्डिहाइडों के पृथक्करण व परिष्करण के लिए उपयोगी होते हैं।
(ग) ग्रिन्यार अभिकर्मकों का संयोजन (देखिए एकक 11, कक्षा XII)
(घ) एेल्कोहॉलों का संयोजन—
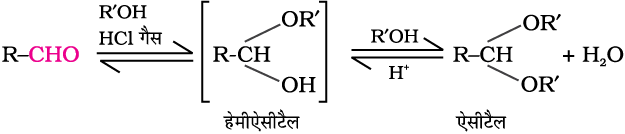
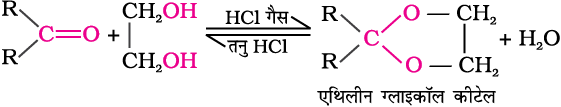
कीटोन इन्हीं अभिक्रिया परिस्थितियों में एथिलीन ग्लाइकॉल के साथ अभिक्रिया करके चक्रीय उत्पाद बनाते हैं, जिसे एथिलीन ग्लाइकॉल कीटेल कहते हैं।
शुष्क हाइड्रोजन क्लोराइड कार्बोनिल समूह की अॉक्सीजन को प्रोटॉनीकृत करती है, जिससे कार्बोनिल समूह की इलेक्ट्रॉनरागी प्रवृत्ति बढ़ती है जो एथिलीन ग्लाइकॉल पर नाभिकरागी आक्रमण को सरल बनाती है। एेसीटैल व कीटेल जलीय खनिज अम्लों के साथ जलअपघटित होकर क्रमशः संगत एेल्डिहाइड व कीटोन देते हैं।
(च) अमोनिया व इसके व्युत्पन्नों का संयोजन–
अमोनिया व इसके व्युत्पन्न H2N–Z जैसे नाभिकरागी एेल्डिहाइड व कीटोन के कार्बोनिल समूह पर जुड़ते हैं। यह अभिक्रिया उत्क्रमणीय होती है तथा अम्ल से उत्प्रेरित होती है। मध्यवर्ती के द्रुत निर्जलीकरण द्वारा > C = N-Z बनने के कारण साम्यावस्था उत्पाद को बनाने में सहायक होती है।
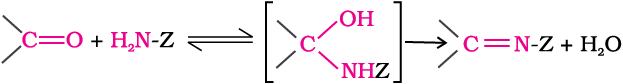
Z= एेल्किल, एेरिल, OH, NH2,
C6H5NH, NHCONH2, आदि।
सारणी 12-2 दृ ऐल्डिहाइडों व कीटोनों (झब्=छर्दृ)दृ के कुछ छ- प्रतिस्थापित व्युत्पन्न

2. अपचयन
(i) एेक्लोहॉलों में अपचयन—
सोडियम बोरोहाइड्राइड (NaBH4) अथवा लीथियम एेलुमिनियम हाइड्राइड (LiAlH4) या उत्प्रेरकी हाइड्रोजनन द्वारा एेल्डिहाइड व कीटोन अपचित होकर क्रमशः प्राथमिक तथा द्वितीयक एेल्कोहॉल देते हैं (एकक II, कक्षा XII)।
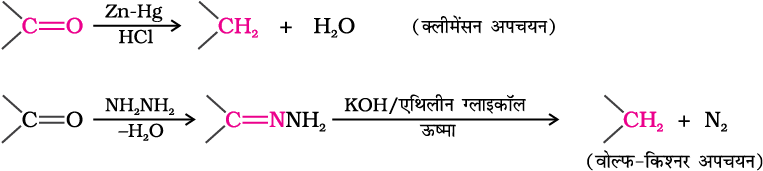
(ii) हाइड्रोकार्बनों में अपचयन—
एेल्डिहाइड एवं कीटोनों का कार्बोनिल समूह अमलगमित जिंक एवं सांद्र हाइड्रॉक्लोरिक अम्ल द्वारा अभिक्रिया से, (क्लीमेन्सन अपचयन) या हाइड्रैज़ीन के साथ अभिक्रिया करने के बाद, एेथिलीन ग्लाइकॉल जैसे उच्च क्वथनांक वाले विलायक में सोडियम या पोटैशियम हाइड्रॉक्साइड के साथ गरम करने पर – CH2 समूह में परिवर्तित हो जाता है (वोल्फ-किश्नर अपचयन)।
बर्नार्ड टॉलेन्स (1841-1918) गौटिन्गेन विश्वविद्यालय, जर्मनी में रसायनविज्ञान के प्रोफ़ेसर थे।
3. अॉक्सीकरण
अॉक्सीकरण अभिक्रिया में एेल्डिहाइड कीटोन से भिन्न व्यवहार करते हैं। एेल्डिहाइड सामान्य अॉक्सीकारकों— जैसे, नाइट्रिक अम्ल, पोटैशियम परमैंगनेट, पोटैशियम डाइक्रोमेट आदि के द्वारा अॉक्सीकृत होकर कार्बोक्सिलिक अम्ल देते हैं। यहाँ तक की मृदु अॉक्सीकरण कर्मक मुख्यतया टॉलेन अभिकर्मक और फेलिंग विलयन भी एेल्डिहाइडों को अॉक्सीकृत कर देते हैं।
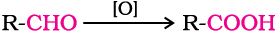
कीटोनों का अॉक्सीकरण सामान्यतः प्रबल परिस्थितियों, जैसे— प्रबल अॉक्सीकरण कर्मकों और उच्च ताप पर होता है। इनके अॉक्सीकरण में कार्बन-कार्बन आबंध का विदलन होता है, जिससे अनेक कार्बोक्सिलिक अम्लों का मिश्रण प्राप्त होता है। जिनमें कार्बन परमाणुओं की संख्या, मूल कार्बोनिल यौगिक के कार्बन परमाणुओं से कम होती है।

नीचे दिए गए मृदु अॉक्सीकरण कर्मक एेल्डिहाइडों और कीटोनों में विभेद करने के लिए प्रयुक्त होते हैं-
(i) टॉलेन-परीक्षण–
एेल्डिहाइड को ताज़ा बने अमोनियामय सिल्वर नाइट्रेट विलयन (टॉलेन अभिकर्मक) के साथ गर्म करने पर सिल्वर धातु बनने के कारण चमकदार सिल्वर दर्पण बन जाता है। एेल्डिहाइड संगत कार्बोक्सिलेट ऋणायन में अॉक्सीकृत हो जाते हैं। यह अभिक्रिया क्षारीय माध्यम में संपन्न होती है।

(ii) फेलिंग-परीक्षण—
फेलिंग अभिकर्मक में दो विलयन फेलिंग विलयन A व फेलिंग विलयन B होते हैं। फेलिंग विलयन A जलीय कॉपर सल्फेट तथा फेलिंग विलयन B सोडियम पोटैशियम टाट्रेेρट (रोशेल लवण) होता है। परीक्षण से पूर्व दोनों विलयन समान मात्रा में मिलाए जाते हैं। एेल्डिहाइड को फेलिंग विलयन के साथ गर्म करने पर लाल- भूरा अवक्षेप प्राप्त होता है। एेल्डिहाइड संगत कार्बोक्सिलेट ऋणायन में अॉक्सीकृत हो जाते हैं। एेरोमैटिक एेल्डिहाइड इस परीक्षण के प्रति प्रतिक्रिया नहीं दर्शाते।

(iii) मेथिल कीटोन का हैलोफॉर्म अभिक्रिया द्वारा अॉक्सीकरण—
एेसे कीटोन जिसमें कम से कम एक मेथिल समूह कार्बोनिल कार्बन परमाणु से आबंधित होता है (मेथिल कीटोन), सोडियम हाइपोहैलाइट द्वारा संगत कार्बोक्सिलिक अम्ल के सोडियम लवण में आक्सीकृत हो जाते हैं, जिसमें कार्बोनिल यौगिक की अपेक्षा एक कार्बन परमाणु कम होता है। मेथिल समूह हैलाफार्म में परिवर्तित हो जाता है। यदि अणु में कार्बन-कार्बन द्विकआबंध उपस्थित हो तो वह इस अॉक्सीकरण द्वारा अप्रभावित रहता है।

सोडियम हाइपोआयोडॉइट द्वारा आयोडोफॉर्म अभिक्रिया, भी CH3CO या CH3CH(OH) समूह की पहचान करने के लिए प्रयुक्त होती है, जो अॉक्सीकरण द्वारा CH3CO समूह बनाती हैं।
उदाहरण 12.4
एक कार्बनिक यौगिक (A) जिसका आण्विक सूत्र C8H8O है, 2, 4-डाईनाइट्रोप़्ाफ़ेनिल हाइड्रैजीन (2, 4 डी-एन-पी-) अभिकर्मक के साथ नारंगी-लाल अवक्षेप प्रदान करता है और सोडियम हाइड्रॉक्साइड की उपस्थिति में आयोडीन के साथ गर्म करने पर एक पीले रंग का अवक्षेप बनाता है। यह यौगिक टॉलेन-अभिकर्मक अथवा फेलिग-विलयन को अपचित नहीं करता और न ही यह ब्रोमीन जल अथवा बेयर-अभिकर्मक को वर्णविहीन करता है। यह क्रोमिक अम्ल द्वारा प्रबल ऑक्सीकरण से एक कार्बोक्सिलिक अम्ल (B) बनाता है जिसका आण्विक सूत्र C7H6O2 है। यौगिक (A) व (B) को पहचानिए एवं प्रयुक्त अभिक्रियाओं को समझाइए।
हल
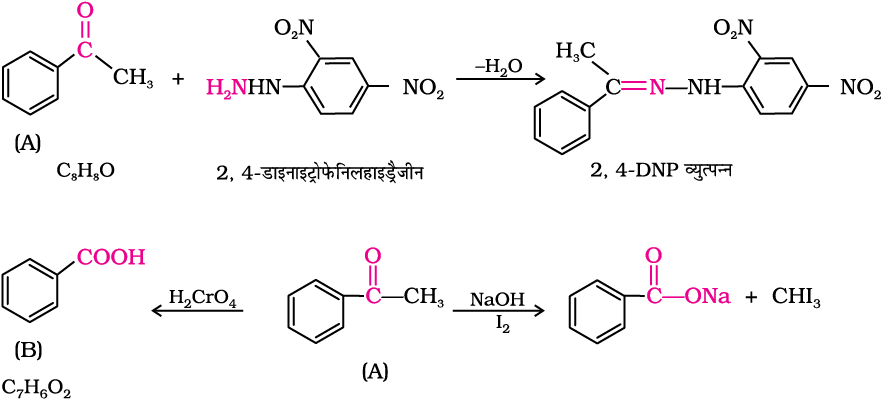
4. α-हाइड्रोजन के कारण होने वाली अभिक्रियाएँ
एेल्डिहाइड व कीटोन के α- हाइड्रोजन परमाणुओं की अम्लता–एेल्डिहाइड व कीटोन α-हाइड्रोजन की अम्लता के कारण कई अभिक्रियाएँ देते हैं।
कार्बोनिल यौगिकों के α-हाइड्रोजन परमाणुओं की अम्लता कार्बोनिल समूह के इलेक्ट्रॉन अपनयन कर लेने (खींच लेने) के प्रबल प्रभाव तथा संयुग्मी क्षार के अनुनाद द्वारा स्थायित्व प्राप्त कर लेने के कारण होती है।
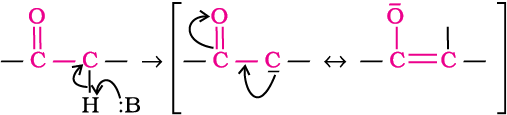
(i) एेल्डोल संघनन–
जिन एेल्डिहाइडों व कीटोनों में कम से कम एक α-हाइड्रोजन विद्यमान होती है, वे तनु क्षार के उत्प्रेरक की तरह उपस्थिति में एक अभिक्रिया द्वारा क्रमशः β-हाइड्रॉक्सी एेल्डिहाइड (एल्डोल) अथवा β-हाइड्रॉक्सी कीटोन (कीटोल) प्रदान करते हैं। इस अभिक्रिया को एेल्डोल अभिक्रिया कहते हैं।
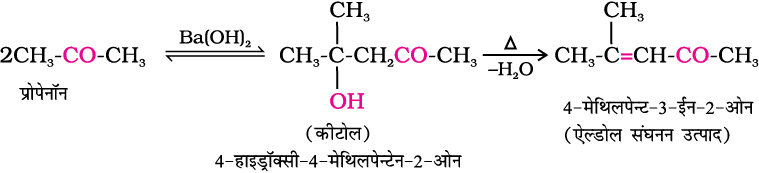
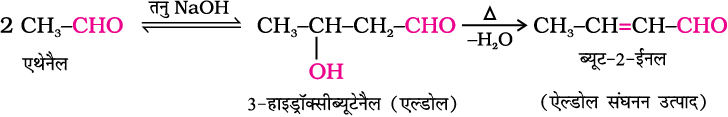
उत्पाद में विद्यमान दो प्रकार्यात्मक समूहों, एेल्डिहाइड व एेल्कोहॉल के नामों से एेल्डोल का नाम व्युत्पन्न होता है। एेल्डोल व कीटोल आसानी से जल निष्कासित करके α, β -असंतृप्त कार्बोनिल यौगिक देते हैं, जो एेल्डोल संघनन उत्पाद हैं और यह अभिक्रिया एेल्डोल संघनन कहलाती है। यद्यपि कीटोन, कीटोल (कीटो व एेल्कोहॉल समूह युक्त यौगिक) निर्मित करते हैं फिर भी उनकी एेल्डिहाइडों के साथ समानता होने के कारण उनकी अभिक्रिया के लिए भी सामान्य नाम एेल्डोल संघनन ही प्रयोग किया जाता है–
(ii) क्रॉस एेल्डोल संघनन–
जब दो भिन्न-भिन्न एेल्डिहाइड और/या कीटोन के मध्य एेल्डोल

संघनन होता है तो उसे क्रॉस एेल्डोल संघनन कहते हैं। यदि प्रत्येक में α-हाइड्रोजन हो तो ये चार उत्पादों का मिश्रण देते हैं। इसे नीचे एथेनैल व प्रोपेनैल के मिश्रण की एेल्डोल संघनन अभिक्रिया द्वारा समझाया गया है।
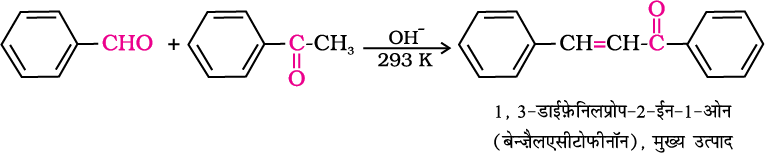
क्रॉस एेल्डोल संघनन में कीटोन भी एक घटक के रूप में प्रयुक्त हो सकते हैं।
5. अन्य अभिक्रियाएँ
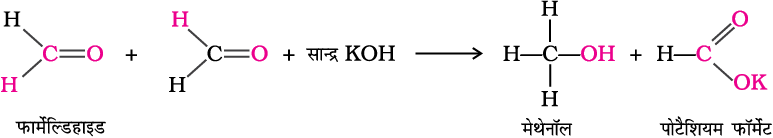
(i) कैनिज़ारो अभिक्रिया–
एेल्डिहाइड, जिनमें α-हाइड्रोजन परमाणु नहीं होते सांद्र क्षार की गरम उपस्थिति में गरम करने से स्वअॉक्सीकरण व अपचयन (असमानुपातन) की अभिक्रियाएँ प्रदर्शित करते हैं। इस अभिक्रिया में एेल्डिहाइड का एक अणु एेल्कोहॉल में अपचित होता है जबकि दूसरा अणु कार्बोक्सिलिक अम्ल के लवण में आक्सीकृत हो जाता है।
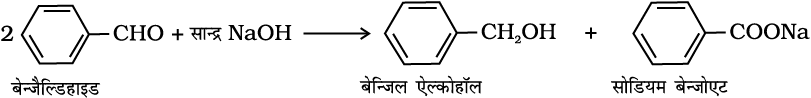
(ii) इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया–
एेरोमेटिक एेल्डिहाइड व कीटोन उस बेन्जीन वलय पर इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रिया प्रदर्शित करते हैं, जिसमें कार्बोनिल समूह निष्क्रियक तथा मेटा-निर्देशक होता है।
पाठ्यनिहित प्रश्न
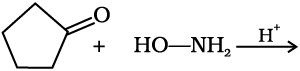

१२.५ एेल्डिहाइडों एवं कीटोनों के उपयोग
रासायनिक उद्योग में एेल्डिहाइड एवं कीटोन अन्य उत्पादों के संश्लेषण के लिए विलायक, प्रारंभिक पदार्थ और अभिकर्मकों के रूप में प्रयोग किए जाते हैं। फार्मेल्डिहाइड का 40% जलीय विलयन फार्मोलिन के नाम से सुप्रसिद्ध है जो जैविक प्रतिदर्शों के परिरक्षण में तथा बैकालाइट के विरचन में (फ़ीनॉलफार्मेल्डिहाइड रेज़िन), यूरिया फार्मेल्डिहाइड सरेस तथा अनेक बहुलक उत्पादों में उपयोग होता है। एेसीटैल्डिहाइड मुख्यतः एेसीटिक अम्ल, एथिल एेसीटेट, वाइनिल एसीटेट बहुलकों एवं औषधों के उत्पादन में प्रारंभिक पदार्थ के रूप में उपयोग किया जाता है। बेन्जैल्डिहाइड का उपयोग सुगंध तथा रंजक उद्योग में किया जाता है। एेसीटोन और एथिलमेथिल कीटोन सामान्य औद्योगिक विलायक हैं। कई एेल्डिहाइड एवं कीटोन, जैसे– ब्यूटैरल्डिहाइड, वेनेलिन, एेसीटोफ़ीनोन, कपूर आदि अपनी सुगंध और सुरुचिकर प्रभाव के लिए सुप्रसिद्ध हैं।
कार्बोक्सिलिक अम्ल
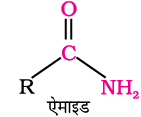
एेसे कार्बनिक यौगिक जिनमें कार्बोक्सिलिक, –COOH प्रकार्यात्मक समूह उपस्थित होता है कार्बोक्सिलिक अम्ल कहलाते हैं। कार्बोक्सिलिक समूह में कार्बोनिल समूह एक हाइड्रॉक्सिल समूह के साथ जुड़ा रहता है, अतः इसका नाम कार्बोक्सिल है। कार्बोक्सिलिक समूह से संयुक्त एेल्किल या एेरिल समूह के आधार पर कार्बोक्सिलिक अम्ल एेलिफैटिक (RCOOH) अथवा एेरोमैटिक अम्ल (ArCOOH) होते हैं। प्रकृति में कार्बोक्सिलिक अम्ल अत्यधिक संख्या में पाए जाते हैं। कुछ एेलिफैटिक कार्बोक्सिलिक अम्लों के उच्च सदस्य (C12–C18), जिन्हें वसा अम्ल कहते हैं। प्राकृतिक वसाओं में ग्लिसरॉल के एस्टर के रूप में पाए जाते हैं; अतः कार्बोक्सिलिक अम्ल अन्य महत्वपूर्ण यौगिकों, जैसे– एनहाइड्राइड, एस्टर, एसिड क्लोराइड और एेमाइडों के संश्लेषण में प्रारंभिक पदार्थ के रूप में प्रयुक्त होते हैं।
१२.६ कार्बोक्सिलिक समूह की नामप)ति व संरचना
12.6.1 नामपद्धति
कार्बोक्सिलिक अम्ल प्रकृति से प्रारंभिक दौर में विलगित किए गए यौगिकों में से हैं, अतः इनमें से बहुत से सामान्य नामों से जाने जाते हैं। सामान्य नाम प्राकृतिक स्रोतों के लेटिन अथवा ग्रीक नामों से व्युत्पन्न होते हैं। और अंग्रेज़ी में लिखे नाम के अंत में अनुलग्न (ic) इक एेसिड लगाते हैं, उदाहरणार्थ– फार्मिक एेसिड या अम्ल, (HCOOH) सर्वप्रथम लाल चीटियों से (लेटिन-फार्मिका का अर्थ चीटियाँ), एेसीटिक अम्ल सिरके से (लेटिन-एेेसीटम का अर्थ सिरका), ब्यूटेरिक अम्ल (CH3–CH2–CH2–COOH) विकृतगंधी मक्खन से (लैटिन-ब्यूटिरम का अर्थ मक्खन) प्राप्त किया गया।
आईयूपीएसी (IUPAC) पद्धति में एेलिफैटिक कार्बोक्सिलिक अम्लों का नामकरण करने के लिए संगत एेल्केन के अंग्रेज़ी में लिखे नाम के अंत में स्थित (-e) के स्थान पर ओइक (–oic) अनुलग्न लगाया जाता है। कार्बन शृंखला का अंकन करते समय कार्बोक्सिलिक समूह के कार्बन परमाणु को प्रथम संख्या (संख्या 1) प्रदान की जाती है। एक से अधिक कार्बोक्सिलिक समूह युक्त यौगिकों का नाम लिखने के लिए कार्बोक्सिलिक समूह हटाकर बची संगत एेल्केन की कार्बन शृंखला के कार्बनों का अंकन करते हैं और कार्बोक्सिल समूहों की स्थिति सहित उनकी संख्या गुणात्मक पूर्वलग्न डाइकार्बोक्सिलिक अम्ल, ट्राइकार्बोक्सिलिक अम्ल इत्यादि को मूल एल्किल शृंखला के नाम के आगे जोड़ दिया जाता है। –COOH समूह की स्थिति गुणात्मक पूर्वलग्न से पहले अरेबिक संख्या में लिख कर दर्शाई जाती है। कुछ कार्बोक्सिलिक अम्लों के सामान्य और आईयूपीएसी नाम सारणी 12.3 में दर्शाए गए हैं।
सारणी 12.3– कुछ कार्बोक्सिलिक अम्लों के नाम एवं संरचना
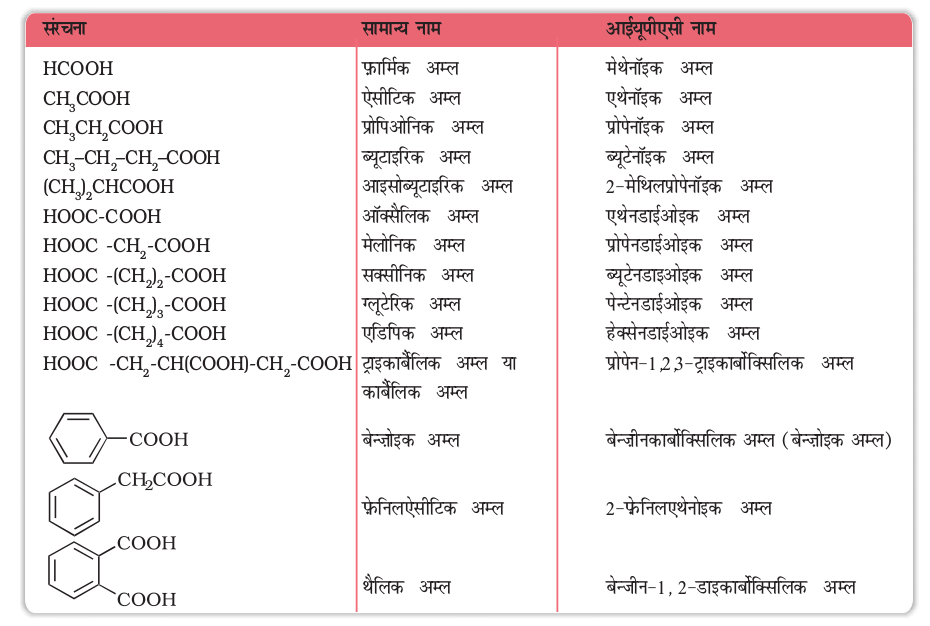
12.6.2 कार्बोक्सिल समूह की संरचना
कार्बोक्सिलिक समूह में कार्बोक्सिल कार्बन से संयुक्त सभी आबंध एक ही तल में होते हैं तथा एक-दूसरे से 120° के कोण द्वारा विलगित रहते हैं। कार्बोक्सिल कार्बन, कार्बोनिल कार्बन से निम्नलिखित अनुनादी संरचनाओं के कारण कम इलेक्ट्रानरागी होता है–
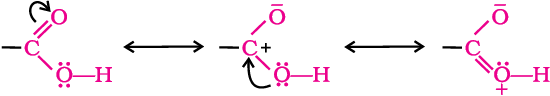
पाठ्यनिहित प्रश्न
12.6 निम्नलिखित यौगिकों के आईयूपीएसी नाम दीजिए–
(i) Ph CH2CH2COOH (ii) (CH3)2C=CHCOOH
(iii) 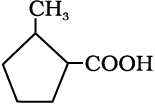 (iv)
(iv) 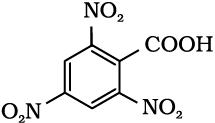
१२.७ कार्बोक्सिलिक अम्ल बनाने की विधियाँ
कार्बोक्सिलिक अम्ल बनाने की कुछ महत्वपूर्ण विधियाँ निम्नलिखित हैं–
1. प्राथमिक एेल्कोहॉल व एेल्डिहाइड से
प्राथमिक एेल्कोहल सामान्य अॉक्सीकरण कर्मकों, जैसे- उदासीन, अम्लीय या क्षारीय माध्यम में पोटैशियम परमैंगनेट अथवा अम्लीय माध्यम में पोटैशियम डाइक्रोमेट और क्रोमियम ट्राइअॉक्साइड द्वारा आसानी से कार्बोक्सिल्कि अम्लों में अॉक्सीकृत हो जाते हैं।
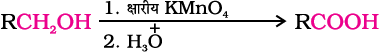
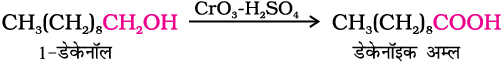
मृदु आक्सीकरण कर्मकों के उपयोग से एेल्डिहाइड द्वारा भी कार्बोक्सिलिक अम्ल प्राप्त किए जाते हैं (खंड 12.4)।
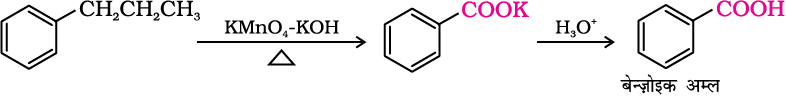
2. एेल्किल बेन्जीनों से
एेरोमैटिक कार्बोक्सिलिक अम्ल एेल्किल बेन्ज़ीनों के क्रोमिक अम्ल अथवा क्षारीय KMnO4 द्वारा प्रबल अॉक्सीकरण से विरचित किए जा सकते हैं। संपूर्ण पार्श्व शृंखला चाहें किसी भी लंबाई की हो, अॉक्सीकृत होकर कार्बोक्सिल समूह निर्मित करती है। प्राथमिक व द्वितीयक एेल्किल समूह भी इसी प्रकार से अॉक्सीकृत होते हैं जबकि तृतीयक समूह प्रभावित नहीं होता। उपयुक्त रूप से प्रतिस्थापित एेल्कीन भी इन अॉक्सीकारकों द्वारा अॉक्सीकृत होकर कार्बोक्सिलिक अम्ल उत्पन्न करती हैं।
(देखें एकक 13 कक्षा XI)

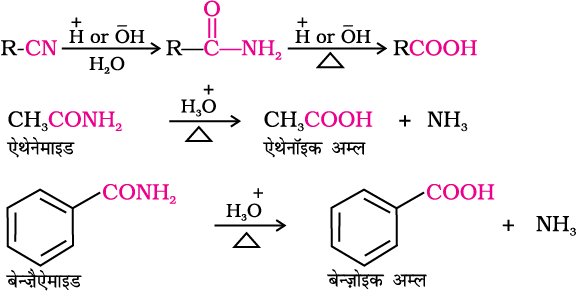
3. नाइट्राइल और एेमाइड से
उत्प्रेरक के रूप में H+ या OH– आयनों की उपस्थिति में नाइट्राइल पहले एेमाइड और फिर अम्लों में जल अपघटित हो जाते हैं। अभिक्रिया को एेमाइड पद पर रोकने के लिए मृदु अभिक्रिया परिस्थितियाँ प्रयुक्त की जाती है।
4. ग्रीन्यार अभिकर्मक से
ग्रीन्यार अभिकर्मक कार्बन डाइअॉक्साइड (शुष्क बर्फ़) के साथ अभिक्रिया से कार्बोक्सिलिक अम्ल के लवण निर्मित करते हैं, जो खनिज अम्ल द्वारा अम्लन से संगत कार्बोक्सिलिक अम्ल देते हैं।
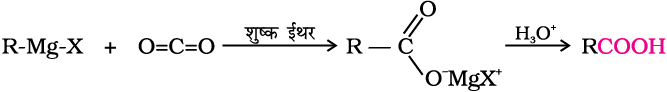
जैसा कि हम जानते हैं; ग्रीन्यार अभिकर्मक एवं एेल्किल नाइट्राइल एेल्किल हैलाएडों से विरचित किए जा सकते हैं। (देखिए एकक 10, कक्षा XII)। उपरोक्त विधियाँ (3 तथा 4) एेल्किल हैलाइडों को संगत कार्बोक्सिलिक अम्लों में परिवर्तित करने में उपयोगी हैं जिसमें एेल्किल हैलाइड में उपस्थित कार्बन परमाणुओं से एक कार्बन परमाणु अधिक विद्यमान होता है (श्रेणी का अवरोहण)।
5. एेसिल हैलाइड और एनहाइड्राइड से
एेसिड क्लोराइड जल द्वारा जलअपघटित होकर कार्बोक्सिलिक अम्ल या जलीय क्षारीय माध्यम में अधिक आसानी से जलअपघटित होकर कार्बोक्सिलेट आयन देते हैं, जो अम्लन द्वारा संगत कार्बोक्सिलिक अम्ल देते हैं। दूसरी ओर एेसिल एनहाइड्राइड जल द्वारा जलअपघटित होकर संगत अम्ल देते हैं।
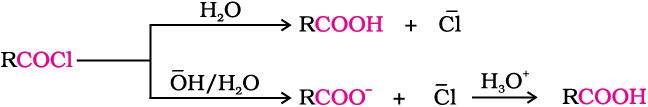
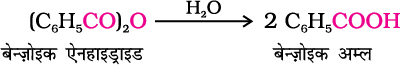
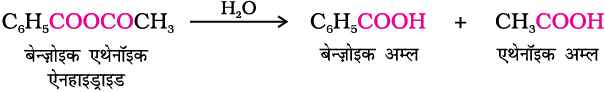
पाठ्यनिहित प्रश्न
12.7 निम्नलिखित यौगिकों को बेन्ज़ोइक अम्ल में कैसे परिवर्तित किया जा सकता है?
(i) एथिलबेन्ज़ीन (ii) एेसीटोफ़ीनोन (iii) ब्रोमोबेन्ज़ीन (iv) फ़ेनिलएथीन (स्टाइरीन)
6. एस्टर से
एस्टरों के अम्लीय जल अपघटन से सीधे ही कार्बोक्सिलिक अम्ल प्राप्त होते हैं। जबकि क्षारीय जल अपघटन द्वारा कार्बोक्सिलेट प्राप्त होते हैं, जो अम्लन द्वारा संगत कार्बोक्सिलिक अम्ल देते हैं।
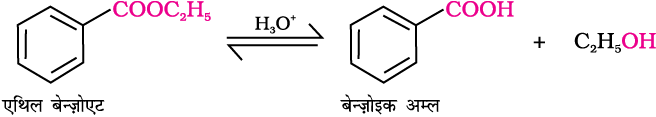
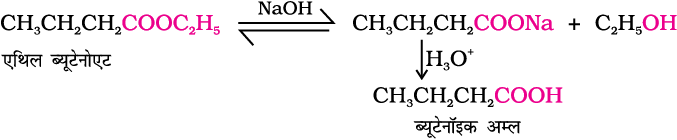
उदाहरण 12.5
निम्नलिखित रूपांतरणों को करने के लिए रासायनिक अभिक्रियाएं लिखिए।
(i) ब्यूटेन-1-ऑल से ब्यूटेनॉइक अम्ल
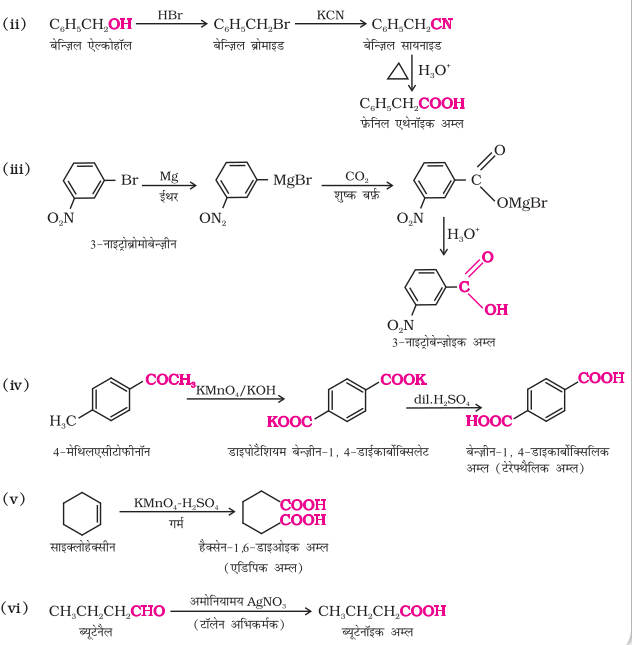
(ii) बेन्जाइल एल्कोहॉल से प़फ़ेनिल एथेनॉइक अम्ल
(iii) 3-नाइट्रोब्रोमोबेन्जीन से 3-नाइट्रोबेन्जोइक अम्ल
(iv) 4-मेथिलऐसीटोप़फ़ीनोन से बेन्जीन-1,4-डाइकार्बोक्सिलिक अम्ल
(v) साइक्लोहेक्सीन से हैक्सेन-1, 6-डाईओइक अम्ल
(vi) ब्यूटेनैल से ब्यूटेनॉइक अम्ल

पाठ्यनिहित प्रश्न
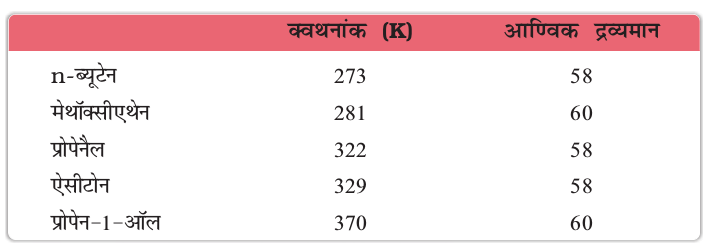
१२.८ भौतिक गुण
एेलिफैटिक कार्बोक्सिलिक अम्ल की श्रेणी में नौ कार्बन परमाणुओं तक की शृंखला वाले सदस्य सामान्य ताप पर अरुचिकर गंध वाले रंगहीन द्रव होते हैं। इस श्रेणी के उच्च सदस्य मोम जैसे ठोस होते हैं तथा अल्प वाष्पशील एवं व्यावहारिक रूप से गंधहीन होते हैं। कार्बोक्सिलिक अम्लों के क्वथनांक समतुल्य आण्विक द्रव्यमानों वाले एेल्डिहाइडों, कीटोनों यहाँ तक कि एेल्कोहॉलों से भी उच्च होते हैं। कार्बोक्सिलिक अम्लों का यह गुणधर्म उनके अणुओं में परस्पर अधिक व्यापक अंतराआण्विक हाइड्रोजन आबंधन द्वारा संगुणन के कारण उत्पन्न होता है। ये हाइड्रोजन आबंध वाष्प अवस्था में भी पूर्ण रूप से नहीं टूटते। वास्तव में अधिकांश कार्बोक्सिलिक अम्ल वाष्प प्रावस्था एवं एेप्रोटिक विलायकों में हाइड्रोजन आबंधित द्वितय के रूप में उपस्थित होते हैं।
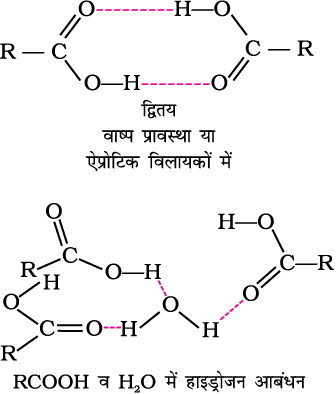
चार कार्बन परमाणु तक सरल एेलिफैटिक कार्बोक्सिलिक अम्ल हाइड्रोजन आबंध निर्मित कर सकने के कारण जल में मिश्रणीय होते हैं। कार्बन परमाणुओं की संख्या बढ़ने के साथ विलेयता घटती जाती है। उच्चतर कार्बोक्सिलिक अम्ल हाइड्रोकार्बन शृंखला की जलविरागी अन्योन्यक्रिया बढ़ने के कारण विशेषकर जल में अविलेय होते हैं। बेन्ज़ोइक अम्ल, जो कि सरलतम एेरोमैटिक कार्बोक्सलिक अम्ल है; ठंडे जल में लगभग अविलेय होता है। कार्बोक्सिलिक अम्ल बेन्ज़ीन, ईथर, एेल्कोहॉल, इत्यादि, जैसे क्रम ध्रुवीय विलायकों में भी विलेय होते हैं।
१२.९ रासायनिक अभिक्रियाएँ
कार्बोक्सिलिक अम्लों की रासायनिक अभिक्रियाएँ निम्न प्रकार से वर्गीकृत हैं–
12.9.1 अभिक्रियाएँ जिनमें O-H आबंध का विदलन होता है
अम्लता
धातु व क्षारों के साथ अभिक्रिया–
एेल्कोहॉलों की तरह कार्बोक्सिलिक अम्ल विद्युत धनी धातुओं के साथ क्रिया करके हाइड्रोजन मुक्त करते हैं तथा फ़ीनॉलों की तरह क्षारों के साथ लवण बनाते हैं। यह दुर्बल क्षारक जैसे कार्बोनेट, हाइड्रोजनकार्बोनेट के साथ अभिक्रिया करके कार्बन डाइअॉक्साइड उत्पन्न करते हैं। यह अभिक्रियाएँ यौगिक में उपस्थित कार्बोक्सिलिक समूह को पहचानने के लिए प्रयुक्त की जाती हैं।
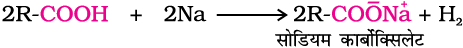


कार्बोक्सिलिक अम्ल जल में वियोजित होकर कार्बोक्सिलेट ऋणायन तथा हाइड्रोनियम आयन देते हैं जो अनुनाद द्वारा स्थायित्व प्राप्त करते हैं।

उपरोक्त अभिक्रिया के लिए–
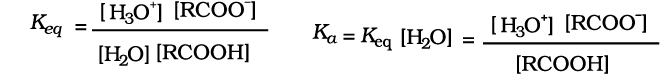
यहाँ Keq साम्यावस्था स्थिरांक तथा Ka अम्ल वियोजन स्थिरांक है।
सुविधा के लिए अम्लों की सामर्थ्य सामान्यतः Ka मान की बजाय pKa के मान से इंगित करते हैं।
pKa = — log Ka
हाइड्रोक्लोरिक अम्ल के pKa का मान -7.0 है, जबकि ट्राइफ्लुओरोेएेसीटिक अम्ल (प्रबलतम कार्बोक्सिलिक अम्ल), बेन्जोइक अम्ल तथा एेसीटिक अम्ल के pKa के मान क्रमशः 0.23, 4.19 एवं 4.76 होते हैं।
अम्ल का pKa मान जितना कम होगा अम्ल उतना ही प्रबल होगा (एक उत्तम प्रोटॉन दाता)। प्रबल अम्लों का pKa मान 1 से कम होता है। मध्यम प्रबल अम्लों के pKa मान 1 से 5 के मध्य होते हैं। दुर्बल अम्लों के pKa के मान 5 से 15 के मध्य तथा अधिक दुर्बल अम्लों के pKa मान 15 से अधिक होते हैं।

इलेक्ट्रॉन दाता समूह (EDG) कार्बोक्सिलेट आयन को अस्थायी बना देते हैं। और अम्ल को दुर्बल कर देते हैं।

इलेक्ट्रॉन अपनयन करने वाले समूह (EWG) कार्बोक्सिलिक आयन को स्थायीकृत करते हैं जिससे अम्ल की सामर्थ्य बढ़ जाती है।
कार्बोक्सिलिक अम्ल खनिज अम्लों से दुर्बल होते हैं परंतु एेल्कोहॉलों एवं अनेक सरल फ़ीनॉलों से (एथेनॉल के pKa का मान ~16 है तथा फ़ीनॉल का pKa मान 10 होता है।) प्रबल होते हैं। वास्तव में आपने अब तक जिन कार्बनिक यौगिकों का अध्ययन किया है उनमें कार्बोक्सिलिक अम्ल सर्वाधिक अम्लीय हैं। आपको पहले से ही ज्ञात है कि फ़ीनॉल एेल्कोहॉल की अपेक्षा क्यों अधिक अम्लीय होते हैं। इसी प्रकार से कार्बोक्सिलिक अम्लों की फ़ीनॉलों की अपेक्षा उच्च अम्लता को समझा जा सकता है। कार्बोक्सिलिक अम्ल का संयुग्मी क्षारक, कार्बोक्सिलेट आयन, दो समान अनुनादी संरचनाओं द्वारा स्थायित्व प्राप्त करता है एवं इसमें ऋणावेश अधिक विद्युत ऋणी अॉक्सीजन परमाणु पर स्थित होते हैं। फ़ीनॉल का संयुग्मी क्षारक एक फीनॉक्साइड आयन होता है, जिसकी अनुनादी संरचनाएं असमान होती हैं तथा इनमें ऋणावेश अल्प विद्युतनऋणी कार्बन परमाणु पर स्थित होता है। इसलिए फीनॉक्साइड आयन में अनुनाद उतना महत्वपूर्ण नहीं है जितना कार्बोक्सिलेट आयन में। कार्बोक्सिलेट आयन का ऋणावेश दो विद्युतऋणी अॉक्सीजन परमाणुओं पर विस्थानित होता है, जबकि फीनॉक्साइड आयन में यह ऋणावेश एक अॉक्सीजन परमाणु तथा कम विद्युतऋणी कार्बन परमाणु पर कम प्रभावशाली ढंग से विस्थानित होता है (एकक 11, कक्षा XII)। फलस्वरूप कार्बोक्सिलेट आयन, फ़ीनॉक्साइड आयन की तुलना में अधिक स्थायित्व प्राप्त होता है। अतः कार्बोक्सिलिक अम्ल फ़ीनॉलों की अपेक्षा अधिक अम्लीय होते हैं।
कार्बोक्सिलिक अम्लों की अम्लता पर प्रतिस्थापियों का प्रभाव–
प्रतिस्थापी संयुग्मी क्षारक के स्थायित्व को प्रभावित कर सकते हैं, अतः कार्बोक्सिलिक अम्लों की अम्लता को भी प्रभावित करते हैं। इलेक्ट्रॉन अपनयन करने वाले समूह प्रेरणिक और/या अनुनादी प्रभाव द्वारा ऋणावेश को विस्थानित करके संयुग्मी क्षारक को स्थायित्व प्रदान करते हैं और कार्बोक्सिलिक अम्ल की अम्लता बढ़ा देते हैं। इसके विपरीत इलेक्ट्रॉन दाता समूह संयुग्मी क्षारक को अस्थायित्व प्रदान करके अम्लता घटा देते हैं।
निम्नलिखित समूहों का प्रभाव अम्लता बढ़ाने के क्रम में हैं।
Ph < I < Br < Cl < F < CN < NO2 < CF3
अतः निम्नलिखित अम्लों को उनकी घटती हुई अम्लता के आधार पर व्यवस्थित किया गया है (pKa मान क्रम पर आधारित)–
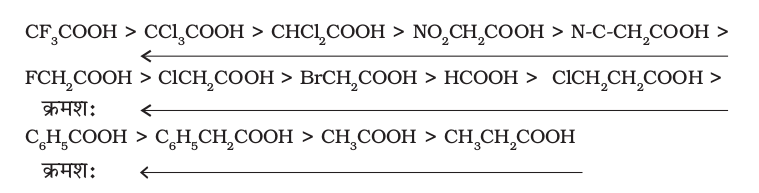
कार्बोक्सिल समूह पर फ़ेनिल अथवा वाइनिल समूह के सीधे संयुक्त होने से संगत कार्बोक्सिलिक अम्लों की अम्लता बढ़ जाती है, जो नीचे दर्शाए गए अनुनाद प्रभाव के कारण अपेक्षित कमी के विपरीत है।
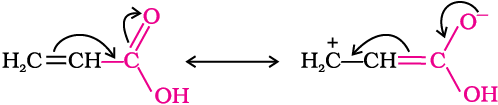
एेसा कार्बोनिल समूह से संलग्नित sp2 संकरित कार्बन की उच्च विद्युतऋणात्मकता के कारण होता है। एेरोमैटिक कार्बोक्सिलिक अम्ल की फ़ेनिल वलय पर इलेक्ट्रॉन अपनयन करने वाले समूह की उपस्थिति अम्लता को बढ़ाती है जबकि इलेक्ट्रॉन दाता समूह की उपस्थिति अम्लता को घटाती है।
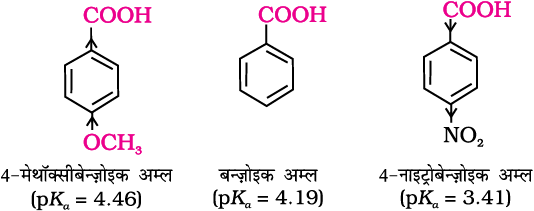
12.9.2 C–OH आबंध विदलन संबंधी अभिक्रियाएँ
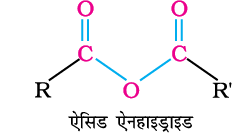
1. एनहाइड्राइड का विरचन
कार्बोक्सिलिक अम्लों खनिज अम्लों जैसे H2SO4 अथवा P2O5 के साथ गर्म करने पर संगत एनहाइड्राइड बनते हैं।
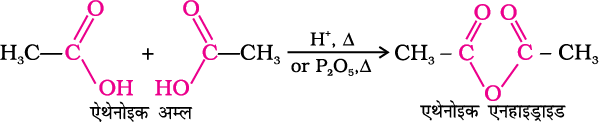
2. एस्टरीकरण
कार्बोक्सिलिक अम्ल एेल्कोहॉलों अथवा फीनॉलों द्वारा सांद्र सल्फ्यूरिक अम्ल अथवा हाइड्रोजन क्लोराइड गैस जैसे खनिज अम्ल उत्प्रेरकों की उपस्थिति में एस्टर बनाते हैं।
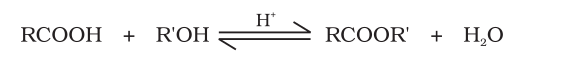
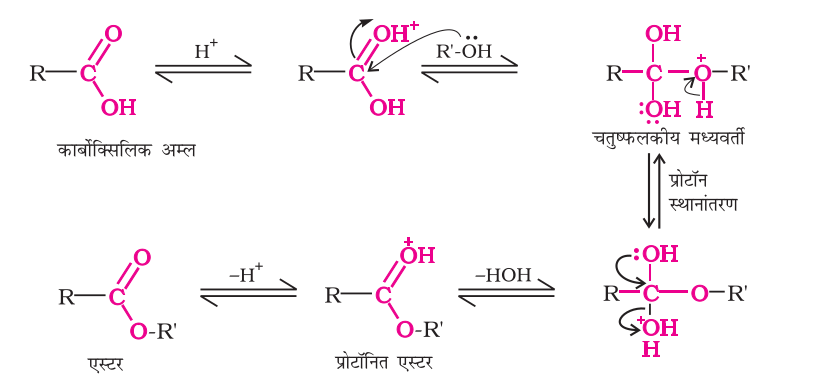
कार्बोक्सिलिक अम्लों के एस्टरीकरण की क्रियाविधिा
कार्बोक्सिलिक अम्लों का ऐल्कोहॉलों के साथ एस्टरीकरण एक प्रकार की नाभिकरागी ऐसिल प्रतिस्थापन अभिक्रिया है। कार्बोनिल की ऑक्सीजन का प्रोटॉनन कार्बोनिल समूह को ऐलकोहॉल के नाभिकरागी योगज के लिए सक्रिय कर देता है। चतुष्फलकीय मध्यवर्ती में एक प्रोटॉन का स्थानांतरण हाइडांक्सिल समूह को -0H2 समूह में परिवर्तित कर देता है जो एक अधिक अच्छा अवशिष्ट समूह होने के कारण, उदासीन जल अणु के रूप में विलोपित हो जाता है। अंततः इस प्रकार निर्मित प्रोटॉनित एस्टर प्रोटॉन को त्यागकर एक एस्टर दे देती है।
3. PCl5, PCl3 एवं SOCl2 के साथ अभिक्रिया
कार्बोक्सिलिक अम्लों का हाइड्रॉक्सिल समूह, एेल्कोहॉलों के हाइड्रॉक्सिल समूह की भाँति व्यवहार करता है और फॉस्फोरस पेन्टाक्लोराइड (PCl5), फॉस्फोरस ट्राइक्लोराइड (PCl3) अथवा थायोनिल क्लोराइड (SOCl2) के साथ अभिक्रिया द्वारा क्लोरीन परमाणु से प्रतिस्थापित हो जाता है। थायोनिल क्लोराइड को वरीयता दी जाती है, क्योंकि इस अभिक्रिया के दो अन्य उत्पाद गैसीय होते हैं, जो अभिक्रिया मिश्रण से बाहर निकल जाते हैं। इसलिए प्राप्त उत्पाद का परिशोधन सुगम हो जाता है।

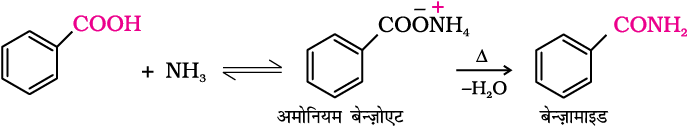
4. अमोनिया के साथ अभिक्रिया
कार्बोक्सिलिक अम्ल अमोनिया के साथ अभिक्रिया द्वारा अमोनियम लवण बनते हैं जो अधिक उच्च ताप पर गर्म करने से एेमाइड बनाते हैं। उदाहरणार्थ–


1. अपचयन
कार्बोक्सिलिक अम्ल लीथियम एेलुमिनियम हाइड्राइड अथवा डाइबोरेन द्वारा प्राथमिक एेल्कोहॉलों में अपचित हो जाते हैं। डाइबोरेन, एस्टर, नाइट्रो, हैलो इत्यादि जैसे प्रकार्यात्मक समूहों को सरलतापूर्वक अपचित नहीं करता। सोडियम बोरोहाइड्राइड कार्बोक्सिल समूह को अपचित नहीं करता।

2. विकार्बोक्सिलन
कार्बोक्सिलिक अम्लों के सोडियम लवणों को सोडालाइम (NaOH तथा CaO, 3:1 के अनुपात में) के साथ गरम करने पर कार्बन डाइअॉक्साइड निकल जाती है एवं हाइड्रोकार्बन प्राप्त होते हैं। यह अभिक्रिया विकार्बोक्सिलन (Decarboxylation) कहलाती है।
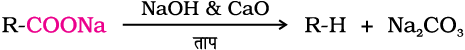
कार्बोक्सिलिक अम्लों के क्षार धातु लवणों के जलीय विलयन का वैद्युतअपघटन द्वारा विकार्बोक्सिलन हो जाता है तथा एेसे हाइड्रोकार्बन निर्मित होते हैं जिसमें कार्बन परमाणुओं की संख्या, अम्ल के एेल्किल समूह में उपस्थित कार्बन परमाणुओं की संख्या से दुगुनी होती है। इस अभिक्रिया को कोल्बे वैद्युत्-अपघटन (Kolbe Electrolysis) कहते हैं (एकक 13, कक्षा XI)।
1. हैलोजनन
एेसे कार्बोक्सिलिक अम्ल जिनमें α-हाइड्रोजन विद्यमान होता है, लाल फ़ॉस्फ़ोरस की अल्प मात्रा की उपस्थिति में क्लोरीन अथवा ब्रोमीन के साथ अभिक्रिया द्वारा α-हैलोकार्बोक्सिलिक अम्ल देते हैं। इस अभिक्रिया को हेलफोलार्ड जेलिंस्की अभिक्रिया (Hell-Volhard-Zelinsky Reaction) कहते हैं।

पाठ्यनिहित प्रश्न
12.8 नीचे प्रदर्शित अम्लों के प्रत्येक युग्म में कौन सा अम्ल अधिक प्रबल है?
(i) CH3CO2H अथवा CH2FCO2H
(ii) CH2FCO2H अथवा CH2ClCO2H
(iii) CH2FCH2CH2CO2H अथवा CH3CHFCH2CO2H
(iv) 
2. वलय प्रतिस्थापन
एेरोमेटिक कार्बोक्सिलिक अम्ल इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाएं प्रदर्शित करते हैं, जिनमें कार्बोक्सिल समूह एक निष्क्रियक एवं मेटा-निर्देशी समूह की भाँति व्यवहार करता है। एेरोमेटिक कार्बोक्सिलिक अम्ल फ्रीडेल-क्राफ्ट्स (Friedel Crafts) अभिक्रिया प्रदर्शित नहीं करते। (चूँकि कार्बोक्सिल समूह निष्क्रियक समूह है एवं उत्प्रेरक एेलुमिनियम क्लोराइड (लूईस अम्ल) कार्बोक्सिल समूह से आबंधित हो जाता है।
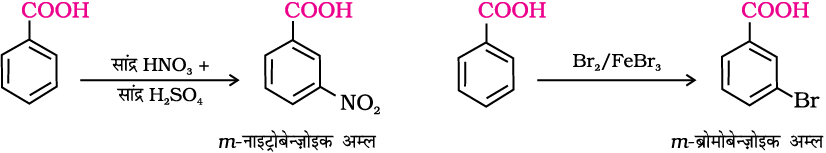
१२.१० कार्बोक्सिलिक अम्लों के उपयोग
मेथेनॉइक अम्ल रबर, वस्त्र, रँगाई, चमड़ा एवं इलेक्ट्रोप्लेटिंग उद्योगों में उपयोग में आता है। एथेनॉइक अम्ल विलायक के रूप में तथा खाद्य उद्योगों में सिरके के रूप में उपयोग किया जाता है। हैक्सेनडाइओइक अम्ल का उपयोग नाइलोन-6,6 के निर्माण में होता है। बेन्ज़ोइक अम्ल की एस्टरों का उपयोग सुगंध द्रव्यों में होता है। सोडियम बेन्ज़ोएट का उपयोग खाद्य परिरक्षण में होता है। उच्चतर वसीय अम्लों का उपयोग साबुन एवं अपमार्जकों के उत्पादन में किया जाता है।
सारांश
एेल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल, कार्बनिक यौगिकों के कुछ महत्वपूर्ण वर्ग हैं जिनमें कार्बोनिल समूह उपस्थित हैं। ये अत्यधिक ध्रुवीय अणु होते हैं। अतः ये हाइड्रोकार्बनों एवं तुलनीय आण्विक द्रव्यमानों वाले ईथरों जैसे कम ध्रुवीय यौगिकों की तुलना में अधिक ताप पर उबलते हैं। इनके निम्नतर सदस्य जल में अत्यधिक विलेय होते हैं, क्योंकि ये जल के साथ हाइड्रोजन आबंध बना सकते हैं। उच्चतर सदस्य अत्यधिक लंबी जल विरागी कार्बन शृंखला की उपस्थिति के कारण जल में अविलेय होते हैं किंतु सामान्य कार्बनिक विलायकों में विलेय होते हैं। एेल्डिहाइडों को प्राथमिक एेल्कोहॉलों के विहाइड्रोजनन या नियंत्रित अॉक्सीकरण अथवा एेसिल हैलाइडों के नियंत्रित अपचयन द्वारा विरचित किया जा सकता है। एेरोमेटिक एेल्डीहाइड भी अॉक्सीकरण द्वारा निम्न प्रकार से बनाए जा सकते हैं।
1. एेसीटिक एेनहाइड्राइड की उपस्थिति में मेथिल बेन्ज़ीनाें के क्रोमिलक्लोराइड अथवा CrO3 द्वारा अॉक्सीकरण से।
2. निर्जल एेलुमिनियम क्लोराइड या क्यूप्रस क्लोराइड की उपस्थिति में एेरीनो के कार्बनमोनोक्साइड एवं हाइड्रोक्लोरिक अम्ल द्वारा फार्मिलन।
3. बैन्जल क्लोराइड के जलअपघटन द्वारा।
कीटोनों को द्वितीयक एेल्कोहॉलों के अॉक्सीकरण और एेल्काइनों के जलयोजन (Hydration) से विरचित किया जाता है। कीटोनों को एेसिल क्लोराइड की डाइएेल्किल कैडमियम के साथ अभिक्रिया द्वारा भी बनाया जा सकता है। एेरोमैटिक कीटोनों को विरचित करने की एक अच्छी विधि एेरोमैटिक हाइड्रोकार्बनों का एेसिल क्लोराइडों तथा एेनहाइड्राइडों द्वाराफ़ीडेल क्राफ्ट्स एेसिलीनन है। एेल्डिहाइड एवं कीटोन दोनों ही एेल्कीनों के ओजोनन द्वारा विरचित किए जा सकते हैं। एेल्डिहाइड एवं कीटोन HCN, NaHSO3 एेल्कोहालों (या डाइअॉलों), अमोनिया व्युत्पन्नों और ग्रीन्यार अभिकर्मकों जैसे अनेक नाभिकरागियों (Nucleophiles) के साथ कार्बोनिल समूह पर नाभिकरागी योगज अभिक्रियाएं देते हैं। एेल्डिहाइड एवं कीटोनों में उपस्थित α-हाइड्रोजन अम्लीय होते हैं। अतः कम से कम एक α−हाइड्रोजन युक्त एेल्डिहाइड एवं कीटोन क्षार की उपस्थिति में एेल्डोल संघनन द्वारा क्रमश; α-हाइड्रॉक्सीएेल्डिहाइड (एेल्डोल) एवं β-हाइड्रॉक्सीकीटोन (कीटोल) बनाते हैं। एेसे एेल्डिहाइड जिनमें α-हाइड्रोजन नहीं होता है सांद्र क्षार की उपस्थिति में कैनिज़ारो अभिक्रिया देते हैं। LiAlH4 NaBH4 या उत्प्रेरित हाइड्रोजनन से एेल्डिहाइड एवं कीटोन अपचित होकर एेल्कोहॉल बनाते हैं। एेल्डिहाइडों एवं कीटोनों का कार्बोनिल समूह क्लीमेन्सन अपचयन यावोल्फ किश्नर अपचयन द्वारा मेथेलीन समूह में अपचयित हो जाता है।टॉलेन अभिकर्मक एवं फ़ेलिंग विलयन के समान मृदु अॉक्सीकरण अभिकर्मक एेल्डिहाइडों को आसानी से कार्बोक्सिलिक अम्लों में अॉक्सीकृत कर देते हैं। इन अॉक्सीकरण अभिक्रियाओं का उपयोग एेल्डिहाइडों एवं कीटोनों में विभेद करने में किया जाता है। कार्बोक्सिलिक अम्लोें का विरचन प्राथमिक एेल्कोहॉलों, एेल्डिहाइडों एवं एेल्कीनों के अॉक्सीकरण, नाइट्राइलों के जलअपघटन और ग्रीन्यार अभिकर्मकों की कार्बन डाइअॉक्साइड द्वारा किया जाता है। एेरोमैटिक कार्बोक्सिलिक अम्लों को भी पार्श्व शृंखला वाले एेल्किलबेन्ज़ीन के अॉक्सीकरण से विरचित किया जा सकता है। यद्यपि कार्बोक्सिलिक अम्ल खनिज अम्लों की तुलना में बहुत दुर्बल होते हैं, किंतु एेल्कोहॉलों एवं अधिकतर अतिसरल फ़ीनॉलों से काफी अधिक अम्लीय होते हैं। कार्बोक्सिलिक अम्लों को LiAlH4 या इससे बेहतर ईथर विलयन में डाइबोरेन द्वारा प्राथमिक एेल्कोहॉलों में अपचित किया जा सकता है। कार्बोक्सिलिक अम्लों का लाल फॉस्फोरस की उपस्थिति में Cl2 या Br2 के साथ α-हैलोजनन होता है (हेलफोलार्ड जेलिंसकी अभिक्रिया)। मेथेनैल, एेथेनैल, प्रोपेनोन, बेन्ज़ैल्डिहाइड, फॉर्मिक अम्ल, एेसीटिक अम्ल, बेन्ज़ोइक अम्ल आदि अनेक कार्बोनिल यौगिक उद्योगों में महत्वपूर्ण हैं।
अभ्यास
12.1 निम्नलिखित पदों (शब्दों) से आप क्या समझते हैं? प्रत्येक का एक उदाहरण दीजिए।
(i) सायनोहाइड्रिन (v) हेमीएेसीटेल (viii) इमीन
(ii) एेसीटल (vi) अॉक्सिम (ix) 2, 4 - DNP व्युत्पन्न
(iii) सेमीकार्बेजोन (vii) कीटैल (x) शिफ-क्षारक
(iv) एेल्डोल
12.2 निम्नलिखित यौगिकों के आईयूपीएसी (IUPAC) नामपद्धति में नाम लिखिए -
(i) CH3CH(CH3)CH2CH2CHO (v)CH3CH(CH3)CH2C(CH3)2COCH3
(ii) CH3CH2COCH(C2H5)CH2CH2Cl (vi) (CH3)3CCH2COOH
(iii) CH3CH=CHCHO (vii) OHCC6H4CHO-p
(iv) CH3COCH2COCH3
12.3 निम्नलिखित यौगिकों की संरचना बनाइए।
(i) 3-मेथिलब्यूटेनैल (v) 4-क्लोरोपेन्टेन-2-अॉन
(ii) p-नाइट्रोप्रोपिओफीनोन (vi) 3-ब्रोमो-4-फेनिल पेन्टेनॉइक अम्ल
(iii) p-मेथिलबेन्ज़ैल्डिहाइड (vii) p,p′−डाईहाइड्रॉक्सीबेन्ज़ोफीनोन
(iv) 4-मेथिलपेन्ट-3-ईन-2-ओन (viii) हेक्स-2-ईन-4-आइनोइक अम्ल
12.4 निम्नलिखित एेल्डिहाइडों एवं कीटोनों के आईयूपीएसी (IUPAC)नाम लिखिए और जहाँ संभव हो सके साधारण नाम भी दीजिए।
(i) CH3CO(CH2)4CH3 (iv) Ph-CH=CH-CHO
(ii) CH3CH2CHBrCH2CH(CH3)CHO (v) 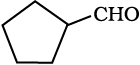
(iii) CH3(CH2)5CHO (vi) PhCOPh
12.5 निम्नलिखित व्युत्पन्नों की संरचना बनाइए–
(i) बेन्जेल्डिहाइड का 2,4-डाइनाइट्रोफेनिलहाइड्रेजोन (iv)साइक्लोब्यूटेनोन का सेमीकार्बेज़ोन
(ii) साइक्लोप्रोपेनोन अॉक्सिम (v) हेक्सेन-3-ओन का एथिलीन कीटेल
(iii) एेसीटैल्डिहाइडडाइमेथिलएेसीटैल (vi) फॉर्मेल्डिहाइड का मेथिल हेमीएेसीटेल
12.6 साइक्लोहेक्सेनकार्बेल्डिहाइड की निम्नलिखित अभिकर्मकों के साथ अभिक्रिया से बनने वाले उत्पादों को पहचानिए–
(i) PhMgBr एवं तत्पश्चात् H3O+ (iv) एथेनॉल का आधिक्य तथा अम्ल
(ii) टॉलेन अभिकर्मक (v) ज़िंक अमलगम एवं तनु हाइड्रोक्लोरिक अम्ल
(iii) सेमीकार्बेज़ाइड एवं दुर्बल अम्ल
12.7 निम्नलिखित में से कौन से यौगिकों में एेल्डोल संघनन होगा, किनमें कैनिज़ारो अभिक्रिया होगी और किनमें उपरोक्त में से कोई क्रिया नहीं होगी? एेल्डोल संघनन तथा कैनिज़ारो अभिक्रिया में संभावित उत्पादों की संरचना लिखिए।
(i) मेथेनैल (iv) बेन्ज़ोफ़ीनॉन (vii) फेनिलएेसीटैल्डिहाइड
(ii) 2-मेथिलपेन्टेनैल (v) साइक्लोहेक्सेनोन (viii) ब्यूटेन-1-अॉल
(iii) बेन्ज़ैल्डिहाइड (vi) 1-फेनिलप्रोपेनोन (ix) 2,2-डाइमेथिलब्यूटेनैल
12.8 एथेनैल को निम्नलिखित यौगिकों में कैसे परिवर्तित करेंगे?
(i) ब्यूटेन-1,3-डाईअॉल (ii) ब्यूट-2-ईनैल (iii) ब्यूट-2-इनॉइक अम्ल
12.9 प्रोपेनैल एवं ब्यूटेनैल के एल्डोल संघनन से बनने वाले चार संभावित उत्पादों के नाम एवं संरचना सूत्र लिखिए। प्रत्येक में बताइए कि कौन सा एेल्डिहाइड नाभिकरागी और कौन सा इलेक्ट्रॉनरागी होगा?
12.10 एक कार्बनिक यौगिक जिसका अणुसूत्र C9H10O है 2,4 DNPव्युत्पन्न बनाता है, टॉलेन अभिकर्मक को अपचित करता है तथा कैनिज़ारो अभिक्रिया देता है। प्रबल अॉक्सीकरण पर वह 1,2-बेन्ज़ीनडाईकार्बोक्सिलिक अम्ल बनाता है। यौगिक को पहचानिए।
12.11 एक कार्बनिक यौगिक ‘क’ (आण्विक सूत्र, C8H16O2) को तनु सल्फ्यूरिक अम्ल के साथ जलअपघटित करने के उपरांत एक कार्बोक्सिलिक अम्ल ‘ख’ एवं एक एेल्कोहॉल ‘ग’ प्राप्त हुई। ‘ग’ को क्रोमिक अम्ल के साथ अॉक्सीकृत करने पर ‘ख’ उत्पन्न होता है। ‘ग’ निर्जलीकरण पर ब्यूट-1-ईन देता है। अभिक्रियाओं में प्रयुक्त होने वाली सभी रासायनिक समीकरणों को लिखिए।
12.12 निम्नलिखित यौगिकों को उनसे संबंधित (कोष्ठकों में दिए गए) गुणधर्मों के बढ़ते क्रम में व्यवस्थित कीजिए–
(i) एेसीटैल्डिहाइड, एेसीटोन, डाइ-तृतीयक-ब्यूटिलकीटोन, मेथिलतृतीयक-ब्यूटिलकीटोन (HCN के प्रति अभिक्रियाशीलता)
(ii) CH3CH2CH(Br)COOH, CH3CH(Br)CH2COOH,(CH3)2CHCOOH, CH3CH2CH2COOH (अम्लता के क्रम में)
(iii) बेन्ज़ोइक अम्ल; 4-नाइट्रोबेन्ज़ोइक अम्ल; 3,4-डाईनाइट्रोबेन्ज़ोइक अम्ल; 4-मेथॉक्सी बेन्ज़ोइक अम्ल (अम्लता की सामर्थ्य के क्रम में)
12.13 निम्नलिखित यौगिक युगलों में विभेद करने के लिए सरल रासायनिक परीक्षणों को दीजिए–
(i) प्रोपेनैल एवं प्रोपेनोन (v) पेन्टेन-2-अॉन एवं पेन्टेन-3-अॉन
(ii) एसीटोफीनॉन एवं बेन्ज़ोफ़ीनोन (vi) बेन्ज़ैल्डिहाइड एवं एसीटोफ़ीनोन
(iii) फ़ीनॉल एवं बेन्ज़ोइक अम्ल (vii) एथेनैल एवं प्रोपेनैल
(iv) बेन्ज़ोइक अम्ल एवं एथिनबेन्ज़ोएट
12.14 बेन्ज़ीन से निम्नलिखित यौगिकों का विरचन आप किस प्रकार करेंगे? आप कोई भी अकार्बनिक अभिकर्मक एवं कोई भी कार्बनिक अभिकर्मक, जिसमें एक से अधिक कार्बन न हो, का उपयोग कर सकते हैं।
(i) मेथिल बेन्ज़ोएट (ii) m-नाइट्रोबेन्ज़ोइक अम्ल
(iii) p-नाइट्रोबेन्ज़ोइक अम्ल (iv) फ़ेनिलएेसीटिक अम्ल
(v) p-नाइट्रोबेन्ज़ैल्डिहाइड
12.15 आप निम्नलिखित रूपांतरणों को अधिकतम दो चरणों में किस प्रकार से संपन्न करेंगे?
(i) प्रोपेनोन से प्रोपीन (vi) ब्रोमोबेन्ज़ीन से 1-फ़ेनिलएथेनॉल
(ii) बेन्ज़ोइक अम्ल से बेन्ज़ैल्डिहाइड (vii) बेन्ज़ैल्डिहाइड से 3-फ़ेनिलप्रोपेन-1-अॉल
(iii) एेथेनॉल से 3-हाइड्रॉक्सीब्यूटेनैल (viii) बेन्ज़ैल्डिहाइड से α-हाइड्रॉक्सीफ़ेनिलएेसीटिक अम्ल
(iv) बेन्ज़ीन से m-नाइट्रोएेसीटोफ़ीनोन (ix) बेन्ज़ोइक अम्ल से m-नाइट्रोबेन्ज़िल एेल्कोहॉल
(v) बेन्ज़ैल्डिहाइड से बेन्ज़ोफ़ीनॉन
12.16 निम्नलिखित पदों (शब्दों) का वर्णन करो–
(i) एेसीटिलिनन (iii) क्रॉस एेल्डोल संघनन
(ii) कैनिज़ारो अभिक्रिया (iv) विकार्बोक्सिलन
12.17 निम्नलिखित प्रत्येक संश्लेषण में छूटे हुए प्रारंभिक पदार्थ, अभिकर्मक अथवा उत्पादों को लिखकर पूर्ण कीजिए–
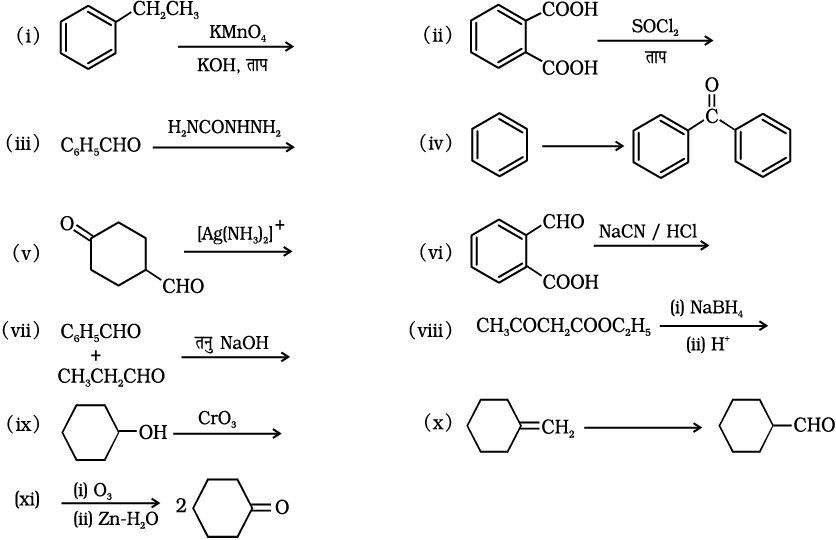
12.18 निम्नलिखित के संभावित कारण दीजिए–
(i) साइक्लोहेक्सेनोन अच्छी लब्धि में सायनोहाइड्रिन बनाता है। परंतु 2, 2, 6-ट्राइमेथिलसाइक्लोहेक्सेनोन एेसा नहीं करता।
(ii) सेमीकार्बोज़ाइड में दो -NH2 समूह होते हैं, परंतु केवल एक -NH2समूह ही सेमीकार्बेज़ोन विरचन में प्रयुक्त होता है।
(iii) कार्बोक्सिलिक अम्ल एवं एेल्कोहॉल से, अम्ल उत्प्रेरक की उपस्थिति में एस्टर के विरचन के समय जल अथवा एस्टर जैसे ही निर्मित होता है उसको निकाल दिया जाना चाहिए।
12.19 एक कार्बनिक यौगिक में 69.77% कार्बन 11.63% हाइड्रोजन तथा शेष अॉक्सीजन है। यौगिक का आण्विक द्रव्यमान 86 है। यह टॉलेन अभिकर्मक को अपचित नहीं करता परंतु सोडियम हाइड्रोजनसल्फाइट के साथ योगज यौगिक देता है तथा आयोडोफार्म परीक्षण देता है। प्रबल अॉक्सीकरण पर एथेनॉइक तथा प्रोपेनॉइक अम्ल देता है। यौगिक की संभावित संरचना लिखिए।
12.20 यद्यपि फ़ीनॉक्साइड आयन की अनुनादी संरचनाएं कार्बोक्सिलेट आयन की तुलना में अधिक है परंतु कार्बोक्सिलिक अम्ल फ़ीनॉल की अपेक्षा प्रबल अम्ल है। क्यों?
कुछ पाठ्यनिहित प्रश्नों के उत्तर
12.1 (i) 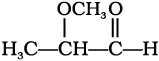 (ii)
(ii) 
(iii) 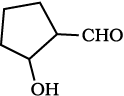 (iv)
(iv) 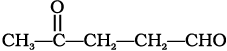
(v) 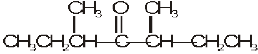 (vi)
(vi) 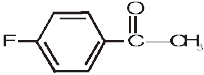
12.2 (i) 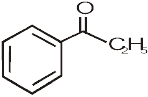 (ii)
(ii) 
iii) 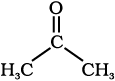 (iv)
(iv) 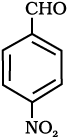
12.3 CH3-CH2-CH3<CH3-O-CH3<CH3-CHO<CH3CH2OH
12.4 (i) ब्यूटेनोन < प्रोपेनोन < प्रोपेनैल < एथेनैल
(ii) एेसीटोफ़ीनोन < p-टॉलूएेल्डिहाइड < बेन्ज़ैल्डिहाइड < p-नाइट्रोबेन्ज़ैल्डिहाइड
12.5 (i) 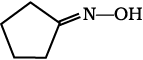 (ii)
(ii) 
(iii) 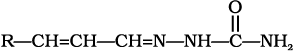 (iv)
(iv) 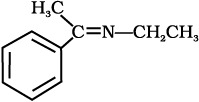
12.6 (i) 3-फ़ेनिलप्रोपेनॉइक अम्ल (ii) 3-मेथिलब्यूट-2-इनोइक अम्ल
(iii) 2-मेथिलसाइक्लोपेन्टेनकार्बोक्सिलिक अम्ल (iv) 2,4,6-ंट्राईनाइट्रोबेन्ज़ोइक अम्ल
12.7 (i) 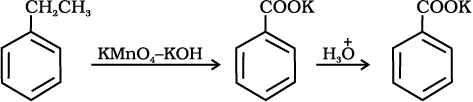
(ii) 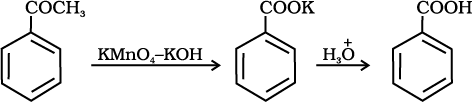
(iii) 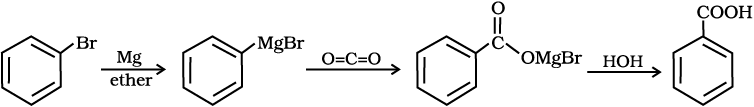
(iv) 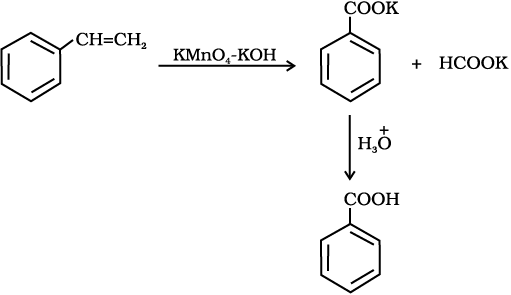
12.8 (i) CH2FCOOH (ii) CH2FCOOH
(iii) CH3CHFCH2COOH (iv)