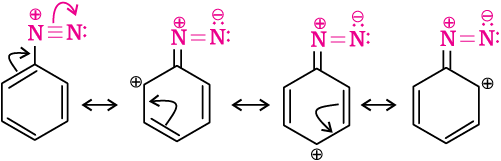Table of Contents
एकक
13
एेमीन
उद्देश्य
इस एकक के अध्ययन के पश्चात् आप –
• एेमीनों की अमोनिया के व्युत्पन्न के रूप में व्याख्या कर सकेंगे, जिसकी संरचना पिरैमिडी होती है;
• एेमीनों का प्राथमिक, द्वितीयक एवं तृतीयक एेमीनों में वर्गीकरण कर सकेंगे;
• एेमीनों का सामान्य एवं IUPAC पद्धति से नामकरण कर सकेंगे;
• एेमीनों के विरचन की कुछ महत्वपूर्ण विधियों का वर्णन कर सकेंगे;
• एेमीनों के गुणों की व्याख्या कर सकेंगे;
• प्राथमिक, द्वितीयक एवं तृतीयक एेमीनों में विभेद कर सकेंगे;
• डाइएेज़ोनियम लवणों के विरचन की विधियों तथा एेरोमैटिक श्रेणी के यौगिकों के संश्लेषण में, जिनमें एेज़ोरंजक भी हैं, इनके महत्व का वर्णन कर सकेंगे।
एेमीनों का मुख्य व्यावसायिक उपयोग औषधियों और तंतुओं के संश्लेषण में मध्यवर्तियों के रूप में होता है।
एेमीन, अमोनिया अणु से एक अथवा अधिक हाइड्रोजन परमाणुओं के एेल्किल अथवा एेरिल समूहों द्वारा विस्थापन से प्राप्त कार्बनिक यौगिकों का एक महत्वपूर्ण वर्ग बनाती हैं। प्रकृति में ये प्रोटीन, विटामिन, एेल्केलॉइड तथा हॉर्मोनों में पाए जाती हैं। संश्लेषित उदाहरणों में बहुलक, रंजक और औषध सम्मिलित हैं। दो जैव-सक्रिय यौगिक, मुख्यतया – एेड्रीनलिन और इफेड्रिन, का उपयोग रक्त-चाप बढ़ाने के लिए किया जाता है दोनों में ही द्वितीयक एेमीनों समूह होता है। एक संश्लेषित यौगिक ‘नोवोकेन’ का उपयोग दंतचिकित्सा में निश्चेतक के रूप में किया जाता है। प्रसिद्ध प्रतिहिस्टैमिन ‘बैनैड्रिल’ में भी तृतीयक एेमीनो समूह उपस्थित है। चतुष्क अमोनियम लवणों का प्रयोग पृष्ठसक्रियक के रूप में होता है। डाइएेज़ोनियम लवण, रंजकों सहित विभिन्न एेरोमैटिक यौगिकों को बनाने में मध्यवर्ती होते हैं। इस एकक में आप एेमीन एवं डाइएेज़ोनियम लवणों के विषय में विस्तृत जानकारी प्राप्त करेंगे।
I. एेमीन
एेमीन को अमोनिया के एक, दो अथवा तीनों हाइड्रोजन परमाणुओं को एेल्किल और/अथवा एेरिल समूहों द्वारा विस्थापित कर प्राप्त हुए व्युत्पन्न के रूप में माना जा सकता है।
उदाहरणार्थ–

१३.१ एेमीनों की संरचना
अमोनिया की भाँति, एेमीन का नाइट्रोजन परमाणु त्रिसंयोजी है एवं इस पर एक असहभाजित इलेक्ट्रॉन युगल है। एेमीन में नाइट्रोजन के कक्षक sp3 संकरित होते हैं तथा एेमीन की आकृति पिरैमिडी होती है। नाइट्रोजन के तीनों sp3 संकरित कक्षकों में से प्रत्येक एेमीन के संगठन के अनुसार हाइड्रोजन अथवा कार्बन के कक्षकों से अतिव्यापन करता है। सभी एेमीनों में नाइट्रोजन के चौथे कक्षक में एक असहभाजित इलेक्ट्रॉन युगल स्थित रहता है। असहभाजित इलेक्ट्रॉन युगल की उपस्थिति के कारण C–N–E कोण (जहाँ E = C अथवा H है), 109.5° से कम होता है। उदाहरण के लिए यह कोण ट्राईमेथिलएेमीन में 108° होता है जैसा कि चित्र 13.1 में दर्शाया गया है।

चित्र 13.1–ट्राईमेथिलएेमीन की पिरैमिडी आकृति
१३.२ वर्गीकरण
अमोनिया अणु में एेल्किल अथवा एेरिल समूहों द्वारा प्रतिस्थापित हाइड्रोजन परमाणुओं की संख्या के आधार पर एेमीनों का वर्गीकरण, प्राथमिक (1°), द्वितीयक (2°) तथा तृतीयक (3°) में किया जाता है। यदि अमोनिया में एक हाइड्रोजन परमाणु R अथवा Ar से प्रतिस्थापित हो तो हमें प्राथमिक (1°) एमीन R-NH2 अथवा Ar-NH2 प्राप्त होती है। यदि अमोनिया के दो हाइड्रोजन परमाणु अथवा R-NH2 के एक हाइड्रोजन का प्रतिस्थापन अन्य एेल्किल/एेरिल (R') समूह से होता है तब आप क्या प्राप्त करेंगे? आपको द्वितीयक एमीन, R-NH-R' प्राप्त होगी। दूसरा एल्किल/एेरिल समूह समान अथवा भिन्न हो सकता है। एक और हाइड्रोजन परमाणु का विस्थापन एेल्किल/एेरिल समूह से होने पर तृतीयक एेमीन बनती है। यदि सभी एेल्किल अथवा एेरिल समूह समान हों तो एेमीन को ‘सरल’ तथा भिन्न होने पर ‘मिश्रित’ कहते हैं।
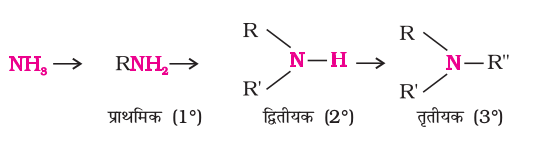
१३.३ नामपद्धति
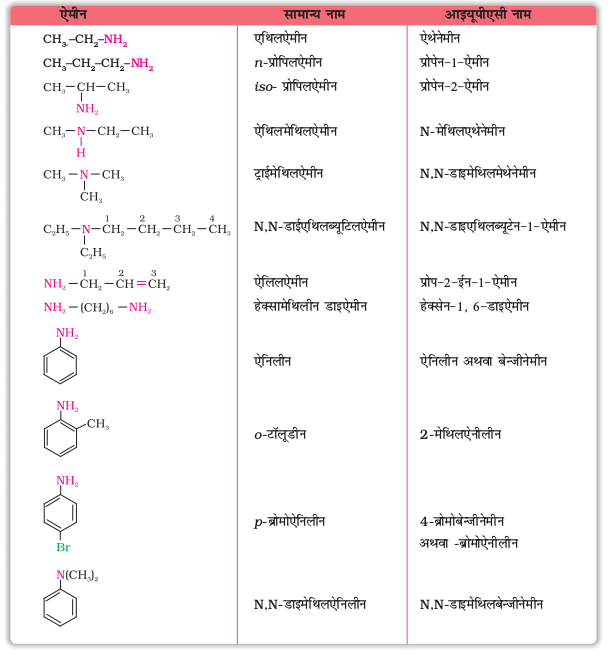
सामान्य पद्धति में एेलिफैटिक एेमीन का नामकरण एेमीन शब्द में पूर्वलग्न एेल्किल लगाकर एक शब्द में, यानी एेल्किलएेमीन के रूप में किया जाता है, जैसे– मेथिलएेमीन। द्वितीयक एवं तृतीयक एेमीनों में जब दो अथवा अधिक समूह समान होते हैं तब एेल्किल समूह के नाम से पहले पूर्वलग्न डाइ अथवा ट्राइ का प्रयोग किया जाता है। आईयूपीएसी पद्धति में एेमीनों का नामकरण एेल्केनेमीन के रूप में होता है। उदाहरणार्थ CH3 NH2 का नाम मेथेनेमीन है। यदि मुख्य शृंखला में एक से अधिक स्थानों पर एेमीन समूह उपस्थित हों तब एेमीन समूहों की स्थिति कार्बन परमाणु की संख्या जिससे ये जुड़े हाें, से व्यक्त कर डाइ, ट्राइ आदि उपयुक्त पूर्वलग्न लगाकर निर्दिष्ट की जाती है। हाइड्रोकार्बन भाग का अनुलग्न बनाए रखा जाता है।
उदाहरणार्थ– H2N–CH2–CH2–NH2 का नाम एथेन-1, 2-डाइएेमीन है।
द्वितीयक तथा तृतीयक एेमीन में N को छोटे एल्किल समूह के साथ जोड़कर विस्थापक के रूप में प्रयुक्त करते हैं। उदाहरणार्थ CH3NH CH2CH3 का नाम है N–मेथिलएेथनामीन तथा (CH3CH2)3N का नाम है N, N–डाइएथिलएेथनामीन। अधिक उदाहरण सारणी 13.1 में दिए हैं। सबसे लम्बी कार्बन शृंखला को मुख्य शृंखला मानते हैं।
एेरिल एेमीनों में –NH2 समूह बेन्जीन वलय से सीधे जुड़ा रहता है। एेरिल एेमीन का सबसे सरल उदाहरण C6H5NH2 है। सामान्य पद्धति में इसे एेनिलीन कहते हैं। यह आइयूपीएसी पद्धति में भी स्वीकार्य नाम है। एेरिल एमीन का नामकरण करते समय एेरीन के अंग्रेज़ी में लिखे नाम के अंत में से 'e' अनुलग्न का प्रतिस्थापन एमीन ('amine') शब्द से करते हैं। अतः आइयूपीएसी पद्धति में C6H5–NH2 का नाम बेन्जीनेमीन होगा।
सारणी 13.1 में कुछ एल्किल एवं एेरिल एेमीनों के सामान्य एवं आइयूपीएसी नाम में दिए गए हैं।
पाठ्यनिहित प्रश्न
13.1 निम्नलिखित एेमीनों को प्राथमिक, द्वितीयक अथवा तृतीयक एेमीनों में वर्गीकृत कीजिए–
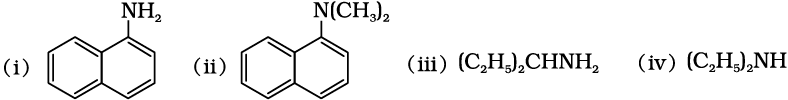
13.2 (i) अणु सूत्र C4H11N से प्राप्त विभिन्न समावयवी एेमीनों की संरचना लिखिए।
(ii) सभी समावयवों के आईयूपीएसी नाम लिखिए।
(iii) विभिन्न युग्मों द्वारा कौन से प्रकार की समावयवता प्रदर्शित होती है?
१३.४ एेमीनों का विरचन
1. नाइट्रो यौगिकों का अपचयन
नाइट्रो यौगिक सूक्ष्म विभाजित निकैल, पैलेडियम अथवा प्लैटिनम की उपस्थिति में हाइड्रोजन गैस प्रवाहित करने से एेमीनों में अपचित हो जाते हैं। अम्लीय माध्यम में धातुओं द्वारा भी इनका अपचयन हो सकता है। इसी प्रकार से नाइट्रोएेल्कीन भी संगत एेल्केनेमीनों में अपचित की जा सकती हैं।

रद्दी लोहे एवं हाइड्रोक्लोरिक अम्ल द्वारा अपचयन को वरीयता दी जाती है, क्योंकि अभिक्रिया में जनित FeCl2 जलअपघटित होकर हाइड्रोक्लोरिक अम्ल देता है। अतः केवल अभिक्रिया प्रारंभ करने के लिए हाइड्रोक्लोरिक अम्ल की बहुत कम मात्रा में आवश्यकता होती है।
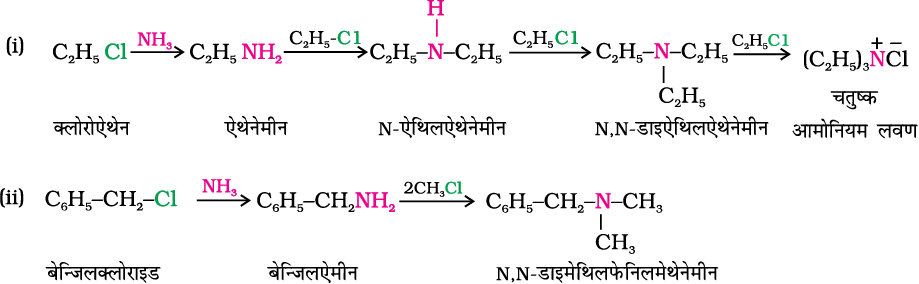
2. एेल्किल हैलाइडों का एेमोनीअपघटन
आपने एकक 10 में पढ़ा है कि एेल्किल अथवा बेन्जिल हैलाइडों में कार्बन-हैलोजन आबंध नाभिकरागी द्वारा सरलता से विदलित हो जाता है। अतः एेल्किल अथवा बेन्जिल हैलाइड अमोनिया के एेथेनॉलिक विलयन से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं जिसमें हैलोजन परमाणु एेमीनो (–NH2) समूह से प्रतिस्थापित हो जाता है। अमोनिया अणु द्वारा C–X आबंध के विदलन की प्रक्रिया को अमोनीअपघटन (ammonolysis) कहते हैं। यह अभिक्रिया 373 K ताप पर सील बंद नालिका में कराते हैं। इस प्रकार से प्राप्त प्राथमिक एेमीन नाभिकरागी की तरह व्यवहार करती है और पुनः एेल्किल हैलाइड से अभिक्रिया करके द्वितीयक एवं तृतीयक एमीन तथा अंततः चतुष्क अमोनियम लवण बना सकती है।

नाभिकरागी प्रतिस्थापित अमोनियम लवण

इस अभिक्रिया में हैलाइडों की एेमीनों से अभिक्रियाशीलता का क्रम RI > RBr > RCl होता है। अमोनियम लवण से मुक्त एेमीन प्रबल क्षार द्वारा अभिक्रिया से प्राप्त की जा सकती है।
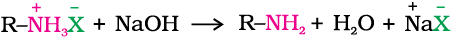
अमोनीअपघटन में यह असुविधा है कि इससे प्राथमिक, द्वितीयक एवं तृतीयक एेमीन तथा चतुष्क अमोनियम लवण का मिश्रण प्राप्त होता है। यद्यपि अमोनिया आधिक्य में लेने पर प्राप्त मुख्य उत्पाद प्राथमिक एेमीन हो सकता है।
उदाहरण 13.1
क्लोरोएेथेन
बेन्जिलक्लोराइड
एेथेनेमीन
बेन्जिलएेमीन
निम्नलिखित अभिक्रियाओं के लिए रासायनिक समीकरण लिखिए–
(i) एथेनॉलिक NH3 की C2H5Cl के साथ अभिक्रिया।
(ii) बेन्जिल क्लोराइड का अमोनीअपघटन तथा प्राप्त एेमीन की दो मोलCH3Cl से अभिक्रिया।
हल
3. नाइट्राइलों का अपचयन
नाइट्राइल लीथियम एेलुमिनियम हाइड्राइड (LiAlH4) अथवा उत्प्रेरकी हाइड्रोजनन द्वारा अपचित होकर प्राथमिक एेमीन बनाते हैं। इस अभिक्रिया का उपयोग एेमीन श्रेणी के आरोहण (ascent) में, अर्थात् प्रारंभिक एेमीन से एक अधिक कार्बन वाले एेमीन के विरचन में किया जाता है।
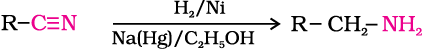
4. एेमाइडों का अपचयन
एेमाइड लीथियम एेलुमिनियम हाइड्राइड द्वारा अपचित होकर एेमीन देते हैं।

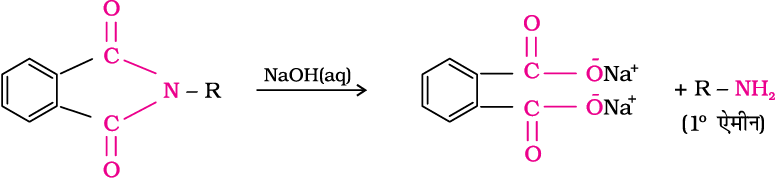
5. गैब्रिएल थैलिमाइड संश्लेषण
गैब्रिएल संश्लेषण का प्रयोग प्राथमिक एेमीनों के विरचन के लिए किया जाता है। थैलिमाइड एेथेनॉलिक पोटैशियम हाइड्रॉक्साइड से अभिक्रिया द्वारा थैलिमाइड का पोटैशियम लवण बनाता है जो एेल्किल हैलाइड के साथ गरम करने के पश्चात् क्षारीय जलअपघटन द्वारा संगत प्राथमिक एेमीन उत्पन्न करता है। एेरोमैटिक प्राथमिक एेमीन इस विधि से नहीं बनाई जा सकतीं क्योंकि एेरिल हैलाइड थैलिमाइड से प्राप्त ऋणायन के साथ नाभिकरागी प्रतिस्थापन; अभिक्रिया नहीं कर सकते।
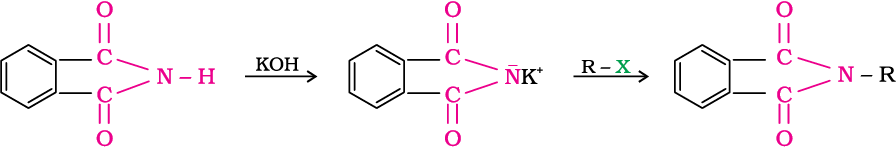
6. हॉफमान ब्रोमामाइड निम्नीकरण अभिक्रिया
हॉफमान ने प्राथमिक एेमीनों के विरचन के लिए एक विधि विकसित की जिसमें किसी एेमाइड की NaOH के जलीय अथवा एेथेनॉलिक विलयन में ब्रोमीन से अभिक्रिया करते हैं। इस निम्नीकरण अभिक्रिया में एेल्किल अथवा एेरिल समूह का स्थानांतरण एेमाइड के कार्बोनिल कार्बन से एेमीन के कार्बाेनिल परमाणु पर होता है। इस प्रकार प्राप्त एेमीन में एेमाइड से एक कार्बन कम होता है।
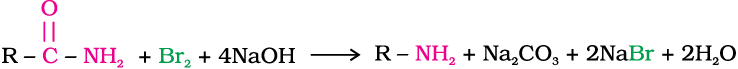
उदाहरण 13.2
हल

उदाहरण 13.3 निम्नलिखित की संरचनाएं एवं आइयूपीएसी नाम लिखिए
(i) एेमाइड जो हॉफमान ब्रोमेमाइड अभिक्रिया द्वारा प्रोपेनेमीन देता है।
(ii) बेन्ज़एेमाइड के हॉफमान ब्रोमेमाइड निम्नीकरण से प्राप्त एेमीन।
हल
(i) प्रोपेनेमीन में तीन कार्बन हैं। अतः एेमाइड अणु में चार कार्बन परमाणु होने चाहिए। चार कार्बन परमाणु युक्त प्रारंभिक एेमाइड की संरचना एवं आईयूपीएसी नाम निम्नलिखित हैं–
 ब्यूटेनेमाइड
ब्यूटेनेमाइड
(ii) बेन्ज़एेमाइड सात कार्बन परमाणु युक्त एक एेरोमैटिक एेमाइड है अतः बेन्ज़एेमाइड से छः कार्बन युक्त प्राथमिक एेरोमैटिक एेमीन प्राप्त होगी।
 एेनिलीन अथवा बेन्ज़ीनेमीन
एेनिलीन अथवा बेन्ज़ीनेमीन
13.3 आप निम्नलिखित परिवर्तन कैसे करेंगे?
(i) बेन्जीन से एेनिलीन
(ii) बेन्जीन से N, N-डाइमेथिलएेनिलीन
(iii) Cl-(CH2)4-Cl से हेक्सेन-1, 6-डाइएेमीन
१३.५ भौतिक गुणधर्म
निम्नतर एेलिफैटिक एेमीन मत्स्य गंध वाली गैसें हैं। तीन अथवा अधिक कार्बन परमाणु वाली प्राथमिक एेमीन द्रव तथा इससे उच्चतर एेमीन ठोस हैं। एेनिलीन तथा अन्य एेरिलएेमीन प्रायः रंगहीन होती हैं। परंतु भंडारण के दौरान वातावरण द्वारा अॉक्सीकरण होने से रंगीन हो जाती हैं।
निम्नतर एेलिफैटिक एेमीन जल में विलेय होती हैं, क्योंकि यह जल के अणुओं के साथ हाइड्रोजन आबंध बना सकती हैं। हालाँकि, अणुभार में वृद्धि के साथ जलविरागी (Hydrophlic) एेल्किल भाग बढ़ जाता है अतः जल में विलेयता घटती है। उच्चतर एेमीन जल में आवश्यक रूप से अविलेय होती हैं। एेमीन की नाइट्रोजन एवं एेल्कोहॉल की अॉक्सीजन की विद्युतऋणात्मकता क्रमशः 3.0 एवं 3.5 मानने पर आप एेमीनों एवं एेल्कोहलों की जल में विलेयता के पैटर्न की प्रागुक्ति कर सकते हैं। ब्यूटेन-1-अॉल एवं ब्यूटेन-1-एेमीन में से कौन जल में अधिक विलेय होगा और क्यों? एेमीन कार्बनिक विलायकों जैसे एेल्कोहॉल, ईथर एवं बेन्जीन में विलेय होती है। आपको याद होगा कि एल्कोहॉल एेमीन की तुलना में अधिक ध्रुवित होती हैं तथा एेमीन की तुलना में प्रबल अंतराआण्विक हाइड्रोजन आबंध बनाती हैं।
प्राथमिक एवं द्वितीयक एेमीनों में एक अणु का नाइट्रोजन परमाणु दूसरे अणु के हाइड्रोजन परमाणु से आबंधित होने के कारण इनमें अंतराआण्विक संघटन होता है। यह अंतराआण्विक संघटन प्राथमिक एेमीनों में द्वितीयक एमीनों की तुलना में हाइड्रोजन आबंधन के लिए दो हाइड्रोजन परमाणुओं की उपलब्धता के कारण अधिक होता है। तृतीयक एेमीन में नाइट्रोजन पर हाइड्रोजन अणुओं के अभाव के कारण अंतराआण्विक संघटन नहीं होता। अतः समावयवी एेमीनाें के क्वथनांकों का क्रम निम्नलिखित होगा–
प्राथमिक > द्वितीयक > तृतीयक
प्राथमिक एेमीन में उपस्थित अंतराआण्विक हाइड्रोजन आबंधन को चित्र 13.2 में दर्शाया गया है।
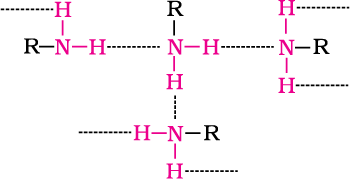
चित्र 13.2–प्राथमिक एेमीन में अंतराआण्विक हाइड्रोजन आबंधन
लगभग समान आण्विक द्रव्यमान वाली एेमीनों, एेल्कोहॉलों एवं एल्केनों के क्वथनांक सारणी 13.2 में दर्शाए गए हैं।
सारणी 13.2–लगभग समान आण्विक द्रव्यमान वाली एेमीनों, एेल्कोहॉलों एवं एल्केनों के क्वथनांकों की तुलना

13-6 रासायनिक अभिक्रियाएँ
नाइट्रोजन एवं हाइड्रोजन परमाणुओं की विद्युतऋणात्मकता में अंतर तथा नाइट्रोजन परमाणु पर असहभाजित इलेक्ट्रॉन युगल की उपस्थिति एेमीन को सक्रिय बना देती है। नाइट्रोजन परमाणुओं से जुड़ी हाइड्रोजन परमाणुओं की संख्या भी एेमीन की अभिक्रिया का पथ निर्धारित करती है। इसलिए प्राथमिक (–NH2), द्वितीयक 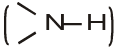 एवं तृतीयक एेमीनों
एवं तृतीयक एेमीनों  की बहुत सी अभिक्रियाओं में भिन्नता होती है। इसके अतिरिक्त, असहभाजित इलेक्ट्रॉन युगल की उपस्थिति के कारण एेमीन नाभिकरागी की तरह व्यवहार करती हैं। एेमीनों की कुछ अभिक्रियाओं की व्याख्या नीचे दी गई है–
की बहुत सी अभिक्रियाओं में भिन्नता होती है। इसके अतिरिक्त, असहभाजित इलेक्ट्रॉन युगल की उपस्थिति के कारण एेमीन नाभिकरागी की तरह व्यवहार करती हैं। एेमीनों की कुछ अभिक्रियाओं की व्याख्या नीचे दी गई है–
1. एेमीनों का क्षारकीय गुण
क्षारकीय प्रकृति होने के कारण एेमीन अम्लों से अभिक्रिया कर लवण बनाती हैं।

एेमीन लवण NaOH जैसे क्षार से अभिक्रिया करके पितृ एेमीन पुनर्जनित करती हैं।
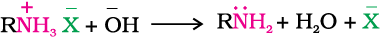
एेमीन लवण जल में विलेय किंतु ईथर जैसे कार्बनिक विलायकों में अविलेय होते हैं। यह अभिक्रिया जल में अविलेय अक्षारकीय कार्बनिक यौगिकों को एेमीन से पृथक् करने का आधार है।
एेमीन की खनिज अम्लों से अभिक्रिया द्वारा लवणों का बनना इनकी क्षारकीय प्रकृति को दर्शाता है। एेमीनों में एक असहभाजित इलेक्ट्रॉन युगल उपस्थित होने के कारण यह लूईस क्षारक की भाँति व्यवहार करती है । एेमीनों के क्षारकीय गुण को उनके Kb एवं pKb के मान पर विचार करके भलीभाँति व्याख्या की जा सकती है।


Kb का मान जितना अधिक होता है अथवा pKb का मान जितना कम होता है,
क्षारक उतना ही प्रबल होता है। कुछ एेमीनों के pKb मान सारणी 13.3 में दिए गए हैं।
अमोनिया का pKb मान 4.75 होता है। एेलिफैटिक एेमीन, नाइट्रोजन परमाणु पर एेल्किल समूहों के +I प्रभाव के कारण अधिक इलेक्ट्रॉन घनत्व होने से अमोनिया से प्रबल क्षारक होते हैं। इनके pKb मान 3 से 4.22 के मध्य होते हैं। दूसरी ओर एेरोमैटिक एेमीन एेरिल समूह की इलेक्ट्रॉन खींचने (इलेक्ट्रॉन अपनयन) की प्रकृति के कारण अमोनिया से दुर्बल क्षारक होते हैं।
सारणी 13.3–जलीय प्रावस्था में कुछ एेमीनों के pKb मान

प्रतिस्थापियों के +I अथवा –I प्रभाव के आधार पर एेमीनों के Kb मान के प्रतिपादन में आपको कुछ विसंगतियाँ मिल सकती हैं। प्रेरणिक प्रभाव के अतिरिक्त कुछ अन्य प्रभाव, जैसे– विलायकयोजन प्रभाव, त्रिविम अवरोधन आदि भी एेमीन की क्षारकीय सामर्थ्य को प्रभावित करते हैं। इस पर विचार कीजिए। आपको इसका उत्तर निम्नलिखित अनुच्छेदों में मिल जाएगा।
एेमीनों की संरचना तथा क्षारकता में संबंध
एेमीनों की क्षारकता इनकी संरचना से संबंधित होती है। एेमीनों का क्षारकीय गुण अम्ल से प्रोटॉन ग्रहण कर धनायन बनाने की सहजता पर निर्भर करता है, एेमीन की तुलना में धनायन जितना अधिक स्थायी होता है एेमीन उतनी ही अधिक क्षारकीय होती है।
(क) एेल्केनेमीन बनाम अमोनिया
आइए हम एेल्केनेमीन और अमोनिया की क्षारकता की तुलना करने के लिए इनकी प्रोटॉन से अभिक्रिया की तुलना करें।

इलेक्ट्रॉन मुक्त करने की प्रकृति के कारण एेल्किल (R) समूह इलेक्ट्रॉन को नाइट्रोजन की ओर धकेलते हैं और इस प्रकार से नाइट्रोजन के असहभाजित इलेक्ट्रॉन युगल की प्रोटॉन से साझेदारी के लिए उपलब्धता को बढ़ा देते हैं। इसके अलावा एेमीन से प्राप्त हुआ प्रतिस्थापित अमोनियम आयन, एल्किल समूह के +I प्रभाव के कारण आवेश के वितरण द्वारा स्थायित्व प्राप्त करता है। अतः एेल्किल-एेमीन अमोनिया से प्रबल क्षारक होते हैं। इसलिए एेलिफैटिक एेमीन की क्षारकता इनमें उपस्थित एेल्किल समूह की संख्या बढ़ने के साथ बढ़नी चाहिए। गैसीय प्रावस्था में यह क्रम बना रहता है। गैसीय प्रावस्था में एेमीनों की क्षारकता का क्रम अपेक्षित क्रम में होता है जो इस प्रकार है– तृतीयक एेमीन > द्वितीयक एेमीन > प्राथमिक एेमीन > अमोनिया (NH3)। सारणी 13.3 में दिए गए pKb के मानों से स्पष्ट होता है कि यह क्रम जलीय प्रावस्था में क्रमानुसार नहीं होता। जलीय प्रावस्था में प्रतिस्थापित अमोनियम धनायनों का स्थायित्व केवल एेल्किल समूह के इलेक्ट्रॉन मुक्त करने के प्रभाव (+I) पर ही निर्भर नहीं होता, अपितु जल अणुओं द्वारा विलायक योजन पर भी निर्भर करता है। धनायन का आकार जितना बड़ा होता है उसका विलायक योजन उतना ही कम होता है, आयनाें के स्थायित्व का क्रम इस प्रकार है–
जल में हाइड्रोजन आबंधन तथा विलायकन द्वारा स्थायित्व के कम होने का क्रम
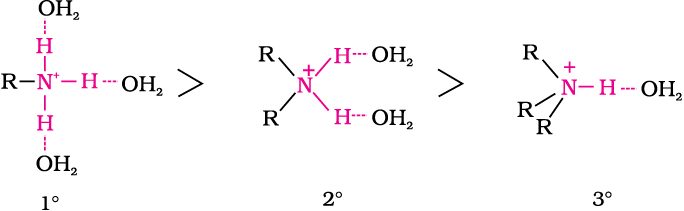
प्रतिस्थापित अमोनियम धनायन का स्थायित्व जितना अधिक होता है, संगत एेमीन का क्षारकीय प्राबल्य उतना ही अधिक होना चाहिए। अतः एेलिफैटिक एमीनों की क्षारकता का क्रम, प्राथमिक > द्वितीयक > तृतीयक होना चाहिए जो कि प्रेरणिक प्रभाव के विपरीत क्रम है। पुनश्चः जब एेल्किल समूह–CH3 की तरह छोटा होता है तो हाइड्रोजन आबंधन में कोई त्रिविम बाधा नहीं होती। यदि एेल्किल समूह –CH3 समूह से बड़ा होगा तो हाइड्रोजन आबंधन में त्रिविम बाधा आएगी। इसलिए एेल्किल समूह की प्रकृति में परिवर्तन, जैसे –CH3 से –C2H5 होने पर क्षारकता सामर्थ्य के क्रम में परिवर्तन हो जाता है। अतः जलीय प्रावस्था में प्रेरणिक प्रभाव, विलायक योजन प्रभाव तथा त्रिविम बाधा का जटिल पारस्परिक प्रभाव क्षारकीय प्राबल्य का निर्धारण करता है। जलीय विलयन में मेथिल और एेथिल प्रतिस्थापित एमीनों के क्षारकीय प्राबल्य का क्रम इस प्रकार है–
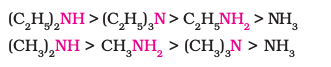
(ख) एेरिलएेमीन बनाम अमोनिया
एेनिलीन के pKb का मान काफ़ी अधिक है। एेसा क्यों है? एेसा इसलिए है कि बेन्जीन तथा अन्य एेरिल एेमीनों में –NH2 समूह सीधे बेन्जीन वलय से जुड़ा होता है। इससे नाइट्रोजन परमाणु पर उपस्थित असहभाजित इलेक्ट्रॉन युगल, बेन्जीन वलय के साथ संयुग्मन के कारण प्रोटॉनन के लिए कम उपलब्ध होता है। यदि आप एेनिलीन की विभिन्न संरचनाएं लिखें, तो आप पाएंगे कि एेनिलीन निम्नलिखित पाँच संरचनाओं का संकर है। दूसरी ओर प्रोटॉन ग्रहण से परिणित एेनिलीनियम आयन की केवल दो अनुनाद संरचनाएं (केकुले) होती हैं।

एेनिलीनियम धनायन की अनुनादी संरचनाएं

हम जानते हैं कि जितनी अधिक अनुनादी संरचनाएं होती हैं स्थायित्व उतना ही अधिक होता है। अतः आप निष्कर्ष निकाल सकते हैं कि एेनिलीन (पाँच अनुनादी संरचनाएं) एेनिलीनियम आयन से अधिक स्थायी होती हैं। अतः एनिलीन अथवा अन्य एेरोमैटिक एेमीनों की प्रोटोन स्वीकार्यता अथवा क्षारक गुण कम होगा। प्रतिस्थापित एेनिलीन में यह देखा गया है कि इलेक्ट्रॉन मुक्त करने वाले समूह जैसे –OCH3, –CH3, क्षारकीय प्राबल्य में वृद्धि करते हैं जबकि इलेक्ट्रॉन खींचने वाले समूह जैसे –NO2, –SO3H, –COOH, –X, इसे कम करते हैं।
उदाहरण 13.4
निम्नलिखित को क्षारकीय प्राबल्य के घटते क्रम में लिखिए–
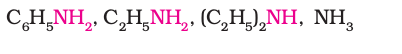
हल
उपरोक्त एेमीनों एवं अमोनिया के क्षारकीय प्राबल्य में कमी का क्रम इस प्रकार है–

2. एेल्किलन
एेमीन एेल्किल हैलाइडों के साथ एेल्किलन अभिक्रिया देती हैं। (देखें कक्षा XII, एकक 10)
3. एेसिलन
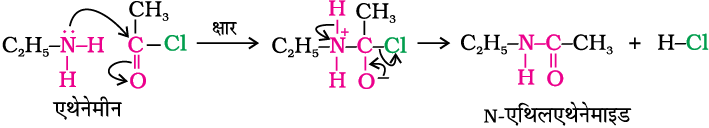
एेलीफैटिक तथा एेरोमैटिक प्राथमिक एवं द्वितीयक एेमीन एेसिड क्लोराइड, एेनहाइड्राइड और एेस्टर से नाभिकरागी प्रतिस्थापन अभिक्रिया करते हैं। यह अभिक्रिया एेसिलन कहलाती है। आप इस अभिक्रिया को –NH2 अथवा > N–H समूह में उपस्थित हाइड्रोजन परमाणु का एेसिल समूह द्वारा प्रतिस्थापन समझ सकते हैं।
एेसिलन अभिक्रिया से प्राप्त उत्पादों को एेमाइड कहते हैं। यह अभिक्रिया एेमीन से अधिक प्रबल क्षारक, जैसे पिरीडीन की उपस्थिति में कराई जाती है जो अभिक्रिया में बने HCl को निकालकर साम्य को दाईं ओर विस्थापित कर देता है।
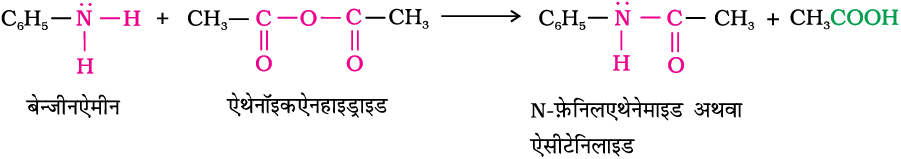

एेमीन बेन्जॉयल क्लोराइड (C6H5COCl) से भी अभिक्रिया करती हैं। इस अभिक्रिया को बेन्ज़ाइलन कहते हैं।
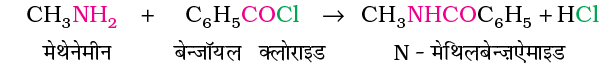
क्या आप जानते हैं कि एेमीन तथा कार्बोक्सिलिक अम्ल की अभिक्रिया से प्राप्त उत्पाद क्या होगा? ये कमरे के ताप पर एेमीन से अभिक्रिया द्वारा लवण बनाते हैं।
4. कार्बिलएेमीन अभिक्रिया
एेलिफैटिक तथा एेरोमैटिक प्राथमिक एेमीन, क्लोरोफ़ार्म और एथेनॉलिक पोटैशियम हाइड्रॉक्साइड के साथ गर्म करने पर दुर्गंधयुक्त पदार्थ आइसोसायनाइड अथवा कर्बिलएेमीन का विरचन करती हैं। द्वितीयक एवं तृतीयक एेमीन यह अभिक्रिया नहीं दर्शातीं। इस अभिक्रिया को कार्बिलएेमीन अभिक्रिया अथवा आइसोसायनाइड परीक्षण कहते हैं तथा यह प्राथमिक एेमीनों के परीक्षण में प्रयुक्त होती है।

5. नाइट्रस अम्ल से अभिक्रिया
खनिज अम्ल एवं सोडियम नाइट्राइट की अभिक्रिया से स्वस्थान (in situ) बनायी गई तीनों वर्गों की एेमीन नाइट्रस अम्ल से अलग-अलग तरह से अभिक्रिया करती हैं।
(क) प्राथमिक एेलीफैटिक एेमीन नाइट्रस अम्ल से अभिक्रिया द्वारा एेलीफैटिक डाइएेज़ोनीयम लवण बनाती हैं जो अस्थायी होने के कारण मात्रात्मकतः नाइट्रोजन निर्मुक्त करती हैं और एल्कोहॉल बनाती हैं। नाइट्रोजन की मात्रात्मकतः निकासी का उपयोग एेमीनो अम्लों एवं प्रोटीनों के आकलन में किया जाता है।
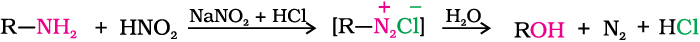
(ख) एेरोमैटिक एेमीन नाइट्रस अम्ल से कम ताप (273–268 K) पर अभिक्रिया कर डाइएेज़ोनियम लवण बनाती हैं। यह यौगिकों का एक महत्वपूर्ण वर्ग है जिसका उपयोग विभिन्न प्रकार के एेरोमैटिक यौगिकों के संश्लेषण में होता है। जिनका वर्णन खंड 13.7 में किया गया है।

द्वितीयक और तृतीयक एेमीन नाइट्रस अम्ल से भिन्न प्रकार से अभिक्रिया करती हैं।
6. एेरिलसल्फोनिल क्लोराइड से अभिक्रिया
बेन्जीन सल्फोनिल क्लोराइड (C6H5SO2Cl) जिसे हिन्सबर्ग अभिकर्मक भी कहते हैं, प्राथमिक और द्वितीयक एेमीनों से अभिक्रिया करके सल्फोनैमाइड बनाता है।
(क) बेन्जीनसल्फोनिल क्लोराइड और प्राथमिक एेमीन की अभिक्रिया से N- एथिलबेन्जीन- सल्फोनिल एेमाइड प्राप्त होते हैं।
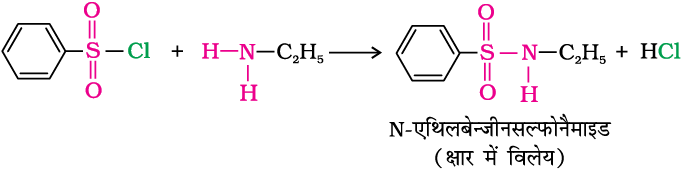
सल्फोनैमाइड की नाइट्रोजन से जुड़ी हाइड्रोजन प्रबल इलेक्ट्रॉन खीचने वाले सल्फोनिल समूह की उपस्थिति के कारण प्रबल अम्लीय होती है। अतः यह क्षार में विलेय होते हैं।

(ख) द्वितीयक एेमीन की अभिक्रिया से N,N- डाइएथिलबेन्जीनसल्फोनैमाइड बनता है।
N,N-डाइएथिलबेन्जीनसल्फोनैमाइड में कोई भी हाइड्रोजन परमाणु, नाइट्रोजन परमाणु से नहीं जुड़ा है अतः यह अम्लीय नहीं होता तथा क्षार में अविलेय होता है।
(ग) तृतीयक एेमीन बेन्जीनसल्फोनिल क्लोराइड से अभिक्रिया नहीं करतीं। विभिन्न वर्गों के एेमीनाें का यह गुण जिसमें वे बेन्जीनसल्फोनिल क्लोराइड से भिन्न-भिन्न प्रकार से अभिक्रिया करती हैं, प्राथमिक, द्वितीयक एवं तृतीयक एेमीनों में विभेद करने एवं इन्हें मिश्रण से पृथक करने में प्रयुक्त होता है। यद्यपि आजकल बेन्जीनसल्फ़ोनिल क्लोराइड के स्थान पर p- टॉलूईनसल्फ़ोनिल क्लोराइड का प्रयोग होता है।
7. इलेक्ट्रॉनरागी प्रतिस्थापन
आपने पहले पढ़ा है कि एेनिलीन पाँच अनुनादी संरचनाओं का संकर होती है। आप इन संरचनाओं में कौन से स्थान पर सर्वाधिक इलेक्ट्रॉन घनत्व पाते हैं? –NH2 समूह के संदर्भ से आर्थो तथा पैरा स्थानों पर अधिक इलेक्ट्रॉन घनत्व के केंद्र बन जाते हैं। अतः –NH2 समूह आर्थो तथा पैरा निर्देशक एवं शक्तिशाली सक्रियक समूह है।
(क) ब्रोमीनन
एेनिलीन कक्ष ताप पर ब्रोमीन जल से अभिक्रिया करके 2, 4, 6 –ट्राईब्रोमोएेनिलीन का सफेद अवक्षेप देती है।
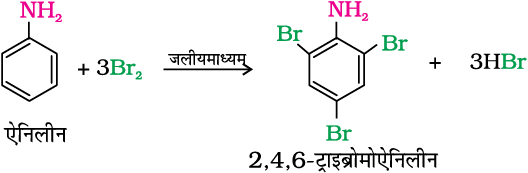
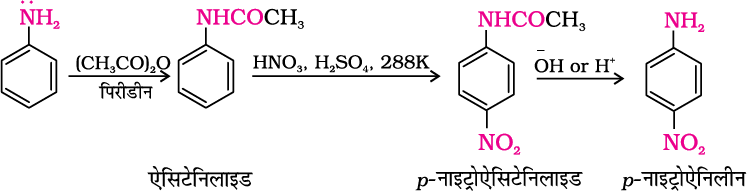
एेरोमैटिक एेमीन की इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में मुख्य समस्या इनकी उच्च अभिक्रियाशीलता है। प्रतिस्थापन आर्थो तथा पैरा दोनों स्थानों पर हो सकता है। यदि हमें एेनिलिन का एकल प्रतिस्थापी व्युत्पन्न बनाना हो तो -NH2 समूह के सक्रियण प्रभाव को कैसे नियंत्रित करेंगे? यह –NH2 समूह को एेसीटिक एेनहाइड्राइड एेसीटिलन द्वारा परिरक्षित करने के बाद वांछित प्रतिस्थापन करके और फिर अंत में प्रतिस्थापित एेमाइड को प्रतिस्थापित एेमीन में जलअपघटित करके किया जा सकता है।
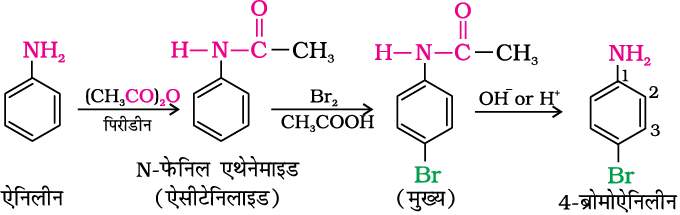
एेसिटेनिलाइड की नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल अॉक्सीजन परमाणु से अनुनाद द्वारा अन्योन्यक्रिया करता है। इसे नीचे दर्शाया गया है–
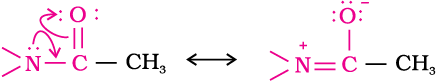
अतः नाइट्रोजन पर उपस्थित एकाकी इलेक्ट्रॉन युगल अनुनाद द्वारा बेन्जीन वलय को प्रदान करने के लिए कम उपलब्ध होता है। इसलिए -NHCOCH3 समूह का सक्रियण प्रभाव एेमीनो समूह से कम होता है।
(ख) नाइट्रोकरण
एेनिलीन के सीधे नाइट्रोकरण से नाइट्रो व्युत्पन्नों के अतिरिक्त अन्य कोलतारी अॉक्सीकरण उत्पाद भी बनते हैं। इसके अलावा प्रबल अम्लीय माध्यम में एेनिलीन प्रोटॉन ग्रहण कर एेनिलीनियम आयन बनाती है जो मेटा निर्देशक है। इसी कारण आर्थो एवं पैरा व्युत्पन्न के अलावा मेटा व्युत्पन्न की भी महत्वपूर्ण मात्रा बनती है।
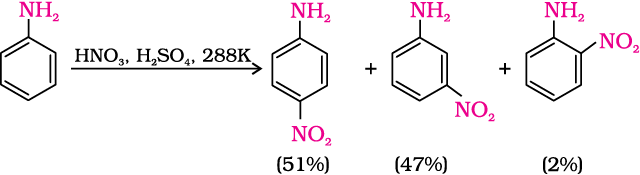
एेसीटिलन अभिक्रिया द्वारा -NH2 समूह का परिरक्षण करके नाइट्रोकरण अभिक्रिया को नियंत्रित किया जा सकता है और पैरा-नाइट्रो व्युत्पन्न को मुख्य उत्पाद के रूप में प्राप्त किया जा सकता है।
(ग) सल्फोनेशन
एेनिलीन सांद्र सल्फ्युरिक अम्ल से अभिक्रिया द्वारा एेनिलीनियम हाइड्रोजनसल्फेट बनाती है जो सल्फ्यूरिक अम्ल के साथ 453-473K तक गरम करने पर p-एेमीनोबेन्जीन सल्फोनिक अम्ल जिसे सामान्यतः सल्फैनिलिक अम्ल भी कहते हैं, मुख्य उत्पाद के रूप में बनाता है।

एेलुमिनियम क्लोराइड के साथ लवण बनाने के कारण एेनीलीन प्ऱηीडेल-क्राफ्ट्स अभिक्रिया (एेल्किलन एवं एेसीटिलन) नहीं करती। एेलुमिनियम क्लोराइड एक लूईस अम्ल है जो इस अभिक्रिया में उत्प्रेरक का कार्य करता है। लवण बनने से एनिलीन की नाइट्रोजन धन आवेश प्राप्त कर लेती है और फिर आगे की अभिक्रिया में प्रबल निष्क्रियक समूह की तरह व्यवहार करती है।
13.4 निम्नलिखित को उनके बढ़ते हुए क्षारकीय प्रबलता के क्रम में लिखिए–
(i) C2H5NH2, C6H5NH2, NH3, C6H5CH2NH2 तथा (C2H5)2NH
(ii) C2H5NH2, (C2H5)2NH, (C2H5)3N, C6H5NH2
(iii) CH3NH2, (CH3)2NH, (CH3)3N, C6H5NH2,C6H5CH2NH2
13.5 निम्नलिखित अम्ल-क्षारक अभिक्रिया को पूर्ण कीजिए तथा उत्पादों के नाम लिखिए–
(i) CH3CH2CH2NH2 + HCl → (ii) (C2H5)3N + HCl →
13.6 सोडियम कार्बोनेट विलयन की उपस्थिति में मेथिल आयोडाइड के आधिक्य द्वारा एेनिलीन के एेल्किलन में उत्पन्न होने वाले उत्पादों के लिए अभिक्रिया लिखिए।
13.7 एेनिलीन की बेन्जॉयल क्लोराइड के साथ रासायनिक अभिक्रिया द्वारा उत्पन्न उत्पादों के नाम लिखिए।
13.8 अणुसूत्र C3H9N से प्राप्त विभिन्न समावयवों की संरचना लिखिए। उन समावयवों के आईयूपीएसी नाम लिखिए जो नाइट्रस अम्ल के साथ नाइट्रोजन गैस मुक्त करते हैं।
II. डाइएेज़ोनियम लवण
डाइएेज़ोनियम लवणों का सामान्य सूत्र 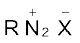 होता है। यहाँ R एक एेरिल समूह है तथा
होता है। यहाँ R एक एेरिल समूह है तथा 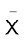 आयन Cl–, Br,–
आयन Cl–, Br,–  ,
, 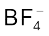 आदि में से कोई भी हो सकता है। इनका नामकरण करने के लिए जनक हाईड्राकार्बन के नाम में डाइएेज़ोनियम अनुलग्न लगाने के पश्चात् ऋणायन का नाम जैसे क्लोराइड, हाइड्रोजन सल्फेट आदि लिखते हैं।
आदि में से कोई भी हो सकता है। इनका नामकरण करने के लिए जनक हाईड्राकार्बन के नाम में डाइएेज़ोनियम अनुलग्न लगाने के पश्चात् ऋणायन का नाम जैसे क्लोराइड, हाइड्रोजन सल्फेट आदि लिखते हैं। 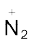 समूह को डाइएेज़ोनियम समूह कहते हैं। उदाहरण के लिए
समूह को डाइएेज़ोनियम समूह कहते हैं। उदाहरण के लिए  को बेन्जीनडाइएेज़ोनियम क्लोराइड तथा C6H5N2+HSO4– को बेन्जीन डाइएेज़ोनियम हाइड्रोजनसल्फेट कहते हैं।
को बेन्जीनडाइएेज़ोनियम क्लोराइड तथा C6H5N2+HSO4– को बेन्जीन डाइएेज़ोनियम हाइड्रोजनसल्फेट कहते हैं।
एेलिफैटिक प्राथमिक एेमीन अति अस्थायी एेल्किल डाइएेज़ोनयम लवण बनाती हैं
(खंड 13.6)। एेरोमैटिक प्राथमिक एेमीन एेरीनडाइएेज़ोनियम लवण बनाती हैं जो विलयन में निम्न ताप पर (273-278 K) अल्प समय के लिए स्थायी होते हैं। एेरीनडाइएेज़ोनियम आयन के स्थायितत्व को अनुनाद के आधार पर समझा जा सकता है।
![2814.png]() १३.७ डाइएजोनियम लवणों के विरचन की विधि
१३.७ डाइएजोनियम लवणों के विरचन की विधि
बेन्जीनडाइएेज़ोनियम क्लोराइड को एेनिलीन एवं नाइट्रस अम्ल की अभिक्रिया द्वारा 273-278K ताप पर बनाया जाता है। नाइट्रस अम्ल को अभिक्रिया मिश्रण में ही सोडियम नाइट्राइट तथा हाइड्रोक्लोरिक अम्ल की अभिक्रिया से उत्पन्न करते हैं। प्राथमिक एेरोमैटिक एेमीन के डाइएेज़ोनियम में परिवर्तन को डाइएेज़ोकरण कहते हैं। अस्थायी प्रकृति के कारण डाइएेज़ोनियम लवण का भंडारण नहीं करते और बनते ही तुरंत प्रयोग कर लेते हैं।

बेन्जीनडाइएेज़ोनियम क्लोराइड एक रंगहीन क्रिस्टलीय ठोस है। यह जल में विलेय तथा ठंडे में स्थायी है किंतु गरम करने पर जल से अभिक्रिया करता है यह ठोस अवस्था में आसानी से विघटित हो जाता है। बेन्जीन डाइएेज़ोनियमफ्लुओबोरेट जल में अविलेय तथा कक्ष ताप पर स्थायी होता है।
१३.८ भौतिक गुण
डाइएेज़ोनियम लवणों की अभिक्रियाओं को मुख्य रूप से दो संवर्गों में बाँटा जा सकता है।
१३.९ रासायनिक अभिक्रियाएँ
(क) नाइट्रोजन प्रतिस्थायन अभिक्रियाएं तथा (ख) अभिक्रियाएं जिनमें डाइएेज़ोसमूह सुरक्षित (Retention) रहता है।
(क) नाइट्रोजन प्रतिस्थापन अभिक्रियाएँ
डाइएेज़ोनियम समूह एक उत्तम अवशिष्ट समूह (Leaving group) होने के कारण Cl–, Br–, I–, CN– एवं  आदि समूहों द्वारा सरलता से प्रतिस्थापित हो जाता है। ये समूह एेरोमैटिक वलय से नाइट्रोजन मुक्त करते हैं। बनी हुई नाइट्रोजन अभिक्रिया मिश्रण से गैस के रूप में निकल जाती है।
आदि समूहों द्वारा सरलता से प्रतिस्थापित हो जाता है। ये समूह एेरोमैटिक वलय से नाइट्रोजन मुक्त करते हैं। बनी हुई नाइट्रोजन अभिक्रिया मिश्रण से गैस के रूप में निकल जाती है।
1. हैलाइड अथवा सायनाइड आयन द्वारा प्रतिस्थापन
बेन्जीन वलय में Cl–, Br– तथा CN– नाभिकरागियों को Cu(I) की उपस्थिति में सरलता से प्रवेश कराया जा सकता है। इस अभिक्रिया को सैन्डमायर अभिक्रिया कहते हैं।

दूसरी ओर ताम्रचूर्ण की उपस्थिति में डाइएेज़ोनियम लवण के विलयन की संगत हैलोजन अम्ल से अभिक्रिया द्वारा क्लोरीन अथवा ब्रोमीन को भी बेन्जीन वलय में जोड़ा जा सकता है। इस अभिक्रिया को गाटरमान अभिक्रिया कहते हैं।

गाटरमान अभिक्रिया की तुलना में सैन्डमायर अभिक्रिया की लब्धि अधिक होती है।
2. आयोडाइड आयन द्वारा प्रतिस्थापन
आयोडीन को सीधे बेन्जीन वलय में सरलता से नहीं जोड़ा जा सकता; किंतु जब डाइएेज़ोनियम लवण के विलयन की अभिक्रिया पोटैशियम आयोडाइड से कराते हैं तो आयोडोबेन्जीन बनती है।
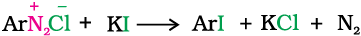
3. फ्लुओराइड आयन द्वारा प्रतिस्थापन
जब एेरीनडाइएेज़ोनियम क्लोराइड की अभिक्रिया फ्लुओरोबोरिक अम्ल से कराते हैं तो एेरीन डाइएेज़ोनियम फ्लुओरोबोरेट अवक्षेपित हो जाता है, जो गरम करने पर विघटित होकर एेरिल फ्लुओराइड देता है।

4. H द्वारा प्रतिस्थापन
हाइपोफ़ास्फ़ोरस अम्ल (फ़ॉस्फ़िनिक अम्ल) अथवा एथेनॉल जैसे दुर्बल अपचयन कर्मक डाइएेज़ोनियम लवणों को एेरीनों में अपचित कर देते हैं और स्वयं क्रमशः फ़ोस्फ़ोरस अम्ल अथवा एथेनैल में अॉक्सीकृत हो जाते हैं।
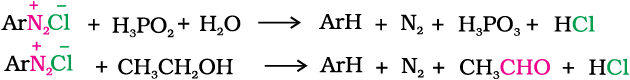
5. हाइड्रॉक्सिल समूह द्वारा प्रतिस्थापन
यदि डाइएेज़ोनियम लवण विलयन का ताप 283K तक बढ़ने दिया जाए तो लवण जलअपघटित होकर फीनॉल देते हैं।
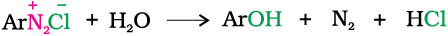
6. –NO2 समूह द्वारा प्रतिस्थापन
जब डाइएेज़ोनियम फलुओरोबोरेट को कॉपर की उपस्थिति में सोडियम नाइट्राइट के जलीय विलयन में गरम किया जाता है, तब डाइएेज़ोनियम समूह, –NO2 समूह द्वारा प्रतिस्थापित हो जाता है।
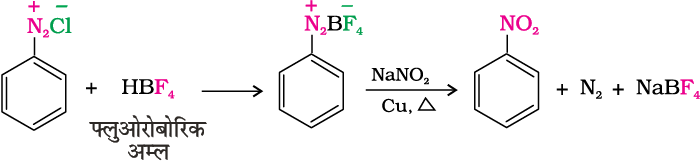
(ख) अभिक्रियाएँ जिनमें डाइएज़ो समूह सुरक्षित रहता है
युग्मन अभिक्रियाएँ
युग्मन अभिक्रिया से प्राप्त एेज़ो उत्पादों में दोनों एेरोमैटिक वलयों एवं इन्हें जोड़ने वाले
–N=N– आबंध के बीच विस्तारित संयुग्मन होता है। ये यौगिक प्रायः रंगीन होते हैं तथा रंजकों की तरह प्रयोग में आते हैं। बेन्जीन डाइएज़ोनियम क्लोराइड फ़ीनॉल से अभिक्रिया करने पर इसके पैरा स्थान पर युग्मित होकर पैरा हाइड्रोक्सीएेज़ोबेन्जीन बनाता है। इसी प्रकार की अभिक्रिया को युग्मन अभिक्रिया कहते हैं। इसी प्रकार से डाइएेज़ोनियम लवण की एनीलीन से अभिक्रिया द्वारा पेराएेमीनोएेजोबेन्जीन बनती है। यह एक इलेक्ट्रॉनरागी अभिक्रिया का उदाहरण है।
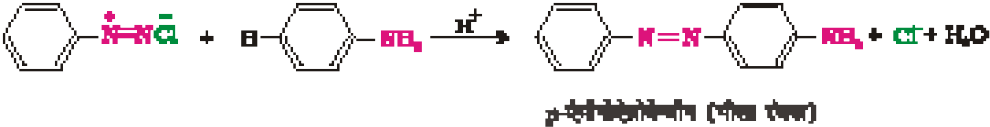

१३.१० एेरोमैटिक यौगिकों के संश्लेषण में डाइएेज़ोलवणों का महत्व
उपरोक्त अभिक्रियाओं से यह स्पष्ट है कि डाइएेज़ोनियम लवण बेन्जीन वलय में –F, –Cl, –Br, –I, –CN, –OH, –NO2 आदि समूहों के प्रवेश के लिए उत्तम माध्यमिक हैं।
एेरिल फ्लुओराइड एवं आयोडाइड को सीधे हैलोजनन द्वारा नहीं बनाया जा सकता। क्लोरोबेन्जीन में क्लोरीन के नाभिकरागी प्रतिस्थापन द्वारा सायनाइड समूह का प्रवेश नहीं कराया जा सकता, किंतु डाइएेज़ोनियम लवण से सायनोबेन्जीन को सरलता से बनाया जा सकता है।
अतः डाइएेज़ो समूह का अन्य समूहों द्वारा प्रतिस्थापन एेसे एेरोमैटिक प्रतिस्थापित यौगिकों को बनाने में सहायक है, जो सीधे बेन्जीन अथवा प्रतिस्थापित बेन्जीन से नहीं बनते।
उदाहरण 13.5
आप 4-नाइट्रोटॉलूईन को 2-ब्रोमोबेन्ज़ोइक अम्ल में कैसे परिवर्तित करेंगे?

पाठ्यनिहित प्रश्न
13.9 निम्नलिखित परिवर्तन कीजिए।
(i) 3-मेथिलएेनिलीन से 3-नाइट्रोटॉलूईन
(ii) एेनिलीन से 1, 3, 5-ट्राइब्रोमोबेन्जीन
सारांश
एेमीनों को अमोनिया के हाइड्रोजन परमाणुओं का एेल्किल अथवा एेरिल समूहों से प्रतिस्थापित व्युत्पन्न मान सकते हैं। अमोनिया में एक हाइड्रोजन परमाणु के प्रतिस्थापन से प्राप्त संरचना R-NH2 को प्राथमिक एेमीन कहते हैं। द्वितीयक एेमीन को R-NHR′ अथवा R2NH संरचना से तथा तृतीयक एेमीनों को R3N, RNR′R′′ अथवा R2NR′ संरचना द्वारा प्रदर्शित करते हैं। द्वितीयक एवं तृतीयक एेमीन को सभी एल्किल समूह समान होने पर सरल एेमीन तथा भिन्न होने पर मिश्रित एेमीन कहते हैं। अमोनिया की भाँति तीनों तरह की एेमीनों में नाइट्रोजन पर एक असहभाजित इलेक्ट्रॉन युगल होता है जिसके कारण ये लूईस क्षारक की तरह व्यवहार करती हैं।
एेमीन प्रायः नाइट्रो, हैलाइड, एेमाइड, इमाइड इत्यादि यौगिकों से बनती हैं। ये हाइड्रोजन आबंधन प्रदर्शित करती हैं जिससे इनके भौतिक गुण प्रभावित होते हैं। एेल्किल एेमीन में इलेक्ट्रॉन त्यागने, त्रिविम, तथा H-आबंधन कारक प्रोटिक विलायक में प्रतिस्थापित अमोनियम धनायन के स्थायित्व अर्थात् क्षारकता को प्रभावित करते हैं। एेल्किल एेमीन अमोनिया से प्रबल क्षारक होते हैं। एेरोमैटिक अमीन में इलेक्ट्रॉन विमोचक व अपनयक समूह क्रमशः क्षारकता में वृद्धि एवं ह्रास करते हैं। एेनिलीन अमोनिया से दुर्बल क्षारक है। एेमीनों की अभिक्रियाएं नाइट्रोजन पर उपस्थित असहभाजित इलेक्ट्रॉन युगल की उपलब्धता द्वारा निर्धारित होती हैं। नाइट्रोजन परमाणु पर उपस्थित हाइड्रोजन परमाणुओं की संख्या का अभिक्रिया के प्रकार तथा प्राप्त उत्पाद की प्रकृति पर प्रभाव प्राथमिक, द्वितीयक एवं तृतीयक एेमीनों की पहचान तथा विभेद के लिए उत्तरदायी है। पेराटॉलूईनसल्फोनिल क्लोराइड प्राथमिक, द्वितीयक एवं तृतीयक एमीनों की पहचान के लिए प्रयोग में लाया जाता है। बेन्जीन वलय में एेमीनो समूह की उपस्थिति एेरोमैटिक एेमीन की अभिक्रियाशीलता को बढ़ा देती है। एेरोमैटिक एेमीनों की अभिक्रियाशीलता को एेसिलन द्वारा नियंत्रित किया जा सकता है। एेसिलन में एमीन की एेसिल क्लोराइड अथवा एेसीटिक एनहाइड्राइड से अभिक्रिया कराते हैं। ट्राइमेथिलएमीन जैसी तृतीयक एेमीन का प्रयोग कीट आकर्षणकर्मक के रूप में किया जाता है।
प्रायः एेरिलएेमीन से प्राप्त किए जाने वाले एेरिलडाइएज़ोनियम लवण; विभिन्न प्रकार के नाभिकरागियों द्वारा प्रतिस्थापित किए जा सकते हैं जिससे डाइएज़ो समूह के अपचायक निष्कासन द्वारा एेरिल हैलाइड, सायनाइड, फ़ीनॉल तथा एेरीन प्राप्त करने की लाभप्रद विधि उपलब्ध होती है। डाइएेज़ोनियम लवण की फ़ीनॉल अथवा एेरिल एेमीन के साथ युग्मन अभिक्रिया से एेज़ो रंजक प्राप्त होते हैं।
अभ्यास
13.1 निम्नलिखित यौगिकों को प्राथमिक द्वितीयक एवं तृतीयक एेमीनों में वर्गीकृत कीजिए तथा इनके आइयूपीएसी
नाम लिखिए।
(i) (CH3)2CHNH2 (ii) CH3(CH2)2NH2 (iii) CH3NHCH(CH3)2
(iv) (CH3)3CNH2 (v) C6H5NHCH3 (vi) (CH3CH2)2NCH3
(vii) m–BrC6H4NH2
13.2 निम्नलिखित युगलों के यौगिकों में विभेद के लिए एक रासायनिक परीक्षण दीजिए–
(i) मेथिलएेमीन एवं डाइमेथिलएेमीन
(ii) द्वितीयक एवं तृतीयक एेमीन
(iii) एेथलएेमीन एवं एेनिलीन
(iv) एेनिलीन एवं बेन्जिलएेमीन
(v) एेनिलीन एवं N मेथिलएेनिलीन।
13.3 निम्नलिखित के कारण बताइए–
(i) एेनिलीन का pKb मेथिलएेमीन की तुलना में अधिक होता है।
(ii) एेथिलएेमीन जल में विलेय है जबकि एेनिलीन नहीं।
(iii) मेथिलएेमीन फेरिक क्लोराइड के साथ जल में अभिक्रिया करने पर जलयोजित फेरिक आक्साइड का अवक्षेप देता है।
(iv) यद्यपि एेमीनों समूह इलेक्ट्रॉनरागी प्रतिस्थापन अभिक्रियाओं में आर्थो एव पैरा निर्देशक होता है फिर भी एेनिलीन नाइट्रोकरण द्वारा यथेष्ट मात्रा में मेटानाइट्रोएेनीलीन देती है।
(v) एेनिलीन प्ऱिηडेल क्राफ्ट्स अभिक्रिया प्रदर्शित नहीं करती।
(vi) एेरोमैटिक एेमीनों के डाइएेज़ोनियम लवण एेलीफैटिक एेमीनों से प्राप्त लवण से अधिक स्थायी होते हैं।
(vii) प्राथमिक एेमीन के संश्लेषण में गैब्रिएल थैलिमाइड संश्लेषण को प्राथमिकता दी जाती है।
13.4 निम्नलिखित को क्रम में लिखिए–
(i) pKb मान के घटते क्रम में–
C2H5NH2, C6H5NHCH3, (C2H5)2NH एवं C6H5NH2
(ii) क्षारकीय प्राबल्य के घटते क्रम में–
C6H5NH2, C6H5N(CH3)2, (C2H5)2NH एवं CH3NH2
(iii) क्षारकीय प्राबल्य के बढ़ते क्रम में–
(क) एेनिलीन, पैरा-नाइट्रोएेनिलीन, एवं पैरा-टॉलूडीन
(ख) C6H5NH2, C6H5NHCH3, C6H5CH2NH2
(iv) गैस अवस्था में घटते हुए क्षारकीय प्राबल्य के क्रम में–
C2H5NH2, (C2H5)2NH, (C2H5)3N एवं NH3
(v) क्वथनांक के बढ़ते क्रम में–
C2H5OH, (CH3)2NH, C2H5NH2
(vi) जल में विलेयता के बढ़ते क्रम में–
C6H5NH2, (C2H5)2NH, C2H5NH2
13.5 इन्हें आप कैसे परिवर्तित करेंगे–
(i) एथेनॉइक अम्ल को मेथेनेमीन में (ii) हैक्सेननाइट्राइल कोे 1-एेमीनोपेन्टेन में
(iii) मेथेनॉल को एथेनॉइक अम्ल में (iv) एथेनेमीन को मेथेनेमीन में
(v) एथेनॉइक अम्ल कोे प्रोपेनॉइक अम्ल में (vi) मेथेनेमीन को एेथेनेमीन में
(vii) नाइट्रोमेथेन को डाइमेथिलएेमीन में (viii) प्रोपेनॉइक अम्ल कोे एेथेनॉइक अम्ल में?
13.6 प्राथमिक, द्वितीयक एवं तृतीयक एेमीनों की पहचान की विधि का वर्णन कीजिए। इन अभिक्रियाओं के रासायनिक समीकरण भी लिखिए।
13.7 निम्न पर लघु टिप्पणी लिखिए–
(i) कार्बिलएेमीन अभिक्रिया (ii) डाइएेज़ोकरण
(iii) हॉफमान ब्रोमेमाइड अभिक्रिया (iv) युग्मन अभिक्रिया
(v) अमोनीअपघटन (vi) एेसीटिलन
(vii) गैब्रिएल थैलिमाइड संश्लेषण
13.8 निम्न परिवर्तन निष्पादित कीजिए–
(i) नाइट्रोबेन्जीन सें बेन्ज़ोइक अम्ल (ii) बेन्जीन से m-ब्रोमोफीनॉल
(iii) बेन्ज़ोइक अम्ल से एेनिलीन (iv) एेनिलीन से 2, 4, 6–ट्राइब्रोमोफ्लुओरोबेन्ज़ीन
(v) बेन्ज़िल क्लोराइड से 2-फ़ेनिलएथेनेमीन (vi) क्लोरोबेन्ज़ीन से p-क्लोरोएेनिलीन
(vii) एेनिलीन से p-ब्रोमोएेनिलीन (viii) बेन्ज़एमाइड से टॉलूईन
(ix) एेनीलीन से बेन्ज़ाइल एेल्कोहॉल।
13.9 निम्न अभिक्रियाओं में A, B, तथा C की संरचना दीजिए–
(i) 
(ii) 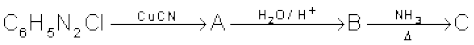
(iii) 
(iv) 
(v) 
(vi) 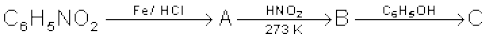
13.10 एक एेरोमैटिक यौगिक 'A' जलीय अमोनिया के साथ गरम करने पर यौगिक 'B' बनाता है जो Br2 एवं KOH के साथ गरम करने पर अणु सूत्र C6H7N वाला यौगिक 'C' बनाता है। A, B एवं C यौगिकों की संरचना एवं इनके आइयूपीएसी नाम लिखिए।
13.11 निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए–
(i)
(ii) 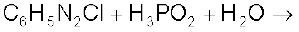
(iii) 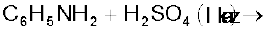
(iv) 
(v) 
(vi) 
(vii) 
13.12 एेरोमैटिक प्राथमिक एेमीन को गैब्रिएल थैलिमाइड संश्लेषण से क्यों नहीं बनाया जा सकता?
13.13 एेलीफैटिक एवं एेरोमैटिक प्राथमिक एेमीनों की नाइट्रस अम्ल से अभिक्रिया लिखिए।
13.14 निम्नलिखित में प्रत्येक का संभावित कारण बताइए–
(i) समतुल्य अणु द्रव्यमान वाले एेमीनों की अम्लता एेल्कोहॉलों से कम होती है।
(ii) प्राथमिक एेमीनों का क्वथनांक तृतीयक एमीनों से अधिक होता है।
(iii) एेरोमैटिक एेमीनों की तुलना में एेलीफैटिक एेमीनों प्रबल क्षारक होते हैं।